原电池电极反应式的书写汇总-练习与答案复习过程
原电池电极反应式的书写答案

1.解析:燃料电池中,负极燃料失电子发生氧化反应,正极氧气得电子发生还原反应,即负极反应中不可能有氧气参与。
答案:C
2.解析:分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂。
(1)负极材料为Li(还原剂),电极反应式为:
Li-e-===Li+。
(2)正极反应式可由总反应减去负极反应式得到:
2SOCl2+4e-===4Cl-+S+SO2↑。
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气味气体生成。
(4)因为构成电池的主要成分Li能和氧气、水反应,且SOCl2也与水反应。
答案:(1)Li Li-e-===Li+
(2)2SOCl2+4e-===4Cl-+S+SO2↑
(3)出现白雾,有刺激性气味气体生成
SOCl2+H2O===SO2↑+2HCl↑
(4)因为构成电池的主要成分Li能和氧气、水反应,且SOCl2也与水反应
3.解析:该电池反应是一个可逆反应,当向B烧杯中加入浓盐酸时,c(H+)增大,平衡正向移动,此时I-被氧化,C1为负极,C2为正极,A烧杯中的电极反应为2I--2e-===I2,B烧杯中的电极反应为2H++AsO3-4+2e-===AsO3-3+H2O。
当向B烧杯中加入NaOH溶液时,c(H+)降低,平衡逆向移动,此时C2为负极,C1为正极,与(Ⅰ)操作中电极相反,故指针偏转方向相反。
答案:(1)操作(Ⅰ)化学平衡正向移动,故C1为负极,C2为正极;操作(Ⅱ)化学平衡逆向移动,C2为负极,C1为正极
(2)2I--2e-===I2
(3)AsO3-3+2OH--2e-===AsO3-4+H2O。
高中常见电极反应式的书写汇总

电极反应方程式一、原电池电极反应方程式1.Cu─H2SO4─Zn原电池正极:2H+ + 2e- == H2↑负极:Zn—2e- == Zn2+总反应式:Zn + 2H+ == Zn2+ + H2↑2.Cu─FeCl3─C原电池正极:2Fe3+ + 2e- == 2Fe2+负极:Cu —2e- == Cu2+总反应式:2Fe3+ + Cu == 2Fe2+ + Cu2+ 3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- == 4OH-负极:2Fe—4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2F e(O H)2↓4.钢铁在潮湿的空气中发生析氢腐蚀正极:2H+ +2e- == H2↑负极:Fe —2e- == Fe2+总反应式:Fe +2H+ == Fe2+ +H2↑5.氢氧燃料电池(中性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O6.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- == 2H2O负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O7.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e- + 4OH- == 4H2O总反应式:2H2 + O2 == 2H2O8.铅蓄电池(放电)正极(PbO2) :PbO2 + 2e- + 24SO-+ 4H+ == PbSO4↓+ 2H2O负极(Pb) :Pb—2e- + 24SO-== PbSO4↓总反应式:Pb + PbO2 + 4H+ + 224SO-== 2PbSO4↓+2H2O9.Al─NaOH─Mg原电池正极:6H2O + 6e- == 3H2↑+ 6OH-负极:2Al —6e- + 8OH- == 22AlO-+ 4H2O总反应式:2Al + 2OH- + 2H2O == 22AlO-+ 3H2↑10.CH4燃料电池(碱性介质)正极:2O2 + 4H2O + 8e- == 8OH-负极:CH4—8e- + 10OH- ==23CO-+ 7H2O总反应式:CH4 + 2O2 + 2OH- == 23CO-+ 3H2O 11.熔融碳酸盐燃料电池(Li2CO3和Na2CO3熔融盐作电解液,CO作燃料):正极:O2 + 2CO2 + 4e- == 223CO-(持续补充CO2气体)负极:2CO + 223CO-—4e- == 4CO2总反应式:2CO + O2 == 2CO212.银锌纽扣电池(碱性介质)正极(Ag2O) :Ag2O + H2O + 2e- == 2Ag + 2OH-负极(Zn) :Zn + 2OH-—2e- == ZnO + H2O总反应式:Zn + Ag2O == ZnO + 2Ag二、电解电极反应方程式1.电解CuCl2溶液阳极:2Cl-—2e- == Cl2↑阴极:Cu2+ + 2e- == Cu总反应式:2Cl- + Cu2+ ==== Cl2↑ + Cu2.电解精炼铜阳极(粗铜):Cu —2e- == Cu2+阴极(纯铜) :Cu2+ + 2e- == Cu总反应式:无3.电镀铜阳极(纯铜):Cu—2e- == Cu2+阴极(待镀金属,如Fe):Cu2+ + 2e- == Cu总反应式:无4.电解饱和食盐水阳极:2Cl-—2e- == Cl2↑阴极:2H2O + 2e- == H2↑ + 2OH-总反应式:2Cl- + 2H2O ==== H2↑+ Cl2↑ + 2OH-5.电解HCl溶液阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑总反应式:2Cl- + 2H+==== Cl2↑ + H2↑6.电解NaOH溶液阳极:4OH-—4e- == O2↑ + 2H2O阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑+ O2↑7.电解H2SO4溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H+ +4e- == 2H2↑总反应式:2H2O ==== 2H2↑ + O2↑8.电解KNO3溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑ + O2↑9.电解CuSO4溶液阳极:2H2O—4e- == O2↑ + 4H+电解电解电解电解电解电解阴极:2Cu2+ + 4e- == 2Cu↓总反应式:2Cu2+ + 2H2O ==== 2Cu↓+ O2↑+ 4H+ 10.电解AgNO3溶液阳极:2H2O—4e- == O2↑ + 4H+阴极:4Ag+ + 4e- == 4Ag↓总反应式:4Ag+ + 2H2O ==== 4Ag↓+ O2↑ + 4H+ 11.铅蓄电池充电阳极:PbSO4—2e- + 2H2O == PbO2 +24SO-+ 4H+阴极:PbSO4 + 2e- == Pb + 24SO-总反应式:2PbSO4 + 2H2O ==== Pb + PbO2 + 4H+ +224SO-B2H6(g) + 3O2(g) ==== B2O3(s) + 3H2O(l);ΔH = - 2165 kJ·mol-1电解电解电解。
常见的原电池电极反应式书写汇总

常见的原电池电极反应式书写汇总一次电池1、伏打电池:(负极—Zn、正极—Cu 电解液:H2SO4)负极:Zn–2e- === Zn2+(氧化反应)正极:2H+ + 2e- === H2↑(还原反应)离子方程式:Zn + 2H+== H2↑+Zn2+2、铁碳电池:(负极—Fe、正极—C 电解液:H2CO3弱酸性)负极:Fe – 2e- === Fe2+(氧化反应)正极:2H+ + 2e- === H2↑(还原反应)离子方程式:Fe + 2H+ === H2↑+ Fe2+(析氢腐蚀)3、铁碳电池:(负极—Fe、正极—C 电解液:中性或碱性)负极:2Fe–4e- === 2Fe2+ (氧化反应)正极:O2 + 2H2O + 4e- === 4OH- (还原反应)化学方程式:2Fe + O2 + 2H2O === 2Fe(OH)2(吸氧腐蚀)4Fe(OH)2 + O2+ 2H2O === 4Fe(OH)32Fe(OH)3=== Fe2O3+ 3H2O (铁锈的生成过程)4.铝镍电池:(负极—Al、正极—Ni 电解液:NaCl溶液、O2) 负极:4Al–12e- === 4Al3+(氧化反应)正极:3O2 + 6H2O + 12e- === 12OH-(还原反应)化学方程式:4Al + 3O2 + 6H2O === 4Al(OH)3(海洋灯标电池)5、普通锌锰干电池:(负极—Zn、正极—C 电解液:NH4Cl、MnO2的糊状物)负极:Zn–2e- === Zn2+(氧化反应)正极:2MnO2 + 2H+ + 2e- === Mn2O3+ H2O (还原反应)化学方程式:Zn + 2NH4Cl + 2MnO2=== ZnCl2+ Mn2O3+ 2NH3↑6、碱性锌锰干电池:(负极—Zn、正极—C 电解液:KOH、MnO2的糊状物)负极:Zn + 2OH–- 2e- === Zn(OH)2(氧化反应)正极:2MnO2 + 2H2O + 2e- === 2MnOOH + 2OH-(还原反应)化学方程式:Zn + 2MnO2 + 2H2O === Zn(OH)2+ MnOOH7、银锌电池:(负极—Zn、正极--Ag2O 电解液:NaOH )负极:Zn + 2OH- - 2e- === Zn(OH)2(氧化反应)正极:Ag2O + H2O + 2e- === 2Ag + 2OH-(还原反应)化学方程式:Zn + Ag2O + H2O === Zn(OH)2+ 2Ag8、铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料 电解液:海水 ) 负极:4Al - 12e - === 4Al 3+ (氧化反应) 正极:3O 2 + 6H 2O + 12e - === 12OH - (还原反应)总反应式为:4Al + 3O 2 + 6H 2O === 4Al(OH)3 (铂网增大与氧气的接触面) 9、镁---铝电池(负极--Al 、正极—Mg 电解液:KOH )负极(Al):2Al + 8OH - - 6e- === 2AlO2– + 4H 2O (氧化反应) 正极(Mg ):6H 2O + 6e - === 3H 2↑+ 6OH – (还原反应) 化学方程式:2Al + 2OH –+ 2H 2O === 2AlO 2–+ 3H 2↑10、锂电池一型:(负极--金属锂、正极--石墨 电解液:LiAlCl 4---SOCl 2 ) 负极:8Li - 8e - === 8Li +(氧化反应)正极:3SOCl 2 + 8e - === SO 32- + 2S + 6Cl - (还原反应) 化学方程式:8Li + 3SOCl 2 === Li 2SO 3 + 6LiCl + 2S二次电池(又叫蓄电池或充电电池)1、铅蓄电池:(负极—Pb 、正极—PbO 2 电解液:浓硫酸 ) 放电时 负极:Pb -2e -+SO 42- === PbSO 4 (氧化反应)正极:PbO 2 + 2e -+ 4H ++ SO 42- === PbSO 4 + 2H 2O (还原反应)充电时 阴极:PbSO 4 + 2H + + 2e - === Pb + H 2SO 4 (还原反应)阳极:PbSO 4 + 2H 2O - 2e - === PbO 2 + H 2SO 4 + 2H + (氧化反应)总化学方程式:Pb + PbO 2 + 2H 2SO 4 2PbSO 4 + 2H 2O 2、铁--镍电池:(负极--Fe 、正极—NiO 2电解质:KOH 溶液)放电时 负极: Fe - 2e - + 2OH – === Fe(OH)2 (氧化反应)正极:NiO 2 + 2H 2O + 2e — === Ni(OH)2 + 2OH – (还原反应)充电时 阴极:Fe(OH)2 + 2e - === Fe + 2OH – (还原反应)阳极:Ni(OH)2 - 2e - + 2OH – === NiO 2 + 2H 2O (氧化反应)总化学方程式:Fe + NiO 2 + 2H 2O Fe(OH)2 + Ni(OH)2 3、LiFePO 4电池(正极—LiFePO 4、负极—石墨 电解质:含Li +导电固体 )放电时 负极:Li – e - === Li + (氧化反应)正极:FePO 4 + Li + + e- === LiFePO 4 (还原反应)充电时 阴极:Li + + e- === Li (还原反应)阳极:LiFePO 4 - e - === FePO 4 + Li+ (氧化反应)总化学方程式:FePO 4 + Li LiFePO 44、镍--镉电池(负极--Cd 、正极—NiOOH 电解质:KOH 溶液 )放电时负极:Cd - 2e—+ 2OH–=== Cd(OH)2(氧化反应)正极:2NiOOH + 2e- + 2H2O === 2Ni(OH)2+ 2OH– (还原反应)充电时阴极:Cd(OH)2+ 2e- === Cd + 2OH–(还原反应)阳极:2Ni(OH)2 - 2e- + 2OH- === 2NiOOH + 2H2O (氧化反应)总化学方程式:Cd + 2NiOOH + 2H2O Cd(OH)2+ 2Ni(OH)25、氢--镍电池:(负极-LaNi5储氢合金、正极—NiOOH 电解质:KOH + LiOH )放电时负极:LaNi5H6-6e— + 6OH–=== LaNi5+ 6H2O (氧化反应)正极:6NiOOH + 6e— + 6H2O === 6Ni(OH)2+ 6OH– (还原反应)充电时阴极:LaNi5 + 6e- + 6H2O === LaNi5H6+ 6OH– (还原反应)阳极:6Ni(OH)2- 6e—+ 6OH–=== 6NiOOH + 6H2O (氧化反应)总化学方程式:LaNi5H6+ 6NiOOH LaNi5+ 6Ni(OH)26、高铁电池:(负极—Zn、正极---石墨电解质:浸湿固态碱性物质)放电时负极:3Zn - 6e-+ 6OH–=== 3Zn(OH)2(氧化反应)正极:2FeO42-+ 6e- + 8H2O === 2Fe(OH)3+ 10OH–(还原反应)充电时阴极:3Zn(OH)2+ 6e- === 3Zn + 6OH–(还原反应)阳极:2Fe(OH)3-6e- + 10OH–=== 2FeO42—+ 8H2O (氧化反应)总化学方程式:3Zn + 2K2FeO4+ 8H2O 3Zn(OH)2+ 2Fe(OH)3+ 4KOH7、锂电池二型(负极LiC6、正极含锂的二氧化钴LiCoO2、充电时LiCoO2中Li被氧化,Li+还原以Li原子形式嵌入电池负极材料碳C6中,以LiC6表示)放电时负极: LiC6–xe-=== Li(1-x)C6+ xLi+ (氧化反应)正极:Li(1-x)CoO2+ xe- + xLi+=== LiCoO2(还原反应)充电时阴极:Li(1-x)C6+ xLi+ + xe-=== LiC6(还原反应)阳极:LiCoO2– xe- === Li(1-x)CoO2+ xLi+ (氧化反应)总反应方程式:Li(1-x)CoO2+ LiC6LiCoO2+ Li(1-x)C6燃料电池一、氢氧燃料电池氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2=== 2H2O 电极反应特别要注意电解质,有下列三种情况:1、电解质是KOH溶液(碱性电解质)负极:H2– 2e- + 2OH—=== 2H2O (氧化反应)正极:O2 + 2H2O + 4e- === 4OH— (还原反应)总反应方程式:2H2 + O2=== 2H2O2、电解质是H2SO4溶液(酸性电解质)负极:H2–2e-=== 2H+ (氧化反应)正极:O2 + 4H+ + 4e- === 2H2O (还原反应)总反应方程式:2H2 + O2=== 2H2O3、电解质是NaCl溶液(中性电解质)负极:H2– 2e-=== 2H+ (氧化反应)正极:O2 + H2O + 4e- === 4OH—总反应方程式:2H2 + O2=== 2H2O说明:1、碱性溶液反应物、生成物中均无H+2、水溶液中不能出现O2-3、中性溶液反应物中无H+和OH-4、酸性溶液反应物、生成物中均无OH-二、甲醇燃料电池1.碱性电解质(铂为两极、电解液KOH溶液)正极:3O2 + 12e- + 6H20 === 12OH-(还原反应)负极:2CH3OH –12e- + 16OH—=== 2CO32- + 12H2O (氧化反应)总反应方程式:2CH3OH + 3O2+ 4KOH === 2K2CO3+ 6H2O2.酸性电解质(铂为两极、电解液H2SO4溶液)正极:3O2 + 12e- + 12H+ === 6H2O (还原反应)(注:乙醇燃料电池与甲醇燃料电池原理基本相同)负极:2CH3OH–12e- +2H2O==12H++2CO2(氧化反应)总反应式:2CH3OH + 3O2=== 2CO2+ 4H2O (氧化反应)三、CO燃料电池(总反应方程式均为:2CO+O2=2CO2)1、熔融盐(铂为两极、Li2CO3和Na2CO3的熔融盐作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气)正极:O2+4e-+ 2CO2= 2CO32- (还原反应)负极:2CO + 2CO32- - 4e- === 4CO2(氧化反应)2、酸性电解质(铂为两极、电解液H2SO4溶液)正极:O2 + 4e- + 4H+ === 2H2O (还原反应)负极:2CO–4e- + 2H2O === 2CO2+ 4H+ (氧化反应)四、肼燃料电池(铂为两极、电解液KOH溶液)正极:O2 + 2H2O + 4e- === 4OH—(还原反应)负极:N2H4+ 4OH—- 4e-=== N2+ 4H2O (氧化反应)总反应方程式:N2H4+ O2=== N2+ 2H2O五、甲烷燃料电池1.碱性电解质(铂为两极、电解液KOH溶液)正极:2O2 + 2H2O + 8e- === 8OH— (还原反应)负极:CH4 + 10OH— - 8e- === CO32- + 7H2O (氧化反应)总反应方程式:CH4 + 2KOH + 2O2=== K2CO3+ 3H2O2、酸性电解质(铂为两极、电解液H2SO4溶液)正极:2O2 + 8e- + 8H+ === 4H2O (还原反应)负极:CH4 - 8e- + 2H2O === 8H+ + CO2(氧化反应)总反应方程式:CH4 + 2O2=== CO2+ 2H2O六、丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1、电解质是熔融碳酸盐(K2CO3或Na2CO3)正极:5O2 + 20e- + 10CO2=== 10CO32- (还原反应)负极:C3H8- 20e- + 10CO32- === 3CO2+ 4H2O (氧化反应)总反应方程式:C3H8+ 5O2=== 3CO2+ 4H2O2、酸性电解质(电解液H2SO4溶液)正极:5O2 + 20e- + 20H+ === 10H2O (还原反应)负极:C3H8- 20e- + 6H2O === 3CO2+ 20H+(氧化反应)总反应方程式:C3H8+ 5O2=== 3CO2+ 4H2O3、碱性电解质(铂为两极、电解液KOH溶液)正极:5O2 + 20e- + 10H2O === 20OH— (还原反应)负极:C3H8- 20e- + 26OH—=== 3CO32- + 17H2O (氧化反应)总反应方程式:C3H8+ 5O2+ 6KOH === 3K2CO3+ 7H2O七、乙烷燃料电池(铂为两极、电解液KOH溶液)正极:7O2 + 28e- + 14H2O === 28OH— (还原反应)负极:2C2H6- 28e- + 36OH—=== 4CO32- + 24H2O (氧化反应)总反应方程式:2C2H6+ 7O2+ 8KOH === 4K2CO3+ 10H2O。
原电池电极反应式的书写练习

原电池电极反应式的书写练习1.伏打电池:(负极—Zn、正极—Cu、电解液—H2SO4)负极:正极:总:2.铁碳电池:(负极—Fe、正极—C、电解液酸性)负极:正极:总:3.铁碳电池:(负极—Fe、正极—C、电解液中性或碱性)负极:正极:化学方程式4.铝镍电池:(负极—Al、正极—Ni 电解液NaCl溶液、O2)负极:正极:化学方程式5.普通锌锰干电池:(负极—、正极—C 、电解液NH4Cl、MnO2的糊状物)负极:正极:2MnO2+2H++2e-==Mn2O3+H2O (还原反应)化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑6.碱性锌锰干电池:(负极—、正极—C、电解液KOH 、MnO2的糊状物)负极:正极:化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2+ MnOOH7.银锌电池:(负极—、正极-- 、电解液NaOH )负极:正极:化学方程式:Zn + Ag2O + H2O == Zn(OH)2 + 2Ag8.铝–空气–海水(负极-- 、正极--石墨、铂网等能导电的惰性材料、电解液--海水)负极:正极:总反应式为:4Al+3O2+6H2O===4Al(OH)3(铂网增大与氧气的接触面)9.镁---铝电池(负极-- 、正极-- 电解液KOH)负极:正极:化学方程式:2Al + 2OH–+ 2H2O =2AlO2–+ 3H210.锂电池一型:(负极--金属锂、正极--石墨、电解液LiAlCl4 -SOCl2)负极:正极:3SOCl2+8e-=SO32-+2S+6Cl-化学方程式:8Li+3SOCl2 === Li2SO3 +6LiCl +2S,放电2PbSO4+2H2O 11.铅蓄电池:总化学方程式:Pb+PbO2 + 2H2SO4充电放电时负极:正极:12. 铅蓄电池充电时阴极:阳极:13.电解质是KOH溶液(碱性电解质)负极:正极:总:2H2 + O2 === 2H2O14.电解质是H2SO4溶液(酸性电解质)负极:正极:总:2H2 + O2 === 2H2O 15.电解质是NaCl溶液(中性电解质)负极:正极:总:2H2 + O2 === 2H2O 16.碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O 17.酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式:2CH3OH + 3O2 === 2CO2 + 4H2O (氧化反应) 18.碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O19.酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应方程式:CH4 + 2O2 === CO2 + 2H2O20.电解质是熔融碳酸盐(K2CO3或Na2CO3)正极:负极:总反应方程式C3H8 + 5O2 === 3CO2 + 4H2O。
(完整版)电极反应式书写练习答案
正极 :3O2+ 12e-+12H+=6H2O
总方程式 :2CH3OH+3O2=2CO2+4H2O 15.CO 燃料电池
(1).熔融盐 (铂为两极、 Li 2CO3 和 Na2CO3 的熔融盐作电解质, CO 为负极燃气, 空气与 CO2 的混合气为正极助燃气)
负极 :2CO-4e-+2CO32-=4CO2
负极 :Zn-2e-=Zn2+
正极
:2MnO
2+
2NH
+
4
+2e-=2MnO(OH)
+
2NH
3↑
2
2. PbO2+Pb+2H2SO4=2PbSO4+2H2O 负极 :Pb- 2e-+SO42-=PbSO4 正极 :PbO2+2e-+4H++ SO42-=PbSO4+2H2O
3. 海水做电解质溶液 :5MnO 2+2Ag +2NaCl=Na2Mn 5O10+2AgCl 负极 :2Ag-2e-+ 2Cl=2AgCl 正极 :5MnO 2+2e-=Mn 5O102-
负极 :3Zn-6e-+6OH-=3Zn(OH) 2
正极 :2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-
3
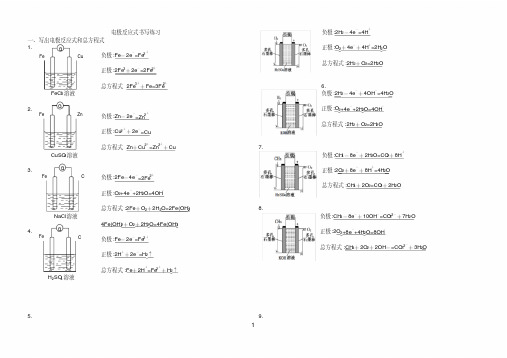
电极反应式书写练习
一、写出电极反应式和总方程式
1.
G
Fe
Cu
负极 :Fe- 2e-=Fe2+
正极 :2Fe3+ 2e-=2Fe2+
FeC3l 溶液
2.
G
Fe
Zn
总方程式 2Fe3++Fe=3Fe2+
负极 :Zn- 2e-=Zn2+ 正极 :Cu2++2e-=Cu
CuSO4 溶液
总方程式 Zn+Cu2+=Zn2++Cu
总方程式 :2Al+2OH-+ 2H2O=2AlO2-+3H2↑
原电池电极反应式的书写专题练习(附答案)

原电池电极反应式的书写专题训练1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:正极:总反应离子方程式Zn + 2H+ == H2↑+ Zn2+负极:Zn–2e-==Zn2+正极:2H++2e-==H2↑2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极:正极:总反应离子方程式Fe+2H+==H2↑+Fe2+负极:Fe–2e-==Fe2+正极:2H++2e-==H2↑3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)负极:正极:总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2;(铁锈的生成过程) 负极:2Fe–4e-==2Fe2+正极:O2+2H2O+4e-==4-OH4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:正极:总反应化学方程式:4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)负极:4Al–12e-==4Al3+正极:3O2+6H2O+12e-==12-OH5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:正极:总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O负极:Zn–2e-==Zn2+正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:正极:总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)负极:Zn + 2OH– 2e-== Zn(OH)2 正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-7、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式:Zn + Ag2O == ZnO + 2Ag负极:Zn+2OH-–2e-== ZnO+H2O 正极:Ag2O + H2O + 2e-== 2Ag + 2OH-8、镁铝电池:(负极--Al ,正极--Mg ,电解液KOH )负极(Al): 正极(Mg ):总反应化学方程式: 2Al + 2OH - + 6H 2O = 2【Al (OH )4】-+ 3H 2↑ 负极(Al): 2Al + 8OH -+6e - = 2【Al (OH )4】- 正极(Mg ): 6H 2O + 6e -= 3H 2↑+6OH – 9、高铁电池 (负极--Zn ,正极--碳,电解液KOH 和K 2FeO 4)正极: 负极:总反应化学方程式:3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH正极:2FeO 42- + 8H 2O +6e -==2Fe(OH)3 + 4OH – 负极: 3Zn + 6OH – 6e -== 3Zn(OH)2 10、镁/H 2O 2酸性燃料电池正极: 负极:总反应化学方程式:Mg+ H 2SO 4+H 2O 2=MgSO 4+2H 2O镁/H 2O 2酸性燃料电池 正极:2H ++H 2O 2=2H 2O 负极:Mg –2e -== Mg 2+ 11、铅蓄电池:(负极—Pb 正极—PbO 2 电解液— 稀硫酸)负极: 正极:总化学方程式 Pb +PbO 2 + 2H 2SO 4==2PbSO 4+2H 2O负极: Pb -2e -+SO 42-==PbSO 4 正极: PbO 2+2e -+4H ++SO 42-==PbSO 4+2H 2O 12、镍镉电池(负极--Cd 、正极—NiOOH 、电解液: KOH 溶液)放电时负极: 正极:总化学方程式 Cd + 2NiOOH + 2H 2O===Cd(OH)2 + 2Ni(OH)2负极: Cd -2e — + 2 OH – == Cd(OH)2 正极: 2NiOOH + 2e — + 2H 2O == 2Ni(OH)2+ 2OH –13、氢氧燃料电池:总反应方程式: 2H 2 + O 2 === 2H 2O(1)电解质是KOH 溶液(碱性电解质)负极: 正极:2H 2 – 4e - + 4OH — === 4H 2O 正极:O 2 + 2H 2O + 4e -=== 4OH — (2)电解质是H 2SO 4溶液(酸性电解质)负极: 正极:负极:2H 2 –4e - === 4H + 正极:O 2 + 4H + + 4e -=== 2H 2O (3)电解质是NaCl 溶液(中性电解质)负极: 正极:放电充电负极:2H2– 4e-=== 4H+正极:O2 + 2H2O + 4e-=== 4OH—14、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O正极:3O2 + 12e-+ 6H2O=== 12OH-负极:2CH3OH – 12e-+ 16OH—=== 2CO32-+12H2O (2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式2CH3OH + 3O2 === 2CO2 + 4H2O正极:3O2 + 12e-+ 12H+ == 6H2O 负极:2CH3OH –12e-+2H2O==12H++2CO215、CO燃料电池(铂为两极、电解液H2SO4溶液)总反应方程式为:2CO +O2 =2CO2正极:负极:正极:O2 + 4e-+ 4H+ == 2H2O 负极:2CO – 4e-+ 2H2O== 2CO2 +4H+16、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O正极:2O2 + 4H2O + 8e-== 8OH- 负极:CH4 + 10OH—-8e-== CO32-+ 7H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)总反应方程式:CH4 + 2O2 === CO2 + 2H2O 正极:负极:正极:2O2 + 8e-+ 8H+ == 4H2O 负极:CH4-8e-+ 2H2O == 8H+ + CO217、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)总反应方程式:N2H4+ O2 === N2 +2H2O正极:负极:正极:O2 + 2H2O + 4e-== 4OH- 负极:N2H4+ 4OH—– 4e-=== N2 +2H2O18、H2、Cl2电池(铂为两极,一极为H2,另一极为Cl2,电解质溶液是20%~30%的KOH溶液)正极:负极:总反应方程式:正极:Cl2+ 2e-== 2 Cl-负极:H2+ 2OH—– 2e-===2H2O总反应方程式:Cl2+ H2+ 2OH—==2 Cl-+2H2O19、Ag、Cl2电池(负极—Ag 、正极—铂,通入Cl2,电解液: 1 mol·L-1盐酸)正极:负极:总反应方程式:2Ag+ Cl2==2 Ag Cl正极:Cl2+ 2e-== 2 Cl-负极:2Ag+2 Cl-– 2e ==2 Ag Cl20、H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是盐酸、氯化铵溶液)正极:负极:总反应方程式:3H2 + N2 +2HCl==2 NH4Cl正极:N2 +8H++ 6e-== 2 NH4+ 负极:3H2– 6e ==6H+21、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式2H2 + O2 === 2H2O负极:2H2– 4e-+2CO32-=== 2CO2↑+2H2O 正极:O2 + 4e-+2CO2 === 2CO32—22、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式2H2 + O2 === 2H2O负极:2H2–4e-=== 4H+正极:O2 + 4H+ + 4e-=== 2H2O23、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O正极:13O2+ 52e-==26O2- 负极:2C4H10+26O2- – 52e-==8CO2+10H2O24、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:总反应方程式O2 +2CO==4CO2正极:O2 +4e-+2CO2 =2CO32-负极:2CO+2CO32-– 4e-==4CO225、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS的石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe正极:2Li++FeS+2e—=Li2S+Fe负极:2Li-2e-=2Li +[练习1] Al和Cu作电极所构成的原电池(1)电解质溶液为稀硫酸:Al作______极, Cu作______极.负极反应____________ 正极反应___________总反应式_____________________(2)电解质溶液为浓硝酸:Al作______极, ②Cu作______极.负极反应____________ 正极反应___________总反应式_____________________(3)电解质溶液为NaOH溶液:①Al作______极, ②Cu作______极,负极反应____________ 正极反应___________总反应式_____________________(4)电解质溶液为NaCl溶液:①Al作______极, ②作Cu ______极.负极反应____________ 正极反应___________总反应式_________________________(5)Al和Mg作电极所构成的原电池, 电解质溶液为NaOH溶液①Al作___极, ②Mg作___极,负极反应____________ 正极反应___________总反应式_________________________[练习2] 丙烷燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.电解质是熔融碳酸盐(K2CO3或Na2CO3)负极反应________________ 正极反应________________总电池反应式为2.酸性电解质(电解液H2SO4溶液)负极反应________________ 正极反应________________总电池反应式为3.碱性电解质(铂为两极、电解液KOH溶液)负极反应________________ 正极反应________________总电池反应式为[练习3]乙醇燃料电池(铂为两极、正极通入O2和CO2、负极通入丙烷、电解液有三种)1.酸性电解质(电解液H2SO4溶液)负极反应___________ 正极反应________总电池反应式为2.碱性电解质(铂为两极、电解液KOH溶液)负极反应________________ 正极反应________________总电池反应式为[练习5]铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极反应________________ 正极反应________________总电池反应式为[练习6]铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极反应________________ 正极反应________________总电池反应式为[练习7]普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极反应________________ 正极反应________________总电池反应式为[练习8]肼(N2H4)燃料电池(电解质溶液是硫酸)总反应方程式:N2H4+ O2 === N2 +2H2O 正极:负极:[练习9]H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是KOH溶液)正极:负极:。
原电池电极反应式的书写汇总_练习和答案与解析

高中常见的原电池、电解池电极反应式的书写练习一、一次电池1、伏打电池:(负极—Zn ,正极—Cu ,电解液—H 2SO 4)负极: 正极:总反应离子方程式 Zn + 2H + == H 2↑+ Zn 2+2、铁碳电池(析氢腐蚀):(负极—Fe ,正极—C ,电解液——酸性)负极: 正极:总反应离子方程式 Fe+2H +==H 2↑+Fe 2+3、铁碳电池(吸氧腐蚀):(负极—Fe ,正极—C ,电解液——中性或碱性)负极: 正极:总反应化学方程式:2Fe+O 2+2H 2O==2Fe(OH)2; (铁锈的生成过程)4.铝镍电池:(负极—Al ,正极—Ni ,电解液——NaCl 溶液)负极: 正极:总反应化学方程式: 4Al+3O 2+6H 2O==4Al(OH)3 (海洋灯标电池)5、普通锌锰干电池:(负极——Zn ,正极——碳棒,电解液——NH 4Cl 糊状物)负极: 正极:总反应化学方程式:Zn+2NH 4Cl+2MnO 2=ZnCl 2+Mn 2O 3+2NH 3+H 2O6、碱性锌锰干电池:(负极——Zn ,正极——碳棒,电解液KOH 糊状物)负极: 正极:总反应化学方程式:Zn +2MnO 2 +2H 2O == Zn(OH)2 + MnO(OH)7、银锌电池:(负极——Zn ,正极--Ag 2O ,电解液NaOH )负极: 正极 :总反应化学方程式: Zn + Ag 2O == ZnO + 2Ag8、镁铝电池:(负极--Al ,正极--Mg ,电解液KOH )负极(Al): 正极(Mg ): 总反应化学方程式: 2Al + 2OH - + 6H 2O = 2【Al (OH )4】-+ 3H 2↑ 9、高铁电池 (负极--Zn ,正极--碳,电解液KOH 和K 2FeO 4)正极: 负极:总反应化学方程式:3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH放电充电10、镁/H2O2酸性燃料电池正极:负极:总反应化学方程式:Mg+ H2SO4+H2O2=MgSO4+2H2O二、充电电池1、铅蓄电池:(负极—Pb 正极—PbO2 电解液—稀硫酸)负极:正极:总化学方程式Pb+PbO2 + 2H2SO4==2PbSO4+2H2O2、镍镉电池(负极--Cd、正极—NiOOH、电解液: KOH溶液)放电时负极:正极:总化学方程式Cd + 2NiOOH + 2H2O===Cd(OH)2 + 2Ni(OH)2三、燃料电池1、氢氧燃料电池:总反应方程式: 2H2 + O2 === 2H2O(1)电解质是KOH溶液(碱性电解质)负极:正极:(2)电解质是H2SO4溶液(酸性电解质)负极:正极:(3)电解质是NaCl溶液(中性电解质)负极:正极:2、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式2CH3OH + 3O2 === 2CO2 + 4H2O3、CO燃料电池(铂为两极、电解液H2SO4溶液)总反应方程式为:2CO +O2 =2CO2正极:负极:4、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式:CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)总反应方程式:CH4 + 2O2 === CO2 + 2H2O 正极:负极:5、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)总反应方程式:N2H4+ O2 === N2 +2H2O正极:负极:6、H2、Cl2电池(铂为两极,一极为H2,另一极为Cl2,电解质溶液是20%~30%的KOH溶液)正极:负极:总反应方程式:7、A g、Cl2电池(负极—Ag 、正极—铂,通入Cl2,电解液: 1 mol·L-1盐酸)正极:负极:总反应方程式:2Ag+ Cl2==2 Ag Cl8、H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是盐酸、氯化铵溶液)正极:负极:总反应方程式:3H2 + N2 +2HCl==2 NH4Cl四、非水电池1、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式2H2 + O2 === 2H2O2、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式2H2 + O2 === 2H2O3、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O4、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:总反应方程式O2 +2CO==4CO25、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS的石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe五、电解池1、写出下列电解池的电极反应式和总反应式(1)用惰性电极电解硫酸钠溶液:若要恢复到原溶液浓度,加入一定量____________ 阳极: 。
ll常见的原电池电极反应式的书写练习讲解

2、甲醇燃料电池 (注:乙醇燃料电池与甲醇相似 )
(1)碱性电解质(铂为两极、电解液KOH溶液)
正极: 3O2 + 12e— + 6H2O=== 12OH—
负极: 2CH3OH –12e— +16OH—==12H2O+2CO32-
பைடு நூலகம் 二、充电电池
1、铅蓄电池:(负极—Pb 正极—PbO2 电解液— 稀硫酸) 负极: Pb-2e—+SO42—==PbSO4 正极: PbO2+2e—+4H++SO42—==PbSO4+2H2O 总化学方程式 Pb+PbO2 + 2H2SO4==2PbSO4+2H2O 2、镍镉电池(负极--Cd 、正极—NiOOH、电解液:
正极: 2MnO2+2NH4++2e—==Mn2O3 +2NH3+H2O
总反应化学方程式Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O 6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊
状物) 负极: 正极:
Zn + 2OH—– 2e—== Zn(OH)2 2MnO2 + 2H2O + 2e—==2MnO(OH) +2OH—
4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液) 负极: 4Al–12e—==4Al3+
正极: 3O2+6H2O+12e—==12OH总反应化学方程式: 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池) 5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池电极反应式的书写汇总-练习与答案高中常见的原电池、电解池电极反应式的书写练习一、一次电池1、伏打电池:(负极—Zn,正极—Cu,电解液—H2SO4)负极:正极:总反应离子方程式 Zn + 2H+ == H2↑+ Zn2+2、铁碳电池(析氢腐蚀):(负极—Fe,正极—C,电解液——酸性)负极:正极:总反应离子方程式 Fe+2H+==H2↑+Fe2+3、铁碳电池(吸氧腐蚀):(负极—Fe,正极—C,电解液——中性或碱性)负极:正极:总反应化学方程式:2Fe+O2+2H2O==2Fe(OH)2; (铁锈的生成过程)4.铝镍电池:(负极—Al,正极—Ni,电解液——NaCl溶液)负极:正极:总反应化学方程式: 4Al+3O2+6H2O==4Al(OH)3 (海洋灯标电池)5、普通锌锰干电池:(负极——Zn,正极——碳棒,电解液——NH4Cl糊状物)负极:正极:总反应化学方程式:Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3+H2O6、碱性锌锰干电池:(负极——Zn,正极——碳棒,电解液KOH糊状物)负极:正极:总反应化学方程式:Zn +2MnO2 +2H2O == Zn(OH)2 + MnO(OH)7、银锌电池:(负极——Zn,正极--Ag2O,电解液NaOH )负极:正极:总反应化学方程式: Zn + Ag 2O == ZnO + 2Ag8、镁铝电池:(负极--Al ,正极--Mg ,电解液KOH )负极(Al): 正极(Mg ):总反应化学方程式: 2Al + 2OH - + 6H 2O = 2【Al (OH )4】-+ 3H 2↑9、高铁电池 (负极--Zn ,正极--碳,电解液KOH 和K 2FeO 4)正极: 负极:总反应化学方程式:3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH10、镁/H 2O 2酸性燃料电池正极: 负极:总反应化学方程式:Mg+ H 2SO 4+H 2O 2=MgSO 4+2H 2O二、充电电池1、铅蓄电池:(负极—Pb 正极—PbO 2 电解液— 稀硫酸)负极: 正极:总化学方程式 Pb +PbO 2 + 2H 2SO 4==2PbSO 4+2H 2O2、镍镉电池(负极--Cd 、正极—NiOOH 、电解液: KOH 溶液)放电时负极: 正极:总化学方程式 Cd + 2NiOOH + 2H 2O===Cd(OH)2 + 2Ni(OH)2三、燃料电池1、氢氧燃料电池:总反应方程式: 2H 2 + O 2 === 2H 2O(1)电解质是KOH 溶液(碱性电解质)负极: 正极:(2)电解质是H 2SO 4溶液(酸性电解质)负极: 正极:放电充电(3)电解质是NaCl溶液(中性电解质)负极:正极:2、甲醇燃料电池(注:乙醇燃料电池与甲醇相似)(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应化学方程式:2CH3OH + 3O2 + 4KOH=== 2K2CO3 + 6H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)正极:负极:总反应式 2CH3OH + 3O2 === 2CO2 + 4H2O3、CO燃料电池(铂为两极、电解液H2SO4溶液)总反应方程式为: 2CO + O2 = 2CO2正极:负极:4、甲烷燃料电池(1)碱性电解质(铂为两极、电解液KOH溶液)正极:负极:总反应方程式: CH4 + 2KOH+ 2O2 === K2CO3 + 3H2O(2)酸性电解质(铂为两极、电解液H2SO4溶液)总反应方程式:CH4 + 2O2 === CO2 + 2H2O正极:负极:5、肼(N2H4)燃料电池(电解质溶液是20%~30%的KOH溶液)总反应方程式: N2H4+ O2 === N2 +2H2O正极:负极:6、H2、Cl2电池(铂为两极,一极为H2,另一极为Cl2,电解质溶液是20%~30%的KOH 溶液)正极:负极:总反应方程式:7、A g、Cl2电池(负极—Ag 、正极—铂,通入Cl2,电解液: 1 mol·L-1盐酸)正极:负极:总反应方程式: 2Ag+ Cl2==2 Ag Cl8、H2、N2电池(铂为两极,一极为H2,另一极为N2,电解质溶液是盐酸、氯化铵溶液)正极:负极:总反应方程式: 3H2 + N2 +2HCl==2 NH4Cl四、非水电池1、氢氧电池:一极为H2,另一极为空气与CO2的混合气,电解质为熔融K2CO3(盐)负极:正极:总反应方程式 2H2 + O2 === 2H2O2、固体酸燃料电池(一极通入空气,另一极通入H2;电解质是CsHSO4固体传递H+)负极:正极:总反应方程式 2H2 + O2 === 2H2O3、新型燃料电池(一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体)正极:负极:总反应方程式:2C4H10+13O2=8CO2+10H2O4、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极:负极:总反应方程式 O2 +2CO==4CO25、Li-Al/FeS电池(一级是Li-Al合金,一极是粘有FeS的石墨,电解质是Li2CO3熔融盐)正极:负极:总反应方程式:2Li+FeS=Li2S+Fe五、电解池1、写出下列电解池的电极反应式和总反应式(1)用惰性电极电解硫酸钠溶液:若要恢复到原溶液浓度,加入一定量____________ 阳极: 。
阴极: 。
总反应式: 。
(2)用惰性电极电解氯化铜溶液:若要恢复到原溶液浓度,加入一定量____________ 阳阳极: 。
阴极: 。
总反应式: 。
(3)用惰性电极电解饱和NaCl溶液:若要恢复到原溶液浓度,加入一定量_____ 阳极: 。
阴极: 。
总反应式: 。
(4)用惰性电极电解硫酸铜溶液:若要恢复到原溶液浓度,加入一定量____________ 阳极: 。
阴极: 。
总反应式: 。
(5)用惰性电极电解硝酸银溶液:若要恢复到原溶液浓度,加入一定量____________ 阳极: 。
阴极: 。
总反应式: 。
(6)用惰性电极电解熔融氯化钠:阳极: 。
阴极: 。
总反应式: 。
(7)用惰性电极电解熔融氧化铝:阳极: 。
阴极: 。
总反应式: 。
2、应用:(1)精炼铜:阳极: 。
阴极: 。
溶液中C(Cu2+)___________,阳极减少的质量_________阴极增加的质量(“=”或“≠”)(2)电镀(镀铜)阳极: 。
阴极: 。
镀件必须作极. 镀层金属作极.电解质溶液中必须含有金属离子。
溶液中C(Cu2+)___________,阳极减少的质量_________阴极增加的质量(“=”或“≠”)答案一、一次电池1、伏打电池:负极: Zn–2e-==Zn2+正极: 2H++2e-==H2↑2、铁碳电池(析氢腐蚀):负极: Fe–2e-==Fe2+正极:2H++2e-==H2↑3、铁碳电池(吸氧腐蚀):负极: 2Fe–4e-==2Fe2+正极:O2+2H2O+4e-==4-OH4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;2Fe(OH)3==Fe2O3 +3 H2O4.铝镍电池:负极: 4Al–12e-==4Al3+正极:3O2+6H2O+12e-==12-OH5、普通锌锰干电池:负极:Zn–2e-==Zn2+正极:2MnO2+2NH4++2e-==Mn2O3 +2NH3+H2O6、碱性锌锰干电池:负极:Zn + 2OH– 2e-== Zn(OH)2 正极:2MnO2 + 2H2O + 2e-==2MnO(OH) +2OH-7、银锌电池:负极:Zn+2OH-–2e-== ZnO+H2O 正极:Ag2O + H2O + 2e-== 2Ag + 2OH-8、镁铝电池:负极(Al): 2Al + 8OH-+6e-= 2【Al(OH)4】-正极(Mg): 6H2O + 6e-=3H2↑+6OH–9、高铁电池正极:2FeO42- + 8H2O +6e-==2Fe(OH)3 + 4OH–负极: 3Zn + 6OH– 6e-== 3Zn(OH)210、镁/H2O2酸性燃料电池正极:2H++H2O2=2H2O 负极:Mg–2e-== Mg 2+二、二次电池(又叫蓄电池或充电电池)1、铅蓄电池:放电时:负极: Pb-2e-+SO42-==PbSO4正极: PbO2+2e-+4H++SO42-==PbSO4+2H2O2、镍镉电池放电时负极: Cd-2e—+ 2 OH– == Cd(OH)2 正极: 2NiOOH + 2e—+ 2H2O ==2Ni(OH)2+ 2OH–三、燃料电池1、氢氧燃料电池(1)电解质是KOH溶液(碱性电解质)负极:2H2– 4e- + 4OH— === 4H2O 正极:O2 + 2H2O + 4e- === 4OH—(2)电解质是H2SO4溶液(酸性电解质)负极:2H2–4e- === 4H+正极:O2 + 4H+ + 4e- === 2H2O(3)电解质是NaCl溶液(中性电解质)负极:2H2– 4e- === 4H+正极:O2 + 2H2O + 4e- === 4OH—2、甲醇燃料电池(1)碱性电解质正极:3O2 + 12e- + 6H2O=== 12OH-负极:2CH3OH – 12e-+ 16OH—=== 2CO32-+12H2O(2)酸性电解质正极:3O2 + 12e-+ 12H+ == 6H2O 负极:2CH3OH –12e-+2H2O==12H++2CO23、CO燃料电池正极: O2 + 4e-+ 4H+ == 2H2O 负极: 2CO – 4e- + 2H2O== 2CO2 +4H+4、甲烷燃料电池(1)碱性电解质正极: 2O2 + 4H2O + 8e- == 8OH- 负极: CH4 + 10OH—-8e- == CO32- + 7H2O (2)酸性电解质正极: 2O2 + 8e-+ 8H+ == 4H2O 负极: CH4- 8e- + 2H2O == 8H+ + CO25、肼(N2H4)燃料电池正极: O2 + 2H2O + 4e- == 4OH- 负极: N2H4+ 4OH—– 4e-=== N2 +2H2O6、正极:Cl2 + 2e- == 2 Cl-负极: H2+ 2OH—– 2e-===2H2O总反应方程式:Cl2 + H2+ 2OH—==2 Cl-+2H2O7、正极:Cl2 + 2e- == 2 Cl-负极: 2Ag+2 Cl-– 2e ==2 Ag Cl8、正极:N2 +8H++ 6e- == 2 NH4+ 负极: 3H2– 6e ==6H+四、非水体系电池1、氢氧燃料电池负极:2H2– 4e-+2CO32- === 2CO2↑+2H2O 正极:O2 + 4e-+2CO2 === 2CO32—2、固体酸燃料电池负极:2H2–4e- === 4H+正极:O2 + 4H+ + 4e- === 2H2O3、新型燃料电池正极:13O2+ 52e-==26O2- 负极:2C4H10+26O2- – 52e-==8CO2+10H2O4、CO电池(一极为CO,另一极为空气与CO2的混合气,Li2CO3和Na2CO3的熔融盐作电解质)正极: O2 + 4e-+ 2CO2 = 2CO32-负极: 2CO+2CO32-– 4e-==4CO25、Li-Al/FeS电池正极:2Li++FeS+2e—=Li2S+Fe负极: 2Li-2e-=2Li +五、电解池1.(1)H2O阳极:4OH-— 4e- == O2↑ + 2H2O 阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O 电解2H2↑ + O2↑(2)Cu Cl2阳极:2Cl-—2e- == Cl2↑阴极: Cu2++ 2e- =Cu总反应式:2Cl- + Cu2+电解Cl2↑ + Cu(3)H Cl阳极:2Cl-—2e- == Cl2↑阴极:2H+ + 2e- == H2↑总反应式:2Cl- + 2H2O 电解H2↑ + Cl2↑ + 2OH-(4) CuO或CuCO3阳极:4OH - 4e- =2H2O + O2↑阴极:2Cu2++ 4e-=2Cu2CuSO4 + 2H2O电解2H2SO4 + O2↑+ 2Cu(5) Ag2O阳极:4OH - 4e- =2H2O + O2↑阴极:4Ag+ + 4e- == 4Ag总反应式:4Ag+ + 2H2O 电解4Ag↓ + O2↑ + 4H+(6)阳极:2Cl-—2e- == Cl2↑ 阴极:2Na+ + 2e- == 2 Na总反应式:2NaCl 电解Cl2↑+2 Na(7)阳极:6O2-—12e- ==3 O2↑ 阴极:4Al3+ +12e- == 4Al总反应式:2 Al2O3电解3 O2↑+4Al2.(1)阳极:Cu–2e- =Cu 2+ 阴极: Cu2++ 2e- =Cu 减小≠(2)阳极:Cu–2e- =Cu 2+ 阴极: Cu2++ 2e- =Cu 阴阳镀层不变=。
