不合格药品报告表
医院药品不合格处理报告表(NCR)
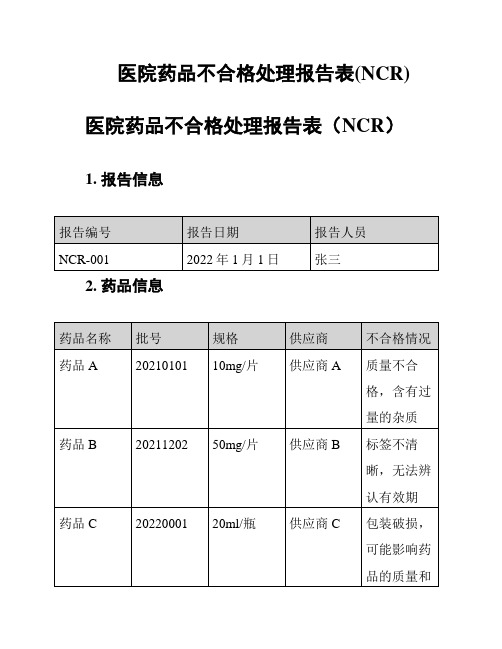
医院药品不合格处理报告表(NCR)医院药品不合格处理报告表(NCR)1. 报告信息
2. 药品信息
3. 处理情况
3.1 药品A
经过与供应商A沟通,供应商将负责回收并更换所有该批次药品,并提供质量合格的替代药品。
3.2 药品B
与供应商B协商后,供应商将提供新的药品,并确保标签清晰可辨,有效期等信息准确无误。
3.3 药品C
对于包装破损的药品C,将按照规定的处理程序进行封存,并联系供应商C,协商退换或补发药品。
3.4 药品D
供应商D将负责回收未通过检验的药品,并重新提供符合规定含量标准的药品。
3.5 药品E
对于过期的药品E,将按照规定的处理程序进行封存,并联系供应商E,协商退换或补发药品。
4. 处理结果
经过相关处理,所有不合格药品将被回收,并由供应商提供替代药品,确保医院药品的质量和安全。
5. 备注
如有其他不合格药品或处理情况,请在备注栏中详细说明,并及时通知相关部门进行跟进处理。
以下内容为其他不合格药品及处理情况的备注栏,请根据实际情况填写:
备注:
- 药品F:不合格原因及处理方案
- 药品G:不合格原因及处理方案
- ...。
不合格药品处理情况汇总分析表
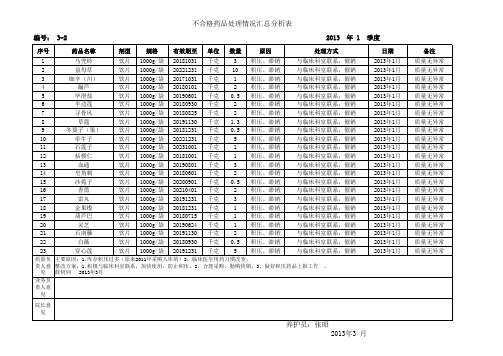
质量负 主要原因:1.库存积压过多(原来2011年采购入库的)2,临床医生用药习惯改变。 责人意 整改方案:1.积极与临床科室联系,加快使用,防止积压。2、合理采购,勤购快销。3、做好积压药品上报工作 。 见 薛钊剑 2013年3月 业务负 责人意 见 院长意 见
养护员:张昭 2013年3 月
与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销 与临床科室联系,催销
不合格药品处理情况汇总分析表
编号: 3-2
序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 药品名称 马兜铃 益母草 细辛(川) 漏芦 毕澄茄 半边莲 寻骨风 草蔻 冬葵子(果) 牵牛子 石莲子 栝楼仁 血通 皂角刺 沙菀子 香薷 雷丸 金果榄 葫芦巴 灵芝 石南藤 白薇 穿心莲 剂型 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 规格 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 1000g/袋 有效期至 20181031 20221231 20171031 20180101 20190601 20180930 20180825 20191130 20181231 20221231 20231001 20181001 20190801 20180601 20200901 20210401 20191231 20181231 20180715 20190624 20191130 20180930 20191231 单位 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 千克 数量 3 10 1 2 0.5 2 2 1.3 0.5 5 1 1 3 2 0.5 2 3 1 1 1 2 0.5 5 原因 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销 积压、滞销
不合格药品汇总分析报告
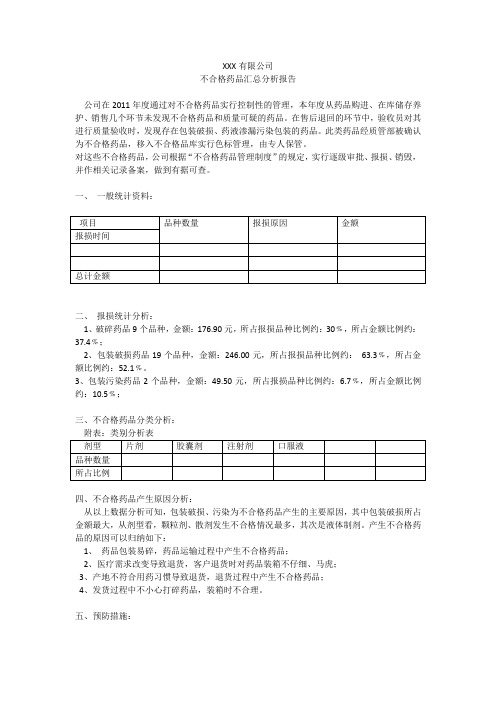
XXX有限公司不合格药品汇总分析报告公司在2011年度通过对不合格药品实行控制性的管理,本年度从药品购进、在库储存养护、销售几个环节未发现不合格药品和质量可疑的药品。
在售后退回的环节中,验收员对其进行质量验收时,发现存在包装破损、药液渗漏污染包装的药品。
此类药品经质管部被确认为不合格药品,移入不合格品库实行色标管理,由专人保管。
对这些不合格药品,公司根据“不合格药品管理制度”的规定,实行逐级审批、报损、销毁,并作相关记录备案,做到有据可查。
一、一般统计资料:二、报损统计分析:1、破碎药品9个品种,金额:176.90元,所占报损品种比例约:30﹪,所占金额比例约:37.4﹪;2、包装破损药品19个品种,金额:246.00元,所占报损品种比例约:63.3﹪,所占金额比例约:52.1﹪。
3、包装污染药品2个品种,金额:49.50元,所占报损品种比例约:6.7﹪,所占金额比例约:10.5﹪;三、不合格药品分类分析:四、不合格药品产生原因分析:从以上数据分析可知,包装破损、污染为不合格药品产生的主要原因,其中包装破损所占金额最大,从剂型看,颗粒剂、散剂发生不合格情况最多,其次是液体制剂。
产生不合格药品的原因可以归纳如下:1、药品包装易碎,药品运输过程中产生不合格药品;2、医疗需求改变导致退货,客户退货时对药品装箱不仔细、马虎;3、产地不符合用药习惯导致退货,退货过程中产生不合格药品;4、发货过程中不小心打碎药品,装箱时不合理。
五、预防措施:1、加强药品运输管理,严格按照包装图示装卸操作,运输途中控制车速,防止碰撞、挤压以免造成不必要的损失;2、加强药品流通信息管理,积极调整医疗机构供货目录,减少不必要的退货;3、实行采购计划责任制,采购计划失误给予处理;4、严格要求发货时必须轻拿轻放,按规定仔细装箱。
XXXx公司质管部年月日。
不合格药品管理档案

解除停售时间
药品名称
规格
剂型
生产厂家
供货单位
生产批号
有效期
解除停售原因:
通知部门:
通知人:年月日
质量管理员意见:
质量管理员签字:年月日
药店经理意见:
经理:年月日
药品拒收报告单
编号:建档时间:
通用名称
商品名称
验收员
剂型
单位
数量
规格
批号
有效期至
生产企业
供货企业
验收时间
质量问题
验收员:年月日
采购员意见
出厂检验
生产日期
供货企业
购进日期
购进数量
验收人员
验收日期
不合格数量
不合格药品
发生地点
不合格药品
发生时间
发现人姓名
不合格项目
验收员签字:年月日
质量管理部门意见
专职质量管理员签字:年月日
经理审核意见
经理签字:年月日
注:存档各查
不合格药品确认表
编号:填写日期:
通用名称
商品名称
规格
批准文号
生产批号
购进日期
年月日
不合格药品管理档案
单 位:
1、不合格药品报告表
2、不合格药品确认表
3、停售通知书
4、不合格药品台账
5、不合格药品报损审批表
6、报损药品销毁记录
7、解除药品停售通知书
8、药品拒收报告单
不合格药品报告表
编号:填写日期:
通用名称
商品名称
剂型
英文名或汉语拼音
批准文号
规格
生产企业
报告书
有效期至
质量标准
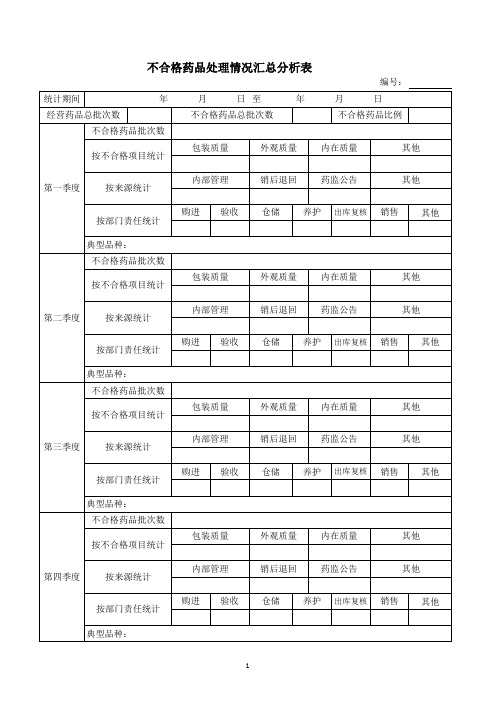
不合格药品处理情况汇总分析表
购进
验收
仓储
养护
出库复核
销售
其他
包装质量
外观质量
内在质量
其他
第二季度
按来源统计
内部管理
销后退回
药监公告
其他
按部门责任统计 典型品种: 不合格药品批次数 按不合格项目统计
购进
验收
仓储
养护
出库复核
销售
其他
包装质量
外观质量
内在质量
其他
第三季度
按来源统计
内部管理
销后退回
药监公告
其他
按部门责任统计 典型品种: 不合格药品批次数 按不合格项目统计
购进
验收
仓储
养护
出库复核
销售
其他
包装质量
外观质量
内在质量
其他
第四季度
按来源统计
内部管理
销后退回
药监公告
其他
按部门责任统计 典型品种:
购进
验收
仓储
养护
出库复核
销售
其他
1
汇总分析 结论
质量改进 建议
分析人:
日期:
质量管理 部意见
经办人:
日期:
2
不合格药品处理情况汇总分析表
编号: 统计期间 经营药品总批次数 不合格药品批次数 按不合格项目统计 包装质量 外观质量 内在质量 其他 年 月 日 至 年 月 日
不合格药品总批次数
不合格药品比例
第一季度
按来源统计
内部管理
销后退回
药监公告
其他
按部门责任统计 典型品种: 不合格药品批次数 按不合格项目统计
不合格药品报告表

河北天宏成药业
购进日期
2009.9.20
进货数量
100盒
验收人员
吕卫龙
验收日期
2009.9.20
不合格数量
2盒
不合格数量及发现地点
待验区
不合格情况发现日期
2009.9.20
不合格项目:
包装破损
报告人签字:年月日
质管部意见:
负责人签字:年月日
总经理审批意见:
签名:年月日
不合格药品报告表
编号:
通用名称
购进日期
进货数量
验收人员
验收日期
不合格数量
不合格数量及发现地点
不合格情况发现日期
不合格项目:
报告人签字:年月日
质管部意见:
负责人签字:年月日
总经理审批意见:
签名:年月日
不合格药品报告表
编号:
通用名称
商品名称
剂型
英文名或汉语拼音
规格
生产企业
有效期至
质量标准
批准文号
产品批号
出厂检验
报告书号
生产日期
供货企业
购进日期
进货数量
验收人员
验收日期
不合格数量
不合格数量及发现地点
不合格情况发现日期
不合格项目:
报告人签字:年月日
质管部意见:
负责人签字:年月日
总经理审批意见:
签名:年月日
购进日期
进货数量
验收人员
验收日期
不合格数量
不合格数量及发现地点
不合格情况发现日期
不合格项目:
报告人签字:年月日
质管部意见:
负责人签字:年月日
总经理审批意见:
不合格药品分析报告

不合格药品分析报告
质量领导组:
2010年8月13日对上半年产生的不合格药品进行了销毁,其中“肌苷注射液3352盒”、“香丹注射液906盒”为查封扣押产品,合计金额:3256.82元;维生素B6片等74批次为到效期产品,合计金额:22163.86元;维生素C注射液等8批次为包装破损,合计金额:1665.55元;
一、一般统计资料(不含查封扣押产品):
二、报损统计分析:
1、到有效期药品74个批次,金额:22163.86元,所占报损品种比例约90.24%,所占报损金额比例约93.01%;
2、包装破损8个批次,金额:1665.55元,所占报损品种比例约
9.76%,所占报损金额比例约6.99%。
三、不合格药品产生原因分析:
附表1:
因果分析表
四、不合格药品分类分析:
附表2:
类别分析表
五、预防措施:
1、加强采购计划管理,调整库存结构;
2、加强药品流通信息管理,调整医疗机构供货目录;
3、实行采购计划责任制,采购计划失误给予处罚;
4、加强药品运输管理,严格按照包装图示装卸操作;
5、近效期药品应制定促销策略,加强质量稳定的药品销售管理。
质量管理部
2010年8月13日。
药店各种表格

药店各种表格
附表005
ⅩⅩ药店药品停售通知单
年号
附表006
ⅩⅩ药店解除停售通知单
如下药品质量复查结果合格,撤消年号“药品停售通知单”,请恢复正常出
库发货及销售,特此告知。
质量管理员:年月日
附表007
ⅩⅩ药店不合格药品确认报告表
附表008
ⅩⅩ药店不合格药品报损审批表
审批时间:年月日
附表012
ⅩⅩ药店药品质量档案表建档时间:
建档人:
附表013
ⅩⅩ药店质量信息汇总表年
收集人:
附表014
ⅩⅩ药店质量信息收集分析表
附表016
ⅩⅩ药店培训现场记录表
附表019
ⅩⅩ药店员工个人健康档案编号:建档时间:
附表020
ⅩⅩ药店首营企业审批表填表日期:
附表021
ⅩⅩ药店首营品种审批表填表日期:
附表022
ⅩⅩ药店养护设备维护保养记录养护设备名称:型号规格:
附表023
XX药店药品质量查询表
附表025
ⅩⅩ药店重点品种养护档案表编号:建档日期:。
