引物设计教程
PCR引物设计详细步骤

PCR引物设计详细步骤引言PCR(聚合酶链式反应)是一种在分子生物学中常用的技术,用于放大DNA片段。
在PCR过程中,引物的选择非常重要,因为引物的设计质量直接影响到PCR反应的效率和准确性。
本文将详细介绍PCR引物设计的步骤。
步骤1. 确定目标序列首先,需要确定所要放大的目标序列。
这可以是任何你感兴趣的DNA片段,如某个基因的编码区域,特定的DNA序列等。
2. 提取目标序列从已有的DNA样本中提取目标序列。
可以通过DNA提取试剂盒等方法进行提取,确保获得纯净的DNA。
3. 序列比对使用BLAST等工具将目标序列与已知的序列数据库进行比对,以确认目标序列的唯一性和可能存在的变异。
4. 引物设计原则根据目标序列,设计符合以下原则的引物:•引物长度通常在18-25个碱基对之间。
•碱基组成均匀,避免引物中存在大量的G或C碱基,以及连续多个重复的碱基。
•引物之间的互补性尽量避免,以防止二聚体的形成。
•避免引物末端存在碱基的互补序列,以防止非特异性扩增。
5. 引物设计工具使用引物设计工具,如Primer3、NCBI Primer-BLAST等,在目标序列中选择合适的引物。
这些工具可以根据给定的参数,自动设计合适的引物。
6. 引物评估对设计的引物进行评估,包括检查引物的反向互补性、引物的Tm值(熔解温度)、引物的二聚体和自身结构等。
确保引物的质量达到实验要求。
7. 引物合成将设计好的引物发送给合成公司进行合成。
确保引物的纯度和浓度符合要求。
8. PCR反应使用合成的引物进行PCR反应,按照标准的PCR反应体系和条件进行。
根据实验需求调整PCR反应的温度、时间等参数。
9. PCR产物验证通过凝胶电泳等方法验证PCR反应产物的大小和纯度。
确保PCR反应成功,并且没有非特异扩增的产物。
结论PCR引物设计是PCR反应成功的关键。
通过遵循引物设计的原则,结合引物设计工具的辅助,可以设计出合适的引物,弥补PCR技术在DNA放大中的巨大优势,为实验研究提供有效的工具。
引物设计——手把手教新手

②Analyze中,第一项为Key info,点击Selected primers,会给出两条引物的概括性信息,其中包括引物的Tm值,此值Oligo是采用nearest neighbor method计算,会比Primer5中引物的Tm值略高,此窗口中还给出引物的Delta G和3’端的Delta G.3’端的Delta G过高,会在错配位点形成双链结构并引起DNA聚合反应,因此此项绝对值应该小一些,最好不要超过9。
⑤在Primer5窗口中,若觉得某一对引物合适,可以在搜索结果窗口中,点击该引物,然后在菜单栏,选择File-Print-Current pair,使用PDF虚拟打印机,即可转换为Pdf文档,里面有该引物的详细信息。
3、用Oligo验证评估引物
①在Oligo软件界面,File菜单下,选择Open,定位到目的cDNA序列(在primer中,该序列已经被保存为Seq文件),会跳出来两个窗口,分别为Internal Stability(Delta G)窗口和Tm窗口。在Tm窗口中,点击最左下角的按钮,会出来引物定位对话框,输入候选的上游引物序列位置(Primer5已经给出)即可,而引物长度可以通过点击Change-Current oligo length来改变。定位后,点击Tm窗口的Upper按钮,确定上游引物,同样方法定位下游引物位置,点击Lower按钮,确定下游引物。引物确定后,即可以充分利用Analyze菜单中各种强大的引物分析功能了。
引物设计的详细步骤

引物设计是PCR(聚合酶链式反应)技术中的关键步骤,以下是引物设计的详细步骤:选择合适的引物长度:通常选择18-30个核苷酸长度的引物。
引物太短可能降低特异性,
而太长则可能导致非特异性结合。
选择合适的引物GC含量:通常选择40%-60%的GC含量。
GC含量过高或过低都可能
影响PCR的效率。
避免引物二聚体和发夹结构:这些结构可能导致引物自身结合,从而影响PCR的效率。
可以使用软件工具检查引物的这种可能性。
避免引物间的互补:引物之间互补的序列可能导致引物结合,从而影响PCR的效率。
选择合适的引物位置:引物应位于目标基因的特异区域,通常选择基因的编码区。
此外,应避免选择有高突变率的区域,这可能影响引物的特异性。
使用软件进行引物设计:有许多在线和离线软件可以帮助设计PCR引物,如Primer3、Oligo 等。
这些软件可以根据输入的基因序列自动设计和选择最佳的引物。
实验验证:即使通过软件设计的引物看起来很好,也需要在实验中进行验证,以确保其特异性、有效性和可靠性。
引物浓度和退火温度的优化:引物的浓度和退火温度也是PCR的重要参数,需要针对特定的反应条件进行优化。
请注意,对于具体的实验和目的,可能需要更具体和详细的设计考虑,建议咨询相关领域的专家或具有丰富经验的实验员。
引物设计的详细步骤

引物设计的详细步骤详细步骤如下:步骤一:了解引物设计的基本原理引物设计是指为特定的DNA序列设计一对合适的引物,以便在PCR反应中扩增目标DNA序列。
引物是PCR反应的关键组成部分,引物的选择和设计对于PCR扩增的成功率和特异性非常重要。
因此,了解引物设计的基本原理对于有效设计合适的引物至关重要。
步骤二:确定PCR反应的目标序列在设计引物之前,我们需要确定PCR反应的目标序列,即我们需要扩增的DNA区域。
这个目标序列可以是已知的基因序列,也可以是未知的区域。
确定目标序列后,我们可以继续设计引物。
步骤三:确定引物的一些基本参数在设计引物之前,我们需要确定一些基本的参数,以便帮助我们选择合适的引物。
这些参数包括引物的长度、GC含量、Tm值以及避免二聚体形成等。
引物长度:通常来说,引物的长度应在18-25个核苷酸之间。
过长的引物可能导致不特异的扩增产物的形成,而过短的引物则可能导致低扩增效率。
GC含量:引物的GC含量对于引物的稳定性和特异性有影响。
在正常情况下,引物的GC含量应在40%-60%之间。
Tm值:引物的Tm值是指引物在PCR反应中的解离温度。
Tm值过低可能导致非特异的扩增产物的形成,而Tm值过高则可能导致低扩增效率。
避免二聚体形成:在设计引物时,我们还需要考虑引物之间的互补性以及避免引物形成二聚体。
引物之间的互补性可能导致引物形成二聚体,从而降低PCR反应的效率和特异性。
步骤四:选择合适的引物设计工具目前有很多在线引物设计工具可供选择,例如NCBI Primer-BLAST、OligoAnalyzer等。
这些工具可以根据输入的目标序列帮助我们快速选择合适的引物。
此外,还可以使用一些商业引物设计软件,如Primer Premier等。
步骤五:进行引物特异性分析设计好引物后,我们需要进行引物特异性分析,确保引物只扩增目标序列而不扩增其他非特异性产物。
这可以通过BLAST或其他相似性工具来完成。
特异性分析的目的是排除可能存在的非特异性扩增产物,以确保PCR反应的准确性和特异性。
Primer5设计引物------图文并茂一步步教你
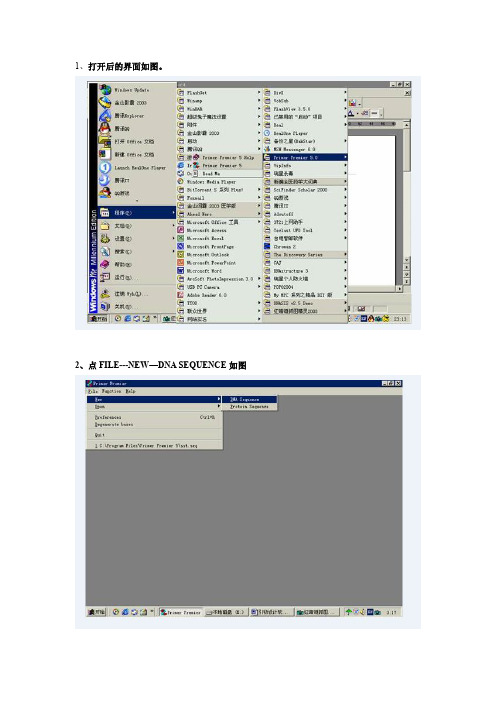
1、打开后的界面如图。
2、点FILE---NEW—DNA SEQUENCE如图3、输入目的基因片段,可以复制后用ctrl+V键拷贝到栏内,后应加数个N以备后续设计时加酶切位点及保护碱基,如图所示。
输入目的基因片段,可以复制后用ctrl+V键拷贝到栏内,后应加数个N以备后续设计时加酶切位点及保护碱基,如图所示。
4、此主题相关图片如下:选中enzyme图标,将所选质粒上的多克隆酶切位点加入左栏此主题相关图片如下:选中OK键,5、分析目的基因中所含的酶切位点,选插入位点时就应排除这些酶此主题相关图片如下:6、选中primer图标,点S图标,edit primer,开始设计正义链。
此主题相关图片如下:7、软件默认引物为二五个碱基此主题相关图片如下8、可将鼠标点在设计框的3端从右向左删除7-9个碱基,保留16-18个配对即可此主题相关图片如下:9、在引物的5端加入选好的酶切位点并在其左侧加3个保护碱基,入该图加入HIND III 酶切位点及TTA保护碱基,完成后点analyze,认为可以后点OK。
此主题相关图片如下:10、选中左上角A图标,用鼠标拉动滑块将待选引物放至目的基因末端。
11、从3端删除7-9个碱基同正义链。
此主题相关图片如下:12、将酶切位点加在5端,应将产品目录所示的酶切位点序列从右至左加入(注意不要加反)如图加入BamH I酶切位点及CGC3个保护碱基。
完成后点analyze,认为可以后点OK。
此主题相关图片如下:13、最后分析结果如图,反义链的FALSE PRIMING可以不考虑,RATING表示引物评分也可以不考虑,主要看Tm值正义链和反义链相差不应超过3度。
GC含量不应超过60%此主题相关图片如下:14、该软件有个缺点,不能保存分析结果,只能选择打印此主题相关图片如下:15、如果设计RT-PCR检测的引物就如下所示,同上输入目的基因片段,选SEARCH图标,选择参数,一般选PCR primers---both—100至250个碱基,引物长短20+/-2,search parametere 中的参数可以不选,为默认设置。
《引物设计教程》课件

适当提高退火温度有助于减少引物二 聚体的形成,因为较高的温度下二聚 体形成的概率降低。
引物特异性不高的解决策略
引物特异性验证
在引物设计完成后,应通过实验验证其特异性,确保引物只对目标序列有反应。
避免引物间的交叉反应
在设计引物时,应确保引物之间不存在交叉反应,避免与非目标序列的结合。
引物3’端的选择
Primer Premier
一款功能强大的引物设计软件,支持 多种PCR方法,可进行多参数搜索和 灵活的筛选功能。
Oligo
提供多种类型的寡核苷酸合成和设计 功能,包括引物、探针、适配体等。
GeneFisher
适用于已知序列的基因片段设计通用 引物。
BatchPrimer3
在线引物设计软件,支持多参数搜索 和灵活筛选功能。
02
引物设计的步骤
确定目标基因序列
目标基因序列的来源
可以是基因组、转录组、cDNA等。
目标基因序列的选择标准
选择基因序列时应考虑其功能、表达水平、变异程度等因素。
目标基因序列的获取方法
可以通过基因数据库、文献报道、实验测序等方法获得。
选择合适的引物序列
引物序列的设计原则
引物序列应具有特异性,避免与基因组其他序列发生非特 异性结合;长度一般在18-30bp之间;GC含量应适中, 一般在40%-60%之间。
引物长度一般在15~30碱基之间,过短可 能降低引物特异性,过长则可能导致引物 结合温度升高,不利于引物的特异性。
碱基分布均匀原则
避免二级结构原则
引物序列中的G+C含量在40%~60%之间 ,避免出现连续的4个以上的G或C。
引物自身及引物之间不能形成互补性二聚 体或发夹结构等二级结构。
(完整word版)PCR引物流程设计详解
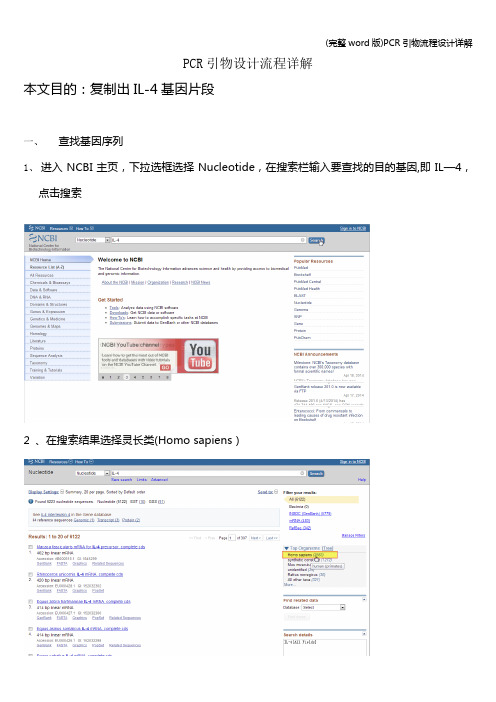
PCR引物设计流程详解本文目的:复制出IL-4基因片段一、查找基因序列1、进入NCBI主页,下拉选框选择Nucleotide,在搜索栏输入要查找的目的基因,即IL—4,点击搜索2 、在搜索结果选择灵长类(Homo sapiens)2、在灵长类IL-4基因中选择需要的mRNA序列3、查看基因的相关信息外显子区域CDs区域4、点击FASTA格式,并将序列保存到文档二、使用primer premier 5。
0设计引物1、建立新文件,将所得的序列复制进输入框内2、点击搜索按钮,搜索引物3、设置引物设计参数(因为在之前查找基因序列的时候获知,外显子区域分别为:1—200、201-248、249-425、426-618,又知在引物设计时引物位置最好跨越一个内含子,PCR产物长度通常为100—150bp,故设定上游引物位置为201—248,下游引物位置为249—425,产物长度为100-150bp)4、确认条件后,显示搜索结果4、双击选中得分最高的引物查看引物情况(上图为上游引物情况,下图为下游引物情况)5、将设计的上下游引物复制出来,保存到文档中三、使用oligo 6.0对设计的引物进行评价1、建立新文件,将从cnki上获得的cDNA复制进输入框,并点击accept接收2、接收后显示出该序列的相关信息3、点击edit按钮录入用primer设计的上游引物,每一次输入新数据后都需要点击accept按钮接收4、同理,录入下游引物5、分析上下游引物二聚体形成情况6、分析上下游引物发卡形成情况7、分析上下游引物GC%8、检测上下游引物与PCR模板其它位置错配情况9、分析PCR整体情况四、引物特异性检验(primer blast)1、进入NCBI主页,并选择blast2、选择primer blast3、在输入框内输入模板序列和上下游引物,并设定对比数据库,点击get primer进行对比4、查看blast结果Blast 结果显示,尽管IL—4与其它基因有相似区,但是引物的3’端没有完全互补。
普通pcr引物设计方法

普通pcr引物设计方法摘要:一、引言二、PCR引物概述1.PCR引物的定义2.PCR引物的作用3.PCR引物的分类三、普通PCR引物设计方法1.设计原则1) 引物长度2) 引物Tm值3) 引物间的互补性4) 引物与模板的互补性2.设计步骤1) 确定目标序列2) 查找引物设计软件3) 输入参数并进行引物设计4) 评估引物性能5) 优化引物四、常用引物设计软件介绍1.Primer 32.NP_Primer3.Oligo4.PyroMark Assay Design五、引物筛选与优化1.引物筛选1) 引物扩增效率2) 引物特异性2.引物优化1) 引物长度和Tm值优化2) 引物碱基序列优化六、总结与展望正文:一、引言PCR技术自1983年被发明以来,已成为分子生物学研究中不可或缺的工具。
PCR引物是PCR反应的核心组成部分,其设计直接影响到PCR扩增效果。
本文将介绍普通PCR引物设计方法,以指导科研人员和技术人员高效地进行PCR实验。
二、PCR引物概述1.PCR引物的定义PCR引物是一对短的DNA片段,分别与目标序列的两端互补,引导DNA 聚合酶在目标序列上进行扩增。
2.PCR引物的作用PCR引物的作用主要有两点:一是引导DNA聚合酶在特定位置开始扩增;二是使扩增产物具有特定的序列。
3.PCR引物的分类根据引物长度和碱基序列,PCR引物可分为常规引物和巢式引物。
三、普通PCR引物设计方法1.设计原则(1)引物长度:通常为18-25个碱基对,过长的引物可能导致扩增效率降低。
(2)引物Tm值:理想的Tm值约为50-65℃,过高或过低的Tm值都会影响引物扩增效果。
(3)引物间的互补性:引物之间应避免互补,以免发生非特异性扩增。
(4)引物与模板的互补性:引物应与目标序列具有较强的互补性,以确保扩增效率。
2.设计步骤(1)确定目标序列:根据研究需求,选取需要扩增的目标序列。
(2)查找引物设计软件:市面上有很多引物设计软件,如Primer 3、NP_Primer、Oligo等。
引物设计原理及详细步骤

引物设计原理及详细步骤引物设计是⼀⼩段单链DNA或RNA,在核酸合成反应时,作为每个多核苷酸链进⾏延伸的出发点⽽起作⽤的多核苷酸链。
引物设计原理及详细步骤:1、引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的⽐较确定的。
在NCBI上搜索不同物种的同⼀基因,通过序列分析软件(⽐如DNAman)⽐对(Alignment),各基因相同的序列就是该基因的保守区。
2、引物长度⼀般在15-30碱基之间。
引物长度(primer length)常⽤的是18-27bp,但不应⼤于38bp,因为过长会导致其延伸温度⼤于74℃,不适于Taq DNA 聚合酶进⾏反应。
3、引物GC含量在40%~60%之间,Tm值最好接近72℃。
GC含量(composition)过⾼或过低都不利于引发反应。
上下游引物的GC含量不能相差太⼤。
另外,上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在⼀定盐浓度条件下,50%寡核苷酸双链解链的温度。
有效启动温度,⼀般⾼于Tm值5-10℃。
若按公式Tm=4(G+C+2(A+T)估计引物的Tm值,则有效引物的Tm为55-80℃,其Tm值最好接近72℃以使复性条件最佳。
4、引物3'端要避开密码⼦的第3位。
如扩增编码区域,引物3'端不要终⽌于密码⼦的第3位,因密码⼦的第3位易发⽣简并,会影响扩增的特异性与效率。
5、引物3'端不能选择A,最好选择T。
引物3'端错配时,不同碱基引发效率存在着很⼤的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,⽽当末位链为T时,错配的引发效率⼤⼤降低,G、C错配的引发效率介于A、T之间,所以3'端最好选择T。
6、碱基要随机分布。
引物序列在模板内应当没有相似性较⾼,尤其是3’端相似性较⾼的序列,否则容易导致错误引发(False priming)。
降低引物与模板相似性的⼀种⽅法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。
引物设计步骤与要点

引物设计步骤与要点引物(primer)是在 DNA 或 RNA 聚合酶链式反应(PCR)或逆转录聚合酶链式反应(RT-PCR)中使用的短的 DNA 或 RNA 片段。
引物通过与目标序列的互补配对,为 PCR 或 RT-PCR 提供起始点,使得复制过程能够在目标序列上进行。
引物的设计是 PCR 或 RT-PCR 的关键步骤,影响其特异性和效率。
下面将介绍引物设计的步骤与要点。
引物设计的步骤如下:1.确定目标序列:首先要明确所需扩增的目标DNA或RNA序列。
例如,目标序列可以是特定基因的编码区域,或者是需要检测的病原体的DNA片段。
2. 引物长度:引物的长度通常在 18-30 bp 之间。
长度较长的引物可能会导致非特异性扩增,而较短的引物可能会导致不够稳定,产生非特异性扩增产物。
在设计引物时,应注意避免引物间或引物与模板间的互相互补性。
3.GC含量:引物的GC含量应在40-60%之间。
GC含量过高可能导致引物之间的二聚体形成,而GC含量过低可能导致引物的稳定性不足。
4.特异性:引物应与目标序列的特定部分互补配对,以确保特异性扩增。
在设计引物时,通常选择序列中的保守区域作为互补匹配的区域,以确保其在各物种或基因型中的适用性。
此外,可以通过使用在线工具,如NCBIBLAST,对引物进行特异性检测,以避免与非目标序列互补匹配。
5. 引物之间的互补配对:在 PCR 扩增中,引物通常成对使用,所以引物之间不应存在互补配对,以避免二聚体形成。
另外,引物对之间的距离应合适,通常在 100-300 bp 之间。
6.引物的末端设计:引物的末端设计直接影响PCR的效率和特异性。
在设计引物时,应注意避免末端的一些特定的串扰序列,如GGGG、CCCC、AAAA、TTTT等。
此外,引物的末端可以添加一些特定的序列,如引物标记和引物序列的识别序列,以便进一步的实验操作。
引物设计的要点如下:1.使用专业软件或在线工具进行辅助设计:可以使用一些专业的引物设计软件或在线工具来辅助引物的设计。
polymarker设计引物方法方法

一、概述Polymerase ch本人n reaction(PCR)是分子生物学和遗传学研究中最常用的技术之一,它能够在体外扩增DNA片段,为研究人员提供了非常强大的工具。
引物设计是PCR实验中至关重要的一步,而PolyMarker作为一种基于人工智能的引物设计方法,为研究人员提供了更加高效和准确的引物设计方案。
本文将介绍Polymarker设计引物方法的具体步骤和原理。
二、Polymarker设计引物方法1. 数据准备对于PolyMarker的引物设计方法来说,首先需要准备基因组序列和多态位点的信息。
这些信息可以从公共数据库或者实验室内部的数据库中获取。
基因组序列要求是该物种的完整基因组序列,多态位点信息包括单核苷酸多态性(SNP)、简单重复序列(SSR)等。
2. 多态位点筛选接下来,根据准备好的多态位点信息,进行筛选。
选择与所要研究的遗传特性相关的多态位点,并排除位点周围存在可能干扰引物合成的序列。
3. 引物设计在确定了目标多态位点后,PolyMarker将基于多态位点的周围序列进行引物设计。
根据PCR的实验条件(如温度、引物长度等),利用算法进行引物设计,确保引物与目标序列的特异性和选择性。
4. 引物评价设计完引物后,还需要进行引物的评价。
这包括引物之间的特异性、引物与非特异性DNA的结合情况、引物的二聚性等。
PolyMarker提供了多项评价标准,确保引物的质量和稳定性。
5. 结果输出PolyMarker将设计好的引物结果输出。
包括引物的序列、特性和评价结果。
研究人员可以根据该结果,进行进一步的PCR试验。
三、Polymarker设计引物方法的优势1. 高效性传统的引物设计方法往往需要研究人员根据经验进行设计,耗时耗力。
而PolyMarker基于人工智能算法,能够高效地完成引物设计,节省研究人员的时间。
2. 准确性PolyMarker采用先进的算法和多项评价标准,确保设计的引物具有高度特异性和选择性,降低了PCR实验中的假阳性和假阴性。
定量pcr引物设计的详细步骤

定量pcr引物设计的详细步骤宝子,来给你唠唠定量PCR引物设计的步骤哈。
一、确定目的基因序列。
你得先知道你要研究的目的基因是啥呀。
这就好比你要找一个小伙伴,你得先知道他长啥样。
你可以去一些基因数据库,像NCBI这种超厉害的地方,找到你要的那个基因的序列。
这个序列就像是这个小伙伴的身份证号码,是独一无二的哦。
二、引物设计软件选择。
有好多好用的引物设计软件呢。
比如说Primer Premier,这个就像一个贴心的小助手。
你把目的基因序列输进去,它就能开始帮你设计引物啦。
还有Beacon Designer也很不错哦。
这些软件就像是魔法棒,能在基因的海洋里给你捞出合适的引物来。
三、引物设计参数设置。
这一步很关键哦。
一般来说呢,引物的长度大概在18 - 25个碱基左右就好啦。
太短了就像小短腿,不太稳;太长了又像大长脚,容易出问题。
还有引物的GC含量,最好在40% - 60%之间。
这就像是一个黄金比例,能让引物和模板结合得更牢。
另外,引物自身不能有太多互补的地方,不然它自己就抱成一团,不跟模板好好玩啦。
四、特异性检查。
设计好引物之后,可不能就这么不管了。
得检查一下它的特异性呢。
这就像是给引物做个忠诚度测试。
你可以用BLAST这个工具,把你设计的引物序列放进去,看看它是不是只和你的目的基因结合,要是和其他乱七八糟的基因也有结合,那可不行,就像找错小伙伴啦。
五、引物合成。
如果前面的步骤都没问题啦,那就要把引物合成出来。
这时候就可以找专门的公司啦,就像把设计图交给工匠,让他们做出真正的成品。
合成好的引物拿回来,就可以开始你的定量PCR之旅啦。
宝子,按照这些步骤来,设计定量PCR引物就不是啥难事啦。
加油哦! 。
引物的设计及修饰最全教程

引物的设计及修饰最全教程引物的设计及修饰1. 引物设计的基本原则是什么?引物设计的下列原则供您参考:1) 引物最好在模板cDNA的保守区内设计。
2) 引物长度⼀般在15-30碱基之间。
3) 引物GC含量在40%-60%之间,Tm值最好接近72℃。
4) 引物3′端要避开密码⼦的第3位。
5) 引物3′端不能选择A,最好选择T。
6) 碱基要随机分布。
7) 引物⾃⾝及引物之间不应存在互补序列。
8) 引物5′端和中间△G值应该相对较⾼,⽽3′端△G值较低。
9) 引物的5′端可以修饰,⽽3′端不可修饰。
10) 扩增产物的单链不能形成⼆级结构。
11) 引物应具有特异性。
2. 常⽤引物设计软件有哪些?常⽤的软件有Oligo 6和Primer Premier 5.0。
引物设计软件是根据引物设计的指导意见设计⽽成。
其实,PCR扩增的成败最关键的是反应模板的制备和反应条件的控制。
引物设计软件的缺点是,有时判断为该基因没有⼀段区域满⾜标准引物的要求。
⾦斯瑞为您提供以下引物设计相关软件:引物计算⼯具引物设计⼯具测序引物设计软件Real-time PCR 引物设计软件3. ⽂献上找到的引物和探针序列能否直接使⽤?通常国外的⽂献可信度⽐较⾼,可直接使⽤;但为了保险起见,最好⽤blast对引物探针的序列进⾏必要的验证;或者再进⼀步⽤引物设计软件对引物探针的⼆级结构和退⽕温度进⾏分析,这样更有利于您对整个实验的把握。
4. 如何计算引物的Tm值?Tm值的概念:DNA熔解温度,指把DNA的双螺旋结构降解⼀半时的温度,亦即DNA 变性过程中,紫外吸收值达到最⼤值的50%时的温度称为 DNA 的解链温度(Tm)。
⾦斯瑞采⽤以下⽅法计算Tm值:长度为20mer及以下的引物,Tm计算公式为:Tm = 4℃(G + C)+ 2℃(A + T)。
但这个公式只适⽤于14~20个碱基的引物,引物的TM值还与引物长度、碱基组成、引物使⽤缓冲溶液的离⼦强度等有关。
《引物设计教程》课件

引物长度:通 常为15-30bp, 过长可能导致 非特异性扩增
引物GC含量: 尽量控制在 40-60%,避
免形成二级结 构
引 物 Tm 值 : 应接近目标序 列 的 Tm 值 , 以提高扩增效
率
引物3'端:避 免形成发卡结 构,以免影响
扩增效果
引物特异性: 确保引物与目 标序列具有高 度特异性,避 免非特异性扩
增效率和稳定性
引物3'端:避免3'端 出现连续3个或以上 的碱基,以降低错配
率
引物二级结构:使用 软件预测引物二级结 构,避免形成发卡结 构,提高扩增效率
引物特异性:通过 BLAST比对,确保引 物特异性,避免非特
异性扩增
引物浓度:优化引物 浓度,以提高扩增效
率和稳定性
引物纯度:确保引物 纯度,避免污染和降 解,提高扩增效率和
引物GC含量:尽量保持 50%左右,避免过高或 过低
引 物 Tm 值 : 确 保 引 物 Tm 值在55-65℃之间,以提 高扩增效率
引物特异性:确保引物与 目标序列具有高度特异性, 避免非特异性扩增
引物错配:避免引物内部 错配,以提高扩增效率和 准确性
引物设计软件:可使用 Primer3、OligoT等软 件辅助设计引物
引物设计不当导 致扩增失败
引物设计不当导 致非特异性扩增
引物设计不当导 致扩增效率低
引物设计不当导 致扩增产物长度 不均一
引物设计软件:选择 合适的引物设计软件, 如Primer3、Primer-
BLAST等
引物长度:确保引物 长度在18-25bp之间, 以提高特异性和扩增
效率
引物GC含量:保持 引物GC含量在4060%之间,以提高扩
引物设计的详细步骤

一、引物设计st ep by step1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的or igin中,Copy该编码序列作为软件查询序列的候选对象。
2、用Prime r Premie r5搜索引物①打开Prim er Premie r5,点击File-New-DNA sequen ce,出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。
点击Prim er,进入引物窗口。
②此窗口可以链接到“引物搜索”、“引物编辑”以及“搜索结果”选项,点击Sear ch按钮,进入引物搜索框,选择“PCRprimer s”,“Pairs”,设定搜索区域和引物长度和产物长度。
在Searc h Parame ters里面,可以设定相应参数。
一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200bp的产物电泳跑得较散,所以可以选择300~500bp.③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。
④对于引物的序列,可以简单查看一下,避免出现下列情况:3’不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配。
此窗口中需要着重查看的包括:Tm应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的T m值最好不要相差太多,大概在2度以下较好。
该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置。
引物设计的详细步骤

引物设计的详细步骤引物设计是一项关键的实验技术,用于在分子生物学实验中扩增目标DNA片段。
该技术的成功与否直接影响到实验结果的准确性和可靠性。
以下是引物设计的详细步骤:1.确定目标DNA序列:首先,确定需要扩增的目标DNA序列。
这可以通过已知的参考序列、文献调研或基因数据库进行。
2.定位扩增区域:根据目标DNA序列,确定需要扩增的特定区域。
通常选择在该区域中的保守性较高的片段,以确保引物的特异性。
3. 确定引物长度:引物长度通常为18-25个核苷酸(nt),最好不超过30nt。
引物长度的选择是为了确保引物在反应温度下的特异性和稳定性,同时不会引起非特异扩增。
4.碱基组成与G/C含量:引物的碱基组成应平衡,避免过多的同质二聚物和结构异常。
G/C含量一般在40-60%之间,过高或过低的G/C含量可能会导致引物与模板DNA结合的效力降低。
5.特异性:使用基因序列数据库或引物设计软件进行引物BLAST比对,确保引物与目标DNA序列的独特性。
6. 避免互补引物间的二聚体形成:引物间不能有太多相互衔接的序列,以免引物自身形成二聚体。
通常应避免引物间的结合自由能低于-9 kcal/mol。
7.避免引物内部二聚体的形成:通过引物设计软件计算引物的内部二聚体结合自由能,避免过多的二聚体形成。
8.引物末端设计:通常引物的末端应设计在较保守的区域,以确保扩增的特异性。
9.引物的副产物与杂交:避免引物自身产生副产物以及与其他非特异目标DNA序列杂交。
10.引物设计验证:使用引物设计软件对设计的引物进行验证,包括引物特异性、二聚体和杂交等。
11.引物合成:通过合成引物的商业公司进行引物合成,选择信誉好的厂家。
12.引物纯化:使用聚丙烯酰胺凝胶电泳等方法对引物进行纯化。
13.引物浓度测定:使用紫外分光光度计等方法测定引物的浓度。
总之,引物设计是一项细致而复杂的步骤,需要考虑多个因素,如目标DNA序列,引物长度,碱基组成,特异性和二聚体等。
基因克隆引物设计步骤

基因克隆引物设计步骤基因克隆是指将感兴趣的基因从一个生物体中转移到另一个生物体中的过程。
在基因克隆中,引物是必不可少的工具,它们作为DNA扩增的起始序列,帮助将目标基因扩增出来。
引物的设计是基因克隆的关键步骤之一,下面是基因克隆引物设计的详细步骤。
1.确定目标基因序列:首先要确定你想要克隆的基因序列。
可以根据已有的序列资料获得,也可以通过测序等技术获得此序列。
2.选择扩增方法:根据实验需求选择适合的扩增方法。
常见的扩增方法有PCR、RT-PCR、RACE等。
3.获取引物序列:根据目标基因序列,设计引物序列。
引物通常由两个部分组成:前向引物和反向引物。
前向引物与目标序列的上游区域互补,反向引物与目标序列的下游区域互补。
引物长度通常为18-22个碱基对。
4.引物设计原则:-引物长度:引物长度应在18-22个碱基对之间,过短则会导致特异性降低,过长则会导致引物的结构稳定性下降。
-GC含量:引物的GC含量应在40%-60%之间,过高或过低的GC含量会导致引物的熔解温度变化,降低引物与目标序列的互补性。
-特异性:引物应具有高度的特异性,避免与其他基因或非目标序列发生互补。
5.避免引物二聚体和髙聚物的形成:-引物二聚体:引物二聚体是指两个引物之间通过碱基配对形成的复合物。
二聚体的形成会导致PCR扩增效率降低甚至完全失败。
要避免引物二聚体的形成,可以使用引物设计软件进行计算和优化。
-引物髙聚物:引物髙聚物是指引物之间互相结合形成的长链。
髙聚物的形成会抑制PCR扩增的产物的生成,同样可使用引物设计软件进行计算和优化。
6.核酸序列分析软件的使用:核酸序列分析软件可以帮助你检查设计引物的性能,如特异性、互补性等。
常用的软件有Primer3、Oligo Analyzer等。
7.引物合成:找到合适的引物序列后,可以将其提交给寡核苷酸合成机构进行合成。
合成的引物会被送到实验室进行后续的基因克隆实验。
总结起来,基因克隆引物设计的关键是确定目标基因序列、选择合适的扩增方法、根据引物设计原则设计引物、避免引物二聚体和髙聚物的形成,并使用核酸序列分析软件进行验证。
pcr引物设计操作流程

pcr引物设计操作流程
PCR引物设计是PCR技术中非常重要的一步,引物的设计质量直接影响到PCR反应的效果和结果。
下面是PCR引物设计的操作流程:
1. 确定目标序列:首先需要确定要扩增的目标序列,这个序列可以是基因、DNA片段或RNA序列等。
2. 选择引物设计工具:选择合适的引物设计工具,比如NCBI Primer-BLAST、Primer3等在线工具或者专业的引物设计软件。
3. 设定引物设计参数:根据实验需求设定引物设计的参数,比如引物长度、GC含量、Tm值等。
4. 引物设计:根据目标序列和设定的参数,使用引物设计工具进行引物设计。
通常需要设计一对引物,一个用于扩增目标序列的前端,一个用于扩增目标序列的后端。
5. 引物评估:对设计出的引物进行评估,包括检查引物的特异性、二聚性、自身互补性等。
6. 引物合成:将设计好的引物提交给引物合成公司进行合成。
通常引物的长度在18-25个碱基对之间。
7. PCR反应:将合成好的引物与DNA模板、PCR反应缓冲液、
DNA聚合酶等混合,进行PCR反应。
根据引物的设计,可以选择不同的PCR条件进行扩增。
8. PCR产物分析:对PCR反应产物进行分析,比如琼脂糖凝胶电泳、测序等,确认扩增的目标序列是否正确。
总的来说,PCR引物设计是PCR技术中至关重要的一步,需要仔细设计和评估引物,确保PCR反应的准确性和可靠性。
通过以上的操作流程,可以有效地设计出高质量的引物,为PCR实验的成功提供保障。
引物设计的详细步骤

引物设计的详细步骤引物设计步骤如下:1.目标序列选择:根据研究目的选择需要扩增或检测的目标DNA序列。
这个目标序列可能是基因的特定区域、启动子区域、外显子、cDNA序列等。
选择一个合适的目标序列对于引物设计至关重要,因为它将决定引物的特异性和扩增产物的大小。
一般而言,目标序列具有良好的保守性和特异性。
2.引物长度和Tm计算:引物通常是15-30个核苷酸长度。
引物长度的选择取决于目标序列的特点以及所使用的实验条件。
合适的引物长度应该综合考虑引物的特异性和扩增效率。
引物的熔解温度(Tm)是指DNA链的两个链断裂开所需要的温度,它是引物设计中一个重要的参数。
Tm可以通过计算引物的碱基组成、盐度和引物浓度等因素来估计,通常约为55-65℃。
3. 引物特异性检查:使用生物信息学工具,如BLAST(Basic Local Alignment Search Tool)或NCBI(National Center forBiotechnology Information)数据库来检查所设计引物的特异性。
确保引物不会扩增与目标序列不匹配的区域,避免非特异性扩增和假阳性结果。
4.引物序列设计:根据目标序列和引物长度选择合适的引物序列。
引物设计的要求包括:GC含量约为40-60%、避免重复序列和目标序列内部的局部重复、避免碱基偏差和突变等。
此外,引物的碱基组成应该是均匀的,避免多个连续G或C碱基的存在。
6.引物的合成:将设计好的引物交给合成公司进行合成,通常采用化学合成方法。
引物的质量控制非常重要,合成的引物应进行质控检测,如毛细管电泳或质谱分析。
推荐文献:2. Untergasser A, et al. (2024) Primer3--new capabilities and interfaces. Nucleic Acids Res. 40(15): e115.。
引物设计是分子生物学研究中必不可少的技术之一、通过遵循上述步骤和参考推荐文献,可以设计出特异性高、效率好的引物,为后续实验的顺利进行提供支持。
引物设计图文教程。

引物设计图⽂教程。
⼀顿操作猛如虎,⼀看战绩0-5。
尽管引物设计是PCR实验成功的前提,但是蛮多⼩伙伴的实战经验稍显不⾜。
今⼉就向⼤家介绍2种引物设计⽅法。
This is the dividing line.引物设计尽管是⽼⽣常谈了,但是⼩编还是想先把引物设计的原则放出来(其实是复制粘贴啦,哪哪都有)。
1、引物应⽤核酸系列保守区设计并具有特异性。
最好位于编码区5\'端的300-400bp区域内,可以⽤DNAMAN,Alignment软件看看结果。
2、不能形成2级结构。
3、引物长度⼀般在17-25bp之间,上下游引物不能相差太⼤。
4、G+C含量在40-60%之间,45-55%最佳。
5、碱基要随机分布,尽量均匀。
6、引物⾃⾝不能有连续4个碱基的互补。
7、引物之间不能有连续4个碱基的互补。
8、引物5‘端可以修饰。
9、3’端不可修饰,⽽且要避开AT,GC富集的区域,避开T/C,A/G连续结构(2-3个)。
10、引物3\'端要避开密码⼦的第三位。
11、引物整体设计⾃由能分布5\'端⼤于3‘端。
12、定量产物长度80-150bp最好,最长是300bp。
原则忒多啦,⼩伙伴们,先别晕,看下⽅。
⽅法⼀:PrimerBank法⽹址:打开以上⽹址,进⼊PrimerBank⽹站界⾯,如下图个⼈觉得这是最便捷的引物获取⽅法,该⽹站可以⾮常迅速地检索到已经他⼈验证的引物序列及相关反应条件。
图中第⼀个⽅框,⼀般选择NCBI Gene ID;第⼆个⽅框选择你所关注的物种,常⽤的就是Mouse和Human了,如果为其它物种,则选择All Species即可;第三个⽅框中需要输⼊你关注的基因ID号码。
如何获取基因ID呢,这⾥就需要打开NCBI⽹站,选择Gene,并输⼊你的⽬的基因如p53 homo,选择第⼀个,可见其ID号为7157。
如下图所⽰。
然后将ID号7157输⼊上⽅PrimerBank⽹站的For text框中,并选择种属为⼈,点击Submit后,跳转页⾯如下。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
引物设计界面 First you can design the primer
manually
Sense strand or anti-sense strand
Useful information of the primer
引物搜索选项设定
引物类型 搜索模式 引物长度
5’引物位置 范围
3’引物位置 范围
PCR引物设计及相关软件使用
主要内容
PCR介绍 引物设计原理 引物设计的优化原则 Primer Premier 5.0 介绍 举例说明引物的设计
PCR介绍
1、什么是PCR
2、PCR的组成
3、如何提高PCR成功率 (定量,对照)
引物设计原理
引物设计的目的是为了找到一对合适 的核苷酸片段,使其能有效地扩增模 板DNA序列。引物设计总体上包含三 个程序:序列下载,同源性比较,引 物设计筛选 。
产物大小范 围
搜索结果
28对引物 引物分值 100分为满分 每对引物的信 息
双击选中一对 引物
回到主窗口
引物信息
引物及产物信息
是否出现 hairpin,dimer,false priming and cross dimer
一对理想的引物应当不存在任何一种上述结 构,因此最好的情况是最下面的分析栏没有 But …
选中引物
上游引物
下游引物 只是示意图
引物分析
首先检查引物二聚体尤其是3’端二聚 体形成的可能性。
引物分析
二项检查是发夹结构(hairpin);与 二聚体相同,发夹结构的能值越低越 好。
引物分析
第三项检查为GC 含量,以45-55%为 宜。 第四False priming 检查
引物分析 Key information of primer
Primer Premier 5.0 的使 用技巧简介
主要功能: 1、即引物设计 2、限制性内切酶位点分析 3、DNA 基元(motif)查找 4、同源性分析
简并引物设计
根据氨基酸序列来设计引物DNA引物 Premier Primer 5提供了8种生物遗传密 码使用的偏好选择
1、纤毛虫大核(Ciliate Macronuclear) 2、无脊椎动物线粒体(Invertebrate Mitochondrion) 3、支原体(Mycoplasma) 4、植物线粒体(Plant Mitochondrion) 5、原生动物线粒体(Protozoan Mitochondrion) 6、一般标准(Standard) 7、脊椎动物线粒体(Vertebrate Mitochondrion) 8、酵母线粒体(Yeast Mitochondrion)
一般原则
3,引物3’端的末位碱基对Taq 酶的DNA 合成效率有较大的影响。不同的末位 碱基在错配位置导致不同的扩增效率 ,末位碱基为A 的错配效率明显高于 其他3 个碱基,因此应当避免在引物 的3’端使用碱基A。另外,引物二聚 体或发夹结构也可能导致PCR 反应失 败。5’端序列对PCR 影响不太大, 因此常用来引进修饰位点或标记物。
引物设计的原则
11、引物的5′端 引物的5′端可以修饰,而3′端不可修饰 ,引物5′ 端修饰包括:加酶切位点、 标记生物素、荧光、地高辛等;引入 蛋白质结合DNA序列;引入点突变、 插入突变、缺失突变序列;引入启动 子序列等。
引物设计的原则
12、在DNA测序和PCR中最好用5′末端 稳定(如GC含量较多),而3′末端不太 稳定(如AT含量较多)的引物
Per 25-mer
GC% graph
Per 25-mer
Stability
Per 5-mer
Oligo 6.44 使用说明
主要功能:专门的引物设计软件
Oligo 6.44 启动界面
Open sequence file
3个弹出窗口
Melting temperature
∆G Internal Stability
Dimer and cross Dimer Hairpin
GC%
Total PCR information
Final PCR information
Search for primer using Oligo 6.44
Search primer
Online primer3 service
/
Primer Premier 5.0 简介
主要功能:
1、即引物设计 2、限制性内切酶位点分析 3、DNA 基元(motif)查找 4、同源性分析
Primer Premier 5.0使用介绍 Load sequence
Preimer Premier 启动界面
引物设计的原则
1、引物长度 大多数应用的最短引物长度为18个核 苷酸。如果期待的产物长度等于或小 于500 bp,选用短的(16~18)的引物; 若产物长5 kb,则用24个核苷酸的引 物。有人用20~23个核苷酸引物得到 40 kb的产物。
引物设计的原则
2、引物GC含量
GC含量在40%-60%之间,以45-55% 为宜。这可为有效退火提供足够热。
一般原则
引物的长度一般为15-30 bp,常用的是18-24 bp ,但不应大于38。 引物过短又同时会引起错配现象,一般来说引物 长度大于16bp是必要的(不容易引起错配)。 例如:一个长度为12bp的引物在人类基因组上存 在200个潜在的退火位点(3 x 109/412=200 ).而一个 长度为20bp的引物在人基因组上存在的退火位点 只有1/400个. 较长的引物(28-35bp) 一般是用来区分同源性较高的模板序列或者使用 于产生一些突变位点
Tm值的计算 一般的公式 Tm = 4 (G+C) + 2(A+T) 对于长一些的引物可用更为准确的 nearest-neighbor (Frier et al. (1986) )
一般原则
2. 引物序列在模板内应当没有相似性较 高,尤其是3’端相似性较高的序列 ,否则容易导致错配。引物3’端出 现3 个以上的连续碱基,如GGG 或 CCC,也会使错误引发机率增加。
5、引物序列与模板序列组成的相似性
可能的错误引发位点决定于引物序列 组成与模板序列组成的相似性,相似 性高则错误引发率高 。
引物设计的原则
6、最好在模板cDNA的保守区内设计
DNA序列的保守区是通过物种间相似 序列的比较确定的。在NCBI上搜索不 同物种的同一基因,通过序列分析软 件(比如DNAman)比对(Alignment ),各基因相同的序列就是该基因的 保守区。
引物设计的原则
7、引物自身及引物之间不应存在互补序 列 引物自身不应存在互补序列,否则引 物自身会折叠成发夹结构(Hairpin) 使引物本身复性。这种二级结构会因 空间位阻而影响引物与模板的复性结 合。
引物设计的原则
8、碱基要随机分布
引物序列在模板内应当没有相似性较 高,尤其是3’端相似性较高的序列,否 则容易导致错误引发(False priming) 。
PCR引物设计
引物设计是PCR 技术中至关重要的一 环。使用不合适的PCR 引物容易导致 实验失败:表现为扩增出目的带之外 的多条带(如形成引物二聚体带), 不出带或出带很弱,等等。现在PCR 引物设计大都通过计算机软件进行。 可以直接提交模板序列到特定网页, 得到设计好的引物,也可以在本地计 算机上运行引物设计专业软件。
Frq为邻近6至7 个碱基组成的亚单位在一个指定数据库文件 中的出现频率。该频率高则可增加错误引发的可能性。
用Oligo 设计引物时的3个标准
Tm 值曲线以选取5’到3’的下降形状 有利于引物引发聚合反应。 Frq 曲线宜选用3’端Frq 值相对较低 的片段。 Δ G 值在5’端和中间值比较高,而在 3’端相对低
一般原则
4. 引物序列的GC 含量一般为40-60%, 过高或过低都不利于引发反应。上下 游引物的GC含量不能相差太大。 不同的算法推荐45-55%或50-60%
一般原则
5. ∆G 值是指DNA 双链形成所需的自由 能,该值反映了双链结构内部碱基对 的相对稳定性。应当选用3’端∆G 值 较低(绝对值不超过9),而5’端和 中间∆G 值相对较高的引物。引物的 3’端的∆G 值过高,容易在错配位点 形成双链结构并引发DNA 聚合反应。 (能值越高越容易结合)
一般原则Байду номын сангаас
6. 对引物的修饰一般是在5’端增加酶 切位点,应根据下一步实验中要插入 PCR 产物的载体的相应序列而确定。
一般原则
7. 引物二级结构对PCR反应的影响。 尽可能少的引物二聚体。
常用的引物设计软件
Oligo 6 (引物评价)* Primer Premier (自动搜索)* Vector NTI Suit Dnasis Omiga Dnastar Primer3 (在线服务)*
Primer Premier 5.0使用介绍 (1) Load sequence
Preimer Premier 启动界面
基本信息
Sequence name Original sequence
Choose a function
Use these two button to translate the DNA seq to a protein seq or a protein seq to a DAN seq 8种密码子偏好
引物设计的原则
9、引物应具有特异性
引物设计完成以后,应对其进行检测 。如果与其它基因不具有互补性,就 可以进行下一步的实验了。
引物设计的原则
10、ΔG值 ΔG值(自由能)反映了引物与模板结合 的强弱程度。一般情况下,引物的ΔG 值最好呈正弦曲线形状,即5’端和中间 ΔG值较高,而3’端ΔG值相对较低,且 不要超过9(ΔG值为负值,这里取绝对 值),如此则有利于正确引发反应而 可防止错误引发。
