电能转化为化学能——电解(习题)
高中化学 1.2 电能转化为化学能 电解习题 鲁科版选修4

高中化学 1.2 电能转化为化学能 电解习题 鲁科版选修41.(2013·北京卷) 用石墨电极电解CuCl 2溶液(如右图)。
下列分析正确的是( )A .a 端是直流电源的负极B .通电使CuCl 2发生电离C .阳极上发生的反应:Cu 2++2e -===CuD .通电一段时间后,在阴极附近观察到黄绿色气体解析:通电时,阳离子Cu 2+向阴极移动,并在阴极放电生成Cu ,阴离子Cl -向阳极移动并在阳极放电生成Cl 2,从而可以确定a 、b 分别为电源的负极和正极,故A 项正确,C 、D 两项错误;CuCl 2溶液发生电解而不是电离,故B 项错误。
答案:A2.右图为电解饱和食盐水示意图,下列说法正确的是( )A .阳极上析出氢气B .阴极上发生氧化反应C .电解时,溶液的pH 增大D .与电源正极相连的是电解池的阴极解析:A 项中,阳极发生氧化反应生成氯气,故A 错误;B 项中,阴极发生还原反应生成氢气,故B 错误;C 项中,电解方程式2NaCl +2H 2O=====通电2NaOH +Cl 2↑+H 2↑,可知生成氢氧化钠,则电解时,溶液的pH 增大,故C 正确;D 项中,与电源正极相连的是电解池的阳极,故D 错误。
答案:C3.下列有关电解原理的应用的说法正确的是( ) A .氯化铝是一种电解质,可用于电解法制铝B .电解法精炼铜时,以粗铜作阴极,纯铜作阳极C .电解饱和食盐水时,阴极反应式为2H ++2e -===H 2↑ D .在铁制品上镀银时,铁制品与电源正极相连解析:电解法制铝是采用氧化铝作原料,而不是氯化铝,故A 项错误;电解精炼铜,粗铜作阳极,精铜作阴极,故B 项错误;电解食盐水,阴极是氢离子得电子析出氢气,电极反应式书写正确;电镀时,被镀制品作阴极,与电源负极相连,故D 项错误。
答案:C4.如图是某同学用Cu 在Fe 片上镀铜的实验装置,下列说法正确的是( )A .Cu 2+在A 极被还原 B .溶液蓝色逐渐变浅C .铜片连接A 极,铁制品连接B 极D .A 极和B 极直接相连,铜片被氧化解析:用Cu 在Fe 片上镀铜时,镀件铁为阴极,连接B 极,该极上是铜离子发生得电子的还原反应;镀层金属铜为阳极,连接A 极,该极上是金属铜发生失电子的氧化反应,Cu-2e -===Cu 2+;电镀液是含有的镀层金属铜离子的盐,电镀液中铜离子浓度不变,所以溶液蓝色不变。
2015届高考化学总复习 第五章 第三节电能转化为化学能 电解试题(含解析)

一、单项选择题1.下列有关电化学的示意图中正确的是()解析:选项A,Zn为原电池负极,Cu为原电池正极,错误。
选项B,盐桥左右两边的烧杯中的应分别为ZnSO4、CuSO4溶液才能形成原电池。
选项C,粗铜应连接电源正极。
选项D,电解饱和NaCl溶液,Cl-在阳极放电而产生Cl2,溶液中的H+在阴极获得电子而产生H2,正确。
答案:D2.下列有关电解硝酸钾溶液的叙述正确的是()A.NO-3向阳极移动,K+向阴极移动,分别在两极放电B.OH-向阳极移动,阳极附近的溶液呈碱性C.阴极上H+放电,阴极附近的溶液呈碱性D.随着电解的进行,溶液的pH减小解析:NO-3、OH-向阳极移动,由于放电能力OH->NO-3,阳极反应为4OH--4e-===2H2O+O2↑,促使阳极附近水的电离平衡正移,富集下来的H+使得阳极附近的溶液呈酸性;K+、H+向阴极移动,由于放电能力H+>K+,阴极反应为2H++2e-===H2↑,促使阴极附近水的电离平衡正移,富集下来的OH-使得阴极附近的溶液呈碱性。
电解硝酸钾溶液实为电解水,由于KNO3溶液呈中性,因此溶液的pH不变。
因此只有C选项正确。
答案:C3.下列说法正确的是()A.蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程B.MgO和Al2O3在工业上用于制作耐高温材料,也常用于电解法冶炼镁、铝金属C.铅蓄电池放电时的正极和充电时的阴极均发生还原反应D.由两种非金属元素组成的化合物分子中只可能有极性键,不可能有非极性键解析:A项油脂不是高分子化合物;B项MgO熔点太高,常用电解熔融氯化镁冶炼镁;H2O2中存在非极性键,D项不正确。
答案:C4.以惰性电极电解CuSO4溶液。
若阳极上产生气体的物质的量为0.010 0 mol,则阴极上析出Cu 的质量为( )A .0.64 gB .1.28 gC .2.56 gD .5.12 g解析:本题主要考查电解原理的基本知识,根据阴、阳两极的电极反应,阴极:Cu 2++2e -===Cu ,阳极:4OH --4e -===2H 2O +O 2↑,且每个电极通过的电量相等有:n(O 2)·4=m (Cu )M (Cu )·2,所以m(Cu)=0.010 0 mol ×2×64 g·mol -1=1.28 g 。
2020-2021学年新教材高二上学期化学鲁科版:第一章第三节化学能转化为电能电解期末(三)

2020-2021学年新教材高二上学期化学鲁科版(2019)选择性必修1:第一章第三节化学能转化为电能——电解期末复习检测卷(三)一、单选题1.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。
下列说法中正确的是()A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠B.Y是阳极,发生氧化反应C.在铁片上镀银时,X是金属银D.电解氯化钠溶液可以获取金属钠2.下列关于电解饱和食盐水的说法中,正确的是()A.电解时阳极得到氯气,阴极得到金属钠B.若在阴极附近的溶液中滴入酚酞试液,溶液显无色C.若在阳极附近的溶液中,滴入碘化钾淀粉溶液,溶液显蓝色D.电解过程中,阴极发生的是氧化反应3.关于电解饱和食盐水,下列说法错误的是()A.正极产物为氯气B.阴极产物是氢气C.此过程将电能转化为化学能D.阴极产物有氢氧化钠4.Zn−CO2水介质电池通过放电获取储氢物质甲酸。
电池示意图如图,电极为金属锌和选择性催化材料。
下列说法错误的是()+ 2e- = Zn + 4OH-A.充电时,a电极反应为Zn(OH)24B.充电时,b电极反应为2H2O - 4e- = 4H+ + O2↑C.放电时,总反应2CO2 + 2H2O = 2HCOOH + O2D.放电时,标况下22.4L CO2转化为HCOOH,转移的电子数为2N A5.将如图所示实验装置的K闭合(已知:盐桥中装有琼脂凝胶,内含KCl),下列判断正确的是()A.Cu电极上发生还原反应B.电子沿Zn→a→b→Cu路径移动O)增大D.片刻后可观察到滤纸b处变红色C.片刻后甲池中c(S2-46.如图是某同学设计的验证原电池和电解池的实验装置,下列说法不正确的是( )A.若关闭K2、打开K1,一段时间后,发现左侧试管收集到的气体比右侧略多,则a为正极,b为负极B.关闭K2,打开K1,一段时间后,用拇指堵住试管移出烧杯,向试管内滴入酚酞,发现左侧试管内溶液变红色,则a为负极,b为正极C.若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则电路中电流方向为从右侧石墨棒沿导线到左侧石墨棒D.若直流电源a为负极,b为正极,关闭K2,打开K1,一段时间后,再关闭K1,打开K2,则左侧石墨棒上发生的电极反应为H2-2e-+2OH-=2H2O7.最近我国成功研制出高效电催化固氮催化剂Mo2N,如图所示,在0.1mol·L-1盐酸溶液中,在一定电压下具有较高的产氨速率和稳定的电流效率。
鲁科版高中化学选择性必修第1册课后习题 第1章 第3节 第1课时 电解的原理

第1章化学反应与能量转化第3节电能转化为化学能——电解第1课时电解的原理课后篇素养形成必备知识基础练1.用铂电极(惰性电极)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )A.稀NaOH溶液B.HCl溶液C.酸性NaCl溶液D.酸性AgNO3溶液解析电解稀NaOH溶液时,阳极:4OH--4e-O2↑+2H2O,阴极:2H2O+2e-H2↑+2OH-,阴极和阳极上的主要产物分别是H2和O2,故A正确;电解HCl溶液、NaCl溶液时,阳极:2Cl--2e-Cl2↑,阴极:2H++2e-H2↑、2H2O+2e-H2↑+2OH-,阴极和阳极上的主要产物分别是H2和Cl2,故B、C错误;电解AgNO3溶液时,阳极:2H2O-4e-O2↑+4H+,阴极:Ag++e-Ag,阴极和阳极上的主要产物分别是Ag和O2,故D错误。
2.用石墨棒作为阳极、铁棒作为阴极电解熔融的氯化钠,下列说法正确的是( )A.石墨棒周围有大量的Na+B.铁棒质量增加C.电子通过熔融电解质由石墨棒流向铁棒D.阴极发生氧化反应解析阴离子移向阳极(石墨棒),发生氧化反应:2Cl--2e-Cl2↑,阳离子移向阴极,发生还原反应:2Na++2e-2Na,A、D项错误,B项正确;电子不能通过熔融电解质,熔融的电解质是由于其内部自由移动的离子定向移动而导电的,C项错误。
3.某校化学兴趣小组的同学在一次活动中做了一个“彩虹”实验。
其装置如右图所示,在一U形管中装入含有紫色石蕊溶液的Na2SO4溶液,通直流电,一段时间后U形管内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )A.蓝、紫、红B.红、蓝、紫C.红、紫、蓝D.紫、红、蓝解析阳极电极反应为4OH--4e-2H2O+O2↑,阳极区溶液呈酸性,溶液呈红色;阴极电极反应为4H++4e-2H2↑,阴极区溶液呈碱性,溶液呈蓝色;中间仍为紫色石蕊溶液。
4.用惰性电极电解下列各组中的三种电解质的溶液,在电解的过程中,溶液pH的变化依次为升高、不变、降低的是( )A.AgNO3CuCl2Cu(NO3)2B.KCl Na2SO4CuSO4C.CaCl2KOH NaNO3D.HCl HNO3K2SO4:由上述分析可知,B项符合题意。
2023版新教材高中化学第3节电能转化为化学能_电解第2课时电解原理的应用课时作业鲁科版选择性必修1

第2课时 电解原理的应用必备知识基础练进阶训练第一层知识点1电解原理的应用1.关于用惰性电极电解NaCl溶液,下列叙述正确的是( )A.电解时在阳极得到氯气,在阴极得到金属钠B.若向阳极附近的溶液中滴入KI溶液,溶液呈棕色C.若向阴极附近的溶液中滴入酚酞溶液,溶液呈无色D.电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性2.如图为电解饱和食盐水的简易装置,下列有关说法正确的是( )A.通电一段时间后,向蛋壳内的溶液中滴加几滴酚酞试液,溶液呈红色B.蛋壳表面缠绕的铁丝发生氧化反应C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝D.蛋壳可阻止生成的氯气与氢气、氢氧化钠接触3.如图为电解饱和食盐水的实验装置。
据此,下列叙述不正确的是( )A.装置中a管导出的气体为氢气B.b管导出的是能使湿润的淀粉碘化钾试纸变蓝的气体C.在石墨棒电极区域有NaOH生成D.以电解饱和食盐水为基础制取氯气等产品的工业称为“氯碱工业”4.如图为阳离子交换膜法电解饱和食盐水的原理示意图(所用电极均为惰性电极)。
下列说法错误的是( )A.电解饱和食盐水的化学方程式为2NaCl+2H2O=====2NaOH+H2↑+Cl2↑B.从E口逸出的气体是Cl2C.从B口加入含少量NaOH的水溶液以增强导电能力D.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH5.用电解法可精炼含有Fe、Zn、Ag等杂质的粗铜。
下列叙述正确的是( )A.电解时以硫酸铜溶液作电解液,精铜作阳极B.粗铜与电源负极相连,发生氧化反应C.阴极上发生的电极反应是Cu2++2e-===CuD.电解后,Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥6.用含少量银和锌的粗铜作阳极、纯铜作阴极、硫酸铜溶液作电解液,电解一段时间后,阳极质量减少了x g(不考虑进入阳极泥的质量),则下列说法正确的是( )A.电解质溶液质量增加x gB.阴极质量增加x gC.若阴极质量增加a g,则a>xD.若阴极质量增加b g,则b<x7.电解精炼铜时,下列叙述不正确的是( )A.与电源正极相连的电极是粗铜板B.阴极发生反应:Cu2++2e-===CuC.粗铜板上发生氧化反应D.电解池的阳极材料为纯铜薄片8.金属镍有广泛的用途。
高考化学总复习《电能转化为化学能——电解》课时作业及答案

第五章化学反应中的能量的转化第三节电能转化为化学能——电解一、单项选择题1.(2011·北京东城区期末)下列有关电化学的示意图中正确的是()2.下列有关电解硝酸钾溶液的叙述正确的是()A.NO-3向阳极移动,K+向阴极移动,分别在两极放电B.OH-向阳极移动,阳极附近的溶液呈碱性C.阴极上H+放电,阴极附近的溶液呈碱性D.随着电解的进行,溶液的pH减小3.(2012·江西联考)下列说法正确的是()A.蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程B.MgO和Al2O3在工业上用于制作耐高温材料,也常用于电解法冶炼镁、铝金属C.铅蓄电池放电时的正极和充电时的阴极均发生还原反应D.由两种非金属元素组成的化合物分子中只可能有极性键,不可能有非极性键4.(2011·梅州模拟)以惰性电极电解CuSO4溶液。
若阳极上产生气体的物质的量为0.010 0 mol,则阴极上析出Cu的质量为() A.0.64 g B.1.28 gC.2.56 g D.5.12 g4题变式4-1.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。
此过程中共消耗水() A.3 mol B.4 molC.5 mol D.6 mol4-2.(双选)500 mL KNO3和Cu(NO3)2的混合溶液中c(NO-3)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况)。
下列说法正确的是()A.原混合溶液中c(K+)为2 mol/LB.上述电解过程中共转移4 mol电子C.电解得到的Cu的物质的量为0.5 molD.电解后溶液中c(H+)为4 mol/L5.(2011·东莞联考)关于下列装置说法正确的是()A.装置①中,盐桥中的K+移向ZnSO4溶液B.装置②工作一段时间后,a极附近溶液的pH增大C.用装置③精炼铜时,c极为粗铜D.装置④中电流由Zn流向Fe,装置中有Fe2+生成6.(2012·茂名二模)下图是某同学用Cu在Fe片上镀铜的实验装置,下列说法正确的是()A.Cu2+在A极被还原B.溶液蓝色逐渐变浅C.铜片连接A极,铁制品连接B极D.A极和B极直接相连,铜片被氧化二、双项选择题7.下图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。
2020-2021学年高中化学鲁科版选择性必修1第一章第二节电能转化为化学能——电解池作业1

2020-2021学年高中化学鲁科版(2019)选择性必修1第一章第二节电能转化为化学能——电解池作业1一、单选题1.把物质的量均为0.1 mol的CuCl2和H2SO4溶于水制成100 mL的混合溶液,用石墨做电极电解混合溶液,并收集两电极所产生的气体,通电一段时间后在两极收集到的气体在相同条件下体积相同,则下列叙述正确的是( )A.电路中共转移0.6N A个电子B.阳极得到的气体中O2的物质的量为0.2 molC.阳极质量增加3.2gD.电解后剩余溶液中硫酸的浓度小于1 mol·L-12.如图用石墨作电极的电解池中,放入某足量蓝色溶液500 mL进行电解,观察到A 电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6g。
下列说法错误..的是A.图中B极同电源正极相连B.该蓝色溶液可能是Cu(NO3)2或CuCl2溶液C.电解后溶液的pH减小D.B电极有氧气生成3.短周期元素W、X、Y、Z的原子序数依次增大。
W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大,W的简单氢化物常温下是液态,X、Y和Z原子的最外层电子数之和为7。
下列说法正确的是( )<<A.离子半径:W Y XB.工业上采用电解Y的氧化物冶炼单质YC.W、X元素组成的化合物一定只含离子键D.W、X、Y、Z四种元素形成的单质中,Z单质的熔点最高N为阿伏加德罗常数的值,下列说法中正确的是( )4.设AA .31molCH +正离子所含的电子总数为A 8NB .16232g O 与183O 混合气体中所含原子总数为A 2N C .常温常压下,222.4LNO 和2CO 混合气体中含有A 2N 个氧原子D .电解NaCl 溶液共得到22.4L 气体(标准状况),理论上转移了A 2N 个电子 5.如图所示,甲池的总反应式为:N 2H 4+O 2=N 2+H 2O ,下列说法不正确的是( )A .该装置工作时,Ag 电极上有气体生成B .甲池和乙池中的溶液的pH 均减小C .甲池中负极反应为:N 2H 4-4e -+4OH -=N 2+4H 2OD .当甲池中消耗0.1molN 2H 4时,乙池中理论上最多产生12.8g 固体6.下列叙述中错误的是( )A .电解池是电能转化为化学能的装置B .电镀时,电镀池里的阳极材料发生氧化反应C .原电池跟电解池连接后,电子从原电池负极流向电解池阳极D .电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气7.实验室用惰性电极电解稀硫酸,下列有关描述中,正确的是( )A .电解时,电源的正极与电解池的阴极相连B .电解过程中,溶液的pH 增大C .电解过程中,24SO -向阴极移动D .电解时,阴极反应是:2H ++2e -=H 2↑8.下列说法中正确的是( )A .Mg 在空气中燃烧时发出耀眼的白光,可用于制造信号弹B .铜的金属活泼性比铝的弱,可用铜罐代替铝罐贮运浓硝酸C .明矾可用于除去酸性废水中的悬浮颗粒D .MgO 、Al 2O 3是耐高温材料,工业上常用其电解冶炼对应的金属单质9.如图所示,a 、b 两电极材料分别为铁和铜。
电能转化为化学能

通电
Al2O3
Al 、 O2
观察与思考
实 验
(1)将两根碳棒分别浸入 氯化铜溶液中。 (2)浸入氯化铜溶液中的 两根碳棒,用导线连接。 (3)浸入氯化铜溶液中的 两根碳棒,分别跟直流 电源的正、负极相连接。
现象小结
1.电源的正极相连的碳棒:有气泡产生, 湿润的KI -淀粉试纸变蓝,说明有氯气生成。 2. 与电源的负极相连的碳棒:有一层红色的固 体析出,说明有铜生成。 3.实验结论:在通直流电的条件下,溶液里的 CuCl2发生了反应,生成了Cu和Cl2
电解的应用
纯金电镀镶钻石
电镀铝制材料诺基亚 6500C
电 镀 花
熔融氯化钠与氯化钠水溶液的电解
2、氯化钠水溶液 的电解
Na+ 、 Cl-、H+、OH• 在氯化钠水溶液中存在: __________
等离子。通电后, Na+、 H+向__ 阴 极(与电源 正极 ____相连)移动,Cl- 、OH-向___极(与电源____ 负极 阳 电解池阴 相连)移动。电子从电源负极流向_________极,在 阴极上水电离出的H+先得电子,电极反应为 2H++ 2e- == H2↑ 还原 __________,发生_______反应。 电源正 电子从电解池阳极流向_______极,在阳极上Cl-先 -2e-==Cl2↑ 失去电子,电极反应为 2Cl __________,发生 氧化 _______反应。总反应为 通电 2NaCl +2H2O 2NaOH +Cl _______________________。 2↑+H2↑
电解的概念
使直流电流通过电解质溶液而在两个两极引起氧化 还原反应的过程.
电能转化为化学能
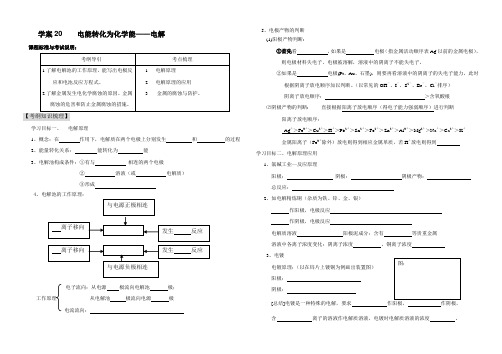
学案20 电能转化为化学能——电解课程标准与考试说明:【考纲知识梳理】学习目标一、 电解原理1、概念:在 作用下,电解质在两个电极上分别发生 和 的过程2、能量转化关系: 能转化为 能3、电解池构成条件:①有与 相连的两个电极② 溶液(或 电解质) ③形成4、电解池的工作原理:电子流向:从电源 极流向电解池 极;工作原理 从电解池 极流向电源 极 电流流向:5、电极产物的判断 (1)阳极产物判断:①首先看 ,如果是 电极(指金属活动顺序表Ag 以前的金属电极),则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子。
②如果是 电极(Pt 、Au 、石墨),则要再看溶液中的阴离子的失电子能力,此时根据阴离子放电顺序加以判断。
(以常见的OH -、I -、S 2-、Br -、Cl -排序)阴离子放电顺序: >含氧酸根⑵阴极产物的判断: 直接根据阳离子放电顺序(得电子能力强弱顺序)进行判断阳离子放电顺序:Ag +>Fe 3+>Cu 2+>H +>Pb 2+>Sn 2+>Fe 2+>Zn 2+>Al 3+>Mg 2+>Na +>Ca 2+>K +金属阳离子(Fe 3+除外)放电则得到相应金属单质,若H +放电则得到学习目标二、电解原理应用 1、氯碱工业—反应原理阳极: 阴极: 阴极产物: 总反应: 2、如电解精炼铜(杂质为铁、锌、金、银)作阳极,电极反应 作阴极,电极反应电解质溶液 阳极泥成分:含有 等贵重金属 溶液中各离子浓度变化:阴离子浓度 ,铜离子浓度3、电镀电镀原理:(以在锌片上镀铜为例画出装置图) 阳极: 阴极:[总结]电镀是一种特殊的电解,要求 作阳极, 作阴极, 含 离子的溶液作电解质溶液,电镀时电解质溶液的浓度 。
学习目标三、电解类型:电解各类电解质溶液(惰性电极)的情况归纳见下表:四、随堂检测1、用惰性电极实现电解,下列说法正确的是( ) A 、电解稀硫酸,实质上是电解水,故溶液pH 不变B 、电解稀NaOH 溶液,要消耗OH -,故溶液pH 减小C 、电解Na 2SO 4溶液,在阴极上和阳极上析出产物的物质的量之比为1:2D 、电解CuCl 2溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 2、下列叙述不正确的是A .电解时,在阴极上发生还原反应B .电镀时,阳极材料发生氧化反应C .电解饱和食盐水时,阴极区产物为氢氧化钠溶液和氢气D .原电池跟电解池连接后,电子从原电池负极流向电解池阳极3、甲、乙两个电解池均以Pt 为电极且互相串联。
电能转化为化学能——电解

特征
被镀件作阴极,镀层金属作阳极 阳极金属与电解质溶液中的阳离子相同 电镀液CuSO4的浓度基本不变
2、精炼铜
- +
粗铜 纯铜
电解液
(CuSO4溶液)
阴极: Cu2+ + 2e- == Cu
(还原反应)
阳极: Cu — 2e- == Cu2+ (氧化反应) 阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子
电解:在直流电的作用下,电 解质在两电极上分别发生氧化 反应和还原反应的过程。 电解池:将电能转化为化学能的装置
电解池:将电能转化为化学能的装置
构成条件: (1)外加直流电源 (2)与电源相连的两个电极: 接电源正极的为阳极,发生 氧化反应 接电源负极的为阴极,发生 还原反应 (3)电解质溶液或熔化的电解 质
阳极
阴极
电子的流向: 电子从外加电源的负极流出,流到电解池 的阴极,再从阳极流回电源正极。
(注:电子只在外电路定向移动,不能从溶液中移动)
e- + - e-
阳极
失 电 子
阴极
得 电 子
氧
化 反 应
阳离子
还
原 反 应
阴离子
离子定向移动的方向:阳离子向 阴极移动, 阴离子向 阳极移动.
分析电解反应的一般思路:
特征
纯铜作阴极,粗铜作阳极 阳极主要金属与电解质中的阳离子相同 电解液CuSO4的浓度基本不变,有杂质离子 Zn2+、Fe2+、Ni2+
通电后:(必须直流电) (1)确定电极名称: 阳极(接电源正极) 阴极(接电源负极) 与电极材料无关
(2)判断电极产物并书写电极反应: 阳离子移向阴极放电,阴离子移向阳极放电 阳极:2Cl-→Cl2↑ + 2e- 氧化反应
电能转化为化学能——电解 经典习题(含详解)

电能转化为化学能——电解经典习题1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语正确的是() A.用铜做阴极,石墨做阳极,电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑B.铅蓄电池放电时的正极反应式为Pb-2e-+SO2-4===PbSO4C.粗铜精炼时,与电源正极相连的应是粗铜,该极发生的电极反应只有Cu-2e-===Cu2+D.钢铁发生电化学腐蚀的正极反应式为Fe-2e-===Fe2+答案A解析用铜做阴极,石墨做阳极,电解饱和食盐水时,氯离子的还原性大于氢氧根离子,阳极的电极反应式为2Cl--2e-===Cl2↑,A项正确;铅蓄电池放电时的正极反应式为PbO2+4H++SO2-4+2e-===PbSO4+2H2O,负极反应式为Pb-2e-+SO2-4===PbSO4,B项错误;粗铜精炼时,与电源正极相连的应是粗铜,该极发生的电极反应除Cu-2e-===Cu2+外,还有比铜活泼的杂质金属失电子的反应,C项错误;钢铁发生电化学腐蚀的负极反应式为Fe-2e-===Fe2+,D项错误。
2.臭氧是常见的强氧化剂,广泛用于水处理系统。
制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示。
下列有关说法错误的是()A.两种方法都是利用电解原理B.高压放电出来的空气中,除含臭氧外还含有氮的氧化物C.电解纯水时,电极b发生的电极反应有3H2O-6e-===O3↑+6H+和2H2O-4e-===O2↑+4H+D.电解纯水时,H+由电极b经聚合固体电解质膜流向电极a答案A解析A项,图1直接在放电条件下发生化学反应,图2是利用电解法分解水,所以图1是化学反应方法、图2是电解法,错误;B项,氮气和氧气在放电条件下生成NO,所以高压放电出来的空气中,除含臭氧外还含有氮的氧化物,正确;C项,根据图2知,电解纯水时,阳极上得到氧气、臭氧,说明阳极上部分水失电子生成氧气、部分水失电子生成臭氧,电极反应式为3H2O-6e-===O3↑+6H+和2H2O-4e-===O2↑+4H+,正确;D项,电解纯水时,阳极b电极上生成氧气、臭氧,同时电解质溶液中得到氢离子,氢离子在阴极a电极上生成氢气,所以H+由电极b经聚合固体电解质膜流向电极a,正确。
将电能转化为化学能的例子

将电能转化为化学能的例子
1. 电池充电呀,这可是个超常见的将电能转化为化学能的例子!就像手机电池,你给它插上充电器,电就一点点存进去了,这不就是把电能变成了电池里可以储存的化学能嘛!哇塞,是不是很神奇?
2. 电解水制氢气,这也很厉害呢!通过电能把水分解成氢气和氧气,这过程不就像是一个魔法么,电能神奇地把水变了样,转化成了充满能量的化学物质,太酷了吧!
3. 电镀啊,比如给一些金属物品镀上一层其他金属。
电能让那些金属离子乖乖地附着在物品表面,形成好看又实用的镀层,这简直就是电能在大显神通,把能量转化为实实在在的化学变化呀!你说有趣不有趣?
4. 电动汽车的电池,那可是关键呀!在路上跑的时候消耗电能,停下来充电又把电能转化为化学能储存起来,这不就跟我们人吃东西储存能量一样嘛,只不过它储存的是化学能呢!
5. 铅酸蓄电池呀,好多设备都要用它。
电进去后被转化成能长期保存的化学能,等到需要的时候又能释放出来,这多像一个能量宝库呀,电能就是打开宝库的钥匙!
6. 电解食盐水生产氯气和烧碱,这也是电能的杰作呢!看着电能把普通的食盐水变得如此不同,转化出各种有用的化学物质,真的会让人惊叹不已呀!
7. 镍镉电池也是个典型呀!它能把电能好好地收藏起来变成化学能,随时准备为我们服务呢。
就像一个忠诚的小伙伴,默默地把电能转化好等待我们的召唤,是不是挺棒呀?
总之,将电能转化为化学能的例子就在我们身边,给我们的生活带来了很多便利和惊喜呢!。
学案27电能转化为化学能及答案

1电能转化为化学能 编号 27班级 组别 姓名 【学习目标】1、掌握电解池工作原理,准确书写电极反应式,电池总反应方程式 2、小组合作探究应用电解原理解决实际生产问题及其有关的简单计算 3、以极度的热情投入课堂,体验学习的快乐。
【使用说明】利用一节课完成学案,下课收齐。
下节课修改8分钟,针对存在问题重点讨论8分钟,师生探究、学生展示20分钟,巩固落实5分钟后进行当堂检测. 标有★★的B 层可不做,标有★或★★的C 层可不做【课前导学】一、电解原理:1、定义:电解是在 作用下,电解质在 上分别发生 的过程电解质导电的实质是 电解池由 、 以及 组成 2、 画出用惰性电极电解CuSO 4溶液的装置图 ,回答下列问题:与电源_____极相连的电极是阳极,发生_____反应,写出电极反应式__________________________,电解时溶液中______离子向阴极移动,写出电解总反应的离子方程式:__________________________________________________.3、放电顺序:(1)用惰性材料作电极时,阴离子在 极放电,常见阴离子的放电顺序是 。
阳离子在 极上放电,常见的阳离子的放电顺序是 (2)阳极材料是活性电极(除 _____、_____之外的金属)时,阳极本身优先失电子被氧化。
【小结】 1、书写电解池的电极反应(1) _____________________________________(2)______________________________________2、书写电解总反应的离子方程式时,放电离子来自强电解质的才能写成离子形式。
练习1、某同学按图所示的装置进行电解实验。
下列说法正确的是 ( )A 、电解初期,主要反应方程式为 Cu + H 2SO 4 CuSO 4 + H 2↑B 、电解过程中,铜电极上有H 2产生C 、电解一定时间后,石墨电极上不会有铜析出D 、整个电解过程中,H + 浓度不断增大4、酸、碱、盐溶液以及熔融物的电解规律表(惰性电极)二、电解的应用1、 电解饱和食盐水制备烧碱、氯气和氢气(氯碱工业)下图表示一个电解池,装有电解液a ;X 、Y 是两块电极板,通过导线与直流电源相连。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电能转化为化学能——电解(习题)
1.下列说法正确的是()
A.电解池能把化学能转化为电能
B.电解池中与直流电源正极相连的电极是阳极
C.通电时,电子从电解池的阴极流出,并沿导线流回电源
的负极
D.电解池中的阴离子在阴极上发生氧化反应
2.下列装置能构成电解池的是()
3.如图是用石墨电极电解CuCl2溶液的装置,下列分析正确的是()
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu+2e Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
4.用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是()
A.稀NaOH溶液B.HCl溶液
C.CuSO4溶液D.AgNO3溶液
5.用石墨电极持续电解下列溶液(电流不变),阳极上产生气体的量可能发生如右图所示
变化的是()
A.KI溶液B.Na2SO4溶液
C.CuSO4溶液D.NaCl溶液
6.关于电解NaCl水溶液,下列说法正确的是()
A.电解时钠离子向阳极移动
B.电解时在阳极得到氯气,在阴极得到金属钠
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.若在阳极附近的溶液中滴入KI溶液,溶液呈棕黄色
7.冶炼铜矿石所获得的铜通常含有锌、铁、镍、银、金和铂等微量杂质,俗称粗铜。
粗铜
的导电性不够理想,工业上常常通过电解法除去这些杂质制得精铜。
下列关于粗铜精炼的叙述中,正确的是()
A.粗铜与电源的正极相连
B.电解过程中,电解质溶液的浓度保持不变
C.电解后,溶液中不存在Fe2+、Zn2+
D.电解后,电解槽底部的阳极泥并无价值
8.若要在铜片上镀银,则下列叙述中错误的是()
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是:Ag+e Ag
④在银片上发生的反应是:4OH-4e2H2O+O2↑
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥B.②③⑥
C.①④⑤D.②③④⑥
9.在50 mL 0.2 mol·L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发):
(1)若两极均为铜片,则电解过程中溶液浓度将_______;
(2)若阳极为纯锌,阳极反应式是___________________;
(3)如果两极均为铜片,且不考虑H在阴极上放电,当电路中有0.01 mol电子通过时,阴极增重_______。
10.右图为以惰性电极进行电解的装置:
(1)写出各电极上的电极反应式和总反应方程式:
A:______________________________________,
B:______________________________________,
总反应:_________________________________;
C:______________________________________,
D:______________________________________,
总反应:_________________________________。
(2)反应一段时间后,在A、B、C、D各电极上析出生成物的物质的量之比为___________。
【参考答案】
1. B
2. C
3. A
4. A
5. D
6. D
7. A
8. C
9.(1)不变
(2)Zn-2e Zn
(3)0.32 g
10.(1)Cu+2e Cu
2Cl-2e Cl2↑
CuCl2Cu+Cl2↑
4Ag+4e4Ag
4OH-4e2H2O+O2↑
4AgNO3+2H2O4Ag+4HNO3+O2↑(2)2:2:4:1。
