乙醇催化氧化反应断键
有机化学实验现象断键规律制取等(最全版)

中学有机化学“断键”全解一.取代反应1.卤代反应:C—H键断裂①烷烃的卤代:CH4 + Cl2CH3Cl + HCl反应条件:光照、纯卤素②苯的卤代:反应条件:液溴、催化剂(FeBr3) ③苯的同系物的卤代:反应条件:液溴、催化剂(FeBr3)④酚的卤代:反应条件:浓溴水⑤醇的卤代:C2H5OH + HBr C2H5Br + H2O反应条件:浓硫酸作催化剂、脱水剂,加热2.硝化反应:C—H键断裂①苯的硝化反应条件:浓硫酸作催化剂、脱水剂,水浴加热55—60℃②苯的同系物的硝化反应条件:浓硫酸作催化剂、脱水剂,加热③酚的硝化反应条件:浓硫酸作催化剂、脱水剂3.酯化反应:羧酸中的C—O键、醇中的O—H键断裂CH3COOH + C2H5OH CH3COOCH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热4.水解反应①卤代烃的水解:C—X断裂C2H5Br + H2O C2H5OH + HBr反应条件:强碱NaOH的水溶液,加热②酯的水解:C—O键断裂反应条件:稀硫酸作催化剂,水浴加热70—80℃③蛋白质的水解:酰氨键中C—N键断裂5.醇与醇分子间脱水:醇分子中的的C—O键与另一醇分子中与羟基相连碳原子上的C—H键发生断裂2 CH3CH2OH CH3CH2OCH2CH3 + H2O反应条件:浓硫酸作催化剂、脱水剂,加热140℃6.置换反应:①醇的置换反应:O—H键断裂2 CH3CH2OH + 2 Na →2CH3CH2ONa + H2↑反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等)②酚的置换反应:O—H键断裂反应条件:活泼金属(K、Ca、Na、Mg、Al、Li等),熔化的苯酚③羧酸的置换反应:O—H键断裂2CH3COOH + Zn →(CH3COO)2Zn + H2↑反应条件:氢以前的活泼金属7.羧酸盐的脱羧反应:C—C键断裂CH3COONa + NaOH CH4↑+ Na2CO3反应条件:羧酸盐无水,加热8.复分解反应:C—H键断裂①中和反应:RCOOH + NaOH →RCOONa + H2O②羧基的检验:RCOOH + NaHCO3→RCOONa + H2O + CO2↑1.烯烃的加成反应:断裂中的一个键①与水的加成:CH2=CH2 + H2O CH3CH2OH②与卤素的加成:CH2=CH2 + Br2 →CH2BrCH2Br③与卤代烃的加成:CH2=CH2 + HCl CH3CH2Cl④与氢气的加成:CH2=CH2 + H2CH3CH32.炔烃:断裂中的一个键或二个键①与水的加成:②与卤素的加成:③与卤代烃的加成:④与氢气的加成:3.苯及苯的同系物的加成:断裂苯环上的特殊化学键4.醛的加成:断裂碳氧双键中的一个键三.消去反应:1.醇的消去反应:羟基与碳相连的C—O键及与羟基所在碳原子相邻的碳上的C—H键断裂CH3CH2OH CH2==CH2↑+ H2O反应条件:浓硫酸作催化剂、脱水剂,加热170℃2.卤代烃的消去反应:卤代烃C—X键及与卤素原子所在碳原子相邻的碳上的C—H键断裂CH3CH2Cl + NaOH CH2==CH2↑+ NaCl + H2O反应条件:强碱NaOH的醇溶液,加热1.剧烈氧化(有机物的燃烧):断裂分子中所有化学键CH3CH2OH + 3O22CO2 +3 H2O2.控制氧化①醇的催化氧化:醇羟基上的C—H键及与羟基所在碳原子相邻的碳上的C —H键断裂2 CH3CH2OH + O22CH3CHO + H2O②醛的催化氧化:断裂醛基上的C—H键2R—CHO + O2RCOOH③醛的银镜反应:断裂醛基上的C—H键R—CHO + 2Ag(NH3)2OH RCOONH4 + 3NH3 +2Ag↓+H2O反应条件:现配的银氨溶液,水浴加热④醛与新制的Cu(OH)2反应:断裂醛基上的C—H键R—CHO +2Cu(OH)2 RCOOH + Cu2O↓+ 2H2O反应条件:新配的Cu(OH)2悬浊液,加热⑤苯的同系物与酸性KMnO4反应:断裂苯环侧链上的C—H、C—C键⑥烯烃的催化氧化:断裂中的一个键断裂CH2=CH2 +O2CH3CHO⑦丁烷的催化氧化:C—C断裂CH3CH2 CH2CH3 + 5O2 4 CH3COOH + 2 H2O五、聚合反应:1.加聚反应:断裂中的一个键断裂①烯烃的加聚:②卤烯烃的加聚:③不饱和羧酸的加聚:①酚醛缩聚:酚羟基上的C—H与醛基上的C==O键断裂②氨基酸缩聚:羧基中C—O键与氨基中N—H键断裂③脂化缩聚:醇羟基上的O—H与羧基上的C—O键断裂六、分解与裂化、裂解1.分解反应①甲烷的分解:断裂C—H键反应条件:隔绝空气,加热到1000—1500℃②烯烃的臭氧分解:中的二个键全断裂③炔烃的臭氧分解:中的三个键全断裂2.裂化与裂解:C—C键断裂CH3CH2 CH2CH3 C2H4 + C2H6七、颜色反应酚遇Fe3+显蓝色:酚羟基上的O—H键断裂高中有机化学中的实验现象及注意事项1.光照甲烷与氯气的混合气体:黄绿色逐渐变浅,时间较长,(容器内壁有液滴生成)。
乙醇醇类重点难点解析

乙醇醇类---重点难点解析一、醇的结构特点与反应规律1.结构特点:a处O-H键和b处C-O键都是强极性键,在一定条件下易断裂发生取代反应。
酯化反应,分子间脱水反应;c处α氢原子和d处β氢原子,受羟基和R影响,有一定活性,可以断裂发生氧化反应、消去反应。
2.反应中化学键断裂部位:3.醇的催化氧化规律:醇羟基在一定条件下(Cu或Ag作催化剂),可发生去氢氧化。
(1)反应机理羟基(-OH)上的氢原子与羟基相连碳原子上的氢原子脱去,氧化为含有( )双键的醛或酮。
(2)醇的催化氧化(或去氢氧化)形成双键的条件是:连有羟基(-OH)的碳原子上必须有氢原子,否则该醇不能被催化氧化。
(3)醇的催化氧化规律:①与羟基(-OH)相连碳原子上有两个氢原子的醇(-OH在碳链末端的醇),被氧化生成醛。
2R-CH2-CH2OH+O2 2R-CH2-CHO+2H2O②与羟基(-OH)相连碳原子上有一个氢原子的醇(-OH在碳链中间的醇),被氧化生成酮。
③与羟基(-OH)相连碳原子上没有氢原子的醇不能被催化氧化。
不能形成双键,不能被氧化成醛或酮。
4.醇的消去反应规律(1)反应机理脱去的水分子是由羟基和羟基所在的碳原子的相邻位碳原子上的氢原子结合而成,碳碳间形成不饱和键。
(2)消去反应发生的条件和规律:醇分子中,连有羟基(—OH)的碳原子必须有相邻的碳原子且此相邻的碳原子上还必须连有氢原子时,才可发生消去反应而形成不饱和键。
表示为:除此以外还必须有浓H2SO4的催化作用和脱水作用,加热至170℃才可发生。
含一个碳原子的醇(如CH3OH)无相邻碳原子,所以不能发生消去反应;与羟基(-OH)相连碳原子相邻的碳原子上没有氢原子的醇也不能发生消去反应。
如:二、醇的反应条件对反应产物的影响温度不同,产物和反应类型不同。
如乙醇在浓H2SO4催化下加热至170℃生成乙烯,属消去反应,加热至140℃时,生成乙醚,是分子间脱水,属取代反应。
催化剂的影响:乙醇与O2反应,在铜作催化剂下生成乙醛,在点燃条件时生成CO2和H2O。
关于乙醇氧化产物的分析

关于乙醇氧化产物的分析乙醇电催化机理乙醇在电催化剂的作用下发生电化学氧化反应过程较复杂,涉及到多种化学吸附态、碳-碳键的断裂以及多种中间产物。
在酸性溶液中,乙醇在Pt电极上的电催化氧化反应可能按图1所示机理进行.由图1可以看出乙醇在Pt上既能完全氧化成CO2,也能氧化成乙醛或乙酸。
其产物的分布符合乙醇的浓度效应;即当乙醇浓度较高时,主要产物为乙醛;当乙醇浓度较低时,主要产物为乙酸和CO2。
其原因可能在于,由于乙醇的羟基中仅含有一个氧原子,要氧化为乙酸和CO2时,还需要一个额外的氧原子,即在Pt上发生水的解离吸附:Pt+H2O→PtOH+H++ e-由图1也可以看出,PtOH对于乙酸和CO2的形成是必不可少的,而乙醇氧化为乙醛不需要额外的氧原子,所以乙醇浓度较高时,Pt电极上覆盖的有机物种也较多,阻止了Pt的活性位上PtOH的形成,对乙酸和CO2的形成不利,使乙醛成为主要产物;反之,乙醇浓度较低时,即水含量较高时,有利于PtOH的形成,乙酸和CO2成为主要产物,从而产生所谓的浓度效应。
在研究人员利用在线质谱仪测试时发现,水与乙醇的摩尔比在5~2之间时,乙醇氧化的产物主要是乙醛,摩尔比越大,产物CO2越多。
亦即乙醇浓度越低,产物CO2越多,氧化越彻底,但乙醇浓度的降低势必会引起反应物传质困难,从而造成电池性能的下降。
对于乙醇氧化动力学结果表明,乙醇浓度不同时,以下反应的速度是不相等的:C2H5OH→CH3CHO+2H++2e- (1)C2H5OH+H2O→CH3COOH+4H++4e- (2)当乙醇浓度大于0.05mol/L时,(1)式的反应速度大于(2)式,使得乙醛成为主要产物;反之,乙酸成为主要产物。
乙醇在Pt电极上发生氧化反应得到不同的氧化产物也与其所处的电极电位有关,如表2所示。
事实上,乙醇在纯Pt上完全氧化成CO2时很困难的。
乙醇氧化过程中涉及到、碳-碳键的断裂[Pt+(CH3CO)Pt→PtCO+ PtCH3],反应中间产物CO在Pt上的吸附PtCO会引起Pt的中毒,所以氧化为CO2的量是极少的。
(新教材)2019-2020学年鲁科版化学必修第二册素养突破学案:3.3 第1课时 乙 醇 Word版含答案
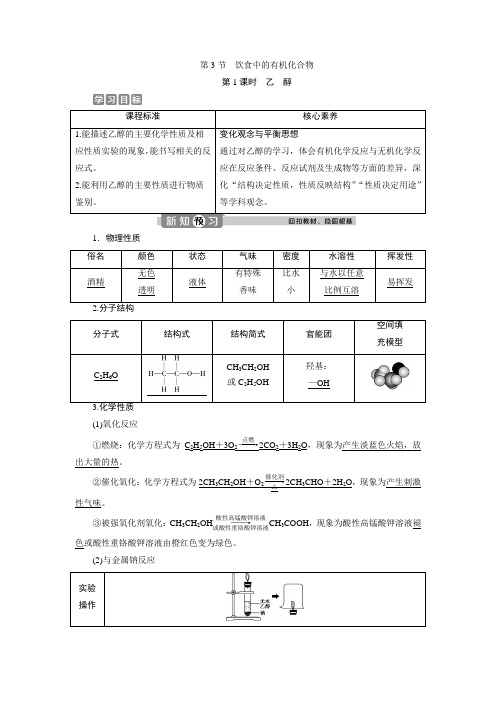
第3节饮食中的有机化合物第1课时乙醇课程标准核心素养1.能描述乙醇的主要化学性质及相应性质实验的现象,能书写相关的反应式。
2.能利用乙醇的主要性质进行物质鉴别。
变化观念与平衡思想通过对乙醇的学习,体会有机化学反应与无机化学反应在反应条件、反应试剂及生成物等方面的差异,深化“结构决定性质,性质反映结构”“性质决定用途”等学科观念。
1.物理性质俗名颜色状态气味密度水溶性挥发性酒精无色透明液体有特殊香味比水小与水以任意比例互溶易挥发2.分子结构分子式结构式结构简式官能团空间填充模型C2H6OCH3CH2OH或C2H5OH羟基:—OH(1)氧化反应①燃烧:化学方程式为C2H5OH+3O2――→点燃2CO2+3H2O,现象为产生淡蓝色火焰,放出大量的热。
②催化氧化:化学方程式为2CH3CH2OH+O2――→催化剂△2CH3CHO+2H2O,现象为产生刺激性气味。
③被强氧化剂氧化:CH3CH2OH――→酸性高锰酸钾溶液或酸性重铬酸钾溶液CH3COOH,现象为酸性高锰酸钾溶液褪色或酸性重铬酸钾溶液由橙红色变为绿色。
(2)与金属钠反应实验操作实验现象①钠开始沉于试管底部,最终慢慢消失,产生无色可燃性气体;②烧杯内壁有水珠产生;③向烧杯中加入澄清石灰水,石灰水不变浑浊实验结论乙醇与钠反应生成H2,化学方程式为2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑4.用途用作燃料、造酒原料、有机溶剂和化工原料等,医疗上则用75%(体积分数)的乙醇溶液杀菌、消毒。
1.乙醇分子的结构特点(1)乙醇分子中有C—H、C—C、C—O、O—H 4种化学键;(2)官能团为羟基,且羟基氢最活泼;(3)一定条件下,可断裂其中的一个或几个化学键乙醇的性质键的断裂与钠反应断①键燃烧断①②③④⑤键催化氧化断①③键总反应方程式为2CH3CH2OH+O2――→Cu△2CH3CHO+2H2O,反应中Cu做催化剂。
4.水、乙醇中羟基氢活动性比较钠与水反应钠与乙醇反应化学方程式2Na+2H2O===2NaOH+H2↑2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑反应实质水中氢被置换羟基氢被置换反应剧烈程度反应剧烈反应较平缓羟基氢活泼性比乙醇活泼比水活泼性弱定量计算关系2H2O~2Na~H22CH3CH2OH~2Na~H2密度大小关系ρ(Na)<ρ(H2O)ρ(Na)>ρ(CH3CH2OH)1.下列有关乙醇的表述正确的是() A.乙醇分子中含有甲基,甲基的电子式为B.乙醇的结构简式为C2H6OC.乙醇分子中羟基的电子式为[·×O••••·×H]-D.乙醇分子的空间填充模型为解析:选D。
乙醇被氧化为乙醛断键方式

乙醇被氧化为乙醛断键方式
乙醇氧化成乙醛,断键在羟基和与羟基相连的碳原子之间的键,即C-H键和O-H键。
具体来说,乙醇的催化氧化过程为:乙醇在金属铜或银的催化作用下,与氧气发生反应。
在这个过程中,乙醇分子中的羟基(O-H)和与羟基相连的碳原子上的一个氢原子(C-H)断裂,并与氧结合形成水分子。
剩余的部分则形成一个碳氧双键(C=O),从而形成乙醛分子。
需要注意的是,在有机化学反应中,断键和成键往往是同时进行的,旧键的断裂伴随着新键的形成。
因此,在乙醇氧化成乙醛的过程中,除了C-H键和O-H键的断裂外,还伴随着C=O键和O-H键(水分子中)的形成。
一、从乙醇的结构看其发生化学反应时键的断裂位置和方式.

Cu或Ag
2RCR` + 2H2O O
(3) 羟基所在的碳原子的相邻的 碳原子上含有氢原子的醇类可以发 生消去反应
一、从乙醇的结构看其发生化 学反应时键的断裂位置和方式
① 处断裂,发生置换反应:
乙醇与钠反应:
2CH3CH2OH + 2Na → 2CH3CH2ONa﹢H2↑
② 处断裂,发生取代反应
乙醇与HX反应:
CH3CH2OH + HX → CH3CH2X + H2O
②⑤处断裂,发生消去反应
乙醇分子内脱水制乙烯:
A、
B、
C、
D、
5、A、B、C三种醇同足量的金属钠反应,在 相同条件下产生相同体积的氢气,消耗这三 种醇的物质的量之比为3:6:2,则A、B、C 三种醇分子中羟基数之比为( D )
A、3:2:1 C、3:6:2 B、2:6:3 D、2:1:3
6、 (CH3)2CHCH(OH)CH3 、 CH3OH和浓H2SO4共热,可能生成的有 机物共有 5 种。
2、下列醇类能发生消去反应的是( B、D ) A、甲醇 B、1—丙醇 C、2,2—二甲基—1—丙醇 D、1—丁醇 3、下列醇可氧化生成醛的是( A、C ) A、CH3—CH2—CH2OH B、CH3—CH—CH3 OH
C、
D、(CH3)3COH
4、饱和一元醇C7H15OH,发生消去反应时,若可 以得到两种单烯烃,则该醇的结构简式为( D )
乙醇与乙酸分析

乙醇醇类一、物理性质:乙醇俗称酒精,它是没有颜色、透明而具有特殊香味的液体,密度比水小,沸点78.5℃。
乙醇易挥发,能够溶解多种无机物和有机物,能跟水任意比互溶。
二、结构:化学式:C2H6O 结构简式:CH3CH2OH乙醇的分子结构,极其可能的断键方位:三、乙醇的化学性质(分析其断键的可能性)1、和金属反应(与水作对比实验)(断键位置①,反应类型:取代反应)2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑2、和氢卤酸反应(乙醇、溴化钠、浓硫酸加热)(断键位置②,反应类型:取代反应)CH3CH2OH + HBr → CH3CH2Br + H2O3、氧化反应①、在空气中燃烧,淡兰色火焰,放出大量的热:C2H5OH(l) + 3O2 (g)→ 2CO2 (g)+ 3H2O(l)+ 1367kJ②、催化氧化(加热的铜丝伸到乙醇中,观察铜丝颜色变化,闻乙醇气味变化)(断键位置:①、③,氧化反应) 2CH3CH2OH + O2→ 2 CH3CHO (乙醛)+ 2 H2O4、脱水反应(演示实验:注意仪器,温度计、沸石)170℃消去反应,断键位置:②④ CH3CH2OH → CH2=CH2↑+ H2O140℃取代反应(分子间脱水)2CH3CH2OH → C2H5-O-C2H5 + H2O五、乙醇的用途:制燃料、饮料、香精、化工原料、有机溶剂六、乙醇的工业制法①、发酵法:含糖农产品(酵母菌)→分馏 95%的乙醇②乙烯水化法: CH2=CH2+ H2O → CH3CH2OH醇类:分子中含有和链烃基结合的羟基的化合物一、命名以及同分异构体二、分类1:一元醇:甲醇(CH3OH)重要的化工原料;“假酒”——含甲醇的工业酒精二元醇:乙二醇(HOCH2CH2OH)无色粘稠状液体,易溶于水,可作为内燃机抗冻剂三元醇:丙三醇(俗称甘油),吸湿性很强,用途很广,制硝化甘油,防冻剂和润滑剂。
分类2:伯醇、仲醇、叔醇练习题:1、能证明乙醇中含有水的试剂是( )A、无水硫酸铜粉末B、新制生石灰C、金属钠D、胆矾2、能证明乙醇分子中有一个羟基的事实是( )A、乙醇能溶于水B、乙醇完全燃烧生成CO2和H2OC、0.1mol乙醇与足量钠反应生成0.5mol氢气D、乙醇能脱水3、由于少数不法分唯利是图,假酒、假盐引起中毒的事件屡有发生。
深圳市高级中学高中化学选修三第三章《烃的衍生物》测试题(含答案解析)

一、选择题1.(0分)[ID:140777]乙醇分子结构式如图所示,下列反应及断键部位不正确的是A.乙醇与钠的反应是①键断裂B.乙醇的催化氧化反应是②③键断裂C.乙醇的完全燃烧是①②③④⑤键断裂D.乙醇与HBr反应是②键断裂2.(0分)[ID:140768]下列有关的说法正确的是A.该有机物的分子式为C13H14O3B.不能与新制的氢氧化铜反应C.该物质的所有碳原子可能共平面D.该物质含有的含氧官能团为醚键、醛基、羟基、碳碳双键3.(0分)[ID:140767]下列五种物质既能使高锰酸钾酸性溶液褪色又能与溴水反应使之褪色的是①甲烷②苯③聚乙烯④邻二甲苯⑤苯酚A.②③B.③⑤C.⑤D.④⑤4.(0分)[ID:140765]下列有机化合物的命名正确的是()A.乙二酸乙二酯B.2,2-二甲基-1-氯乙烷C.2-羟基丁烷D.3,3-二甲基-1-戊烯5.(0分)[ID:140764]下列离子方程式书写正确的是A.用醋酸除去水垢:CaCO3+2H+ =Ca2++H2O+CO2↑B.碳酸钠溶液中加入少量的苯酚:CO23-+ C6H5OH→C6H5O-+HCO3-−−→CH2=CH2↑+Br-+H2O C.溴乙烷与6 mol·L-1氢氧化钠水溶液共热:C2H5Br+OH-Δ−−→HCOO-+D.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-ΔNH++2Ag↓+3NH3+H2O46.(0分)[ID:140737]下列说法不正确的是A.玉米芯、甘蔗渣等在稀硫酸作用下水解所得的木糖C5H10O5,属于多羟基醛,木糖与浓硫酸加热作用可生成糠醛,由木糖生成糠醛的反应有消去反应。
B.醛类、葡萄糖、甲酸及其甲酸酯类均能发生银镜反应C.阿斯巴甜是目前使用最广泛的甜味剂,结构简式为,它既能与酸反应又能与碱反应,属于ɑ-氨基酸D.BAD是一种紫外线吸收剂,结构简式为:,1 mol BAD最多能和含6 mol NaOH的溶液进行反应7.(0分)[ID:140723]由X、Y和Z合成缓释药物M,下列说法错误的是A.X可用作汽车防冻液B.Z由加聚反应制得,其单体存在顺反异构C.1 mol M与NaOH溶液反应时,最多消耗4n mol NaOHD.Y可以发生氧化、中和、取代、加成反应8.(0分)[ID:140722]三蝶烯是最初的“分子马达的”关键组件,它的某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。
高中化学“乙醇”的项目式探究——乙醇结构确定与性质探究

高中化学“乙醇”的项目式探究——乙醇结构确定与性质探究摘要:以“乙醇结构确定与性质探究”为项目主题,开展高中化学“乙醇”的教学。
学生通过搭建乙醇的球棍模型、小组合作设计实验进行探究确定乙醇的结构,掌握确定有机物结构式的一般思路和方法,提高学生的科学探究意识和严谨求实的科学态度。
通过知识的迁移与应用提升学生“证据推理与模型认知”的化学学科核心素养。
从化学键的角度认识乙醇催化氧化反应中羟基结构的变化,形成“结构决定性质,性质反映结构”的学科思想,提高三重表征能力和表达交流能力。
关键词:项目式教学;乙醇;实验探究1 项目教学主题分析1.1 教材内容分析本节课位于鲁科版高中化学必修第二册第3章第3节《饮食中的有机化合物》第一课时[1]。
乙醇是高中阶段学生学习的第一个烃的衍生物,是学习烃和烃的衍生物之间的桥梁,既能以新的视角去重新认识前面所学过的有机化合物,又能够为后面学习烃的衍生物提供知识基础,帮助学生认识研究有机物结构和性质的思路与方法。
[2]1.2 课程标准分析《普通高中化学课程标准 (2017年版2020年修订) 》 (以下统称课标)对有机内容的学习非常注重“结构决定性质,性质反映结构”这一学科思想的体现,这也是本章需要重点强调的基本概念和学科大概念。
[3]本节课根据课标要求,将教学内容聚焦在乙醇的结构和化学性质两个方面,将两个知识点拆分为结构确定和性质探究两个项目学习,将“结构决定性质,性质反映结构”的学科思想外显出来,渗透到教学中去,构建研究有机物的方法模型。
2 项目教学目标【教学目标】(1)辨识乙醇中的官能团,掌握乙醇的结构和性质;(2)通过提取信息、设计实验、实际操作、总结交流的过程,提高学生的信息处理能力、操作能力和表达交流能力,培养学生的科学探究能力,构建研究有机物的方法模型;(3)通过对实验现象的总结归纳、球棍模型的搭建,从化学键的角度认识有机物之间的相互转化,掌握醇类的一种重要反应——催化氧化。
醇类的氧化反应与消去反应规律

醇类的氧化反应与消去反应规律氧化反应与消去反应是醇类物质的两类重要反应,我们可以从教材中乙醇的氧化反应和消去反应中总结出两类反应的规律。
1. 醇类的氧化反应乙醇的催化氧化:断的是结构式中①③两键,即属于去氢反应,去掉的是羟基上的氢原子和连有羟基的碳原子上的一个氢原子。
所以醇类物质是否能发生氧化反应,以及氧化后生成哪类产物,就看连有羟基的碳原子上是否连有氢原子,连有几个氢原子。
规律为:(1)连有两个氢原子,则氧化后生成醛类物质。
R-CH2-OH R-CHO(2)连有一个氢原子,则氧化后生成酮类物质。
R1-CHR2-OH R1-CO-R2(3)不连有氢原子,则不能发生氧化反应。
R1-CR2R3-OH不能发生氧化反应。
2. 消去反应乙醇的消去反应:断的是结构式中的②⑤两键。
即该反应消去的是羟基和连有羟基的碳原子相邻的碳原子上的一个氢原子。
所以醇类物质能否发生消去反应,就是看连有羟基的碳原子相邻的碳原子上是否连有氢原子。
规律为:(1)连有氢原子,则能发生消去反应。
R1-CR2H-CH2-OH R1-CR2CH2R-CH2-CH2-OH R-CHCH2(2)不连有氢原子,则不能发生消去反应。
R1-CR2R3-CH2-OH 不能发生消去反应。
例题:对有机物CnH2n+1OH (n>1)(1)若不能生成烯烃,则n的最小值为______ ;若含有该最小值个碳原子,则其中能生成两种烯烃的物质的结构简式为_________;不能生成烯烃的物质的结构简式为_______。
(2)若不能发生催化氧化反应,则n的最小值为_______;若含有该最小值个碳原子,则其中氧化产物为醛类的结构简式为_________-;氧化产物为酮类的结構简式为______;不能发生催化氧化反应的物质结构简式为_________。
解析:该类物质为饱和一元脂肪醇。
(1)不能发生消去反应生成烯烃,说明连有羟基的碳原子相邻的碳原子上没有氢原子,碳原子最少的物质为(CH3)3C-CH2-OH,n的最小值为5,生成两种烯烃的醇,应该连有羟基的碳原子上连有一个氢原子和两个不同的烃基,即结构简式为:CH3-CH2-CH2-CHCH3-OH 、CH3-CHCH3-CHCH3-OH 。
高中化学乙醇

⑵
如何检验酒精是否含水? 用无水硫酸铜检验 .
小知识
啤酒含酒精 3%-5% (啤酒的度数指麦芽汁含量) 葡萄酒含酒精 6%-20% 黄酒含酒精 8%-15% 白酒含酒精 50%-70% (以上均为体积分数)
实验:乙醇和钠的反应
视频 钠与水 钠与乙醇 沉在液面下 仍是块状
钠是否浮在液面上 浮在水面 钠的形状是否变化 熔成小球 有无声音 有无气泡 剧烈程度
CH2-CH2 H OH
浓H2SO4 170℃
CH2= CH2↑+H2O
制乙烯实验装置
为何使液体温度迅速升到 170℃,不能过高或高低?
酒精与浓硫酸混 合液如何配置 浓硫酸的作 用是什么? 温度计的 位置? 有何杂质气体?如 何除去?
放入几片碎瓷 片作用是什么?
混合液颜色如何 变化?为什么?
用排水集 气法收集
发出嘶嘶响声 没有声音 放出气泡 放出气泡
剧烈
2Na+2H2O= 2 NaOH +H2↑
缓慢
化学方程式
①
H H H—C—C—O—H , ①处O—H H H 2CH3CH2OH + Mg
键断开
(CH3CH2O)2Mg + H2↑
乙醇镁
学以致用
哪一个建议处理反应釜中金属钠的更合理、更安全? 建议(1):打开反应釜,用工具将反应釜内的金属钠 取出来; 建议(2):向反应釜内加水,通过化学反应“除掉”金 属钠; 建议(3):采用远程滴加乙醇的方法向反应釜内加入 乙醇,并设置放气管,排放乙醇与金属钠 反应产生的氢气和热量。
√
√
8、写出由CH2BrCH2Br与NaOH醇溶液共热的 反应方程式
CH2BrCH2Br
NaOH、△ CH3CH2OH
乙酸和乙醇反应断键位置

乙酸和乙醇反应断键位置英文回答:Acetic acid and ethanol can react to form an ester through a process called esterification. In this reaction, the bond between the carbonyl carbon of acetic acid and the hydroxyl group of ethanol is broken, and a new bond is formed between the carbonyl carbon and one of the carbon atoms in the ethanol molecule.The specific position at which the bond is broken depends on the reaction conditions and the relative reactivity of the functional groups involved. Generally, the bond between the carbonyl carbon and the oxygen atom in the acetic acid is more reactive than the bond between the hydroxyl group and the carbon atom in ethanol. Therefore,it is more likely for the bond between the carbonyl carbon and the oxygen atom to be broken.To illustrate this, let's consider an example. Imaginewe have acetic acid and ethanol in a reaction flask. We add a catalytic amount of sulfuric acid to the mixture to speed up the reaction. As the reaction proceeds, the sulfuric acid protonates the carbonyl oxygen in acetic acid, making it more electrophilic. The hydroxyl group in ethanol acts as a nucleophile and attacks the electrophilic carbonyl carbon, resulting in the formation of an intermediate.Now, the intermediate can undergo a series of proton transfer and elimination reactions to form the ester. During these steps, the bond between the carbonyl carbon and the oxygen atom in acetic acid is broken, and a new bond is formed between the carbonyl carbon and one of the carbon atoms in ethanol. The specific carbon atom in ethanol that forms the bond with the carbonyl carbon can vary, leading to different esters.中文回答:乙酸和乙醇可以通过酯化反应生成酯。
乙醇消去反应机理

乙醇消去反应机理
乙醇消去反应是一种重要的有机化学反应,它可以将乙醇分子转化为烯烃或炔烃。
这种反应的机理比较复杂,但是可以通过实验和理论计算来揭示其本质。
首先,乙醇消去反应的基本步骤是质子转移和碳碳键断裂。
在质子转移的过程中,乙醇分子中的羟基离子会从一个碳原子上脱离,并转移到另一个碳原子上。
这个过程通常需要一个酸性催化剂来促进。
接下来,在碳碳键断裂的过程中,C-O键会被打断,并形成一个双键或三键。
这个过程通常需要高温和高压来促进。
最终产物的类型取决于反应条件和底物结构。
在理论计算方面,量子化学方法已经被广泛用于研究乙醇消去反应的机理。
例如,在密度泛函理论(DFT)框架下,可以计算出各个中间体和过渡态的结构、能量和振动频率等信息,从而揭示反应路径和可能存在的副反应。
总之,乙醇消去反应是一种复杂的有机化学反应,其机理涉及质子转移和碳碳键断裂等步骤。
通过实验和理论计算,可以揭示其本质和优化反应条件。
人教版B版高中化学选择性必修第3册 第三章 烃的衍生物 第二节 第1课时 醇

解析 根据甲、乙、丙之间的转化关系可知,①发生消去反应,②发生加成反 应,则甲为醇、乙为烯烃、丙为卤代烃。甲的结构简式可能为
CH3CH2CH2OH、
。乙的结构简式为 CH2=CHCH3,乙与 Br2
发生加成反应生成丙,丙的结构简式为
。
课堂篇 素养提升
探究一 乙醇的消去反应和取代反应 【问题探究】
+H—O—R'
+H2O
酸脱羟基醇脱氢 【微点拨】酯化反应化学反应方程式中要使用“ 酸,△”。
”,反应条件为“浓硫
(2)醇分子间脱水(成醚反应) (3)醇与HX的取代反应
【素能应用】 典例1某化学兴趣小组用如图甲所示装置进行探究实验,以验证产物中有 乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到装置Ⅱ试管 中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
4.氧化反应
②氧化反应与还原反应
四、醚
【自我检测】 1.正误判断: (1)从碘水中提取单质碘时,能用无水乙醇代替CCl4。( ) 提示 ×。乙醇与水互溶,不能作萃取剂。
(2)沸点由高到低的顺序为
>CH3CH2OH>CH3CH2CH3。( )
提示 √。醇类沸点远远高于相对分子质量相近的烃类,分子中含相同碳原
变式训练1下列说法正确的是( ) A.CH3CH2CH2OH和(CH3)2CHOH在一定条件下发生消去反应生成的烯烃 结构不同
B.CH3OH、CH3CH2OH、
、
都能在催化
剂作用下发生氧化反应
C.将
与 CH3CH2OH 在浓硫酸存在下加热,最多可生成 3 种有机
产物 D.醇类在一定条件下都能与氢卤酸反应生成卤代烃
1.某醇 A 的结构简式为
从乙醇的结构看其发生化学反应时键的断裂位置和方式

•
每天都是美好的一天,新的一天开启 。20.12. 1820.1 2.1822:1522:15 :2622:1 5:26De c-20
•
人生不是自发的自我发展,而是一长 串机缘 。事件 和决定 ,这些 机缘、 事件和 决定在 它们实 现的当 时是取 决于我 们的意 志的。2 020年1 2月18 日星期 五10时1 5分26 秒Friday , December 18, 2020
•
树立质量法制观念、提高全员质量意 识。20. 12.1820 .12.18Friday , December 18, 2020
•
人生得意须尽欢,莫使金樽空对月。2 2:15:26 22:15:2 622:15 12/18/2 020 10:15:26 PM
•
安全象只弓,不拉它就松,要想保安 全,常 把弓弦 绷。20. 12.1822 :15:262 2:15De c-2018 -Dec-2 0
(4) 分子间脱水生成醚
R—OH + R`—OH 浓硫酸 R—O—R` + H2O
(5) 和氢卤酸(HX)取代生成 卤代烃
R—OH + HX
R—X + H2O
三、练习 1、乙醇分子中的化学键如图所示:
关于乙醇在各种不同反应中断裂键的说法不正确的是
( D、E )
A、和金属钠反应,键①断裂 B、和浓硫酸共热,在170℃时键②和⑤断裂 C、和浓硫酸共热,在140℃时键①或②断裂 D、在Ag或Cu催化作用下和O2反应,键②和键③断裂 E、 和氢溴酸反应时,键①断裂
B、羟基所在的碳原子上含有氢原子 的醇可被催化氧化
2RCH2OH + O2 Cu或Ag 2RCHO +2H2O
练后归纳醇的消去反应和催化氧化反应规律

下列不能与白藜芦醇反应的是( C )
A.Na2CO3溶液 B.FeCl3溶液 C.NaHCO3溶液 D.酸性KMnO4溶液
解析:从白藜芦醇的结构可知,它的官能团有碳碳双键、酚羟基,所以具
有烯烃和酚的性质:与Na2CO3溶液反应生成酚钠和NaHCO3,与FeCl3 溶液发生显色反应(显紫色),双键和酚都能被酸性KMnO4溶液氧化,只 有C项中的NaHCO3溶液不反应。
4.化学性质 由于苯环对羟基的影响,酚羟基比醇羟基 活泼 ;由于羟基对苯环的影 响,苯酚中苯环上的氢比苯中的氢 活泼 。
紫 粉红
化学
5.对环境的影响 酚类化合物有毒,是重点控制的水污染物之一。在含酚废水中,以苯酚、 甲酚的污染最为突出。处理含酚废水主要有两种方法:回收利用和降解 处理。
【多维思考】
化学
2.膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一 种非糖类膳食纤维,其单体之一——芥子醇结构简式如图所示。下列有关 芥子醇的说法不正确的是( A ) A.芥子醇分子中有两种含氧官能团 B.1 mol芥子醇分子中与足量钠反应能生成1 mol H2 C.1 mol芥子醇与足量浓溴水反应,最多消耗1 mol Br2 D.芥子醇能发生的反应类型有氧化、取代、加成反应
②④ 消去反应 CH3CH2OH
《乙醇断键研究》课件

理论计算方法与模型
精确预测
理论计算方法和模型可以对乙醇断键反应进行精确预测。这些方法和模型基于量子力学原理,能够模 拟和计算分子在不同条件下的行为,从而为实验设计和优化提供指导。
理论预测与实验结果的比较
验证与修正
将理论预测与实验结果进行比较是检 验理论模型准确性的重要步骤。通过 比较,可以发现理论模型的不足之处 ,并进行修正和完善,从而提高理论 预测的可靠性和准确性。
在环境保护中的应用
乙醇断键可以应用于环境保护中,如 污水处理和废气处理。通过断键反应 ,可以将污水中的有害物质转化为无 害物质或易于处理的中间体,如将有 机物转化为二氧化碳和水等;同时也 可以将废气中的有害气体如硫化物、 氮氧化物等转化为无害或低害的物质 。
VS
乙醇断键还可以应用于土壤修复领域 ,如重金属污染土壤的修复。通过断 键反应,可以将重金属离子转化为不 易溶于水的物质,降低其在土壤中的 迁移性和生物可利用性,从而减少对 环境和人体的危害。
《乙醇断键研究》 ppt课件
目录
CONTENTS
• 乙醇断键研究背景 • 乙醇断键的实验方法 • 乙醇断键的实验结果 • 乙醇断键的理论研究 • 乙醇断键的应用前景 • 结论与展望
01
乙醇断键研究背景
乙醇的化学性质
乙醇是一种有机化合物,具有醇类的通性,如能与酸发生酯化反应等。 乙醇具有羟基,可以与金属钠等活泼金属发生取代反应,生成乙醇钠等化合物。
乙醇断键反应选择性研究
我们发现,在某些条件下,乙醇断键反应可以表现出良好 的选择性,生成特定产物,这为乙醇断键反应在实际应用 中的选择性控制提供了可能。
研究不足与展望
01
实验条件限制
虽然我们已经取得了一些重要的实验结果,但由于实验条件的限制,部
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、写出甲醇(CH3OH)和钠反应的化学方程式:
2CH3OH + 2Na 2CH3ONa + H2↑
。
2、在下列物质中,分别加入金属钠,不能产生氢
气的是( A )
A、苯
B、蒸馏水
C、无水酒精 D、75%的是 乙醇的10倍
成
分
是
乙
醇
实验3-3:乙醇被氧化成乙醛
啤酒
鸡尾酒
白酒
洋酒
葡萄酒
乙醇(俗称酒精)
一、物理性质
颜 色 无色 气 味 特殊香味
状 态 液体 挥发性 易挥发 密 度 密度比水小 溶解性 能溶解多种有机物和无机
物,与水以任意比互溶
75%医用酒精
二、乙醇的结构:
分子式: C2H6O
HH
结构式:H—C—C—O—H
HH
羟基 简写:—OH
结构简式:CH3CH2OH 或 C2H5OH
练习:
乙醇分子结构中各化学键如右图,关于乙醇在各种反
应中断键的说法不正确的是(BD )
⑤ H④ H② ①
A、和金属钠反应时①断裂
HC CO H
B、乙醇燃烧时断裂②和⑤
③ HH
C、银催化条件下,与O2反应断裂①和③
D、铜催化条件下,与O2反应断裂①和⑤
3、下列关于乙醇的叙述正确的是( D )
A、乙醇结构中有—OH,所以乙醇溶于水电离 出OHB、乙醇分子结构中含有6个相同的氢原子 C、乙醇的密度比水小,所以可以用分液的方法 分离乙醇和水 D、乙醇和钠的反应属于取代反应
4、将等质量的铜片在酒精灯上加热后,分别插
入下列溶液中,放置片刻,铜片质量增加的是
(C )
A、硝酸
B、无水乙醇
C、石灰水
D、盐酸
CH2OH
5、已知乙二醇的分子结构为
,1mol
CH2OH
乙二醇分子与足量的钠反应,生成氢气为(BC)
A、0.5mol B、1mol C、2g D、1g
6、司机是否酒后驾车,可通过对其
③ HH
实验结论:乙醇催化氧化反应断①③键。
催化氧化(部分氧化)
叠
2Cu + O2 === 2CuO
加
红色
黑色
2C2H5OH+ 2CuO 黑色
CH2 3CHO+ H22O+ Cu2 有刺激性气味 红色
2C2H5OH + O2 Cu 2CH3CHO +2 H2O 工业上利用该反应制取乙醛!
乙醇的化学性质: 2、乙醇的氧化反应
HH
HH
H—C—C—H
H—C—C—O—H
H H 乙烷
H H 乙醇
烃的衍生物:烃分子中的氢原子被其他原子 或原子团所取代而生成的一系列化合物。
例如:CH3Cl、CH2Cl2等
结构式:
HH
⑤ ④② ①
HC CO H
③
HH 乙醇的化学性质
实验3-2 乙醇与金属钠反应
实验步骤
1、取少量无水乙醇于试管中, 加入一小块新切的、用滤纸擦 干表面煤油的钠,观察现象。
实验现象
金属钠沉在试管底部,反 应平缓,不断有气泡冒出。
2、收集气体验纯,点燃气体, 观察火焰,将烧杯倒扣在火焰 上方,观察现象,并用澄清石 灰水检验。
火焰为淡蓝色。将烧杯倒扣 在火焰上方,烧杯内壁有水珠, 澄清石灰石没有变浑浊。
请与“金属钠和水反应”的实验进行 对比,总结异同之处,说明什么。
乙醇与钠
呼出的气体进行检验而查出,所利
用的化学反应如下:
2CrO3(红色)+3C2H5OH+3H2SO4 == Cr2(SO4)3(绿色) +3CH3CHO+6H2O
反应中的氧化剂是( C )
A、C2H5OH C、CrO3
B、H2SO4 D、Cr2(SO4)3
7、乙醇、乙二醇
CCHH22OOHH、甘油
CH2OH CHOH
三、化学性质: 1、与钠反应:(断①键) 2、氧化反应:
结构决定 性质
体现
(1)催化氧化(断①③键)
(2)燃烧反应(断全部键)
实验3-2
金属钠的变化 气体燃烧的现象 检验产物 水
乙醇
乙醇与钠
水与钠
实验3-2
在盛有少量无水乙醇的试管中,加入一小块新切的用 滤纸擦干煤油的金属钠,观察现象,并收集气体验纯。燃 烧气体,加澄清石灰石检验产物。比较前面金属钠和水反 应的实验,完成表格。
(1)点燃酒精灯,拿一根洁净 的铜丝在酒精灯外焰灼烧
(2)把灼热的铜丝放入盛有 乙醇的烧杯中。
(3)闻液体的气味。
实验:乙醇被氧化成乙醛
实验现象
加热
插入 乙醇
2Cu + O2=== 2CuO
闻到刺激性气味
2Cu + O2 === 2CuO
红色
黑色
HH || H—C— C—H || H O—H
+CuO
黑色
HH
|| H—C — C =O + Cu +H2O
| H
2 有刺激性气味 红色
学生活动:拆一拆,拼一拼
HO
H
HC H
C H
H
HH || H—C— C—H || H O—H
运用准备好的 模型模拟乙醇 氧化生成乙醛 的过程。
HH || H—C — C =O | H
HH ⑤ ④② ① HC CO H
分别与
足量金属钠反应,产生等量的氢气CH,2O则H三种醇
的物质的量之比是 ( A )
A、6:3:2
B、1:2:3
C、3:2:1
D、4:3:2
8、已知异丙醇的分子结构为 CH3CHCH3 ,如
OH
果发生催化氧化反应,生成物为
。
乙醇
⑤ H④ H② ①
一、物理性质
HC CO H
二、结构
③
HH
分子中具有的官能团:羟基(—OH)
(1)乙醇的催化氧化:
2CH3CH2OH
+
O2
Cu/Ag △
2CH3CHO+2H2O
(2)乙醇的燃烧反应: (断全部键)
点燃
CH3CH2OH +3O2
2CO2 + 3H2O
绿色能源
汽车也能喝“酒”?!
乙醇汽油
乙醇汽油由 90%的普通 汽油与10% 的燃料乙醇 调和而成。
乙醇的燃烧
固体酒精
固体酒精燃烧时无烟尘、无毒、无异味,火 焰温度均匀,是一种理想的燃料。
金属钠的变化 气体燃烧的现象 检验产物 水
乙醇
1、沉与浮:P水> P钠> P乙醇
水与钠
2、平缓与剧烈:乙醇羟基中的氢原子不如水分子中氢原子活泼。
HH ⑤ ④② ① HC CO H
③ HH
实验结论: 乙醇与钠的反应断①键。
乙醇的化学性质:
1、乙醇和钠的反应
2CH3CH2OH + 2Na
2CH3CH2ONa + H2↑
该反应属于什么类型?
综合练习:
