(精校版)物理化学第九章模拟试卷C
2019-2020年高中物理 第九章 固体、液体和物态变化单元测评 新人教版选修3-3

2019-2020年高中物理第九章固体、液体和物态变化单元测评新人教版选修3-3一、选择题(本题共10小题,每小题5分,共50分。
在每小题给出的四个选项中,至少有一个选项正确;全部选对的得5分,选不全的得3分,有选错或不答的得0分)1.关于晶体和非晶体,下列说法正确的是( )A.有规则的几何外形的固体一定是晶体B.晶体在物理性质上一定是各向异性的C.晶体熔化时具有确定的熔点D.非晶体在适当的条件下可以转化为晶体解析:单晶体有规则的几何外形,多晶体与非晶体都没有规则的几何外形,但如果固体有规则的几何外形但不是天然的,而是人为加工的,则其不一定是晶体,A错误;单晶体只在某些物理性质上表现为各向异性,并非所有的物理性质都表现为各向异性,多晶体在物理性质上表现为各向同性,B错误;晶体有确定的熔点,C正确;理论和实验都证明非晶体是不稳定状态,在适当条件下会变成晶体,D正确。
答案:CD2.有关晶体的排列结构,下列说法正确的有( )A.同种元素原子按不同结构排列时具有相同的物理性质B.同种元素原子按不同结构排列时具有不同的物理性质C.同种元素形成晶体只能有一种排列规律D.同种元素形成晶体可能有不同的排列规律解析:同种元素原子在不同情况下可能按不同的方式排列,并导致物理性质有明显的差异,故A、C 错误,B、D正确。
答案:BD3.(2012·江苏单科)下列现象中,能说明液体存在表面张力的有( )A.水黾可以停在水面上B.叶面上的露珠呈球形C.滴入水中的红墨水很快散开D.悬浮在水中的花粉做无规则运动解析:由于液体表面层分子引力,使得液体表面具有收缩的趋势,露珠表面张力使表面面积收缩到最小,水面的张力给水黾向上的弹力,选项A、B正确;红墨水散开是扩散现象,选项C错误;悬浮在水中的花粉做无规则运动,是水分子对花粉颗粒碰撞不均衡造成的,选项D错误。
答案:AB4.如图所示,ABCD是一厚度均匀的由同一种微粒构成的圆板,AB和CD是互相垂直的两条直径,把圆板从图示位置转90°角后电流表读数发生了变化(两种情况下都接触良好),关于圆板,下列说法正确的是( )A.圆板是非晶体B.圆板是多晶体C.圆板是单晶体D.不知有无固定熔点无法判定是晶体还是非晶体解析:电流表读数发生变化,说明圆板沿AB和CD两个方向的导电性能不同,即各向异性,所以圆板是单晶体,故A、B、D错,C对。
人教版高二物理选修3-3第九章 固体、液体和物态变化期末复习模拟测试(带解析)

绝密★启用前2019-2020学年第二学期人教版物理选修3-3第九章固体、液体和物态变化期末复习模拟测试本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间150分钟。
分卷I一、单选题(共10小题,每小题4.0分,共40分)1.已知50 ℃时饱和水汽压是92.5 mmHg,则在以下两种变化中:①如果温度不变,汽的体积缩小到原来一半;②体积不变,汽的温度升高到100°C其饱和水汽压变化是()A.不变,不变B.变大,不变C.不变,变大D.变大,变大2.在晶体中,原子(或分子、离子)都是按照各自的规律排列的,具有空间上的周期性.晶体的这种微观结构可用来解释()A.单晶体具有规则的几何形状,非晶体没有B.晶体能溶于水,非晶体不能C.晶体的导电性比非晶体强D.晶体的机械强度不如非晶体3.下列说法正确的是()A.空气的绝对湿度跟水的饱和汽压的百分比,叫做空气的相对湿度B.人们的有些病症与空气的相对湿度有关C.干湿泡湿度计上,两温度计的示数的差值越大,说明空气越潮湿D.只要气温不高,人们就一定不会感到闷热4.液体与固体具有的相同特点是()A.都具有确定的形状B.体积都不易被压缩C.物质分子的位置都确定D.物质分子都在固定位置附近振动5.下列关于汽化热的说法中正确的是()A.汽化热不会随温度的变化而变化B.不同物质的汽化热不同,同一物质的汽化热相同C.汽化热不仅与物质的种类有关,还与温度、压强有关D.汽化热只与物质的种类有关,与温度、压强无关6.关于晶体和非晶体,下列说法中正确的是()A.可以根据各向异性或各向同性来鉴别晶体和非晶体B.一块均匀薄片,沿各个方向对它施加拉力,发现其强度一样,则此薄片一定是非晶体C.一个固体球,如果沿其各条直径方向的导电性能不同,则该球体一定是单晶体D.一块晶体,若其各个方向的导热性能相同,则这块晶体一定是多晶体7.有关蒸发和沸腾说法正确的是()A.蒸发和沸腾都是发生在液面的汽化现象B.提高液体的温度可减缓液体的蒸发C.要提高液面沸点必须减少液面的气压D.蒸发可以在任何情况下进行8.高压锅又叫压力锅,用它可以将被蒸煮的食物加热到100 ℃以上,所以食物容易被煮熟,且高压锅煮食物比普通锅煮食物省时间、省燃料,尤其做出的米饭香软可口,很受人们欢迎.下表是AS22-5-80高压锅的铭牌,对此下列解释正确的是()A.食品受到的压强大而易熟B.高压锅保温性能好,热量损失少而易熟C.锅内温度能达到100 ℃以上,食品因高温而易熟D.高压锅的密封性好,减少水的蒸发而易熟9.吉尼斯大全中,记述了一个人赤着脚在650 ℃的燃烧着的一长堆木炭上步行约7.5米的“世界之最”纪录.下面说法正确的是()A.这个表演者一定在脚下事先抹上了一种高级绝热防护剂B.这个表演者一定是跳跃式地走过去的,这样做接触时间短,炭火来不及灼伤脚C.这个表演者一定是用汗脚踩在炭火上一步步轻轻地走过去的D.这个表演者一定是轻轻地踮着脚走过去的,这样做接触面积小,即使灼伤也不厉害10.晶体在熔化过程中,吸收热量的作用是()A.增加晶体的温度B.克服分子间引力,增加分子势能C.克服分子间引力,使分子动能增加D.既增加分子动能,也增加分子势能二、多选题(共4小题,每小题5.0分,共20分)11.(多选)液体表面具有收缩趋势的原因是 ()A.液体可以流动B.液体表面层的分子势能小于液体内部分子势能C.液体表面层的分子势能大于液体内部分子势能D.液体表面层的分子势能有减小的趋势12.(多选)某日白天的气温是20 ℃,空气中水蒸气的压强是1.1×103Pa;夜间,空气中水蒸气的压强不变,气温降到10 ℃,白天水的饱和汽压为2.3×103Pa,夜间水的饱和汽压为1.2×103Pa,则我们感觉到的潮湿与干爽情况是()A.夜间干爽B.白天潮湿C.白天干爽D.夜间潮湿13.(多选)关于晶体、液晶、液体,下列说法正确的是()A.晶体和液晶的性质是完全相同的B.液晶就是液体,具有液体的所有性质C.液晶是介于晶体与液体之间的一种中间态D.液晶具有液体的流动性,具有晶体的各向异性14.(多选)在相对湿度相同的情况下,比较可得()A.冬天的绝对湿度大B.夏天的绝对湿度大C.冬天的绝对湿度小D.夏天的绝对湿度小分卷II三、计算题(共4小题,每小题10.0分,共40分)15.测得室温为20 ℃时,空气的绝对湿度p=0.799 kPa.求此时空气的相对湿度是多少?(20 ℃时水的饱和汽压p s=2.34 kPa)16.在“l”形铁丝框架上有一可以自由滑动的细铁丝ab,如图所示.铁丝长L=20 cm,框上布着液膜.使液膜表面积增加ΔS=200 cm2,需要做多少功?(液体表面单位长度上的表面张力α=72×10-3N/m,摩擦可以不计)17.冬季某天,日间气温6 ℃时的相对湿度是65%,如果夜间最低气温是-3 ℃,那么,空气中的水蒸气会不会成为饱和汽?为什么?(设绝对湿度不变,6 ℃时水蒸气的饱和汽压p s1=9.34×102Pa,-3 ℃时水蒸气的饱和汽压为p s2=5.68×102Pa)18.把0.5千克处于熔点的液态铅倒入1千克22 ℃的水中,铅在水中凝固过程中,水温升高并有一部分水变成100 ℃的水蒸气.如果最终铅和余下水的温度都是27 ℃,那么变成水蒸气的水有多少?(铅的熔点是327 ℃,熔化热λ=2.5×104焦/千克,比热c=125焦/千克·℃;100 ℃水的汽化热L=2.25×106焦/千克).答案1.【答案】C2.【答案】A【解析】单晶体内的原子按一定规律排列,因此具有规则的几何外形,在物理性质上有各向异性,A正确;这种微观结构不能解释晶体能溶于水、晶体的导电性、机械强度,也不能解释非晶体的各向同性.3.【答案】B【解析】选项A中的饱和汽压应改为“同一温度”下的饱和汽压(因为不同温度下的饱和汽压的值不等),A错误;选项B中所述的情况,就是相对湿度对人的生活造成影响的一个例子,B正确;两温度计示数差值越大,说明湿泡温度计上的水蒸发得越快,空气越干燥,C错误;若空气相对湿度大,尽管气温不高人们也会感到闷热,D错误。
物理化学第九章自测题

第九章自测题一、选择题1.下列两反应所对应电池的标准电动势分别为θ1E 和θ2E :(1))1()(21)(2122===+a HCl p Cl p H θθ (2))()()1(222θθp Cl p H a HCl +===则两个θE 的关系为( )。
(a )θ2E =2θ1E (b )θ2E = -θ1E (c ) θ2E = -2θ1E (d ) θ2E =θ1E2.298K 时,要使下列电池成为自发电池,Na(Hg)(a 1)| Na +(aq)|Na(Hg)(a 2)则必须使两个活度的关系为( )。
(a )a 1 < a 2 (b )a 1 = a 2 (c )a 1 > a 2 (d )a 1和a 2可取任意值3.298K 时,已知V Fe Fe 771.023=++θϕ,V SnSn 150.024=++θϕ,则反应2Fe 3+ + Sn 2+==2Fe 2+ + Sn 4+ 的θ∆m r G 为(设活度因子均为1)( )。
(a )-268.7kJ ⋅mol -1 (b )-177.8kJ ⋅mol -1 (c )-119.9kJ ⋅mol -1 (d )119.9kJ ⋅mol -14.某电池在298K 和p θ压力下,可逆放电的热效应为Q R = -100J ,则该电池反应的m r H ∆值应为( )。
(a )100J (b )-100J (c )>100J (d )<-100J5.已知Tl 3+,Tl +| Pt 的电极电势V 250.11=θϕ,Tl + | Tl 的电极电势V 336.02-=θϕ,则电极Tl 3+| Tl 的电极电势θϕ3为( )。
(a )0.305V (b )0.721V (c )0.914V (d )1.586V6.298K 时有如下两个电池:(1)Cu(s) | Cu +(a 1)||Cu +(a 1), Cu 2+(a 2) | Pt(2)Cu(s) | Cu 2+(a 2)||Cu +(a 1), Cu 2+(a 2) | Pt两个电池的电池反应都可写成Cu(s)+ Cu 2+(a 2)==2Cu +(a 1)则两个电池的θE 和θ∆m r G 之间的关系为( )。
物理化学第九章模拟试卷C

物理化学第九章模拟试卷C1物理化学第九章模拟试卷C班级 姓名 分数一、选择题 ( 共10题 20分 ) 1. 2 分已知:(1) Cu │Cu 2+(a 2)‖Cu 2+(a 1)│Cu 电动势为 E 1(2) (2) Pt │Cu 2+(a 2),Cu +(a ')‖Cu 2+(a 1),Cu +(a ')│Pt 电动势为 E 2,则: ( )(A) E 1= 12E 2 (B) E 1= 2 E 2 (C) E 1= E 2 (D) E 1≥ E 22. 2 分298 K 时,已知 φ∃ (Fe 3+,Fe 2+)=0.77 V , φ∃ (Sn 4+,Sn 2+)=0.15 V , 当这两个电极组成自发电池时, E ∃为: ( ) (A) 1.39 V (B) 0.62 V (C) 0.92 V (D) 1.07 V3. 2 分某电池电动势与温度的关系为: E /V = 1.01845 - 4.05×10-5 (t /℃ - 20) - 9.5×10-7(t /℃ - 20)2298 K 时,电池可逆放电 ,则: ( ) (A) Q > 0 (B) Q < 0 (C) Q = 0 (D) 不能确定4. 2 分在电极─溶液界面处形成双电层,其中扩散层的厚度 δ 与溶液中相关离子浓度m 的 大小关系是: ( ) (A) m 增大,δ 增大 (B) m 增大,δ 变小 (C) 两者无关 (D) 两者关系不确定5. 2 分已知E 1∃(Fe 3+|Fe) = - 0.036 V , E 2∃(Fe 3+|Fe 2+) = 0.771 V , 则E 3∃(Fe 2+|Fe)值为:( ) (A) - 0.807 V (B) - 0.4395 V (C) - 0.879 V (D) 0.807 V6. 2 分有两个电池,电动势分别为E 1和E 2: H 2(p ∃)│KOH(0.1 mol ·kg -1)│O 2(p ∃) E 1H 2(p ∃)│H 2SO 4(0.0l mol ·kg -1)│O 2(p ∃) E 2比较其电动势大小: ( ) (A) E 1< E 2 (B) E 1> E 2 (C) E 1= E 2(D) 不能确定物理化学第九章模拟试卷C7. 2 分下列电池不属于浓差电池的是:()(A) (A) Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2)(B) (B) Na(Hg)(a)|NaCl(m1)|| NaCl(m2)|Na(Hg)(a)(C) (C) Na(Hg)(a)| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)(a)(D) (D) Ag(s)|AgCl(s)|NaCl(aq)|Na(Hg)(a)|NaCl(CH3CN溶液)|Na(s)8. 2 分298 K时, 电池反应为Zn(s)+Ni2+(a1=1)=Zn2+(a2)+Ni(s) 的电池的电动势为0.54 V, 已知φ∃ (Zn2+,Zn)=-0.763 V, φ∃ (Ni2+,Ni)=-0.250 V, 则Zn2+的活度a2为:( )(A) 0.08 (B) 0.06(C) 0.12 (D) 0.049. 2 分某电池在等温、等压、可逆情况下放电,其热效应为Q R,则: ( )(A) Q R=0 (B) Q R=∆H(C) Q R=T∆S(D) Q R=∆U*. 2 分298 K 时,在下列电池Pt│H2(p∃)│H+(a=1)‖CuSO4(0.01 mol·kg-1)┃Cu(s)右边溶液中加入0.1 mol·kg-1 Na2SO4溶液时(不考虑稀释效应), 则电池的电动势将:( )(A) 上升(B) 下降(C) 基本不变(D) 无法判断二、填空题( 共9题18分)11. 2 分下列两个反应:Pb(Hg) ─→Pb2+(a) + 2e-+ Hg(l)Pb ─→Pb2+(a) + 2e-其电极电势公式分别为及,这两个反应相应的φ及φ∃是否相同?12. 2 分将反应Cl-(a1)→Cl-(a2)设计成电池的表示式为:__________________________________________。
物理化学实验模拟试卷C

物理化学实验模拟试卷C班级姓名分数一、选择题( 共10题20分)1. 2 分开启气体钢瓶的操作顺序是:( ) (1) 顺时针旋紧减压器旋杆; (2) 反时针旋松减压旋杆;(3) 观测低压表读数;(4) 观测高压表读数;(5) 开启高压气阀(A) 5─4─3─1 (B) 2─5─4─1─3(C) 1─5─4─2─3 (D) 2─5─12. 2 分在测定H2O2在KI水溶液中均相催化分解速率常数时, 加入(1) H2O2, (2) KI溶液的方法是:( )(A) (1), (2)同时一起加入(B) 先(1), 后(2)(C) 先(2), 后(1) (D) 不必注意加入的方法3. 2 分在双液系气液平衡实验中, 常选择测定物系的折光率来测定物系的组成。
下列哪种选择的根据是不对的? ( )(A) 测定折光率操作简单(B) 对任何双液系都能适用(C) 测定所需的试样量少(D) 测量所需时间少, 速度快4. 2 分已知环己烷、醋酸、萘、樟脑的摩尔凝固点降低常数K f 分别为6.5, 16.60, 80.25及173, 今有一未知物能在上述四种溶剂中溶解, 欲测定该化合物之摩尔质量, 最适宜的溶剂是:( )(A) 萘(B) 樟脑(C) 环己烷(D) 醋酸5. 2 分饱和标准电池在20℃时电动势为:( )(A) 1.01845 V(B) 1.01800 V(C) 1.01832 V(D) 1.01865 V6. 2 分使用分光光度计测量吸光度D,为了使测得的D更精确,则应:( )(A) 在最大吸收波长进行测定(B) 用比较厚的比色皿(C) 用合适浓度范围的测定液(D) 选择合适的波长,比色皿及溶液浓度,使D值落在0 ~ 0.8 区间内7. 2 分用对消法测量可逆电池的电动势时,如发现检流计光标总是朝一侧移动,而调不到指零位置,与此现象无关的因素是:( )(A) 工作电源电压不足(B) 工作电源电极接反(C) 测量线路接触不良(D) 检流计灵敏度较低8. 2 分在差热分析中, 都需选择符合一定条件的参比物, 对参比物的要求中哪一点应该除外? ( )(A) 在整个实验温度范围是热稳定的(B) 其导热系数与比热尽可能与试样接近(C) 其颗粒度与装填时的松紧度尽量与试样一致(D) 使用前不能在实验温度下预灼烧9. 2 分具有永久磁矩μm的物质是:( )(A) 反磁性物质(B) 顺磁性物质(C) 铁磁性物质(D) 共价络合物*. 2 分在氧弹实验中, 若测得∆c H m=-5140.7 kJ·mol-1, ∆│∆H│最大=25.47 kJ·mol-1,则实验结果的正确表示应为: ( )(A) ∆c H m= -5140.7 kJ·mol-1(B) ∆c H m= -5140.7±25.47 kJ·mol-1(C) ∆c H m= -(5.1407±0.02547)×103 kJ·mol-1(D) ∆c H m= -5140.7±25.5 kJ·mol-1二、填空题( 共9题18分)11. 2 分具有何种特性的电解质可用来作盐桥,常用作盐桥的电解质有______ 和________ 等。
(完整word版)《物理化学》高等教育出版(第五版)第九章

第九章电解质溶液练习题一、判断题:1.溶液是电中性的,正、负离子所带总电量相等,则正、负离子离子的迁移数也相等。
2.离子迁移数与离子速率成正比,某正离子的运动速率一定时,其迁移数也一定。
3.离子的摩尔电导率与其价态有关系。
4.电解质溶液中各离子迁移数之和为1。
5.电解池通过l F电量时,可以使1mol物质电解。
6.因离子在电场作用下可以定向移动,所以测定电解质溶液的电导率时要用直流电桥。
7.无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
8.电解质的无限稀摩尔电导率Λ∞m可以由Λm作图外推到c1/2 = 0得到。
下列关系式是否正确:(1) Λ∞,1<Λ∞,2<Λ∞,3<Λ∞,4(2)κ1=κ2=κ3=κ4(3)Λ∞,1=Λ∞,2=Λ∞,3=Λ∞,4(4)Λm,1=Λm,2=Λm,3=Λm,410.德拜—休克尔公式适用于强电解质。
11.对于BaCl2溶液,以下等式成立:(1) a = γb/b0;(2) a = a+·a - ; (3) γ± = γ+·γ - 2;(4) b = b+·b-;(5) b±3 = b+·b-2; (6) b± = 4b3。
12.若a(CaF2) = 0.5,则a(Ca2+) = 0.5 ,a(F-) = 1。
二、单选题:1.下列溶液中哪个溶液的摩尔电导最大:(A) 0.1M KCl水溶液;(B) 0.001M HCl水溶液;(C) 0.001M KOH水溶液;(D) 0.001M KCl水溶液。
2.对于混合电解质溶液,下列表征导电性的量中哪个不具有加和性:(A) 电导;(B) 电导率;(C) 摩尔电导率;(D) 极限摩尔电导。
3.在一定温度和较小的浓度情况下,增大强电解质溶液的浓度,则溶液的电导率κ与摩尔电导Λm变化为:(A) κ增大,Λm增大;(B) κ增大,Λm减少;(C) κ减少,Λm增大;(D) κ减少,Λm减少。
《物理化学(第五版)》第九章复习题答案
复习题
8.有哪些求算标准电动势EΘ的方法?在公式E zF ln K 中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
zE F K exp RT
a
复习题
(8).醋酸的解离平衡常数。 电池:Pt|H2(pΘ)|HAc(mHAc),Ac-(mAc-),Cl-(aCl)|AgCl(s)|Ag(s) 净反应:AgCl(s)+H2(pΘ)→H+(aH+)+Cl-(aCl-) +Ag(s
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题? 答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如: Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极 反应所依附的惰性金属。
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
物理化学课后答案第9章电解与极化作用
利用氢在电极上的超电势,可以使比氢活泼的金 属先在阴极析出,这在电镀工业上是很重要的。
例如,只有控制溶液的pH,利用氢气的析出有超 电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。
上一内容 下一内容 回主目录
返回
4/3/2020
氢气在几种电极上的超电势
金属在电极上析出时超电势很小,通常可忽略不 计。而气体,特别是氢气和氧气,超电势值较大。
判断在阴极上首先析出何种物质,应把可能发生还 原物质的电极电势计算出来,同时考虑它的超电势。电 极电势最大的首先在阴极析出。
E(Mz+|M) E (Mz+, M) RT ln 1 zF aMz+
E(H+|H) RT F
ln 1 aH+
H2
上一内容 下一内容 回主目录
返回
4/3/2020
9.3 电解时电极上的反应
上一内容 下一内容 回主目录
返回
4/3/2020
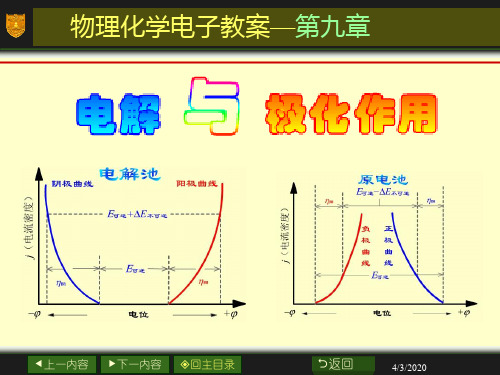
极化曲线(polarization curve)
η阳
E可逆 -ΔE不可逆
η阴
j(电流密度)
负
正
极
极
曲
曲
线
线
E可逆
电位
电解池中两电极的极化曲线
上一内容 下一内容 回主目录
返回
4/3/2020
氢超电势
电解质溶液通常用水作溶剂,在电解过程中,H+ 在阴极会与金属离子竞争还原。
用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析。
上一内容 下一内容 回主目录
返回
4/3/2020
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
完整word版,物理化学第九章模拟试卷C编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(完整word版,物理化学第九章模拟试卷C)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为完整word版,物理化学第九章模拟试卷C的全部内容。
物理化学第九章模拟试卷C一、选择题(共10题 20分)1。
极谱分析中加入大量惰性电解质的目的是: ()(A) 增加溶液电导(B) 固定离子强度(C) 消除迁移电流 (D)上述几种都是2。
用铜电极电解 0.1mol·kg—1的 CuCl2水溶液,阳极上的反应为( ) (A) 2Cl—─→ Cl2+ 2e- (B) Cu ─→ Cu2++ 2e—(C) Cu ─→ Cu++ e- (D) 2OH-─→ H2O + 12O2+ 2e-3。
极谱分析仪所用的测量阴极属于下列哪一种? ( ) (A)浓差极化电极(B)电化学极化电极 (C)难极化电极(D)理想可逆电极4. 电解金属盐的水溶液时, 在阴极上:()(A) 还原电势愈正的粒子愈容易析出(B)还原电势与其超电势之代数和愈正的粒子愈容易析出(C) 还原电势愈负的粒子愈容易析出(D)还原电势与其超电势之和愈负的粒子愈容易析出5. 电解时,在阳极上首先发生氧化作用而放电的是: ( )(A) 标准还原电势最大者(B) 标准还原电势最小者(C) 考虑极化后,实际上的不可逆还原电势最大者(D) 考虑极化后,实际上的不可逆还原电势最小者6。
298 K、0。
1 mol·dm—3的 HCl 溶液中,氢电极的热力学电势为 -0。
06 V,电解此溶液时,氢在铜电极上的析出电势f H2为:()(A) 大于—0.06 V (B)等于—0.06 V (C) 小于—0.06 V (D) 不能判定7。
电池在恒温、恒压及可逆情况下放电,则其与环境的热交换为 ( )(A)D r H (B) T D r S(C) 一定为零 (D) 与D r H与T D r S均无关8。
电解混合电解液时,有一种电解质可以首先析出,它的分解电压等于下列差值中的哪一个?式中f平,f阴和f阳分别代表电极的可逆电极电势和阴、阳极的实际析出电势。
()(A)f平,阳-f平,阴 (B) f阳 + f阴(C) f阳(最小) -f阴(最大)(D) f阳(最大) -f阴(最小)9。
以石墨为阳极,电解 0。
01 mol·kg-1 NaCl 溶液,在阳极上首先析出: ( )(A) Cl2(B) O2 (C) Cl2与 O2混合气体(D) 无气体析出已知:f$(Cl2/Cl-)= 1.36 V ,h(Cl2)= 0 V ,f$ (O2/OH-)= 0。
401V ,h(O2) =0.8 V 。
*. 298K,101。
325 kPa 下,以 1 A 的电流电解 CuSO4溶液,析出 0。
1 mol 铜,需时间大约是: ( )(A) 20。
2 h (B) 5。
4 h (C) 2。
7 h (D) 1.5 h二、填空题 ( 共 9题 18分)11. 将一 Pb 酸蓄电池在 10。
0 A 电流下充电 1。
5 h,则 PbSO4分解的质量为。
(已知M(PbSO4)= 303 g·mol—1 ) 12.在锌电极上,H2的超电势为 0.75 V,电解一含Zn2+的浓度为 1×10—5 mol·kg-1的溶液,为了不使H2(g)析出,问溶液的 pH 值应控制在______.已知25℃时,f$(Zn2+/Zn)= -0.763 V 。
13. 电极表面反应速率r与电流密度j之间应满足_______________关系。
14。
电池 Pb(s)│H2SO4(m)│PbO2(s),作为原电池时,负极是,正极是;作为电解池时,阳极是,阴极是。
15. 电池放电时,随电流密度增加阳极电位变 ________,阴极电位变 ________,正极变 ________ ,负极变_____.16。
采用三电极装置研究超电势时, 一般采用鲁金毛细管,其作用为________________,采用搅拌其作用为_______________________________。
17. 铜板上有一些铁的铆钉, 长期暴露在潮湿的空气中,在__________部位特别容易生锈。
18。
已知f$(Fe2+/Fe)= -0。
440 V,f$ (Cu2+/Cu) = 0.337 V,在 25℃,p$时,以Pt 为阴极,石墨为阳极,电解含有 FeCl2(0.01 mol·kg—1)和 CuCl2(0.02 mol·kg-1)的水溶液,若电解过程不断搅拌溶液,且超电势可忽略不计,则最先析出的金属是 ______。
19。
已知电极(1)Pt│H2, H+,(2) Pt│Fe3+, Fe2+,和(3)Pb│H2, H+的交换电流密度j e分别为:(1) 0.79 mA·cm-2; (2) 2。
5 mA·cm—2; (3) 5.0×10-12 A·cm—2。
当它们在298 K处于平衡态时,每秒有多少电子或质子通过双电层被输送? (1) _____________cm—2·s-1;(2) _____________cm-2·s-1;(3) _____________cm—2·s—1。
三、计算题 ( 共 5题 40分)20. 298 K 时,用铂电极电解 1 mol·dm-3的 H2SO4(不考虑活度系数):(1) 计算理论分解电压(2)若两电极面积均为 1cm2,电解液电阻为 100 W,H2和O2的超电势h(V) 与电流密度j(A·cm—2) 的关系分别为h H2= 0。
472 + 0.118 lg j h O2= 1.062 + 0.118 lg j问当通过的电流为 1 mA 时,外加电压为若干?已知:f$ (O2,H2O,H+) = 1。
229 V 。
21. 金属的腐蚀是氧化作用,金属作原电池的阳极,在不同的 pH 条件下,水溶液中可能有下列几种还原作用:酸性条件: 2H3O+ + 2e—= 2H2O + H2(p$) O2(p$) + 4H+ + 4e-→ 2H2O 碱性条件: O2(p$) + 2H2O + 4e-→ 4OH-所谓金属腐蚀是指金属表面附近能形成离子浓度至少为 1×10-6 mol·kg—1.现有如下6 种金属:Au,Ag,Cu,Fe,Pb 和 Al,试问哪些金属在下列 pH 条件下会被腐蚀:(甲)强酸性溶液 pH = 1 (乙) 强碱性溶液 pH = 14 (丙)微酸性溶液 pH = 6 (丁)微碱性溶液 pH = 8 设所有活度系数均为 1.已知f$(Al3+/Al)= -1.66 V,f$ (Cu2+/Cu)= 0.337 V, f$ (Fe2+/Fe)= -0。
440V ,f$(Pb2+/Pb)= —0。
126 V,f$(Au+/Au)= 1.50 V..22。
298 K时,用Pt阳极Cu阴极电解0。
10 mol·dm—3 CuSO4溶液,电极的面积为50cm2, 电流保持在0.040 A, 并采取措施,使浓差极化极小. 若电解槽中含1dm3溶液,试问至少电解多少时间后, H2才会析出? 此时剩余Cu2+的浓度为多少?设活度系数均为1。
已知氢在铜上之h=a+blg j, a=0.80 V, b=0。
115 V,f$(Cu2+/ Cu) =0。
337 V。
23. 求在 Fe 电极上,自 1mol·kg—1 KOH 水溶液中,每小时电解出氢 100 mg·cm—2时应维持的电势(氢标)。
(已知: a = —0。
76 V,b = -0.11V)24。
若氢在 Cd、Hg 电极上的超电势,在所讨论电流密度范围内服从塔菲尔公式h = a +blg j。
对于这两个电极, 其 b 值都为 0。
118 V,但两电极的 a 值不同。
氢在这些电极上析出时的传递系数a均为 0.5.电极反应得失电子数均为 1。
氢在 Cd 和 Hg 上的交换电流j。
分别是 1×10-7A·m-2和 6×10-9 A·m—2.求在 298 K时,两电极通过相同的电流密度情况下,氢在 Hg、Cd 两电极上的超电势的差值。
四、问答题(共 3题 20分)25。
(1) 试导出同一电极反应在不同的超电势时,反应速率(即电流密度j)之比的表达式;(2) 25℃时,1 mol·dm—3的KOH溶液用镀铂黑的铂电极电解,使它在阳极上产生O2,当超电势为0。
4V时,电流密度j=10—3 A·cm-2,若超电势为0。
6 V,j为多少?(设对称因子或传递系数b=0.5)26. 298 K 时,某钢铁容器内盛 pH = 4.0 的溶液,试通过计算说明此时钢铁容器是否会被腐蚀?假定容器内 Fe2+浓度超过 10-6 mol·dm—3时,则认为容器已被腐蚀。
已知:f$ (Fe2+/Fe) = —0。
4402 V,H2在铁上析出时的超电势为 0。
40 V。
27. 试述电极过程产生超电势的原因。
参考答案一、选择题(共10题 20分 )1。
(C) 2. (B) 3。
(A) 4. (B) 5。
(D) 6。
(C) 7. (B) 8. (C) 9。
(A)*。
(B)二、填空题 ( 共 9题 18分 )11. PbO2+ Pb + 2H2SO4= 2PbSO4+ 2H2O(10 A×1.5×3600 s)/(96500 C·mol—1 )×1/2×303 g·mol-1 = 84。
8g 12. 若f (Zn2+/Zn) > f (H+/H2) 时,则 Zn 析出,而 H2不能析出,即—0。
763 - 0。
05917/2×lg (1/10—5) > (—0。
0591pH —0。
75) pH > 2.72 13。
j = nFr14. Pb│H2SO4(m) PbO2│H2SO4(m) Pb│H2SO4(m) PbO2│H2SO4(m)15. 正,负,负,正16.降低电阻超电势; 降低浓差超电势. 17.铆钉18。
f(Fe2+/Fe) = f$+ RT/2F× ln 0.01 = -0.4992 Vf(Cu2+/Cu) = f$+ RT/2F× ln 0.02 = 0。
