第十六章d区元素(一)
无机分析12第十六章d区元素

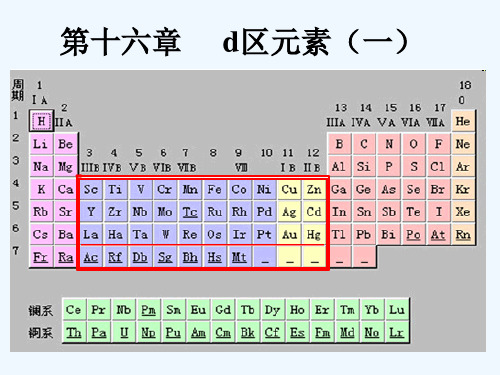
Fe2+
浅绿色
Co2+
酒红色
Ni2+
绿色
Cu2+
蓝色
Zn2+
无色
上页 下页 目录 返回
许多二价过渡元素金属离子 M 2+ (aq)的 颜色与d-d 跃迁或 f-f 跃迁有关。这种 跃迁发生在金属离子本身,通常强度都 很弱,不能解释无机颜料的颜色。副篇 介绍了荷移跃迁和价层间跃迁。
第一过渡系金属水合离子的颜色
●熔点、沸点高
同周期元素单质的熔 点,从左到右一般是先逐渐
升高,然后又缓慢下降。在
同一族中,第二过渡系元素 的单质的熔点、沸点大多高 于第一过渡系,而第三过渡 系的熔点、沸点又高于第二 过渡系(第 3 族除外),熔点 最高的单质是钨。 熔点最高的单质: 钨(W) 3683±20℃
上页 下页 目录 返回
(4)
金属元素的电极电势
φθ的单位为V
元素
Ca -2.87 Sc Ti V Cr Mn Fe Co Ni Cu 0.34 Zn -0.76
φθ(M2+/M)
Φθ (M3+/M2+)
- -1.63 -1.18
-0.91 -1.18 -0.44 -0.28 -0.23
-
-
-0.37 -0.256 -0.41 +1.51
d 电子组态 M2+(aq)
d1 d2 Sc2+ Ti2+
d3 d4 V2+ Cr2+
d5 d6 d7 Mn2+ Fe2+ Co2+
d8 d9 d10 Ni2+ Cu2+ Zn2+
稳 定 性 增 大
第十六章+d+区元素

Cr2O3 (铬绿)
绿色
CrCl3·6H2O
紫色
KCr(SO4)2·12H2O 暗紫色
198
975 398 2330 83 89
Cr2O3 (铬绿)
受热时的变化 250℃分解为
Cr2O3与O2 熔融不分解
熔融不分解
不分解
失去结晶水
失去结晶水
水溶液中铬的各种离子
颜色
Cr2O
27
橙红
CrO
24
黄
Cr3+(aq) 紫
NH3 冷却
(NH4)2Cr2O7
K2Cr2O7 KCl,浓H2SO4 CrO2Cl2(氯化铬酰) 浓H2SO4, SO2 KCr(SO4)2·12H2O(铬钾矾)
浓HCl
CrCl3·H2O
K2Cr2O7 H2SO 4 (浓) K2SO 4 2CrO 3 (s) H2O
(暗红色,针状)
Cr(OH)
4
H2O Cr2O3 (绿)
(3)
Cr(H
2O)
3的水解
6
[Cr(H2O)6]3+ [Cr(OH)(H2O)5]2+ + H+ K 10-4
2[Cr(H2O)6]3+ [(H2O)4Cr(OH)2Cr (H2O)4]4+
+ 2H+ +2H2O K 10-2.7
2Cr3 3S2 6H2O Cr(OH)3(s) 3H2S(g) 2Cr3 3CO32- 3H2O 2Cr(OH)3(s) 3CO2 (g)
MnSO4和MnCl2。 除MnO2外,余者均易溶于水,相应 含锰离子分别为:MnO4,MnO24和Mn 2。
无机化学课件16-d区元素(一)

Cr -0.90
稀 HCl H2SO4
Cu +0.339
HNO3,浓 热 H2SO4
Mn
-1.18
稀 HCl H2SO4
等 Zn
-0.762
稀 HCl H2SO4
等
精品
1. 第一过渡系的单质比第二过渡系的单质 活泼; 例:第一过渡系除Cu外均能与稀酸作用, 第二、三过渡系仅能溶于王水、 氢氟酸,而Ru,Rh,Os,Ir不溶于王水。
EB
/
V
CrO
2 4
-0.12
Cr(OH)
4
-1.1
Cr(OH) 2
-1.4
Cr
-1.3
酸性溶液中, Cr2O CrO24 无氧化性
2 7
有强氧化性碱性溶液中,
酸性溶液中, Cr3+稳定
碱性溶液中, [Cr(OH)4]-有还原性
无论酸性或碱性溶液,Cr(Ⅱ)均不稳定
精品
1.铬(Ⅵ)的化合物
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
第十六章 d区元素(一)
§16.1 d区元素概述 §16.2 钛 钒 §16.3 铬 钼 钨 多酸型配合物 §16.4 锰 §16.5 铁 钴 镍 *§16.6 铂系元素简介 *§16.7 金属有机化合物
精品
族 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠBⅡB
周
钪 钛钒铬 锰 分 分分分 分
铜锌 分分
期 族族族族族
精品
16.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W, Sg 价层电子构型:(n-1)d 4-5ns1-2
灰白色金属,熔沸点高,硬度大。 表面易形成氧化膜。
室温时纯铬溶于稀HCl,H2SO4,在浓 HNO3中钝化。高温下与活泼的非金属及 C,B,N反应。
第十六章d区元素一

第十六章d区元素(一)[教学要求]1.了解过渡元素的原子结构特征和通性。
2.了解钛、钒及其重要化合物的性质。
3.了解铬单质的性质。
掌握Cr(Ⅲ)、Cr(Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。
*了解钼、钨的重要化合物。
4.掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质。
5.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律。
掌握Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律。
熟悉铁、钴、镍的重要配合物。
[教学重点]1.过渡元素的价电子构型特点及其与元素通性的关系。
2.Ti、V、Cr、Mn、Fe、Co、Ni的单质及化合物的性质。
[教学难点]第四周期d区金属元素氧化态、最高氧化态氧化物及其水合氧化物的酸碱性、氧化还原稳定性、水合离子以及含氧酸根颜色等变化规律。
[教学时数]10学时[主要内容]1.第一过渡系元素的基本性质。
2.Ti、TiO2、H4TiO4、TiCl4、TiCl3的性质。
3.V、V2O5、钒酸盐和多钒酸盐的性质。
4.Cr的性质,Cr(III)、Cr(VI)化合物的性质。
5.Mn的性质,Mn(II)、Mn(IV)、Mn(VI)、Mn(VII)化合物的性质。
6.Fe、Co、Ni的单质及化合物的性质和用途。
[教学内容]§16.1 d区元素概述16.1.1 d区元素概述1.d区元素在周期表中的位置d区元素(d区金属):周期表中具有部分填充d壳层电子的元素.第一过渡系:周期表中第四周期的d区(3d)元素包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni.第二过渡系:周期表中第五周期的d区(4d)元素包括Zr、Nb、Mo、Tc、Ru、Rh、Pd.第三过渡系:周期表中第六周期的d区(5d)元素包括Hf、Ta、W、Re、Os、Ir、Pt.第四过渡系:周期表中锕(89号)到112号元素。
镧系元素:镧(57号)和镥( 71号)之间的15种元素。
无机化学大连理工第十六章-d区元素(一)-习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
《d区元素》PPT课件

精选PPT
11
• ②第一过渡系列的低氧化态化合物具有还 原性
TiCl2 +TiOCl2 +H2
4CrCl2 +4HCl +O2 == 2CrCl3 +2H2O 2V2VO2 (aq)
Cr3/ Cr2 = 0.41V
VO2 / V2 = 0.05V
2CrCl2 +2HCl== 2CrCl3 +H2
==TiO2·XH2O + 4C4H9OH
精选PPT
22
• 钛的检验: • 以H2SO4—HCl溶解式样生成TiO2+ • TiO2+ +H2O2 ==[TiO(H2O2)]2+ • 3TiO2+ +Al +6H+ ==3Ti3+ +Al3+ +3H2O • Ti3+ +Fe3+ +H2O ==TiO2+ +Fe2+ +2H+ • 以FeCl3滴定,NH4SCN(aq)作指示剂
第十六章 d区元素(过渡)元素
IIIB —VIII 25个元素 (n-1)d 1-9ns1-2
Sc Ti V Cr Mn Fe Co Ni
Y Zr Nb Mo Tc Ru Rh Pd
La Hf Ta W Re Os
Ir Pt
Ac
精选PPT
1
§16—1过渡金属元素的通性
• 第一过渡系列 3d1-84s2 例外Cr : 3d54s1
精选PPT
16
• 三、钼的冶炼
• 辉钼矿 MoS2
• 灼烧 MoS2+2O2 == 2MoO3 +4SO2
大学无机化学d区元素介绍
3.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大 (3) 密度大
熔点: 3410℃ 沸点: 5900℃
硬度最大的金属:铬(Cr)
以金刚石为10,铬为9
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
22.7gcm-3
4.离子呈现多种颜色
物质显色的原因是由于可见光作用到物质上以后物质
12.2.3(2)钒的化学性质
•价电子层结构3d34s2,主要氧化态+5,也能形成氧化态为 +4,+3,+2的化合物。化学性质相当复杂。
VO2+ 1.0 VO2+ 0.36 V3+
-0.25
-0.25
V2+ -1.2 V
17
12.2.3(3)钒的氧化物(V2O5)
•酸碱性: VO碱O2+ 2C +2Cl2 = TiCl4 +2CO 四氯化钛是无色液体,有剌鼻的气味,极易水解, 在潮湿的空气中由于水解而发烟——利用此反应可 制造烟幕:
•TiCl4高温氧化制备优质钛白——氩气氛保护下得Ti: TiCl4(l) +Mg = Ti +2MgCl2
16
12.2.3(1) 钒
•钒在地壳中的含量比锌、铜、铅等普通元素还要多,但分 布很分散,属稀有元素。 •钒被广泛用于制造特种钢和催化剂。
在钛的化合物中,以+4氧 化态的化合物最稳定。二 氧化钛在自然界中有三种 晶型:金红石、锐钛矿和 板钛矿。其中最重要的是 金红石,天然金红石中因 含少量杂质而呈红色或橙 色。
金红石的结构
13
12.2.1(3) 化学性质
•室温下金属钛较稳定,但受热时,钛可与许多非金属,如: 氧、氮、碳、卤素等反应。 •钛在室温下不能与水或稀酸反应,但可溶于浓盐酸或热的 稀盐中形成三价钛离子:
湖南理工学院无机化学习题库第16章d 区元素(一)

第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
第16章d区1资料

16.1 d 区元素概述
16.2 钛 钒 16.3 铬 钼 钨 多酸型配合物 16.4 锰 16.5 铁 钴 镍
无机化学
16.1 d区元素概述
16.1 d 区元素概述
16.1.1 d 区元素通性
16.1.2 羰合物和烯烃配合物简介
无机化学
16.1 d区元素概述
16.1.1 d 区元素通性
无机化学
同副族 上下 不规律
16.1 d区元素概述
3.物理性质
⑴ 熔点、沸点高 熔点最高的单质:钨(W)
⑵ 硬度大
硬度最大的金属:铬(Cr)
⑶ 密度大
密度最大的单质:锇(Os)
⑷ 导电性、导热性、延展性好
无机化学
16.1 d区元素概述
熔点变化示意图
无机化学
16.1 d区元素概述
密度变化示意图
2 性质
(1)灰白色, 熔点沸点高,硬度大
(2)活泼金属,表面已形一层成氧化膜,活泼 性下降 (3)无膜金属与酸的反应
Cr + 2H+(稀) → Cr3+(蓝) + H2 O2 Cr 3 (紫)
2Cr 2H 2SO4 (浓) Cr(2 SO4)3 3SO2 H2O 在冷、浓硝酸中钝化
Ni
Cr
-0.86
稀 HCl H2SO4
Cu
-0.25
+0.34
稀 HCl H2SO4 等
HNO3,浓热 H2SO4
Mn
-1.17
稀 HCl H2SO4 等
Zn
-0.763
稀 HCl H2SO4 等
单质的活泼性 :同周期 左右 降低
无机化学
d区元素课件

d区元素
§16.1 铜族元素
一.铜族元素的单质 1.存在 单质:Cu, Ag, Au 矿物:孔雀石:Cu2(OH)2CO3
辉银矿:Ag2S 碲金矿:AuTe2 砂金
2.物理性质 (1) 特征颜色:Cu,Ag, Au (2) 溶、沸点较其它过渡金属低 (3)导电性、导热性好,金属中居首位
Ag>Cu>Au
电解铜,99.9%;电解铝,99.5%。
(4) 金属光泽,延展性好
金可作首饰,编织成各 种形状。一克金能抽成 3公里长的丝,金箔可做 成0.0001 mm的薄片。
3.化学性质 (1) 与O2作用
碱式碳酸铜 Au Ag不与O2发生反应, 当有沉淀剂或配合剂存在时,可反应。
Cu,Ag,Au单质活性依次下降, Cu,Ag可溶 于氧化性酸, Au只溶于王水。
§16.2 锌族元素
一、锌族元素的单质
存在 闪锌矿:ZnS,
(1) 低熔点
物 理
Zn:419℃
性
Cd:321℃
辰砂:HgS 富山事件
质
Hg:-39℃ 日本九州水俣事件
(2) 易形成合金
黄铜:Cu-Zn
汞齐:Na-Hg、Au-Hg、Ag-Hg
化学性质 (1) 与O2的作用:(在干燥空气中稳定) 潮湿:
二、 铜族元素的化合物
1价铜离子d10结构,其化合物难溶于水,固 态时比2价铜的化合物稳定。
难溶物:
CuCl CuBr CuI CuSCN CuCN Cu2S
K
sp
大
小
铜的配合物
Cu(I)的配合物多为2配位
配合物:CuCl2-,CuBr2-,CuI2-,Cu(SCN)2-,Cu(CN)2-
d区元素1

KCl,浓H2SO4
K2Cr2O7
浓H2SO4, SO2 浓HCl
KCr(SO4)2· 2O(铬钾矾) 12H
CrCl3· 2O H
(暗红色,针状)
K2Cr2O7 + H2SO 4 (浓) K2SO 4 + 2CrO3 (s) + H2O
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化 •H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
②不稳定性
(见光)遇酸
4MnO + 4H (微酸) 4MnO2 + 3O2 + 2H2O
4 +
浓碱 24MnO4 + 4OH 4MnO4 + O2 + 2H2O 加热 2KMnO4 220CK2MnO4 + MnO2 (s) + O2
锰(Ⅵ)的化合物 K2MnO4暗绿色晶体,在强碱性溶液存在。 在酸性、中性溶液中歧化
24
(4) K2Cr2O7的氧化性
2 + 3SO3 - + 8H+ Cr2 O 27
+ 2Cr3+ + 4H2 O 3SO 3S + 2Cr + 7H2 O
3+
24
Cr2 O + 3H2S + 8H
27
27
+
+ 6Fe2 + + 14H+ Cr2 O
K 2 Cr2 O7 (s) + 14HCl(浓)
3MnO2- + 4H+ MnO2 + 2MnO- + 2H2 O 4 4 3MnO + 2CO2 MnO2 + 2MnO + 2CO
北理无机化学:第十六章 D区元素(一)

第十六章 d区元素(一)
§16.1 d区元素通性
16.1.1 过渡元素与过渡系
1. 过渡元素 (Transition Element)
IIIB IVB VB VIB VIIB
VIII
IB IIB 电子层
21 22 23 24 25 26 27 28 29 30
Sc Ti V Cr Mn Fe Co Ni Cu Zn M 8
Ⅷ族元素的水平相关性 > 垂直相关性 铁系元素:Fe Co Ni 铂系元素:Ru Rh Pd , Os Ir Pt
第十六章 d区元素(一)
16.1.2 价层电子构型
§16.1 d区元素通性
(n-1)d1-10ns1-2
过渡元素的原子结构共同特点:
电子依次填充在(n-1)d轨道上,而 外层只有1-2个电子,易失去,所以它 们都是金属元素。
两性
两性
强酸性 强酸性 酸
性 Y(OH)3
Zr(OH)4 Nb(OH)5 H2MoO4 HTcO4 性
增 中强碱 两性 微碱
两性
弱酸性
酸性 增
强 La(OH)3
Hf(OH)4
Ta(OH)5 H2WO4
HReO4 强
强碱性 两性 微碱
两性
弱酸性 弱酸性
Ac(OH)3 强碱
第十六章 d区元素(一)
2. d区元素离子的颜色
但其它各族第五、六周期同族元素原子 半径相近。
第十六章 d区元素(一)
§16.1 d区元素通性
(2)原因—镧系(Ln)收缩(Lanthanide Contraction)
镧系元素的原子半径和Ln3+离子半径/pm
IIIB
21 Sc
原子序数
d 区金属(一)

Crystal-Field Theory
Crystal-Field Theory
• The complex metal ion has a lower energy than the separated metal and ligands. • However, there are some ligand-d-electron repulsions which occur since the metal has partially filled d-orbitals. • In an octahedral field, the degeneracy(简并) of the five d orbitals is lifted. • In an octahedral field, the five d orbitals do not have the same energy: three degenerate orbitals are higher energy than two degenerate orbitals. • The energy gap between them is called , the crystal field splitting energy.
Crystal-Field Theory
Crystal-Field Theory
Electron Configurations in Octahedral Complexes • We still apply Hund’s rule to the d-orbitals. • The first three electrons go into different d orbitals with their spins parallel. • Recall: the s electrons are lost first. • So, Ti3+ is a d1 ion, V3+ is a d2 ion and Cr3+ is a d3 ion. • We have a choice for the placement of the fourth electron: – if it goes into a higher energy orbital, then there is an energy cost ();
大学无机化学 d区元素介绍

16.3.2 铬的化合物
Cr2O3 (铬绿)
颜色 CrO3 (铬酐) 暗红色
熔点/℃ 受热时的变化 198 250℃分解为 Cr2O3与O2 熔融不分解 熔融不分解 不分解 失去结晶水 失去结晶水
K2CrO4
K2Cr2O7 (红矾) Cr2O3 (铬绿) CrCl3· 2O 6H
黄色
橙红色 绿色 紫色
Ac, (104-112,人工合成元素)
57-71
89-103
2
第十六章
d区元素(一)
§16.1 d区元素概述
§16.2 钛 钒
§16.3 铬 钼 钨 多酸型配合物 §16.4 锰
§16.5 铁 钴 镍
§16.1 d区元素概述
16.1.1 d区元素通性
1.原子的价电子层构型:
(n-1)d1-10ns1-2
•常温下,Cr, Mo, W表面因形成致密的氧化膜而降低了化学 活性,在空气中或水中都相当稳定。
21
16.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W 价电子构型:(n-1)d 4-5ns1-2 灰白色金属,熔沸点高,硬度大。 表面易形成氧化膜。 室温时纯铬溶于稀HCl,H2SO4,在浓 HNO3中钝化。高温下与活泼的非金属及 C,B,N反应。
(4) Cr(Ⅲ)的还原性与氧化性
酸性条件:E (Cr2 O / Cr ) = 1.33V 2Cr 3S2O 7 H 2 O
24
4 27 3
3
28
Ag
2Cr2O 7 SO 2 14H 4
E (CrO / Cr(OH)-4 ) = -0.12V 碱性条件: 3H 2 O 2 2OH 2Cr(OH)
d区元素一(相关知识点)
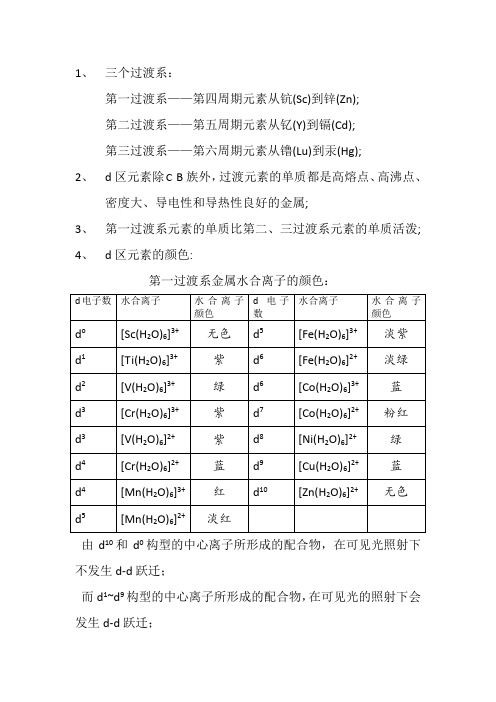
1、三个过渡系:第一过渡系——第四周期元素从钪(Sc)到锌(Zn);第二过渡系——第五周期元素从钇(Y)到镉(Cd);第三过渡系——第六周期元素从镥(Lu)到汞(Hg);2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、密度大、导电性和导热性良好的金属;3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼;4、d区元素的颜色:第一过渡系金属水合离子的颜色:由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁;而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能;(2)加热TiO 22nH O 可得到白色粉末状的TiO 2:3002222CTiO nH O TiO nH O −−−→+;(3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色;(4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法:通常用TiO 2、碳和氯气在800C~900C 时进行反应:800~900224222C CTiO C Cl TiCl CO ++−−−−→+ ;用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下:2TiCl 4+H 2=2TiCl 3+2HCl ;(8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在;(9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:TiO2++H2O2=[TiO](H2O2)]2+(橘黄色) ;(10)在酸性溶液中用Zn还原TiO2+时,可形成紫色的[Ti(H2O)6]3+(可简写成Ti3+):2TiO2++Zn+4H+=2Ti3++Zn2++2H2O ;(11)向含有Ti3+的溶液中加入碳酸时:2Ti3++3CO32-+3H2O=2Ti(OH)3(s)+3CO2;(12)在酸性溶液中,Ti3+是一种比Sn2+略强的还原剂,它易被空气中的氧所氧化:4Ti3++2H2O+O2=4TiO2++4H+;(13)有机化学中常用Ti3+来证实硝基化合物的存在,它可将硝基还原为氨基:RNO2+6Ti3++4H2O=RNH2+6TiO2++6H+;6、(1)钒在自然界中的存在极为分散,很少可以见到钒的富矿;(2)钒是银灰色金属,在空气中是稳定的,其硬度比刚大;(3)钒对于稀酸也是稳定的,但在室温下,它能溶于王水或硝酸中,生成VO2+;浓硫酸和氢氟酸仅在加热条件下与钒发生作用;(4)加热时。
d区元素PPT演示文稿

• 另一些过渡金属的酸性氧化物,在一定的条件(pH)下也有缩合作
用 2CrO42 +2H
Cr2O72 +H2O
• Mo, W, V, Nb, Ta 最易形成多酸 • 这种由含氧酸彼此缩合而成比较复杂的酸称为多酸,它们可以看作
若干水分子和两个或两个以上的酸酐组成的酸。 • 如果两个以上的酸酐是属于同一类的,该酸叫做同多酸 • 如果两个以上的酸酐是属于不同类的,该酸叫做杂多酸 • 同多酸的形成与溶液的PH密切相关,PH值越小,缩合度越大,如:
• H 2TiO 3==TiO 2+H 2O • ②氯化
TiO2(s) +2Cl2 (g)== TiCl4(g) +O2(g) TiO2(s) + CO +2Cl2 (g)== TiCl4(g) +2CO(g)
• ③还原 • TiCl4 + 2Mg ==Ti + 2MgCl2
G =126.7KJ/mol G =149.8KJ/mol
2Mn(OH)2 +O2 ==MnO(OH)2 4Fe(OH)2 +O2 == 4Fe(OH)3 4Co(OH)2 +O2 == 4Co(OH)3
13
• ③第二、三过渡系列比较相似,而第一过 渡系列有较大差别
• ④同一过渡系列元素,最高氧化态的氧化 性从左至右逐渐增强
FeO42 MnO42 Cr2O72
15
• 二、铬的冶炼 • 铬铁矿 FeCr2O4 • 碱熔 • 4Fe(CrO2)2+7O2+8Na2CO3=2Fe2O3+8N
• 同一副族元素最高氧化态从上至下呈下降 趋势
MnO42/ Mn2 = 1.51V Tc(VII)/Tc2 =0.72V
大学本科无机化学 第十六章 d区元素(一)

•导电性,导热性,延展性好。
熔 点 变 化 示 意 图
d区元素的化学性质
元素
E
M
2
/M V
Sc --各种酸 Fe -0.409 稀 HCl H2 SO4 等
Ti -1.63 热 HCl HF Co -0.282 缓慢溶解 在 HCl 等 酸中
Ag+ Ba2+ Pb2+
§16.3 锰
16.3.1 锰的单质
16.3.2 锰的化合物
16.3.3 水溶液中的锰离子及其反应
锰的单质
锰分族(VIIB):Mn Tc Re 价电子构型:(n-1)d5ns2 锰的存在:软锰矿(MnO2•xH2O) 制备与性质:
制备:
②
MnO2 xH2O
KClO3
2 7 2 7 2
3Cl 2 2CrCl 3 2KCl 7H 2 O 6Fe 2Cr 7H 2 O
3 3
Cr2 O 3Sn
2
14H
3Sn 2Cr 7H 2 O
4
3
洗液:K2Cr2O7饱和溶液+H2SO4(浓)
K2Cr2O7 H2SO 4 (浓) K2SO 4 2CrO3 (s) H2O
d区元素的原子半径和电离能
1.d区元素在周期表中的位置
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2
3. d区元素的原子半径
4.d区元素的第一电离能
总趋势:同周期 左右由小大,幅度不大。 同副族 不规律。
d区元素的物理性质
•熔点、沸点高
•硬度大 •密度大
熔点最高的单质:钨(W)
d区元素一

C r
2Fe 2 O3 8Na 2 CrO4 8CO2
② 2Na 2 CrO4 H 2SO 4
③ Na 2 Cr2 O7 2C ④ 2Al Cr2 O3
Na 2 Cr2 O7 Na 2SO 4 H 2 O
Cr2 O3 Na 2 CO3 CO
2Cr Al 2 O3
16.1.2 d区元素的物理性质 16.1.3 d区元素的化学性质
16.1.4 d区元素的氧化态
16.1.5 d区元素离子的颜色
16.1.1 d区元素的原子半径和电离能
1.d区元素在周期表中的位置
过渡元素的通性
具有部分填充d或f壳层电子的元素。
狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
Sc Ti
2
V
3
Cr
4
Mn
5
Fe
6
Co
7
Ni
8
Cu
9
Zn
10 无 色
-
浅桃红 褐 紫 天蓝 (几乎 浅绿 粉红 无色) 1 2 3 4 5 6
绿
浅蓝
M3+中d电子 数
0
7
[M(H2O)6]3+ 无 紫 绿 蓝紫 颜色
红
浅紫
绿
粉红
7. 形成多种配合物
磁性
§16.3
铬
钼
钨 多酸型配合物
铬、钼、钨的单质
(NH4 ) 2 Cr2O7 Cr2O3 N 2 4H2O
Δ
性质:Cr2O3 6H Cr 3 3H2O
3H2O Cr2O3 2OH Cr(OH) 2.Cr(OH)3 (适量)OH (灰绿) OH (亮绿色) 3 Cr Cr(OH)4 Cr(OH)3 (s)
第十六章d区元素(一)

第十六章 d区元素(一)一、教学基本要求1、熟悉过渡元素结构特征及在周期表中位置,了解过渡元素的通性及主要性质特征。
2、掌握铬的氧化物和氢氧化物的碱性,铬(Ⅲ)的还原性,铬(Ⅵ)的氧化性,铬酸及其盐和重铬酸及其盐的转变关系。
3、掌握锰的各种氧化态,掌握+7,+6,+4,+2各氧化态的氧化还原性,和介质对它们的影响。
4、熟悉铁系元素及其重要化合物的氧化还原性及配位特征。
5、了解Ti,Cr,Mn,Fe,Co,Ni等元素的单质的一般性质及应用,重要离子的鉴定方法。
二、内容要点1、d区元素结构特征是(n-1)d x ns1-2(x1-8)只要求第一过渡系,这些元素的共同特征是都有可变的氧化态,由于d轨道未满大多可以形成比较稳定的配合物,并且水合离子具有特征的颜色。
2、第一过渡系元素的单质多为活泼金属,可以置换酸中的氢,但由于在空气中形成保护膜,在水中是稳定的。
它们可以形成以铁为主体的各种合金。
具有不同的特征性质。
3、铬的化合物中主要掌握Cr(Ⅲ)的氧化物及其水合物的酸碱性,还原性特征。
Cr(Ⅵ)的含氧化合物的氧化性及CrO3,H2CrO4,H2CrO7及其盐的转变关系。
熟悉Cr(Ⅲ),Cr(Ⅵ)的鉴定方法。
4、以锰的元素电势图为指导。
熟悉锰的各种不同氧化态的氧化还原性和歧化趋势。
5、掌握KMnO4在不同介质中的还原产物及还原剂加入量的关系。
Mn2+的还原性,在酸介质中为强氧化剂氧化为MnO4-,在碱性介质中,其还原性增强。
在空气中逐步完成:Mn(OH)2 →Mn(OH)3→Mn(OH)4(MnO2Nh2O)MnO2在酸性介质中也是较强的氧化剂,但在碱性介质中可被氧化剂氧化为MnO42-.6、Fe,Co,Ni中+3氧化态化合物的氧化性和+2氧化态还原性特征氧化态 Ni3+>Co3+>Fe3+还原态 Fe2+>Co2+>Ni2+在碱介质中Fe(OH)2-----------Fe(OH)3很快Co(OH)2-----------Co(OH)3(Co2O3.nH2O)缓慢Ni(OH)2加强氧化剂可形成高价太化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
熔点/℃ 受热时的变 化
200℃以上分 解为 K2MnO4 , MnO2,O2
640℃~680℃ 分解为 Mn3O4、O2 和 K2O 224.7gL-1 (2MKOH)形 成绿色溶液, 静止或水量 较多时,变为 紫红色
Cr -0.90 稀 HCl H2 SO4 Cu +0.339 HNO3 , 浓 热 H2 SO4
Mn -1.18 稀 HCl H2 SO4 等 Zn -0.762 稀 HCl H2 SO4 等
可溶该 金属的 酸 元素
E
M
2
/M V
可溶该 金属的 酸
总趋势:从左至右活泼性降低。
新乡学院化学与化工学院
4.Cr(Ⅲ)的鉴定
Cr 3 H 2O2 OH Cr(OH)4 CrO2 4
H 2O2 2 2CrO(O2 ) 2 Cr2 O 7 戊醇(乙醚)
H+
蓝色
2 Cr2O7 4H2O2 2H 2CrO(O 2 ) 2 5H2O
新乡学院化学与化工学院
锰单质的性质: •白色金属,硬而脆 •活泼金属: E (Mn /Mn) 1.182V
2
Mn 2H (稀) Mn
2
H2
Mn 2H2 O Mn(OH)2 (s) H 2
•与氧、卤素等非金属反应: Δ 3Mn 2O 2 Mn3O 4
Cr2+(aq) Cr3+(aq)
新乡学院化学与化工学院
•Cr(Ⅲ)的配合物的多种颜色
[Cr(H2O) [Cr(H2O) 6 ]Cl 3紫色, 5Cl]Cl 2 H 2 O蓝绿色 [Cr(H2O) 4 Cl 2 ]Cl 2H 2 O绿色
2.Cr2O72-与CrO42-间的转化 •pH值的影响 2 2CrO 4 2H (黄 )
新乡学院化学与化工学院
16.3.2 铬的化合物
1.Cr2O3(铬绿) Δ 2Cr2O3 制备:4Cr 3O2
(NH4 ) 2 Cr2O7 Cr2O3 N 2 4H2O
Δ
性质:Cr2O3 6H Cr 3 3H2O
3H2O Cr2O3 2OH Cr(OH) 4 2.Cr(OH)3 (灰绿) (亮绿色) ( 适量 ) OH OH Cr 3 Cr(OH)4 Cr(OH)3 (s)
•性质
① 灰白色, 熔点沸点高,硬度大。 ② 活泼金属,表面已形成一层氧化膜,活
泼性下降。 ③ 无膜金属与酸的反应 Cr + 2H+(新) Cr3+(蓝)+ H2
O2
3
Cr (紫)
2Cr 2H2SO 4 (浓) Cr ( 2 SO 4) 3 3SO 2 H2O 在冷、浓硝酸中钝化。
新乡学院化学与化工学院
§16.4 锰
16.4.1 锰的单质
16.4.2 锰的化合物
16.4.3 水溶液中的锰离子及其反应
新乡学院化学与化工学院
16.4.1 锰的单质
锰分族(VIIB):Mn Tc Re 价电子构型:(n-1)d5ns2 锰的存在:软锰矿(MnO2•xH2O) 制备与性质:
新乡学院化学与化工学院
4.d区元素的第一电离能
总趋势:同周期 左右由小大,幅度不大。 同副族 不规律。
新乡学院化学与化工学院
16.1.2 d区元素的物理性质
•熔点、沸点高 •硬度大 熔点最高的单质:钨(W) 硬度最大的金属:铬(Cr)
•密度大
密度最大的单质:锇(Os)
•导电性,导热性,延展性好。
新乡学院化学与化工学院
乙醚 CrO(O 2 ) 2 CrO(O 2 ) 2 (C 2 H 5 ) 2 O
新乡学院化学与化工学院
小结: Cr
H+
O2,△
Cr2O3(s,绿)
△ 过量OH H+
Cr2+
H+
H+ Fe2+
O2 Zn 氨水或适量OH 3+
△
Cr(OH)3 (灰绿)
OH -
(NH4)2CrO4(橙黄) Cr(OH)4(亮绿)
2HCrO
pH<2:Cr2O72-为主
Cr2 O H 2 O (橙) pH>6:CrO42-为主
4
2 7
新乡学院化学与化工学院
•溶解度的影响 7 12 10 Ksp(Ag2Cr2O7 ) 2.0× × 10 Ksp(Ag 2CrO4 ) 1.1
2 4Ag Cr2 O7 H 2 O 2 2 2Ba Cr2O7 H 2O 2 2Pb Cr2O7 H 2O 2 2Ag2 CrO4 (s, 砖红) 2H 2BaCrO4 (s, 柠檬黄) 2H 2PbCrO4 (s, 黄) 2H
16.1.3 d区元素的化学性质
16.1.4 d区元素的氧化态
16.1.5 d区元素离子的颜色
新乡学院化学与化工学院
16.1.1 d区元素的原子半径和电离能
1.d区元素在周期表中的位置
新乡学院化学与化工学院
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2
3. d区元素的原子半径
新乡学院化学与化工学院
制备:
②
MnO2 xH2O
H2
KClO3 KOH
①
△ 530℃
③ Al
H2 Mn3 O 4 MnO
Mn
C
熔融 水浸
K 2MnO4
Cl2
中性还原
MnO2
KMnO4
① 3MnO2 6KOH KClO3 ② 3MnO2
3K2 MnO4
KCl 3H2O Mn3O4 O2 ③ 3Mn3O4 8Al 9Mn 4Al2O3
K2Cr2O7
PbCrO4
新乡学院化学与化工学院
3. Cr2O72-的氧化性 2 3 E (Cr2 O 7 /Cr ) 1.33V
Cr2 O 3SO
2 7 2 7 2 7 2 3
8H
3SO 2Cr 4H 2 O 3S 2Cr 7H 2 O 3I 2 2Cr
2+/Ni) =-0.2363V (Ni E
E (Pd2+/Pd) = +0.92V
2+/Pt) = +1.2V(估计值) (Pt E
E Zn /Zn 0.762V
2 2 2
E Hg /Hg 0.852V
总趋势:从上到下活泼性降低。
E Cd /Cd 0.402V
新乡学院化学与化工学院
16.1.4 d区元素的氧化态
有多种氧化态。红色为常见的氧化态。
新乡学院化学与化工学院
16.1.5 d区元素离子的颜色
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Cu(Ⅱ) Zn(Ⅱ)
水合离子呈现多种颜色。
新乡学院化学与化工学院
§16.3 铬 钼 钨
16.3.1 铬、钼、3;7,
最高氧化值=价电子数
新乡学院化学与化工学院
氧化态 分子式 颜色和状态 密度/(gcm-3) +7 KMnO4 紫红色或近 乎黑色的晶 体 2.71 +6 K2MnO4 暗绿色晶体 --+4 MnO2 黑色无定形 粉末 5.03 MnSO47H2 O 肉红色晶体 2.1 54℃时溶于 结晶水中,无 水 MnSO4 为 白色,灼烧变 为 Mn3O4 +2 MnCl24H2O 肉红色晶体 2.01 58℃,200℃ ~230℃ 部分分解出 HCl ,无水 MnCl2 红色 片状, 熔点为 650℃
16.3.2 铬的化合物
16.3.3 水溶液中离子及其反应
新乡学院化学与化工学院
16.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W 价层电子构型:(n-1)d 4-5ns1-2
1. 铬单质的制备 铬以铬铁矿Fe(CrO2)2的形式存在, 以铬铁矿为原料制备之。
新乡学院化学与化工学院
2Fe 2 O 3 8Na 2 CrO 4 8CO 2
② 2Na 2 CrO 4 H 2SO 4
Na 2 Cr2 O 7 Na 2SO 4 H 2 O Cr2 O 3 Na 2 CO 3 CO
③ Na 2 Cr2 O 7 2C
④ 2Al Cr2 O 3
2Cr Al 2 O 3
3 3
2 4
3
Cr2 O 3H 2S 8H Cr2 O 6I 14H
7H 2 O
K 2 Cr2 O 7 (s) 14HCl(浓)
Cr2 O 6Fe 14H Cr2 O 3Sn
2 7 2
2 7 2
3Cl 2 2CrCl 3 2KCl 7H 2 O
H H
H2O Cr2O3 (绿)
新乡学院化学与化工学院
16.3.3 水溶液中离子及其反应
1.Cr(Ⅲ)的盐
12H 2 O, CrCl 3 Cr SO 4) KCr(SO 4) ( 2 3, 2
•水解
[Cr(H 2 O) 6]
3
H [Cr(OH)(H 2 O) 5]
4
2
K 10
3 3 2 23
Mn X 2 MnX2 (X F) Mn F2 MnF 4 和MnF 3
新乡学院化学与化工学院
•在氧化剂存在下与熔融的碱作用:
2Mn 4KOH 3O 2 2K 2 MnO 4 2H 2 O
熔融
新乡学院化学与化工学院
16.4.2 锰的化合物
Mn的价电子构型:3d54s2
Cr
