相律相图答案
第四章 二元合金相图与合金凝固答案

第四章二元合金相图与合金凝固一、本章主要内容:相图基本原理:相,相平衡,相律,相图的表示与测定方法,杠杆定律;二元匀晶相图:相图分析,固溶体平衡凝固过程及组织,固溶体的非平衡凝固与微观偏析固溶体的正常凝固过程与宏观偏析:成分过冷,溶质原子再分配,成分过冷的形成及对组织的影响,区域熔炼;二元共晶相图:相图分析,共晶系合金的平衡凝固和组织,共晶组织及形成机理:粗糙—粗糙界面,粗糙—光滑界面,光滑—光滑界面;共晶系非平衡凝固与组织:伪共晶,离异共晶,非平衡共晶;二元包晶相图:相图分析,包晶合金的平衡凝固与组织,包晶反应的应用铸锭:铸锭的三层典型组织,铸锭组织控制,铸锭中的偏析其它二元相图:形成化合物的二元相图,有三相平衡恒温转变的其它二元相图:共析,偏晶,熔晶,包析,合晶,有序、无序转变,磁性转变,同素异晶转变二元相图总结及分析方法二元相图实例:Fe-Fe3C亚稳平衡相图,相图与合金性能的关系相图热力学基础:自由能—成分曲线,异相平衡条件,公切线法则,由成分—自由能曲线绘制二元相图二、1.填空1 相律表达式为___f=C-P+2 ___。
2. 固溶体合金凝固时,除了需要结构起伏和能量起伏外,还要有___成分_______起伏。
3. 按液固界面微观结构,界面可分为____光滑界面_____和_______粗糙界面___。
4. 液态金属凝固时,粗糙界面晶体的长大机制是______垂直长大机制_____,光滑界面晶体的长大机制是____二维平面长大____和_____依靠晶体缺陷长大___。
5 在一般铸造条件下固溶体合金容易产生__枝晶____偏析,用____均匀化退火___热处理方法可以消除。
6 液态金属凝固时,若温度梯度dT/dX>0(正温度梯度下),其固、液界面呈___平直状___状,dT/dX<0时(负温度梯度下),则固、液界面为______树枝___状。
7. 靠近共晶点的亚共晶或过共晶合金,快冷时可能得到全部共晶组织,这称为____伪共晶。
相律相图答案

第5章 相律与相图复习思考题1.什么是独立组分数独立组分数与物种数有何区别和联系2.试以NaCl 和水构成的系统为例说明系统的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组分数却不受影响。
3. 在下列物质共存的平衡系统中,有几个独立反应请写出反应式。
(a )C (s )、CO (g )、CO 2(g )、H 2(g )、H 2O (l )、O 2(g )。
(b )C (s )、CO (g )、CO 2(g )、Fe (s )、FeO (s )、Fe 3O 4(s )、Fe 2O 3(s )4.“单组分系统的相数一定少于多组分系统的相数,一个平衡系统的相数最多只有气、液、固三相。
”这个说法是否正确为什么5.水和水蒸气在363 K 平衡共存,若保持温度不变,将体积增大一倍,蒸气压将如何改变 6.什么是自由度自由度是否等于系统状态的强度变量数如何理解自由度为零的状态7.将CaCO 3置于密闭真空容器中加热,以测定其分解压强,问CaCO 3的用量是否需精确称量若CaCO 3量过少可能会发生什么现象8. I 2在水和CCl 4间的分配平衡,当无固态I 2存在时,其自由度为多少9.二液体组分若形成恒沸混合物,试讨论在恒沸点时组分数、相数和自由度各为多少。
习 题1.指出下列平衡系统的物种数、组分数、相数和自由度: (1)Ca (OH )2(s )与CaO (s )、H 2O (g )呈平衡。
(2)CaSO 4与其饱和水溶液达平衡。
(3)在标准压力下,水与水蒸气平衡。
(4)由Fe(s)、FeO(s)、C(s)、CO(g)、CO 2(g)组成的平衡系统; (5)由Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)组成的平衡系统; 解:(1)3,1,0,=3,=1SR b f ===Φ(2)2,0,0,=2,=2S R b f ===Φ (3)1,0,0,=2,=0SR b f ===Φ (4)5,2,0,=4,=1SR b f ===Φ(5)5,2,0,=4,=1S R b f ===Φ2.固体NH 4HS 和任意量的H 2S 及NH 3气体混合物组成的系统达到平衡: (1))求该系统组分数和自由度;(2)若将NH 4HS 放在一抽空容器内分解,平衡时,其组分数和自由度又为多少 解:(1)3,1,0,=2,=2SR b f ===Φ(2)3,1,1,=2,=1S R b f ===Φ3.已知Na 2CO 3(s)和H 2O(1)可形成的水合物有三种:Na 2CO 3·H 2O (s),Na 2CO 3·7 H 2O (s)和Na 2CO 3·10 H 2O (s),试问: (1)在101325 Pa 下,与Na 2CO 3水溶液及冰平衡共存的含水盐最多可有几种 (2)在 K 时,与水蒸气平衡共存的含水盐最多可有几种解:(1)设最多有x 种含水盐,则 2,,0,=2+,1S x R x b x n =+==Φ=由相律得2(2)110f x x =-++=-≥ ,所以,1x ≤。
相图
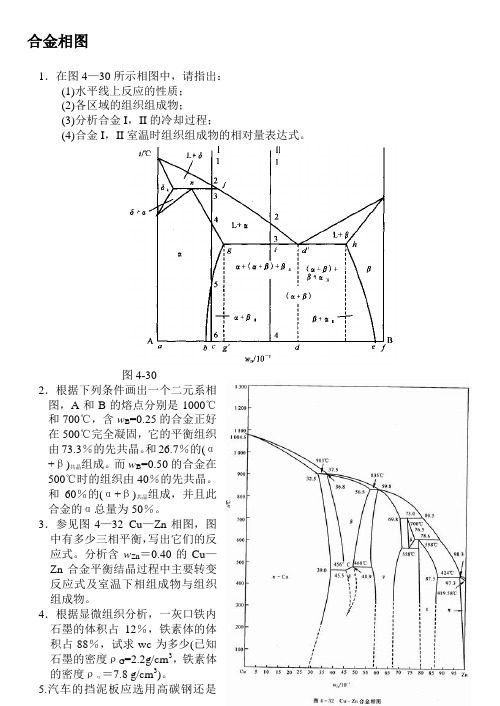
合金相图1.在图4—30所示相图中,请指出:(1)水平线上反应的性质;(2)各区域的组织组成物;(3)分析合金I ,II 的冷却过程;(4)合金I ,II 室温时组织组成物的相对量表达式。
图4-302.根据下列条件画出一个二元系相图,A 和B 的熔点分别是1000℃和700℃,含w B =0.25的合金正好在500℃完全凝固,它的平衡组织由73.3%的先共晶。
和26.7%的(α+β)共晶组成。
而w B =0.50的合金在500℃时的组织由40%的先共晶。
和60%的(α+β)共晶组成,并且此合金的α总量为50%。
3.参见图4—32 Cu —Zn 相图,图中有多少三相平衡,写出它们的反应式。
分析含w Zn =0.40的Cu —Zn 合金平衡结晶过程中主要转变反应式及室温下相组成物与组织组成物。
4.根据显微组织分析,一灰口铁内石墨的体积占12%,铁素体的体积占88%,试求wc 为多少(已知石墨的密度ρG =2.2g/cm 3,铁素体的密度ρα=7.8 g/cm 3)。
5.汽车的挡泥板应选用高碳钢还是低碳钢来制造。
6.一碳钢在平衡冷却条件下,所得显微组织中,含有50%的珠光体和50%的铁素体,问:(1)此合金中含碳质量分数为多少?(2)若该合金加热到730℃,在平衡条件下将获得什么组织?(3)若加热到850℃,又将得到什么组织?7.利用相律判断图4—34所示相图中错误之处。
8.指出下列概念中错误之处,并更正。
(1)固熔体晶粒内存在枝晶偏析,主轴与枝间成分不同,所以整个晶粒不是一个相。
(2)尽管固熔体合金的结晶速度很快,但是在凝固的某一个瞬间,A ,B 组元在液相与固相内的化学位都是相等的。
(3)固熔体合金无论平衡或非平衡结晶过程中,液—固界面上液相成分沿着液相平均成分线变化;固相成分沿着固相平均成分线变化。
(4)在共晶线上利用杠杆定律可以计算出共晶体的相对量。
而共晶线属于三相区,所以杠杆定律不仅适用于两相区,也适用于三相区。
物理化学第5章相律与相图

第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。
【2017年整理】物理化学答案——第五章-相平衡[1]
![【2017年整理】物理化学答案——第五章-相平衡[1]](https://img.taocdn.com/s3/m/053cf390d1d233d4b14e852458fb770bf78a3b91.png)
第五章 相平衡一、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙方程m mH dp dT T V ∆=∆相相(克拉贝龙方程,适用于任何纯物质的两相平衡) 2ln m H d p dT RT ∆=相(克劳修斯—克拉贝龙方程,适用与其中一相为气相,且服从理想气体状态方程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --∆=∆≈⋅⋅(T b 为该液体的正常沸点)3.相律 f+Φ=C+n C=S-R-R ′f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压力有一个固定,f * 称为“条件自由度”)*4. Ehrenfest 方程2112()p p C C dp dT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数) 基本概念1. 相:体系中物理性质和化学性质完全均匀的部分,用Φ表示。
相的数目叫相数。
2. 独立组分数C =S -R -R ′,S 为物种数,R 为独立化学反应计量式数目,R ′ 为同一相中独立的浓度限制条件数。
3. 自由度:指相平衡体系中相数保持不变时,所具有独立可变的强度变量数,用字母 f 表示。
单组分体系相图相图是用几何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最小为零,Φ 最多应为 3 ,因相数最少为 1 ,故自由度数最多为 2 。
在单组分相图中,(如图5-1,水的相图)有单相的面、两相平衡线和三相平衡的点,自由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙方程求得。
图5-1二组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最小为零,则Φ最多为 4 ,而相数最少为 1 ,故自由度最多为 3 。
为能在平面上显示二组分系统的状态,往往固定温度或压力,绘制压力-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,自然f*最小为 0 ,Φ最多为 3,所以在二组分平面图上最多出现三相共存。
大学物理化学5-相图课后习题及答案

相图一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”。
1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的部分。
( )2.依据相律,纯液体在一定温度下,蒸气压应该是定值。
( )3.依据相律,恒沸温合物的沸点不随外压的改变而改变。
( )二、选择题选择正确答案的编号,填在各题题后的括号内。
1NH4HS(s)和任意量的NH3(g)及H2 S(g)达平衡时有:( )。
(A)C=2,φ=2,f =2;(B) C=1,φ=2,f =1;(C) C=1,φ=3,f =2;(D) C=1,φ=2,f =3。
2已知硫可以有单斜硫,正交硫,液态硫和气态硫四种存在状态。
硫的这四种状态____稳定共存。
(A) 能够;(B) 不能够;(C) 不一定。
3硫酸与水可形成H2SO4⋅H2O(s),H2SO4⋅2H2O(s),H2SO4⋅4H2O(s)三种水合物,问在101 325Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(A) 3种;(B) 2种;(C) 1种;(D) 不可能有硫酸水合物与之平衡共存。
4将固体NH4HCO3(s) 放入真空容器中,恒温到400 K,NH4HCO3按下式分解并达到平衡:NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( )(A) C=2,f =2;(B) C=2,f =2;(C) C=2,f =0;(D) C=3,f =2。
5某系统存在C(s)、H2O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡:H2O(g)+C(s) H2(g) + CO(g)CO2(g)+H2(g) H2O + CO(g)CO2(g) + C(s) 2CO(g)则该系统的独立组分数C为:( )。
(A) 3;(B) 2;(C) 1;(D) 4。
三、计算题习题1A,B二组分在液态完全互溶,已知液体B在80︒C下蒸气压力为101.325 kPa,汽化焓为30.76 kJ·mol-1。
大连理工-物理化学-相图-习题

则该系统的独立组分数C为:( 11 答: A
12 已知A,B两液体可组成无最高或最低恒沸点的液态完全互 溶的系统,则将某一组成的溶液蒸馏可以获得:( )。 (A)一个纯组分和一个恒沸混合物 (B) 两个恒沸混合物 (C) 两个 纯组分。 12 答: C
13 已知A和B二组分可组成具有 最低恒沸点的液态完全互溶的 系统,其t-x(y)如图所示。若把 xB=0.4的溶液进行精馏,在塔顶 可以获得:( )。 (A) 纯组分A(l) (B)纯组分B(l) (C)最低恒沸混合物。
是非题 下述各题中的说法是否正确 ? 正确的在题后括号内画“ ” , 错 的画“”。 1.相是指系统处于平衡时,系统中物理性质及化学性质都均匀的 部分。( ) 1 答: 2. 依据相律,纯液体在一定温度下,蒸气压应该是定值。( ) 2 答: 3. 依据相律,恒沸温合物的沸点不随外压的改变而改变。( ) 3 答: 4 双组分相图中恒沸混合物的组成随外压力的不同而不同。( ) 4 答:
10 将固体NH4HCO3(s) 放入真空容器中,恒温到400 K, NH4HCO3 按下式分解并达到平衡: NH4HCO3(s) === NH3(g) + H2O(g) + CO2(g) 系统的组分数C和自由度数f为:( ) (A) C=2,f =2; (B) (C) C=2,f =0; 10 答: C
16 在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统 的沸点( ) (A) 必低于373.2K (B) 必高于373.2K
( C)取决于水与有机物的相对数量 (D)取决于有机物的相对分子质量的大小 16答: A 17 已知A与B可构成固熔体,在组分A中,若加入组分B可使固 熔体的熔点提高,则组分B在此固熔体中的含量必( )组分 B在液相中的含量。 (A)大于 17 答: A (B)小于 (C )等于 (D)不能确定
第4章习题答案(科学出版社)

第四章相平衡思考题1.什么叫自由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质称为系统的自由度。
相律就是在平衡系统中,系统内相数、组分数、自由度数及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。
相律是一个定性规律,可以指示相平衡体系中有几个相,可以指导如何去识别由实验绘制的相图。
2.水的三相点与冰点是否相同?答:不相同。
纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为610.62Pa,温度为273.16K。
热力学温标1K就是取水的三相点温度的1/273.16K。
5 水的冰点是在大气压力下,水的三相共存点的温度。
由于冰点受外界压力影响,在10Pa压力下,温度下降0.00747K,由于水中溶解了空气,温度又下降0.0024K,所以在大气压力为105Pa时,水的冰点为273.15K。
3.相点与物系点有什么区别?答:相点是相图中表示某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压力等。
相点位置可随压力、温度的改变而改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表示系统总组成的点,在单相区,物系点可与相点重合,而在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表示。
在T-x图上,物系点可沿着与温度坐标平行的直线上下移动;在水盐系统图上,随着水的含量不同,物系点可沿着与组成坐标平行的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是气-液-固三相共存,这时的自由度为零,它的压力、温度由系统自身性质决定,不受外界因素影响。
而二组分系统的低共熔点在等压的条件下自由度为零。
外压改变,低共熔点的温度和组成也会随之而改变。
5.米粉和面粉混合得十分均匀。
再也无法彼此分开,这时混合体系有几相?答:两相6.金粉和银粉混合后加热,使之熔融后冷却,得到的固体是一相还是两相?答:一相7.低共熔物能不能看作是化合物?答:不能。
相律分析及相图表示

6) 具有液相分层的二元相图 溶解度随温度的变化
t/oC
20 40 60 80 100 120 132.8
水相wB% 8.5 7.0 6.4 7.2 9.3 14.0 37 醇相wB% 83.6 81.6 79.0 75.2 70.2 61.5 37
a,b (L’,L”): 共轭溶液 (conjugate
CaO-C2S体系:具有一个低共熔点。 含有一个异分熔化化合物C3S,存在温 度为1250-1900℃。低于1250℃时C3S 分解为CaO和C2S。
C2S-CS体系: 含有一个异分熔化 化合物C3S2和一个包晶点。在 1475℃发生包晶反应:
L+C2S=C3S2
CS-SiO2体系:具有一个共晶点; 存在一个两液相分层区(L1+L2), 两个液相在1700℃以上平衡共存。 1700℃时的相平衡关系为:
1) 具有一个稳定化合物的二元相图
2) 具有一个不稳定化合物的二元相图
T=Tp时,发生包晶反应:
Lp + A
C (AmBn)
析晶路线
T
a
L
L+A E A+C
1
b
K
P GD
L+C OH
M L+B
F
C+B
L C
B
A
C
B
L B
熔体1 L
K [M , (B)]
p=1 f=2
p=2 f=1
P[F, 开始转溶B+(C)]LP +BC p=3 f=0
炉渣中有Fe2O3出现时,有利于CaO的溶解,在烧
结过程中有利于铁酸钙粘结相的形成。
3. 三元体系相图
3.1 三元系的组成表示法
热力学

1、相、相律、相图、零变量反应类型、Gibbs自由能能、化学势、活度、活度系数、焓、熵等相图与热力学的基础知识。
相:体系的内在性质在物理上和化学上都是均匀的部分,不同相之间由界面隔开。
相平衡:平衡体系各相温度相等;平衡体系各相压强相等;平衡体系中各相组分的化学势相等。
相律: F=C-P+2 F:自由度数,C:组元数,P:相数相图表达在平衡条件下环境约束(如温度和压力)、组分、稳定相态及相组成之间关系的几何图形。
相区接触法则:1、单相区和单相区只能有一个点接触,而不应有一条边界线;2、相邻相区的相数相差为1(点接触除外);3、一个三相反应的水平线和三个两相区相遇,共有6条边界线;4、如有两个三相反应中有两个共同的相,则此两个共同的相组成两个三相水平线之间的两相区;5、所有两相区的边界线不应延伸到单相区,而应伸向两相区。
零变量反应:垂直截面、等温截面、液相投影面。
ΔG=ΔH-TΔS (Kj/mol) 吉布斯自由能吉布斯自由能又叫吉布斯函数,(英Gibbs free energy,Gibbs energy or Gibbs function; also known as free enthalpy)是热力学中一个重要的参量,常用G表示,它的定义是:G =U -TS + pV = H- TS,其中U是系统的内能,T是温度,S是熵,p是压强,V是体积,H是焓。
吉布斯自由能的微分形式是:dG = - SdT + Vdp + μdN,其中μ是化学势,也就是说每个粒子的平均吉布斯自由能等于化学势。
化学势多组分均相系统中,在等温等压并保持系统中其他物质的量都不变的条件下,系统的吉布斯由能随某一组分的物质的量的变化率。
G叫做吉布斯自由能。
因为H、T、S均为状态函数,所以G为状态函数ΔG叫做吉布斯自由能变吉布斯自由能的变化可作为恒温、恒压过程自发与平衡的判据。
吉布斯自由能改变量。
表明状态函数G是体系所具有的在等温等压下做非体积功的能力。
相平衡及相图习题练习

相平衡及相图练习1.下列说法对吗?为什么?(1)在一给定的体系中,独立组分数是一个确定的数。
(2)单组分体系的物种数一定等于1。
(3)相律适用于任何相平衡体系。
(4)在相平衡体系中,如果每一相中的物种数不相等,则相律不成立。
提示2.请论证(1)在一定温度下,某浓度的 NaCl 水溶液只有一个确定的蒸气压;(2)在一定温度下,草酸钙分解为碳酸钙和一氧化碳时只能有一个确定的 CO 压力。
提示3.试求下述体系的自由度并指出变量是什么?(1)在压力下,液体水与水蒸气达平衡;(2)液体水与水蒸气达平衡;(3)25℃ 和压力下,固体 NaCl 与其水溶液成平衡;(4)固态 NH4HS 与任意比例的 H2S 及 NH3的气体混合物达化学平衡;(5)I2(s)与 I2(g)成平衡。
提示4.Na2CO3与水可形成三种水合物 Na2CO3·H2O(s),Na2CO3·7H2O(s)和 Na2CO3·10H2O(s)。
问这些水合物能否与 Na2CO3水溶液及冰同时平衡共存?提示5.根据碳的相图,回答下列问题:(1)点 O 及曲线 OA,OB 和 OC 具有什么含义?(2)试讨论在常温常压下石墨与金刚石的稳定性;(3)2000K 时,将石墨变为金刚石需要多大压力?(4)在任意给定的温度和压力下,金刚石与石墨哪个具有较高的密度?提示6.在 1949~2054K 之间,金属 Zr 的蒸气压方程为请得出 Zr 的摩尔升华焓与温度T的关系式。
并估算 Zr 在溶点 2128K 时的摩尔升华焓和蒸气压。
提示7.某物质的固体及液体的蒸气压可分别用下式表示:(固体) (1)(液体) (2)试求其:(1)摩尔升华焓(2)正常沸点(3)三相点的温度和压力(4)三相点的摩尔熔化熵提示8.在海拔 4500m 的西藏高原上,大气压力只有 57.329kPa,水的沸点为84℃,求水的气化热。
提示9.一冰溪的厚度为 400m,其比重为 0.9168,试计算此冰溪底部冰的熔点。
材料科学基础相图习题
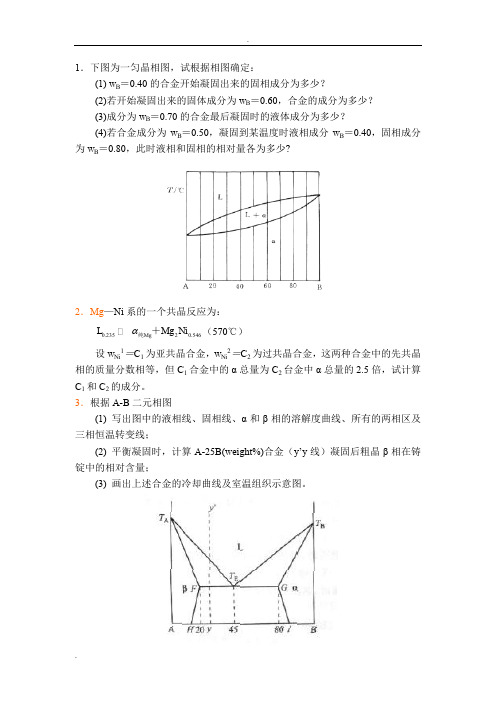
1.下图为一匀晶相图,试根据相图确定:(1) w B =0.40的合金开始凝固出来的固相成分为多少?(2)若开始凝固出来的固体成分为w B =0.60,合金的成分为多少?(3)成分为w B =0.70的合金最后凝固时的液体成分为多少?(4)若合金成分为w B =0.50,凝固到某温度时液相成分w B =0.40,固相成分为w B =0.80,此时液相和固相的相对量各为多少?2.Mg —Ni 系的一个共晶反应为:0.23520.546g g i M L M N 纯+(570℃)设w Ni 1=C 1为亚共晶合金,w Ni 2=C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2台金中α总量的2.5倍,试计算C 1和C 2的成分。
3.根据A-B 二元相图(1) 写出图中的液相线、固相线、α和β相的溶解度曲线、所有的两相区及三相恒温转变线;(2) 平衡凝固时,计算A-25B(weight%)合金(y ’y 线)凝固后粗晶β相在铸锭中的相对含量;(3) 画出上述合金的冷却曲线及室温组织示意图。
4.根据如图所示的二元共晶相图(1)分析合金I,II的结晶过程,并画出冷却曲线;(2)说明室温下合金I,II的相和组织是什么,并计算出相和组织组成物的相对含量?(3)如果希望得到共晶组织加上5%的 初的合金,求该合金的成分。
(4)合金I,II在快冷不平衡状态下结晶,组织有何不同?5.指出下列相图中的错误:6.试述二组元固溶体相的吉布斯(Gibbs)自由能-成分曲线的特点?(a) (b)(c) (d)1.下图为一匀晶相图,试根据相图确定:(1) w B =0.40的合金开始凝固出来的固相成分为多少?(2)若开始凝固出来的固体成分为w B =0.60,合金的成分约为多少?(3)成分为w B =0.70的合金最后凝固时的液体成分约为多少?(4)若合金成分为w B =0.50,凝固到某温度时液相成分w B =0.40,固相成分为w B =0.80,此时液相和固相的相对量各为多少?第1题答案2.Mg —Ni 系的一个共晶反应为:0.23520.546g g i M L M N 纯+(570℃)设w Ni 1=C 1为亚共晶合金,w Ni 2=C 2为过共晶合金,这两种合金中的先共晶相的质量分数相等,但C 1合金中的α总量为C 2台金中α总量的2.5倍,试计算C 1和C 2的成分。
三组分相图.

萃取剂糠醛在塔上部适当位置加入,进料在塔中部适当位置进入, 在糠醛作用下,环乙烷成为易挥发组分,从塔顶获得环乙烷产品。糠 醛和苯从塔底排出,进入第二塔,从塔顶分离出苯产品,塔底回收萃 取剂糠醛,返回前塔循环使用。为避免糠醛进入环乙烷中,在糠醛入 塔上方,也必须保证适宜塔板数,以脱出蒸气中的糠醛。
• 原理是:对于可逆反应,当某一产物的挥发度 大于反应物时,如果将该产物从液相中蒸出, 则可破坏原有的平衡,使反应继续向生成物的 方向进行,因而可提高单程转化率,在一定程 度上变可逆反应为不可逆反应。
• 反应精馏的优点
1.反应产物不断移出反应区,有利于反应 正向进行,使反应转化率和选择性提高。
2.由于反应产物不断离开反应区,反应区 内反应物浓度较高,增加了反应速度, 提高了生产能力。
物系点落在三相区时,三液相共存, 在表观上,将会出现互不相溶的3 个液层.
目前,尚未发现4液相共存的现象.
B 水
l
两相区,f=1 E
三相区,f=0
两相区,f=1
D
F
l
两相区,f=1
l
C 乙醚
三元相图的应用
A:H2O; B: KNO3; C:NaNO3.
A
蓝色:298K的相图;
紫红色:373K的相图.
F C
三角坐标的特点
(2) 通过某点的任意
直线上各物系点所
A
代表的体系中,另外
两顶点所代表组分
含量之比, 必定相同.
WB/WC=GI/HG=DC/BD
H
WB/WC=DC/BD B
HG
GI I
G
BD
第4章-习题答案(科学出版社)

第4章-习题答案(科学出版社)第四章相平衡思考题1.什么叫⾃由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在⼀定范围内独⽴变动的强度性质称为系统的⾃由度。
相律就是在平衡系统中,系统内相数、组分数、⾃由度数及影响物质性质的外界因素(如温度、压⼒、重⼒场、磁场、表⾯能等)之间关系的规律。
相律是⼀个定性规律,可以指⽰相平衡体系中有⼏个相,可以指导如何去识别由实验绘制的相图。
2.⽔的三相点与冰点是否相同?答:不相同。
纯⽔的三相点是⽓-液-固三相共存,其温度和压⼒由⽔本⾝性质决定,这时的压⼒为610.62Pa,温度为273.16K。
热⼒学温标1K就是取⽔的三相点温度的1/273.16K。
⽔的冰点是在⼤⽓压⼒下,⽔的三相共存点的温度。
由于冰点受外界压⼒影响,在105Pa压⼒下,温度下降0.00747K,由于⽔中溶解了空⽓,温度⼜下降0.0024K,所以在⼤⽓压⼒为105Pa时,⽔的冰点为273.15K 。
3.相点与物系点有什么区别?答:相点是相图中表⽰某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压⼒等。
相点位置可随压⼒、温度的改变⽽改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表⽰系统总组成的点,在单相区,物系点可与相点重合,⽽在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表⽰。
在T-x图上,物系点可沿着与温度坐标平⾏的直线上下移动;在⽔盐系统图上,随着⽔的含量不同,物系点可沿着与组成坐标平⾏的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是⽓-液-固三相共存,这时的⾃由度为零,它的压⼒、温度由系统⾃⾝性质决定,不受外界因素影响。
⽽⼆组分系统的低共熔点在等压的条件下⾃由度为零。
外压改变,低共熔点的温度和组成也会随之⽽改变。
5.⽶粉和⾯粉混合得⼗分均匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第5章 相律与相图复习思考题1.什么是独立组分数?独立组分数与物种数有何区别和联系?2.试以NaCl 和水构成的系统为例说明系统的物种数可以随考虑问题的出发点和处理方法而有所不同,但独立组分数却不受影响。
3. 在下列物质共存的平衡系统中,有几个独立反应?请写出反应式。
(a )C (s )、CO (g )、CO 2(g )、H 2(g )、H 2O (l )、O 2(g )。
(b )C (s )、CO (g )、CO 2(g )、Fe (s )、FeO (s )、Fe 3O 4(s )、Fe 2O 3(s )4.“单组分系统的相数一定少于多组分系统的相数,一个平衡系统的相数最多只有气、液、固三相。
”这个说法是否正确?为什么?5.水和水蒸气在363 K 平衡共存,若保持温度不变,将体积增大一倍,蒸气压将如何改变? 6.什么是自由度?自由度是否等于系统状态的强度变量数?如何理解自由度为零的状态?7.将CaCO 3置于密闭真空容器中加热,以测定其分解压强,问CaCO 3的用量是否需精确称量?若CaCO 3量过少可能会发生什么现象?8. I 2在水和CCl 4间的分配平衡,当无固态I 2存在时,其自由度为多少?9.二液体组分若形成恒沸混合物,试讨论在恒沸点时组分数、相数和自由度各为多少。
习 题1.指出下列平衡系统的物种数、组分数、相数和自由度: (1)Ca (OH )2(s )与CaO (s )、H 2O (g )呈平衡。
(2)CaSO 4与其饱和水溶液达平衡。
(3)在标准压力下,水与水蒸气平衡。
(4)由Fe(s)、FeO(s)、C(s)、CO(g)、CO 2(g)组成的平衡系统; (5)由Fe(s)、FeO(s)、Fe 3O 4(s)、CO(g)、CO 2(g)组成的平衡系统; 解:(1)3,1,0,=3,=1SR b f ===Φ(2) 2,0,0,=2,=2S R b f ===Φ(3)1,0,0,=2,=0S R b f ===Φ (4)5,2,0,=4,=1SR b f ===Φ(5)5,2,0,=4,=1S R b f ===Φ2.固体NH 4HS 和任意量的H 2S 及NH 3气体混合物组成的系统达到平衡: (1))求该系统组分数和自由度;(2)若将NH 4HS 放在一抽空容器分解,平衡时,其组分数和自由度又为多少? 解:(1)3,1,0,=2,=2SR b f ===Φ(2)3,1,1,=2,=1S R b f ===Φ3.已知Na 2CO 3(s)和H 2O(1)可形成的水合物有三种:Na 2CO 3·H 2O (s),Na 2CO 3·7 H 2O (s)和Na 2CO 3·10 H 2O (s),试问: (1)在101325 Pa 下,与Na 2CO 3水溶液及冰平衡共存的含水盐最多可有几种? (2)在293.15 K 时,与水蒸气平衡共存的含水盐最多可有几种?解:(1)设最多有x 种含水盐,则 2,,0,=2+,1S x R x b x n =+==Φ=由相律得2(2)110f x x =-++=-≥ ,所以,1x ≤。
即最多有一种含水盐与之共存。
(2)分析同(1)可得,2(1)120f x x =-++=-≥,所以,2x ≤即最多有两种含水盐与之共存。
4.固态氨的饱和蒸气压与温度的关系可表示为ln (p/p º)= 4.707–767.3/T ,液体氨的饱和蒸气压与温度的关系可表示为ln (p/p º)=3.983–767.3/T 。
试求:(1)三相点的温度及压强;(2)三相点时的蒸发热、升华热和熔化热。
解:(1)在三相点处液氨对应的饱和蒸气压应与固氨对应的饱和蒸气压相等,故有:4.707767.3/ 3.983626.0/T T -=-解得:195.17K 77.90T==℃将所求温度数据代入任意一个饱和蒸气压与温度的关系式可解得:p 2.17 p Pa Θ=(2) 由克-克公式: ln /trs PR C Hm T ∆=-+与题目所给关系式相比较可得:-1626.05204.56 J mol vap m H R ⋅∆==-1767.36379.33 J mol sub m H R ⋅∆==-11174.77 J mo l ==fus m sub m vap m H H H ⋅∆∆-∆5. 溜冰鞋下面的冰刀与冰接触的地方,长度为7.62×10―2m ,宽度为2.45×10―5m ,(1)若某人的体重为60kg ,试问施加于冰的压力为若干?(2)在该压力下冰的熔点为若干?已知冰的熔化热为6010 J/mol ,冰和水的密度分别是920kg / m 3和1000 kg / m 3。
解:(1)Pa S F p 852105748.11045.21062.728.960⨯=⨯⨯⨯⨯⨯==-- (2)Clapeyron 方程用于固液系统fus mfus mH dp dT T V ∆=∆代入数据积分得,T =262.2K6. 试根据下列数据,画出HAc 的相图(示意图)。
(1)固体HAc 的熔点为16.6℃,此时的饱和蒸气压为120Pa 。
(2)固体HAc 有α、β两种晶型,这两种晶型的密度都比液体大,α晶型在低压下是稳定的。
(3)α晶型和β晶型与液体成平衡的温度为55.2℃,压力为2×108Pa 。
(4)α晶型和β晶型的转化温度(即α和β的平衡温度)随压力的降低而降低。
(5)HAc 的正常沸点为118℃。
7. 在标准压力和不同温度下,丙酮和氯仿系统的溶液组成及平衡蒸气压有如下数据: t/℃ 56.0 59.0 62.5 65.0 63.5 61.0 x (丙酮,l ) 0.00 0.20 0.40 0.65 0.80 1.00 y (丙酮,g ) 0.00 0.11 0.31 0.65 0.88 1.00 (1)画出此系统的T-x 相图。
(2)将4mol 氯仿与1mol 丙酮的混合物蒸馏,当溶液沸点上升到60℃时,整个馏出物的组成约为若干?(3)将(2)中所给溶液进行精馏,能得何物?若将4mol 丙酮与1mol 氯仿的混合物进行精馏,又能得何物?氯仿与丙酮的混合物能否用精馏法同时得到纯氯仿和纯丙酮?解:(1)根据数据,origin 作图得T-x 相图0.00.20.40.60.81.0565860626466T (℃)x 丙酮A OB(2)如图所示,根据杠杆原理可知气态混合物约为3.33mol ,其中丙酮约为 0.53 mol ,氯仿约为2.80 mol.(3)将(2)中所给溶液进行精馏,将得到纯丙酮以及丙酮与氯仿的共沸混合物。
若将4mol 丙酮与1mol 氯仿的混合物进行精馏,将得到纯氯仿以及丙酮与氯仿的共沸混合物。
无法用精馏法同时得到纯氯仿和纯丙酮。
8.图5-29是标准压力下正丁醇-水的溶解度图,在20℃时往100克水中慢慢滴加正丁醇,试根据相图求: (1)系统开始变浑浊时,加入的正丁醇质量;(2)正丁醇的加入量为25克时,两共轭液层的组成和数量; (3)至少应加入多少正丁醇才能使水层消失?(4)若加入正丁醇25.0克,并将此溶液加热至80℃,两共轭液层的质量比;(5)若将(4)中的混合液在常压下一边搅拌一边加热,将在什么温度下系统由浑浊变清澈?图5-29 正丁醇-水溶解度图解:(1)约为8.8g ;(2)约1.6g 正丁醇和18.4g 水共20g ,以及约86.1g 正丁醇和18.9g 水共105g 的共轭液层;(3)约456g ;(4)类似(3)可计算;(5)393K 。
9.NaCl-H 2O 所成的二组分系统,在252K 时有一个低共熔点,此时冰、NaCl •2H 2O (s )与浓度为22.3%(质量百分数,下同)的NaCl 水溶液共存。
在264K 时不稳定化合物NaCl •2H 2O 分解,生成无水NaCl 和27%的NaCl 水溶液。
已知无水NaCl 在水中的溶解度受温度的影响不大(当温度升高时,溶解度略有增加)。
(1)绘制相图,并指出各相区的状态。
(2)若有1.00kg28%的NaCl 溶液由433K 冷却到263K ,问在此过程中最多能析出多少纯NaCl ?解:(1)240260 280300 320 340 360 380 400 10H 2O 2030405060708090NaCl(Ⅰ)NaCl (%Wt)T/K252420 440 LL+NaCl(s)(Ⅴ)M(22%NaCl,433K)NaCl ·2H 2O+NaCl(Ⅲ) (Ⅳ)(Ⅱ)NaCl ·2H 2O+冰 L+ NaCl ·2H 2O 冰+L (Ⅵ) 264K(2)按杠杆规则有W b·ba= W c·ac而ba=28-27=1 ac=100-28=72 又 W b+ W c=1∴解得:W c=0.0137Kg 即可得纯NaCl约13.7g10.由Sb-Cd系统的一系列不同组成的熔点步冷曲线得到下列数据:W(Cd)(质量分数) 0 0.20 0.375 0.475 0.50 0.583 0.70 0.90 1.00t(开始凝固的温度)/℃— 550 460 — 419 — 400 ——t(全部凝固的温度)/℃ 630 410 410 410 410 439 295 295 321 (1)试根据上述数据画出Sb-Cd系统的相图,并标出各区域存在的相和自由度。
(2)将1kg含Cd0.80(质量分数)的熔液由高温冷却,刚到295℃时,系统中有哪两个相存在,其两相的质量各有若干?解:(1)由数据表可知:①纯组分锑、镉的熔点分别为630℃和321℃;②含Cd 58.3%物系在冷却过程中出现一停顿温度,且为最高,又无转折温度,说明生成了稳定化合物Sb m Cd n;③含Cd 58.3%的稳定化合物左边有一共同停顿温度(410℃),此即为Sb与Sb m Cd n的低共熔温度,其最低共熔点组成为含Cd 47.5%。
④含Cd 58.3%稳定化合物右边有一共同停顿温度(295℃),此即为Sb m Cd n和Cd之低共熔点,其低共熔点组成为Cd 93%。
由以上分析可知,Sb-Cd 相图为两个简单低共熔点相图合并而成,如图所示。
250300350400450500550600650T (℃)x Cd(2)由杠杆原理可计算。
11. 金属A 和B 的熔点分别是623K 和553K ,热分析指出,在473K 时有三相共存,其中一相是含30%B 的熔化物,其余两相分别是含20%B 和25%B 的固溶体。
冷却到423K 时又呈现三相共存,分别是含55%B 的熔化物、含35%B 和80%B 的两个固溶体。
