2019版高考化学 第13讲 氮及其化合物课件.ppt
合集下载
高一化学氮及其化合物ppt课件.ppt
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮气
1、氮元素的存在及单质的物理性质
存 游离态形式存在于空气中 在 化合态形式存在于多种无机物及有机物中
物 理 无色无味的气体、密度比空气小; 性 难溶于水,1体积水溶解0.02体积的氮气。
思考题
1、1molMg在足量的氮气、空气、纯氧气、二
氧化碳气体中燃烧生成 的固体质量由大到小的 排列次序是_二__氧__化__碳__>__氧__气___>_空__气__>__氮__气_____.
点燃
2Mg + O2 →2MgO
点燃
3Mg + N2 → Mg3N2
(40g) (100/3g)
2Mg + CO2 →点燃2MgO +C (46g)
质
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
工业上怎样制取氮气?利用氮气的什么性质?
空气
液化
先气化 液态空气
氮气 b.p -195.8℃
后气化
氧气 b.p -183℃
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮的固定------把大气中的游离态氮转化为氮的化合物 1生物固氮
豆科作物根瘤中的固氮菌常温下将空气中的氮 气转化为硝酸盐。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
2019版高考化学一轮复习第13讲氮及其化合物课件

b.方法
自然固氮高 ⑦能 固 生氮 物固 ( 约氮占(1约0%占)90%) 人工固氮仿 ⑧生 固 合氮 成氨固 氮
活化氮数量增加
c.影响 破坏全球生态平衡问题水 温体 室污 效染 应
(2)NOx的污染
酸雨
a.氮氧化物:主要有NO、N2O、NO2、N2O3、N2O4、N2O5等,其中NO和
(5)检验N H 4时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸
检验逸出的气体 ( ✕ )
(6)用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,是因为浓氨
水呈碱性 ( √ )
自测4 (1)现有1 mol·L-1的氨水,则该溶液中NH3·H2O的物质的量浓度是 1 mol·L-1吗?为什么? (2)为什么蘸有浓氨水和浓盐酸的两支玻璃棒靠近时会产生白烟?蘸有 浓氨水和浓硫酸的两支玻璃棒靠近时是否也产生白烟?
黄色的方法是通入少量O2,发生的反应为:⑥ 4NO2+O2+2H2O
4HNO3 。
(3)强氧化性 a.与金属的反应(大部分金属能与硝酸反应) Cu与浓、稀硝酸均能反应,化学方程式分别为: Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O、⑦ 3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O 。
常温下,铁、铝遇冷的浓HNO3能发生⑧ 钝化 。
b.与非金属的反应,如C+4HNO3(浓) CO2↑+4NO2↑+2H2O。
c.硝酸还能与其他还原剂,如H2S、SO2、Na2SO3、FeSO4、KI、NaBr等 发生氧化还原反应。 d.王水 浓HNO3和浓盐酸按体积比1∶3混合即得王水,它的氧化性更强,能溶解
2020高考一轮复习:第13讲 氮及其重要化合物

B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参与了氮循环
[解析] N2→NH3中氮元素被还原,A错误;工业合成氨是氮气转化为氨气,属 于人工固氮,B正确;通过生物体,铵盐(含氮无机物)与蛋白质(含氮有机物)可 相互转化,C正确;生物体合成蛋白质的过程有C、H、O的参与,D正确。
a无.色通,入而水溴中蒸,气N溶O2于溶水于后水溶发液生呈反橙应色:。3NO2+H2O===2HNO3+NO,反应后溶液
b.通入 AgNO3 溶液中,有淡黄色沉淀生成的为溴蒸气(Br2+H2O HBr +HBrO,HBr+AgNO3===AgBr↓+HNO3),无此现象的为 NO2。
c.通入 CCl4 有机溶剂中,易溶于 CCl4 而且 CCl4 溶液呈橙红色的为溴蒸气, 无此现象的为 NO2。
3_N_O_2+__H_2_O_==_=_2_H_N_O_3_+_N_O_____ 不反应
形成酸雨、__光_化__学_烟__雾______、 破坏臭氧层
4.氮氧化物对环境的污染及防治 (1)常见的污染类型 a产.生光的化一学种烟有雾毒:的N烟Ox雾在。紫外线作用下,与碳氢化合物发生一系列光化学反应,
(8)制二氧化氮时,用水或NaOH溶液吸收尾气 ( )
×
×
(9)工业上利用合成氨实现人工固氮涉及氧化还原反应 ( )
(10)NO2通入FeSO4溶液中始终无明显现象
()
√
(11)在实验室里,NO和NO2均可用排水法收集 ( ) (12)NO能够与人体里血红蛋白结合,造成人体缺氧中毒
()
× ×
√
(13)用湿润的淀粉KI试纸或NaOH溶液可以鉴别溴蒸气和NO2 ( )
必考内容 第四章 非金属及其重要化合物
C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参与了氮循环
[解析] N2→NH3中氮元素被还原,A错误;工业合成氨是氮气转化为氨气,属 于人工固氮,B正确;通过生物体,铵盐(含氮无机物)与蛋白质(含氮有机物)可 相互转化,C正确;生物体合成蛋白质的过程有C、H、O的参与,D正确。
a无.色通,入而水溴中蒸,气N溶O2于溶水于后水溶发液生呈反橙应色:。3NO2+H2O===2HNO3+NO,反应后溶液
b.通入 AgNO3 溶液中,有淡黄色沉淀生成的为溴蒸气(Br2+H2O HBr +HBrO,HBr+AgNO3===AgBr↓+HNO3),无此现象的为 NO2。
c.通入 CCl4 有机溶剂中,易溶于 CCl4 而且 CCl4 溶液呈橙红色的为溴蒸气, 无此现象的为 NO2。
3_N_O_2+__H_2_O_==_=_2_H_N_O_3_+_N_O_____ 不反应
形成酸雨、__光_化__学_烟__雾______、 破坏臭氧层
4.氮氧化物对环境的污染及防治 (1)常见的污染类型 a产.生光的化一学种烟有雾毒:的N烟Ox雾在。紫外线作用下,与碳氢化合物发生一系列光化学反应,
(8)制二氧化氮时,用水或NaOH溶液吸收尾气 ( )
×
×
(9)工业上利用合成氨实现人工固氮涉及氧化还原反应 ( )
(10)NO2通入FeSO4溶液中始终无明显现象
()
√
(11)在实验室里,NO和NO2均可用排水法收集 ( ) (12)NO能够与人体里血红蛋白结合,造成人体缺氧中毒
()
× ×
√
(13)用湿润的淀粉KI试纸或NaOH溶液可以鉴别溴蒸气和NO2 ( )
必考内容 第四章 非金属及其重要化合物
氮及其化合物课件-高一人教版(2019)化学必修第二册

3NO2 + H2O == 2HNO3 + NO 2NO + O2 ==2NO2 4NO2 + O2 + 2H2O == 4HNO3
NO2与O2的体积比 发生的化学反应
剩余气体
= 4:1
4NO2 + O2 + 2H2O =4HNO3
无
﹤4:1 ﹥4:1
4NO2 + O2 + 2H2O =4HNO3
O2
解得: V(NO2)=80mL V(O2)=20mL
(2) 若20mL剩余气体为O2,设参加反应的O2为x mL,则原 混合气体中NO2为100mL-(20+x)mL=(80-x)mL
由V(NO2):V(O2)=4:1 得 (80-x)mL=4x mL 解得:x=16 即V(O2)=20+16=36 ∴ V(NO2)=64 若20mL剩余气体为NO,则 3NO2 + H2O == 2HNO3 + NO 设生成20mLNO需NO2为z mL, 由此可得:z=3×20mL=60mL,即NO2和O2反应共消耗了 40mL,设O2为y mL,则NO2为(40-y)mL. 由V(NO2):V(O2)=4:1 (40-y)mL=4y mL 解得y=8
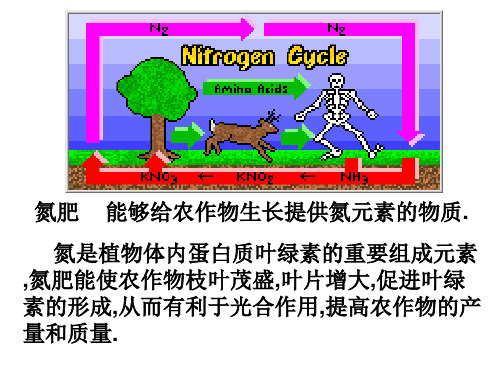
氮肥种类
氨水 (NH3▪H2O) 铵态氮肥 NH4Cl (NH4)2SO4 NH4HCO3 硝态氮肥: KNO3
有机氮肥: 尿素(CO(NH2)2)
N
高温、高压
N2 + 3H2 催化剂
人工固氮
N
大气中的氮
2NH3
氨或铵盐
N
自然界中氮的循环
硝酸盐
化合价
+5 +4
HNO3
NO2与O2的体积比 发生的化学反应
剩余气体
= 4:1
4NO2 + O2 + 2H2O =4HNO3
无
﹤4:1 ﹥4:1
4NO2 + O2 + 2H2O =4HNO3
O2
解得: V(NO2)=80mL V(O2)=20mL
(2) 若20mL剩余气体为O2,设参加反应的O2为x mL,则原 混合气体中NO2为100mL-(20+x)mL=(80-x)mL
由V(NO2):V(O2)=4:1 得 (80-x)mL=4x mL 解得:x=16 即V(O2)=20+16=36 ∴ V(NO2)=64 若20mL剩余气体为NO,则 3NO2 + H2O == 2HNO3 + NO 设生成20mLNO需NO2为z mL, 由此可得:z=3×20mL=60mL,即NO2和O2反应共消耗了 40mL,设O2为y mL,则NO2为(40-y)mL. 由V(NO2):V(O2)=4:1 (40-y)mL=4y mL 解得y=8
氮肥种类
氨水 (NH3▪H2O) 铵态氮肥 NH4Cl (NH4)2SO4 NH4HCO3 硝态氮肥: KNO3
有机氮肥: 尿素(CO(NH2)2)
N
高温、高压
N2 + 3H2 催化剂
人工固氮
N
大气中的氮
2NH3
氨或铵盐
N
自然界中氮的循环
硝酸盐
化合价
+5 +4
HNO3
2019届一轮复习人教版 氮及其重要化合物 课件(60张)

碱石灰 向下排空气
蓝色 白烟
栏目 导引
第四章·非金属及其重要化合物
1.氨水中含氮微粒中最多的微粒是 NH+ 4 ( × ) 2.液氨汽化时要吸收大量的热,可用作制冷剂( √ ) 3.检验 NH+ 4 时,往试样中加入 NaOH 溶液,微热,用湿润的 蓝色石蕊试纸检验逸出的气体( × ) 4.分别充满 HCl、NH3 的烧瓶倒置于水中后液面迅速上升,说 明二者均易溶于水( √ ) 5.用湿润的红色石蕊试纸检验氨气( √ ) 6.固态 NH4Cl 受热升华变为气体( × ) 7.实验室可用浓氨水与生石灰制取氨气( √ )
NO _无__色___ 有毒 不溶
NO2 _红__棕___色__
有毒
能溶
化学 与 O2 反应 _2_N_O__+__O_2_=_=_=__2_N_O__2
性质 与 H2O 反应
__3_N_O__2+___H_2_O_=__=_=___ __2_H_N__O_3_+__N__O______
栏目 导引
第四章·非金属及其重要化合物
栏目 导引
第四章·非金属及其重要化合物
2.用加热法可以分离的一组物质是( ) A.氯化铵和消石灰 B.碳酸氢铵和过氧化钠 C.氯化铵和氯化钠 D.碘和氯化铵
栏目 导引
第四章·非金属及其重要化合物
解析:选 C。铵盐可与碱反应,因此选项 A 在加热时发生反应 2NH4Cl+Ca(OH)2==△===2NH3↑+2H2O+CaCl2,不能用于分 离。选项 B 中的 NH4HCO3 受热分解,且产生的 H2O 及 CO2 能与 Na2O2 反应,也无法达到分离的目的。选项 D 中碘在受热 时升华,NH4Cl 受热分解再重新化合后仍与碘混合,无法达到 分离的目的。对于选项 C,NH4Cl 受热分解后可从体系中脱离, 遇冷又重新化合为 NH4Cl 晶体,从而达到与 NaCl 分离的目的。
蓝色 白烟
栏目 导引
第四章·非金属及其重要化合物
1.氨水中含氮微粒中最多的微粒是 NH+ 4 ( × ) 2.液氨汽化时要吸收大量的热,可用作制冷剂( √ ) 3.检验 NH+ 4 时,往试样中加入 NaOH 溶液,微热,用湿润的 蓝色石蕊试纸检验逸出的气体( × ) 4.分别充满 HCl、NH3 的烧瓶倒置于水中后液面迅速上升,说 明二者均易溶于水( √ ) 5.用湿润的红色石蕊试纸检验氨气( √ ) 6.固态 NH4Cl 受热升华变为气体( × ) 7.实验室可用浓氨水与生石灰制取氨气( √ )
NO _无__色___ 有毒 不溶
NO2 _红__棕___色__
有毒
能溶
化学 与 O2 反应 _2_N_O__+__O_2_=_=_=__2_N_O__2
性质 与 H2O 反应
__3_N_O__2+___H_2_O_=__=_=___ __2_H_N__O_3_+__N__O______
栏目 导引
第四章·非金属及其重要化合物
栏目 导引
第四章·非金属及其重要化合物
2.用加热法可以分离的一组物质是( ) A.氯化铵和消石灰 B.碳酸氢铵和过氧化钠 C.氯化铵和氯化钠 D.碘和氯化铵
栏目 导引
第四章·非金属及其重要化合物
解析:选 C。铵盐可与碱反应,因此选项 A 在加热时发生反应 2NH4Cl+Ca(OH)2==△===2NH3↑+2H2O+CaCl2,不能用于分 离。选项 B 中的 NH4HCO3 受热分解,且产生的 H2O 及 CO2 能与 Na2O2 反应,也无法达到分离的目的。选项 D 中碘在受热 时升华,NH4Cl 受热分解再重新化合后仍与碘混合,无法达到 分离的目的。对于选项 C,NH4Cl 受热分解后可从体系中脱离, 遇冷又重新化合为 NH4Cl 晶体,从而达到与 NaCl 分离的目的。
高三化学氮及其重要的化合物PPT优秀课件

思考2:不对。在跟金属反应时,浓硝酸一 般被还原为NO2而稀硝酸一般被还原为NO的原 因,可作如下简单解释:硝酸越浓,氧化性越
强,反应中即使生成了氮的低价化合物,也会 被浓HNO3氧化为氮的较高价氧化物——NO2;硝 酸较稀时,氧化能力较弱,生成氮元素的较低 价氧化物——NO,NO不会被稀HNO3进一步氧化 。
自主检查 1.下列实验过程中,始终无明显现象的是( ) A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中 C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
[答案]B
2.下列变化中,属于物理变化的是( ) A.氮的固定 B.加热NH4Cl晶体,受热后由试管底部移 到试管上部
2
盐的性 质与应
制法。 2.了解铵盐的主要性质,
用 认识它在生产中的应用。
硝酸的
基础回扣 一、N2和氮氧化合物 1.N2的主要性质 (1)N2的还原性:______________。
2.NO、NO2的主要性质 (1)一氧化氮在常温下很容易与空气中的氧 气反应,化学方程式为 ____________________。
D.一氧化氮易溶于水,不能用排水法收集
[答案]C
5.下列对于硝酸的认识,不正确的是(
)
A.浓HNO3和稀HNO3都具有氧化性 B.铜与HNO3的反应属于置换反应 C.金属与HNO3反应不产生氢气 D.可用铁和铝制容器盛装浓HNO3 [答案]B
(2)不稳定性:
浓硝酸显黄色,是因为 __________________,
说明浓硝酸具有________性,化学方程式 为__________。
(3)强氧化性 ①与金属的反应
a.除Pt、Au外,大部分金属均能与HNO3 反应。
强,反应中即使生成了氮的低价化合物,也会 被浓HNO3氧化为氮的较高价氧化物——NO2;硝 酸较稀时,氧化能力较弱,生成氮元素的较低 价氧化物——NO,NO不会被稀HNO3进一步氧化 。
自主检查 1.下列实验过程中,始终无明显现象的是( ) A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中 C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
[答案]B
2.下列变化中,属于物理变化的是( ) A.氮的固定 B.加热NH4Cl晶体,受热后由试管底部移 到试管上部
2
盐的性 质与应
制法。 2.了解铵盐的主要性质,
用 认识它在生产中的应用。
硝酸的
基础回扣 一、N2和氮氧化合物 1.N2的主要性质 (1)N2的还原性:______________。
2.NO、NO2的主要性质 (1)一氧化氮在常温下很容易与空气中的氧 气反应,化学方程式为 ____________________。
D.一氧化氮易溶于水,不能用排水法收集
[答案]C
5.下列对于硝酸的认识,不正确的是(
)
A.浓HNO3和稀HNO3都具有氧化性 B.铜与HNO3的反应属于置换反应 C.金属与HNO3反应不产生氢气 D.可用铁和铝制容器盛装浓HNO3 [答案]B
(2)不稳定性:
浓硝酸显黄色,是因为 __________________,
说明浓硝酸具有________性,化学方程式 为__________。
(3)强氧化性 ①与金属的反应
a.除Pt、Au外,大部分金属均能与HNO3 反应。
氮及其化合物中小学PPT教学课件

B.氨水中滴入酚酞变红,是因为氨气能电离出氢氧
根离子
C.因氨水中的氨主要以NH3·H2O的形式存在,故25% 的氨水是指每100 g氨水中含NH3·H2O 25 g
D.NH3·H2O的热不稳定性可以解释实验室中用加热氨 水的方法制取氨气
解析:氨气极易溶于水,常温下1体积的水溶解约700 体积的氨气,故A项中剩余气体中不含氨气,错误; 氨水显碱性的原因是氨气与水反应生成的一水合氨电 离出氢氧根离子,B项错误;虽然氨在其水溶液中主 要以一水合氨的形式存在,但习惯上认为氨水的溶质 是氨,C项错误;NH3·H2O不稳定,受热容易分解, 向浓氨水中加入氧化钙制取氨气的原因之一就是氧化 钙与水反应消耗水以及反应放热.
V(O2)=1.4 mL,V(NO2)=(4×1.4 mL)+3 mL=8.6 mL.
[答案] 7.2 mL NO2和2.8 mL O2或8.6 mL NO2和1.4 mL O2
1.如图所示,试管中盛装的是红棕色气 体(可能是混合物),当倒扣在盛有水 的水槽中时,试管内水面上升,但不 能充满试管,当向试管内鼓入氧气后, 可以观察到试管中水柱继续上升,经过多次重复后,试 管内完全被水充满,原来试管中盛装的可能是什么气体 ()
(2)若剩余的1 mL气体是NO,根据3NO2+H2O === 2HNO3+NO,则发生反应4NO2+O2+2H2O === 4HNO3 时过量的NO2体积为3 mL,设反应的O2的体积为y,则有 4NO2+O2+2H2O === 4HNO3
4y
y
则(4y+3)mL+y=10 mL,解得:y=1.4 mL,
答案:(1)C+4HNO3(浓)= =△= = = CO2↑+4NO2↑+2H2O
(2)
(3)加热
化学人教版(2019)必修第二册5.2.2氮及其化合物(共32张ppt)

一、氮气
1、物理性质
无色、无味
熔点、沸点很低(m.p.−210℃ b.p.−196℃)
密度略小于空气(ρ=1.25g·L−1)
难溶于水(1:0.02)
“潜水病”知多少?
2、原子结构 +7 2 5 常见价态 −3 0 +1 +2 +3 +4 +5
3、单质分子 N2
电 子 式 ··N······N··
氮气能否助燃?
N2
+
3H2
高温 高压 催化剂
2NH3
N2 + O2 =放==电= 2NO 2NO + O2 ==== 2NO2 N2 + O2 =高==温= 2NO
气态氢化物稳定性有何变化规律? NH3____H2O____HF,HI____HBr____HCl____HF
氮气与氧气能否共存、会否反应? 放电之初无明显现象,后来变红棕色,why? 为何不写成N2 + O2 ==== 2NO2? 生活中N2与O2的化合反应会在哪里发生?
氮气与氧气能否共存、会否反应? 放电之初无明显现象,后来变红棕色,why?
二、氮氧化物
1、物理性质
NO 无色气体 难溶于水
NO2 红棕色气体
易液化、易溶于水
氮氧化物包括多种化合物,如N2O、NO、NO2、N2O4、N2O3和N2O5等。 除NO2以外,其他氮氧化物均不稳定,遇光、湿或热变成NO2及NO。因此 ,职业环境中接触的是几种气体混合物常称为硝气,主要为NO2和NO。 NO为无色气体,分子量30.01,熔点-163.6℃,沸点-151.5℃。溶于乙醇、 二硫化碳,难溶于水和硫酸。水中溶解度4.7%(20℃)?
用浓氨水检验输送氯气管道是否泄漏, 82NH3 + 3Cl2 ==== N2 + 6NHHC4lCl 冒白烟处即泄漏点。
1、物理性质
无色、无味
熔点、沸点很低(m.p.−210℃ b.p.−196℃)
密度略小于空气(ρ=1.25g·L−1)
难溶于水(1:0.02)
“潜水病”知多少?
2、原子结构 +7 2 5 常见价态 −3 0 +1 +2 +3 +4 +5
3、单质分子 N2
电 子 式 ··N······N··
氮气能否助燃?
N2
+
3H2
高温 高压 催化剂
2NH3
N2 + O2 =放==电= 2NO 2NO + O2 ==== 2NO2 N2 + O2 =高==温= 2NO
气态氢化物稳定性有何变化规律? NH3____H2O____HF,HI____HBr____HCl____HF
氮气与氧气能否共存、会否反应? 放电之初无明显现象,后来变红棕色,why? 为何不写成N2 + O2 ==== 2NO2? 生活中N2与O2的化合反应会在哪里发生?
氮气与氧气能否共存、会否反应? 放电之初无明显现象,后来变红棕色,why?
二、氮氧化物
1、物理性质
NO 无色气体 难溶于水
NO2 红棕色气体
易液化、易溶于水
氮氧化物包括多种化合物,如N2O、NO、NO2、N2O4、N2O3和N2O5等。 除NO2以外,其他氮氧化物均不稳定,遇光、湿或热变成NO2及NO。因此 ,职业环境中接触的是几种气体混合物常称为硝气,主要为NO2和NO。 NO为无色气体,分子量30.01,熔点-163.6℃,沸点-151.5℃。溶于乙醇、 二硫化碳,难溶于水和硫酸。水中溶解度4.7%(20℃)?
用浓氨水检验输送氯气管道是否泄漏, 82NH3 + 3Cl2 ==== N2 + 6NHHC4lCl 冒白烟处即泄漏点。
高考化学总复习 第四章 13 氮及其化合物课件

第四章 非金属及其化合物
第13讲 氮及其化合物
微考点•大突破 微充电•大收获
微考点•大突破
探微提能 点点结合
•微考点1 氮气 氮的氧化物
•基础微回扣
• 一、氮气
• 1.物理性质 • 通常情况下,N2
溶于水。
无_____
__无___
_不____
• 2.化学性质 • (1)与O2反放应电。 • __N_2_+_O_2=_==_==_2_NO________________。 • (2)工业合成氨催。化剂 • ____N_2+_3_H_2高_温_、__高_压_2_NH_3___________。 • (3)与Mg反应点燃。 • __3_M_g_+_N_2=_==_==_M_g_3N_2 ______________。
2.原子组成法 4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,即1.(1)中的 ②③两种情况中的总反应式都与N2O5+H2O===2HNO3等效。这不仅是记 忆1.(1)中的②③二式的方法,也为上述问题的解决提供了新的思路,即利 用混合气体中的N、O原子个数比进行分析判断。
N(N)∶N(O)< =22∶ ∶55, ,恰O2好剩完余全反应 >2∶5,NO剩余
序号
气体
反应 剩余气体 剩余气体的体积
Ⅰ
NO2
①
NO
1 3V(NO2)
Ⅱ
NO2+NO
①
NO
V(NO)原+13V(NO2)
VVNOO22=4∶1
②
无
Ⅲ
NO2 +O2
VVNOO22<4∶1
②
O2
VVNOO22>4∶1
①②
NO
0 V(O2)原-14V(NO2) 13[V(NO2)-4V(O2)]
第13讲 氮及其化合物
微考点•大突破 微充电•大收获
微考点•大突破
探微提能 点点结合
•微考点1 氮气 氮的氧化物
•基础微回扣
• 一、氮气
• 1.物理性质 • 通常情况下,N2
溶于水。
无_____
__无___
_不____
• 2.化学性质 • (1)与O2反放应电。 • __N_2_+_O_2=_==_==_2_NO________________。 • (2)工业合成氨催。化剂 • ____N_2+_3_H_2高_温_、__高_压_2_NH_3___________。 • (3)与Mg反应点燃。 • __3_M_g_+_N_2=_==_==_M_g_3N_2 ______________。
2.原子组成法 4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,即1.(1)中的 ②③两种情况中的总反应式都与N2O5+H2O===2HNO3等效。这不仅是记 忆1.(1)中的②③二式的方法,也为上述问题的解决提供了新的思路,即利 用混合气体中的N、O原子个数比进行分析判断。
N(N)∶N(O)< =22∶ ∶55, ,恰O2好剩完余全反应 >2∶5,NO剩余
序号
气体
反应 剩余气体 剩余气体的体积
Ⅰ
NO2
①
NO
1 3V(NO2)
Ⅱ
NO2+NO
①
NO
V(NO)原+13V(NO2)
VVNOO22=4∶1
②
无
Ⅲ
NO2 +O2
VVNOO22<4∶1
②
O2
VVNOO22>4∶1
①②
NO
0 V(O2)原-14V(NO2) 13[V(NO2)-4V(O2)]
高考一轮复习 氮及其化合物(2课时,共56张PPT)

H+(少量)
②氨跟酸的反应 氨气+酸→铵盐
NH3 + HCl =NH4Cl(现象:白烟。用于NH3的检验)
NH3 + HNO3=NH4NO3 2NH3 + H2SO4 =(NH4)2SO4
(现象:白烟)
②与酸反应 氨气+酸→铵盐
a. 蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻 璃棒靠近,其现象为 有白烟生成 ,
3. 用途 4. 制法
考点二:氮的氧化物
1. NO、NO2 (1)物理性质 (2)化学性质 (3)制法
2. NO2、Br2 (1)共性 (2)特性
17
考点: 氮及其化合物
课时二:氨 硝酸
【考纲解读】 1. 掌握NH3的性质及实验室制法; 2. 掌握铵盐的不稳定性及NH4+的检验; 3. 掌握HNO3的性质; 4. 了解HNO3的工业制法。
环境 的关 系
②转化成NO2形成 酸雨、光化学烟雾光化烟雾10直击高考
3. 汽车排放的尾气中含有NO2,NO2是城 市大气污染的主要污染物之一,在日光照射
下,NO2发生一系列光化学烟雾的循环反 应,从而不断产生O3,加重空气污染。反 应过程为①2NO2→2NO+2O,②2NO+ O2→2NO2,③O+O2→O3。下列对该反 应过程及生成物叙述正确的是 ( )
相似相容原理 与水分子间形 氨极易溶于水 成氢键
应用:喷泉实验
20
喷泉实验的原理 中学教材中喷泉实验装置如右 图所示。实验操作是:打开橡 皮管上的夹子,挤压滴管的胶 头,则烧杯中的水由玻璃管进 入烧瓶,形成喷泉。
(1)喷泉实验的原理 因为烧瓶内气体易溶于水或易与水反应,
使瓶内压强减小,形成压强差,大气压将 烧杯中的水压入烧瓶而形成喷泉。
②氨跟酸的反应 氨气+酸→铵盐
NH3 + HCl =NH4Cl(现象:白烟。用于NH3的检验)
NH3 + HNO3=NH4NO3 2NH3 + H2SO4 =(NH4)2SO4
(现象:白烟)
②与酸反应 氨气+酸→铵盐
a. 蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻 璃棒靠近,其现象为 有白烟生成 ,
3. 用途 4. 制法
考点二:氮的氧化物
1. NO、NO2 (1)物理性质 (2)化学性质 (3)制法
2. NO2、Br2 (1)共性 (2)特性
17
考点: 氮及其化合物
课时二:氨 硝酸
【考纲解读】 1. 掌握NH3的性质及实验室制法; 2. 掌握铵盐的不稳定性及NH4+的检验; 3. 掌握HNO3的性质; 4. 了解HNO3的工业制法。
环境 的关 系
②转化成NO2形成 酸雨、光化学烟雾光化烟雾10直击高考
3. 汽车排放的尾气中含有NO2,NO2是城 市大气污染的主要污染物之一,在日光照射
下,NO2发生一系列光化学烟雾的循环反 应,从而不断产生O3,加重空气污染。反 应过程为①2NO2→2NO+2O,②2NO+ O2→2NO2,③O+O2→O3。下列对该反 应过程及生成物叙述正确的是 ( )
相似相容原理 与水分子间形 氨极易溶于水 成氢键
应用:喷泉实验
20
喷泉实验的原理 中学教材中喷泉实验装置如右 图所示。实验操作是:打开橡 皮管上的夹子,挤压滴管的胶 头,则烧杯中的水由玻璃管进 入烧瓶,形成喷泉。
(1)喷泉实验的原理 因为烧瓶内气体易溶于水或易与水反应,
使瓶内压强减小,形成压强差,大气压将 烧杯中的水压入烧瓶而形成喷泉。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
题组一 氮气、一氧化氮、二氧化氮 1.判断下列说法是否正确。 (1)NO只能用排水法收集,不能用排空气法收集。 ( ) (2)NO2只能用排空气法收集,不能用排水法收集。 ( ) (3)NO、NO2都是酸性氧化物。 ( ) (4)氮的氧化物能导致光化学烟雾和酸雨、破坏臭氧层。 ( )
答案 (1)√ (2)√ (3)✕ (4)√
课标版 化学 第13讲 氮及其化合物
教材研读
题组一 氮气、一氧化氮、二氧化氮 1.氮气的物理性质
颜色
状态
气味
① 无色
气体
无味
2.氮气的化学性质
水中的溶解性 不溶
3.一氧化氮、二氧化氮
物质
物理性质
颜色 毒性
NO 无色 有毒
NO2 ⑤ 红棕 色
有毒
溶解性
⑥ 难溶 于水
易溶于水
化学性质
与O2反应 ⑦ 2NO+O2 2NO2 与H2O反应
题组三 硝酸 6.判断下列说法是否正确。 (1)浓硝酸的还原产物一般是NO2,而稀硝酸的还原产物一般是NO,并且硝 酸的浓度越大,氧化性越强。 ( ) (2)硝酸与金属反应时,只体现硝酸的强氧化性。 ( ) (3)硝酸与活泼金属Mg、Al等反应产生H2,而与Cu反应产生NO或者NO2。
() (4)将浓硝酸滴在干燥的蓝色石蕊试纸上,现象是先变红后褪色。 ( )
答案 B 纯净的NH3能在O2中燃烧,产物是N2和H2O,也能在高温和催化 剂的作用下发生催化氧化反应,但是不能在空气中燃烧,A项错;由于氨水中 存在:NH3·H2O N +HO4H-,故氨水显碱性,B项对;氨气只有与挥发性酸相 遇才能生成白烟,C项错;氨水是混合物,D项错。
5.下列说法不正确的是 ( )
(2)化学性质
NH3— (3)制法与用途 a.实验室制法:④ 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O 。
b.工业制法:⑤ N2+3H2
2NH3 。
c.用途:制HNO3、铵盐、纯碱、尿素、制冷剂等。
2.铵盐
(1)构成:由N
H
和酸根离子构成。
4
(2)物理性质:白色或无色晶体,都能溶于水。
2H2O+4NO2↑+O2↑ 。
b.存放:HNO3应盛放在④ 棕 色试剂瓶里,并存放在⑤ 黑暗阴凉 处。 c.浓硝酸常呈黄色是因为HNO3分解产生的NO2溶解于硝酸中,去掉硝酸中 黄色的方法是通入少量O2,发生的反应为:⑥4NO2+O2+2H2O 4HNO3 。 (3)强氧化性 a.与金属的反应(大部分金属能与硝酸反应) Cu与浓、稀硝酸均能反应,化学方程式分别为:
的氧化产物,如4NH3+5O2 4NO+6H2O,故C正确。NO与O2按4∶3的 体积比混合后与足量水反应,可完全转化为HNO3:4NO+3O2+2H2O 4 HNO3。
题组二 氨和铵盐 4.有关氨的性质的叙述正确的是 ( ) A.氨能在空气中燃烧 B.氨水呈碱性 C.氨水和酸相遇都能产生白色烟雾 D.纯净的氨水是化合物
2.下列反应必须加入氧化剂且一步反应就能完成的是 ( ) ①N2→NO2 ②NO2→NO ③NO2→HNO3 ④N2→NO ⑤N2→NH3 A.① B.②⑤ C.④ D.③④
答案 C 该题有两个要求:(1)必须加入氧化剂;(2)一步反应就能完成。 反应①、③、④从化合价角度来看都升高,但反应①N2→NO2不能一步反 应就完成;而反应③NO2→HNO3不加氧化剂也能实现,如3NO2+H2O 2 HNO3+NO,在该反应中,NO2既是氧化剂又是还原剂;只有反应④N2→NO必 须加入氧化剂且一步反应就能完成。
⑧ 3NO2+H2O 2H
NO3+NO
与人体、环境的关系
a.与血红蛋白结合,使人中毒 形成酸雨、光化 b.转化成NO2,形成酸雨、光 学烟雾 化学烟雾
题组二 氨和铵盐
1.氨
(1)结构与物理性质
电子式
密度
H
N
① H··
比空气小
··H
气味
水溶性
强烈刺激性气味 常温常压下,1体积水大约 能溶解② 700体积氨气
(3)化学性质—
题组三 硝酸 1.物理性质 (1)纯硝酸为无色、有① 刺激性 气味的② 液 体。 (2)硝酸沸点较低,易挥发,在空气中遇水蒸气形成白雾。 (3)质量分数在69%以上的硝酸称为浓硝酸。 2.化学性质 (1)强酸性 稀硝酸使紫色石蕊试液变红。 (2)不稳定性 a.浓硝酸不稳定,见光或受热易分解,反应的化学方程式为:③ 4HNO3(浓)
3.最近的病毒学研究发现,一氧化氮对非典病毒抑制作用明显,下列关于 NO的说法正确的是 ( ) A.NO是亚硝酸的酸酐 B.NO只能通过人工合成 C.NO可以是某些含低价态氮元素的物质的氧化产物 D.NO与O2按4∶1的体积比混合后与足量水反应可完全转化为硝酸
答案 C 亚硝酸(HNO2)的酸酐是N2O3,故A错。NO可以通过人工合成, 也可以通过雷电作用生成,故B错。NO可以是某些含低价态氮元素的物质
A.①②④ B.③⑤⑥ C.①⑤⑥ D.②⑤⑥
答案 C NH3溶于水生成NH3·H2O,NH3·H2O部分电离而使氨水导电,故 NH3不是电解质;在氨水中,NH3·H2O的电离很微弱,故含氮元素最多的微粒 是NH3·H2O;当NH3和HNO3等物质的量反应生成NH4NO3时,N H4水解使溶液 呈酸性。
①氨气溶于水能导电,所以氨气是电解质
②实验室可用浓氨水与NaOH固体制取氨气
③氨和酸反应生成铵盐,与挥发性酸相遇时能形成白烟
④某晶体与NaOH共热放出一种能使湿润的红色石蕊试纸变蓝的气体,则
该晶体中含有N
H
4
⑤氨水中含有氮元素最多的微粒是N
H
4
⑥把NH3通入稀HNO3中,当NH3和HNO3等物质的量反应时,溶液的pCu(NO3)2+2NO2↑+2H2O、⑦ 3Cu+8HNO3(稀) 3 Cu(NO3)2+2NO↑+4H2O 。 常温下,铁、铝遇冷的浓HNO3能发生⑧ 钝化 。 b.与非金属(木炭)的反应:C+4HNO3(浓) CO2↑+4NO2↑+2H2O。 c.硝酸还能与其他还原剂,如H2S、SO2、Na2SO3、FeSO4、KI、NaBr等发 生氧化还原反应。 d.王水 浓HNO3和浓盐酸按体积比1∶3混合即为王水,它的氧化性更强,能溶解 Pt、Au等金属。
