2015年河北省高中化学竞赛初赛试题图片版
2015高中化学竞赛测试题.doc

2015高中化学竞赛测试题(时间:120分钟满分:150分)一、选择题(每小题只有1个正确答案,各3分,共30分)1.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现了A1的超原子结构Al13和Al14,并在质谱仪检测到稳定的Al13I—等。
A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。
下列说法不正确的是A Al14与ⅡA族元素性质相似B Al13与卤素性质类似C 在气相中能发生反应:Al13+HI=HAl13ID Al13中Al原子间是通过离子键结合的2.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、生态学和环境科学研究中获得广泛应用。
如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。
下列说法正确的是A 34S原子核内中子数为16B 1H216O在相同条件下比1H218O更易蒸发C 13C和15N原子核内的质子数相差2D 2H+的酸性比1H+的酸性更强3.下列四个反应:①氨气与氯化氢混合产生白烟;②硫化氢和二氧化硫混合生成淡黄色固体;③乙醇和乙酸反应生成乙酸乙酯;④CH3COO-和H+结合成CH3COOH。
其中属于化合反应的有A 0个B 1个C 2个D 3个4.除去下列物质中的少量杂质(括号内为杂质),所选试剂和分离方法能达到目的的是A 苯(苯酚):溴水、过滤B CO2气体(HCl):饱和Na2CO3溶液、洗气C 淀粉(氯化钠):蒸馏水、渗析D 乙酸乙酯(乙酸):NaOH溶液、分液5.蒽与苯炔反应生成化合物A:如果A中二个氢被甲基取代的异构体种数有A 11B 13C 15D 176.苯酚和甲醛以物质的量2︰3完全反应生成酚醛树脂,所得产物中C、H两原子物质的量之比是A 1︰1B 7︰6C 5︰4D 5︰67.关节炎病原因是在关节滑液中形成尿酸钠晶体①HUr(尿酸)+H 2O Ur-(尿酸根离子)+H3O+②Ur-(,溶液)+Na+(溶液)NaUr(固)第一次关节炎发作大部分在寒冷季节脚趾和手指的关节处。
15全国高中学生化学竞赛(省级赛区)试题

全国高中学生化学竞赛(初赛)试题及答案按:为节省版面原试题提供的给出元素符号和相对原子质量的元素周期表和对评分的某些说明被删节.1. 1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。
按已知的原子结构规律,118号元素应是第__周期第__族元素,它的单质在常温常压下最可能呈现的状态是__(气、液、固选一填入)态。
近日传闻俄国合成了第166号元素,若已知原子结构规律不变,该元素应是第__周期第____族元素。
(5分)答案: 七; 零; 气; 八; VIA2.今年是勒沙特列(Le Chatelier1850-1936)诞生150周年。
请用勒沙特列原理解释如下生活中的常见现象:打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。
(6分) 答案要点: 溶解平衡 CO 2(气) = CO 2(溶液)受CO 2气体的压力和温度影响, 平衡按勒沙特列原理移动. 压力和温度各3分. 不与勒沙特列原理挂钩不给分.3.1999年合成了一种新化合物,本题用X 为代号。
用现代物理方法测得X 的相对分子质量为64;X 含碳93.8%,含氢6.2%;X 分子中有3种化学环境不同的氢原子和4种化学环境不同的碳原子;X 分子中同时存在C —C 、C=C 和C ≡C 三种键,并发现其C=C 键比寻常的C=C 短。
3-1.X 的分子式是____(2分)3-2.请将X 的可能结构式画在下面的方框内。
(4分) 答案1, C 5H 4 2.如附图3a(只有一种可能结构; 重键位置必须正确, 而键角和立体结构则不要求).4.理想的宏观单一晶体呈规则的多面体外形。
多面体的面叫晶面。
今有一枚MgO 单晶如附图1所示。
它有6个八角形晶面和8个正三角形晶面。
宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。
已知MgO 的晶体结构属NaCl 型。
它的单晶的八角形面对应于它的晶胞的面。
请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。
高中化学竞赛初赛试卷(04)

高中化学竞赛初赛试卷(04)(时间:3小时满分:100分)题号 1 234567、891011满分7561012'141176814H相对原子质量&HeLi Be B C(N O F NeNa > Mg Al Si P!SCl ArK Ca·Sc Ti V Cr Mn—FeCo Ni Cu Zn】GaGe As Se Br、KrRb Sr Y Zr·Nb Mo Tc[98]Ru Rh)PdAg Cd In Sn)SbTe I XeCs~Ba La-Lu Hf Ta WRe—Os Ir Pt AuHg—Tl Pb Bi Po[210]At【[210]Rn[222]Fr [223]Ra[226]Ac-La Rf Db.SgBh Hs Mt DsLa系La~CePr Nd Pm Sm—EuGd Tb Dy Ho:ErTm Tb Lu第一题(7分)工业上生产氨所需的氮来自,氢来自,氨氧化制硝酸的催化剂是_____,写出氨氧化制硝酸中的全部反应方程式。
第二题(5分)某不饱和烃A,分子式为C9H8,它能和银氨溶液反应产生白色沉淀B。
A催化加氢得到化合物C(C9H12),将化合物B用酸性高锰酸钾氧化得到化合物D(C8H6O4),将化合物加热则得到另一个不饱和化合物E。
试写出A,B,C,D,E的结构。
《第三题(6分)MgSO4·7H2O可用造纸、纺织、陶瓷、油漆工业,也可在医疗上用作泻盐。
它可以由某种工业废渣中提练,该工业废渣主要成分是MgCO3,另外还有CaCO3、B2O3、SiO2等杂质。
试设计从此废渣中提出MgSO4·7H2O(要求写出主要实验步骤)。
CaSO4和MgSO4的溶解度与温度的关系如右图所示#第四题(10分)实验室制备少量的碘乙烷:将红磷粉末放入乙醇里,在不断振荡下逐次加入细粒的I2,则有反应:2P+3I2→2PI3…………待反应缓和后,用右图装置进行水浴加热,半小时后反应可基本完成,这时反应液中已基本无固体颗粒I2和红磷,然后要加入一些物质X,并将竖直的冷凝管更换为横放的冷凝管,水浴加热,蒸馏出粗品碘乙烷,此粗品中溶有乙醇和碘(纯净的碘乙烷为无色不溶于水的液体,沸点℃),请回答下列问题:1.写出由PI3制备碘乙烷的主反应和副反应。
高中化学竞赛,强基计划,大学化学自招,有机化学-2015-2019全国初赛真题
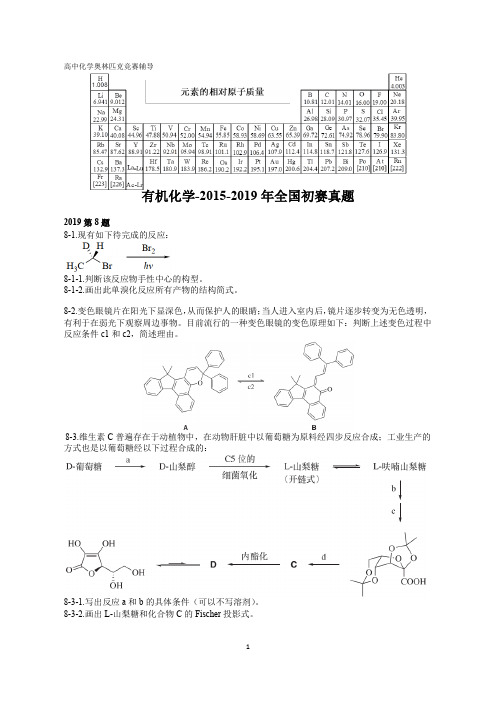
高中化学奥林匹克竞赛辅导有机化学-2015-2019年全国初赛真题2019第8题8-1.现有如下待完成的反应:8-1-1.判断该反应物手性中心的构型。
8-1-2.画出此单溴化反应所有产物的结构简式。
8-2.变色眼镜片在阳光下显深色,从而保护人的眼睛;当人进入室内后,镜片逐步转变为无色透明,有利于在弱光下观察周边事物。
目前流行的一种变色眼镜的变色原理如下:判断上述变色过程中反应条件c1和c2,简述理由。
8-3.维生素C普遍存在于动植物中,在动物肝脏中以葡萄糖为原料经四步反应合成;工业生产的方式也是以葡萄糖经以下过程合成的:8-3-1.写出反应a和b的具体条件(可以不写溶剂)。
8-3-2.画出L-山梨糖和化合物C的Fischer投影式。
8-4.以下给出四个取代反应,右侧是其中某一反应的反应势能图:(1)CH3CH2Br+NaOCH3→(2)(CH3)3CBr+HOCH3→(3)(CH3)2CHI+KBr→(4)(CH3)3CCl+(C6H5)3P→8-4-1.指出哪个反应与此反应势能图相符。
8-4-2.画出过渡态E和F的结构式。
解:2019第9题某简单芳香三酮化合物在有机合成、生物化学以及分析化学中均具有重要的应用。
它常以水合物的形式稳定存在,室温下此水合物在浓硫酸中与苯反应高产率地生成化合物G。
G的核磁共振氢谱为:δ 7.27–7.34(10H),7.91(2H),8.10(2H)ppm。
9-1.画出G的结构简式。
9-2.研究发现,当使用超酸三氟甲磺酸代替浓硫酸后,反应的产物如下图左所示。
研究还表明,化合物G在三氟甲磺酸作用下也可以转化为该化合物。
画出化合物G转化为此产物过程中所形成的中间体。
提示:同一物种只须画出其中一个主要共振式。
9-3.参照以上实验结果,如果希望制备以下内酯,画出所用原料H的结构简式(说明:LA为Lewis 酸)9-4.室温下五元环状化合物克酮酸(croconic acid,C5H2O5)在浓硫酸的作用下先与等量的苯反应形成中间体I(C11H6O4);I继续在苯中反应生成J(C23H16O3)。
高中化学竞赛初赛试卷(12)
高中化学竞赛初赛试卷(12)(时间:3小时满分:100分)第一题(5分)1.陶瓷表面有一层绚丽多彩的釉,加工方法是在普通釉中加入一些金属元素,控制烧制时空气的用量(即氧用量)即可得到不同的颜色。
若空气不足,铁、铜、锰元素形成的化合物呈现的颜色分别是A 蓝或绿、红、黑褐B 红或黄、蓝、紫褐C 蓝或绿、蓝、黑褐D 红或黄、红、紫褐2.能源是当今社会发展的三大支柱之一,是制约国民经济发展的瓶颈。
有专家提出:如果对燃料燃烧产物如CO2、H2O,N2等利用太阳能让它们重新组合,使之能够实现(如右图),那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。
在此构想的物质循环中太阳能最终转化为A 化学能B 热能C 生物能D 电能3.重氮甲烷的分子式为CH2N2,能与具有酸性的有机物发生化学反应,例如:CH3COOH +CH2N2→CH3COOCH3+N2。
已知下列化合物都能和CH2N2反应,则其中生成的有机物不属于酯类的是A C6H5SO2OHB C6H5OHC C6H5CHOD C6H5COOH4.地壳岩石中含有很多种复杂的硅酸盐,象花岗石里的正长石(KAlSi3O8)在长期风化,进行复杂的变化后,能生成以下物质A 石灰石、沸石和硅酸钾B 高岭土、硅酸和碳酸氢钾C 滑石粉、刚玉和硝酸钾D 粘土、砂和无机盐5.在一定条件下,可逆反应2A(气)+B(气)nC(固)+D(气)达平衡。
若维持温度不变,增大压强,测得混合气体的平均相对分子质量不发生改变,则下列说法正确的是A 其他条件不变,增大压强,平衡不发生移动B 其他条件不变,增大压强,混合气体的总质量不变C 该反应式中n值一定为2D 原混合气体中A与B的物质的量之比为2︰1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量)第二题(7分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体所释放出的热能为氯化钠晶体的晶格能。
1.下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是。
2015年全国化学竞赛试题及答案

2015年全国高中化学奥林匹克竞赛预赛试题(满分100分时间120分钟)可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32Cl-35.5 K-39 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137一、选择题(本题包括18小题,每题2分,共36分,每题有.1.~.2.个.选项符合题意。
多选错选不得分,有两个答案的只选一个且答对者得1分)1.两位美国科学家彼得·阿格雷和罗德里克·麦金农,因为发现细胞膜水通道,以及对离子通道结构和机理研究作出的开创性贡献而获得2003年诺贝尔化学奖。
他们之所以获得诺贝尔化学奖而不是生理学或医学奖是因为( )。
A.他们的研究和化学物质水有关B.他们的研究有利于研制针对一些神经系统疾病和心血管疾病的药物C.他们的研究深入到分子、原子的层次D.他们的研究深入到细胞的层次2.为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包藏有碳氢化合物(当然这仅仅是探索的第一步)。
科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。
这个实验不能用普通盐酸,其理由是( )。
A.普通盐酸的酸性太强B.普通盐酸具有挥发性C.普通盐酸和月球岩石中的碳化物无法反应D.无法区别岩石中原来含有的是碳化物,还是碳氢化合物3.下列与“神舟五号”载人飞船有关的说法不正确...的是( )。
A.飞船的表面覆盖的一层石墨瓦之所以能起到保护作用是因为石墨能够耐高温B.宇航员的食物做成大小可口的“一口酥”,目的是防止飞船内产生飘尘C.飞船在宇宙中运行时,船舱内温度低、氧气少,无法划着火柴D.在飞船上使用LiOH吸收多余的CO2而不使用NaOH4.下列解释不科学...的是( )。
A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2的缘故B.长期盛放NaOH溶液的试剂瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成“负压”的缘故C.严格地讲,实验室使用“通风橱” 防污染是不负责任的,因为实验产生的有害气体没有得到转化或吸收D.“雨后彩虹”与“海市蜃楼”都是自然界的光学现象,也与胶体的知识有关5.2002年12月31日,世界上第一条商业磁悬浮铁路在上海投入运营。
全国高中化学竞赛(初赛)试题15(含答案)

高中化学竞赛初赛试卷(15)(时间:3小时满分:100分)第一题(3分)一个250mL锥形瓶中盛大约3mL液溴(密度为3.18g/cm3),另一个250mL锥形瓶中盛氯气(标准状况下为3.17g/L)。
分别加入过量的铝,加塞。
在哪一个瓶子里反应更为剧烈,为什么?第二题(9分)工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行:第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。
1.写出第一步制取K2MnO4的反应方程式。
连续搅拌的目的是什么?2.写出电解KMnO4的浓溶液时的两极发生的电极反应式和电解总的反应方程式。
3.高锰酸钾在240~300℃加热时失重12.66%,写出反应方程式。
(已知K2MnO4 640℃分解,K3MnO4 800℃分解。
)某金属是立方面心晶格型式,密度为8.90g/cm3,最临近原子之间的距离为250pm。
1.计算其空间利用率(即原子体积占晶体空间的百分率);2.通过计算确定该金属3.计算能放入到该金属晶体空隙中最大原子半径是多少?第四题(10分)在THF中以碱金属处理(CH3)2SiCl2,主要产物A为一晶体,摩尔质量为0.290kg/mol,分析其成分为:C 41.4%、H 10.3%、Si 48.3%。
在苯中,其质子的NMR谱具有单谱带。
化合物A与溴反应生成含溴35.5%的产物B,当B在甲苯中以(CH3)3SiCl和Na处理时,产物之一是液体C。
C的质子NMR谱含有四个谱带,面积比为3︰2︰2︰1。
1.写出A、B、C的结构式。
2.写出(CH3)2SiCl2水解并且脱水后的产物结构式。
3.写出(CH3)2SiCl2和少量CH3SiCl3水解并且脱水的产物结构式。
第五题(11分)Na2CO3(106 g/mol)和H2O2(34.0 g/mol)结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合。
全国高中学生化学竞赛初试(河北赛区)

全国高中学生化学竞赛初试(河北赛区)可能用到的相对原子质量:H:1 B:11 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 K:39 Cu:64 Zn:65 Ba:137一、选择题(本题共10小题,每小题1分,共10分,)每小题只有一个选项符合题意,请将符合题意的选项的编号A、B、C、D填入答栏内。
1.在两种短周期元素组成的化合物中,若它们的原子个数之比为1:3,设这两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )。
①a=b+4 ②a+b=8 ③a+b=30 ④a=b+8A.只有②③ B.只有②③④ C.吸有③④ D.①②③④2.最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉素(AFTB),其分子结构式如图所示。
人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。
一般条件下跟1 mol AFTB起反应的H2或NaOH的最大量分别是()。
A.5 mol;1 mol B.5 mol;2 molC.6 mol;1 mol D.6 mol;2 mol3.某有机物的结构简式为:,可发生反应的类型组合()①取代②加成③消去④水解⑤酯化⑥中和⑦氧化⑧加聚A.①②③⑤⑥ B.②③④⑥⑧ C.①②③⑤⑥⑦ D.③④⑤⑥⑦⑧4.往蓝色的CuSO4溶液中逐滴加入KI溶液可以观察到产生白色沉淀X和生成含有Y物质的棕色溶液。
再向反应后的混合物中不断通入SO2气体,并加热,又发现白色沉淀显著增多,溶液逐渐变成无色。
则下列分析推理中错误的是()A.白色沉淀X可能是CuI2,Y可能是I2B.白色沉淀X可能是CuI,Y可能是I2C.上述实验条件下,物质的氧化性:Cu2+>I2>SO42-D.上述实验条件下,物质的还原性:SO2 >I->Cu+5.在一定条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ。
高中化学竞赛初赛试卷(13)教材

高中化学竞赛初赛试卷(14)(时间:3小时满分:100分)题号 1 2 3 4 5 6 7 8 9 10 11 12 满分7 2 6 11 10 6 8 6 8 12 10 14H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt DsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0第一题(7分)1.为洗涤盛KMnO4溶液后产生的褐色污垢,下列洗涤液最合适的是A.铬酸洗液B.草酸和盐酸溶液C.粗盐酸D稀硝酸2.核磁共振谱是测定有机分子结构最有用的工具之一。
高中化学竞赛初赛试卷(16)

高中化学竞赛初赛试卷(17)第一题(9分) 光气学名“碳酰氯”,化学式COCl 2,是窒息性毒剂之一。
1.光气化学性质活泼,具有酰卤的典型反应,易发生水解、氨解和醇解。
(1)光气及足量乙醇反应所得产物的化学名称是【 】;(2)光气及足量氨气反应的化学方程式【 】; (3)足量苯在AlCl 3催化剂作用下及光气反应所得产物的结构简式【 】; (4)光气及苯胺分两步反应可得异氰酸苯酯,中间产物的结构简式是【 】,异氰酸苯酯的结构简式是【 】。
可在一定条件下分解产生3mol 光气,所以又被称为“三光气”。
工业上可以利用碳酸二甲酯的氯代反应制备BTC 。
BTC 的反应活性及光气类似,可以和醇、醛、胺、酰胺、羧酸、酚、羟胺等多种化合物反应,因此低毒性的BTC 在化学反应中完全可替代剧毒(被禁用)的光气合成相关的化工产品。
(1)BTC 分子中所有氯原子都等价,试写出结构简式 (2)除毒性外,BTC 比光气还有什么优点?(2)第二题(10分)电解食盐溶液的氯碱生产技术,已由传统的隔膜法变革为离子膜法高新技术。
这种技术进步,如下表所示:离子膜法隔膜法隔膜法项目NaOH% 35(已有50%的报道)10~12 30NaCl% 0.0025 14~16 4Na2CO3% 0.02 (一般不计量) 1项目离子膜法隔膜法电解用电度/吨2160 2600蒸汽用电度/吨80 700隔膜法和离子膜法新技术中所用的膜有本质区别。
前者是有条件地阻止阴、阳极电解产物相混合的多孔石棉隔膜。
后者由阳离子交换树脂(几类氟碳树脂)组成,树脂的高分子骨架上接有能电离出H+而可及Na+等阳离子交换的离子交换基团—SO3H、—COOH,所以是一类厚度虽仅0.l~0.5mm,但一般只允许溶液中的阳离子在膜中通过,更不能自由通过气体或液体的阳离子交换膜。
1.在所给离子膜法电解食盐溶液示意图中的括号内,填写开始电解时进入电解槽用作电解液的液体A、B的组成名称,以及电解产出气体C、D的化学式。
(2015)全国高中生化学竞赛(初赛)试卷及答案

● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr H Li Be B C N O F Na MgAl Si P Cl SK Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(9分)用α粒子撞击铋-209合成了砹-211。
河北省唐山市2015届高三化学第一次模拟考试试题

河北省唐山市2014—2015学年度高三年级第一次模拟考试理综试题本试卷分第I卷(选择题)和第II卷(非选择题)共300分。
考生注意:1.答题前,考生务必将自己的准考证号、姓名填写在答题卡上。
考生要认真核对答题卡上粘贴的条形码的“准考证号、姓名、考试科目”与考生本人准考证号、姓名是否一致。
2.第1卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再涂选其它答案标号。
第II卷用黑色墨水签字笔在答题卡上书写作答,在试题卷上作答,答案无效。
3.考试结束后,监考员将试题卷、答题卡一并交回。
第I卷本卷共21小题,每小题6分,共126分。
以下数据可供解题时参考相对原子质量(原子量):H-l C-12 0-16 Na-23 Mg-24 Al-27 Cl-35.5 Ca-40 Fe-56一、选择题(本题包括13小题,每小题只有一个选项符合题意)7、化学与生活密切相关,下列说法不正确的是A.改燃煤为燃气,可以减少废气中S02等有害物质的排放量天气的一种措施B.84消毒液的有效成分是NaClOC.凡含有食品添加剂的食物对人体健康均有害D.金属防护中:牺牲阳极的阴极保护法利用的是原电池原理,外加电流的阴极保护法利用的是电解原理8、设NA表示阿伏伽德罗常数的值,下列判断正确的是9.W、X、Y、Z均是短周期主族元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高价氧化物对应的水化韧与其氢化物能反应生成盐,X的氧化物既能溶于酸又能溶于碱,Y的最高正价与最低负价的代数和为O。
下列说法正确的是A.离子半径:W>X>Z B.原子半径:Z>X>YC.单质的熔点:W>Z>Y D.最高正价:Z>W>X10.有甲两种有机物,下列说法中不正确的是A.可用新制的氢氧化铜悬浊液区分这两种有机物B.甲、乙互为同分异构体C.1 mol甲与H2在一定条件下反应,最多消耗3 mol H2D.等物质的量的甲、乙分别与NaOH溶液反应消耗NaOH的量相同11.在下列溶液中一定能大量共存的离子组是12.已知某温度时CH3COOH的电离平衡常数为K。
河北省唐山市第一中学2015年高一下学期期初考试化学试卷

河北省唐山市第一中学2015年高一下学期期初考试化学试卷说明:1. 考试时间90分钟,满分100分。
2 .将卷I答案用2B铅笔涂在答题卡上,卷H用蓝黑钢笔或圆珠笔答在试卷上。
3.H卷卷头和答题卡均填涂本次考试的考号,不要误填学号,答题卡占后5位。
卷I (选择题共58分)可能用到的相对原子质量:H-1 C-12 N-14 0-16 Na-23 S-32 C1-35.5 Fe-56 Cu-64一、选择题(共14小题,每小题2分,共28分。
每小题有1个正确答案。
)1、下列变化或过程中发生化学变化的是()A. 氮的固定B. 丁达尔效应C.实验室中制取蒸馏水D.用铂丝蘸取NaCI溶液进行焰色反应2、下列物质属于纯净物的是()A. 氢氧化铁胶体B.漂白粉C.胆矶D.生铁3、下列生产生活中常见物质的主要成分与化学式相对应的是()A. 光导纤维一SiB.铝土矿—AI(0H)3C.水泥一Na2SiC3D.明矶一KAI(SQ)2 42H2O4、钴酞菁(分子直径1.3 X -0m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为钴酞菁”分子恢复了磁性。
下列关于钴酞菁”的说法正确的是()A. 在水中形成的分散系属于悬浊液B. 在水中形成的分散系属于胶体C. 分子直径比Na。
」、D. 钴酞菁”分子既能透过滤纸,也能透过半透膜5、A. 此食盐是混合物B. 烹饪时加入,菜熟后最佳”的原因可能是碘酸钾受热不稳定C. 碘酸钾(KIO3)中碘的化合价+5D. 1kg此食盐中含碘酸钾(18 —33)mg6、只用一种试剂就能将AgNO3、KSCN稀硫酸、NaOH四种无色溶液区分开来的是()A. BaC2溶液B. Na z CQ溶液C. Fe(NO3)3溶液D. FeC3溶液7、某学习小组设计有关Na2CO3和NaHCO3的探究实验,其中设计方案明显错误的是A.可用加热的方法除去Na2CO3固体中混有NaHCO sB.可向NaHCO s溶液中通入过量的CO?气体除去其中混有的Na z CO sC. 可用澄清石灰水鉴别NaHCO s和Na?CO s两种溶液D. 分别向Na?CO s溶液、NaHCO s溶液中滴加过量的稀盐酸,均有气泡产生8、下列反应的离子方程式正确的是()A. 铜和稀硝酸的反应:3Cu+ 8H+ + 2NO3「==3C U2++ 2NOT + 4也0B. 盐酸加到氢氧化铁中:H++ 0H「== H2O2 _ +C. 碳酸钙溶于盐酸:C03 _ + 2H == H20 +CQ fD. Ba(0HR 和(NH4)2SC4 溶液混合加热:Ba2++ SQ2_ == Ba SQ J9、把0.05molNa0H固体分别加入到100ml下列溶液中,溶液导电性基本不变的是()A. 自来水B. 0.5mol/L 盐酸C. 0.5mol/L 醋酸D. 0.5mol/L 氨水10、下列物质性质与应用关系的描述正确的是()A. 稀硝酸具有强酸性,实验室可用其制取少量氢气B. 铝具有强氧化性,生产上可用铝热反应制取一些金属C. 氢氧化铝具有两性,医疗上可用其治疗胃酸过多D. 钠具有强还原性,可用其与硫酸铜溶液反应来制取铜11、下列物质的存贮方法错误.的是()A.金属钠保存在石蜡油或煤油中B.用铁制或铝制容器运输浓硫酸、浓硝酸C. FeC2溶液的试剂瓶中要放铁钉D.氢氧化钠溶液盛装在玻璃塞的试剂瓶中12、将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的()A. 1/2B. 2/3C. 1/3D. 1/613、下列有关离子的检验方法和判断正确的是()A. 向某溶液中滴加KSCN 溶液,若溶液出现血红色则说明原溶液中含Fe3*B. 向某溶液中滴加BaC2溶液,若有白色沉淀,再滴加足量稀HNQ,若沉淀不溶解,则说明原溶液中一定含Ag+C. 向某溶液中滴加足量稀HCI,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含C032_D. 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K14、向含有Na+、SC42-、HCQ3_、CQ2_的溶液中,加入适量Na202粉末充分反应后,溶液中离子浓度降低的是()A. Na+B. SO42-C. HCQ3_D. CQ2_二、选择题(共10小题,每小题3分,共30分。
