93离子键理论
离子键价键理论

no =8+8+2×8=32
nv=4+6+2×7=24
ns = no - nv=32-24=8
成鍵数=8/2=4
nl = nv – ns=24-8=16
孤电子对数=16/2=8
画出结பைடு நூலகம்式:
Cl CO
Cl
离子键价键理论
画出CO32-的路易斯结构式
no =8+3×8=32
nv=4+3×6+2=24
ns = no - nv=32-24=8
离子键价键理论
•离子半径:离子晶体中,正负离子之间吸引和排斥保持 平衡时的距离为正负离子半径之和
A.同主族比较 B.电子层结构相同的离子比较 •离子键强弱判断:
A.NaCl NaBr NaI 8010 C 、7470 C、6600 C B. NaCl MgCl2 AlCl3 熔点比较
8010 C、7140 C、1940 C
NaCl晶体,其化学式仅表示Na离子与Cl离子的 离子数目之比为1∶1,并不是其分子式,整个 NaCl晶体就是一个大分子。
离子键价键理论
NaCl的晶胞结构
离子键价键理论
3.键的离子性与元素的电负性有关 用两元素的电负性差 x判断键的性质
离子键的形成:与元素的电负性差有关。实验表明, 即使是电负性差值最大的氟与铯形成化合物,离子 性也只有92%,仍有8%的共价性。当两个原子的电 负性差为1.7时,单间具50%的离子性,这是参考数 据。如果两个原子的电负性大于1.7。可判断它们之 间形成了离子键,是离子化合物,两个原子的电负 性小于1.7,可判断它们形成共价键,形成共价化合 物。 形成条件:两原子的电负性差值较大,电负性差值>1.7, 离子性大于50%,形成离子键。
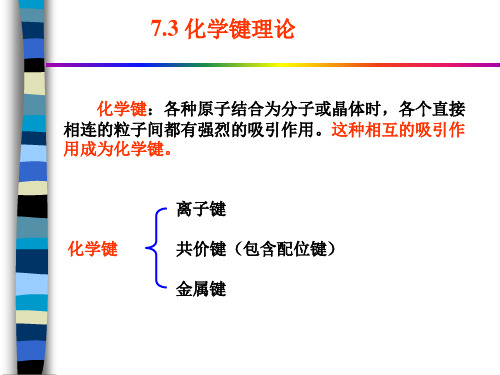
化学键理论

化学键理论1. 引言化学键理论是化学的基础理论之一,用于解释物质中原子如何通过共用、离子、金属等键形成化合物。
本文将介绍化学键的概念、类型、强度和特点,以及相关的分子轨道理论和晶体结构中的键。
2. 化学键的概念化学键是由原子之间的相互作用力形成的,用于稳定原子之间的连接,以形成化合物。
它是化学反应和化学转化的基础。
根据原子之间电子的共享或转移方式,化学键可分为共价键、离子键和金属键三种类型。
2.1 共价键共价键是由两个原子共用一对电子而形成的。
在共价键中,原子之间的电子密度共享,以形成一个稳定的化合物。
共价键的强度取决于原子间的电子云重叠程度。
2.2 离子键离子键是由正负电荷之间的相互作用力形成的。
离子键通常存在于由金属和非金属元素组成的化合物中,其中金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子。
离子键的强度取决于产生的离子之间的吸引力。
2.3 金属键金属键是金属原子之间的强电子云相互作用力形成的。
金属键的特点是原子之间的电子云重叠形成一个导电的金属电子海,这种电子海使得金属具有良好的导电性和延展性。
3. 化学键的强度和特点化学键的强度决定了化合物的稳定性和性质。
共价键通常强于离子键和金属键。
化学键的强度可以通过键能来衡量,键能是在形成化学键时放出或吸收的能量。
化学键的特点还包括键长和键角。
键长是指两个原子之间的距离,它通过实验或计算得到。
键角是指连接三个原子的两个化学键之间的夹角,它决定了分子的形状和空间结构。
4. 分子轨道理论分子轨道理论是用于描述共价键形成和分子性质的理论。
根据分子轨道理论,原子中的原子轨道会线性组合形成分子轨道。
分子轨道存在于整个分子中,描述了共价键中电子的分布情况。
常见的分子轨道包括Sigma(σ)轨道和Pi(π)轨道。
Sigma轨道是由轴向重叠形成的,是共价键中电子密度最高的轨道。
Pi轨道则是通过平面上的侧向重叠形成的,通常存在于双键和三键中。
5. 晶体结构中的键除了在分子中形成化学键外,化学键也存在于晶体结构中。
第六章 1节离子键理论

NaCl (s) U E I Na+ (g) + Cl (g) + eNa (g) + Cl (g) ∆fH0 Na (s) + 1/2 Cl2 (g) S Na (g) +1/2 Cl2 (g) 1/2D
Na+ (g)+
Cl- (g)
U = -∆fH0 + S +1/2 D + I - E = [-(-411)+109+121+496-349] ∆ = 788 kJ· mol-1
半径比、晶型、配位数关系表
半径比(r+/r-) 配位数 晶体构型 0.225 ~ 0.414 4 0.414 ~ 0.732 6 0.732 ~ 1.0 8 立方ZnS型 NaCl型 CsCl型 实例 ZnO、ZnS NaCl CsCl
注意:构型还与物质的存在条件有关。
(2)理论推导
• 方法很多,如 Bron-Lande公式:
138490Z + Z − A 1 U = (1 − ) r n
Z+、Z-:离子电荷; A:Madelung常数; n:Bron指数; r:正负离子半径之和。
一些离子晶体的晶格能表
晶体 NaCl 晶格能 晶体 晶格能
四.离子的特征
• 1.离子的电荷 1.离子的电荷 离子是一种带电微粒,所带电荷数=在反应时 得到或失去的电子数。 对于主族元素最高电荷数=其族数。 2.离子的电子构型 2.离子的电子构型
三.离子键的强度
• 在实际中常用晶格能衡量离子键的强度。 • 晶格能越大,键越强。 1.定义:
晶格能:互相远离的气态正、负离子结合生 成1 mol 离子晶体时所释放的能量,用 U 表示。 如:Na + ( g ) + Cl- ( g ) = NaCl ( s ) U = -△rHm
化学键与分子结构

价层电 配位原 孤对电 电子对的 子对数 子数 子对数 空间构型
分子的 空间构型
示例
3 2 1 平面三角形 V形
SnCl2
43 2
54 3 2
65 4
1 四面体 2 四面体
三角锥
NH3
V形
H2O
1 三角双锥 变形四方体 SF4
杂化轨道类型 sp
sp 2
sp 3
sp
不等性 3
参加杂化的轨道s+p s+(2)p s+(3)p s+(3)p
杂化轨道数 2 3 4
4
成键轨道夹角 1800 1200 109028' 900 109028'
分子空间构型
实例 中心原子
直线形 三角形 四面体
BeCl 2 BF3 CH 4 HgCl 2 BCl 3 SiCl 4
在多原子分子中,断裂气态分子中的某
一个键,形成两个“碎片”时所需要的能量
叫做此键的解离能。
H2O(g) H(g) OH(g) D(H OH) 499kJ mol1 HO(g) H(g) O(g) D(O H) 429kJ mol1
键能E(bond energy): 标准状态下气态分 子断裂成气态原子时,每种键所需能量的平 均值。单位kJ.mol-1。
BF3
价层电子对数=
1 2
(3+3) = 3
CH 4
价层电子对数=
1 2
(4+4) = 4
PCl 5
价层电子对数=
1 2
(5+5) = 5
SF6
价层电子对数=
1 2
(6+6) = 6
化学键与分子轨道理论

分子轨道理论:分 子轨道理论的发展 趋势是向着更精确、 更全面的方向发展, 包括对分子电子结 构和性质更准确的 计算和预测。
计算方法的改进:随着计算机技术的进步,计算方法不断优化,使得分子轨道理论计 算更加准确和高效。
实验验证的加强:随着实验技术的不断发展,对分子轨道理论的实验验证越来越精 确,有助于理论的发展和完善。
化学键理论的优点:简单易懂,能 够解释许多化学现象。
分子轨道理论的优点:能够更准确 地描述电子云的分布和跃迁等化学 现象,预测分子的性质。
添加标题
添加标题
添加标题
添加标题
化学键理论的缺点:无法解释分子 轨道理论中的某些现象,如电子云 的分布和跃迁等。
分子轨道理论的缺点:较为复杂, 需要较高的数学基础和计算能力。
跨学科的融合:分子轨道理论正与其他学科领域如量子化学、生物学、环境科学等相 互融合,拓展了其应用范围。
人工智能的应用:人工智能技术正在逐渐应用于分子轨道理论的研究中,为理论的 发展提供了新的思路和方法。
化学键与分子轨道理论在药 物设计中的交叉发展
化学键与分子轨道理论在材 料科学中的应用
化学键与分子轨道理论在能 源领域的应用与交叉发展
添加标题
添加标题
添加标题
添加标题
原子轨道:构成分子轨道的基本单 元
分子轨道对称性:决定分子在空间 中的对称性和旋光性
分子轨道理论 的基本概念
电子填充规律
分子轨道的能 级顺序
分子轨道能级 的实际应用
分子轨道的对称元素:包括对称轴、对称面和对称中心等 对称性分类:根据分子轨道的对称性,可以将分子轨道分为对称与反对称两类
局限性:无法解释某些物质的性质,例如共价键和金属键的形成机制。
第三章 化学键和晶体结构第一节 离子键和离子晶体

2023/2/19
11
(二)离子晶体及其特征结构
(1)离子晶体(ionic crystals) 靠离子 间引力结合而成的晶体 (2)特点
•晶格结点上交替排列着正、负离子,依静电引力结合 •离子键没有饱和性和方向性,正负离子按一定配位数在空 间排列,不存在单个分子,而是一个巨大的分子,如NaCl只表示 晶体的最简式 •因静电引力较强,离子晶体有较高熔、沸点和硬度。离子 电荷越高,半径越小,静电引力越强,熔、沸点越高,硬度越大 •熔融时或水溶液是电的良导体,但固态不导电
H- 208
Br7+
39
Cr6+
52
Hg2+ 110
B3+
20 Co2+ 74
In3+ 81
Bi5+
74
Cr3+
64
I7+
50
Ba2+ 135 Cu+ 96
I-
216
Be2+ 31
Cs+ 169
K+
133
Li+ 60
La3+ 115
Mn7+ 46
Mn2+ 80
Mo6+ 62
Mg2+ 65
N3- 171
6
离子 半径 离子 半径 离子 半径 离子 半径 离子 半径 离子 半径 离子 半径
Ag+ 126 C4- 260
Fe2+ 76
Al3+
50
Ca2+
99
Fe3+ 60
As3+ 47 Cd2+ 97
F-
136
As3- 222 Cl7+ 26
Ge4+ 53
Au+ 137 C4+
15
Ga3+ 62
Br- 195 Cl- 181
5. 了解价层电子互斥理论的基本要点,并能用其解释多原子分子或离子的空 间构型
第7章 化学键理论概述

2
离子的电子构型
简单负离子一般为 8 电子构型
如 F―,O2―,Cl― 简单正离子 ① 0 电子构型 如 H+
② 2 电子构型(ns2) 如 Li+,Be2+ ③ 8 电子构型(ns2 np6) 如 Na+, Ca2+
④ 9~17 电子构型(ns2 np6 nd1―9) 如 Fe2+,Cr3+ ⑤ 18 电子构型 (ns2 np6 nd10) 如 Ag+,Cd2+ ⑥ (18 + 2) 电子构型 (n―1)s2(n―1)p6(n―1)d10 ns2
H5
H3
Na+(g) +
H6 是 NaCl 的标准生成热 fHm 由盖斯定律得:
H6 = H1 + H2 + H3 + H4 + H5
由 得
H6 = H1 + H2 + H3 + H4 + H5 H5 = H6-(H1 + H2 + H3 + H4)
所以 -H5 =(H1 + H2 + H3 + H4)- H6 即 U = H1 + H2 + H3 + H4 - H6 = A + 1 D + I1- E - f Hm 2
如 Sn2+,Bi3+
离子的电子构型与离子键的强度有关, 对离子化合物的性质有影响。 例如,Na+ 与 Ag+ 的离子半径分别是 99 和 100 pm,但是 NaCl 易溶于水,而
AgCl 难溶于水。
3 离子半径
将离子晶体中的离子看成是相切的球体, 正负离子的核间距 d 则是 r + 和 r- 之和 r+ d r-
配位化合物知识题

第9章配位化合物一判断题1 价键理论认为,配合物具有不同的空间构型是由于中心离子(或原子)采用不同杂化轨道与配体成键的结果。
()2 价键理论能够较好地说明配合物的配位数、空间构型、磁性和稳定性,也能解释配合物的颜色。
()3 价键理论认为,在配合物形成时由配体提供孤对电子进入中心离子(或原子)的空的价电子轨道而形成配位键。
()4 同一元素带有不同电荷的离子作为中心离子,与相同配体形成配合物时,中心离子的电荷越多,其配位数一般也越大。
()5 在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
()6 所有八面体构型的配合物比平面四方形的稳定性强。
()7 所有金属离子的氨配合物在水中都能稳定存在。
()8 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。
()9 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。
()10 内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。
()11 内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。
()12 不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体形。
13 [Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨道杂化方式不同。
()14 [Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。
()15 K3[FeF6]和K3[Fe(CN)6]都呈顺磁性。
()16 Fe2+的六配位配合物都是反磁性的。
()17 在配离子[AlCl4]-和[Al(OH)4]-中,Al3+的杂化轨道不同,这两种配离子的空间构型也不同。
()18 已知E(Cu2+/Cu) = 0.337V,E([Cu(NH 3)4]2+/Cu) = -0.048V,则E([Cu(CN)4]2-/Cu) < -0.048V。
选论——离子键理论和离子极化理论

(1)正离子
①正离子所带电荷越高,极化作用越强; ②正离子半径越小,极化作用越强; ③不同电子层结构的正离子,其极化作用大小的顺序为:
18e或(18+2)e > 9~17e > 8e
(2)负离子
①负离子所带电荷越低,极化作用越强; ②负离子半径越大,极化作用越强; ③复杂负离子对称性高,变形性差,极化作用弱; (复杂负离子的中心原子化合价越高,变形性越差)
(1) CaSO4 > CdSO4 (2) MnSO4 > Mn2(SO4)3 (3) SrSO4 > MgSO4 (4) Na2SO4 > MgSO4 (5) HNO3 > HNO2 (6) Na2CO3 > NaHCO3 (7) ZnO > HgO (8) Cu2O > Ag2O (9) BaCO3 > PbCO3
(10) Na2CO3、K2CO3 (11) Na2S2O3、Ag2S2O3 (12) Na2SO3、Na2SO4 (13) AgNO3、Cu(NO3)2 (14) FeBr3、FeBr2 (15) HNO3、LiNO3 (16) CaCO3、MnCO3
(10) Na2CO3 < K2CO3 (11) Na2S2O3 > Ag2S2O3 (12) Na2SO3 < Na2SO4 (13) AgNO3 > Cu(NO3)2 (14) FeBr3 < FeBr2 (15) HNO3 < LiNO3 (16) CaCO3 > MnCO3
反极化作用越强
化合物越不稳定
由于H原子半径很小,使且O带原正子电靠荷近,N从原而使子O原 子 化极作化用,效其果靠与近N相H原反子 ,部部 故分分 称呈带 其”负 为-电反”电,极性因化H作原用子极
无机化学7.3化学键理论
)
2
(
* 1S
)1
]
键级= 2 1 0.5 2
He2+ 可以存在。
5. Li2 [(1s)2 (*1s) 2 (2s)2 ]
键级= 2 0 1 2
6. Be2 [[(1s)2 (*1s) 2 (2s)2 (*2s) 2]
键级= 2 2 0 2
Be2不能稳定存在
7.
B2 [ ( 1S
)2
MO法优缺点
1. 把分子作为一个整体处理(对比:VB法定域 键),成功解释了单电子键、三电子键、离域键、 O2和B2分子的顺磁性及一些复杂分子的形成,随 着计算机科学的发展,前景看好。
2.不如VB法直观,比较抽象。
作业: 7-21
7.3.5 化学键参数与分子的物理性质
➢ 化学键参数(Bond parameters)
这种分子中的原子通过共用电子对的形式而形成
的化学键称为“共价键”,相应的分子称为“共价分 子”。
Lewis式
结构式
HCl
H:Cl
H-Cl 单键
O2
O::O
O=O 双键
N2
N┇┇N
N N 参键
H2
H:H
H-H 单键
(1) Lewis学说成绩 1. 指出了共价键与离子键的差异; 2. 解释了一些简单的非金属单质和化合物分子的形
(1)一个原子其价电子层有未共用电子对,
又称孤对电子。
CO
(2)另一个原子其价电子层有空轨道。
如:CO (一个键,一个 键和一个 配位 键)
π CO
π
2s2 2p4
7. 3.4 分子轨道法(Meleeular Orbital Theory, MO法)
离子键和库仑力

离子键和库仑力一、离子键的形成与特性离子键是化学键的一种,指的是两个原子或分子之间通过电荷相互作用形成的共价键。
当一个原子或分子失去电子或获得电子时,会形成正离子或负离子。
这些带电粒子之间的相互作用就是离子键。
离子键的特点是强度较高,但同时其方向性和饱和性较低。
二、库仑力的基础概念及其与离子键的关联库仑力是指两个带电粒子之间的相互作用力,其大小与带电粒子的电荷量成正比,与它们之间的距离的平方成反比。
在离子键的形成过程中,正离子和负离子之间的库仑力起到了关键作用,是形成离子键的主要因素。
库仑力不仅对离子的稳定存在有重要意义,也是许多化学反应得以进行的重要推动力。
三、离子键和库仑力在化学反应中的作用在化学反应中,离子键的形成和改变是反应发生的重要推动力。
当两个带电粒子接近到一定距离时,它们之间的库仑力会变得相当大,足以克服它们之间的排斥力,促使它们结合形成离子键。
此外,库仑力在化学反应中的另一个重要作用是维持反应中间体的稳定。
四、离子键与库仑力在物质性质中的影响物质性质由其组成分子的内部结构和相互作用决定。
离子键的形成以及与之相关的库仑力对物质的物理性质和化学性质产生显著影响。
例如,离子键的形成使得许多物质具有较高的熔点和硬度,同时使得物质在水溶液中具有可溶性。
此外,离子键的强度和排列方式也影响物质的电导率、光学性能和磁学性能等。
五、离子键和库仑力在现实生活中的应用离子键和库仑力的研究不仅对理论科学有重要意义,而且在实际应用中也有广泛的应用价值。
例如,离子键在电池技术、电镀工艺、陶瓷材料等领域中发挥着关键作用。
同时,库仑力的研究也在电子显微镜技术、表面科学、纳米技术等领域中具有重要应用价值。
深入研究和理解离子键和库仑力的性质和作用机制,有助于推动相关领域的技术进步和创新。
六、未来展望:离子键与库仑力研究的新领域随着科学技术的不断发展,对离子键和库仑力的研究也在不断深入。
未来研究可能涉及以下几个方面:探索离子键和库仑力与其他物理现象的关联,如量子力学、热力学等;研究离子键在不同环境下的性质变化及其对物质性质的影响;发展新型实验技术和计算方法,以更精确地测量和模拟离子键和库仑力的性质和作用机制等。
化学键与分子结构

2s
2s
sp sp杂化
Be采用sp杂化 生成BeCl2
两个sp杂化轨道
sp2杂化 B: 2s22p1
2p
2s
BF3的空间构型 为平面三角形
F
B
F
F
2s
2p 激发 2s 2p
sp2 sp2杂化
BF3的形成
三个sp2杂化轨道
sp3杂化 C:2s22p2
2p
2s
CH4的空间构 型为正四面体
2s
n —— 未成对电子数 顺磁性:被磁场吸引 µ> 0 , n > 0
如:O2,NO,NO2等 反磁性:被磁场排斥 µ= 0 , n =0 (大多数物质) 铁磁性:被磁场强烈吸引。如:Fe,Co,Ni
根据 n(n 2) 可用未成对电子 数目n估算磁矩µ 。
n 01 2 3 4 5
µ/B.M. 0 1.73 2.83 3.87 4.90 5.92 实例: [Ti(H2O)6]3+ Ti3+: 3d1 µ=1.73 n=1 K3[Mn(CN)6] Mn3+: 3d4 µ=3.18 n=2
432
366
298
159
243
193
151
共价键
H-H C-C C--C C---C N-N N---N C-H O-H
键长 l/pm
74 154 134 120 145 110 109 96
键
能
E/(kJ·mol-1)
436
346
602
835
159
946
414
464
由表数据可见,H-F, H-Cl, H-Br, H-I 键长依次递增,而键能 依次递减;单键、双键及叁键的键长 依次缩短,键能依次增大,但与单键 并非两倍、叁倍的关系。
化学键理论概述

7-1-2 离子键的性质
从离子键形成过程中可以看出,当活泼金属原子和 活泼非金属原子相互接近时,发生电子转移,形成正、负 离子,正离子和负离子之间通过静电引力结合在一起形成 离子键。也就是说离子键的本质是静电作用力。
根据库仑定律,两个带有相反电荷 q+ 和 q- 的正负离 子之间的静电作用力与离子电荷的乘积成正比,与离子间 距离成反比。所以,离子的电荷越大,离子间的距离越小, 离子间的静电引力越强。
近代实验证明,即使是电负性最小的铯与电负性最大 的氟所形成的氟化铯,也不纯粹是静电作用,仍有部分原 子轨道的重叠,即仍有部分共价键的性质。一般用离子性 百分数来表示键的离子性的相对大小,实验证明,在氟化 铯中,离子性占 92%,也就是说铯离子与氟离子之间的 键仍有 8% 的共价性。
第14页/共225页
第22页/共225页
同时,这个反应可以通过如下 5 个分步反应进行: (1) 1 mol 金属钠气化变为气态钠原子:
Na(s) = Na(g) 升华热 = H1 = 108 kJ·mol-1 (2) 0.5 mol 氯分子解离为气态氯原子:
0.5 Cl2(g) = Cl(g) 0.5解离能=H2 = 121 kJ·mol-1 (3) 1 mol 气态钠原子失去电子形成1 mol气态钠离子:
(7-1)
第4页/共225页
V吸引=
q q 4 0 r
(7-1)
式中 q+ 和 q- 分别是 1 个正电荷和 1 个负电荷所带的 电量,即 1.6 10-19 C,ε0 是介电常数。
当正负离子相互接近时,它们之间主要是静电吸引作 用。
但当正负离子进一步相互接近时,除了静电吸引外, 还存在外层电子之间以及原子核之间的相互排斥作用。这 种排斥作用当 r 较大时可以忽略。
非极性共价键与极性共价键

例:NH
4
H
H N H
H
CO
C O
2s2 2p2 2s2 2p4
22
4.6.2 杂化轨道理论
CH4 形成的过程中, C 原子的电子先进行如下的激 发步骤,以得到 4 个单电子。
2p
2s
电子激发
2p
2s
显然,这 4 个单电子所在的原子轨道不一致。利用这些原子轨道 与 4 个 H 原子形成的化学键,应该不完全相同,也不应该指向正四面 体的四个顶点。CH4 为什么是正四面体结构 ?
容原理; 当这两个电子同时在重叠区域中运动,能有效地降低两核
之间的排斥作用,使体系的能量降低,从而形成共价键。 共价键的结合力:两个原子核对共用电子对所形成的负电
区的吸引力,说明共价键的本质是电性作用力,但不同于 正负离子间的静电引力。
13
2. 价键理论要点 —定性地推广到其他分子中去
要点一:自旋相反的成单电子互相配对成键。已成对的电子不 能用于成键,称为孤对电子。 表现为共价键具有饱和性。
6
(3)离子的电子层构型
正离子的电子层构型大致有5种:
(1)2电子构型
Li+(1s2) Be2+(1s2)
(2)8电子构型
Na+(2s22p6)
(3)18电子构型
Zn2+(3s23p63d10)
(4)(18+2)电子构型 Pb2+(5s25p65d106s2)
(5)9~17电子构型
Fe2+(3s23p63d6)
2
Na - e → Na+
1s22s22p63s1 (χ = 0.9 )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.3离子键理论
9.3.1离子键理论
9.3.2典型的AB型离子晶体9.3.3离子极化
9.3.4晶格能
上节
返回章下节
.1.离子键:-
+
+
+
--.
(1)形成:
休息
(2)本质:
静电引力.
(3)特征:
①无方向性:
②无饱和性:
离子电场球形对称;
离子电场力无方向性.-+
2.离子的特征:
(1)电子构型(ionic electron configuration):
所有简单阴离子:8 电子构型,如F-、Cl-、S2-等.
休息
60
95
133
Li(Ⅰ)Na(Ⅰ)K(Ⅰ)
阳离子电子构型较复杂.(2)离子半径(ionic radius ):
d = r ++ r -+-变化规律(pm) :①同元素离子:
184
37
29S(Ⅱ)
S(Ⅳ)
S(Ⅵ)
Z ↑, r ±↓
②同周期不同元素离子:③同族元素Z 相同的离子:
95
65
50
Na(Ⅰ)
Mg(Ⅱ)
Al(Ⅲ)
Z ↑, r ±↓
周期数↑, r ±↑
7
休息
目录
阳离子电子构型:
2 8 9~17 18 18+21s2
ns2np6
ns2np6nd1~9
ns2np6nd10
(n-1)s2(n-1)p6(n-1)d10ns2
Li+,Be2+
Na+,Mg2+,Al3+,Sc3+
Cr3+,Mn2+,Fe2+,3+,Cu2+
Cu+,Zn2+,Cd2+,Hg2+
Sn2+,Pb2+,Sb3+,Bi3+
电子
构型外电子层电子排布式实例
.
1.特征:
+
++
+
规则:阴阳离子相互接触稳定,配位数大稳定.
配位数:
晶体内(或分子内)某一个粒子周围最接近的粒子数目.
5休息
①NaCl 型:配位比: 6:6
2.结构类型与离子堆积规则:晶格:面心立方NaBr 、KI 、LiF 、MgO 等.
晶格:简单立方②CsCl 型:配位比: 8:8CsBr 、CsI 、TlCl 等.
晶格: 面心立方③ZnS 型(立方型):配位比: 4:4
例:BeO 、ZnO 、HgS 等.
休息
配位数为6:6的晶体:
2
2
)22(2)4(-+-+=r r r 414
.0/=-+r r ④离子堆积规则:
可解得:+
+
+
+
a b
c
半径比定则:配位数和离子半径比值的对应关系.
休息
配位数 构型 0.225~0.414 4 ZnS 型 0.414~0.732 6 NaCl 型 0.732~1.00 8 CsCl 型 1.00
12
最密堆积
离子半径比与配位数的关系:
-
+r r /休息目录
1.离子的极化:
未极
化的
简单
离子
离子在外电场中:
离子在外电场作用下产生诱导偶极的过程.
休息
离子极化的强弱主要取决于离子的极化力以及离子的变形性.
2.离子的极化力:
离子的极化力:某离子使异电荷离子产生变形的能力.
主要影响因素:
①Z;
②r;
③离子的电子构型.
休息
一般来说:
Z↑,r+↓,极化力↑.
Z相同, r+ 相近,与电子构型有关:
18,(18+2)以及2电子构型具强极化力.
如Cu+,Pb2+,Li+等.
8电子构型离子极化力最弱.
如Na+, Ca2+等.
其它电子构型极化力中等.
休息
离子在外电场作用下,外层电子与核发生相对位移的性质.
也用极化率衡量.
主要取决于离子半径的大小.
①r相近,但电荷不同时:
负离子: Z
-大,α大;
正离子: Z
+大,α小.
②r相近,Z相同时,与电子构型有关.
3.离子变形性:
:
4.一般规律
休息
①r -相同时,Z +越大,阴离子越易被极化;.②Z +相同时,r +越大,阴离子越不易被极化;③Z +相同,大小相近时, r -↑越易被极化;④附加极化作用:
离子晶体中,每个离子总极化力是离子固有极化力与附加极化力之和.5.对物质结构和性质影响:
休息
①键型以及晶型:
②性质:
键的极性
极化作用增强减小
如对卤化银物理性质的影响.
休息
AgF AgCl AgBr AgI
物理性质变化键型
晶体类型
溶解度
化合物颜色
电导率
金属光泽
共价键
离子键
NaCl型
大
浅
小
弱强
大
深
小
ZnS型
休息目录
1.晶格能(lattice energy):
由无限远离的气态正负离子,形成1mol离子晶体时所放出的热量.
∆r H m
Na+(g) + Cl-(g) → NaCl(s)
∆r H m = -788.1kJ·mol-1
U= 788.1kJ·mol-1
2.晶格能计算:
20
休息
利用Born-Haber 循环. K(s) + 1/2Br 2(l)
KBr(s)
K(g)
K +(g)
1/2Br 2(g)
Br (g)
Br -(g)∆f H
m (KBr,s)
∆H
m,1
∆sub H
m
∆H
m,3=1/2 ∆vap H
m (Br 2,l)
∆H
m,4=1/2E (Br-Br)
∆H
m,5=-E A
∆H
m,2=I 1
∆H
m,6=-U
=
+
3.影响因素:
①Z
±
:Z↑,U↑ 例:U(NaCl) < U(MgO)
②r
±
:r↑,U↓ 例:U(MgO) > U(CaO)
③晶体结构类型;
④离子电子层结构类型.
4.对物理性质影响:
MgO CaO SrO BaO
r U 熔点硬度小大大小高低大小
目录
18下节
休息。
