金属及其化合物化学方程式汇总
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
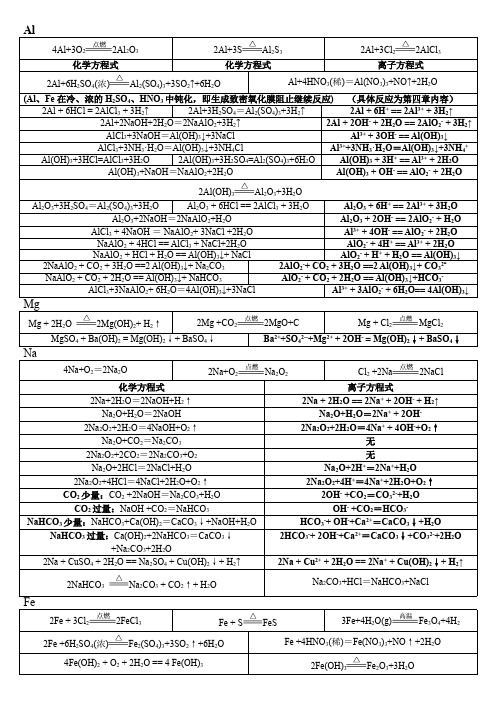
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
金属+非金属化学方程式整理(全)

金属+非金属化学方程式整理(全)-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN2金属化学方程式整理一、钠、镁、铝及其化合物1、 钠暴露在空气中4Na+O 2==2Na 2O ; 钠在空气中点燃:2Na+O 2 == Na 2O 22、 2Na+2H 2O==2NaOH +H 2↑3、 2Na+2HCl==2NaCl +H 2↑4、 钠投入硫酸铜溶液中:2Na+2H 2O==2NaOH +H 2 ↑ CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 总:2Na+2H 2O+CuSO 4== Cu(OH)2↓+Na 2SO 4 +H 2 ↑5、 Mg+2HCl==MgCl 2+H 2↑ ( Mg+2H +==Mg 2++H 2 ↑ ) 2Al+6HCl ==2AlCl 3+3H 2↑ ( 2Al+6H +==2Al 3++3H 2 ↑ )6、 2Al+2NaOH+2H 2O ==2NaAlO 2+3 H 2↑( 2Al+2OH -+2H 2O ==2AlO 2-+3 H 2↑ )7、 2Na 2O 2+2H 2O==4NaOH+O 2↑ ( 2Na 2O 2+2H 2O==4Na ++4OH -+O 2↑) 8、 2Na 2O 2+2CO 2==2Na 2CO 3+O 29、 Na 2O + 2HCl == 2NaCl + H 2O ( 说明Na 2O 是碱性氧化物 ) 10、2Na 2O 2 + 4HCl==4NaCl + 2H 2O + O 2↑ ( Na 2O 2不是碱性氧化物 ) 11、Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ ( CO 32- +2H + == H 2O + CO 2↑) 12、NaHCO 3 + HCl== NaCl + H 2O + CO 2↑ ( HCO 3- + H + == H 2O + CO 2↑) 13、2NaHCO 3= Na 2CO 3+H 2O+CO 2↑14、Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ( Al 2O 3 + 6H +== 2Al 3++ 3H 2O ) 15、Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O ( Al 2O 3 + 2OH - ==2AlO 2- + H 2O ) 16、AlCl 3 + 3NH 3·H 2O== Al(OH)3↓+ 3NH 4Cl (实验室制氢氧化铝)Al 3++3NH 3· H 2O== Al(OH)3↓+3NH 4+17、Al(OH)3+3HCl==AlCl 3+3H 2O ( Al(OH)3+3H +== Al 3++3H 2O ) 18、Al(OH)3+NaOH==NaAlO 2+2H 2O ( Al(OH)3+OH - ==AlO 2-+2H 2O )△△△319、2Al(OH)3 == Al 2O 3+3H 2O 20、少量CO 2通入NaOH 溶液:2NaOH+ CO 2== Na 2CO 3+ H 2O ( 2OH -+ CO 2==CO 32-+ H 2O ) 21、足量CO 2通入NaOH 溶液:NaOH+ CO 2== NaHCO 3 ( OH -+ CO 2==HCO 3- ) 22、少量NaOH 加入AlCl 3溶液:AlCl 3+3NaOH== Al(OH)3↓+3NaCl ( Al 3++3OH - ==Al(OH)3↓ ) 23、足量NaOH 加入AlCl 3溶液:AlCl 3+4NaOH== NaAlO 2+3NaCl+2 H 2O ( Al 3++4OH - == AlO 2-+2H 2O ) 24、Na 2CO 3 与NaHCO 3相互转化Na 2CO 3+ H 2O+ CO 2==2NaHCO 3 (CO 32-+ H 2O+ CO 2== 2HCO 3-) NaHCO 3+NaOH== Na 2CO 3+ H 2O (HCO 3-+ OH - == CO 32-+ H 2O )25、氯碱工业(电解饱和食盐水):2NaCl +2 H 2O==== 2NaOH +H 2↑+Cl 2↑ 26、侯氏(侯德榜)制(纯)碱法(饱和食盐水中先通氨气,再通二氧化碳) ①NaCl +NH 3+H 2O+ CO 2==NaHCO 3↓+NH 4Cl ②2NaHCO 3=== Na 2CO 3+H 2O+CO 2↑ 二、铁及其化合物1、Fe+2HCl==FeCl 2+H 2↑ ( Fe +2H +=Fe 2++H 2↑) Fe+CuSO 4==FeSO 4+Cu ( Fe +Cu 2+=Fe 2++Cu )2、FeO+2HCl=FeCl 2 +H 2O ( FeO +2H +=Fe 2++H 2O )3、Fe 2O 3+6HCl=2FeCl 3 +3H 2O ( Fe 2O 3+6H +=2Fe 3++3H 2O )4、Fe 3O 4+8HCl=FeCl 2 +2FeCl 3+4H 2O ( Fe 3O 4+8H += Fe 2++2Fe 3++4H 2O )5、Fe 2? + 2OH ? = Fe(OH)2?6、Fe 3? + 3OH ? = Fe(OH)3?电解△47、4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 (现象:白色沉淀迅速变成灰绿色,最后变为红褐色)8、2Fe(OH)3 == Fe 2O 3+3H 2O9、Fe(OH)2+2HCl=FeCl 2 +2H 2O ( Fe(OH)2 +2H +=Fe 2++2H 2O ) 10、Fe(OH)3+3HCl=FeCl 3+3H 2O ( Fe(OH)3 +3H +=Fe 3++3H 2O )11、Fe 3? +3SCN ?=Fe(SCN)3 (现象:溶液呈红色。
高一必修一铁及其化合物的化学反应方程式

高一必修一铁及其化合物的化学反应方程式
铁及其化合物是当今世界中相当重要的物质,自史前以来就被大量使用。
这种稀有金属由于其易于锻造及耐腐蚀而十分受人们欢迎,用于建造桥梁和房屋,也曾在很多国家发行货币。
铁在单质状态下是黑色的,与氧及其他元素化合会形成有色,重量较轻的化合物。
铁及其化合物的化学反应方程式主要有以下几种:
1、铁与硫化氢的反应:Fe + H2S → FeS + H2
2、铁与四氧化三铁的反应:Fe + Fe2O3 → 3FeO
3、铁与硫酸的反应:Fe + H2SO4 → FeSO4 + H2
4、铁与氧气的反应:4Fe + 3O2 → 2Fe2O3
5、铁与氧的反应:4Fe + 3O2 → 2Fe2O3
铁及其化合物在人们的生活中占据了非常重要的地位,它们可以高效地把资源转化为实用的物资。
通过上述化学反应方程式可以看出,铁与其他元素在反应中表现出了明显的不同性质。
实验表明,铁是一种非常可靠的建造材料,因此,它在建筑、桥梁、货币制作和发电等领域都有着极大的应用价值。
常见金属非金属及其化合物的化学方程式

常见金属非金属及其化合物的化学方程式好嘞,今天我们来聊聊那些常见的金属和非金属,还有它们的化合物。
这些东西可真是咱们日常生活中随处可见,搞得我一想到就忍不住想笑。
先说说金属吧,听起来高大上,其实它们在我们生活中可真是亲民啊。
比如说铁,咱们的“铁哥们”,不管是做成铁钉还是锅,都是陪伴着我们。
铁和氧气一旦碰上,哎呀,锈就来了,这可不是好事。
我们说“铁锈生锈”,这个道理大家都懂。
化学方程式上写成这样:4Fe + 3O₂ →2Fe₂O₃,听起来挺复杂,其实就是铁在空气中和氧气玩捉迷藏,最后变成了铁锈。
再说说铝,很多人都知道铝箔吧,包食物、烤东西,真是个好帮手。
铝和氧气结合成氧化铝,这可真是个有趣的过程。
化学方程式是4Al + 3O₂ → 2Al₂O₃。
铝在高温下和氧气反应,就像在炫技一样,真是个调皮捣蛋的小家伙。
然后是铜,铜的电线可是咱们家电的“命根子”。
铜和氧结合后也能产生氧化铜,这化学式写成2Cu + O₂ →2CuO。
真是简单明了,铜就像是在和氧气进行一场“贴贴”的游戏。
转过头来聊聊非金属,别看它们不如金属那样“闪闪发光”,其实也是个“厉害角色”。
像氯,这家伙可真调皮,单独一个氯气是绿色的,跟小绿人似的。
氯跟钠结合成氯化钠,就是咱们平常用的盐,听说过“盐能治百病”吧,这可不是说说而已。
氯和钠反应的方程式是2Na + Cl₂ → 2NaCl。
简简单单就把两个元素结合在一起,成就了咱们的美味。
还有硫,硫可是一位“火山之神”,在自然界中可是个大忙人。
硫和氧反应,生成了二氧化硫,这化学方程式是S + O₂ → SO₂。
听说这个东西一多就会造成酸雨,大家可得注意,别让它把咱们的屋顶给腐蚀了。
然后再说说碳,碳是个万用的元素,能跟很多东西“搭伙”。
比如说,碳和氧结合成二氧化碳,化学式是C + O₂ → CO₂。
这个小家伙可是我们呼吸时的“老朋友”,虽然有时候也被人说成“坏蛋”,但其实它在植物的光合作用中可是个“大功臣”。
元素(金属、非金属)及其化合物化学方程式

金属及其化合物1、钠放置在空气中 4Na + O2 = 2Na2O2、钠在空气中燃烧(黄色的火焰)2Na + O2 Na2O2(淡黄色固体)3、铝箔被氧气氧化 4Al + 3O2 △2O34、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑【2Na + 2H2O = 2Na+ + 2OH - + H2 ↑】5、高温下铁与水反应 3Fe + 4H2O(g) 高温Fe3O4 + 4H26、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3 + 3H2↑【2Al + 6H+ = 2Al3+ +3H2↑】7、铝与氢氧化钠溶液反应(实际是钠和水反应) 2Al + 2NaOH + 2H2O = 2NaAlO2(偏铝酸钠) + 3H2↑【2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑】8、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O = 4NaOH + O2↑【2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑】9、过氧化钠可用在呼吸面具和潜水艇中作为【供氧剂】,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O210、苏打(纯碱)与盐酸反应 Na2CO3 +2HCl=2NaCl+H2O +CO2↑【 CO32- + 2H+ = H2O + CO2↑】11、小苏打(碳酸氢钠)溶液与盐酸反应 NaHCO3 + HCl= NaCl+H2O +CO2↑【HCO3- + H+ = H2O + CO2↑】12、小苏打受热分解 2NaHCO3△Na2CO3 + H2O +CO2 ↑13、小苏打和氢氧化钠溶液溶液反应NaHCO3+NaOH= Na2CO3 + H2O 【HCO3-+ OH - = H2O + CO32- 】14、氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH ===2NaAlO2 +H2O 【Al2O3 + 2OH - === 2AlO2- + H2O】15、氧化铝溶于硫酸Al2O3+ 3H2SO4==Al2(SO4)3+3H2O 【Al2O3 +6H+ = 2Al3+ +3H2O】16、硫酸铝溶液中滴加过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4【Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+】17、氢氧化铝中加盐酸 Al(OH)3 + 3HCl = AlCl3 + 3H2O 【Al(OH)3 + 3H+ = Al3+ + 3H2O】18、Al(OH)3与NaOH溶液反应: Al(OH)3 + NaOH NaAlO2 +2H2O【Al(OH)3 + OH - = AlO2- +2H2O】19、氢氧化铝受热分解 2Al(OH)3△Al2O3+3H2O20、铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑【Fe + 2H+ = Fe2+ + H2↑】21、氧化铁溶于盐酸中 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 【Fe 2O 3 + 6H + = 2Fe 3++ 3H 2O 】 22、氧化亚铁溶于盐酸中 FeO + 2HCl = FeCl 2 + H 2O 【FeO + 2H += Fe 2++ H 2O 】 23、氯化铁溶液中滴入氢氧化钠溶液 FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl【Fe 3++ 3OH - = Fe(OH)3 ↓(红褐色沉淀)】 24、硫酸亚铁溶液中滴加氢氧化钠溶液Fe SO 4+ 2NaOH = Fe(OH)2↓+ Na 2SO 4 【Fe 2++ 2OH - = Fe(OH)2 ↓(白色沉淀)】25、氢氧化亚铁在空气中被氧化(白色沉淀迅速变为灰绿色,最后变为红褐色沉淀) 4Fe(OH)2 + O 2 +2H 2O = 4Fe(OH)3 26、氢氧化铁受热分解 2Fe(OH)3△Fe 2O 3+3H 2O27、氯化亚铁溶液中通入氯气 2FeCl 2 + Cl 2 = 2FeCl 3 【2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - 】 28、氯化铁溶液中加入铁粉2FeCl 3 + Fe =3FeCl 2 【2Fe 3++ Fe =3Fe 2+】非金属及其化合物1、硅及其化合物的转化关系※ ①SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)※ ②SiO 2+2NaOH = Na 2SiO 3+H 2O( SiO 2+2OH -= SiO 32-+H 2O )※ ③Na 2SiO 3+2HCl = H 2SiO 3(胶体)+2NaCl ( SiO 32-+2H += H 2SiO 3(胶体))④ SiO 2+CaO 高温 CaSiO 32、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3②Cu +Cl 2 点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2(2Fe 3++Cu = 2Fe 2++Cu 2+)④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O(MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O) ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑(不稳定性)(Cl 2+H 2O = H ++Cl -+HclO) (2HClO 2H ++2Cl -+O 2↑)※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O (工业制漂白粉) Ca(ClO)2+CO 2+H 2O = CaCO 3↓+2HClO(漂白原理)3、硫及其化合物的转化关系Na 2SiO 3 SiF 4 SiO 2 H 2SiO 3CaSiO 3 ① ② ③④ CuCl 2 HClO HCl Cl 2 FeCl 3 NaClO Ca(ClO)2 ① ② ③④ ⑤ ⑥ ⑦ ⑧ ⑨点燃或光照 光照光照①S +O 2 点燃 SO 2 ※②SO 2+O 2 催化剂 加热 2SO 3③SO 3+H 2O = H 2SO 4(工业制硫酸) ④SO 2+H 2O H 2SO 3⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O(SO 2+Ca 2++2OH -=CaSO 3↓+H 2O )⑥SO 3+CaO = CaSO 4 或 SO 3+Ca(OH)2 = CaSO 4+H 2O※⑦Cu+2H 2SO 4(浓) △ CuSO 4+SO 2↑+2H 2O ※⑧C +2H 2SO 4(浓) △CO 2↑+2SO 2↑+2H 2O4、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2 ※③3NO 2+H 2O = 2HNO 3+NO ( 3NO 2+H 2O =2H ++2NO 3-+NO)※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O)※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂高温高压 2NH 3 (3Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O ) (工业制氨气)⑦NH 3+HCl = NH 4Cl NH 4HCO 3 △NH 3↑+H 2O+CO 2↑(铵盐受热易分解)⑧NH 4Cl△NH 3↑+HCl ↑(水溶液中)( NH 3+H += NH 4+) ⑧NH 4Cl +NaOH △ NaCl+NH 3↑+H 2O (NH 4++OH-△NH 3↑+H 2O) ※⑧2NH 4Cl +2Ca(OH)2 △ CaCl 2+2NH 3↑+2H 2O⑨4NH 3+5O 2 催化剂△ 4NO +6H 2OSO 42 3 CaSO 3 4① ⑨ ⑧⑦ ⑥ ④ ③ N 2 NH 3 NH 4Cl NO 3② ③高温或放电。
高中化学必修1金属和非金属及其化合物化学方程式汇总

高中化学必修1金属和非金属及其化合物化学方程式汇总9、“铝三角”(氢氧化铝的反应在上面已经提到,略):AlCl3+3NaOH(少量)=Al(OH)3↓+3NaClAl3++3OH-=Al(OH)3↓+AlCl3+4NaOH(过量)=2NaAlO2 + 2H2O +3NaClAl3++4OH- = AlO2- +2H2ONaAlO2+HCl(少量)+H2O=Al(OH)3↓+NaClAlO2- +H+ +H2O=Al(OH)3↓NaAlO2+4HCl(过量)=AlCl3+3NaCl+2H2OAlO2- +4H+ =Al 3+ + 2H2O10、明矾净水原理明矾溶于水后发生电离:KAl(SO4)2==K++Al3++2SO42-铝离子与水反应生成:Al(OH)3胶体:Al3++3H2O==Al(OH)3(胶体)+3H+三、铁及其重要化合物1、工业炼铁原理:Fe2O3+3CO 高温 2Fe+3CO22、铁与非金属反应:2Fe+3Cl2点燃 2FeCl33Fe+2O2点燃 Fe3O43、与水反应:3Fe+4H2O(g) 高温 Fe3O4+4H24、铁与酸反应:Fe+2HCl== FeCl2+H2↑Fe+2H+== Fe2++H2↑5、铁与盐溶液反应:Fe+CuSO4==Cu+FeSO4 Fe+Cu2+==Cu+Fe2+Fe+2FeCl3 == 3FeCl2Fe+2Fe3+ == 3Fe2+6、铁的氧化物Fe2O3 + 6H+ == 2Fe3+ + 3H2OFeO + 2H+ == Fe2+ + H2O7、Fe2+与Fe3+的检验①、Fe2+的检验:(1) 颜色:浅绿色 (2)加NaOH溶液:先产生白色沉淀,后变成灰绿色,最后成红褐色Fe2++2OH-== Fe(OH)2↓ (白色)4Fe(OH)2+O2+2H2O== 4Fe(OH)3(红褐色)(3) 先加KSCN溶液,不变色,再加新制氯水,溶液变成血红色2Fe2++Cl2==2Fe3++2Cl-②、Fe3+的检验(1)颜色:棕黄色(2)加KSCN溶液:溶液变成血红色(3)加NaOH溶液:红褐色沉淀 Fe3++3OH-== Fe(OH)3↓8、氢氧化铁受热分解:2Fe(OH)3△ Fe2O3 + 3H2O9、 Fe2+与Fe3+的转化(1)Fe2+→Fe3+2Fe2++Cl2==2 Fe3++2Cl-(2) Fe3+→Fe2+Fe+2Fe3+ == 3Fe2+四、硅及其重要化合物1、二氧化硅① 酸性氧化物:SiO2+2NaOH==Na2SiO3+H2OSiO2+CaO高温 CaSiO3② 弱氧化性:SiO2 +4HF==SiF4↑+2H2O2、硅酸盐Na2SiO3+2HCl==H2SiO3↓+2NaClNa2SiO3+ CO2+H2O==H2SiO3 ↓+Na2CO3(酸性:H2CO3 > H2SiO3)五、氯的重要化合物1、氯气与金属的反应2Fe+3Cl2点燃 2FeCl3Cu+Cl2点燃 CuCl22Na+Cl2点燃 2NaCl2、氯气与非金属的反应H2+Cl2 点燃 2HCl 2P+3Cl2点燃 2PCl3 2P+5Cl2点燃 2PCl5 3、氯气与水的反应Cl2+H2O == HCl + HClO(次氯酸)4、次氯酸光照分解:2HClO 光照 2HCl + O2↑5、Cl2与碱溶液的反应Cl2+2NaOH=NaCl+NaO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(制漂白粉)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO(漂白原理)(酸性:H2CO3 > HClO)六、硫及其重要化合物1、硫的可燃性S+O2点燃 SO22、2SO2 + O2 2SO33、与水反应:SO2+H2O H2SO3SO3+H2O == H2SO44、与碱反应:SO2 + Ca(OH)2= CaSO3 + H2OSO3 + Ca(OH)2= CaSO4 + H2O5、与碱性氧化物反应:SO2+CaO == CaSO3SO3+CaO == CaSO46、浓硫酸强氧化性C + 2H2SO4(浓) △ CO2↑+ 2SO2↑+ 2H2OCu+2H2SO4(浓)△ CuSO4+SO2↑十2H2O七、氮及其重要化合物1、合成氨: N2 + 3H22NH32、NH3①氨气与水:NH3 + H2O NH3·H2O NH4+ + OH -②氨气与酸:NH3+HCl=NH4ClNH3+HNO3=NH4NO33、铵盐与碱反应:NH4NO3+NaOH △ NaNO3+NH3↑+H2O2NH4Cl + Ca(OH)2△ CaCl2 + 2NH3↑+ 2H2O(实验室制氨气)4、铵盐不稳定性:NH4Cl △ NH3↑+HCl ↑ NH4HCO3△ NH3+H2O+CO2↑5、HNO3强氧化性:4HNO3(浓)+Cu==Cu(NO3)3+3NO2↑+2H2O8HNO3+3Cu==3Cu(NO3)3+2NO↑+4H2O6、雷雨发庄稼N2 + O2放电 2NO2NO + O2 == 2NO23NO2 + H2O == 2HNO3 + NO其它知识1、固体颜色:淡黄色固体: Na2O2 , S2、颜色反应:Na元素:黄色;K元素:紫色(透过蓝色钴玻璃)3、沉淀颜色:Mg(OH)2白色;Fe(OH)2 白色; Fe(OH)3 红褐色;Cu(OH)2蓝色4、离子溶液颜色:Fe2+浅绿色;Fe3+黄色;Cu2+蓝色5、气体颜色:NO2红棕色;Cl2黄绿色6、 Al 、Fe在冷的浓H2SO4、浓HNO3中发生钝化。
高三化学金属及其化合物化学方程式大全

高三化学金属及其化合物化学方程式大全在高三化学的学习中,金属及其化合物的化学方程式是非常重要的知识点。
熟练掌握这些方程式,对于理解化学反应的本质、解决化学问题以及在考试中取得好成绩都具有关键作用。
下面我们就来一起梳理一下常见的金属及其化合物的化学方程式。
一、钠及其化合物1、钠与氧气反应常温下:4Na + O₂= 2Na₂O加热时:2Na + O₂= Na₂O₂2、钠与水反应2Na + 2H₂O = 2NaOH + H₂↑3、钠与盐酸反应2Na + 2HCl = 2NaCl + H₂↑4、钠在空气中燃烧2Na + Cl₂= 2NaCl5、氧化钠与水反应Na₂O + H₂O = 2NaOH6、过氧化钠与水反应2Na₂O₂+ 2H₂O = 4NaOH + O₂↑7、过氧化钠与二氧化碳反应2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂8、碳酸钠与盐酸反应Na₂CO₃+ 2HCl = 2NaCl + H₂O + CO₂↑9、碳酸氢钠与盐酸反应NaHCO₃+ HCl = NaCl + H₂O + CO₂↑10、碳酸氢钠受热分解2NaHCO₃= Na₂CO₃+ H₂O + CO₂↑11、碳酸钠溶液中通入二氧化碳Na₂CO₃+ H₂O + CO₂= 2NaHCO₃二、铝及其化合物1、铝与氧气反应4Al + 3O₂= 2Al₂O₃2、铝与盐酸反应2Al + 6HCl = 2AlCl₃+ 3H₂↑3、铝与氢氧化钠溶液反应2Al + 2NaOH + 2H₂O = 2NaAlO₂+ 3H₂↑4、氧化铝与盐酸反应Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O5、氧化铝与氢氧化钠溶液反应Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O6、氢氧化铝与盐酸反应Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O7、氢氧化铝与氢氧化钠溶液反应Al(OH)₃+ NaOH = NaAlO₂+ 2H₂O8、实验室制取氢氧化铝AlCl₃+ 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄Cl9、偏铝酸钠溶液中通入二氧化碳(少量)2NaAlO₂+ CO₂+ 3H₂O = 2Al(OH)₃↓ + Na₂CO₃偏铝酸钠溶液中通入二氧化碳(过量)NaAlO₂+ CO₂+ 2H₂O = Al(OH)₃↓ + NaHCO₃三、铁及其化合物1、铁与氧气反应3Fe + 2O₂= Fe₃O₄2、铁与盐酸反应Fe + 2HCl = FeCl₂+ H₂↑3、铁与硫酸铜溶液反应Fe + CuSO₄= FeSO₄+ Cu4、氧化亚铁与盐酸反应FeO + 2HCl = FeCl₂+ H₂O5、氧化铁与盐酸反应Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O6、四氧化三铁与盐酸反应Fe₃O₄+ 8HCl = FeCl₂+ 2FeCl₃+ 4H₂O 7、氯化亚铁溶液中通入氯气2FeCl₂+ Cl₂= 2FeCl₃8、氯化铁溶液中加入铁粉2FeCl₃+ Fe = 3FeCl₂9、氯化铁溶液中加入铜粉2FeCl₃+ Cu = 2FeCl₂+ CuCl₂10、氢氧化亚铁在空气中被氧化4Fe(OH)₂+ O₂+ 2H₂O = 4Fe(OH)₃11、氢氧化铁受热分解2Fe(OH)₃= Fe₂O₃+ 3H₂O四、铜及其化合物1、铜在空气中加热2Cu + O₂= 2CuO2、铜与硝酸反应(浓硝酸)Cu + 4HNO₃(浓) = Cu(NO₃)₂+ 2NO₂↑ + 2H₂O (稀硝酸)3Cu + 8HNO₃(稀) = 3Cu(NO₃)₂+2NO↑ + 4H₂O 3、氧化铜与盐酸反应CuO + 2HCl = CuCl₂+ H₂O4、氢氧化铜受热分解Cu(OH)₂= CuO + H₂O5、硫酸铜溶液与氢氧化钠溶液反应CuSO₄+ 2NaOH = Cu(OH)₂↓ + Na₂SO₄掌握这些金属及其化合物的化学方程式,不仅需要死记硬背,更要理解反应的本质和规律。
金属及其化合物化学方程式汇总

.必修一金属及其化合物化学方程式一、金属钠及其化合物1、钠在空气中(1)钠块在空气中变暗:2Na +O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体)现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体(3)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH +H2↑2Na +2H2O =2Na++2OH-+H2↑3、钠与盐溶液反应(先水后盐)(1)与氯化钠溶液:本质上就是与水反应(2)与硫酸铜溶液:2Na +2H2O =2NaOH +H2↑2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4总:2Na +2H2O + CuSO4=Cu(OH)2↓+ Na2SO4+H2↑2Na +2H2O+ Cu2+ =Cu(OH)2↓+H2↑+ 2Na+(3)与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+2H2O =4NaOH +O2 ↑2Na2O2+2H2O =4Na++4OH -+O2↑现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O +H2O =2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+2CO2=2Na2CO3+O2碱性氧化物Na2O与二氧化碳的反应Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应2Na2O2+4HCl =4NaCl +2H2O+O2 ↑2Na2O2+4H+=4Na++2H2O+O2↑碱性氧化物Na2O与盐酸的反应Na2O +2HCl =2NaCl +H2O Na2O +2H+=2Na++H2O7、氢氧化钠(1)与酸性氧化物反应a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2OOH -+CO2 (少量)= CO32-+H2Ob 继续向该溶液中通入CO2:Na2CO3+H2O +CO2=2NaHCO3CO32-+H2O +CO2=2HCO3-c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3a+bOH -+CO2 (过量)= HCO3-d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2OCa2++ 2OH -+CO2 (少量)= CaCO3↓+H2Oe继续向该溶液中通入CO2:CaCO3+H2O +CO2=Ca(HCO3)2CaCO3+H2O +CO2=Ca2++ 2HCO3-f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+eOH -+CO2 (过量)= HCO3-CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠)①向盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑CO32-+2H+=H2O +CO2↑现象:立即有气泡产生②纯碱溶液中滴加盐酸,至过量△△.Na2CO3+HCl =NaHCO3+NaCl CO32-+H+ =HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑现象:先无明显现象,然后有气泡产生9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立即有气泡产生)NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑10、碳酸钠与Ca(OH)2反应:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓CO32-+Ca2+ = CaCO3↓11、碳酸氢钠与碱反应(1)与NaOH反应:NaHCO3 + NaOH== Na2CO3 + H2OHCO3-+OH -=H2O +CO32-(2)与Ca(OH)2反应Ca(OH)2 + NaHCO3(少)==CaCO3↓+ H2O+ NaOHCa2+ +OH -+HCO3-(少)==CaCO3↓+ H2OCa(OH)2 + 2NaHCO3(多)== CaCO3↓ + 2H2O+Na2CO3Ca2+ +2OH -+2HCO3-(多)== CaCO3↓ + 2H2O+CO32-12、碳酸钠与某些盐反应Na2CO3+CaCl 2== CaCO3↓+2NaCl CO32-+Ca2+ = CaCO3↓NaHCO3+CaCl 2== 不反应(可用于鉴别碳酸钠和碳酸氢钠)13、小苏打受热分解2NaHCO3=Na2CO3+H2O +CO2↑14、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离子方程式)二、铝及其化合物1、与非金属4Al + 3O2 = 2Al2O32Al+3Cl2 == 2AlCl32Al + 3S == Al2S32、铝片与稀盐酸反应2Al +6HCl =2AlCl3 +3H2↑2Al +6H+=2Al3++3H2↑3 、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH-+2H2O =2AlO2-+3H2↑4、与盐溶液反应:置换出较不活泼的金属单质2Al+3CuSO4 ==Al2(SO4 )3+3Cu 2Al+3Cu2+ = 2Al3++3Cu5、与水不反应:6、Al2O3(两性氧化物)(1)与强酸反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+ = 2Al3++3H2O(2)与强碱反应Al2O3+2NaOH = 2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O7. Al(OH)3(两性氢氧化物)(1)Al(OH)3的制备:可溶性铝盐和氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+(2)与强酸反应Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O (3)与强碱反应Al(OH)3+NaOH =NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O (4)加热分解2Al(OH)3△Al2O3 + 3H2O8、Al3+(1)少量强碱:AlCl3+3NaOH===Al(OH)3↓+3N aCl Al3++3OH-=Al(OH)3↓(2)过量强碱:AlCl3+4NaOH===NaAlO2 +3NaCl+2 H2OAl3++4OH-=AlO2-+2 H2O9、AlO2-(1)少量HCl:NaAlO2 +HCl+H2O=NaCl+Al(OH)3↓AlO2-+H++H2O=Al(OH)3↓(2)继续向该溶液中加入盐酸:Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O△点燃△.(3)过量HCl:NaAlO2+4HCl=NaCl+AlCl3+2H2O AlO2-+4H+=Al3++2 H2O(4)通入少量CO2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(5)通入过量CO2CO2+NaAlO2+2H2O=Al(OH)3↓+Na HCO3 (工业制取氢氧化铝)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-10、KA1(SO4)2 (净水剂)(1)使硫酸根恰好沉淀完全: KA1(SO4)2+2Ba(OH)2==2BaSO4↓+KAlO2Al3++4OH-+2Ba2++2SO42-==2BaSO4↓+AlO2-(2)使铝离子恰好沉淀完全: 2KA1(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO42Al3++ 3 SO42- + 6OH—+ 3Ba2+==3Ba SO4↓+ 2Al(OH)3↓(3)净水原理:Al3++3H2O=== Al(OH)3(胶体)+3 H+11、相互滴加顺序不同而现象不同的几组反应:(可用于鉴别)①:AlCl3+ NaOH ②:NaAlO2 + HCl ③:Na2CO3+ HCl (NaHSO4)三、铁及铁的化合物1、铁的冶炼: 3CO+ Fe2O3== 2Fe+ 3CO22、与非金属:(1)2Fe + 3Cl2 === 2FeCl3(2)3 Fe + 2O2=== Fe3O4(3)Fe + S === FeS3、与水蒸气:3 Fe + 4 H2O(g) ====Fe3O4+ 4 H24、与非氧化性酸:Fe + 2 HCl === FeCl2+ H2↑Fe + 2 H+ == Fe2++ H2↑5、与盐:Fe + CuSO4 == FeSO4+Cu Fe + Cu2+===Fe2+ + Cu6、与碱不反应:7、铁的氧化物FeO(黑色)、Fe2O3(红棕色,俗名铁红)、Fe3O4(磁性氧化铁,黑色晶体)(1)FeO + 2 HCl === FeCl2 + H2O(非氧化性酸,不变价;遇HNO3变价,下同)FeO + 2 H+ == Fe2+ + H2O(2)Fe2O3 + 6HCl ===2 FeCl3 + 3 H2OFe2O3 + 6 H+ ===2 Fe3+ + 3 H2O(3)Fe3O4+ 8 HCl ===2 FeCl3 + FeCl2 + 4 H2OFe3O4+ 8 H+ === 2 Fe3+ +Fe2+ + 4 H2O用途:作油漆的颜料,炼铁的原料8、铁的氢氧化物(Fe(OH)2,Fe(OH)3)(1)制备:A:FeSO4 + 2 NaOH = Fe(OH)2↓+ Na 2SO4Fe2+ + 2 OH—= Fe(OH)2↓B:3NH3 .H2O + FeCl3 ==== Fe(OH)3↓+ 3 NH4CIFe3+ + 3NH3 .H2O =Fe(OH)3↓+ 3 NH4+(2)氢氧化亚铁不稳定性:4 Fe(OH)2 + O2 + 2 H2O= 4 Fe(OH)3(3)氢氧化铁不稳定性:2Fe(OH)3 ==== Fe2O3 + 3H2O(4)与酸:Fe(OH)3+ 3HCl ====FeCl3+ 3 H2O Fe(OH)3+ 3 H+ === Fe3+ + 3 H2O Fe(OH)2+ 2 HCl ==== FeCI2+ 2 H2O(非氧化性酸,不变价;遇HNO3变价)Fe(OH)2 + 2 H+ == Fe2+ + 2H2O9、Fe2+盐(还原性离子,易被氧化,保存需加少量Fe粉及相应酸)(1)与氯气:2FeCl2 + Cl2 = 2 FeCl3 2Fe2+ + Cl2 === 2Fe3+ + 2 CI—(2)FeSO4溶液和H2O2:2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O(3)FeSO4溶液和酸性KMnO4溶液:5 Fe2+ + MnO4—+8 H+=== Mn 2++ 4H2O+ 5Fe3+(4)FeSO4溶液在空气中变质:4Fe2+ + O2 + 4 H+=== 4Fe3+ + 2H2O10、Fe3+盐(氧化性离子,易被还原. 易水解,保存需加少量相应酸抑制水解.)(1) 2 FeCl3 + Fe =3 FeCl22Fe3+ + Fe === 3 Fe2+(2)2 FeCl3+ Cu === 2FeCl2+ CuCl22Fe3+ + Cu ==2Fe2++ Cu2+(3)Fe3+的检验:FeCl3 + 3 KSCN == 3 KCI+ Fe(SCN)3Fe3+ + 3SCN— === Fe(SCN)3(4)用途:净水剂Fe3+ +3 H2O=== Fe(OH)3(胶体)+ 3 H+高温点燃点燃△高温△.。
鲁科版高中化学选修三金属及其化合物重要方程式汇总

金属及其化合物重要方程式汇总(一)钠及其化合物1.刚切开钠的断面很快变暗:化学方程式:;2.钠在空气中燃烧:化学方程式:;3.过量钠投入稀盐酸中:化学方程式:①;②;离子方程式:①;②;4.钠投入硫酸铜溶液中:化学方程式:;离子方程式:;5.氧化钠受热氧化:化学方程式:;6.氧化钠与二氧化碳:化学方程式:;7.氧化钠投入水中:化学方程式:;离子方程式:;8.氧化钠投入稀盐酸中:化学方程式:;离子方程式:;9.过氧化钠投入水中:化学方程式:;离子方程式:;10.呼吸面具中常用过氧化钠做供氧剂的原因:化学方程式:;11.向碳酸钠溶液中滴入几滴澄清石灰水:化学方程式:;离子方程式:;12.向碳酸钠溶液中滴入几滴氯化钡溶液:化学方程式:;离子方程式:;13.除去碳酸氢钠溶液中混有的少量碳酸钠:化学方程式:;离子方程式:;14.除去碳酸钠固体中混有的少量碳酸氢钠:化学方程式:;15.碳酸氢钠溶液与稀盐酸:化学方程式:;离子方程式:;16.碳酸氢钠溶液与烧碱:化学方程式:;离子方程式:;17.碳酸钠溶液与醋酸(CH3COOH)溶液:化学方程式:;离子方程式:;18.用大理石与稀盐酸制取二氧化碳:化学方程式:;离子方程式:;19.氢氧化钡溶液和稀硫酸:化学方程式:;离子方程式:;20.氢氧化钡溶液和硫酸铜溶液:化学方程式:;离子方程式:;21.向烧碱溶液中通入少量二氧化碳:化学方程式:;离子方程式:;22.向烧碱溶液中通入过量二氧化碳:化学方程式:;离子方程式:;23.向纯碱溶液中滴加几滴稀盐酸:化学方程式:;离子方程式:;24.向稀盐酸中滴加几滴纯碱溶液:化学方程式:;离子方程式:;25.碳酸氢钠与足量氢氧化钙溶液:离子方程式:26.碳酸氢钠与少量氢氧化钙溶液:离子方程式:(二)铝及其化合物1.表面被氧化的铝片溶于过量氢氧化钠溶液:化学方程式:①;②;离子方程式:①;②;2.表面被氧化的铝片溶于过量稀盐酸:化学方程式:①;②;离子方程式:①;②;3.制备氢氧化铝(1)往氯化铝溶液中加过量氨水:离子方程式:;(2)往偏铝酸钠溶液中通过量二氧化碳:离子方程式:;4.氢氧化铝受热分解:化学方程式:;5.铝盐的性质往氯化铝溶液中逐滴滴加烧碱溶液,先产生白色胶状沉淀,后沉淀逐渐溶解,最后得到无色透明溶液。
完整版)初三化学方程式大全

完整版)初三化学方程式大全化学资料以下是常见的化学元素和化合物的化学式:1.镁Mg、铁Fe、铜Cu、锌Zn、汞Hg;氦气He、氖气Ne、氩气Ar;氢气H2、氧气O2、氮气N2、氯气Cl2、臭氧O3、碳C、磷P、硫S2.水H2O、过氧化氢H2O2、一氧化碳CO、二氧化碳CO2、五氧化二磷P2O5、氧化钠Na2O、氧化镁MgO、氧化钙CaO、氧化铝Al2O3、二氧化锰MnO2、氧化铁Fe2O3、四氧化三铁Fe3O4、氧化亚铁FeO、氧化铜CuO、氧化汞HgO3.氯酸钾KClO3、高锰酸钾KMnO4、锰酸钾K2MnO4、氯化钠NaCl、硫酸H2SO4、硝酸HNO3、盐酸HCl、硫酸铜CuSO4、硫酸亚铁FeSO4、碳酸钠Na2CO3、硫酸钠Na2SO4、氢氧化铜Cu(OH)2、氢氧化钠NaOH化合价口诀和根的化合价:化合价口诀:一价氯氢钾钠银,二价氧钙镁钡锌,三铝四硅五价磷,一二铜汞二三铁,二四六硫二四碳,单质化合价为零。
根的化合价:铵根离子NH4+、碳酸根离子CO32-、高锰酸根离子MnO4-、锰酸根离子MnO42-、硝酸根离子NO3-、氯酸根离子ClO3-、硫酸根离子SO42-、氢氧根离子OH-金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au酸、碱和盐溶液组成、指示剂和pH:组成:酸H+ + 酸根离子、碱金属离子 + OH-、盐金属离子 + 酸根离子指示剂:酸溶液能使紫色石蕊溶液变红色,碱溶液能使紫色石蕊溶液变蓝色;酸溶液能使无色酚酞溶液不变色,碱溶液能使无色酚酞溶液变红色。
pH:酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7.酸、碱和盐的溶解性:可溶于水的物质:NH4OH(挥发性)、KOH、NaOH、Ba(OH)2、Ca(OH)2、Mg(OH)2、Al(OH)3、Mn(OH)2、Zn(OH)2、Fe(OH)2、Fe(OH)3、Cu(OH)2不易溶于水的物质:OH-、NH4+、CO32-、PO43-、SO42-、ClO3-、MnO4-、FeSO4、CuSO4、Na2SO4、Na2CO3以上是化学中常见的元素、化合物和相关知识点。
03铁、铜及其化合物-【化学方程式】高考重要化学方程式汇总

②过量锌:2Fe3++3Zn 2Fe+3Zn2+
(4)与KI溶液反应
①化学反应:2KI+2FeCl3 2FeCl2+I2+2KCl
②离子反应:2Fe3++2I- 2Fe2++I2(FeI3不存在的原因)
③反应现象:溶液颜色变化不明显,产生紫黑色沉淀
(5)与H2S反应
(3)与C反应
①FeO:2FeO+C 2Fe+CO2↑
②Fe3O4:Fe3O4+2C 3Fe+2CO2↑
③Fe2O3:2Fe2O3+3C 4Fe+3CO2↑
(4)与Al反应(铝热反应)
①FeO:2Al+3FeO 3Fe+Al2O3
②Fe3O4:8Al+3Fe3O4 9Fe+4Al2O3
③Fe2O3:2Al+Fe2O3 2Fe+Al2O3
(1)与H2反应
①FeO:FeO+H2 Fe+H2O
②Fe3O4:Fe3O4+4H2 3Fe+4H2O
③Fe2O3:Fe2O3+3H2 2Fe+3H2O
(2)与CO反应
①FeO:FeO+CO Fe+CO2
②Fe3O4:Fe3O4+4CO 3Fe+4CO2
③Fe2O3:Fe2O3+3CO 2Fe+3CO2(高炉炼铁的主反应)
知识点8硫酸铜的性质
1.与强碱溶液反应
(1)离子反应:Cu2++2OH- Cu(OH)2↓
高中无机化学化学方程式总结

高中化学元素化合物化方程式汇总(一)金属及其化合物一、钠及其化合物(37)1.钠与氧气常温反应:4Na+O2=2Na2O(白色)2.钠与氧气加热反应:2Na+O2≜Na2O2(淡黄色)3.钠和水反应:2Na+2H2O=2NaOH+H2↑(2Na+2H2O=2Na++2OH-+H2↑)4.钠与硫酸铜溶液反应:{2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(不能置换出金属,先水后盐的原则)5.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑(2Na+ 2H+=2Na++H2↑)6.钠与氯气反应:2Na+Cl2点燃→2NaCl(白烟)7.钠与硫反应:2Na+S=Na2S8.氢化钠与水反应:NaH(s)+H2O=NaOH+H2↑9.氧化钠与水反应:Na2O+H2O=2NaOH10.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO311.氧化钠与盐酸溶液反应:Na2O+2HCl=2NaCl+H2O12.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑13.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O214.过氧化钠与盐酸溶液反应:2Na2O2+4HCl=4NaCl +2H2O+O2↑15.过氧化钠与氢气反应(“白吃”):Na2O2+H2氧气→2NaOH16.过氧化钠与一氧化碳反应(“白吃”):Na2O2+CO= Na2CO317.氢氧化钠与二氧化碳1:1反应:NaOH +CO2 =NaHCO318.氢氧化钠与二氧化碳2:1反应:2NaOH+CO2=Na2CO3+H2O19.氢氧化钠与二氧化碳反应(1:1与1:2总方):5NaOH+4CO2=3 NaHCO3+Na2CO3+H2O20.碳酸钠与水反应:CO32-+ H2O⇔HCO3-+OH-21.碳酸钠与少量酸反应:CO32-+H+= HCO3-22.碳酸钠与酸(1:1)反应:CO32-+H+= HCO3-23.碳酸钠与酸(1:2)反应:CO32-+2H+=H2O+CO2↑24.碳酸钠与氢氧化钠溶液反应:——25.碳酸钠与石灰水反应:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(CO32-+Ca2+=CaCO3↓)26.碳酸钠与氯化钡溶液反应:Na2CO3+BaCl2=2NaCl+BaCO3↓(CO32-+Ba2+=BaCO3↓)27.碳酸钠与二氧化碳反应:Na2CO3 +CO2+H2O =2NaHCO3↓28.碳酸氢钠与水反应:HCO3-+ H2O⇔H2CO3+OH-29.碳酸氢钠与盐酸溶液反应:NaHCO3+HCl=NaCl+H2O+CO2↑(HCO3-+H+=H2O+CO2↑)30.碳酸氢钠与氢氧化钠溶液反应:NaHCO3+NaOH=Na2CO3+H2O(HCO3-+OH-=CO32-+H2O)31.少量碳酸氢钠与石灰水反应:NaHCO3+ Ca(OH)2= NaOH+ CaCO3↓+H2O32.过量碳酸氢钠与石灰水反应:2NaHCO3+ Ca(OH)2= Na2CO3+ CaCO3↓+2H2O33.碳酸氢钠与氯化钡溶液反应:——34.碳酸氢钠与二氧化碳反应:——35.碳酸氢钠受热分解:2NaHCO3≜Na2CO3+H2O+CO2↑36.侯德榜制碱法:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3↓37.钠长期放在空气中的反应:Na+O2=Na2O+H2O→NaOH(固)+H2O→NaOH(液)+CO2→Na2CO3·10H2O→Na2CO3二、铝及其化合物(22)38.铝与水常温反应:2Al+6H2O= 2Al(OH)3+3H2↑39.铝与氧气加热反应:4Al+3O2≜2Al2O340.铝与氯气加热反应:2Al+3Cl2点燃→2AlCl341.铝与硫加热反应:2Al+3S≜Al2S342.铝与三氧化二铁反应:2Al+Fe2O3高温→2Fe+Al2O343.三硫化二铝与水:Al2S3+6H2O=2Al(OH)3↓+3H2S↓44.铝与盐酸溶液反应:2Al+6HCl=2AlCl3+3H2↑(2Al+6H+=2Al3++3H2↑)45.铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑)46.铝与稀硝酸溶液的钝化反应:Al+4HNO3(稀) =Al(NO3)3 + NO↑+ 2H2O47.铝离子与偏铝酸根反应:Al3++3AlO2-+6H2O= 4Al(OH)3↓48.铝离子与氢氧根(1:3)反应:Al3++3OH-=Al(OH)3↓49.铝离子与氢氧根(1:4)反应:Al3++4OH-=AlO2-+2H2O50.铝离子与水反应:Al3++ H2O= Al(OH)3↓(胶体)+3H+51.偏铝酸根与酸(1:1)反应:AlO2-+H++H2O= Al(OH)3↓52.偏铝酸根与酸(1:4)反应:AlO2-+4H+= Al3++2H2O53.氧化铝与盐酸溶液反应:Al2O3+6HCl=2AlCl3+3H2O (Al2O3+6H+=2Al3++3H2O)54.氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3+2OH-=2AlO2-+H2O)55.氢氧化铝与酸反应:Al(OH)3+3H+=Al3++3H2O56.氢氧化铝与碱反应:Al(OH)3+OH-=AlO2-+2H2O57.氢氧化铝的制备方法1:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4[Al23++3NH3·H2O=Al(OH)3↓+3NH4+]58.氢氧化铝的制备方法2:AlO2-+CO2+2H2O= Al(OH)3↓+ HCO3-2AlO2-+CO2+3H2O= 2Al(OH)3↓+ CO32-59.氢氧化铝受热分解:2Al(OH)3≜Al2O3+3H2O三、镁及其化合物(11)60.镁与氧气反应:2Mg+O2点燃→2MgO61.镁与二氧化碳反应:2Mg+CO2点燃→2MgO+C62.镁与氮气反应:3Mg+N2点燃→Mg3N263.二氮化三镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑64.镁与水反应:Mg+2H2O≜Mg(OH)2+H2↑65.镁与酸反应:Mg+2H+=Mg2++H2↑66.氧化镁与酸反应:MgO+2H+=Mg2++H2O67.镁离子与碱反应(氢氧化镁的制备):Mg2++2OH-=Mg(OH)2↓68.镁离子与氨水反应(氢氧化镁的制备):Mg2++2 NH3·H2O=Mg(OH)2↓+ 2NH4+69.氢氧化镁与酸反应:Mg(OH)2+2H+=Mg2++2H2O70.氢氧化镁受热分解:Mg(OH)2≜MgO+H2O四、铁及其化合物(24)71.铁与氧气反应:3Fe+2O2点燃→Fe3O472.铁与氯气反应:2Fe+3Cl2点燃→FeCl3(棕色烟)73.铁与硫反应:Fe+S≜FeS74.铁与酸反应:Fe+2H+=Fe2++H2↑75.铁与稀硝酸反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O76.铁与硝酸铁反应:Fe+ Fe(NO3)3=3Fe(NO3)277.过量铁与稀硝酸反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O注:序号为75、76是二次反应,77为这个二次反应的总方。
第三章 金属及其化合物化学方程式(四)铜及其化合物

第三章金属及其化合物化学方程式(四)铜及其化合物1、铜分别与O2、Cl2、S、I2反应化学反应方程式:2Cu+O22CuO(黑色固体)Cu+Cl2CuCl2(棕黄色烟)2Cu+S Cu2S(黑色固体) 2Cu+I22CuI2、铜和浓硫酸反应化学方程式:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O3.铜和浓硝酸反应化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O4.铜和稀硝酸反应化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2N O↑+4H2O;离子方程式: 3Cu+8H++2NO3-= 3Cu2++2N O↑+4H2O5、铜与硝酸银溶液反应化学方程式:Cu+2AgNO3===Cu(NO3)2+2Ag离子方程式:Cu+2Ag+===Cu2++2Ag6、氯化铁溶液腐蚀印刷电路板化学方程式:Cu+2FeCl3=CuCl2+2FeCl2离子方程式:Cu+2Fe3+=Cu2++2Fe2+7、铜在空气中生锈化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。
8、Cu2(OH)2CO3(碱式碳酸铜、铜绿、孔雀石)受热分解化学方程式:Cu2(OH)2CO32CuO + H2O+ CO2↑9、碱式碳酸铜溶于盐酸化学方程式:Cu2(OH)2CO3+4HCl= 2Cu Cl2+3H2O+ CO2↑10、Cu2O在非氧化性酸中,不稳定,发生歧化反应化学方程式:Cu2O+H2SO4=CuSO4+Cu+H2O离子方程式:Cu2O+2H+=Cu2++Cu+H2O11、Cu2O溶于稀硝酸化学方程式: 3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O 离子方程式:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O12、Cu2S溶于稀硝酸化学方程式:3Cu2S +16HNO3(稀)=6Cu(NO3)2+3S+4NO↑+8H2O离子方程式:3Cu2S +16H++4NO3-=6Cu2++3S+4NO↑+8H2O13、CuS溶于稀硝酸化学方程式:3CuS + 8HNO3(稀)= 3S+3Cu(NO3)2+2NO↑+4H2O)离子方程式:3CuS +8H++2NO3- =3Cu2++3S +2NO↑+4H2O14、氧化铜氧化氨气化学方程式:3CuO+2NH33Cu+N2+3H2O15、氧化铜受热10000C以上分解化学方程式:4CuO 2Cu2O +O2↑16、SO2通入氯化铜溶液中反应离子方程式:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-17、将铜粉加入氯化铜溶液中反应离子方程式:Cu2++2Cl-+Cu= CuCl↓18、将KI溶液加入到氯化铜溶液中反应离子方程式:2Cu2++4l-= 2Cul↓+ l219、氢氧化铜溶于强酸离子方程式:Cu(OH)2+2H+=Cu2++2H2O20、氢氧化铜溶于氨水离子方程式:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++ 2OH-+4H2O21、氢氧化铜受热分解化学方程式:Cu(OH)2 CuO+ H2O。
金属及其化合物的化学方程式

金属及其化合物一、钠及其化合物(一)记忆口诀钠块银白质柔软,置于空气色变白,燃烧产物黄色固,阴阳比数1比2呼吸潜水供氧剂,氧化性强可漂白,黄豆钠块投入水,浮熔游嘶小变红,钠酸反应更剧烈,钠盐反应水优先,钠要保存煤油中,失火要用沙盖灭,钠钾火焰的焰色,黄紫蓝玻要记熟,纯碱苏打小苏打,小的受热遇碱变苏打,遇酸皆放CO(读C、O、2),碳酸钠中速度慢。
2(二))钠及其化合物化学方程式配平方法:氧化还原反应据电子守恒配平。
非氧化还原反应:设1法,把跟其他元素联系较多的物质系数设为1,利用彼此联系配平。
1.钠与氧气反应常温4Na+O=2Na O(白色)22加热2Na+O2Na O(淡黄色)222.钠与水反应2Na+2H O=2NaOH+H↑现象:浮熔游嘶小红222Na+2H O=2Na++2OH-+H↑223.氧化钠与水反应Na O+H O=2NaOH22Na O+H O=2Na++2OH-224.过氧化钠与水反应2Na O+2H O=4NaOH+O↑22222Na O+2H O=4Na++4OH-+O↑22225.过氧化钠与二氧化碳反应2Na O+2CO=2Na CO+O2222326.少量二氧化碳与氢氧化钠溶液反应2NaOH+CO=Na CO+H O22322OH-+CO=CO2-+H O232足量二氧化碳与氢氧化钠溶液反应NaOH+CO=NaHCO2OH-+CO=HCO-2337.碳酸钠与少量盐酸反应Na CO+HCl=NaCl+NaHCO233CO2-+H+=HCO-33碳酸钠与足量盐酸反应Na CO+2HCl=2NaCl+CO↑+H O2322CO2-+2H+=CO↑+H O322碳酸钠溶液中逐滴滴入稀盐酸先无气体生成,有气体生成;稀盐酸中滴加碳酸钠溶液立即有气体生成;两试剂滴加顺序不同,现象不同8.碳酸氢钠与盐酸反应 NaHCO +HCl = NaCl + CO + H O322HCO - + H + = CO ↑+ H O322碳酸钠与碳酸氢钠分别与同浓度的盐酸反应,碳酸氢钠与盐酸反应产生气体的速度快些9.碳酸氢钠与氢氧化钠溶液反应NaHCO + NaOH = Na CO + H O3232HCO - + OH -= CO 2-+ H O33 210.碳酸钠溶液中通入二氧化碳 Na CO + CO + H O = 2NaHCO 23223CO 2-+ CO + H O =2HCO -3223饱和碳酸钠溶液中通入足量的二氧化碳有晶体( N aHCO )析出311.加热碳酸氢钠固体2NaHCO二、镁铝及其化合物(一)记忆口诀3 Na CO + CO ↑+ H O (提纯、差量法计算)2 3 2 2二氧化碳镁条燃,铝热反应很耀眼。
铁及其化合物的化学方程式

铁及其化合物的化学方程式一、铁的化学方程式1. 铁的氧化反应:2Fe(s) + O2(g) → 2FeO(s)2. 铁的还原反应:FeO(s) + CO(g) → Fe(s) + CO2(g)3. 铁的酸性氧化反应:Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)4. 铁的碱性氧化反应:Fe(s) + 2NaOH(aq) + H2O(l) → Na2FeO2(aq) + 2H2(g) 5. 铁的硫化反应:Fe(s) + S(s) → FeS(s)6. 铁的卤素化合物反应:Fe(s) + 2Br2(l) → FeBr4(s)二、铁的化合物化学方程式1. 氢化亚铁反应:FeCl2 + 2NaBH4 → FeB2H6 + 2NaCl + 2H22. 氢氧化铁反应:FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl3. 氢氧化铁沉淀反应:Fe2+ + 2OH- → Fe(OH)2Fe3+ + 3OH- → Fe(OH)34. 亚硫酸铁反应:FeSO4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O5. 碘化铁反应:FeSO4 + 2KI → FeI2 + K2SO46. 硫酸铁反应:FeS + H2SO4 → FeSO4 + H2S7. 硫酸铁氧化反应:4FeSO4 + O2 + 2H2SO4 → 2Fe2(SO4)3 + 2H2O8. 偏铁酸钾反应:2KFeO4 + H2SO4 → K2SO4 + Fe2O3 + H2O + O29. 铁氰化钾反应:FeCl2 + 2K4[Fe(CN)6] → Fe[Fe(CN)6] + 4KCl三、铁的物理性质铁的原子结构:铁元素的原子序数为26,电子布局为[Ar]3d6 4s2。
铁的晶体结构:铁的晶体结构属于针铁矿结构,每个铁原子周围都有六个氧原子形成八面体。
铁的颜色:铁的颜色为灰白色。
铁的密度:铁的密度为7.87g/cm³。
金属及其化合物化学方程式

★☆钠及其重要化合物☆★一、金属钠1.钠与氧气反应常温:4Na + O2 = 2Na2O (白色)点燃:2Na + O2Na2O2(淡黄色)或:2Na + O2Na2O2 (淡黄色) 2.钠与氯气反应2Na + Cl22NaCl(剧烈燃烧,大量白烟)3.钠与硫的反应2Na + S = Na2S (直接化合,甚至爆炸)4.钠与熔融盐(如TiCl4)的反应:4Na + TiCl44NaCl + Ti5.钠与水的反应2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++2OH- + H2↑6.钠与盐酸的反应2Na + 2HCl = 2NaCl + H2↑2Na + 2H+ = 2Na+ + H2↑7.钠与硫酸铜等盐溶液的反应2Na +2H2O = 2NaOH + H2↑2NaOH+CuSO4 = Cu(OH)2↓+ Na2SO4总反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑二、氧化钠—碱性氧化物:能与酸反应生成盐和水的氧化物1.碱性氧化物+水→碱(碱可溶才易反应)Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH-2.碱性氧化物+酸性氧化物→盐Na2O + CO2 = Na2CO33.碱性氧化物+酸→盐+水Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O三、过氧化钠—不是碱性氧化物1.过氧化钠与水反应2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++4OH- + O2↑2.过氧化钠与二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O23.过氧化钠与酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、苏打)1.碳酸钠与酸的反应⑴碳酸钠溶液分别与少量盐酸、足量盐酸反应Na 2CO 3 + HCl = Na HCO 3 + NaClCO 32- + H + = HCO 3-Na 2CO 3 + 2HCl = 2NaCl +CO 2↑+ H 2OCO 32- + 2H + = CO 2↑+ H 2O⑵碳酸钠溶液与足量醋酸反应Na 2CO 3+2CH 3COOH=2CH 3COONa+CO 2↑+H 2OCO 32-+2CH 3COOH=2CH 3COO -+CO 2↑+H 2O ⑶碳酸钠溶液中通入二氧化碳气体Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3CO 32- + H 2O + CO 2 = 2HCO 3-过量..CO 2通入饱和..Na 2CO 3溶液:析出NaHCO 3晶体.. *Na 2CO 3 + H 2O + CO 2 = 2NaHCO 3↓2Na ++CO 32- + H 2O + CO 2 = 2NaHCO 3↓ ⑷***碳酸钠溶液中通入二氧化碳气体*Na 2CO 3 + SO 2 = Na 2SO 3 + CO 2↑*Na 2CO 3 + H 2O + 2SO 2 = 2NaHSO 3 + CO 2↑2.碳酸钠与某些盐(CaCl 2、BaCl 2、AgNO 3、NaHSO 4)的反应Na 2CO 3+ CaCl 2=CaCO 3↓+2NaClCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ 2AgNO 3=Ag 2CO 3↓+2NaNO 3CO 32-+ 2Ag +=Ag 2CO 3↓*Na 2CO 3+ 2NaHSO 4=2Na 2SO 4+CO 2↑+H 2O CO 32-+ 2H +=CO 2↑+H 2O3.碳酸钠溶液与某些碱[Ca(OH)2、Ba(OH)2]溶液的反应Na 2CO 3+ Ca(OH)2=CaCO 3↓+2NaOHCO 32-+ Ca 2+=CaCO 3↓Na 2CO 3+ Ba(OH)2=BaCO 3↓+2NaOHCO 32-+ Ba 2+=BaCO 3↓五、碳酸氢钠(小苏打)1.碳酸氢钠受热分解2NaHCO 3Na 2CO 3+H 2O+CO 2↑2.碳酸氢钠分别与盐酸、醋酸的反应NaHCO 3 + HCl = NaCl+CO 2↑+ H 2OHCO 3-+H+ =CO 2↑+H 2ONaHCO 3+CH 3COOH=CH 3COONa+CO 2↑+H 2O HCO 3-+CH 3COOH=CH 3COO -+CO 2↑+H 2O3.用饱和..NaHCO 3溶液除去CO 2中混有的SO 2气体:*2NaHCO 3 + SO 2 = Na 2SO 3 + 2CO 2↑+H 2O4.碳酸氢钠溶液与某些碱的反应NaHCO 3 + NaOH = Na 2CO 3 + H 2OHCO 3-+OH-=CO 32-+H 2O*** NaHCO3溶液与Ca(OH)2溶液的反应:*a.足量NaHCO3溶液与少量澄清石灰水时:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O *b.少量NaHCO3溶液与足量澄清石灰水时:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+2H2O5.碳酸氢钠与某些盐的反应NaHCO3 + NaHSO4 = Na2SO4 + CO2↑+H2OHCO3-+H+=CO2↑+H2O六、氢氧化钠(烧碱、火碱、苛性钠)1.氢氧化钠与酸性氧化物(CO2、SO2)的反应2NaOH + CO2 = Na2CO3 + H2O2OH- + CO2 = CO32- + H2ONa2CO3 + H2O + CO2 = 2NaHCO3CO32-+ H2O + CO2 = 2HCO3-总反应:NaOH + CO2 = NaHCO3OH- + CO2 = HCO3-2.氢氧化钠分别与盐酸、醋酸的反应NaOH +HCl =NaCl+ H2OOH-+H+=H2ONaOH + CH3COOH = CH3COONa+H2OOH- + CH3COOH = CH3COO-+H2O3.氢氧化钠与某些盐的反应2NaOH+CuSO4=Na2SO4+ Cu(OH)2↓2OH-+Cu2+=Cu(OH)2↓*** NaOH溶液与Ca(HCO3)2溶液的反应:*a.少量NaOH溶液与足量Ca(HCO3)2溶液时:Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-=CaCO3↓+H2O*b.足量NaOH溶液与少量Ca(HCO3)2溶液时:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O七、氯化钠1.氯化钠与某些盐的反应NaCl+AgNO3=AgCl↓+ NaNO3Cl-+Ag+=AgCl↓2.氯化钠固体与浓硫酸反应NaCl + H2SO4(浓)NaHSO4+HCl↑2NaCl + H2SO4(浓)Na2SO4+2HCl↑3.电解熔融的氯化钠2NaCl(熔融)2Na+Cl2↑1.镁与氧气反应2Mg + O22MgO(耀眼白光、大量白烟)2.镁与氯气反应Mg + Cl2MgCl23.镁与氮气反应3Mg + N2Mg3N24.镁与CO2反应2Mg + CO22MgO +C5.镁与H2O反应(与冷水很缓慢、与沸水较迅速反应)Mg + 2H2O = Mg(OH)2 +H2↑6.镁与盐酸反应Mg + 2HCl =MgCl2 +H2↑Mg + 2H+=Mg2+ +H2↑7.镁与某些盐的反应Mg + CuCl2 = MgCl2 + CuMg + Cu2+ = Mg2+ + Cu8.氧化镁与酸反应MgO + 2HCl =MgCl2 + H2OMgO + 2H+=Mg2+ + H2O9.氢氧化镁与酸反应Mg(OH)2 + 2HCl =MgCl2 + 2H2OMg(OH)2 + 2H+=Mg2+ + 2H2O10.氢氧化镁受热分解Mg(OH)2MgO + H2O11.氯化镁与碱反应⑴氯化镁溶液与氢氧化钠溶液反应MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaClMg2+ + 2OH- = Mg(OH)2↓⑵氯化镁溶液与氨水反应MgCl2 + 2NH3·H2O = Mg(OH)2↓+ 2NH4Cl Mg2+ + 2NH3·H2O = Mg(OH)2↓+ 2NH4+ 12.氯化镁与某些盐(Na2CO3)的反应MgCl2 + Na2CO3 = MgCO3↓+ 2NaClMg2+ + CO32- = MgCO3↓13.电解熔融的氯化镁MgCl2(熔融)Mg+Cl2↑一、金属铝1.铝与氧气反应4Al + 3O22Al2O32.铝与氯气反应2Al + 3Cl22AlCl33.铝与硫的反应2Al + 3S Al2S34.铝热反应2Al+Fe2O3Al2O3+2Fe(剧烈反应,火星四射,有红热的熔融物生成)5.铝与强酸的反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+ = 2Al3+ + 3H2↑6.铝与强碱的反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑或:2Al+2NaOH+6H2O = 2Na[Al(OH)4] + 3H2↑2Al+2OH-+6H2O = 2[Al(OH)4]- + 3H2↑四羟基合铝酸钠7.铝与某些盐的反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu2Al + 3Cu2+ = 2Al3+ + 3Cu二、氧化铝1.与强酸反应:Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2O2.与强碱反应:Al2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O三、氢氧化铝1.Al(OH)3的两性:①与强酸反应:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②与强碱反应:Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O2.Al(OH)3的不稳定性: 受热易分解2Al(OH)3Al2O3+3H2O四、氯化铝1.氯化铝溶液与氢氧化钠溶液反应氢氧化钠不足时:AlCl3+3NaOH = Al(OH)3↓+3NaClAl3++3OH- = Al(OH)3↓氢氧化钠过量后:Al(OH)3+NaOH = NaAlO2+2H2OAl(OH)3+OH- = AlO2-+2H2O☆总反应:AlCl3+4NaOH = NaAlO2+3NaCl +2H2OAl3++4OH- = AlO2-+2H2O2.氯化铝溶液与氨水反应AlCl3+3NH3·H2O=Al(OH)3↓+ 3NH4ClAl3++3NH3·H2O=Al(OH)3↓+ 3NH4+3.氯化铝溶液与偏铝酸钠溶液反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓五、偏铝酸钠1.偏铝酸钠溶液与盐酸的反应盐酸不足时:NaAlO2+HCl+H2O=Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓盐酸过量后:Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O☆总反应:NaAlO2+4HCl=AlCl3+NaCl +2H2OAlO2-+4H+=Al3++2H2O2.偏铝酸钠溶液与CO2的反应NaAlO2溶液中通入少量CO2气体:2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-NaAlO2溶液中通入过量CO2气体:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-3.偏铝酸钠溶液与氯化铝溶液的反应3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl3AlO2-+Al3++6H2O=4Al(OH)3↓六、硫酸铝钾—KAl(SO4)2——复盐明矾:KAl(SO4)2·12H2O(十二水合硫酸铝钾)明矾净水:溶于水时产生Al(OH)3胶体,能吸附水中悬浮的杂质而沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
必修一金属及其化合物化学方程式一、金属钠及其化合物1、钠在空气中(1)钠块在空气中变暗:2Na + O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体)现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体(3)2Na2O+O2=2Na2O22、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2NaOH + H2↑2Na + 2H2O = 2Na++ 2OH-+ H2↑3、钠与盐溶液反应(先水后盐)(1)与氯化钠溶液:本质上就是与水反应(2)与硫酸铜溶液:2Na + 2H2O = 2NaOH + H2↑2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4总:2Na + 2H2O + CuSO4= Cu(OH)2↓+ Na2SO4+ H2↑2Na + 2H2O+ Cu2+ = Cu(OH)2↓+H2↑+ 2Na+(3)与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)2Na2O2+ 2H2O = 4NaOH + O2 ↑2Na2O2+ 2H2O = 4Na++4OH -+O2↑现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O + H2O = 2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2+ 2CO2= 2Na2CO3+ O2碱性氧化物Na2O与二氧化碳的反应 Na2O+CO2===Na2CO36、过氧化钠与盐酸的反应2Na2O2+ 4HCl = 4NaCl + 2H2O+O2 ↑ 2Na2O2+ 4H+= 4Na++2H2O+O2↑碱性氧化物Na2O与盐酸的反应Na2O + 2HCl = 2NaCl + H2O Na2O + 2H+= 2Na++H2O7、氢氧化钠(1)与酸性氧化物反应a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2OOH -+ CO2 (少量)= CO32-+H2Ob 继续向该溶液中通入 CO2: Na2CO3+ H2O +CO2=2NaHCO3CO32-+H2O +CO2=2HCO3-c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3 a+bOH -+ CO2 (过量)= HCO3-d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2OCa2++ 2OH -+ CO2 (少量)= CaCO3↓+H2Oe继续向该溶液中通入 CO2:CaCO3+H2O +CO2=Ca(HCO3)2CaCO3+H2O +CO2=Ca2++ 2HCO3-f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+eOH -+ CO2 (过量)= HCO3-CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠)①向盐酸中滴加纯碱溶液 Na2CO3+ 2HCl = 2NaCl + H2O+CO2↑CO32-+ 2H+= H2O + CO2↑△△现象:立即有气泡产生②纯碱溶液中滴加盐酸,至过量Na2CO3+ HCl =NaHCO3+ NaCl CO32-+ H+ = HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑现象:先无明显现象,然后有气泡产生9、碳酸氢钠和盐酸反应(无论是向碳酸氢钠中滴加稀盐酸还是向盐酸中滴加碳酸氢钠,现象均为:立即有气泡产生)NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑10、碳酸钠与Ca(OH)2反应:Na2CO3+Ca(OH)2= 2NaOH+CaCO3↓CO32-+ Ca2+ = CaCO3↓11、碳酸氢钠与碱反应(1)与NaOH反应:NaHCO3 + NaOH== Na2CO3 + H2OHCO3-+OH -= H2O +CO32-(2)与Ca(OH)2反应Ca(OH)2 + NaHCO3(少)==CaCO3↓+ H2O+ NaOHCa2+ +OH -+ HCO3-(少)==CaCO3↓+ H2OCa(OH)2 + 2NaHCO3(多)== CaCO3↓ + 2H2O+Na2CO3Ca2+ +2OH -+2HCO3-(多)== CaCO3↓ + 2H2O+CO32-12、碳酸钠与某些盐反应Na2CO3+CaCl 2== CaCO3↓+2NaCl CO32-+ Ca2+ = CaCO3↓NaHCO3+CaCl 2== 不反应(可用于鉴别碳酸钠和碳酸氢钠)13、小苏打受热分解 2NaHCO3=Na2CO3+ H2O +CO2↑14、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+ NaOH=Na2CO3+ H2OHCO3-+ OH -= H2O + CO32-(若是溶液中反应有离子方程式)二、铝及其化合物1、与非金属 4Al + 3O2= 2Al2O32Al+3Cl2== 2AlCl32Al + 3S == Al2S32、铝片与稀盐酸反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+= 2Al3++3H2↑3 、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O = 2NaAlO2+3H2↑2Al + 2OH-+2H2O = 2AlO2-+ 3H2↑4、与盐溶液反应:置换出较不活泼的金属单质2Al+ 3CuSO4 ==Al2(SO4 )3+3Cu 2Al+ 3Cu2+ = 2Al3++3Cu5、与水不反应:6、Al2O3(两性氧化物)(1)与强酸反应Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+ = 2Al3++3H2O(2)与强碱反应 Al2O3+ 2NaOH = 2NaAlO2+H2O Al2O3+ 2OH-= 2AlO2-+ H2O7. Al(OH)3(两性氢氧化物)(1)Al(OH)3的制备:可溶性铝盐和氨水Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4 Al3++ 3 NH3·H2O = Al(OH)3↓+ 3NH4+(2)与强酸反应 Al(OH)3+ 3HCl = AlCl3+ 3H2O Al(OH)3+ 3H+= Al3++ 3H2O (3)与强碱反应 Al(OH)3+ NaOH = NaAlO2+2 H2O Al(OH)3+ OH-= AlO2-+2 H2O (4)加热分解2Al(OH)3△Al2O3+ 3H2O8、Al3+(1)少量强碱:AlCl3+3NaOH===Al(OH)3↓+3N aCl Al3++3OH-=Al(OH)3↓(2)过量强碱:AlCl3+4NaOH===NaAlO2 +3NaCl+2 H2OAl3++4OH-=AlO2-+2 H2O9、AlO2-(1)少量HCl:NaAlO2 +HCl+H2O=NaCl+Al(OH)3↓AlO2-+H++H2O=Al(OH)3↓△点燃△(2)继续向该溶液中加入盐酸: Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O (3)过量HCl:NaAlO2+4HCl=NaCl+AlCl3+2H2O AlO2-+4H+=Al3++2 H2O(4)通入少量CO2CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(5)通入过量CO2CO2+NaAlO2+2H2O=Al(OH)3↓+Na HCO3 (工业制取氢氧化铝)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-10、KA1(SO4)2 (净水剂)(1)使硫酸根恰好沉淀完全: KA1(SO4)2+2Ba(OH)2==2BaSO4↓+KAlO2Al3++4OH-+2Ba2++2SO42-==2BaSO4↓+AlO2-(2)使铝离子恰好沉淀完全: 2KA1(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO42Al3++ 3 SO42- + 6OH—+ 3Ba2+==3Ba SO4↓+ 2Al(OH)3↓(3)净水原理:Al3++3H2O=== Al(OH)3(胶体)+3 H+11、相互滴加顺序不同而现象不同的几组反应:(可用于鉴别)①:AlCl3+ NaOH ②: NaAlO2 + HCl ③: Na2CO3+ HCl (NaHSO4)三、铁及铁的化合物1、铁的冶炼: 3CO+ Fe2O3== 2Fe+ 3CO22、与非金属:(1)2Fe + 3Cl2 === 2FeCl3(2) 3 Fe + 2O2=== Fe3O4(3)Fe + S === FeS3、与水蒸气:3 Fe + 4 H2O(g) ====Fe3O4+ 4 H24、与非氧化性酸: Fe + 2 HCl === FeCl2+ H2↑ Fe + 2 H+ == Fe2++ H2↑5、与盐: Fe + CuSO4 == FeSO4+Cu Fe + Cu2+===Fe2+ + Cu6、与碱不反应:7、铁的氧化物FeO(黑色)、Fe2O3(红棕色,俗名铁红)、Fe3O4(磁性氧化铁,黑色晶体)(1) FeO + 2 HCl === FeCl2 + H2O(非氧化性酸,不变价;遇HNO3变价,下同)FeO + 2 H+ == Fe2+ + H2O(2) Fe2O3 + 6HCl ===2 FeCl3 + 3 H2OFe2O3 + 6 H+ ===2 Fe3+ + 3 H2O(3) Fe3O4+ 8 HCl ===2 FeCl3 + FeCl2 + 4 H2OFe3O4+ 8 H+ === 2 Fe3+ +Fe2+ + 4 H2O用途:作油漆的颜料,炼铁的原料8、铁的氢氧化物(Fe(OH)2,Fe(OH)3)(1)制备:A: FeSO4 + 2 NaOH = Fe(OH)2↓+ Na 2SO4Fe2+ + 2 OH—= Fe(OH)2↓B: 3NH3 .H2O + FeCl3 ==== Fe(OH)3↓+ 3 NH4CIFe3+ + 3NH3 .H2O =Fe(OH)3↓+ 3 NH4+(2)氢氧化亚铁不稳定性:4 Fe(OH)2 + O2 + 2 H2O= 4 Fe(OH)3(3)氢氧化铁不稳定性:2Fe(OH)3 ==== Fe2O3 + 3H2O(4)与酸: Fe(OH)3+ 3HCl ====FeCl3+ 3 H2O Fe(OH)3+ 3 H+ === Fe3+ + 3 H2O Fe(OH)2+ 2 HCl ==== FeCI2+ 2 H2O(非氧化性酸,不变价;遇HNO3变价) Fe(OH)2 + 2 H+ == Fe2+ + 2H2O9、Fe2+盐(还原性离子,易被氧化,保存需加少量Fe粉及相应酸)(1)与氯气: 2FeCl2 + Cl2 = 2 FeCl3 2Fe2+ + Cl2 === 2Fe3+ + 2 CI—(2)FeSO4溶液和H2O2:2Fe2+ + H2O2 + 2H+== 2Fe3+ + 2H2O(3)FeSO4溶液和酸性KMnO4溶液:5 Fe2+ + MnO4—+8 H+=== Mn 2++ 4H2O+ 5Fe3+(4)FeSO4溶液在空气中变质: 4Fe2+ + O2 + 4 H+=== 4Fe3+ + 2H2O10、Fe3+盐(氧化性离子,易被还原. 易水解,保存需加少量相应酸抑制水解.)(1) 2 FeCl3 + Fe =3 FeCl22Fe3+ + Fe === 3 Fe2+(2) 2 FeCl3+ Cu === 2FeCl2+ CuCl22Fe3+ + Cu ==2Fe2++ Cu2+(3)Fe3+的检验:FeCl3 + 3 KSCN == 3 KCI+ Fe(SCN)3高温点燃点燃△高温△Fe3+ + 3SCN— === Fe(SCN)3(4)用途:净水剂 Fe3+ +3 H2O=== Fe(OH)3(胶体)+ 3 H+。
