硅和二氧化硅的反应方式
二氧化硅和硅

二氧化硅和硅主备:王胜菊学习目标:了解二氧化硅和硅的主要性质认识二氧化硅在生产、信息技术、材料科学等领域的应用1.二氧化硅的性质(1)物理性质:(2)化学性质:①具有弱氧化性:②具有酸性氧化物的通性:SiO2是一种,是H2SiO3的酸酐。
CaO+SiO2CaSiO3(炼铁中除炉渣)SiO2+2NaOH Na2SiO3+H2O(盛放碱性溶液的试剂瓶不能用玻璃塞,常用橡皮塞)③与某些盐的反应:Na2CO3+SiO2CaCO3+SiO2④特性:SiO2+4HF SiF4↑+2H2O(腐蚀玻璃)。
(3)SiO2和CO2的性质比较(4)二氧化硅的用途①SiO2是制造光导纤维的主要原料。
②石英制作石英玻璃、石英电子表、石英钟等。
③水晶常用来制造电子工业的重要部件、光学仪器、工艺品等。
④石英砂常用作制玻璃和建筑材料。
4、硅的工业制法及性质(1)工业制法:工业上用炭自在高温下还原二氧化硅的方法,制得含有少量杂质的粗硅。
将粗硅在高温下跟氯气气反应生成四氯化硅,四氯化硅经提纯后,再用氢气还原,就可以得到高纯度的硅。
操作流程:二氧化硅→粗硅→四氯化硅→精硅(2)物理性质:(3)化学性质:很稳定①常温下不与等反应。
②加热或高温时有强还原性:③常温下能与氟气(F2)、氢氟酸(HF)反应:。
达标检测:一.选择题(每小题有一个正确答案)1.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有()A.①②⑥B.全部C.①③④⑤D.②③⑥2.能贮存在具有玻璃塞的磨口试剂瓶里的试剂是()A.HF溶液B.KOH溶液C.盐酸D.水玻璃3.熔化烧碱应选用的坩埚是()A.铁坩埚B.玻璃坩埚C.石英坩埚D.陶瓷坩埚4.下列物质属于纯净物的是()A. 玻璃B.水玻璃C. 二氧化硅D. 大理石。
二氧化硅制硅酸

二氧化硅制硅酸以《二氧化硅制硅酸》为标题,写一篇3000字的中文文章硅酸是一种重要的化学强酸,主要由水解法和氧化法制备,常由二氧化硅和硝酸以及一定的辅助物料合成。
目前,水解法制备硅酸的技术已发展较为成熟,而氧化法制备硅酸的技术仍在不断的发展之中。
本文将重点阐述使用二氧化硅制备硅酸的相关技术,帮助读者更好的理解制备硅酸的原理和核心技术思路。
首先,二氧化硅通过氧化法制备硅酸需要采用反应式SiO2+HNO3→SiO3H+NO,即将二氧化硅与硝酸反应,反应发生在室温下,反应进行的时候有大量的氮氧化物排放。
需要注意的是,在反应进行的时候要控制硝酸的浓度,以免使得反应产物太多,同时也要保证反应的速率,当二氧化硅的质量达到一定程度的时候,可以适当增加硝酸的浓度来保证反应的速率。
其次,当硅酸的溶解度达到一定程度之后,就可以开始矿物加成操作了。
一般情况下,矿物加成可以采用三种不同的辅助物料,包括氯化钙、氯化钠以及磷酸钙等,它们的主要作用是影响硅酸的析出,并且有利于促使酸中的硅离子析出,从而实现硅酸的浓缩和回收。
同时,经过上述操作之后,硅酸的结晶要经过一定的热处理过程,以达到全部结晶的效果,其中合理的热处理参数也会对结晶效果产生重要影响,热处理温度通常在150-160摄氏度之间,处理时间通常在4-6小时之间,时间和温度的变化会影响结晶的几率和细度。
最后,硅酸的结晶之后,需要放置一段时间才能完全结晶,而之后的硅酸就可以供应市场使用了,无论是用于水处理还是用于工业硅酸浴都可以使用。
总之,使用二氧化硅制备硅酸技术步骤要求严格,因此,在实际操作之前要对技术要求和流程充分了解,确保制备硅酸的质量和效率。
本文中所提到的二氧化硅制备硅酸的技术,只是其中的一小部分,也只是做出具体技术要求的一个大致过程,并不是所有的技术流程,因此,大家在实际操作的时候,要多加注意,以免发生安全事故。
高中化学-硅及二氧化硅
实验室有六种试剂,根据 它们各自的性质,必须选择适 当的试剂瓶盛放,请在对应的 各种试剂瓶和所装试剂之间进 行连线。
试剂 二氧化硅 氢氧化钠溶液 硝酸银晶体 氢氟酸 浓硫酸 氯水
试剂瓶 细口磨口塞 广口瓶 棕色细口磨口塞 细口橡皮塞 棕色广口瓶 细口塑料瓶
3、二氧化硅的用途
制光导纤维
石英制品
硅酸及硅酸盐
(1)硅酸:硅酸、原硅酸都不溶于水,属 于弱酸,其酸性比碳酸弱:
Na2SiO3+2HCl+H2O=2NaCl+H4SiO4↓
H4SiO4===H2SiO3+H2O(易) Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓
(2)硅酸盐
结构复杂 种类繁多 用二氧化硅和金属氧化
物的形式表示其组成
5、工业制粗硅:
高温
SiO2+2C===Si+2CO
粗硅提纯 Si+2Cl2===SiCl4
*
SiCl4+2H2===Si+4HCl
能溶解硅且能放出氢气的是
( C、D )
A、浓盐酸
B、稀硫酸
C、氢氟酸
D、浓烧碱
6、用途:
高纯硅:半导体材料。 变压器铁芯
合金 (含硅4%的钢有导磁性) 耐酸设备
(含硅15%左右的钢有耐 酸性)
有三种元素X、Y、Z。X和Y位于周期表的同 一周期,可形成共价化合物XY2,此化合物在常 温下为气态。 Z和 X为同族元素,Z和 Y可形成 共价化合物 ZY2,此化合物在常温下为固态。 X 的单质跟 ZY2反应可生成Z的单质。Z的一种晶体 是很好的半导体材料。根据以上事实判断X、Y、 Z各为什么元素,写出上述有关反应的化学方程 式。
硅和二氧化硅的反应方式

硅和二氧化硅的反应方式硅和二氧化硅的反应方式1. 引言硅(Si)和二氧化硅(SiO2)是常见的化学元素和化合物,它们在日常生活和工业生产中起着重要的作用。
了解硅和二氧化硅的反应方式,能够帮助我们更好地理解它们的性质和应用。
本文将从深度和广度两个方面介绍硅和二氧化硅的反应方式,包括其与氧气、水、酸、碱等物质的相互作用。
2. 硅与氧气的反应硅与氧气的反应是指硅与氧气在高温下(约为1360℃)形成二氧化硅的过程,这个过程被称为燃烧或熔融。
硅燃烧的化学方程式如下:Si + O2 -> SiO2在这个反应中,硅原子(Si)和氧气分子(O2)发生化学反应,生成硅和氧的化合物——二氧化硅(SiO2)。
二氧化硅是一种广泛应用于玻璃制造、电子器件制造和建筑材料等领域的重要材料。
3. 二氧化硅的反应3.1 二氧化硅与水的反应二氧化硅与水反应是指二氧化硅与水分子发生化学反应形成硅酸的过程。
硅酸是一种弱酸,其化学方程式如下:SiO2 + 2H2O -> H4SiO4在这个反应中,二氧化硅与水反应生成硅酸(H4SiO4)。
硅酸是一种具有重要应用价值的物质,常用于水泥制造、陶瓷工艺和水处理等方面。
3.2 二氧化硅与酸的反应二氧化硅与酸反应是指二氧化硅与酸溶液接触时发生的化学反应。
这种反应过程产生硅酸盐和水等产物。
硅酸盐是一类化合物,这些化合物的结构中包含硅离子(Si4+)。
二氧化硅与酸反应的化学方程式如下:SiO2 + 2H+ -> H2SiO3在这个反应中,二氧化硅与酸反应生成硅酸(H2SiO3)。
硅酸盐的形成与有机化合物合成中的硅酮化反应密切相关,具有重要的应用价值。
3.3 二氧化硅与碱的反应二氧化硅与碱反应是指二氧化硅与碱溶液发生的化学反应,生成硅酸盐和水等产物。
这个反应过程与水玻璃的制备密切相关,是一种重要的工业应用。
二氧化硅与碱反应的化学方程式如下:SiO2 + 2NaOH -> Na2SiO3 + H2O在这个反应中,二氧化硅与碱反应生成硅酸钠(Na2SiO3)和水。
硅和二氧化硅的反应方式

硅和二氧化硅的反应方式概述硅是一种常见的非金属元素,其与氧化态最常见的化合物是二氧化硅。
二氧化硅在自然界中广泛存在,例如石英和硅灰石等矿物中。
硅和二氧化硅之间的反应方式在材料科学和化学领域具有重要的意义。
本文将介绍硅和二氧化硅的主要反应方式以及反应的应用。
1.硅的氧化反应硅在高温下与氧气发生氧化反应,生成二氧化硅。
这个过程称为硅的燃烧反应。
其化学方程式如下:硅+氧气⟶二氧化硅硅的氧化反应可以通过各种实验方法进行研究。
例如,可以通过加热硅样品并通入氧气,观察其燃烧现象,同时测量生成的二氧化硅的质量和体积等参数。
进一步的分析可以通过化学分析方法,如质谱分析和红外光谱分析等,来确定反应的产物和反应机理。
2.二氧化硅的还原反应二氧化硅可以通过还原反应转化为硅。
这种反应在材料制备和半导体工业中具有重要应用。
常用的还原剂包括碳、氢气和金属等。
以碳为还原剂的反应方程式如下:二氧化硅+碳⟶硅+一氧化碳通过改变还原剂的种类和反应条件,可以控制反应得到的硅的结构和形貌。
例如,可通过控制反应温度和反应时间等参数,制备出纳米级别的硅材料,其应用包括纳米电子器件和可见光下的光催化剂等领域。
3.硅和二氧化硅的酸碱性反应硅和二氧化硅都属于氧化物,可以与酸和碱反应生成相应的盐和水。
这种反应在化学分析和材料工程中有广泛应用。
硅和酸反应的化学方程式如下:硅+酸⟶相应的盐+水此外,硅和碱反应的化学方程式如下:硅+碱⟶相应的盐+水这些反应在化学实验室和工业生产中用于盐的合成、酸碱指示剂的制备以及清洗材料的生产等。
结论硅和二氧化硅的反应方式包括硅的氧化反应、二氧化硅的还原反应以及硅和二氧化硅的酸碱性反应。
这些反应在科学研究、材料制备和工业生产中具有重要的意义。
通过理解和掌握这些反应的机理和条件,可以为新材料的设计和制备提供有力的理论支持。
进一步的研究和应用将推动科学技术的发展和创新。
以上为硅和二氧化硅的反应方式的简要介绍,希望对您有帮助。
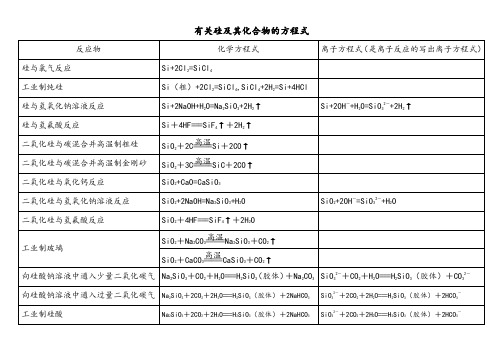
有关硅及其化合物的方程式
Na2SiO3+2CO2+2H2O===H2SiO3(胶体)+2NaHCO3
SiO32-+2CO2+2H2O===H2SiO3(胶体)+2HCO3-
工业制硅酸
Na2SiO3+2CO2+2H2O===H2SiO3(胶体)+2NaHCO3
SiO32-+2CO2+2H2O===H2SiO3(胶体)+2HCO3-
二氧化硅与氢氟酸反应
SiO2+4HF===SiF4↑+2H2O
工业制玻璃
SiO2+Na2CO3 Na2SiO3+CO2↑
SiO2+CaCO3 CaSiO3+CO2↑
向硅酸钠溶液中通入少量二氧化碳气
Na2SiO3+CO2+H2O===H2SiO3(胶体)+Na2CO3
SiO32-+CO2+H2O===H2SiO3(胶体)+CO32-
硅与氢氟二氧化硅与碳混合并高温制粗硅
SiO2+2C Si+2CO↑
二氧化硅与碳混合并高温制金刚砂
SiO2+3C SiC+2CO↑
二氧化硅与氧化钙反应
SiO2+CaO=CaSiO3
二氧化硅与氢氧化钠溶液反应
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2OH-=SiO32-+H2O
有关硅及其化合物的方程式
反应物
化学方程式
离子方程式(是离子反应的写出离子方程式)
硅与氯气反应
Si+2Cl2=SiCl4
工业制纯硅
Si(粗)+2Cl2=SiCl4,SiCl4+2H2=Si+4HCl
硅与氢氧化钠溶液反应
Si+2NaOH+H2O=Na2SiO3+2H2↑
硅粉和水反应原理

硅粉和水反应原理
硅粉是一种含有丰富的硅元素的粉末,它可以和水反应产生一些有趣的化学变化。
硅粉和水反应的原理是硅粉中的硅原子与水中的氧原子结合,形成二氧化硅(SiO2)。
这个过程也可以用化学方程式表示为:
Si + 2H2O → SiO2 + 2H2
在这个方程式中,硅粉和水反应生成了二氧化硅和氢气。
这个反应需要足够的能量来进行,因此通常需要加热硅粉和水的混合物,或者用强氧化剂促进反应。
硅粉和水反应的结果可以用于制备一些有用的物质。
例如,硅粉和水反应生成的二氧化硅可以用于制备玻璃、陶瓷、水泥等材料。
此外,硅粉和水反应生成的氢气也可以用于制备氢气燃料电池。
总之,硅粉和水反应的原理是硅原子和水中的氧原子结合形成二氧化硅,这个反应需要足够的能量来进行。
这个反应可以用于制备一些有用的物质,例如玻璃、陶瓷、水泥等。
- 1 -。
第二节 硅和二氧化硅

Si
Si O
二氧化硅
180° °
在二氧化硅晶体中, 个氧原子结合, 在二氧化硅晶体中,一个硅原子跟 4 个氧原子结合,同时每个氧原子跟 两个硅原子结合 实际上, 结合。 两个硅原子结合。实际上,二氧化硅晶体是由硅原子和氧原子按 1 :2 的比 例所成的立体网状结构的晶体。它的熔点( 立体网状结构的晶体 例所成的立体网状结构的晶体。它的熔点(1723℃)沸点(2230℃)高,硬 ℃ 沸点( ℃ 度大,不导电,难溶于一些常见的溶剂。 度大,不导电,难溶于一些常见的溶剂。
(2)加热时: (2)加热时:与某些非金属反应 加热时 Si+O2== SiO2
高温
Si+2H2=== SiH4(很难) 很难)
高温
Si+2Cl2=== SiCl4
工业制粗硅: 4、工业制粗硅:
SiO2+2C=== Si + 2CO↑ Si+2Cl2=== SiCl4 粗硅提纯: 粗硅提纯: 高温 SiCl4+2H2=== Si + 4HCl
12 . Na2SiO3+2HCl + H2O = H4SiO4↓+2NaCl
1. Si + O2== SiO2
2. Si + 4HF = SiF4 ↑+ 2H2↑ 高温 3. Si + C === SiC 4 . Si + 2NaOH+ H2O= Na2SiO3+ 2H2↑
5 . SiO2+ 2C === Si + 2CO↑ 6 .SiO2 + 4HF== SiF4↑+ 2H2O
高温 高温
高温
SiO2+ 2C === Si + 2CO↑ 高温 Na + KCl === NaCl + K↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硅和二氧化硅的反应方式
摘要:
I.硅和二氧化硅的性质和用途
- 硅的性质和用途
- 二氧化硅的性质和用途
II.硅和二氧化硅的反应方式
- 硅和氧气反应生成二氧化硅
- 二氧化硅与其他物质的反应
III.硅和二氧化硅在工业中的应用
- 半导体行业中的应用
- 建筑材料中的应用
- 其他行业中的应用
正文:
硅是一种非金属元素,具有半导体性质,是现代电子技术中不可或缺的原材料。
二氧化硅则是硅的一种常见氧化物,具有良好的光学、化学和物理性质,广泛应用于各个领域。
本文将介绍硅和二氧化硅的反应方式及其在工业中的应用。
硅和氧气反应生成二氧化硅。
这一反应在自然界中广泛存在,如硅石与氧气在高温下反应生成二氧化硅。
在工业生产中,这一反应可通过硅的研磨和加热来实现。
二氧化硅在高温下可与碳、氯、氢等元素发生反应,生成相应的化合物,如碳化硅、硅氯化物和硅氢化物。
二氧化硅与其他物质的反应主要表现在以下几个方面:
1.与碱性氧化物反应,如与氢氧化钠反应生成硅酸钠和水;
2.与碱金属反应,如与锂反应生成硅酸锂;
3.与酸反应,如与氢氟酸反应生成四氟化硅和水。
硅和二氧化硅在工业中有着广泛的应用。
在半导体行业中,硅作为半导体材料,被用于制造各种集成电路、晶体管等电子元件。
二氧化硅则被用作光纤预制棒、光纤涂料等光通信领域的材料。
此外,硅和二氧化硅还被广泛应用于建筑材料、玻璃制造、陶瓷制品、涂料等行业。
总之,硅和二氧化硅的反应方式多样,且在工业中具有广泛的应用。
