硅和二氧化硅 ppt课件1
合集下载
二氧化硅 PPT

服务特 权
共享文档下载特权
VIP用户有效期内可使用共享文档下载特权下载任意下载券标价的文档(不含付费文档和VIP专享文档),每下载一篇共享文
档消耗一个共享文档下载特权。
年VIP
月VIP
连续包月VIP
享受100次共享文档下载特权,一次 发放,全年内有效
赠每的送次VI的发P类共放型的享决特文定权档。有下效载期特为权1自个V月IP,生发效放起数每量月由发您放购一买次,赠 V不 我I送 清 的P生每 零 设效月 。 置起1自 随5每动 时次月续 取共发费 消享放, 。文一前档次往下,我载随时随地彰显尊贵身份。
专属客服
VIP专属客服,第一时间解决你的问题。专属客服QQ:800049878
路漫部权益:1.海量精选书免费读2.热门好书抢先看3.独家精品资源4.VIP专属身份标识5.全站去广告6.名
VIP有效期内享有搜索结果页以及文档阅读页免广告特权,清爽阅读没有阻碍。
知识影响格局,格局决定命运! 多端互通
抽奖特权
VIP有效期内可以无限制将选中的文档内容一键发送到手机,轻松实现多端同步。 开通VIP后可以在VIP福利专区不定期抽奖,千万奖池送不停!
福利特权
开通VIP后可在VIP福利专区定期领取多种福利礼券。
服务特 权
共享文档下载特权
VIP用户有效期内可使用共享文档下载特权下载任意下载券标价的文档(不含付费文档和VIP专享文档),每下载一篇共享文
档消耗一个共享文档下载特权。
年VIP
月VIP
连续包月VIP
享受100次共享文档下载特权,一次 发放,全年内有效
赠每的送次VI的发P类共放型的享决特文定权档。有下效载期特为权1自个V月IP,生发效放起数每量月由发您放购一买次,赠 V不 我I送 清 的P生每 零 设效月 。 置起1自 随5每动 时次月共续 取发享费 消放文, 。一档前次下往,载我持特的续权账有,号效-自
硅和二氧化硅

5.硅的用途 硅的用途 1.良好的半导体材料,制造集成电路、晶体管、硅 良好的半导体材料,制造集成电路、晶体管、 良好的半导体材料 整流器等半导体器件。 整流器等半导体器件。 2.制成太阳能电池。 制成太阳能电池。 制成太阳能电池 3.硅合金可制造变压器芯及耐酸设备。 硅合金可制造变压器芯及耐酸设备。 硅合金可制造变压器芯及耐酸设备
四、硅酸盐
Na2SiO3:固体俗称泡花碱,水溶液俗称水玻璃, :固体俗称泡花碱,水溶液俗称水玻璃 固体俗称泡花碱 水玻璃, 是无色粘稠的液体,常作粘合剂、防腐剂、 是无色粘稠的液体,常作粘合剂、防腐剂、耐 火材料。 火材料。 组成表示方法: 组成表示方法:活泼金属氧化物 • 较活泼金属氧 化物 • 二氧化硅 • 水
二、二氧化硅
1.物理性质 物理性质 SiO2是一种坚硬、难熔的固体,不溶于水,天然 是一种坚硬、难熔的固体,不溶于水, SiO2又叫硅石,是构成岩石的成份之一。 又叫硅石,是构成岩石的成份之一。 2.存在形式:石英、水晶、砂子 存在形式:石英、水晶、 存在形式 3.化学性质 3.化学性质 (1)酸性氧化物的性质 ) SiO2是酸性氧化物,是H2SiO3的酸酐,但它不能溶 是酸性氧化物, 的酸酐, 于水得到相应的酸。 于水得到相应的酸。
第二节
硅和二氧化硅
Si SiO2
Байду номын сангаас
第二节 硅和二氧化硅
一、硅
1.硅元素的含量及存在 硅元素的含量及存在 在地壳里,硅的含量在所有元素中居第 2 位 在地壳里,硅的含量在所有元素中居第____位,仅次 于氧,全部以______态存在。 于氧,全部以 化合 态存在。 态存在 2. 硅的同素异形体 硅有_______硅和 无定形 硅两种同素异形体 硅有 晶体 硅和________硅两种同素异形体 。 硅和 3.硅的物理性质 硅的物理性质 晶体硅是灰黑色,有金属光泽, 晶体硅是灰黑色,有金属光泽,硬而脆的 固体,熔沸点高,硬度大, 固体,熔沸点高,硬度大,是良好的半导 体材料。 体材料。
sio2

受水晶的美。
正长石
斜长石
透辉石
高岭石
5、将下列物质的化学式改写成氧化物的形式表示: K2 O · 2 O3 · Al 6SiO2 (1)正长石:KAlSi3O8 ___________________ 3MgO · 4SiO2 · 2O H (2)滑石:Mg3Si4O10(OH)2 __________________ (3)Fe3O4可以写成FeO· 2O3形式,若看成一种盐时,又可 Fe 写成Fe(FeO2)2。根据化合价规律,Pb3O4若用氧化物形式可写成 2PbO · 2 PbO Pb2(PbO4) ___________,若看成一种盐时,其化学式又可写成___________。
高温
△
(三)硅的工业制法
高温下,用碳还原二氧化硅制得粗硅
SiO2 + 2C ==== Si + 2CO↑
了解:粗硅提纯
高温
Si + 2Cl2 == SiCl4 SiCl4 + 2H2 == Si+ 4HCl
思考:1、 C的还原性与Si的还原性谁强? 此反应并不表示C的还原性比Si强,反应能发生是 因为碳的氧化物比SiO2易挥发。 2、由上方程式分析粗硅中可能含有什么杂质? C 过量,还要生成SiC
3、化学性质 硅酸是不溶于水的极弱酸,酸性弱于碳酸,不能使酸碱 指示剂变色。
H2SiO3 + 2NaOH= Na2SiO3 + 2H2O Δ H2SiO3== SiO2 + H2O
(二)硅酸盐 1、存在:地壳岩石的主要成分 2、表示方式:用二氧化硅和金属氧化物的形式来表示 3、大多数硅酸盐都难溶于水,常见易溶于水:硅酸钠。
高温
△
△
高中化学 第1课时 硅 二氧化硅课件 鲁科版必修1

答案 (1)B (2)C (3)A
课时作业
1.下列关于硅的叙述中,错误的是
(C )
①硅广泛存在于自然界中,天然单质硅叫水晶 ②单
质硅的导电性介于导体和绝缘体之间 ③晶体硅具
有金属光泽,故它属于金属材料,能导电 ④含硅的
钢具有良好的导磁性和耐酸性
A.①② B.②③ C.①③ D.②④
解析 硅元素在自然界中含量丰富,但都以化合态存在,
属单质发生反应
解析 常温下,硅的化学性质不活泼,但可与氟气、氢氟
酸、强碱溶液反应:Si+2F2===SiF4,Si+4HF===SiF4↑ +2H2↑,Si+2NaOH+H2O===Na2SiO3+2H2↑。故答案 为 C。
2.下列关于 SiO2 和 Si 的叙述中错误的是
(D )
A.SiO2 是一种酸性氧化物,Si 是一种非金属单质
A.反应中有 12 g C 被还原
B.反应生成了 22.4 L CO(标准状况)
C.反应中有 3.01×1023 个电子发生转移
D.反应中有 0.5 mol SiO2 被氧化
9.硅单质是从它的氧化物中提取出来的,主要的化学反
应如下: SiO2 + 2C=电高==炉温==Si+2CO↑ 石英砂 焦炭 粗硅 Si(粗)+2Cl2=高==温==SiCl4 SiCl4+2H2=高==温==Si(纯)+4HCl 根据以上反应,回答下列问题。
6.制造太阳能电池需要高纯度的硅,工业上制高纯硅常
用以下反应实现: ①Si(s)+3HCl(g)=3=0=0℃==SiHCl3(g)+H2(g)
△H=-381 kJ·mol-1 ②SiHCl3+H21=0=0=0=~==1==1=00=℃= Si+3HCl
对上述两个反应的叙述中,错误的是
课时作业
1.下列关于硅的叙述中,错误的是
(C )
①硅广泛存在于自然界中,天然单质硅叫水晶 ②单
质硅的导电性介于导体和绝缘体之间 ③晶体硅具
有金属光泽,故它属于金属材料,能导电 ④含硅的
钢具有良好的导磁性和耐酸性
A.①② B.②③ C.①③ D.②④
解析 硅元素在自然界中含量丰富,但都以化合态存在,
属单质发生反应
解析 常温下,硅的化学性质不活泼,但可与氟气、氢氟
酸、强碱溶液反应:Si+2F2===SiF4,Si+4HF===SiF4↑ +2H2↑,Si+2NaOH+H2O===Na2SiO3+2H2↑。故答案 为 C。
2.下列关于 SiO2 和 Si 的叙述中错误的是
(D )
A.SiO2 是一种酸性氧化物,Si 是一种非金属单质
A.反应中有 12 g C 被还原
B.反应生成了 22.4 L CO(标准状况)
C.反应中有 3.01×1023 个电子发生转移
D.反应中有 0.5 mol SiO2 被氧化
9.硅单质是从它的氧化物中提取出来的,主要的化学反
应如下: SiO2 + 2C=电高==炉温==Si+2CO↑ 石英砂 焦炭 粗硅 Si(粗)+2Cl2=高==温==SiCl4 SiCl4+2H2=高==温==Si(纯)+4HCl 根据以上反应,回答下列问题。
6.制造太阳能电池需要高纯度的硅,工业上制高纯硅常
用以下反应实现: ①Si(s)+3HCl(g)=3=0=0℃==SiHCl3(g)+H2(g)
△H=-381 kJ·mol-1 ②SiHCl3+H21=0=0=0=~==1==1=00=℃= Si+3HCl
对上述两个反应的叙述中,错误的是
二氧化硅和硅酸课件

二氧化硅和硅酸
光纤
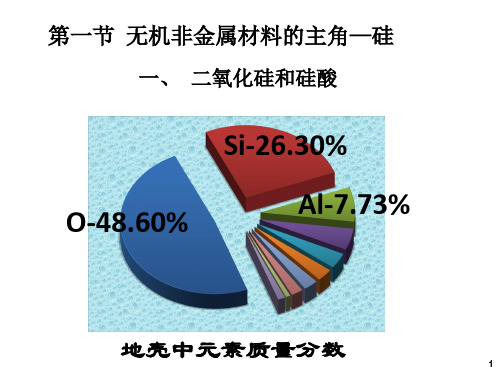
一、 二氧化硅( SiO2 )
水晶
1、存在:
结晶形(石英晶体) 水晶 无色透明 玛瑙 彩色环带或层状
硅石
无定形——硅藻土
玛瑙
SiO2是自然界中沙子、石英的主要成分。结 晶的二氧化硅叫石英;天然二氧化硅叫硅石。
2、结构
立体网状结 构决定了 SiO2具有优 良的物理和 化学性质
➢硅胶的用途:
干燥剂(吸水),
吸附剂(多孔),
催化剂的载体。
思考一下
如何用SiO2制取 H2SiO3 ?
SSiOiO2 2
Na2SiO3H2SiOH32SiO3
NaOH
酸
能证明硅酸的酸性弱于碳酸酸性的实验事实
是( B )
A.CO2溶于水形成碳酸,SiO2难溶于水 B.CO2通入可溶性硅酸盐中析出硅酸沉淀 C.高温下SiO2与碳酸盐反应生成CO2 D.氯化氢通入可溶性碳酸盐溶液中放出气2CO3弱。
硅酸的性质
①弱酸性(酸性比碳酸弱)
②不稳定(比H2CO3稳定),受热易分解 H2SiO3 =∆= H2O + SiO2
➢生成的硅酸逐渐聚合而形成硅酸溶胶(能流动),
当硅酸的浓度较大时,就会形成硅酸凝胶(不能流 动),硅酸凝胶经过干燥脱水就形成硅胶。(硅胶的 基本成份是 mSiO2·nH2O)
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角。 同时每1个O原子周围结合2个Si原子相结合。 二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示
3、二氧化硅的物理性质
根据SiO2的存在, SiO2有哪些物理 性质?(从水溶性、硬度、熔点考虑)
物理性质:__硬___度__大__、__熔__点__高__、__难__溶__于__水____ 化学稳定性:____通__常__条__件__下__,__很___稳__定____
光纤
一、 二氧化硅( SiO2 )
水晶
1、存在:
结晶形(石英晶体) 水晶 无色透明 玛瑙 彩色环带或层状
硅石
无定形——硅藻土
玛瑙
SiO2是自然界中沙子、石英的主要成分。结 晶的二氧化硅叫石英;天然二氧化硅叫硅石。
2、结构
立体网状结 构决定了 SiO2具有优 良的物理和 化学性质
➢硅胶的用途:
干燥剂(吸水),
吸附剂(多孔),
催化剂的载体。
思考一下
如何用SiO2制取 H2SiO3 ?
SSiOiO2 2
Na2SiO3H2SiOH32SiO3
NaOH
酸
能证明硅酸的酸性弱于碳酸酸性的实验事实
是( B )
A.CO2溶于水形成碳酸,SiO2难溶于水 B.CO2通入可溶性硅酸盐中析出硅酸沉淀 C.高温下SiO2与碳酸盐反应生成CO2 D.氯化氢通入可溶性碳酸盐溶液中放出气2CO3弱。
硅酸的性质
①弱酸性(酸性比碳酸弱)
②不稳定(比H2CO3稳定),受热易分解 H2SiO3 =∆= H2O + SiO2
➢生成的硅酸逐渐聚合而形成硅酸溶胶(能流动),
当硅酸的浓度较大时,就会形成硅酸凝胶(不能流 动),硅酸凝胶经过干燥脱水就形成硅胶。(硅胶的 基本成份是 mSiO2·nH2O)
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角。 同时每1个O原子周围结合2个Si原子相结合。 二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示
3、二氧化硅的物理性质
根据SiO2的存在, SiO2有哪些物理 性质?(从水溶性、硬度、熔点考虑)
物理性质:__硬___度__大__、__熔__点__高__、__难__溶__于__水____ 化学稳定性:____通__常__条__件__下__,__很___稳__定____
无机非金属材料PPT课件
性质
与碱性氧化 物反应
二氧化碳(CO2) CO2+Na2O=Na2CO3
二氧化硅(SiO2)
高温
SiO2+ CaO == CaSiO3
与碱反应 CO2+2NaOH=Na2CO3+H2O SiO2+2NaOH=Na2SiO3+H2O
与水反应 CO2+H2O=H2CO3
——Biblioteka 与氢氟酸反应——SiO2+4HF=SiF4 ↑+2H2O
25
一、二氧化硅和硅酸
26
2.硅酸(H2SiO3)
硅酸是一种白色粉末状的固体,它不溶于水; 是一种弱酸,不能使指示剂变色。
实验探究: 实验4-1:向饱和Na2SiO3溶液 中滴入酚酞,再滴入稀盐酸。
现象
①滴入酚酞溶液呈红色 ②滴入盐酸有凝胶产生
结论
① Na2SiO3溶液呈碱性 ②硅酸难溶于水
方程式 Na2SiO3+2HCl = H2SiO3(胶体) +2NaCl
演讲人:XXXXXX 时 间:XX年XX月XX日
8
一、二氧化硅和硅酸
粘土
9
一、二氧化硅和硅酸
硅元素
画出硅的原子结构示意图
与哪种原子的结构相似? 碳
分析: 既不易失电子,又不易得电子,主要
形成四价的化合物。
10
1、二氧化硅
(1)存在
水晶
硅石
结晶形:石英 无定形
玛瑙
(2)用途:
光导纤维 石英:耐高温化学仪器、石英电子表、石英钟 水晶:电子工业的重要部件、光学仪器、
物理性质:__硬___度__大__、__熔__点__高__、__难__溶__于__水____ 化学稳定性:____通__常__条__件__下__,__很___稳__定____
硅和二氧化硅

Si + 2F2 = SiF4 Si + 4HF = SiF4 ↑ + 2H2 ↑ Si+2NaOH + H2O = Na2SiO3 + 2H2↑ +
Na2SiO3的水溶液称为水玻璃(但不是玻璃),又称泡花碱 的水溶液称为水玻璃(但不是玻璃), ),又称泡花碱 但不是碱溶液,而是盐溶液),是一种矿物胶, ),是一种矿物胶 (但不是碱溶液,而是盐溶液),是一种矿物胶,有粘合 性。
一 .硅
4.硅的化学性质
Si与C同族,最外层均有四个电子,它们的化学性质有 与 同族 最外层均有四个电子, 同族, 许多相似点。 许多相似点。
1.常温下,化学性质不活泼,除氟气、氢氟酸和强碱外,硅不 常温下,化学性质不活泼, 氟气、氢氟酸和强碱外, 常温下 与其他物质(氧气、氯气、硫酸、硝酸等)反应。 与其他物质(氧气、氯气、硫酸、硝酸等)反应。
1、下列反应一步就能实现的是: 下列反应一步就能实现的是: A、SiO2---- H2SiO3 C、CuO----Cu(OH)2 CuO----Cu(OH) -------H B、CO2----H2CO3 ○ C、S------SO3 ------SO
2、将4.6gNa和5.6g硅粉同时投入适量水中,在标 4.6gNa和5.6g硅粉同时投入适量水中, 硅粉同时投入适量水中 准状况下产生H 的体积是: 准状况下产生H2的体积是: B、 A、2.24L B、2.8L C、 C、6.72L C、11.2L ○
三. 硅酸盐
硅酸盐是构成地壳岩石的主要成分, 硅酸盐是构成地壳岩石的主要成分,自然界 中存在的各种天然硅酸盐矿物, 中存在的各种天然硅酸盐矿物,约占地壳质量的 5%。 。 硅酸盐种类很多,多数难溶于水,只有含钾、 硅酸盐种类很多,多数难溶于水,只有含钾、 钠的硅酸盐是可溶的。 钠的硅酸盐是可溶的。 硅酸盐结构很复杂, 硅酸盐结构很复杂,通常可用二氧化硅和金 属氧化物的形式来表示其组成。 属氧化物的形式来表示其组成。
无机非金属材料ppt课件

类型:陶瓷、玻璃、水泥 (1)陶瓷 ·主要原料:黏土 ·主要成分:含水的铝硅酸盐,成分复杂
(2)玻璃 ·主要原料:纯碱(Na2CO3)、石灰石(CaCO3)、石英砂(SiO2) ·主要成分:Na2SiO3、CaSiO3和SiO2
高温
Na2CO3+SiO2===Na2SiO3+CO2↑
高温
CaCO3 +SiO2===CaSiO3 + CO2↑
二、新型无机非金属材料
1、硅和二氧化硅
根据元素周期表中硅的位置,思考: 为什么硅能成为应用最为广泛的半导体材料?
第三周期、第IV A族
①硅的存在与性质:
硅在自然界以硅酸盐和氧化物的形式存在
硅酸盐矿石
玛瑙( SiO2 )
水晶( SiO2 )
高温下,硅能与氧气反应生成SiO2,与氯气反应生成 SiCl4 。
(3)碳纳米材料
碳纳米材料是近年来人们十分关注的一类新型无机非金属 材料,主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、 医药等领域有着广阔的应用前景。
注:碳纳米材料、金刚石、石墨都是碳的同素异形体, 它们因结构不同(碳原子排列方式不同)而具有不同性质。
——富勒烯
富勒烯是由碳原子构成的 一系列笼形分子的总称,其中 的C60是富勒烯的代表物。C60的 发现为纳米科学提供了重要的 研究对象,开启了碳纳米材料 研究和应用的新时代。
③
。
②二氧化硅的性质:
(1)物理性质: 二氧化硅硬度大、熔点高,不溶于水
(2)化学性质:
酸性氧化物:SiO2+2NaOH=== Na2SiO3+H2O ;
具有氧化性:SiO2+2C
Si+2CO↑;
特 性 :SiO2+4HF=== SiF4↑+2H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制集成电路、晶体管、硅整流器等 半导体材料
硅的用途(太阳能电池)
硅的用途(变压器铁芯)
含硅4%的钢可制变压器铁芯
二、二氧化硅
熔点高 硬度大 难溶于水
SiO2
1、二氧化硅的物理性质二氧化硅.
水晶晶体
美丽的玛瑙
高岭石
2、二氧化硅的化学性质 不活泼
(1)SiO2是H2SiO3的酸酐,具有酸性氧化物的通性
◆高岭石
Na2SiO3
Al2(Si2O5)(OH)4
Na2O· 2 SiO
Al2O3· 2SiO2· 2O 2H
金属氧化物 ·二氧化硅 ·水
练习:
1、下列溶液通入过量二氧化碳后,无沉淀的是( D )
A 饱和Na2CO3溶液 C Na2SiO3 B Ca(ClO)2 D Ca(OH)2
2、写出下列变化的化学方程式:
石英钟 精Байду номын сангаас仪器轴承
眼镜
玛瑙
硅酸盐
☆硅酸盐是构成地壳岩石的主要成分,自然界中存在的 各种天然硅酸盐矿物,约占地壳质量的5%。 ☆硅酸盐种类很多,多数难溶于水,只有钾、钠盐是可 溶的。硅酸钠(Na2SiO3)溶液俗称水玻璃,又叫泡花碱。
☆硅酸盐结构很复杂,通常可用二氧化硅和金属氧化物 的形式来表示其组成。 ◆硅酸钠
>
H2SiO3
Na2SiO3+CO2 +H2O =H2SiO3 +Na2CO3
4、怎样由SiO2制取硅酸?
SiO2+2NaOH=Na2SiO3+H2O 实验
3、二氧化硅的存在和用途
存在:
硅石 玛瑙 水晶 石英 分为:晶体(石英和水晶) 无定形(硅藻土)
光导纤维
石英玻璃
石英手表
玛瑙首饰 高级工艺品
二氧化硅
SiO2+2NaOH=Na2SiO3+H2O SiO2+CaO
(2)特性 SiO2+4HF =SiF4+2H2O
高温
CaSiO3
思考:
1、为什么实验室中盛放碱液的试剂瓶用橡皮塞而不用 玻璃塞(玻璃中含有SiO2)? 2、实验室中保存氢氟酸时能否用玻璃仪器?
3、比较碳酸和硅酸的酸性,如何来证明? 酸性:H2CO3
高温
SiO2+2C (2)存在:
Si+2CO↑
自然界中,只以化合态在(SiO2或硅酸盐的形式存在)
(3)用途:
存在于地壳的矿物和岩石里,在地壳中,硅的含量居第二位
制集成电路、晶体管、硅整流器等 半导体材料 含硅4%的钢可制变压器铁芯
含硅15%的钢具有耐酸性,制耐酸设备
硅的用途 (硅晶片)
硅芯片 硅单晶制造
④ ① ② ⑤ ⑥ Na SiO SiF4 SiO2 2 3 ⑧ ⑨ ⑦ CaSiO3 H2SiO3
③
Si
3、硅的化学性质
(1)在常温下,硅的化学性质不活泼 • 只与氟气、氢氟酸和强碱反应 • 不与氧气、氯气、硫酸、硝 酸等起反应 Si+2F2=SiF4 Si+4HF=SiF4 +2H2 ↑ Si+2NaOH+H2O=Na2SiO3+2H2↑ (2)加热时,硅可与氧气、氯气等非金属反应 Si+O2=SiO2 Si+2Cl2=SiCl4 硅 显 还 原 性
2、二氧化硅的化学性质 不活泼
(1)SiO2是H2SiO3的酸酐,具有酸性氧化物的通性 SiO2+2NaOH=Na2SiO3+H2O SiO2+CaO (2)特性 SiO2+4HF=SiF4↑+2H2O
高温
CaSiO3
一、硅
硅 的 结 构 类 似 于 金 刚 石
Si
14
28
1、硅的结构
2、硅的物理性质
灰黑色
硬而脆 有金属光泽的固体 熔点、沸点高 硬度大 半导体材料
3、硅的化学性质
(1)在常温下,硅的化学性质不活泼
只与氟气、氢氟酸和强碱反应 不与氧气、氯气、硫酸、硝 酸等起反应
4、硅的制法、存在及用途
(1)制法:
