药包材标准新旧替代对照表
新旧GMP对照对照(1.0版)

第三章厂房与设施(98)编号条款编号8药品生产企业必须有整洁的生产环境;厂区的地面、路面及运输等不应对药品的生产造成污染;生产、行政、生活和辅助区的总体布局应合理,不得互相妨碍。
45495060627576779厂房应按生产工艺流程及所要求的空气洁净级别进行合理布局。
同一厂房内以及相邻厂房之间的生产操作不得相互妨碍。
43445210厂房应有防止昆虫和其他动物进入的设施。
4811 在设计和建设厂房时,应考虑使用时便于进行清洁工作。
洁净室(区)的内表面应平整光滑、无裂缝、接口严密、无颗粒物脱落,并能耐受清洗和消毒,墙壁与地面的交界处宜成弧形或采取其他措施,以减少灰尘积聚和便于清洁。
465512 生产区和储存区应有与生产规模相适应的面积和空间用以安置设备、物料,便于生产操作,存放物料、中间产品、待验品和成品,应最大限度地减少差错和交叉污染。
5413 洁净室(区)内各种管道、灯具、风口以及其他公用设施,在设计和安装时应考虑使用中避免出现不易清洁的部位。
5614 洁净室(区)应根据生产要求提供足够的照明。
主要工作室的照度宜为300勒克斯;对照度有特殊要求的生产部位可设置局部照明。
厂房应有应急照明设施。
476115进入洁净室(区)的空气必须净化,并根据生产工艺要求划分空气洁净级别。
洁净室(区)内空气的微生物数和尘粒数应定期监测,监测结果应记录存档。
16洁净室(区)的窗户、天棚及进入室内的管道、风口、灯具与墙壁或天棚的连接部位均应密封。
空气洁净级别不同的相邻房间之间的静压差应大于5帕,洁净室(区)与室外大气的静压差应大于10帕,并应有指示压差的装置。
5317洁净室(区)的温度和相对湿度应与药品生产工艺要求相适应。
无特殊要求时,温度应控制在18~26℃,相对湿度控制在45%~65%。
18洁净室(区)内安装的水池、地漏不得对药品产生污染。
5719 不同空气洁净度级别的洁净室(区)之间的人员及物料出入,应有防止交叉污染的措施。
内包材标准替代对照表

聚乙烯/铝/聚乙烯复合药用软膏管 药用低密度聚乙烯膜、袋 注射液用卤化丁基橡胶塞 注射用无菌粉末用卤化丁基橡胶塞 药用合成聚异戊二烯垫片 口服制剂用硅橡胶胶塞、垫片 预灌封注射器组合件(带注射针) 预灌封注射器用硼硅玻璃针管 预灌封注射器用不锈钢注射针 预灌封注射器用氯化丁基橡胶活塞 预灌封注射器用溴化丁基橡胶活塞 预灌封注射器用聚异戊二烯橡胶针头护帽 笔式注射器用硼硅玻璃珠 笔式注射器用硼硅玻璃套筒 笔式注射器用铝盖 笔式注射器用氯化丁基橡胶活塞和垫片 笔式注射器用溴化丁基橡胶活塞和垫片 固体药用纸袋装硅胶干燥剂 包装材料红外光谱测定法 包装材料不溶性微粒测定法 乙醛测定法 加热伸缩率测定法 挥发性硫化物测定法 包装材料溶剂残留量测定法 注射剂用胶塞、垫片穿刺力测定法 注射剂用胶塞、垫片穿刺落屑测定法 玻璃耐沸腾盐酸浸蚀性测定法 玻璃耐沸腾混合碱水溶液浸蚀性测定法 玻璃颗粒在98℃耐水性测定法和分级 砷、锑、铅、镉浸出量测定法 抗机械冲击测定法 直线度测定法 药用陶瓷吸水率测定法 药品包装材料生产厂房洁净室(区)的测试方法 药用玻璃砷、锑、铅、镉8 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65
YBB00012002-2015 YBB00022002-2015 YBB00242004-2015 YBB00342002-2015 YBB00102005-2015 YBB00112005-2015 YBB00062002-2015 YBB00072002-2015 YBB00082002-2015 YBB00092002-2015 YBB00102002-2015 YBB00392003-2015 YBB00112002-2015 YBB00122002-2015 YBB00262002-2015 YBB00172004-2015 YBB00132002-2015 YBB00172002-2015 YBB00182002-2015 YBB00192002-2015 YBB00192004-2015 YBB00202004-2015 YBB00212005-2015 YBB00232005-2015 YBB00222005-2015 YBB00182004-2015 YBB00202005-2015 YBB00242002-2015 YBB00372003-2015 YBB00402003-2015 YBB00212004-2015 YBB00132005-2015 YBB00142005-2015 YBB00152005-2015
国家药品包装容器材料标准

国家药品包装容器材料标准第一篇:国家药品包装容器材料标准国家食品药品监督管理局国家药品包装容器(材料)标准YBB00042005 替代原YBB00042002 注射液用卤化丁基橡胶塞Zhusheyeyong Luhuadingji Xiangjiaosai Halogenated butyl rubber Stopper for injection 本标准适用于直接与注射剂接触的氯化或溴化丁基橡胶塞的检验。
【外观】取本品数个,照附表检查法检查,应符合规定。
【鉴别】*(1)取本品适量剪成小颗粒,称取2.0g,置于30ml坩埚中,加碳酸氢钠2.0g均匀覆盖试样,置电炉上,缓缓加热至炭化,放冷,置高温炉300℃加热至完全灰化,取出,放冷,加水10ml使溶解,过滤,取滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1滴,应产生白色或淡黄色沉淀。
(2)除另有规定外,照包装材料红外分光光谱测定法(YBB00262004)第四法测定,应与对照图谱基本一致。
【穿刺落屑】取本品10个,照注射剂用胶塞、垫片穿刺落屑测定法(YBB00332004)第一法测定,落屑数应不得过20粒。
【穿刺力】取本品10个,照注射剂用胶塞、垫片穿刺力测定法(YBB00322004)第一法测定,平均穿刺力不得过75N;且每个胶塞的穿刺力均不得过80N。
【密封性与穿刺器保持性】取本品10个,置高压蒸气灭菌器中(不浸水),121±2℃,保持30分钟,冷却至室温,另取10个与之配套的玻璃注射液瓶加水至标示容量,用上述胶塞,塞紧,再加上与之配套铝盖,压盖。
用符合注射剂用胶塞、垫片穿刺力测定法(YBB00322004)中图1所示的穿刺器,向胶塞穿刺部位垂直穿刺,穿刺器刺穿胶塞,倒挂瓶,穿刺器悬挂0.5kg重物,穿刺器应保持4小时不被拔出,且瓶塞穿刺部位应无泄漏。
【灰分】除另有规定外,取本品1.0g,置已炽灼至恒重的坩锅中,精密称定,缓缓炽灼至完全炭化,再在800℃炽灼至完全灰化,移置干燥器内,放冷至室温,精密称定后,再在800℃炽灼至恒重,遗留残渣不得过45%。
新旧附录通则编码对照表

1
0120 0121
0122
0123 0124
0125
0126 0127 0128 0129 0130 0131
0181
0182 0183 0184 0185 0186 0187 0188 0189 0190
0200 0211 0212 0213 0251
0261
0271 0272 0291 0300
1000 分子生物学技术 1001 核酸分子鉴定法
拟新增
1100 生物检查法 1101 无菌检查法
非无菌产品微生物限度检查:微 1105 生物计数法
一部 二部 三部 一部 二部
附录Ⅻ ⅩⅢ B 无菌检查法 Ⅺ H 无菌检查法 Ⅻ A 无菌检查法 ⅩⅢ A 微生物限度检查法 Ⅺ J 微生物限度检查法
6
原附录名称 附录Ⅰ制剂通则 Ⅰ D 片剂 Ⅰ A 片剂 Ⅰ E 片剂 Ⅰ U 注射剂 Ⅰ B 注射剂 Ⅰ A 注射剂 Ⅰ L 胶囊剂 Ⅰ E 胶囊剂 Ⅰ F 胶囊剂 Ⅰ C 颗粒剂 Ⅰ N 颗粒剂 Ⅰ J 颗粒剂 Ⅰ Y 眼用制剂 Ⅰ G 眼用制剂 Ⅰ C 眼用制剂 Ⅰ X 鼻用制剂 Ⅰ R 鼻用制剂 Ⅰ L 鼻用制剂 Ⅰ W 栓剂 Ⅰ D 栓剂 Ⅰ B 栓剂 Ⅰ R 软膏剂 Ⅰ F 软膏剂 乳膏剂 糊剂 Ⅰ G 软膏剂、乳膏剂 Ⅰ Z 气雾剂 喷雾剂 Ⅰ L 气雾剂 粉雾剂 喷雾剂 Ⅰ H 喷雾剂 Ⅰ Q 凝胶剂 Ⅰ U 凝胶剂 Ⅰ M 凝胶剂 Ⅰ B 散剂 Ⅰ P 散剂 Ⅰ K 散剂 Ⅰ K 滴丸剂 Ⅰ H 丸剂 Ⅰ H 丸剂 Ⅰ H 糖浆剂 Ⅰ K 糖浆剂 Ⅰ V 搽剂 洗剂 涂膜剂
0116 0117 0118 0119
滴丸剂 糖丸 糖浆剂 搽剂
原附录
一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 三部 一部 二部 二部 一部 二部 一部
药典品种新老版对比(全)

水分≤13.0 总灰分≤10.0 醇性冷浸出物:12.0 挥发油:1.0
杂质≤4
杂质≤4
水分≤13.0
水分≤13.0
总灰分≤10.0
仙茅苷:0.080,其他 总灰分≤10.0
酸不溶≤2.0
同药材
酸不溶≤2.0
醇性浸出物:7.0
醇性浸出物:7.0
仙茅苷:0.10
仙茅苷:0.10
23 白芍
水分≤14.0 总灰分≤4.0 重金属及有害元素:详 见备注 水性浸出物:22.0 芍药苷:1.6
水分≤16.0 总灰分≤8.0 水性冷浸出物:65.0 杯苋甾酮:0.030
7 山药
8 山豆根 9 大黄 10 干姜 11 木香 12 牛膝 13 天麻
水分≤16.0(毛山药和
光山药)12.0(山药
片)
水分≤16.0 总灰分≤4.0 水性冷浸出物:7.0
山药:总灰分≤2.0 其他项目同药材 麸炒山药:水分≤12.0 总灰分≤4.0 水性冷浸出物:4.0
总灰分≤4.0 木香烃内酯和去氢木香 内酯总量:1.8
总灰分≤4.0 醇性浸出物:12.0 木香烃内酯和去氢木香 内酯总量:1.5
总灰分≤4.0 木香烃内酯和去氢木香 内酯总量:1.8
煨木香:鉴别同药材
水分≤15.0
水分≤15.0
总灰分≤9.0
总灰分≤9.0
牛膝:浸出物:5.0 二氧化硫残留量≤
醇性浸出物:6.5
10-15版药典品种标准汇总
类别一 根茎类
序号 品名 原料
10版药典检测标准 成品
原料
15版药典检测标准
1 人参
水分≤12.0
总灰分≤5.0 人参皂苷Rg1和Re:0.30
药包材标准汇编第六辑

直接接触药品的包装材料和容器标准汇编(第六辑)YBB00202005聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片YBB00212005聚氯乙烯固体药用硬片YBB00222005聚氯乙烯/聚偏二氯乙烯固体药用复合硬片YBB00232005聚氯乙烯/低密度聚乙烯固体药用复合硬片YBB00042005注射液用卤化丁基橡胶塞YBB00052005注射用无菌粉末用卤化丁基橡胶塞YBB00072005药用低密度聚乙烯膜、袋YBB00082005注射剂瓶用铝盖YBB00092005输液瓶用铝盖YBB00102005三层共挤输液用膜(Ⅰ)、袋YBB00112005五层共挤输液用膜(Ⅰ)、袋YBB00122005药用固体纸袋装硅胶干燥剂YBB00132005药用聚酯/铝/聚丙烯封口垫片YBB00142005药用聚酯/铝/聚酯封口垫片YBB00152005药用聚酯/铝/聚乙烯封口垫片YBB00162005药用口服固体陶瓷瓶YBB00032005钠钙玻璃输液瓶(代替YBB00032002)YBB00292005-1高硼硅玻璃管制注射剂瓶(代替YBB00292002)YBB00292005-2中性硼硅玻璃管制注射剂瓶(代替YBB00292002)YBB00322005-2中性硼硅玻璃安瓿(代替YBB00322002)YBB00012005-1药用高硼硅玻璃管(代替YBB00262003)YBB00012005-2药用中性硼硅玻璃管(代替YBB00262003)YBB00022005-2中性硼硅玻璃输液瓶(代替YBB00292003)YBB00062005-2中性硼硅玻璃模制注射剂瓶(代替YBB00312003)YBB00252005药用聚丙烯/铝/聚乙烯复合软膏管(代替YBB00252002)YBB00172005药用玻璃铅、镉、砷、锑浸出量限度YBB00182005药用陶瓷容器铅、镉浸出量限度YBB00192005药用陶瓷容器铅、镉浸出量测定法YBB00242005环氧乙烷残留量测定法YBB00262005橡胶灰分的测定法国家食品药品监督管理局国家药品包装容器(材料)标准(试行)YBB00072005药用低密度聚乙烯膜、袋Yaoyong DimiduJuyixi Mo、DaiLDPE films and pouches for medical Packaging 本标准适用于以低密度聚乙烯树脂(LDPE)为主要原料采用流涎法、吹制法生产的药用薄膜,及由此薄膜通过热封制成的袋。
新旧gmp对照对照(10版).xls

第十章质量管理(98)编号条款编号74 药品生产企业的质量管理部门应负责药品生产全过程的质量管理和检验,受企业负责人直接领导。
质量管理部门应配备一定数量的质量管理和检验人员,并有与药品生产规模、品种、检验要求相适应的场所、仪器、设备。
775质量管理部门的主要职责:89101112141576质量管理部门应会同有关部门对主要物料供应商质量体系进行评估。
280 281 282283284285286287 1.制定和修订物料、中间产品和成品的内控标准和检验操作规程,制定取样和留样制度;2.制定检验用设备、仪器、试剂、试液、标准品(或对照品)、滴定液、培养基、实验动物等管理办法;3.决定物料和中间产品的使用; 4.审核成品发放前批生产记录,决定成品发放;5.审核不合格品处理程序;6.对物料、中间产品和成品进行取样、检验、留样,并出具检验报告;7.监测洁净室(区)的尘粒数和微生物数;8.评价原料、中间产品及成品的质量稳定性,为确定物料贮存期、药品有效期提供数据;9.制定质量管理和检验人员的职责。
第二章质量管理第一节基本要求第二章质量管理第二节质量保证第二章质量管理第四节质量控制第十章质量控制与质量保证第七节供应商的审计和批准288289新增项目第二章质量管理第三节GMP13161718241242243244245246247248第十章质量控制与质量保证第七节供应商的审计和批准第二章质量管理第五节质量风险管理249250251252253254255256257258259260261第十章质量控制与质量保证第一节质量控制实验室管理规范第十章质量控制与质量保证第二节物料和产品放行定性考察计划262263264265266267268269270271272273274275276277278279290291292第四节变更控制第五节偏差处理第六节纠正和预防措施(CAPA)第八节产品质量回顾分析第三节持续稳定性考察计划第二章质量管理、第十章质量控制与质量保证((new)条款药品生产企业应建立并实施质量目标,将药品注册中有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、发放的全过程中,确保所生产的药品适用于预定的用途,符合药品注册批准或规定的要求和质量标准,并避免让患者承受安全、疗效和质量的风险。
新旧版GSP对比(完整版)
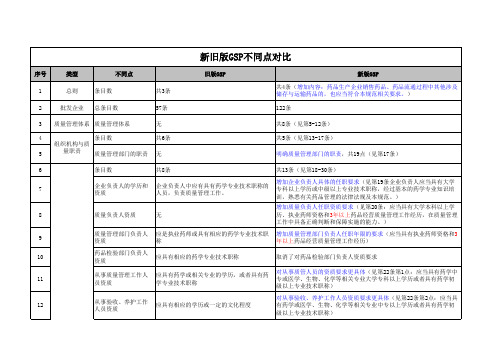
校准与验证 计算机系统
校准与验证 计算机系统 条目数
无 无 共8条
34
采购活动的要求
无
见第61条:确定供货单位的合法资格;确定所购入药品的合法性;核 实供货单位销售人员的合法资格;与供货单位签订质量保证协议。 较明确(见第62、63条:对首营企业的审核,应当查验加盖其公章原 印章的以下资料,确认真实、有效:《药品生产许可证》或《药品经 营许可证》复印件;营业执照及其年检证明复印件;《药品生产质量 管理规范》认证证书或《药品经营质量管理规范》认证证书复印件; 相关印章、随货同行单(票)样式;开户户名、开户银行及账号;《 税务登记证》和《组织机构代码证》复印件。采购首营品种应当审核 药品的合法性,索取加盖供货单位公章原印章的药品生产或进口批准 证明文件复印件并予以审核,审核无误的方可采购。以上资料应当归 入药品质量档案。) 见第64条:加盖供货单位公章原印章的销售人员身份证复印件;加盖 供货单位公章原印章和法定代表人印章或签名的授权书。授权书应当 载明被授权人姓名、身份证号码,以及授权销售的品种、地域、期 限;供货单位及供货品种相关资料。 见第65条:明确双方质量责任;供货单位应当提供符合规定的资料且 对其真实性、有效性负责;供货单位应当按照国家规定开具发票;药 品质量符合药品标准等有关要求;药品包装、标签、说明书符合有关 规定;药品运输的质量保证及责任;质量保证协议的有效期限。 见第66、67条:企业应当向供货单位索取发票。发票应当列明药品的 通用名称、规格、单位、数量、单价、金额等;不能全部列明的,应 当附《销售货物或者提供应税劳务清单》,并加盖供货单位发票专用 章原印章、注明税票号码;发票上的购、销单位名称及金额、品名应 当与付款流向及金额、品名一致,并与财务账目内容相对应。发票按 有关规定保存。 见第68条:采购药品应当建立采购记录。采购记录应当有药品的通用 名称、剂型、规格、生产厂商、供货单位、数量、价格、购货日期等 内容,采购中药材的还应当标明产地。 见第69条:发生灾情、疫情、突发事件或临床紧急救治等特殊情况, 以及其他符合国家有关规定的情形,企业可采用直调方式购销药品, 即将已采购的药品不入本企业仓库,直接从供货单位发送到购货单 位,并建立专门的采购记录,保证有效的质量跟踪和追溯。
YYT0313新旧对比表

YYT0313新旧对比表YY/T 0313 对比表序号YY/T 0313-1998 YY/T 0313-20141 医用高分子制品包装、标志、运输和贮存医用高分子产品包装和制造商提供信息的要求2 1范围本标准规定了医用高分子制品的包装、标志、运输和贮存。
本标准适用于医用高分子制品(以下简称制品)的包装、标志、运输和贮存。
特殊制品由产品标准规定。
1、范围本标准规定了医用高分子产品的包装和制造商提供信息的要求。
注:国家法规以及产品标准中的规定优先于本标准。
3 2、引用标准下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。
GB 191-90 包装储运图示标志GB 4892-85硬质直方体运输包装尺寸系列GB 6543-86瓦楞纸箱2、规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 3102 (所有部分)量和单位GB/T 4892 硬质直方体运输包装尺寸系列GB/T 6543 运输包装用单瓦楞纸箱和双瓦楞纸箱GB/T 7408 数据元和交换格式信息交换日期和时间表示法GB/T 19633.1 最终灭菌医疗器械包装第1部分:材料、无菌屏障系统和包装系统的要求YY/T 0466.1 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求YY/T 0468 命名用于管理资料交流的医疗器械命名系统规范YY/T 1119 医用高分子产品术语4 制品(全文)产品(全文)5 无 3.7、货架包装shelf package在遵守制造商贮存条件下,摆放在货架上确保产品在使用期限内符合预期的性能的保护性包装单元。
6 3. 9、软包装flexible package在装入或取出内装物后,容器形状发生变化的包装。
国家药用包装容器(材料)标准

国家食品药品监督管理局国家药用包装容器(材料)标准(试行)YBB00322005-2替代原YBB00322002中性硼硅玻璃安瓿Zhongxingboli AnbuAmpoules made of neutral glass tubing本标准适用于色环和点刻痕易折中性玻璃安瓿。
【外观】 取本品适量,在自然光线明亮处,正视目测。
应为无色透明或棕色透明;不应有明显的玻璃缺陷;任何部位不得有裂纹;点刻痕易折安瓿的色点应标记在刻痕上方中心,与中心线的偏差不得过±1.0mm 。
【鉴别】* (1)线热膨胀系数 取本品适量,照线热膨胀系数测定法(YBB00212003)测定,线热膨胀系数不得大于5×10-6K -1(20℃~300℃)。
(2)三氧化二硼的含量 取本品适量,照三氧化二硼测定法(YBB00232003)测定, B2O3的含量不得小于8%(g/g )。
【121℃颗粒法耐水性】 取本品适量,照玻璃颗粒在121℃耐水性测定法和分级(YBB00252003)测定,应符合1级的要求。
【98℃颗粒法耐水性】 取本品适量,照玻璃颗粒在98℃耐水性测定法(YBB00362004)测定,应符合HGB1级的要求。
【内表面耐水性】 取本品适量,照121℃内表面耐水性测定法和分级(YBB00242003)测定,应符合HC1级的要求。
【耐酸性】* 取本品适量,照玻璃耐沸腾盐酸浸蚀性测定法(YBB00342004)第一法测定,应符合1级的要求;或照玻璃耐沸腾盐酸浸蚀性测定法(YBB00342004)第二法测定,碱性氧化物的浸出量应小于等于100μg/dm 2。
【耐碱性】* 取本品适量,照玻璃耐沸腾混合碱水溶液浸蚀性测定法(YBB00352004)测定,应符合2级的要求。
【内应力】 取本品适量,照内应力测定法(YBB00162003)测定,退火后的最大永久应力造成的光程差不得过40nm/mm 。
【圆跳动】取本品适量,照垂直轴偏差测定法(YBB00192003)测定,应符合表1规定。
药包材标准ybb00262004-2015

药包材标准YBB00262004-2015:全面解读导语药包材标准YBB00262004-2015是指我国药品包装材料标准的一项重要内容,它规定了药品包装中所使用的材料的要求和测试方法。
本文将从深度和广度多方面全面解读这一标准,帮助读者更深入地理解其内容和意义。
一、 YBB00262004-2015的基本概况1.1 标准的制定背景药品包装材料的质量对药品的安全性和有效性起着至关重要的作用,为了保障患者的用药安全和药品的质量,我国药品包装材料标准YBB00262004-2015应运而生。
这一标准的制定旨在规范药品包装材料的选用与使用,促进药品包装行业的健康发展。
1.2 标准的适用范围YBB00262004-2015标准主要适用于药品包装中所使用的各类包装材料,包括但不限于玻璃、聚合物、金属、橡胶、纸张和纺织品等。
该标准覆盖了常见的药品包装材料,为其提供了技术规范和质量测试标准。
1.3 标准的主要内容YBB00262004-2015标准主要包括了对药品包装材料的一般要求、特殊要求、测试方法、标志和说明等内容。
其中,一般要求包括了物理性能、化学性能和生物相容性等方面的规定;特殊要求则针对不同类型的药品包装材料提出了具体的要求;测试方法则为药品包装材料的检测提供了技术支持。
二、 YBB00262004-2015的主要特点和亮点2.1 与老标准的对比分析YBB00262004-2015标准相较于之前的药包材标准在哪些方面有了更新和提升?在本章节,我们将对比新旧标准,分析出YBB00262004-2015的主要特点和亮点。
2.2 与国际标准的接轨情况作为我国药品包装材料的标准,YBB00262004-2015在多大程度上与国际标准接轨?在本章节,我们将分析该标准在国际化方面的表现,探讨其对我国药品包装材料行业的影响。
三、个人观点和理解3.1 对YBB00262004-2015的认识在撰写本文的过程中,我对YBB00262004-2015标准有了更深入的认识和理解。
化学药品申报资料要求新旧对比

敏毒性)、溶血性和局部(
血管、皮肤、粘膜、肌肉等
)刺激性等特殊安全性试验
资料和文献资料。
21.致癌试验资料及文献资料。
22.复方制剂中多种成份药效
、毒性、药代动力学相互影
响的试验资料及文献资料。
22.依赖性试验资料及文献资料。
23.致突变试验资料及文献资
料。
23.过敏性(局部、全身和光敏毒性)、
D格式的编号,以下同)
3.2.S.1基本信息
12.1(3.2.S.1)基本信息
3.2.S.2生产信息
12.2(3.2.S.2
3.2.S.3特性鉴定
12.3(3.2.S.3
3.2.S.4原料药的质量控制
12.4(3.2.S.4
3.2.S.5对照品
12.5(3.2.S.5)对照品
3.2.S.6包装材料和容器
12.4.(3.2.P.4)原辅料的控制
3.2.S.5对照品
12.5.(3.2.P.5)制剂的质量控制
3.2.S.6包装材
料和容器
12.6.(3.2.P.6)对照品
3.2.S.7稳定性
12.7.(3.2.P.7)稳定性
3.2.P制剂
13.(2.4.P)制剂非临床研究信息汇总表。
3.2.P.1剂型及
产品组成
影响因素条件:光照4500Lu
x;高温60℃;高湿90%RH
光照1.2×106Lux•hr、200w•hr/m2;高
温高于加速温度10℃以上;高湿75%或
更高
第二部分
注册分类
1、2、3、4、5
、6类
4、5.2类
申报资料
项目
1.药品名称。
[VIP专享]新旧附录通则编码对照表
![[VIP专享]新旧附录通则编码对照表](https://img.taocdn.com/s3/m/463f7a8149649b6649d74709.png)
Ⅰ Z 气雾剂 喷雾剂(指喷雾剂) Ⅰ L 气雾剂 粉雾剂 喷雾剂(指喷雾 剂) I H 喷雾剂(指喷雾剂) Ⅰ Z 气雾剂 喷雾剂(指气雾剂) Ⅰ L 气雾剂 粉雾剂 喷雾剂(指气雾 剂)
Ⅰ Q 凝胶剂 Ⅰ U 凝胶剂
Ⅰ S 洗剂 冲洗剂 灌肠剂(指洗剂) Ⅰ V 搽剂 洗剂 涂膜剂(指洗剂)
Ⅰ S 洗剂 冲洗剂 灌肠剂(指冲洗剂)
Ⅰ S 洗剂 冲洗剂 灌肠剂(指灌肠剂)
Ⅰ J 合剂 Ⅰ E 锭剂 Ⅰ F 煎膏剂(膏滋) Ⅰ G 胶剂 Ⅰ M 酒剂 Ⅰ P 膏药 Ⅰ S 露剂 Ⅰ T 茶剂 Ⅰ O 流浸膏剂与浸膏剂
0200 其他通则
I M 凝胶剂 Ⅰ B 散剂 Ⅰ P 散剂 I K 散剂 Ⅰ H 糖浆剂 Ⅰ K 糖浆剂 Ⅰ V 搽剂 洗剂 涂膜剂(指搽剂) Ⅰ T 搽剂 涂剂 涂膜剂(指搽剂) Ⅰ T 搽剂 涂剂 涂膜剂(指涂剂) I D 外用制剂 Ⅰ V 搽剂 洗剂 涂膜剂(指涂膜 剂) Ⅰ T 搽剂 涂剂 涂膜剂(指涂膜剂 Ⅰ N 酊剂 Ⅰ C 酊剂 Ⅰ I 贴膏剂 (指贴剂) Ⅰ V 贴剂 Ⅰ I 贴膏剂 Ⅰ O 口服溶液剂 口服混悬剂口服乳 剂 Ⅰ J 植入剂 Ⅰ M 膜剂 Ⅰ Q 耳用制剂 Ⅰ V 搽剂 洗剂 涂膜剂(指洗剂)
1) B2Ak+22+1=2+15+c51mc+=m5=21c11+m++12+2+1++=212=2+1+2+1+2+2+22+32k+1+2
0106 鼻用制剂
0105 眼用制剂
新旧药典原辅料对比

12
丝氨酸
1、比旋度:+14.0°~+16.0°
1、比旋度:+14.0°~+15.6°
2、鉴别:
2、鉴别:增加薄层色谱鉴别
3、其他氨基酸
3、增加系统适用性试验,采用丝氨酸对 照品与甲硫氨酸对照品制成的混合液作 为系统适用性试验溶液,应显两个清晰分 离的斑点
3、含量测定中系统适用性试验: 罗红霉素的保留时间不少于9分钟,其与
前相邻杂质峰的分离度不得小于1.0,与
后相邻杂质峰的分离度不得小于2.0,理
论板数按罗红霉素峰计算不低于25000
3、含量测定中系统适用性试验:取罗红 霉素对照品和红霉素标准品适量,加流动
相溶解并稀释制成每1ml中各约含1mg
的混合溶液,取20卩l注入液相色谱仪, 罗红霉素峰的保留时间约为14分钟,其
5
木糖醇
增加“还原糖”检查项
6
牛磺酸
1、鉴别:(1)化学反应
1、更改为:薄层色谱鉴别
2、氯化物:限值w0.1%
2、氯化物:限值w0.01%
3、硫酸盐:限值w0.1%
3、硫酸盐:限值w0.01%
4、
4、增加“铁盐、有关物质(薄层法)”检 查
7
甘氨酸
1、性状:本品为白色结晶性粉末;无臭; 味甜
1、性状:本品为白色至类白色结晶性粉 末;无臭;味甜
增加“溶液的澄清度与颜色”检查 增加“甲醇和甲酯”检查
26
单硝酸异 山梨酯
1、性状:
1、性状描述中增加“本品受热或受到撞 击易发生爆炸”
2、熔点
删除
3、鉴别:(1)化学反应
新旧药名对照
45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91
倍他乐克片 利喜定片 高特灵 钠催离片 代文胶囊 胃舒平片 胃达喜片 潘妥洛克片 果胶铋胶囊 膜固思达 惠加强片 聚克 丽珠肠乐胶囊 西利宾胺片 五脂胶囊 干易克片(葫芦素) 加诺片(托尼萘酸) 力蜚能 呋喃氟脲嘧啶片 骁悉片 开瑞坦片 美喘清片 帮备 顺尔宁片 必嗽平片 哈乐胶囊 宁通片 三七总甙片 小施尔康片 顺尔宁咀嚼片 罗钙全胶囊 艾力达(盐酸伐地那非片) 德巴金片 舒喘灵片 脑益嗪片 消炎痛片 安普索片 波利特片 吗丁啉片 复方新诺明片(百炎净) 科素亚片 易蒙停胶囊 文迪雅片 西乐葆胶囊 强力安喘通 加诺片(托尼萘酸) 诺宁片
酒石酸美托洛尔片 乌拉地尔缓释片 特拉唑嗪片 吲达帕胺片 缬沙坦胶囊(代文) 复方氢氧化铝片 铝碳酸镁片(达喜) 泮托拉唑肠溶片(潘妥洛克) 胶体果胶铋胶囊 瑞巴派特片 吉法酯片(惠加强_G) 复合乳酸菌胶囊 口服双歧杆菌活菌制剂 水飞蓟宾葡甲胺片 五酯胶囊 葫芦素片 托尼萘酸片 多糖铁复合物胶囊 替加氟片 吗替麦考酚酯片 氯雷他定片 丙卡特罗片 班布特罗片 孟鲁司特钠片(顺尔宁) 溴己新片 坦索罗辛缓释胶囊 酒石酸托特罗定片 血塞通片 小儿维生素咀嚼片(小施尔康) 孟鲁司特钠咀嚼片(顺尔宁) 骨化三醇胶丸(罗盖全) 伐地那非片(艾力达) 丙戊酸钠缓释片(德巴金) 沙丁胺醇片 桂利嗪片 吲哚美辛肠溶片 氨溴索片 雷贝拉唑钠肠溶片(波利特) 多潘立酮片(吗丁啉) 复方磺胺甲噁唑片(百炎净) 氯沙坦钾片 洛哌丁胺胶囊(易蒙停) 罗格列酮片(文迪雅) 塞来昔布胶囊(西乐葆) 复方甲氧那明胶囊 托尼萘酸片 硫普罗宁肠溶片
98版及2010版新旧GMP对照(药品).

1
1
2
2
本规范是药品生产和质量管理的基本准则。适 用于药品制剂生产的全过程、原料药生产中影 响成品质量的关键工序。
3
4
第一章总则(98)
编号 条款 根据《中华人民共和国药品管理法》规定,制 定本规款 为规范药品生产质量管理,根据《中华人民共和国药品管理法》、 《中华人民共和国药品管理法实施条例》,制定本规范。 企业应当建立药品质量管理体系。该体系应当涵盖影响药品质量的 所有因素,包括确保药品质量符合预定用途的有组织、有计划的全 部活动。 本规范作为质量管理体系的一部分,是药品生产管理和质量控制的 基本要求,旨在最大限度地降低药品生产过程中污染、交叉污染以 及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册 要求的药品。 企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行 为。
新旧版中药材GAP对比

新旧版中药材GAP对比2017年10月27日,国家食品药品监督管理总局发布了《中药材生产质量管理规范(修订稿)》,由康美中药网最新整理并发布了新版GAP的变化和要求(绿底标示),在此本人在其基础上,结合自身的理解,对新版GAP与旧版GAP要求差异进行了简单的梳理。
一. 总则修订稿明确与药品管理法和新立的中医药法保持一致互通,强调法律法规的一致性。
1、第一条:对新版GAP提供了法律依据。
2、第二条:从适用范围看,新版GAP并未降低认证的门槛要求。
3、第四条:特别提出了企业的诚信原则。
二. 质量管理修订稿在质量要求上,增加了风险管理、规范管理、物料和操作统一性等内容,建立中药材产品批次,引进溯源管理,完善质控体系,开展自检自查,并鼓励物联网技术的应用。
在种源的历史和道地方面,增加了选址要求,并强调以药典作为药材质量标准和检测方法。
1、第八条:风险管理、规范管理、五统一等内容的增加,大大提高了原药材的生产过程质量要求,需要增强基地对原药材实际种植生产的管控力度。
2、第十六条:明确以《中国药典》为中药材质量标准,对农残、重金属及微生物限量未再做另行规定。
3、上面标红字体内容,主要是个人对其理解有异议,在新版GAP中并未能得到相应的理解。
三. 机构与人员在生产和管理人员方面,修订稿明确要求,具有三年经验大专学历或者五年从业经验,强调需培训上岗,列出培训内容。
1、第十九条:对生产、质量的管理负责人资格有了更高的要求;四. 设施、设备与工具在设备和工具方面,修订稿从原“人员”项目中单独列出,并增加对生产物料、设备、仓库的管理要求,要求设施齐全,工具达到生产卫生标准。
1、对设施、设备与工具等要求进行了明确和细化,须达到相应的标准要求。
五. 生产基地要求首选道地产区,其他产区需严格论证土壤、空气、水、环境、卫生要求等条件符合标准。
修订稿强调,初加工水要达到生活饮用水标准,基地须有2个收获历史周期作为生产论证,基地边界和流转方案要清晰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100
YBB00252005-2015 YBB00072005-2015 YBB00042005-2015 YBB00052005-2015 YBB00232004-2015 YBB00222004-2015 YBB00112004-2015 YBB00062004-2015 YBB00092004-2015 YBB00072004-2015 YBB00082004-2015 YBB00102004-2015 YBB00122004-2015 YBB00132004-2015 YBB00142004-2015 YBB00152004-2015 YBB00162004-2015 YBB00122005-2015 YBB00262004-2015 YBB00272004-2015 YBB00282004-2015 YBB00292004-2015 YBB00302004-2015 YBB00312004-2015 YBB00322004-2015 YBB00332004-2015 YBB00342004-2015 YBB00352004-2015 YBB00362004-2015 YBB00372004-2015 YBB00382004-2015 YBB00392004-2015 YBB00402004-2015 YBB00412004-2015 YBB00172005-2015
代替标准名称 钠钙玻璃输液瓶(试行) 低硼硅玻璃输液瓶(试行) 中性硼硅玻璃输液瓶(试行) 低硼硅玻璃安瓿(试行) 中性硼硅玻璃安瓿(试行) 钠钙玻璃管制注射剂瓶(试行) 低硼硅玻璃管制注射剂瓶(试行) 中性硼硅玻璃管制注射剂瓶(试行) 高硼硅玻璃管制注射剂瓶(试行) 钠钙玻璃模制注射剂瓶(试行) 低硼硅玻璃模制注射剂瓶(试行) 中性硼硅玻璃模制注射剂瓶(试行) 钠钙玻璃管制口服液体瓶(试行) 低硼硅玻璃管制口服液体瓶(试行) 硼硅玻璃管制口服液体瓶(试行) 钠钙玻璃药瓶(试行) 低硼硅玻璃模制药瓶(试行) 硼硅玻璃模制药瓶(试行) 钠钙玻璃管制药瓶(试行) 低硼硅玻璃管制药瓶(试行) 硼硅玻璃管制药瓶(试行) 钠钙玻璃药用管(试行) 低硼硅玻璃药用管(试行) 药用中性硼硅玻璃管(试行) 药用高硼硅玻璃管(试行) 药用口服固体陶瓷瓶(试行) 药品包装用铝箔(试行) 铝质药用软膏管(试行) 注射剂瓶用铝盖(试行) 输液瓶用铝盖(试行) 口服液瓶用撕拉铝盖(试行)
聚乙烯/铝/聚乙烯复合药用软膏管 药用低密度聚乙烯膜、袋 注射液用卤化丁基橡胶塞 注射用无菌粉末用卤化丁基橡胶塞 药用合成聚异戊二烯垫片 口服制剂用硅橡胶胶塞、垫片 预灌封注射器组合件(带注射针) 预灌封注射器用硼硅玻璃针管 预灌封注射器用不锈钢注射针 预灌封注射器用氯化丁基橡胶活塞 预灌封注射器用溴化丁基橡胶活塞 预灌封注射器用聚异戊二烯橡胶针头护帽 笔式注射器用硼硅玻璃珠 笔式注射器用硼硅玻璃套筒 笔式注射器用铝盖 笔式注射器用氯化丁基橡胶活塞和垫片 笔式注射器用溴化丁基橡胶活塞和垫片 固体药用纸袋装硅胶干燥剂 包装材料红外光谱测定法 包装材料不溶性微粒测定法 乙醛测定法 加热伸缩率测定法 挥发性硫化物测定法 包装材料溶剂残留量测定法 注射剂用胶塞、垫片穿刺力测定法 注射剂用胶塞、垫片穿刺落屑测定法 玻璃耐沸腾盐酸浸蚀性测定法 玻璃耐沸腾混合碱水溶液浸蚀性测定法 玻璃颗粒在98℃耐水性测定法和分级 砷、锑、铅、镉浸出量测定法 抗机械冲击测定法 直线度测定法 药用陶瓷吸水率测定法 药品包装材料生产厂房洁净室(区)的测试方法 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 标准号 YBB00032005-2015 YBB00012004-2015 YBB00022005-2-2015 YBB00332002-2015 YBB00322005-2-2015 YBB00332003-2015 YBB00302002-2015 YBB00292005-2-2015 YBB00292005-1-2015 YBB00312002-2015 YBB00322003-2015 YBB00062005-2-2015 YBB00032004-2015 YBB00282002-2015 YBB00022004-2015 YBB00272002-2015 YBB00302003-2015 YBB00052004-2015 YBB00362003-2015 YBB00352003-2015 YBB00042004-2015 YBB00282003-2015 YBB00272003-2015 YBB00012005-2-2015 YBB00012005-1-2015 YBB00162005-2015 YBB00152002-2015 YBB00162002-2015 YBB00082005-2015 YBB00092005-2015 YBB00382003-2015 标准名称
32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65
YBB00012002-2015 YBB00022002-2015 YBB00242004-2015 YBB00342002-2015 YBB00102005-2015 YBB00112005-2015 YBB00062002-2015 YBB00072002-2015 YBB00082002-2015 YBB00092002-2015 YBB00102002-2015 YBB00392003-2015 YBB00112002-2015 YBB00122002-2015 YBB00262002-2015 YBB00172004-2015 YBB00132002-2015 YBB00172002-2015 YBB00182002-2015 YBB00192002-2015 YBB00192004-2015 YBB00202004-2015 YBB00212005-2015 YBB00232005-2015 YBB00222005-2015 YBB00182004-2015 YBB00202005-2015 YBB00242002-2015 YBB00372003-2015 YBB00402003-2015 YBB00212004-2015 YBB00132005-2015 YBB00142005-2015 YBB00152005-2015
YBB00012002 YBB00022002 YBB00242004 YBB00342002 YBB00102005 YBB00112005 YBB00062002 YBB00072002 YBB00082002 YBB00092002 YBB00102002 YBB00392003 YBB00112002 YBB00122002 YBB00262002 YBB00172004 YBB00132002 YBB00172002 YBB00182002 YBB00192002 YBB00192004 YBB00202004 YBB00212005 YBB00232005 YBB00222005 YBB00182004 YBB00202005 YBB00242002 YBB00372003 YBB00402003 YBB00212004 YBB00132005 YBB00142005 YBB00152005
代替标准号 YBB00032005 YBB00012004 YBB00022005-2 YBB00332002 YBB00322005-2 YBB00332003 YBB00302002 YBB00292005-2 YBB00292005-1 YBB00312002 YBB00322003 YBB00062005-2 YBB00032004 YBB00282002 YBB00022004 YBB00272002 YBB00302003 YBB00052004 YBB00362003 YBB00352003 YBB00042004 YBB00282003 YBB00272003 YBB00012005-2 YBB00012005-1 YBB00162005 YBB00152002 YBB00162002 YBB00082005 YBB00092005 YBB00382003
低密度聚乙烯输液瓶(试行) 聚丙烯输液瓶(试行) 塑料输液容器用聚丙烯组合盖(拉环式)(试行) 多层共挤输液用膜、袋通则(试行) 三层共挤输液用膜(I)、袋(试行) 五层共挤输液用膜(I)、袋(试行) 低密度聚乙烯药用滴眼剂瓶(试行) 聚丙烯药用滴眼剂瓶(试行) 口服液体药用聚丙烯瓶(试行) 口服液体药用高密度聚乙烯瓶(试行) 口服液体药用聚酯瓶(试行) 外用液体药用高密度聚乙烯瓶(试行) 口服固体药用聚丙烯瓶(试行) 口服固体药用高密度聚乙烯瓶(试行) 口服固体药用聚酯瓶(试行) 口服固体药用低密度聚乙烯防潮组合瓶盖(试行) 药品包装用复合膜、袋通则(试行) 聚酯/铝/聚乙烯药品包装用复合膜、袋(试行) 聚酯/低密度聚乙烯药品包装用复合膜、袋(试行) 双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、袋(试 双向拉伸聚丙烯/真空镀铝流延聚丙烯药品包装用复合膜、 袋(试行) 玻璃纸/铝/聚乙烯药品包装用复合膜、袋(试行) 聚氯乙烯固体药用硬片 聚氯乙烯/低密度聚乙烯固体药用复合硬片 聚氯乙烯/聚偏二氯乙烯固体药用复合硬片 铝/聚乙烯冷成型固体药用复合硬片(试行) 聚氯乙烯/聚乙烯/聚偏二氯乙烯固体药用复合硬片 聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片(试行) 抗生素瓶用铝塑组合盖(试行) 输液瓶用铝塑组合盖(试行) 药品包装用铝塑封口垫片通则(试行) 药用聚酯/铝/聚丙烯封口垫片(试行) 药用聚酯/铝/聚酯封口垫片(试行) 药用聚酯/铝/聚乙烯封口垫片(试行)
