埃索美拉唑杂质分析
埃索美拉唑钠-分析方法

8.1. 试药与试剂:乙醇、正己烷、三乙胺。
埃索美拉唑钠 CTD 申报资料
程》 (Q/SOP ZL059)测定,在系统适用性试验符合上述要求的条件下,取对照 溶液 10μl 注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量 程的 15%,再精密量取供试品溶液和对照溶液各 10μl,分别注入液相色谱仪, 记录色谱图。供试品溶液的色谱图中如有与对映异构体保留时间一致的色谱峰, 其峰面积不得大于对照溶液主峰面积的 0.5 倍(0.5%) 。 8.9. 计算公式:
埃索美拉唑钠 CTD 申报资料
察指标与初始相比,均没有发现明显的变化趋势,放行标准与货架期标准一致。 3.2.S.4.2 分析方法 (1)订入质量标准的分析方法 1 性状
目检:本品应为白色或类白色粉末;无臭;遇光易变色;有引湿性。 2 溶解度
2.1. 试药与试剂:甲醇 2.2. 仪器与设备:秒表、电子分析天平(万分之一) 、容量瓶、量筒、刻度吸管。 2.3. 操作方法: a). 水中溶解度: 精密称取本品 1g,置于 10ml 具塞刻度试管中,加水 1ml,然后于 25℃±2℃ 的水浴条件下每隔 5 分钟强力振摇 30 秒,观察 30 分钟,应完全溶解。 b). 甲醇中的溶解度:
4.1. 试液与试药:0.1mol/L氢氧化钠溶液、溴化钾 4.2. 仪器与用具:紫外-可见分光光度仪、傅里叶变换红外光谱仪、电子分析天 平(十万分之一) 、移液管、刻度吸管、容量瓶、烧杯。 4.3. 操作方法 4.3.1. 取供试品约 15mg,置 100ml 容量瓶中,加 0.1mol/L 氢氧化钠溶液溶解并 稀释至刻度,摇匀,精密量取 5ml 置 50ml 容量瓶中,加 0.1mol/L 氢氧化钠溶液 并稀释至刻度,摇匀,照《紫外-可见分光光度法操作规程》 (Q/SOP ZL062)测 定, 在 276nm 与 305nm 的波长处有最大吸收, 在 256nm 与 281nm 的波长处有最 小吸收。 4.3.2. 取供试品 1~1.5mg、溴化钾约 200~300mg(与供试品的比约为 200:1) , 置玛瑙研钵中,研磨均匀,压制成透明的溴化钾片,将溴化钾片放在红外光谱仪
埃索美拉唑钠中七种残留溶剂的测定

・
l 4 0・
承 德 医 学 源自院 学 报
VO 1 . 3 4 No. 2 2 0 1 7
J 0URNAL 0F CHE NGDE ME DI C AL COL LE GE
更一致的药代动力学 , 使到达质子泵的药物增加 , 抑酸效 果优于其它质子泵药物 。 埃索美拉唑钠合成制备路线[ 3 1 中
强医务 人员、 患者及家属对跌倒的防范意识 , 有效降低跌
倒的发生率。
( 6 / 9 ) ; 观察组 因透析 因素致跌倒4 例, 占该组跌倒人数 的
6 6 . 6 7 %( 4 / 6 ) 。
【 参考 文献】
[ 1 】 孙慧娟 . 血液透析患者跌倒危险的评 估与干预措施【 . I 】 . 护理
埃索美拉唑钠中七种残留溶剂的测定
韩 月, 李成文 , 刘 秀鹏 , 刘 伟
( 德州德药制药有限公司, 山东德州 2 5 3 0 0 0 )
【 关键词】 埃索美拉唑钠 ; 残 留溶剂 ; 顶空气相色谱法
【 中图分类号】 T ( 6
【 文献标识码】 A
【 文章编号] 1 0 0 4 - 6 8 7 9 ( 2 0 1 7 ) 0 2 - 0 1 4 0 - 0 3
[ J ] . 中国医药指南 , 2 0 1 1 , 9 ( 2 ) : 1 0 0 — 1 0 1 .
[ 3 ] 曹瑞颜 , 刘玉清 . 个体化 健康教育对老年维持性血液透析患
等, 可在某种程度上缩短患者寿命 , 降低透 析患者 的生存 质量和透析生存率。 血液透析 患者是跌倒的高危人群 , 主 要与年龄 、 卧床 、 直立性低血压 、 贫血 、 肌 肉痉挛、 肾性 骨 病等危险 因素有关 。 因此 , 运用跌倒风险评估表评估和预
埃索美拉唑杂质列表

Impurity 2
6-8
50mg,100mg
埃索美拉 Esomeprazole 73590-85 10mg,25mg,
3
≥99
唑杂质 3
Impurity 3
-9
50mg,100mg
埃索美拉 Esomeprazole 88546-55 10mg,25mg,
4
≥99
唑杂质 4
Impurity 4
-8
50mg,100mg
埃索美拉唑杂质列表(部分)
序号 产品名称 英文名称
CAS 号
规格
纯度
结构式
埃索美拉 Esomeprazole 37052-78 10mg,25mg,
1
≥99
唑杂质 1
Impurity 1
-1
50mg,100mg
埃索美拉 Esomeprazole 110374-1 10mg,25mg,
2
≥99
唑杂质 2
埃索美拉 Esomeprazole 176质 5
Impurity 5
4-8
50mg,100mg
埃索美拉 Esomeprazole 161796-7 10mg,25mg,
6
≥99
唑杂质 6
Impurity 6
7-6
50mg,100mg
广州隽沐生物主营各种杂质对照品:紫杉醇杂质,莫西沙星杂质,达托霉素杂质,
阿奇霉素杂质,帕拉米韦杂质,克拉霉素磷酸酯杂质,西格列汀杂质,林可霉素
杂质,奥拉帕利杂质,阿加曲班杂质,法莫替丁杂质,他达拉非杂质,厄洛替尼
杂质,替格瑞洛杂质等;并提供 COA、NMR、HPLC、MS、定量核磁等结构确证
图谱。
177 二 8 一 3 八 655
HPLC法测定埃索美拉唑钠的有关物质

HPLC法测定埃索美拉唑钠的有关物质马延;王媛;罗智敏;常春;傅强【摘要】目的:建立HPLC法测定埃索美拉唑钠的有关物质。
方法采用Capcell Pak C18色谱柱,流动相采用0.01 mol · L -1磷酸盐缓冲液(pH=7.6±0.2)4‐乙腈梯度洗脱,流速为1.0 mL · min-1,检测波长为280 nm。
结果在选定的色谱条件下,主成分与各已知杂质分离度良好。
H431/41、H118/87、H168/66、埃索美拉唑钠、H193/61和奥美拉唑硫醚进样量分别在0.8~66.3 ng (r=0.9999)、2.0~59.1 ng(r=0.9995)、1.0~75.6 ng(r=0.9999)、0.5~149.7 ng(r=0.9999)、1.0~74.7 ng(r=1.0000)和1.4~94.8 ng(r=0.9995)范围内,与峰面积呈良好线性关系。
RSD均在0.54%~0.82%范围内,精密度良好。
供试品溶液在室温下不稳定,应临用新配。
结论该法可用于检测埃索美拉唑钠的产品质量。
%Objective To establish an HPLC method for the determination of related substances of esomeprazole sodium .Method The determination was performed on a Capcell Pak C18 column .The mobile phase consistedof acetonitrile and 0 .01 mol · L -1 phosphate buffer(pH=7 .6 ± 0 .2) .The flow rate was 1 .0 mL · min-1 and the detection wavelength was 280nm .Results Related substances were completely separated from the main constituent .H431/41 ,H118/87 ,H168/66 ,esomeprazole sodium ,H193/61 and omeprazole sulfide showed good linearity over the ranges of 0 .8‐66 .3 ng(r=0 .999 9) ,2 .0‐59 .1 ng(r=0 .999 5) ,1 .0‐75 .6 ng (r=0 .999 9) ,0 .5‐149 .7 ng(r=0 .999 9) ,1 .0‐74 .7 ng(r=1 .000 0) and 1 .4‐94 .8 ng(r=0 .999 5) ,respectively .The RSD was 0 .54%‐0 .82% and the precision wassatisfactory .Conclusion The esteblished method can be used for testing the product quality of esomeprazole sodium .【期刊名称】《西北药学杂志》【年(卷),期】2016(000)002【总页数】4页(P154-157)【关键词】埃索美拉唑钠;有关物质;反相高效液相色谱法【作者】马延;王媛;罗智敏;常春;傅强【作者单位】西安交通大学药学院,西安 710061; 西安新通药物研究有限公司,西安 710077;西安新通药物研究有限公司,西安 710077;西安交通大学药学院,西安 710061;西安交通大学药学院,西安 710061;西安交通大学药学院,西安710061【正文语种】中文【中图分类】R927.2埃索美拉唑钠是奥美拉唑的S-异构体,目前已在国内批准上市,主要用于胃食管反流性疾病(GERD)-糜烂性反流性食管炎的治疗[1-2]。
埃索美拉唑钠中有关物质检查方法的研究

F 家 庭 心 理 医 生 a mi l y p s y c h o l o g i c a l d o c t o r
2 0 1 4年 6月第 6期
埃 索 美拉 唑钠 中有 关 物 质 检 查 方 法 的研 究
杨 蕾
( 河 南 辅 仁 医药 科 技 开 发 有 限公 司 河 南 郑 州
Hl 1 8 / 8 7来 源 : US P批 号; 2 一 GHZ一 1 8 4~ 1对 照 品 名 称 :
2 . 3 . 6 氧化 破坏试 验 : 精 密量取 贮备 液 5 ml 置 2 5 ml 量 瓶
H2 1 5 / 0 1来 源 : U S P批号 : 7 一 Az c一 9 4 — 1对 照 品 名 称 : H1 6 8 / 中, 加3 O H2 O2 0 . 2 ml , 混匀 后室 温放 置 0 . 5小 时 后 加 流 动 相 6 6来 源 : US P批号 : T R C一 0 0 1 1 1 2 0 0 5对 照 品 名 称 : H1 9 3 / 6 1来 稀 释 至刻 度 , 摇匀 , 作 为 氧 化 破 坏 样 品溶 液 。精 密 量 取 上 述 溶 液
入 的工 艺 杂 质 和贮 存 过 程 中 可 能 产 生 的 降 解 产 物 , 本 文 采 用 高 液 调 p H 值 至 中性 , 加流动相稀释至刻度 , 摇匀 , 作 为碱 破 坏 样 品
0 g l , 注入液相 色谱 仪 , 记 录 色 谱 图至 主 效液相色谱法 对其有关 物质 及 主要降 解产 物进 行 了研究 , 建 立 溶 液 。精 密 量 取 本 溶 液 2
1 . 1 仪器 : 岛津 L c一2 0 AT v p泵 岛津 s P D一2 0 A VP紫 外 6小 时 , 作 为光照破坏样 品溶 液。精密 量取 上述 溶液 2 O l , 注 入
埃索美拉唑镁肠溶片的质量研究

埃索美拉唑镁肠溶片的质量研究埃索美拉唑镁是治疗酸相关疾病的药物,是第一个单一光学异构体的质子泵抑制剂。
2003年,埃索美拉唑镁肠溶片在中国获得上市批准(商品名:耐信,Nexium),上市的埃索美拉唑镁肠溶片有20 mg和40 mg两种规格。
本课题对方法学进行了再验证并对埃索美拉唑镁肠溶片进行了质量研究。
通过实验,主要得出以下几个结论:本实验对埃索美拉唑镁肠溶片进行了质量研究,分别采用高效液相色谱法对其含量、溶出曲线、有关物质、异构体等进行了检测,结果均符合2015版《中国药典》艾司奥美拉唑镁肠溶片质量标准。
有关物质测定色谱条件:色谱柱:Microspher C18(4.6 mm×100 mm,3μm);流动相A:水-pH7.6磷酸盐缓冲液(每1000 mL中含磷酸二氢钠0.0052 mol、磷酸氢二钠0.0135 mol)-乙腈(80:10:10),流动相B:乙腈-pH7.6磷酸盐缓冲液-水(80:1:19);进样体积:20μL;柱温:35℃;检测波长:302 nm。
流速:1 mL/min。
主药与有关物质D的分离度大于2.5。
空白辅料不干扰有关物质的测定。
埃索美拉唑镁及有关物质线性关系良好;该方法准确,简便,重复性好,可用于埃索美拉唑镁肠溶片的质量控制。
含量、溶出曲线测定色谱条件:色谱柱:Aglient Microspher C18,3.0μm,4.6mm×100 mm;流动相:乙腈-pH7.3磷酸盐缓冲液-水(35:50:15);检测波长:302 nm;进样体积:20μL;流速:1 mL/min;柱温:40℃。
主峰保留时间大于3.5 min。
空白辅料不干扰含量、溶出样品的测定,专属性较好,回收率均在98%~102%之间,符合要求,该方法能够准确测定埃索美拉唑镁肠溶片含量和溶出度。
对映异构体检测色谱条件:流动相:乙腈-磷酸盐缓冲液(pH6.0)-水(150:85:765);色谱柱:CHIRALAPK?AGP(100×4 mm,5μm);检测波长:302 nm;进样体积:20μL;流速:0.6 mL/min;柱温:25℃。
埃索美拉唑杂质分析

埃索美拉唑杂质分析埃索美拉唑是一种常用的抗酸药,主要用于治疗消化性溃疡和胃食管反流病。
在药物制剂中,杂质的含量和性质对药品的质量和安全性起着重要的影响。
因此,对埃索美拉唑及其制剂中的杂质进行分析是非常必要的。
本文将综述埃索美拉唑及其制剂中常见的杂质分析方法。
埃索美拉唑是一种苯并咪唑类的药物,在药物制剂中可能存在着一些有机杂质,如未反应的中间体、有害的附加反应产物等。
此外,制剂中还可能存在着其他药物或化合物的杂质,比如其它药品的残留或降解产物。
因此,对埃索美拉唑及其制剂中常见的杂质进行有效的分析是关键。
分析埃索美拉唑及其制剂中有机杂质的方法主要包括高效液相色谱法(HPLC)和气相色谱法(GC)。
高效液相色谱法是一种常用的分离分析技术,可以对埃索美拉唑及其制剂中的有机杂质进行分离和定量。
常用的分离柱有C18、CN和Phenyl等,流动相可以采用甲醇-水或乙腈-水等。
检测可以选择紫外检测器、荧光检测器等。
气相色谱法主要用于分析挥发性或半挥发性有机杂质,常用的毛细管柱有DB-5、DB-1701等。
埃索美拉唑及其制剂中无机杂质的分析方法包括原子吸收光谱法(AAS)、电感耦合等离子体发射光谱法(ICP-OES)和离子色谱法(IC)。
原子吸收光谱法主要用于分析埃索美拉唑农药残留中的铜、锌、镁、钠等元素。
电感耦合等离子体发射光谱法是一种分析多种元素的方法,可以用于分析埃索美拉唑中的多种有害金属元素。
离子色谱法可以用于分析埃索美拉唑制剂中的阴离子杂质,常用的分离柱有强阴离子交换柱。
除了上述常见的分析方法,还可以利用质谱法、核磁共振法、红外光谱法等对埃索美拉唑及其制剂中的杂质进行分析。
质谱法可以用于分析特定的有机杂质,可以通过测量离子的质量和相对丰度来鉴定杂质的结构。
核磁共振法可以提供关于杂质分子结构和化学环境的信息。
红外光谱法可以用于检测埃索美拉唑及其制剂中的功能性基团和官能团。
综上所述,对埃索美拉唑及其制剂中的杂质进行分析是非常重要的。
埃索美拉唑相关杂质

相关杂质整理列表中文名英文名CAS 号规格纯度结构式埃索美拉唑杂质1EsomeprazoleImpurity 137052-78-110mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质2EsomeprazoleImpurity 2110374-16-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质3EsomeprazoleImpurity 373590-85-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质4EsomeprazoleImpurity 488546-55-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质5EsomeprazoleImpurity 5176219-04-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质6EsomeprazoleImpurity 6161796-77-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质7EsomeprazoleImpurity 7158812-85-210mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质8(异构体混合物)EsomeprazoleImpurity 8(Mixture OfIsomers)125656-82-8&125656-83-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质10Esomeprazole Impurity 102227107-89-110mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质11(异构体混合物)Esomeprazole Impurity 11(Mixture OfIsomers)89352-76-1&784143-42-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质13Esomeprazole Impurity 13151602-49-210mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质14Esomeprazole Impurity 14301669-82-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质15Esomeprazole Impurity 15863029-89-410mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质16Esomeprazole Impurity 162080-75-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质17Esomeprazole Impurity 17125656-82-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质18Esomeprazole Impurity 18125656-83-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质19Esomeprazole Impurity 191803449-15-1&301669-82-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质20Esomeprazole Impurity 2074409-42-010mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质21Esomeprazole Impurity 2186604-79-710mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质22Esomeprazole Impurity 2286604-80-010mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质23Esomeprazole Impurity 2396-96-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质24Esomeprazole Impurity 24695-98-710mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质25Esomeprazole Impurity 25102-51-210mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质26Esomeprazole Impurity 2686604-78-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质27Esomeprazole Impurity 27617-94-710mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质28Esomeprazole Impurity 28220757-74-410mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质29Esomeprazole Impurity 29704910-89-410mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质32Esomeprazole Impurity 3291219-90-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质33Esomeprazole Impurity 33577-72-010mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质34Esomeprazole Impurity 34614-94-8&615-05-410mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质35Esomeprazole Impurity 35610-81-110mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质36Esomeprazole Impurity 36615-72-510mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质37Esomeprazole Impurity 3792806-98-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质38Esomeprazole Impurity 38848694-10-010mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质39Esomeprazole Impurity 39143016-68-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质40Esomeprazole Impurity 40153476-68-710mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质41Esomeprazole Impurity 41220771-03-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质44Esomeprazole Impurity 44317807-10-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质45Esomeprazole Impurity 45103876-98-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质46Esomeprazole Impurity 4673590-58-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质47(奥美拉唑)EsomeprazoleImpurity 47(Omeprazole)89352-76-110mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质48Esomeprazole Impurity 48784143-42-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质54Esomeprazole Impurity 54142885-88-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质55Esomeprazole Impurity 551424857-66-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质56Esomeprazole Impurity 561424857-86-210mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质57Esomeprazole Impurity 571424857-83-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质58Esomeprazole Impurity 581424857-95-3(freebase)10mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质59Esomeprazole Impurity 59848694-09-7(free base)10mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质60Esomeprazole Impurity 6020734-76-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质61Esomeprazole Impurity 6123165-60-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质62Esomeprazole Impurity 62142885-95-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质63Esomeprazole Impurity 63149082-03-110mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质64Esomeprazole Impurity 6473590-93-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质65Esomeprazole Impurity 6549559-83-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质66Esomeprazole Impurity 66142885-92-510mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质67Esomeprazole Impurity 671803449-02-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质72Esomeprazole Impurity 721080689-87-710mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质75Esomeprazole Impurity 75208-75-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质81Esomeprazole Impurity 8137466-89-0&878769-98-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质83Esomeprazole Impurity 8384006-10-010mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质84Esomeprazole Impurity 8480-15-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质86Esomeprazole Impurity 86100-66-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质87Esomeprazole Impurity 8790-04-010mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质88Esomeprazole Impurity 8899-59-210mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质89Esomeprazole Impurity 8991168-31-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质90Esomeprazole Impurity 90104-94-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质93Esomeprazole Impurity 93220770-99-0(base)10mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质94Esomeprazole Impurity 94106135-28-810mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质95Esomeprazole Impurity 95125656-80-610mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质96Esomeprazole Impurity 96110464-72-710mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质99Esomeprazole Impurity 991831938-48-7&1384163-92-110mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质106Esomeprazole Impurity 1064887-80-310mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质112Esomeprazole Impurity 112109371-19-910mg-25mg-50mg-100mg ≥99%埃索美拉唑杂质114Esomeprazole Impurity 114727375-13-510mg-25mg-50mg-100mg ≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD 、LGC 、TLC 、EP 、USP 、TRC 等多个品牌产品,提供上万种标准品对照品,真诚为您服务。
埃索美拉唑钠原料药质量标准的研究

埃索美拉唑钠原料药质量标准的研究
埃索美拉唑钠是奥美拉唑的S型异构体的钠盐,它是世界上第一例经分离得到的单一光学异构体药物,也属于质子泵抑制剂(Proton Pump Inhibitors,PPIs),主要用于与胃酸相关疾病的治疗。
随着合成技术的改进和产业化的进步,埃索美拉唑钠的合成工艺路线不断改进,国内仿制原料药的品质也不断提高,而相应的检测方法没有随之进行相应的完善,为了更好地服务制药企业,便于产业化的顺利进行,原料药的质量标准需进一步提高。
本文对埃索美拉唑钠的原料药样品,在有机溶剂残留、有关物质的种类分析及埃索美拉唑钠原料药含量测定方法等方面进行了系统研究,拟定了埃索美拉唑钠原料药质量标准(草案),为国内原料药产业化过程中的质量监管提供了一定的实验基础。
目的:研究埃索美拉唑钠原料药有机溶剂残留、有关物质和埃索美拉唑钠含量测定的方法,并据此建立埃索美拉唑钠原料药的质量标准。
方法:采用顶空气相色谱法研究了原料药样品中有机溶剂残留测定的方法;采用高效液相色谱法,对样品的有关物质及埃索美拉唑钠的含量进行了研究。
结果:对于三批次埃索美拉唑钠原料药样品,采用顶空进样气相色谱法均未检测出残留有机溶剂;采用本文建立的高效液相色谱法对三批次样品进行有关物质的检测,均在标准限度之内;采用所建立的高效液相色谱法检测三批次埃索美拉唑钠含量均>98.5%。
结论:所建立的有机溶剂残留、有关物质及埃索美拉唑钠含量的分析方法,具有准确性好,精密度高,耐受性较好等优点。
并在此基础上拟定了埃索美拉唑钠原料药的质量标准草案。
埃索美拉唑杂质列表集

中文名称 埃索美拉唑
英文名称 Esomeprazole
CAS 161796-78-7
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
埃索美拉唑杂质1 Esomeprazole Impurity 37052-78-1 1
10mg 25mg 50mg 100mg 更大规格请咨询
志 -064- 维酸钾杂质,红霉素杂质,克拉霉素杂质,林可霉素杂质,罗红霉素杂质,克林霉素杂质,恩曲他滨杂质,艾地那非;
康
-3157 瑞卢戈利杂质,艾康氟康唑杂质等;并提供COA、NMR、HPLC、MS等结构确证图谱;详情请点 用户名 ,谢谢!
扬信医药专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/ STD 等品牌。
项目报批 纯度高于98%
Esomeprazole Impurity
埃索美拉唑杂质4
88546-55-8
4
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
唐 1814- 扬信医药 代理各品种杂质对照品:舒更葡糖钠杂质,达托霉素杂质,依维莫司杂质,他克莫司杂质,阿奇霉素杂质,克拉
项目报批 纯度高于98%
埃索美拉唑杂质2 Esomeprazole Impurity 110374-16-8 2
10mg 25mg 50mg 100mg 更大规格请咨询
ቤተ መጻሕፍቲ ባይዱ
项目报批 纯度高于98%
埃索美拉唑杂质3 Esomeprazole Impurity 73590-85-9 3
埃索美拉唑杂质分析

埃索美拉唑杂质分析埃索美拉唑杂质谱研究目录一、简介二、文献报道三、实验方法四、杂质谱分析一、简介埃索美拉唑(Esomeprazole,1),化学名为5-甲氧基-2-((S)-((4-甲氧基-3,5-二甲基-2- 吡啶基)甲基)亚硫酰基)-1H-苯并咪唑。
是一种质子泵抑制剂,通过抑制胃壁细胞的H+/K+-ATP酶来降低胃酸分泌,防止胃酸的形成。
二、文献报道1的合成报道很多,文献报道的方法主要有以下3种:?是采用手性拆分试剂的方法对消旋体奥美拉唑进行拆分,但是传统的拆分方法很难有效的对奥美拉唑自由碱进行拆分,而且这种方法会浪费l,2的奥美拉唑原料;?是采用生物化学的方法,使用生物酶来对奥美拉唑硫醚进行氧化或者对奥美拉唑砜进行还原,得到奥美拉唑的单一对映体,但是这种方法需要专门的实验装置和实验方法,过于繁琐和麻烦;?是采用不对称氧化的方法,使用手性的辅基或者催化剂制备用2-巯基-5-甲氧基-1H-苯并咪唑和2-氯甲基-3,5-二甲基-4-甲氧基吡啶在碱作用下缩合生成5-甲氧基-2-[(3,5-二甲基-4-甲氧基-2-吡啶基)甲硫基]-1-苯并咪唑,再经氧化得1。
运用不对称氧化技术合成埃索美拉唑更加符合绿色化学和原子经济性原则,工艺也已非常成熟。
关键中间体和所需的辅助原料价格都比较便宜而且极易获得。
其中间体硫醚的合成方法较多:傅建渭等(傅建渭,陶兴法,傅诏娟,王井明.中国医药工业杂志[J],2007,38(2):78)在硝化制得2,3,5-三甲基-4-硝基吡啶-N-氧化物后,不经甲氧基化反应,直接在乙酐中重排,再经盐酸水解得2-羟甲基-3,5-二甲基-4-硝基吡啶(4),4与氯化亚砜反应得2-氯甲基-3,5-二甲基-4-硝基吡啶盐酸盐(5),5和2-巯基-5-甲氧基苯并眯唑在甲醇钠参与下缩合成硫醚,同时4-硝基被甲氧基取代,得5-甲氧基-2-[(4-甲氧基-3,5-二甲基吡啶-2-基)甲硫基]-1-苯并咪唑(6)。
注射用埃索美拉唑钠-分析方法
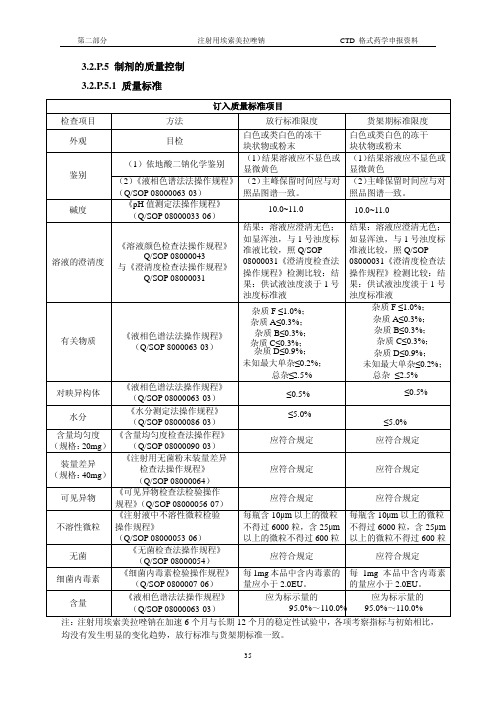
3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准均没有发生明显的变化趋势,放行标准与货架期标准一致。
3.2.P.5.2 分析方法(1)订入标准的分析方法1 性状目检:本品为白色或类白色的冻干块状物或粉末。
2 鉴别2.1. 试药与试剂:硫酸镍、氨试液、丁二酮肟、乙醇、乙二胺四醋酸二钠2.2. 仪器与设备:电子分析天平(万分之一)、高效液相色谱仪。
2.3. 操作方法:a). 依地酸二钠的鉴别:取供试品1瓶,加水5ml使溶解,作为供试品溶液。
取0.008%硫酸镍溶液1ml,加供试品溶液0.5ml,摇匀,加1mol/L氨试液1ml,摇匀,加1%丁二酮肟乙醇溶液1ml,摇匀,放置1分钟,结果溶液应不显色或显微黄色。
另取0.03%乙二胺四醋酸二钠溶液与水各0.5 ml(0.5ml),分别作为阳性对照溶液和空白溶液,同法操作,结果空白溶液应显粉红色。
b). HPLC保留时间法:在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间与对照品溶液主峰的保留时间一致。
3 碱度3.1. 试剂与试液:硼砂标准缓冲液、氢氧化钙标准缓冲液。
3.2. 仪器与用具:旋光仪、电子分析天平、容量瓶。
3.3. 操作方法:取供试品1瓶,加0.9%氯化钠注射液5.2 ml使溶解,照Q/SOP 08000033《pH值测定法操作规程》检测,即得。
3.4. 限度:pH值应为10.0~11.0。
4 溶液的澄清度4.1. 操作方法取可见异物项下的供试品溶液,照Q/SOP 08000043《溶液颜色检查法操作规程》与Q/SOP 08000031《澄清度检查法操作规程》检测。
结果:溶液应澄清无色;如显浑浊,与1号浊度标准液比较,照Q/SOP 08000031《澄清度检查法操作规程》检测比较。
结果:供试液浊度淡于1号浊度标准液5 有关物质5.1. 试剂与试液:乙腈、磷酸氢二钠、氢氧化钠、磷酸。
5.2. 仪器与用具:电子分析天平、移液管、容量瓶、十八烷基硅烷键合硅胶柱、高效液相色谱仪。
注射用埃索美拉唑钠中杂质的检查及控制

( 1 .Z h e j i a n g J o l l y P h a r ma c e u t i c a l C o .L t d . , Hu z h o u 3 1 3 2 0 0 , C h i n a ; 2 .Ha n g z h o u H e x o C h e m t e e h C o . , L t d . , H a n g z h o u 3 1 0 0 1 2 , C h i n a )
摘要 : 目的: 建立注射用埃索荚拉唑钠 中杂质 的检 查方法 , 并确定杂质的结构及有关物质 方法学研究 。 方法 : 采 用高效液相色谱法 对注射 用埃索美拉 唑钠 的杂质 的系统适 应性 、 限度检 查及方法学 验证 ; 采用 A g i l e n t 1 2 6 0 商做 液相谱仪 ( G I 3 1 5 D检 测器 ) ; 色 谱
第 3期
秦 序锋 , 等: 注射用埃索美拉唑钠 中杂质 的检查及控 制
・ 2 1・
注 射 用 埃 索 美 拉 唑 钠 中 杂 质 的 检 查 及 控 制
秦序锋 , 王开颖 , 方明春 , 胡小兰
( 1 . 浙江佐力 药业 股份有限公 司 , 浙江 湖州 2 . 杭州 和素化学技 术有限公 司 , 浙江 杭州 3 1 3 2 0 0 3 1 0 0 1 2 )
s o d i u m p e a k w e r e e f e c t i v e l y s e p a r a t e d wh e n t h e s a mp l e w a s f o e c e d d e s t r u c t i o n,n o ma t t e r c h a n g e t h e p r o p o r t i o n o f mo b i l e
注射用埃索美拉唑钠-分析方法

3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准均没有发生明显的变化趋势,放行标准与货架期标准一致。
3.2.P.5.2 分析方法(1)订入标准的分析方法1 性状目检:本品为白色或类白色的冻干块状物或粉末。
2 鉴别2.1. 试药与试剂:硫酸镍、氨试液、丁二酮肟、乙醇、乙二胺四醋酸二钠2.2. 仪器与设备:电子分析天平(万分之一)、高效液相色谱仪。
2.3. 操作方法:a). 依地酸二钠的鉴别:取供试品1瓶,加水5ml使溶解,作为供试品溶液。
取0.008%硫酸镍溶液1ml,加供试品溶液0.5ml,摇匀,加1mol/L氨试液1ml,摇匀,加1%丁二酮肟乙醇溶液1ml,摇匀,放置1分钟,结果溶液应不显色或显微黄色。
另取0.03%乙二胺四醋酸二钠溶液与水各0.5 ml(0.5ml),分别作为阳性对照溶液和空白溶液,同法操作,结果空白溶液应显粉红色。
b). HPLC保留时间法:在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间与对照品溶液主峰的保留时间一致。
3 碱度3.1. 试剂与试液:硼砂标准缓冲液、氢氧化钙标准缓冲液。
3.2. 仪器与用具:旋光仪、电子分析天平、容量瓶。
3.3. 操作方法:取供试品1瓶,加0.9%氯化钠注射液5.2 ml使溶解,照Q/SOP 08000033《pH值测定法操作规程》检测,即得。
3.4. 限度:pH值应为10.0~11.0。
4 溶液的澄清度4.1. 操作方法取可见异物项下的供试品溶液,照Q/SOP 08000043《溶液颜色检查法操作规程》与Q/SOP 08000031《澄清度检查法操作规程》检测。
结果:溶液应澄清无色;如显浑浊,与1号浊度标准液比较,照Q/SOP 08000031《澄清度检查法操作规程》检测比较。
结果:供试液浊度淡于1号浊度标准液5 有关物质5.1. 试剂与试液:乙腈、磷酸氢二钠、氢氧化钠、磷酸。
5.2. 仪器与用具:电子分析天平、移液管、容量瓶、十八烷基硅烷键合硅胶柱、高效液相色谱仪。
HPLC法测定注射用埃索美拉唑钠的含量

HPLC法测定注射用埃索美拉唑钠的含量杨林;戴芸【摘要】目的:建立反相高效液相色谱法测定注射用埃索美拉唑钠含量的方法.方法:采用Diamonsil C18色谱柱(4.6mm×150mm,5μm),流动相为20mM K2HPO4缓冲液(pH值6.86)-甲醇(35:65,V/V),流速为1 mL· min-1,检测波长为302nm.结果:埃索美拉唑钠的线性范围为50~200μg·mL-1,r=0.9997,平均回收率99.2%,RSD=0.6%(n=9).结论:该方法快速、简便、准确,适用于注射用埃索美拉唑钠的含量测定.【期刊名称】《化学工程师》【年(卷),期】2016(030)001【总页数】3页(P31-32,4)【关键词】HPLC;埃索美拉唑钠;注射;含量测定【作者】杨林;戴芸【作者单位】黄石市中心医院(湖北理工学院附属医院)药学部,湖北黄石435000;肾脏疾病发生与干预湖北省重点实验室,湖北黄石435000;黄石市中心医院(湖北理工学院附属医院)药学部,湖北黄石435000;肾脏疾病发生与干预湖北省重点实验室,湖北黄石435000【正文语种】中文【中图分类】R917质子泵抑制剂(proton pump inhibitor,PPI)在临床上主要应用于治疗酸相关性疾病,主要包括溃疡病、胃食管反流病(GERD)和胃泌素瘤的治疗[1]。
第一个PPI——奥美拉唑(omeprazole,OPZ)于1988年上市[2,3]。
OPZ是两种光学异构体的消旋混合物(S-奥美拉唑和R-奥美拉唑),其中S-奥美拉唑被称为埃索美拉唑(esomeprazole),是第一个发展为异构体的PPI,主要用于治疗GERD、幽门螺杆菌(HP)阳性的消化性溃疡及与胃酸有关的消化系统紊乱性疾病,其血药浓度和生物利用度比奥美拉唑或R-奥美拉唑,且抑酸作用更强[4,5]。
本文建立了测定注射用埃索美拉唑钠含量的高效液相色谱法,方法专属性好,灵敏度高,快速准确。
注射用埃索美拉唑钠CTD案例点评分析整理稿

注射用埃索美拉唑钠CTD案例点评分析整理稿3.2.P.1 剂型及产品组成1.标明了辅料种类、作用及执行标准。
2.灌装时增加4%装量以抵消复溶时的损失。
3.说明了包装材料及容器。
4.不足:建议列出辅料型号和百分比。
3.2.P.2.1 处方组成1.考察了原料药的溶解性与稳定性,列出FDA公布的耐信处方,进行了原辅料相容性试验。
2.不足:产品开发目标缺失;埃索美拉唑钠的吸湿性?埃索美拉唑钠溶液稳定性——温度的影响?问号处内容缺失。
3.2.P.2.2 制剂研究1.在处方开发过程中,考察了甘露醇用量、依地酸二钠/依地酸钠钙、依地酸二钠的用量(0.10mg、0.15mg),pH=11.0相关内容,以性状、有关物质、水分、复溶后性状为考察指标,同时用两个批次对照药品进行比对。
2.本品小试、注册批的处方一致,不存在过量投料。
3.本品与耐信质量对比—等同。
4.制剂相关特性研究方面,结合对照药品,考察了碱度(5.2ml 0.9%氯化钠注射液复溶)、临床使用时的渗透压、复溶(澄清度、复溶时间)、有关物质、对映异构体等,项目比较齐全。
不足:5.在P.2.1.1中说明埃索美拉唑钠遇光易变色,试验发现本品光照10天后性状变为淡绿色,原研产品光照10天后是否与本品发生相同变化?—数据?这些均应考察。
6.不同用量依地酸二钠处方各项指标没有差异,没有说明为什么要加依地酸二钠?配伍后输液中金属离子可能会使药物产生不溶性微粒,继而发生沉淀,故需加依地酸二钠来控制金属离子水平,此项应在配伍后考察,检查项目应为不溶性微粒水平。
7.潜在的降解产物没有考察,配伍后室温放置下形成的杂质?8.原研产品两批生产日期仅相差3个月,刚出厂与接近有效期的批次比较更能说明问题。
3.2.P.2.3 生产工艺的开发1.选择常规冻干工艺,进行工艺研究,包括:a.药液配制,考察了药液pH值控制、药液的温度、是否需要氮气保护、活性炭用量、原辅料的加入顺序等;b.除菌过滤,考察了滤材选择;c.冷冻干燥,考察了预冻方式和温度、升华升温速率和温度、真空度、解析干燥的温度上限等;d.包装,提供了小试工艺和放大生产工艺,总结了生产工艺和生产设备的变化,随批量规模增加,生产地点、生产设备随之改变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
埃索美拉唑杂质谱研究目录一、简介二、文献报道三、实验方法四、杂质谱分析一、简介埃索美拉唑(Esomeprazole,1),化学名为5-甲氧基-2-((S)-((4-甲氧基-3,5-二甲基-2- 吡啶基)甲基)亚硫酰基)-1H-苯并咪唑。
是一种质子泵抑制剂,通过抑制胃壁细胞的H+/K+-ATP酶来降低胃酸分泌,防止胃酸的形成。
二、文献报道1的合成报道很多,文献报道的方法主要有以下3种:①是采用手性拆分试剂的方法对消旋体奥美拉唑进行拆分,但是传统的拆分方法很难有效的对奥美拉唑自由碱进行拆分,而且这种方法会浪费l/2的奥美拉唑原料;②是采用生物化学的方法,使用生物酶来对奥美拉唑硫醚进行氧化或者对奥美拉唑砜进行还原,得到奥美拉唑的单一对映体,但是这种方法需要专门的实验装置和实验方法,过于繁琐和麻烦;③是采用不对称氧化的方法,使用手性的辅基或者催化剂制备用2-巯基-5-甲氧基-1H-苯并咪唑和2-氯甲基-3,5-二甲基-4-甲氧基吡啶在碱作用下缩合生成5-甲氧基-2-[(3,5-二甲基-4-甲氧基-2-吡啶基)甲硫基]-1-苯并咪唑,再经氧化得1。
运用不对称氧化技术合成埃索美拉唑更加符合绿色化学和原子经济性原则,工艺也已非常成熟。
关键中间体和所需的辅助原料价格都比较便宜而且极易获得。
其中间体硫醚的合成方法较多:傅建渭等(傅建渭,陶兴法,傅诏娟,王井明.中国医药工业杂志[J],2007,38(2):78)在硝化制得2,3,5-三甲基-4-硝基吡啶-N-氧化物后,不经甲氧基化反应,直接在乙酐中重排,再经盐酸水解得2-羟甲基-3,5-二甲基-4-硝基吡啶(4),4与氯化亚砜反应得2-氯甲基-3,5-二甲基-4-硝基吡啶盐酸盐(5),5和2-巯基-5-甲氧基苯并眯唑在甲醇钠参与下缩合成硫醚,同时4-硝基被甲氧基取代,得5-甲氧基-2-[(4-甲氧基-3,5-二甲基吡啶-2-基)甲硫基]-1-苯并咪唑(6)。
万欢等(万欢,方峰,段梅莉,许煦,冀亚飞.华东理工大学药学院化工学院.应用化学V01.26 No.2 Feb.2009)用化合物2,3,5-三甲基吡啶为原料采用一锅煮的方法制得2,3,5-三甲基-4-硝基吡啶-N-氧化物(4)后,先不进行甲氧基化、乙酰化重排、水解和氯化反应,而直接与三氯异氰尿酸(TCCA)进行氯化反应得到关键中间体2-氯甲基-3,5-二甲基-4-硝基吡啶-N-氧化物(5);在过量甲醇钠作用下化合物(5)与2-巯基-5-甲氧基苯并咪唑(6)同时完成缩合与甲氧基化反应,高收率得到5-甲氧基-2-(4-甲氧基-3,5-二甲基吡啶-N-氧化物)-甲硫基]-1H-苯并咪唑(7)。
武卫等(武卫,唐磊,邓银来,顾维,张荣久.奥美拉唑磺酰化物的制备. 江苏吴中苏药医药开发有限责任公司,南京)在500ml三颈圆底烧瓶,烧瓶内加入苯并咪唑物、去离子水,NaOH,和乙醇,,搅拌溶解后加入氯甲基物,加热搅拌回流。
反应完毕,冷却,过滤,滤液用乙酸调至pH=8-9,加入去离子水适量,用乙酸乙酯萃取次,合并有机层,水洗,无水Na2SO4干燥。
过滤,滤液减压蒸馏,剩余物用乙酸乙酯重结晶得米黄色固体硫醚。
NOCl2-Chloromethyl-4-methoxy-3,5-dimethyl-pyridineHNSHO5-Methoxy-1H -benzoimidazole-2-thiol+HNSONO5-Methoxy-2-(4-methoxy-3,5-dimethyl-pyridin-2-ylmethanesulfinyl)-1H -benzoimidazole Cl三、实验方法我们在第③种方法得基础上,采用不对称氧化的方法,使用手性的辅基或者催化剂制备,用2-巯基-5-甲氧基-1H-苯并咪唑和2-氯甲基-3,5-二甲基-4-甲氧基吡啶在碱作用下缩合生成5-甲氧基-2-[(3,5-二甲基-4-甲氧基-2-吡啶基)甲硫基]-1-苯并咪唑,再经氧化得1。
NOCl2-Chloromethyl-4-methoxy-3,5-dimethyl-pyridineHNSHO5-Methoxy-1H -benzoimidazole-2-thiol+N HNSNO5-Methoxy-2-(4-methoxy-3,5-dimethyl-pyridin-2-ylmethanesulfinyl)-1H -benzoimidazoleN HNSONOO 5-Methoxy-2-(4-methoxy-3,5-dimethyl-pyridin-2-ylmethanesulfinyl)-1H -benzoimidazole四、杂质谱分析埃索美拉唑合成中仅最后一步不对称氧化与奥美拉唑不同,其余反应一样,且最后一步虽反应不同,但产生杂质却相同,所以对奥美拉唑杂质进行研究。
1. 原料:Omeprazole Imp. A (EP):化学名5-Methoxy-1H-benzimidazole-2-thiol ,是合成奥美拉唑中间体奥美拉唑硫醚的一个原料。
该方法的具体步骤为:500ml三颈圆底烧瓶1只,安装搅拌轮,100。
C温度计和加液管置于恒温水槽中。
烧瓶内加入苯并咪唑物(5-Methoxy-1H-benzimidazole-2-thiol)26.8g()、去离子水30ml、NaOH6.0g和乙醇200ml,搅拌溶解后加入氯甲基物(2-Chloromethyl-4-methoxy-3,5-dimethylpyridine hydrochloride)33.3g(),加热搅拌回流3h。
反应完毕,冷却,过滤,滤液用乙酸调至pH=7,加入去离子水适量,用乙酸乙酯萃取4次,合并有机层,水洗,无水Na2SO4干燥。
过滤,滤液减压蒸馏,剩余物用乙酸乙酯重结晶得米黄色固体,即奥美拉唑硫醚。
(李鸿运.奥美拉唑合成工艺研究.哈尔滨商业大学学报(自然科学版),2006).本实验所用方法与其所用方法与其相似,但有所改进,将氢氧化钠得使用量加大3倍,用乙酸调PH=8~9。
所以反应中可能有原料苯并咪唑物与氯甲基物残留。
氯甲基物在萃取过程中可以完全去除,而苯并咪唑物则有较大残留,应进行研究。
2.中间体:Omeprazole Imp. C (EP):化学名5-Methoxy-2-[[(4-methoxy-3,5-dimethylpyridin-2-yl)methyl]-sulphanyl]-1H-benzimidazole ,即奥美拉唑硫醚,又名Ufiprazole。
为本反应的重要中间体,由其进行氧化即可得奥美拉唑。
具体步骤为:在装有机械搅拌器、恒压滴液漏斗、温度计的500mL三口瓶中加入奥美拉唑硫醚(16.5g,0.05mo1)和二氯甲烷(140mL),在一l0℃下滴人m-CPBA(10.5g,的二氯甲烷(66mL)溶液,约1h,加毕再于-10℃下搅拌反应。
向反应液中加入水(7mL),再用10%NaOH溶液调pH为~11,分去水层。
有机层再加水(70mL),并用l0%NaOH溶液调pH为13,分去有机层。
水层中加入二氯甲烷(3mL),搅拌下加入乙酸铵溶液调pH为。
分出二氯甲烷层。
用无水硫酸钠干燥,减压浓缩,残留物用丙酮重结,过滤,室温真空干燥得产品奥美拉唑。
(武卫,唐磊,邓银来,顾维,张荣久.奥美拉唑磺酰化物的制备. 江苏吴中苏药医药开发有限责任公司,南京).本实验使用该方法制备奥美拉唑,产品中检测到硫醚,所以对该杂质应进行研究。
3.副产物:Omeprazole Imp. D (EP):化学名5-Methoxy-2-[[(4-methoxy-3,5-dimethylpyridin-2-yl)methyl]-sulphonyl]-1H-benzimidazole ,即Omeprazole Sulphone奥美拉唑砜。
Omeprazole Imp. I(EP) 化学名4-Methoxy-2-[[(5-methoxy-1H-benzimidazol-2-yl)sulphonyl]methyl]-3,5-dimethylpyridine 1-Oxide,即奥美拉唑砜N-氧化物(Omeprazole Sulphone N-Oxide)这两个杂质为硫醚氧化为奥美拉唑时滴加温度,滴加速度,反应时间,氧化剂用量等原因导致过度氧化形成,可以检测到,应进行研究。
(郝玲花,李薇,魏金钊,陈帅,吴松.奥美拉唑产品中二种杂质的制备. 中国医药工业杂志.2009 ,40(2))4.降解产物:Omeprazole Imp. F (EP),Omeprazole Imp. G (EP),这两个杂质应为奥美拉唑的酸降解产物,从欧洲药典中所述可以看出,其在奥美拉唑原料中可能出现,但在奥美拉唑成盐之后则不在其必须研究杂质之列,说明该物质成盐后呈碱性,不会再发生酸降解,我们实验所得的为埃索美拉唑的钠盐,且反应过程中并没有酸性环境,所以这两个物质并不需要进行研究。
欧洲药典(European Pharmacopeia ,缩写为EP)共列出其杂质9个。
奥美拉唑及其九个杂质分别为:Omeprazole Imp. G (EP) Omeprazole Imp. H(EP)NNH SOO NOOONNHSONOOOmeprazole Imp. I(EP)4-Methoxy-2-[[(5-methoxy-1H-benzimidazol-2-yl)sulphonyl]methyl]-3,5-dimethylpyridine 1-OxideOmeprazole以上为奥美拉唑合成中产生的杂质,其中一些杂质由于实验方法和过程得不同,并不会出现在我们的实验产品中,所以不用进行研究,现对其进行分析:1.Omeprazole Imp. B (EP):化学名:2-[(RS)-[(3,5-Dimethylpyridin-2-yl)methyl]sulphinyl]-5-methoxy-1H-benzimidazole,是另一种方法所产生的副产物,该方法使用2-氯甲基-3,5-二甲基-4-硝基吡啶-N-氧化物与苯并咪唑物进行反应,在甲醇钠进行取代时未反应完全会产生该杂质,(颜国和,王飞武.奥美拉唑合成路线图解[J].中国医药工业杂志,1991,2 2( 6 ) :2 83-28)本反应与其使用方法不同,反应历程也不相同,最终结果未检测到该杂质,所以不对该杂质进行研究。
2.Omeprazole Imp. E(EP):化学名4-Methoxy-2-[[(R,S)-(5-methoxy-1Hbenzimidazol-2-yl)-sulphinyl]methyl]-3,5-dimethylpyridine 1-Oxide,同为使用2-氯甲基-3,5-二甲基-4-硝基吡啶-N-氧化物与苯并咪唑物进行反应后,用三氯化磷除去N上的氧未反应完全的产物。
