钒 2
2 钒的性质

七、钒的毒性
课后作业
• 1、书54页1题 • 2、钒的钠盐种类及其主要性质有哪些? • 3、钒的铵盐种类及其主要性质有哪些?
四、钒卤化合物性质
• 1、低价卤化物有强烈的还原性,高价卤化 物有强的氧化性; • 2、五价钒无碘化物; • 3、二价钒无卤氧化物。
五、钒的其它二元非金属化合物
名称
碳化物
分子式
V2C VC VN V3Si V5Si3 VSi2
颜色
暗黑 暗黑 灰紫
熔点,℃
2200 2830 2050 1350 2150 1750
• 3.钒的铵盐 • 偏钒酸铵(NH4VO3)是白色或带淡黄色的结晶粉末,在水中 的溶解度较小,20℃时为0.48g/100g水,50℃时为 1.78g/100g水,随温度升高而增大,在真空中加热到135℃ 开始分解,超过210℃时分解生成V2O4和V2O5。
温度/℃ 250 250 340 气氛 分解产物 V2O5 (NH4)2O· 3V2O5 (NH4)2O· V2O4· 5V2O5 空气665 5.649 6.04 5.67 4.8 4.7
结构
立方 立方 立方 立方 六方 六方
氮化物 硅化物
硫化物
V3S VS V5S4 V3S5 V2S3 VS4
黑 棕黑 黑 黑 灰黑 黑
825~950,相变 600,相变 700,歧化 450,分解 850-950,分解 500,分解
钒的性质
资源与环境工程学院 丁满堂
复习上次课的内容
• 钒钛的应用及发展方向
本次课重点内容
• 钒的氧化物的性质及其作用 • 钒酸盐的种类及其主要性质
一、钒及其化合物主要性质
• 钒是一种单晶金属,呈银灰色,具有体心立方 晶格,在1550℃和-28~-38℃时有多晶转变。 高熔点难熔金属,在低温时有良好的耐腐蚀性。 纯钒具有良好的延展性和可锻性,在常温下可 制成片、丝和箔。钒呈弱顺磁性,是电的不良 导体。钒的力学性能取决于它的纯度。少量的 杂质,如氧、氮、碳、氢可提高钒的硬度和抗 拉强度,但降低了它的延展性。 • 常温下钒的化学性质较稳定,但在高温下能与 碳、硅、氮、氧、硫、氯、溴等大部分非金属 元素生成化合物。
第一章 钒的基础知识2

正方 兰黑 4.2~4.4 斜方 橙黄 3.357
1、一氧化物(VO或V2O2)
物理性质: —浅灰色带有金属光泽的晶体粉末
—是非整比氧化物,组成为VO0.94-1.12
—固体具有氯化钠型晶体结构,即属离子型的 —具有较高的导电性 化学性质: —具有碱性氧化物的性质,不溶于水,能溶解于酸中生成强 还原性的紫色钒盐[V(H2O)6 ]2+ 离子。 —在空气中和水中不稳定,容易氧化成V2O3。 —在真空中它发生歧化反应生成金属钒和V2O3。 制备:用氢在1700℃下还原V2O5或V2O3制得。
件有关,含碳较高的矿层钒含量较高,以硅质页岩为主的矿层品位较
低。 ⑹有机基原料矿床:钒与其它有机化合物形成络合物。如高硫石油、
沥 青 质 岩 等 , 通 常 中 东 的 原 油 V2O5 含 量 20 ~ 150g/t , 有 的 高 达
300~400g/t。因此,这些有机燃油的渣、灰及脱硫用的废催化剂等 含有大量的钒,有的还含有钼、镍等二次资源,可作为提钒的重要原
第一章 钒的基础知识
29
教学要求:
1、了解钒制备的发展史,钒及其化合物的
用途。
2、掌握钒矿物及其主要性质,钒的生产方法。
重点:钒矿物的主要性质,钒的生产方法。
一、世界钒的发展历史
钒(V),呈银灰色,原子序数为23,原子量为50.942,在元素周期 表中属VB族,具有体心立方晶格。
钒提取技术2

一、石煤提钒工艺
2. 钙化焙烧一碳酸氢铵浸出一离子交换工艺
同传统的钠化焙烧相比,钙法焙烧的优缺点: 优点: (1)用钙盐(石灰、石灰石)替代食盐,完全消除了钠法焙烧工艺的含HCl、Cl2等有毒 有害气体的废气污染问题。 (2)焙烧过程添加的钙盐(5%左右),基本都和浸出过程的硫酸反应生成少量的硫酸钙 沉淀,工艺水中的水溶性离子含量低,利于工艺水的循环利用,每生产一吨五氧化二钒产品, 外排或需处理的工艺废水仅为60m3左右,为加盐焙烧提钒工艺的五分之一; (3)焙烧料为低酸浸出(配酸浓度1~2%,硫酸),硫酸消耗低,每100吨矿石耗酸仅为4 吨左右,生产成本低、液体含杂质较少,利于工艺水循环利用; 缺点: (1) 钙化焙烧提钒工艺对焙烧产物有一定的选择性,对一般矿石存在转化率偏低,成 本偏高等问题,不适于大量生产。 (2)装置投资较加盐焙烧工艺高。
一、石煤提钒工艺
4.石煤提钒的技术改革两方面 一方面是焙烧添加剂的多样化、焙烧设备的优化、浸出工艺的变化以及从含 钒稀溶液中分离富集钒的方法的改进等几个方面; 另一方面为湿法提取钒工艺。 焙烧添加剂的多样化:食盐添加剂、低氯复合添加剂、无氯多元添加剂、无 添加剂。焙烧添加剂的多样化,使得钒浸出率得到了提高,但总的来说钒的浸出 率还是偏低。
大;
烧碱吸收法效果好,设备投资低,但处理成本高。按照一般工业状况,比如矿石含 钒品位1%计算,每生产一吨五氧化二钒需要消耗氢氧化钠五吨多,吸收剂消耗一万五千元 以上。 污染实质:烟气污染物在吸收后将转变为废水污染,造成废气处理成本高,废水循 环利用率低、废水排放量大,造成企业周边的土壤盐碱化,环境污染严重。 目前,由于污染严重,此工艺已被各地环保部门禁止采用。
钒提取技术(二)
主要内容:
1
钒及其化合物

在强酸中, V(V) 以 VO3+ 形式存在
或以 VO2+ 形式存在 V(IV) 以 VO2+ 形式存在
V2O5 在氢气流中加热,将被还原 成 V2O3
V2O5 + 2 H2 —— 2 V2O3 + 2 H2O
若与高压氢气在高温下作用, 其 将被还原成单质钒。
VSO4 中的 V(II)可以被 KMnO4 氧化成 V(III)
若浓缩上述红色溶液或再滴加 H2O2, 则 [ V(O2)](2 SO4)3 将转化 为黄色的 H3 [ V(O2)O3 ]。
V2O5 溶于 H2O2,可直接得到 过氧偏钒酸。
V2O5 + 2 H2O2 —— 2 HVO4 + H2O
碱金属的偏钒酸盐溶于 H2O2,可生成碱金属的过氧 偏钒酸盐,如 KVO4。
或 9. 7. 1 钒的氧化物
V2O5 为砖红色固体,无臭、 无味、有毒,是钒酸 H3VO4 及 偏钒酸 HVO3 的酸酐。
除通过单质高温合成外,加热 偏钒酸铵可得 V2O5
2 NH4VO3 —> 4—00 ℃— V2O5 + 2 NH3 + H2O
钒的氢化物为灰黑色物质,仍保 持金属外观。
金属钒吸氢后晶格膨胀,随 着吸氢量的不同其密度比金属钒 减小 6~10%。
金属钒吸氢后变脆变硬。
钒的氢化物在真空中加热到 600 ~ 700℃ 将发生分解,随着氢 的释出,钒的硬度降低,并恢复 原有的延展性。
钢中加 0.1% ~ 0.2 % 的钒,韧性、强度、延展性 及抗冲击力均加强。
2 H3VO4 + HCOOH + 4 H+ —— 2 VO2+ + CO2↑ + 6 H2O
钒

钒钒:元素符号V,银白色金属,在元素周期表中属VB族,原子序数23,原子量50.9414,体心立方晶体,常见化合价为+5、+4、+3、+2。
钒的熔点很高,常与铌、钽、钨、钼并称为难熔金属。
有延展性,质坚硬,无磁性。
具有耐盐酸和硫酸的本领,并且在耐气-盐-水腐蚀的性能要比大多数不锈钢好。
于空气中不被氧化,可溶于氢氟酸、硝酸和王水。
钒能分别以二、三、四、五价于氧结合,形成四种氧化物,一氧化钒(VO )三氧化二钒(v2o₃),二氧化钒,五氧化二钒三氧化二钒灰黑色结晶或粉末。
不溶于水,溶于硝酸、氢氟酸、热水。
在空气中慢慢吸收氧而转变为四氧化二钒。
在空气中加热猛烈燃烧。
在空气中慢慢吸收氧而转变为四氧化二钒。
在空气中加热猛烈燃烧。
为强还原剂制备:1、由氢、碳或一氧化碳还原五氧化二钒制得,或在1750℃下热分解五氧化二钒、在隔绝空气下煅烧钒酸铵制得。
[3]2、、将由偏钒酸铵热分解生成的无定形五氧化二钒在纯化的氢气流中,于600℃下还原2h(V2O5的熔点为690℃,温度不能超过此熔点),再在900℃下继续还原5~6h。
将生成物的一部分用碱熔融之后溶解于稀硫酸中,用过氧化氢进行氧化还原滴定,就可以知道得到的产品为VO1.506。
将此产品再在1250℃还原4h,则变为V2O3。
[4]3、、该发明公开了一种三氧化二钒的生产方法,是把一定粒度的钒酸铵或五氧化二钒连续地加入外热式容器中,在其容器中通入工业煤气。
通过外加热使容器内高温区达到500~650℃,使炉料通过此温度区域发生还原反应15~40分钟,使其分解还原为三氧化二钒。
冷却炉料至100℃以下出炉。
该方法的优点是大大降低了还原温度;缩短了还原时间;降低了生产的成本。
二氧化钒深蓝色晶体粉末,单斜晶系结构。
密度4.260 g/cm3。
熔点1545 ℃。
不溶于水,易溶于酸和碱中。
溶于酸时不能生成四价离子,而生成正二价的钒氧离子。
在干的氢气流中加热至赤热时被还原成三氧化二钒,也可被空气或硝酸氧化生成五氧化二钒,溶于碱中生成亚钒酸盐。
钒简介

钒为本词条添加义项名钒钒钒5基本构成四氯化钒等卤化钒类。
钒6.1应用范围应用领域占总量比例(%)主要用途使用产品钒钒6.2钒电池6.3应用优点一、电堆作为发生反应的场所与存放电解液的储罐分开,从根本上克服了传统电池的自放电现象。
功率只取决于电堆大小,容量只取决于电解液储量和浓度,设计非常灵活;当功率一定时,要增加储能容量,只需要增大电解液储罐容积或提高电解液体积或浓度即可,而不需改变电堆大小;可通过更换或添加充电状态的电解液实现“瞬间充电”的目的。
可用于建造千瓦级到百兆瓦级储能电站,适应性很强。
二、充、放电性能好,可以进行大功率的充电和放电,也可以允许浮充和深度放电。
对铅酸蓄电池来说,放电电流越大,电池的寿命越短;放电深度越深,电池的寿命也越短。
而钒电池放电深度即使达到10 0%,也不会对电池造成影响。
而且钒电池不易发生短路,这就避免了因短路而引起的爆炸等安全问题。
三、可充放电次数极大,理论上寿命是无数次。
充放电时间比为1:1,而铅酸电池是4:1。
而且钒电池充、放切换响应速度快,小于20毫秒,非常有利于均衡供电。
四、能量效率高,直流对直流能量效率可以达到80%以上,而铅酸电池只有60%左右。
钒电池组中的各个单位电池状态基本一致,维护简单方便。
五、选址自由度大,占地少,系统可全自动封闭运行,不会产生酸雾,没有酸腐蚀。
电解液可反复利用,无排放,维护简单,操作成本低。
是一种绿色环保储能技术。
因此对于可再生能源发电,钒电池是铅酸电池理想的替代品。
6.4钒电池优点与其它化学电源相比,钒电池具有明显的优越性,主要优点如下:1.功率大:通过增加单片电池的数量和电极面积,即可增加钒电池的功率,目前美国商业化示范运行的钒电池的功率已达6兆瓦。
2.容量大:通过任意增加电解液的体积,即可任意增加钒电池的电量,可达吉瓦时以上;通过提高电解液的浓度,即可成倍增加钒电池的电量。
3.效率高:由于钒电池的电极催化活性高,且正、负极活性物质分别存储在正、负极电解液储槽中,避免了正、负极活性物质的自放电消耗,钒电池的充放电能量转换效率高达7 5%以上,远高于铅酸电池的45%。
钒的物化性质

钒--碳系中只有V2C和VC两个中间相在1320℃以上的温度下稳定,两种碳化钒均系非化学计量化合物,其物理性能均与其实际组成有依赖关系。
一、钒的物理性质
钒属于元素周期表第VB族。它与其他VB族金属一样,具有体心立方结构,没有任何晶型变化,致密钒的外观呈浅灰色,熔点较高,在冶金分类上与同一副族的铌和钽同属于稀有高熔点金属。琪硬度和抗拉强度极限与加工和热处理状况及杂质含量有密切关系。纯钒具有良好的可塑性,在常温下可轧成片、箔和拉成丝。少量的杂质,特别是碳、氧、氮和氢等间隙元素,可使钒的可塑性降低,硬度和脆性增加。
不同价态的钒离子在酸性溶液中具有不同的颜色。因此,可以根据离子的颜色和颜色的深浅初步鉴别酸性溶液中钒离子的价态和离子浓度。
室温下金属钒较稳定,不与空气、水和碱作用,也能耐稀酸。高温下,金属钒很容易与氧化氮作用。当金属钒在空气中加热时,钒氧化成棕黑色的三氧化二钒、铁红色的四氧化二钒,并最终成为桔黄色的五氧化二钒。钒在氮气中加热至900~1300℃会生成氮化钒。钒与碳在高温下可生成碳化钒,但碳化反应必须在真空中进行。当钒在真空下或惰性气氛中与硅、硼、磷、砷一同加热时,可形成相应的硅化物、硼化物、磷化物和砷化物。
3、3、2、钒酸铵
偏钒酸铵在钒的湿法冶金中占有重要地位。偏钒酸铵为白色或微黄色的晶体粉末,微溶于水和氨水,难溶于冷水。它在不同温度下在水中溶解度也不尽相同。
当水溶液中有铵盐存在时,因共同离子效应,偏钒酸铵的溶解度下降。这一现象在钒的湿法冶金中被广泛应用。偏钒酸铵在常温下稳定,加热时易分解。它在空气中的分解反应为:
3、3、钒酸盐
通常说的钒酸盐多指含(V)V的钒酸盐。钒酸盐分偏矾酸盐MVO3、正钒酸盐M3VO4、和焦钒酸盐M4V2O7,式中M代表一价金属。Bi、Ca、Cd、Cr、Co、Cu、Fe、Pb、Mg、Mn、Ni、K、Ag、Na、Sn和Zn均能生成钒酸盐。碱金属和镁的偏矾酸盐可溶于水,得到的溶液呈淡黄色。其他金属的钒酸盐不大能溶于水。
二氧化钒相变机制

二氧化钒相变机制我们需要了解二氧化钒的晶体结构。
二氧化钒的晶体结构属于四方晶系,空间群为P42/mnm。
它由钒离子(V4+)和氧离子(O2-)构成,钒离子位于晶格的四方中心位置,氧离子位于钒离子的周围。
这种结构使得二氧化钒具有一定的稳定性。
二氧化钒的相变过程主要包括低温相变和高温相变。
在常温下,二氧化钒存在着单斜相。
当温度升高到一定程度时,二氧化钒会发生相变,转变为正交相。
这个过程中,晶体结构发生了显著的改变。
低温相变是指二氧化钒由单斜相转变为正交相的过程。
这个相变过程是一个连续的过程,随着温度的升高,钒离子和氧离子的排列方式发生了改变。
在单斜相中,钒离子和氧离子的排列比较紧密,相互之间的距离较小。
而在正交相中,钒离子和氧离子的排列比较疏松,相互之间的距离较大。
这种结构改变导致了晶体结构的不稳定性,引发了相变的发生。
高温相变是指二氧化钒由正交相转变为金红石相的过程。
这个相变过程是一个不连续的过程,发生在较高的温度下。
在正交相中,钒离子和氧离子的排列方式较为松散,晶体结构相对稳定。
当温度升高到一定程度时,钒离子和氧离子的排列方式发生了显著的改变,形成了金红石相。
金红石相的晶体结构更加稳定,能够在高温下保持一定的稳定性。
二氧化钒相变的机制主要与晶体结构的改变有关。
在相变过程中,钒离子和氧离子的排列方式发生了改变,导致晶体结构的不稳定性。
这种不稳定性使得二氧化钒发生了相变。
相变的发生与温度密切相关,温度的升高会导致晶体结构的改变,从而引发相变的发生。
总结起来,二氧化钒的相变过程主要包括低温相变和高温相变。
低温相变是指二氧化钒由单斜相转变为正交相的过程,而高温相变是指二氧化钒由正交相转变为金红石相的过程。
相变的发生与晶体结构的不稳定性密切相关,温度的变化会引发晶体结构的改变,从而引发相变的发生。
通过研究二氧化钒的相变机制,可以深入理解其物理和化学性质,为二氧化钒的应用提供理论依据。
无机化学-钒和铬分族

Dawson
Paratungstate B
[X2M18O62]n−
[H2M12O42]10− [M12O40(OH)2]10−
Anderson [XM6O24]n−
[W200Co8O660]
Strandberg
[HP2Mo5O23]4-
Polyoxometalate anions can be prepared by carefully adjusting pH and concentrations.
CrO42-+H2O C- rO42-+Br
Cr3+
还氧 原化
剂
OH- H+
Cr(OH)3↓灰蓝
OH- H+
CrO2-
([Cr(OH)4]-)
氧
化 剂
H2O
OH-
2
Cr2O7- + H2O
2H+ + 2 CrO42-
H+
Cr2O72-+H+
I-
H2S H2SO3 Fe2+
Cl- NO2-
Cr3++ I2 + H2O Cr3++ S↓+ H2O
ⅥB 铬 Cr 3d54s1 钼 Mo 4d55s1 钨 W 5d46s2
铬在自然界存在
FeO·Cr2O3 或 FeCrO4铬铁矿
辉钼矿MoS2
(Fe、Mn)WO4黑钨矿 CaWO4白钨矿
12.2.3 氧化态与氧化还原性
V
离子色彩丰富:V2+紫、 V3+绿 、VO2+兰、 VO2+、 VO3-黄 酸根极易聚合:V2O7 4- 、V3O9 3- 、V10O286- pH下降,聚合 度增加,颜色从无色→黄色→深红,酸度足够大时为VO2+
二氧化钒相变材料

二氧化钒相变材料二氧化钒是一种重要的相变材料,具有许多独特的性质和潜在的应用价值。
本文将从材料的基本特性、相变机制、应用前景等方面进行探讨。
一、二氧化钒的基本特性二氧化钒是一种黑色晶体,具有良好的导电性和磁性。
它的晶体结构属于金红石型结构,其中钒原子和氧原子以八面体的方式排列。
二氧化钒具有较高的熔点和热稳定性,同时还具有较高的硬度和抗腐蚀性。
二、二氧化钒的相变机制二氧化钒的相变主要涉及到其晶格结构的改变。
在低温下,二氧化钒具有单斜晶系结构,钒原子和氧原子呈现出一定的偏离。
当温度升高到一定程度时,二氧化钒会发生相变,晶格结构由单斜晶系变为正交晶系。
这种相变是伴随着原子间的重新排列和晶格的重新组织。
三、二氧化钒的应用前景由于二氧化钒具有多种特殊的性质,它在许多领域具有广阔的应用前景。
1.储能材料:二氧化钒作为一种具有高比能量和高功率密度的储能材料,可以应用于电池、超级电容器等领域。
其相变特性可以实现对储能过程的控制和调节,提高储能效率和循环寿命。
2.传感器:二氧化钒具有较高的电阻率和灵敏度,可用于制作传感器。
例如,利用二氧化钒的电阻随温度变化的特点,可以制作温度传感器;利用其磁性可制作磁传感器。
3.热敏材料:二氧化钒的电阻率随温度的变化较大,可用于制作热敏电阻。
通过控制二氧化钒的相变温度和相变温度范围,可以实现对热敏电阻的调节,满足不同应用领域的需求。
4.光电材料:二氧化钒具有较高的光吸收能力和光电导率,可用于制作光电器件。
例如,可以将二氧化钒应用于太阳能电池、光电探测器等领域,提高光电转换效率和性能稳定性。
5.光催化材料:由于二氧化钒具有较高的光吸收能力和电子传导性能,可以用作光催化材料。
利用其相变特性,可以实现光催化反应的调控和增强,提高光催化材料的活性和稳定性。
二氧化钒作为一种重要的相变材料,具有许多独特的性质和潜在的应用价值。
通过研究和开发二氧化钒的相变机制和应用前景,可以为材料科学和工程领域的发展提供新的思路和方法。
二氧化钒在红外伪装隐身技术中的应用研究进展

2017年第36卷第11期 CHEMICAL INDUSTRY AND ENGINEERING PROGRESS·4099·化 工 进展二氧化钒在红外伪装隐身技术中的应用研究进展嵇海宁,刘东青,张朝阳,程海峰,杨力祥(国防科技大学新型陶瓷纤维及其复合材料重点实验室,湖南 长沙 410073)摘要:二氧化钒是一种具有热致相变性质的功能材料,其相变温度接近于室温,在相变温度处发生金属-绝缘体转变并伴有电阻率和红外发射率的突变,具有重要的研究价值和潜在的应用前景。
本文综述了二氧化钒的热致相变特性和相变温度的调控方法。
基于二氧化钒可以主动降低红外发射率,控制自身红外辐射强度,总结了二氧化钒薄膜和粉体在红外伪装隐身中的研究进展,并对二氧化钒用于红外伪装隐身情形进行了模拟分析。
最后提出了制备高纯单相二氧化钒纳米粉体、增加二氧化钒涂层的热致变发射率突变量、系统研究二氧化钒的中远红外特性以及实现可见/红外兼容伪装等方面是今后的发展趋势。
关键词:二氧化钒;相变;红外;伪装隐身中图分类号:TB381 文献标志码:A 文章编号:1000–6613(2017)11–4099–07 DOI :10.16085/j.issn.1000-6613.2017-0243Application advances of vanadium dioxide in infrared camouflage andstealth technologyJI Haining ,LIU Dongqing ,ZHANG Chaoyang ,CHENG Haifeng ,YANG Lixiang(Science and Technology on Advanced Ceramic Fibers and Composites Laboratory ,National University of DefenseTechnology ,Changsha 410073,Hunan ,China )Abstract :Vanadium dioxide is a thermochromic functional material that undergoes a reversible metal-insulator phase transition at near room temperature. This phase change is accompanied by a marked change in resistivity and infrared emissivity. Vanadium dioxide materials are of important research value and potential application prospects. Thermochromic properties of vanadium dioxide and the regulation of its phase transition temperature are reviewed. Since the infrared radiation intensity of vanadium dioxide could be controlled by reducing its infrared emissivity actively ,the research progress of vanadium dioxide thin films and powders in the infrared camouflage and stealth technology are summarized. Besides ,tha application of vanadium dioxide for infrared camouflage stealth is also simulated and analyzed. Finally ,it is proposed that the preparation of high purity single phase vanadium dioxide powders ,the increase of thermally induced emissivity changes of vanadium dioxide ,c omprehensive study of the mid-IR and far-IR characteristics ,and visible/infrared compatible camouflage will be the trends of future research .Key words :vanadium dioxide ;phase change ;infrared ;camouflage and stealth在高技术条件下的信息化局部战争中,通过信息对抗争夺制信息权如同以往夺取制空权、制海权一样,成为现代战争的焦点,而侦察监视与伪装隐身日益成为信息对抗的矛和盾[1]。
二氧化钒的制备工艺现状

矿产综合利用Multipurpose Utilization of Mineral Resources第2期2021年4月·119·二氧化钒的制备工艺现状张帅,李慧,梁精龙(华北理工大学 冶金与能源学院 现代冶金技术教育部重点实验室,河北 唐山 (063210)摘要:概述了二氧化钒的基本特性及应用状况,介绍了二氧化钒的制备工艺,包括溶胶-凝胶法、水热法、磁控溅射法和化学气相沉积法研究现状及优缺点。
并对未来如何更加合理的制备二氧化钒给出了自己的见解。
关键词:二氧化钒;溶胶-凝胶法;水热法;磁控溅射法;化学气相沉积法doi:10.3969/j.issn.1000-6532.2021.02.020中图分类号:TD952 文献标志码:A 文章编号:1000-6532(2021)02-0119-06收稿日期:2019-08-29;改回日期:2019-09-25基金项目:国家自然科学基金项目(51874141)资助作者简介:张帅 (1994-),男,硕士研究生,主要研究方向为物理化学。
通信作者:李慧(1981-),女,博士,副教授,硕士研究生导师,主要研究方向为资源综合利用与原料优化及金属材料制备。
E-mail :121775262@二氧化钒是一种深蓝色正方金结构的金属氧化物,熔点为1545 ℃。
易溶于酸和碱,不溶于水。
十九世纪三十年代,瑞典人N.G.Sefstrom 首次将金属钒从铁矿渣中提取出来[1],1959年,科学家F .J .Mofin 发现V 2O 3,VO ,VO 2等不同价态的钒的氧化物具有良好的半导体-金属的相变特性[2],其中VO 2从半导体相到金属相转变的临界温度较低,当温度为68℃以下时,二氧化钒具有半导体的性质,当温度为68℃以上时,二氧化钒具有金属的性质,基于其独特的优势[3-4],二氧化钒被广泛应用于红外探测器[5]、光开关[6]、智能窗[7]及热敏电阻[8]等多个领域。
西昌钢钒2号高炉强化冶炼实践
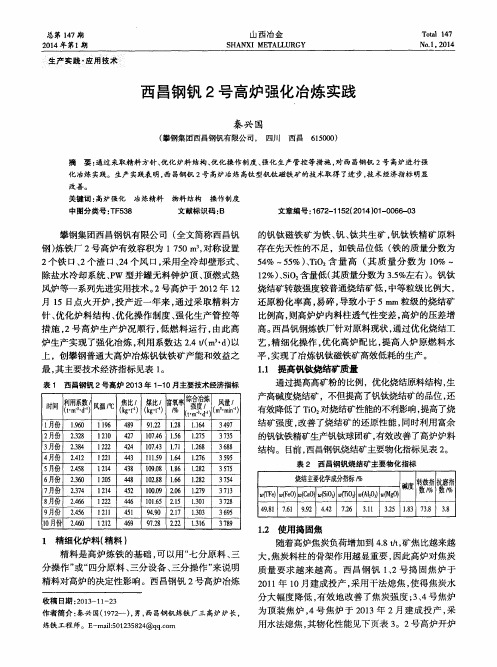
1 2 1 0 4 2 7 l 0 7 . 4 6 1 . 5 6 1 . 2 7 5 1 2 2 2 4 2 4 1 0 7 . 4 3 1 . 7 1 1 . 2 6 8 l 2 2 1 4 4 3 l 】 1 . 5 9 1 . 6 4 1 . 2 7 6 l 2 1 4 4 3 8 1 0 9 . O 8 1 . 8 6 1 . 2 8 2 l 2 0 5 4 4 8 1 0 2 . 8 8 1 . 6 6 1 . 2 8 2 1 2 1 4 4 5 2 l 0 0 . O 9 2 . 0 6 1 . 2 7 9
的钒钛 磁 铁矿 为 铁 、 钒、 钛共 生 矿 , 钒 钛铁 精 矿 原料 存在 先天性 的不 足 ,如铁 品位低 ( 铁 的质 量分 数 为 5 4 %~ 5 5 %) 、 T i O 含 量高 ( 其质 量分 数为 1 0 %
1 2 %) 、 S i O : 含量低( 其质量分数为 3 . 5 % 左右) 。钒钛 烧结 矿转 鼓强度 较普 通烧结 矿 低 , 中等粒 级 比例大 , 还原粉化率高 , 易碎 , 导致小于 5 m m粒级的烧结矿 比例高 , 则高炉炉 内料柱透气性变差 , 高炉的压差增 高。 西昌钒钢炼铁厂针对原料现状 , 通过优化烧结工
总第 1 4 7期 2 0 1 4年 第 1 期
山 西 冶 金
S HANXI ME n I 工U RGY
T o t a l 1 7 4 No . 1 , 2 0 1 4
生产 实 践 ・ 应 用技 术
西 昌钢钒 2号高炉强化冶炼实践
秦兴 国
( 攀钢集团西 昌钢钒有限公 司, 四川 摘 西昌 6 1 5 0 0 0 )
表 2 西 昌 钢钒 烧 结 矿 主 要 物化 指 标
钒及钒生产工艺

钒及钒生产工艺第一章钒的性质及应用一、钒的性质:钒是一种十分重要的战略物资,在钢铁、电子、化工、宇航、原子能、航海、建筑、体育、医疗、电源、陶瓷等在国民经济和国防中占有十分重要的位置。
常温下钒的化学性质较稳定,但在高温下能与碳、硅、氮、氧、硫、氯、溴等大部分非金属元素生成化合物。
例如:钒在空气中加热至不同温度时可生成不同的钒氧化物。
在180℃下,钒与氯作用生成四氯化钒(VCl4);当温度超过800℃时,钒与氮反应生成氮化钒(VN);在800~1000℃时,钒与碳生成碳化钒(VC)。
钒具有较好的耐腐蚀性能,能耐淡水和海水的侵蚀,亦能耐氢氟酸以外的非氧化性酸(如盐酸、稀硫酸)和碱溶液的侵蚀,但能被氧化性酸(浓硫酸、浓氯酸、硝酸和王水)溶解。
在空气中,熔融的碱、碱金属碳酸盐可将金属钒溶解而生成相应的钒酸盐。
此外,钒亦具有一定的耐液态金属和合金(钠、铅、铋等)的腐蚀能力。
钒有多种氧化物。
V2O3和V2O4之间,存在着可用通式V n O2n-1(3≤n≤9)表示的同族氧化物,在V2O4到V2O5之间,已知有V3O5、V3O7、V4O7、V4O9、V5O9、V6O11、V6O13等氧化物。
工业上钒氧化物主要是以V2O5、V2O4和V2O3形式存在,特别是V2O5和生产尤为重要。
它们的主要性质列于下表:二、钒的应用三、五氧化二钒的性质V2O5是一种无味、无嗅、有毒的橙黄色或红棕色的粉末,微溶于水(质量浓度约为0.07g/L),溶液呈黄色。
它在约670℃熔融,冷却时结晶成黑紫色正交晶系的针状晶体,它的结晶热很大,当迅速结晶时会因灼热而发光。
V2O5是两性氧化物,但主要呈酸性。
当溶解在极浓的NaOH中时,得到一种含有八面体钒酸根离子VO43-的无色溶液。
它与Na2CO3一起共熔得到不同的可溶性钒酸钠。
第二章五氧化二钒生产工艺方法概述五氧化二钒生产工艺大致历经了70年,通过几代人的不断总结、探讨,已初步形成了不同的生产工艺模式。
vo2纳米粉体;掺杂;相变温度

VO2纳米粉体一、背景介绍VO2(钒氧化物)是一种具有多种应用潜力的过渡金属氧化物材料。
VO2的相变特性使其成为一种理想的材料用于温度敏感器件、智能窗户、核燃料控制棒等领域。
近年来,研究人员开始探索将VO2纳米粉体用于材料掺杂的可能性,以改变其性能和功能。
二、VO2纳米粉体的制备方法1. 热沉积法热沉积法是较常用的制备VO2纳米粉体的方法之一。
该方法首先将VO2的前驱体溶解在适当的溶剂中,然后通过控制沉积温度和时间来得到纳米粉体。
2. 水热法水热法是一种低成本且简单有效的制备VO2纳米粉体的方法。
在水热反应条件下,通过适当的前驱体混合物并添加适量的助剂,可以制备出具有良好结晶性和纳米尺度的VO2粉体。
3. 气相沉积法气相沉积法是制备高纯度VO2纳米粉体的常用方法之一。
该方法通过在高温下,使气相中的VO2前驱体分解并在基底上沉积形成纳米粉体。
三、VO2纳米粉体的掺杂方法VO2纳米粉体掺杂是一种改变其特性与功能的方法。
通过向VO2纳米粉体中引入其他元素或化合物,可以调控其电学、光学、磁学等性能。
1. 元素掺杂元素掺杂是一种常见的VO2纳米粉体掺杂方法。
通过向VO2纳米粉体中添加其他过渡金属元素,如铁、镍等,可以调节VO2的相变温度和相变温度范围,从而改变其应用性能。
2. 氧化物掺杂氧化物掺杂是另一种常用的VO2纳米粉体掺杂方法。
在制备VO2纳米粉体的过程中,可以向体系中添加一定量的氧化物,如TiO2、W,以调节VO2的晶格结构和相变温度。
3. 离子掺杂离子掺杂是一种较新颖的VO2纳米粉体掺杂方法。
通过在VO2纳米粉体中引入离子,如锂离子、铜离子等,可以改变VO2的导电性能和稳定性,从而拓宽其应用领域。
四、VO2纳米粉体的相变温度调控VO2纳米粉体的相变温度是其在不同温度下发生相变的临界点。
通过调控VO2纳米粉体的制备方法和掺杂方式,可以有效调节其相变温度,进而满足不同应用领域的需求。
1. 温控溶剂法温控溶剂法是一种有效的调控VO2纳米粉体相变温度的方法。
钒的化学性质

钒的化学性质
书山有路勤为径,学海无涯苦作舟
钒的化学性质
钒在空气中250℃以下是稳定的。
呈浅银灰色,有良好的可塑性、可锻性。
长期保存表面会呈现蓝灰、黑橙色,超过300℃会有明显的氧化。
超过500℃,钒吸附氢于晶格间隙,使其变得易脆,易成粉末。
真空下600~700℃加热,氢可逸出,低温下存在氢化物VH。
大于800℃钒与氮反应生成氮化钒。
钒对碳有较高亲和力,800~1000℃形成碳化物。
钒有2+、3+、4+、5+等多种价态,原子的价电子结构式为。
五价钒有氧化性,低价钒有还原性。
对稀硫酸、稀盐酸、稀磷酸保持相对稳定。
但在硝酸、氟氢酸中溶解。
金属钒对自来水抗蚀性良好,对海水抗蚀性中等,但未出现点腐蚀。
钒能抗10%NaOH 溶液,但抗不住热KOH 溶液。
钒及其合金对低熔点金属或合金的熔融体有良好的抗蚀性,特别是碱金属。
它们在核反应堆中用作冷却剂或热交换介质。
表1 为钒的抗腐蚀性能。
表1 钒对某些介质的抗腐蚀性能
溶液
腐蚀速度/(mg(㎝2·h)-1)
腐蚀速度/(nm2·h-1)
材料
10% H2SO4(沸)
0.055
20.5(70℃)
钒板
30% H2SO4(沸)
0.251。
vo2+读法

vo2+读法Vo2+的读法Vo2+ 是一个常见的化学元素离子,它由钒和氧两种元素组成。
在正式介绍 Vo2+ 的读法之前,我们先来了解一下“Vo2+”代表的含义和特点。
Vo2+ 是一个带正电荷的离子,其中钒的化学符号是 V,氧的化学符号是 O。
Vo2+ 中的“2+”表示这个离子带有两个正电荷,也就是它失去了两个电子。
在化学方程式中,Vo2+ 通常以离子形式出现。
当Vo2+ 与其他物质发生反应时,它能够表现出不同的性质和特点。
关于 Vo2+ 的读法,根据国际化学命名规则,我们可以使用三种不同的方法来表达。
下面将分别介绍这三种读法以及它们的特点和应用场景。
第一种读法:氧化钒(II)根据化学惯例,我们可以将 Vo2+ 表达为“氧化钒(II)”。
在这种表达方式中,使用罗马数字表示钒的氧化状态,括号中的阿拉伯数字表示带电离子的电荷数。
这种读法明确地告诉我们 Vo2+ 的结构和组成,即它由钒和氧组成,并且带有+2 的正电荷。
氧化钒(II) 在化学领域中有广泛的应用。
它可以作为催化剂,用于促进化学反应的进行。
此外,氧化钒(II) 也可以用于电池、涂料和陶瓷材料等领域。
第二种读法:钒离子除了使用具体的化学名称之外,我们还可以将 Vo2+ 表达为“钒离子”。
这种读法更加简洁直观,适用于非正式场合或对化学术语不熟悉的人。
通过称呼 Vo2+ 为钒离子,我们侧重于突出其作为正离子的特性。
作为钒离子,Vo2+ 参与了许多重要的化学反应和化合物的形成。
例如,在钒电池中,钒离子参与了电极之间的反应,产生电能。
此外,钒离子还可用于有机合成、催化剂和电子材料等领域。
第三种读法:二价钒离子第三种读法将 Vo2+ 表示为“二价钒离子”。
这种表达方式更强调Vo2+ 带有两个正电荷。
在某些化学反应和领域中,特别需要强调正离子的电荷数目,这种读法能够准确地传达这一信息。
二价钒离子在化学分析和实验室研究中具有重要意义。
通过对二价钒离子的检测和分析,我们可以了解到钒化合物的性质和反应机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钒钒元素的发现史钒先后被两次发现。
第一次是在1801年由墨西哥城的矿物学教授Andrés Manuel del Rio发现的。
他发现它在亚钒酸盐样本中,Pb5(VO4)3Cl并把这个样本送到巴黎。
然而,法国化学家推断它是一种铬矿石。
第二次发现钒是在1831年,由斯德哥尔摩的瑞典化学家Nil Gabriel Selfström发现。
他从一个矿石制作的铸铁样本中分离了它,矿石是在斯莫兰开采出来的。
他能够证明它是一种新的元素,并因此击败了一位与他竞争的化学家,来自在锡马潘(墨西哥)的Friedrich Wöhler,他也在对另一种钒矿石进行研究。
钒元素的诞生及存在形式纯净的钒是由Henry Roscoe在曼彻斯特(英格兰西北部城市),于1869年制取,而且他证明了之前的金属样本其实是氮化钒(VN)。
钒是一种银灰色的金属。
熔点1919±2℃,属于高熔点稀有金属之列。
它的沸点3000--3400℃,钒的密度为6.11克每立方厘米。
纯钒具有展性,但是若含有少量的杂质,尤其是氮,氧,氢等,也能显著的降低其可塑性。
硫钒矿(秘鲁)、钒铅锌铜矿(南部非洲)、钒钛磁铁矿(中国、俄罗斯、南非)、钒铀矿(美国、西澳大利亚、乌兹别克)、燃油发电油灰(中东、委内瑞拉)。
钒能分别以二、三、四、五价于氧结合,形成四种氧化物,一氧化钒(vo)三氧化二钒(v2o3),二氧化钒,五氧化二钒。
钒盐有五价盐:偏钒酸铵、偏钒酸钠、偏钒酸钾、正钒酸钠、焦钒酸钠。
四价盐:硫酸氧钒、草酸氧钒,四氯化钒等卤化钒类三氯氧钒等卤氧化钒类。
中国是钒资源比较丰富的国家,钒矿主要分布在四川的攀枝花和河北的承德,大多数是以石煤的形式存在。
钒元素的结构及其单质电子层分布:2-8-11-2核电荷数:23电子层:K-L-M-N外围电子层排布:3d3 4s2晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
氧化态:Main V+3,V+4,V+5Other V-3,V-1,V0,V+1,V+2晶胞参数:a = 303 pmb = 303 pmc = 303 pmα = 90°β = 90°γ = 90°莫氏硬度:7电离能(kJ /mol)M - M+ 650M+ - M2+ 1414M2+ - M3+ 2828M3+ - M4+ 4507M4+ - M5+ 6294M5+ - M6+ 12362M6+ - M7+ 14489M7+ - M8+ 16760M8+ - M9+ 19860M9+ - M10+ 22240声音在其中的传播速率:(m/S)4560分子式:V分子量:50.9415钒的物理和化学性质及其应用钒具有众多优异的物理性能和化学性能,因而钒的用途十分广泛,有金属“维生素”之称。
最初的钒大多应用于钢铁,通过细化钢的组织和晶粒,提高晶粒粗化温度,从而起到增加钢的强度、韧性和耐磨性。
后来,人们逐渐又发现了钒在钛合金中的优异改良作用,并应用到航空航天领域,从而使得航空航天工业取得了突破性的进展。
随着科学技术水平的飞跃发展,人类对新材料的要求日益提高。
钒在非钢铁领域的应用越来越广泛,其范围涵盖了航空航天、化学、电池、颜料、玻璃、光学、医药等众多领域。
应用领域占总量比例(%)主要用途,使用产品碳素钢25 %钢筋FeV,HSLA钢25 %建筑,石油管道FeV,高合金钢20% 铸件,石油管配件FeV,工具钢15% 高速工具钢,耐磨件FeV(80%V),钛合金10% 喷气式发动机零件,飞行器机V-Al基合金,化学制品5 %硫酸和顺丁烯二酸酐生产V2O5和其它钒化合物。
钒的性质和钽以及铌相似,在它被发现后英国化学家罗斯科研究了它的性质,确定它与钽和铌相似,这为它们三个在元素周期表中共建一个分族建立了基础。
才能出众的金属——钒钒的踪迹遍布全世界。
在地壳中,钒的含量并不少,平均在两万个原子中,就有一个钒原子,比铜、锡、锌、镍的含量都多,但钒的分布太分散了,几乎没有含量较多的矿床。
在海水中,在海胆等海洋生物体内,在磁铁矿中,在多种沥青矿物和煤灰中,在落到地球的陨石和太阳的光谱线中,人们都发现了钒的踪影。
可以说,几乎所有的地方都有钒,可是世界到处钒的含量都不多。
表面看来,钒跟铁没什么两样,同样穿着银灰色的衣眼,但钒比铁要坚硬得多,而且在常温下,钒十分“冷静”,它不会被氧化,即使把它加热到摄氏三百度,它依旧如故,仍然是亮堂堂的。
它也不怕水、各种稀酸和碱液的腐蚀。
在各种金属中,它可真特别。
如果说钢是虎,那么钒就是翼,钢含钒犹如虎添翼。
只需在钢中加入百分之几的钒,就能使钢的弹性、强度大增,抗磨损和抗爆裂性极好,既耐高温又抗奇寒,难怪在汽车、航空、铁路、电子技术、国防工业等部门,到处可见到钒的踪迹。
此外,钒的氧化物已成为化学工业中最佳催化剂之一,有“化学面包”之称。
看来,凡娜迪丝的“儿子”在人间正大受宠爱。
把钒掺进钢里,可以制成钒钢。
钒钢比普通钢结构更紧密,韧性、弹性与机械强度更高。
钒钢制的穿甲弹,能够射穿40厘米厚的钢板。
但是,在钢铁工业上,并不是把纯的金属钒加到钢铁中制成钒钢,而是直接采用含钒的铁矿炼成钒钢。
钒的盐类的颜色真是五光十色,有绿的、红的、黑的、黄的,绿的碧如翡翠,黑的犹如浓墨。
如二价钒盐常呈紫色;三价钒盐呈绿色,四价钒盐呈浅蓝色,四价钒的碱性衍生物常是棕色或黑色,而五氧化二钒则是红色的。
这些色彩缤纷的钒的化合物,被制成鲜艳的颜料:把它们加到玻璃中,制成彩色玻璃,也可以用来制造各种墨水。
钒的盐类的颜色真是五光十色,有绿的、红的、黑的、黄的,绿的碧如翡翠,黑的犹如浓墨。
比如说吧,化合价是二的钒盐一般都是紫色的,三价钒盐是绿色的,四价钒盐是浅蓝色的,而五氧化二钒常是红色的。
我们的世界,需要各种各样的颜色来装扮。
这些色彩缤纷的钒的化合物,可以用来制造各种各样的颜料,用它们就能把我们的生活打扮得更美丽。
如果把钒盐加入玻璃中,就能生产出非常好看的彩色玻璃。
把钒盐加入墨水中,就能制造出各种彩色墨水。
钒对生物体的作用,还有极强的毒性。
如果人体内的钒盐过多,就会得病。
但让人意外的是,如果在牛和猪的饲料中加入微量的钒盐,却能使它们的食量增加,脂肪层加厚。
这真是咄咄怪事。
颜色奇异的血液每个人都知道,人体内的血液是红色的。
不仅人体如此,绝大多数的高等动物的血液都是鲜红色的。
在自然界中还有许多低等动物,它们的血液是蓝色的。
而在高等动物与低等动物之间还有一些动物的血液是绿色的。
真奇怪!血液怎么会有这么不同的颜色呢?原来,高等动物的血液中含有铁离子,铁离子呈规出的是红色,所以高等动物的血液就是红色的。
低等动物的血液中含的是铜离子,铜离子的溶液是蓝色的,比如硫酸铜溶液是天蓝色的,因而低等动物的血液是蓝色的。
居于它们之间的那些动物的血液中含有三价钒离子,细心的人会记得三价钒离子显绿色,所以这些动物的血液就是绿色的。
钒(vanadium V)是地球上广泛分布的微量元素,其含量约占地壳构成的0.02%,获取相对容易。
钒是人体必需的微量元素在人体内含量大约为25mg,在体液pH4~8条件下钒的主要形式为VO-3,即亚钒酸离子(metavandate);另一为+5价氧化形式VO4 - 3即正钒酸离子(orthovanadate)。
由于生物效应相似,一般钒酸盐(Va)统指这两种+5价氧化离子。
VO3 经离子转运系统或自由进-入细胞,在胞内被还原型谷胱甘肽还原成VO2+(+4价氧化态),即氧钒根离子(vanadyl)。
由于磷酸和Mg2+离子在细胞内广泛存在VO3 与磷酸结构相似,VO2+与Mg2+大小相当(离子半径分别为016 -埃和0165埃),因而二者就有可能通过与磷酸和Mg2+竞争结合配体干扰细胞的生化反应过程。
例如,抑制ATP磷酸水解酶、核糖核酶磷酸果糖激酶、磷酸甘油醛激酶、6-磷酸葡萄糖酶、磷酸酪氨酸蛋白激酶[11]。
所以,钒进入细胞后具有广泛的生物学效应。
钒化合物又具有合成相对容易、价格较低廉的优势,因此研究钒化合物的降压机制有利于对钒的开发和利用。
国内外对钒化合物的研究已有20 多年的历史,早期多集中在钒化合物降糖作用的研究[12~16],也有报道钒能舒张猪的离体冠状动脉[17]。
近期国外有些研究开始用钒化合物治疗原发性高血压大鼠,已经取到肯定的实验结果[18,19]。
有报道认为BMOV 可以降低SHR 的高胰岛素血症和高血压[20]。
另有学者采用SHR 和WKY 大鼠对比探讨钒化合物对血压的药物疗效,结果可见钒化合物使收缩压降低(149±3/mmHg,非治疗组184±3mmHgP<0.0001)。
钒的氧化物及其盐钒能分别以二、三、四、五价于氧结合,形成四种氧化物,一氧化钒(vo)三氧化二钒(v2o3),二氧化钒,五氧化二钒生成热氧化物颜色密度熔点千卡每克分子vo 灰色 5.23-5.76 106v2o3 黑色 4.85 2000 300vo2 深蓝色 4.26. 1967 171v2o5 红黄 3.32 675 373钒盐:五价盐:偏钒酸铵、偏钒酸钠、偏钒酸钾、正钒酸钠、焦钒酸钠。
四价盐:硫酸氧钒、草酸氧钒。
四氯化钒等卤化钒类。
三氯氧钒等卤氧化钒类。
钒电池的应用优点一、电堆作为发生反应的场所与存放电解液的储罐分开,从根本上克服了传统电池的自放电现象。
功率只取决于电堆大小,容量只取决于电解液储量和浓度,设计非常灵活;当功率一定时,要增加储能容量,只需要增大电解液储罐容积或提高电解液体积或浓度即可,而不需改变电堆大小;可通过更换或添加充电状态的电解液实现“瞬间充电”的目的。
可用于建造千瓦级到百兆瓦级储能电站,适应性很强。
二、充、放电性能好,可以进行大功率的充电和放电,也可以允许浮充和深度放电。
对铅酸蓄电池来说,放电电流越大,电池的寿命越短;放电深度越深,电池的寿命也越短。
而钒电池放电深度即使达到100%,也不会对电池造成影响。
而且钒电池不易发生短路,这就避免了因短路而引起的爆炸等安全问题。
三、可充放电次数极大,理论上寿命是无数次。
充放电时间比为1:1,而铅酸电池是4:1。
而且钒电池充、放切换响应速度快,小于20毫秒,非常有利于均衡供电。
四、能量效率高,直流对直流能量效率可以达到80%以上,而铅酸电池只有60%左右。
钒电池组中的各个单位电池状态基本一致,维护简单方便。
五、选址自由度大,占地少,系统可全自动封闭运行,不会产生酸雾,没有酸腐蚀。
电解液可反复利用,无排放,维护简单,操作成本低。
是一种绿色环保储能技术。
因此对于可再生能源发电,钒电池是铅酸电池理想的替代品。
二、与其它化学电源相比,钒电池具有明显的优越性,主要优点如下:1.功率大:通过增加单片电池的数量和电极面积,即可增加钒电池的功率,目前美国商业化示范运行的钒电池的功率已达6兆瓦。
