(完整版)(完美版)高中有机化学方程式总结
高中有机化学方程式总结(绝对全)

光照 光照 光照 光照 催化剂 催化剂 △ 催化剂 △浓硫酸 △催化剂 △ △NO 2 NO 2 O 2NCH 3 CH 3催化剂 H 2O 浓硫酸 140℃ OH BrBr Br OH 一、取代反应1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl22. + HO -NO 2 NO 2 +H 2O 23. + HO -SO 3H SO 3H+H 2O25. +3HO -NO 2 +3H 2O28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 37. +3Br 2 ↓ +3HBr二、加成反应8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl催化剂 催化剂醇 △催化剂 △催化剂 △ 浓硫酸 170℃ 催化剂 △△△ 催化剂 △24.+ 3H 238. CH 3CHO + H 2 CH 3CH 2OH三、加聚反应12. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n18. nCH 2 = CH [ CH 2-CH ] nCl Cl四、消去反应29. CH 3CH 2Br+ NaOH CH 2 = CH 2 ↑+ NaBr +H 2O32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O五、置换反应30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑六、氧化反应39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O浓硫酸 △ 七、复分解反应34. OH+NaOH ONa+H 2O36. ONa+H 2O+CO 2 OH+ NaHCO 343.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O八、酯化反应47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 九、水解反应48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH十、缩聚反应49. nOHCH 2CH 2COO H → [ OCH 2CH 2C ] n +H 2O高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式汇总(全)(已)

光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压催化剂 △ 催化剂高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n13. nCH 22-CH=CH-CH 2] n14. 2CH 23CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2+ Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+233738. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH32O↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.3.4.5.6. 7.8.222Br CH CH CH CH +=-= 9.10. 11.12.13.14.15.16.17. OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式总结

高中有机化学方程式总结一、烃1. 烷烃—通式:C n H 2n-2(1)氧化反应①甲烷的燃烧:CH 4+2O 2CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2CCl 4+HCl (3)分解反应CH 4C+2H 22. 烯烃—通式:C n H 2n 乙烯的制取:CH 3CH 2OHH 2C=CH 2↑+H 2O(1)氧化反应①乙烯的燃烧:H 2C=CH 2+3O 22CO 2+2H 2O②乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2CH 3CH 3与氯化氢加成:H 2C=CH 2+HClCH 3CH 2Cl与水加成:H 2C=CH 2+H 2OCH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH 2 n3. 炔烃—通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HCCH ↑+Ca(OH)2(1)氧化反应①乙炔的燃烧:HC CH+5O 24CO 2+2H 2O②乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HCCH+Br 2HC=CH Br CHBr=CHBr+Br2CHBr 2—CHBr 2 与氢气加成:HC CH+H 2H 2C=CH 2与氯化氢加成:HC CH+HClCH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:nCH 2=CHCln乙炔加聚,得到聚乙炔:n HC CH n点燃光光光光浓硫酸170℃点燃催化剂△催化剂加热加压催化剂CH 2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△催化剂△BrCH 2—CH催化剂Cl催化剂CH=CH催化剂△高温溴的CCl 4可用于鉴别烯烃和烷烃,也可用于除去烷烃中混有的烯烃。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学反应方程式总结(较全)

高中有机化学反应方程式总结(较全)
简介
这份文档总结了高中有机化学中常见的反应方程式,旨在帮助学生更好地理解和记忆有机化学反应。
以下是一些常见的有机化学反应类型及其方程式。
1. 烷烃类反应
1.1 烷烃燃烧反应
烷烃 + 氧气→ 二氧化碳 + 水
例如:甲烷 + 氧气→ 二氧化碳 + 水
1.2 烷烃与卤素反应
烷烃 + 卤素→ 卤代烷 + 氢卤酸
例如:甲烷 + 溴→ 溴代甲烷 + 氢溴酸2. 烯烃类反应
2.1 烯烃与卤素反应
烯烃 + 卤素→ 二卤代烷
例如:乙烯 + 光→ 过氧化氢 + 氯乙烷3. 醇类反应
3.1 醇脱水反应
醇→ 烯烃 + 水
例如:乙醇→ 乙烯 + 水
3.2 醇氧化反应
醇 + 氧气→ 酮/醛 + 水
例如:乙醇 + 氧气→ 乙酸 + 水
4. 酮类反应
4.1 酮的高温还原反应
酮 + 还原剂→ 伯胺
例如:丙酮+ NaBH4 → 正丙胺
5. 羧酸类反应
5.1 羧酸与醇酸酐化反应
羧酸 + 醇酸酐→ 酯 + 水
例如:乙酸 + 乙酸酐→ 乙酸乙酯 + 水
5.2 羧酸与碱反应
羧酸 + 碱→ 盐 + 水
例如:乙酸 + 氢氧化钠→ 乙酸钠 + 水
6. 醛类反应
6.1 醛还原反应
醛 + 还原剂→ 一级醇
例如:乙醛+ NaBH4 → 乙醇
以上是高中有机化学反应方程式的一些简单总结。
更详细的反应方程式及反应条件请参考有机化学教材或咨询化学老师。
注意:文档中的所有反应方程式仅供参考,请在实验操作时遵循正确的操作规程和安全注意事项。
高中有机化学方程式总结

高中有机化学方程式总结一、烃1. 烷烃 —通式:C n H 2n -21氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色; 2取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HClCHCl 3又叫氯仿四氯化碳:CHCl 3+Cl 2 CCl 4+HCl3分解反应CH 4 C+2H 22. 烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 1氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2②乙烯可以使酸性高锰酸钾溶液褪色,2加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 32Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 3聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH↑+CaOH 2 1氧化反应①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O②乙炔可以使酸性高锰酸钾溶液褪色,2加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr CHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl 3聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2n乙炔加聚,得到聚乙炔:n HC ≡n 4. 苯 C 6H 6点燃光光光光浓硫酸170℃ 点燃催化剂 △ 催化剂加热加压 2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△催化剂△Br2—CHClCH=CH催化剂 △高温1氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O②苯不能使溴水和酸性高锰酸钾溶液褪色; 2取代反应 ①苯与溴反应+HO 3加成反应环己烷5. 甲苯 苯的同系物通式:C n H 2n-61氧化反应①甲苯的燃烧:C 7H 8+9O 2 7CO 2+4H 2O②甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色; 2取代反应3加成反应二、烃的衍生物点燃点燃+Br +3H CH 3| +3HNO 3浓硫酸 △ O 2N — CH 3 | —NO 2| NO 2 +3H 2O 三硝基甲苯TNT,是一种淡黄色晶体,不溶于水;它是一种烈性炸药CH 3 | + Cl 2 光CH 2Cl | + HCl CH 3 | + Cl 2 Fe CH 3 |+ HCl —Cl 甲苯和氯气在光照和铁的催化条件下发生的取代反应不一样 CH 3 |+ 3H 2 催化剂△ CH 3|烃的衍生物的重要类别和主要化学性质:6. 卤代烃1取代反应溴乙烷的水解:C 2H 5—Br+NaOH C 2H 5—OH+NaBr2消去反应溴乙烷与NaOH 溶液反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O7. 醇1与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑乙醇钠2氧化反应①乙醇的燃烧;②2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 乙醛3取代反应乙醇与浓氢溴酸反应:CH 3CH 2OH+HBr CH 3CH 2Br+H 2O4消去反应CH 3CH 2OH H 2C=CH 2↑+H 2O 注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚; 2C 2H 5OH C 2H 5—O —C 2H 5+H 2O 乙醚5酯化反应CH 3CH 2—OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O 乙酸乙酯8. 苯酚苯酚是无色晶体,露置在空气中会因氧化显粉红色;苯酚具有特殊的气味,熔点43℃, 水中溶解度不大,易溶于有机溶剂;苯酚有毒,是一种重要的化工原料;H 2O醇△Cu 或Ag△浓硫酸140℃ 浓硫酸170℃ △浓硫酸△1苯酚的酸性苯酚钠 苯酚钠与CO 2反应:+CO 2+H 2O +NaHCO 32取代反应+3Br 2 ↓+3HBr三溴苯酚 3显色反应苯酚能和FeCl 3溶液反应,使溶液呈紫色 4缩聚反应9. 醛乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发;1加成反应 乙醛与氢气反应:CH 3—C —H+H 2 CH 3CH 2OH2氧化反应 乙醛与氧气反应:2CH 3—C —H+O 2 2CH 3COOH 乙酸乙醛的银镜反应:CH 3CHO +2AgNH 32OH CH 3COONH 4+2Ag↓+3NH 3+H 2O注意:硝酸银与氨水配制而成的银氨溶液中含有AgNH 32OH 氢氧化二氨合银, 这是一种弱氧化剂,可以氧化乙醛,生成Ag;有关制备的方程式:Ag ++NH 3·H 2O===AgOH↓++4NHAgOH+2NH 3·H 2O===AgNH 32++OH -+2H 2O乙醛还原氢氧化铜:CH 3CHO+2CuOH 2 CH 3COOH+Cu 2O↓+2H 2O10. 羧酸1乙酸的酸性乙酸的电离:CH 3COOH CH 3COO -+H+2酯化反应CH 3CH 2—OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O 乙酸乙酯注意:酸和醇起作用,生成酯和水的反应叫做酯化反应;11. 酯乙酸乙酯是一种带有香味的无色油状液体; 1水解反应—OH +NaOH +H 2O —ONa —ONa—OH—OH—BrBr — OH| Br |O || 催化剂△O || 催化剂△△△O ||浓硫酸 △无机酸催化剂酚醛树脂的制取CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH 2中和反应CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH注意:酚酯类碱水解如: 的水解 +2NaOH→CH 3COONa+ + H 2O其他1葡萄糖的银镜反应 CH 2OHCHOH 4CHO +2AgNH 32OH CH2OHCHOH 4COONH 4+2Ag +3NH 3+H 2O2蔗糖的水解 C 12H 22O 11+ H 2OC 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖 3麦芽糖的水解 C 12H 22O 11 + H 2O2C 6H 12O 6麦芽糖 葡萄糖 4淀粉的水解:5葡萄糖变酒精 CH 2OHCHOH 4CHO 2CH 3CH 2OH +2CO 26纤维素水解7油酸甘油酯的氢化8硬脂酸甘油酯水解 ①酸性条件②碱性条件皂化反应附加:官能团转化示意图CH 3COO - -ONa CH 3COO -烃三、有机合成的常用方法 1、官能团的引入:在有机化学中,卤代烃可谓烃及烃的衍生物的桥梁,只要能得到卤代烃,就可能得到诸如含有羟基、醛基、羧基、酯基等官能团的物质;此外,由于卤代烃可以和醇类相互转化,因此在有机合成中,如果能引入羟基,也和引入卤原子的效果一样,其他有机物都可以信手拈来;同时引入羟基和引入双键往往是改变碳原子骨架的捷径,因此官能团的引入着重总结羟基、卤原子、双键的引入; 1引入羟基-OH①醇羟基的引入:a.烯烃与水加成;b.卤代烃碱性水解;c.醛酮与氢气加成;d.酯的水解; ②酚羟基的引入:酚钠盐过渡中通入CO 2 、的碱性水解等;③羧羟基的引入:醛氧化为酸被新制CuOH 2悬浊液或银氨溶液氧化、酯的水解等; 2引入卤原子:a.烃与X 2取代;b.不饱和烃与HX 或X 2加成;c.醇与HX 取代; 3引入双键:a.某些醇或卤代烃的消去引入C=C ;b.醇的氧化引入C=O; 2、官能团的消除1通过加成反应消除不饱和键;2通过消去、氧化或酯化等消除羟基-OH 3通过加成或氧化等消除醛基—CHO 4通过取代或消去消除卤素原子; 3、官能团间的衍变①利用官能团的衍生关系进行衍变,如伯醇[]−→−O 醛[]−→−O 羧酸;②通过某种化学途径使一个官能团变为两个,如一元醇经过消去、加成、取代变成二元醇如CH 3CH 2OH OH 2-−−→−消去CH 2=CH 22Cl +−−→−加成Cl —CH 2—CH 2—Cl−−→−水解HO —CH 2—CH 2—OH; ③通过某种手段,改变官能团位置;如丙醇 丙烯 2-丙醇 4、有机化学中碳链的增减方法 1增长碳链的方法①加聚反应:如nCH 3CH=CH 2消去加成H 2O一定条件下催化剂②缩聚反应:如③加成反应:如④酯化反应:如⑤卤代烃的取代反应:如⑥醛酮与HCN、ROH的加成反应:如2减短碳链的方法①氧化反应;包括燃烧,烯烃、炔烃的部分氧化,丁烷直接氧化成乙酸,某些苯的同系物氧化成苯甲酸,羧酸钠盐在碱石灰条件下的脱羧反应;②水解反应;主要包括酯的水解、蛋白质的水解和多糖的水解;5、常见有机官能团的保护1物质检验中碳碳双键与醛基的先后处理检验碳碳双键时,当有机物中含有醛基、碳碳双键等多个官能团时,可以先用弱氧化剂,如银氨溶液、新制的CuOH2悬浊液等氧化醛基,再用溴水、酸性KMnO4溶液进行碳碳双键的检验;2物质合成中酚羟基的保护由于酚羟基易被氧化,在有机合成中,如果需要用氧化剂进行氧化时,经常先将酚羟基通过酯化反应,使其成为酯而被保护,待氧化过程完成后,再通过水解反应,使酚羟基恢复;也可用NaOH处理成-ONa,再加H+复原;3为防止醇-OH被氧化可先将其酯化;4芳香胺-NH2的保护:转化为酰胺保护氨基;1.能使溴水Br2/H2O褪色的物质1有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀;③通过氧化反应使之褪色:含有—CHO醛基的有机物有水参加反应注意:纯净的只含有—CHO醛基的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯2无机物①通过与碱发生歧化反应3Br2 + 6OH- =5Br- + BrO3- + 3H2O或Br2 + 2OH- = Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质1有机物:含有、—C≡C—、—OH较慢、—CHO的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物与苯不反应2无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与含有酚羟基...、—COOH的有机物反应加热时,能与卤代烃、酯反应取代反应与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3;含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;含有—SO3H的有机物反应生成磺酸钠并放出CO2气体;与NaHCO3反应的有机物:含有-COOH、-SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2; 4.银镜反应的有机物1发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖葡萄糖、麦芽糖等2银氨溶液AgNH32OH多伦试剂的配制:向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失;3实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出4有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3AgOH + 2NH3·H2O == AgNH32OH + 2H2O银镜反应的一般通式:RCHO + 2AgNH32OH 2 Ag↓+ RCOONH4 + 3NH3 + H2O悬浊液斐林试剂的反应5.与新制CuOH21有机物:羧酸中和、甲酸先中和,后氧化、醛、还原性糖葡萄糖、麦芽糖、甘油等多羟基化合物;2斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液;3实验现象:①若有机物只有醛基-CHO,则滴入新制的CuOH2悬浊液中,常温时无变化,加热煮沸后有砖红色沉淀生成②若有机物为多羟基醛如葡萄糖,则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有砖红色沉淀生成4有关反应方程式:2NaOH + CuSO4 == CuOH2↓+ Na2SO4RCHO + 2CuOH2RCOOH + Cu2O↓+ 2H2OHCHO + 4CuOH2CO2 + 2Cu2O↓+ 5H2O巩固练习:1,乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料;它可以用甲苯和乙醇为原料进行人工合成;合成路线:1C 的结构简式为__________________________;2反应②、③的反应类型为_______________,_______________; 3甲苯的一氯代物有 种;4写出反应①的化学方程式_______________________________;5为了提高乙酸苯甲酯的产率应采取的措施是写一项 ; 2,下面是一个合成反应的流程图A BCH 2=CH 2 BrCH 2-CH 2Br C请写出:1.中间产物A 、B 、C 的结构简式:A .__________B . ________ C .____________ 2.①、②、③、④各步反应所需用的反应试剂及各步反应的类型①________、_______②__________、_______③________、______④________、______3,分子式为C 12H 14O 2的F 有机物广泛用于香精的调香剂;为了合成该物质,某实验室的科技人员设计了下列合成路线:1A 物质在核磁共振氢谱中能呈现 种峰;峰面积比为 2C 物质的官能团名称3上述合成路线中属于取代反应的是 填编号;4写出反应④、⑤、⑥的化学方程式:④ ⑤ ⑥5F 有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F 相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH 2COOCH 3; 4,菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物;⑴甲一定含有的官能团的名称是 ;⑵5.8g 甲完全燃烧可产生0.3mol CO 2和0.3 mol H 2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ;⑶苯氧乙酸有多种酯类的同分异构体,其中能与FeCl 3溶液发生显色反应,且有2种一硝基取代物的同分异构体是写出任意2种的结构简式 ;CH CH 3Cl 2 光 ① CH 2OH CH 2OH ② 催化剂 CHO CHO O 2 催化剂 ③ △ NaOH 水溶液 ④COOCH 2CH 2OH COOCH 2CH 2OH⑷已知:R-CH 2-COOH 2Cl −−−→催化剂R-ONa 'Cl-R∆−−−→R-O-R′R -、R′-代表烃基 菠萝酯的合成路线如下:①试剂X 不可选用的是选填字母 ;a. CH 3COONa 溶液b. NaOH 溶液c. NaHCO 3溶液d.Na②丙的结构简式是 ,反应II 的反应类型是 ; ③反应IV 的化学方程式是 ; 5,以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G;OOAF E 2△①②③△浓硫酸△C 13H 16O 42C 2H 4C 4H 8O 21E 是一种石油裂解气,能使酸性高锰酸钾溶液褪色;同温同压下,E 的密度是H 2的21倍;核磁共振氢谱显示E 有3种不同化学环境的氢原子,其个数比为1:2:3;E 的结构简式为 ;2反应类型:① ,④ ; 3反应条件:③ ,⑥ ; 4反应②、③的目的是 ; 5反应⑤的化学方程式为 ;6B 被氧化成C 的过程中会有中间产物生成,该中间产物可能是 写出一种物质的结构简式,检验该物质存在的试剂是 ;7G 的结构简式为 ;。
(完整版)高中有机化学方程式归纳
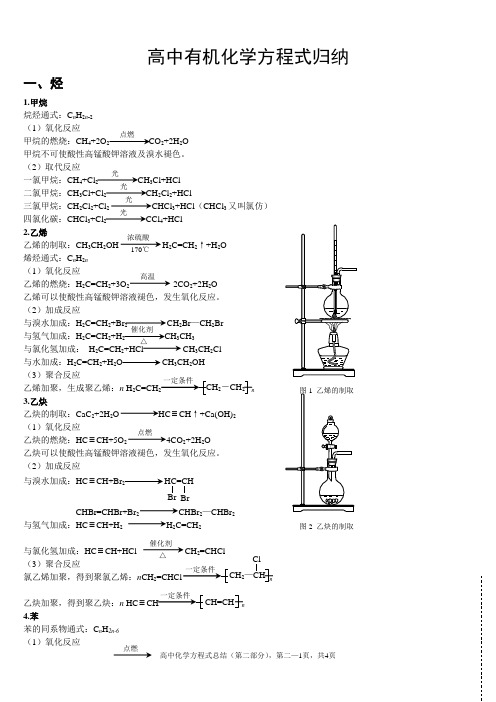
高中有机化学方程式归纳一、烃1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完美版)高中有机化学方程式总结

一、烃 1.甲烷烷烃通式:CnH2n-2 (1)氧化反应甲烷的燃烧:CH点燃4+2O22+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH+Cl光4二氯甲烷:CHCl+Cl 光3Cl+HCl322Cl2+HCl三氯甲烷:CH 光2Cl2+Cl2 CHCl3+HCl(CHCl3四氯化碳:CHCl 光又叫氯仿)3+Cl4+HCl2.乙烯浓硫酸乙烯的制取:CH3CH2OH 170℃ H2C=CH2↑+H2O 烯烃通式:CnH2n (1)氧化反应高温乙烯的燃烧:H2C=CH2+3O2乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
2CO2+2H2O (2)加成反应与溴水加成:HC=CH22+BrCH2Br—CH与氢气加成:H 催化剂 2Br2C=CH2+H3CH3与氯化氢加成: H△2C=CH2 CH3CH2Cl 与水加成:H2C=CH2+H2CH3CH2(3)聚合反应OH乙烯加聚,生成聚乙烯:n H2C=CH 2 - CH n3.乙炔乙炔的制取:CaC+2H22CH↑+Ca(OH)2 (1)氧化反应点燃乙炔的燃烧:HC CH+5O2 4CO2+2H2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC CH+Br2BrCHBr=CHBr+Br2 CHBr2—CHBr2与氢气加成:HC CH+H2 H2C=CH2 图2 乙炔的制取催化剂与氯化氢加成:HC CH+HCl △CH2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:nCH22 — n乙炔加聚,得到聚乙炔:n HC n4.苯苯的同系物通式:CnH2n-6 (1)氧化反应苯的燃烧:2C点燃6H6+15O2(2)取代反应12CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
①苯与溴反应Br +Br +HBr(溴苯)②硝化反应浓H2SO4 NO2+HO—NO2 60 ℃ +H2O(硝基苯)(3)加成反应+3H (环己烷)。
完美版高中有机化学方程式总结

高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHBr CHBr=CHBr+Br 2CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式总结(高三总复习)

8 乙 醇 分 子 间 脱 水 成 C2H5OH+HOC2H5 浓硫酸 C2H5OC2H5+H2O
醚
140C
9
乙醇与浓氢卤酸的 取代
CH3CH2OH+HBr CH3CH2Br+H2O
10
乙醇与酸的酯化反 应
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
3 乙烯能使酸性高锰 5CH2=CH2 + 12KMnO4 + 18H2SO4―→10CO2 + 12MnSO4 + 6K2SO4 +
酸钾褪色
28H2O
4
乙烯与溴水加成 CH2==CH2+Br2 CCl4 CH2Br—CH2Br
5
乙烯与水加成
CH2==CH2+H2O 催化剂 CH3CH2OH
加热、加压
2CH3CH2OH+O2 Cu /Ag 2CH3CHO+2H2O
5 正丙醇催化氧化
2CH3CH2CH2OH+O2 Cu /Ag 2CH3CH2CHO+2H2O
6 异丙醇催化氧化
2
+O2 Cu /Ag 2
+2H2O
7
乙醇直接被氧化成 乙酸
CH3CH2OH 酸性高锰酸钾/酸性重铬酸钾 CH3COOH
C16H34 高温 C14H30+C2H4
C16H34 高温 C12H26+C4H8
第 1 页 共 14 页
2、乙烯及烯烃 (易氧化、能使酸性高锰酸钾褪色、易加成、易加聚)
1
乙烯的制备
CH3CH2OH 浓硫酸 CH2===CH2↑+H2O 170C
2
乙烯的燃烧反应 CH2=CH2+3O2 点燃 2CO2+2H2O
有机化学方程式汇总
1、甲烷及烷烃 (易燃烧、易取代、可裂解)
高中化学有机方程式总结

高中有机化学方程式总结一、烃及烃的衍生物1、甲烷烷烃通式:C n H 2n +2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)分解反应甲烷分解:CH 4 C+2H 22、乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br—CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应点燃光 光 光光 高温浓硫酸170℃ 点燃催化剂 △乙烯加聚,生成聚乙烯:n H 2C=CH 23、乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH)2炔烃的通式:C n H 2n-2 (1)氧化反应乙炔的燃烧:2HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2CHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC ≡CH n 4、苯苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O苯不能使溴水和酸性高锰酸钾溶液褪色。
(完整版)高中有机化学方程式汇总

姓名高中有机化学方程式汇总甲烷及烷烃的反应(烷烃性质较稳定,主要是燃烧和取代反应)1. 甲烷的取代反应(一氯取代) CH 4 + Cl 2 CH 3Cl + HCl(取代反应)2. 甲烷的高温分解3. 甲烷的实验室制取4. 石油气的裂化5. 有机物的燃烧通式CxHyOz + (x+y/4-z/2)O 2 == xCO 2 + y/2H 2O乙烯的化学性质(乙烯产量标志着一个国家石油工业的发展水平)6. 乙烯与溴水的反应 (加成反应)7. 乙烯与水的反应 (加成反应)8. 乙烯与溴化氢反应(加成反应) 9. 乙烯与氢气反应 (加成反应) 10. 乙烯的催化氧化(氧化反应)11. 烯烃的燃烧通式12. 乙烯的加聚反应(加聚反应)苯密度比水小,沸点为80.1℃,不能使酸性高锰酸钾褪色,能萃取溴使溴水褪色。
13. 苯与液溴的反应 (催化剂为铁粉)(取代反应)14. 苯与浓硝酸的反应 (硝化反应)(取代反应) 15. 苯与浓硫酸反应(磺化反应)(取代反应)16. 苯与氢气反应(加成反应)17. 苯的生成反应18. 甲苯与浓硝酸反应(取代反应)浓硫酸Δ光照19. 甲苯被酸性高锰酸钾氧化(高锰酸钾褪色)(氧化反应)卤代烃的化学性质(卤代烃连接着烃及烃的衍生物,是有机反应的纽带)20. 卤代烃生成醇(水解反应)21. 卤代烃生成烯烃(消去反应)醇类的化学性质(甲乙丙等低级醇均可与水混溶,不能充当溶液的萃取剂)22. 工业上制乙醇 (加成反应)乙醇和氢卤酸反应→ 23. 乙醇和钠反应 (取代反应) 24. 乙醇的催化氧化(氧化反应) 25. 乙醇的脱水反应(分子内) (消去反应)乙醇的脱水反应(分子间)(取代反应)26. 乙醇与酸的酯化反应(取代反应)醛的化学性质(甲醛是市内装修的主要污染物,其水溶液叫福尔马林)27. 乙醛与氢气的加成 (加成反应) 28. 乙醛的催化氧化 (氧化反应)29. 银镜反应(氧化) 30. 醛与新制氢氧化铜的反应(氧化)羧酸的化学性质(甲酸的分子结构决定了它既有酸的性质,又有醛的性质)31. 冰醋酸与金属钠反应 (置换/取代)32. 醋酸与纯碱反应 (复分解) 33. 醋酸与小苏打反应 (复分解)34. 醋酸与烧碱反应(中和)C 2H 5OH+H —Br ΔCH 3CH 2Br+H 2O (取代反应)35. 醋酸与弱碱反应(中和)36. 醋酸与醇的酯化反应 (酯化/取代)37. 甲酸的银镜反应(氧化)酯的化学性质(有催化剂及加热情况下才会水解;碱存在时完全水解,反应不可逆;酸存在时,部分水解,反应可逆)38. 酯的碱性水解(取代反应)39. 酯的酸性水解(取代反应) 40. 酯键的缩聚 (缩聚反应) 41. 丁二烯烃的加聚反应(加聚反应)炔烃的化学性质(可加成、加聚,可使酸性高锰酸钾褪色)42. 实验室制乙炔43. 乙炔与溴水1:1加成(加成反应)乙炔与氢气足量加成((加成反应) 乙炔与水1:1加成(加成反应)44. 1,2-二溴乙烯与液溴的加成(加成反应) 45. 氯乙烯的加聚反应(加聚反应)苯酚(易被氧气氧化成粉红色,有毒,沾到皮肤时,应立即用酒精清洗;常温下微溶于水,65℃以上时与水混溶;能使高锰酸钾褪色)46. 苯酚与强碱的反应(复分解反应)(可用于除去苯中混有的少量苯酚)47. 苯酚的电离(弱酸性)48. 苯酚钠与二氧化碳反应(复分解反应)(比较碳酸与石炭酸的酸性强弱)49. 苯酚与浓溴水的取代反应(取代反应)⇋2H 2CH 3CH 350.苯酚与浓硝酸的硝化反应(取代反应)51.酚类的显色反应(紫色,可用于检验酚类物质)52.苯酚与氢气的加成反应(加成反应)53.苯酚的缩聚反应基本营养物质的组成及性质54.葡萄糖的彻底氧化55.二糖蔗糖的水解(取代反应)(水解反应)二糖麦芽糖的水解56.多糖淀粉的水解(取代反应)(水解反应)多糖纤维素的水解57.植物油的硬化反应58.油脂的水解反应(皂化反应)59.乙二醇与乙二酸的聚合反应。
高中有机化学方程式汇总

高中有机化学方程式汇总一、取代反应1、CH 4 + Cl 2 HCl + CH 3Cl ( 气态) 一氯甲烷CH 3Cl + Cl 2HCl + CH 2Cl2 ( 液态 ) 二氯甲烷CH 2Cl + Cl 2HCl + CHCl 3 ( 液态 ) 三氯甲烷或氯仿 CHCl 3+ Cl 2HCl +CCl 4 ( 液态 )四氯甲烷或四氯化碳 2、C 2H 6 + Cl 2 HCl + CH 3CH 2Cl3 + Br 2Br + HBr (真正催化剂是FeBr3)3 + Cl 22Cl + HCl3 + 3Cl 2 + 3HCl4 + HONO 2 2 + H 2O+ HOSO 3H 3H + H 2O5 + 3Br 2 + 3HBr+ 3HONO 2 + H 2O6、C 2H 5OH + HBr C 2H 5Br + H 2O C 2H 5Br C 2H 5OH + HBrC 2H 5Br CH 2 CH 2 + HBr7、CH 3COOC 2H 5 + H 2O CH 3COOH + C 2H 5 OH光照光照光照 光照光照Fe 光照无水AlCl 3Cl LNaOHH 2O NaOHC 2H 5OHBr L3H 2SO 4浓50-60℃2NO NO 2 LH 2SO 4浓50-60℃ H 2SO 4浓70-80℃ 无机酸或碱8、 + 3 NaOH + 3C 17H 35 COONa二、加成反应1、CH 2 CH 2 + H 2CH 3 CH 32、CH 2 CH 2 + HCl CH 3 CH 2Cl3、CH 3CH CH 2+ HClCH 3 CHClCH3(马氏加成)CH 3 CHCH 2 + HCl CH 3 CH 2 CH 2Cl (反马氏加成)4、CH CH + H 2 CH 2 CH 2 CH CH + 2 H 2 CH 3 CH 35、CH CH + 2HCl CH 3 CHCl 26、CH 3 CHO + 2 H 2 CH 3 CH 2OH 7+ 3 H 2 + H 2 CH 3 CH 2 CH 3+ H 2 CH 3 CH 2 CH 2 CH 3 ㊣ Pt 比Ni 催化效率高 8+ 3Cl 2 C 6H 6 Cl 69、 CH 2 CH 2 + H 2O CH 3 CH 2OHCH CH + H 2O 2CH 2 CH 2 + O 22 1、CH3 CH 2OH CH 2 2 + H 2O2、2CH 3 CH 2OH+ H 2O (分子间脱水) 3、C 2H 5 Cl CH 2 CH 2 + H ClOOOCH 2 O C C 17H 35 CH O C C 17H 35 CH 2 O C 17H 35CH 2CH OH CH 2 无水AlCl 3/HgCl 2/ZnCl 2150-160℃ 无过氧酸有过氧酸如CH 3COOOH 催化剂加热 HHC CH Cl +--+ H Cl无水AlCl 3 H 2SO 4 或 H 3PO 4 加热 加压HgSO 4(H +)OCH 3 C H高温、高压PdCl 2 或CuCl 2OCH 3 C H三、消去反应H 2SO 4浓170℃ H 2SO 4浓 140℃CH 3 CH 2 O CH 2 CH 3 NaOH C 2H 5OH四、酯化反应 (酯化反应也是取代反应)1、CH 3 COOH + CH 3 CH 2OH CH 3 COOCH 2 CH 3 + H 2O2、 + 3HONO 2+ H 2O3、[C 6H 7 O 2(OH) 3 ]n + 3n HONO 2 [C 6H 7 O 2(NO 2) 3 ]n + 3nH 2O 五、水解反应(卤代烃、酯、油脂的水解见上,也是取代反应)1、CH 3 COONa + H 2O 3 COOH + NaOH2、C 17H 35 COONa + H 2 C 17H 35 COOH + NaOH3、(C 6H 10O 5)n + nH 2O n C 6H 12O 64、C 12H 22O11 + H 2OC 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖5、CH 3 COOCH 2 CH 3 + H 2O CH 3 COOH + CH 3 CH 2OH六、氧化反应①被强氧化剂氧化 1、2 CH 3 CH 2OH + O 2 2 + H 2O 2、2 + O 2 2 CH 3 COOH 3、2 CH 2 CH 2 + O 2 2 ②被弱氧化剂缓慢氧化1、CH 3 CHO + 2[Ag(NH 3)2] OH CH 3 COOH + 4 NH 3 + 2Ag + H 2O2、CH 3 CHO + 2 Cu(OH)2 CH 3 COOH + 2 Cu 2O + H 2O3、CH 2 OH(CHOH)4 CHO + 2[Ag(NH 3)2] OH CH 2 OH(CHOH)4 COOH + 4 NH 3 + 2Ag + H 2O4、CH 2 OH(CHOH)4 CHO +2 Cu(OH)2 OH(CHOH)4 COOH + 2 Cu 2O + H 2O5、HCOOH + 2[Ag(NH 3)2] OH CO 2 + 4 NH 3 + 2Ag + H 2OH 2SO 4浓 加热CH 2 OH CH OHCH 2 OHCH 2 O NO 2 CH O NO 2 CH 2 O NO 2 H 2SO 4浓 H 2SO 4浓H 2SO 4稀加热淀粉/纤维素 葡萄糖H 2SO 4稀加热蔗糖 葡萄糖 果糖H 2SO 4稀加热无机酸 或碱Cu 或Ag OCH3 C H OCH 3 C H Mn(AC)2 Mn(AC)2 OCH 3 C H 水浴加热 水浴加热 水浴加热6、HCOOH + 2 Cu(OH)2CO 2 + 2 Cu 2O + 2H 2O③有化合机物的燃烧 C x H y + (x+y /4) O 2xCO 2 + y /4 H 2O七、还原反应1、+ H 22、 + H 2 CH 3 CH 2OH3、 八、加聚反应1、n CH 2 CH 22、n CH CH3、 九、缩聚反应1、n+ nH 2O2、+ nH 2O 1、CH 4 C + 2H 2 C 16H 34 C 8H 16 + C 8H 18C 8H 18 C 4H 8 + C 4H 10 C 8H 16 CH 4 + C 7H 12十一、其它有机反应12 + H 2O 3 2、2CH 3 CH 2OH + 2Na 2CH 3 CH 2O Na + H 2 3、OH + 2Na 24、C 12H 22O 11 12C + 11 H 2O C + 2H 2SO 4(浓) CO 2 +2 SO 2 + 2H 2O5、氨基酸的两性点燃 O CH 3 C CH 3 CH 3 C CH 3 OCH 3 C H 2 CH 2 + H 2 2 CH 3nCH 2 CH CH 2 CH 2催化剂[ CH 2 CH CH 2 CH 2]nH N CH 2 C OH H O [N CH 2 C ]n H O催化剂COOH + nHO CH 2 CH 2 OH 催化剂O O CH 2 CH 2 O C C]n [ O 十、裂化反应高温 高温 高温 高温 H 2SO 4浓 + HClCH 2 COOH NH 2 CH 2 COOHNH 3Cl+ NaOHCH 2 COOH NH 2CH 2 COONa + NH 2H 2O。
高中有机化学方程式汇总(全)(已免费)

高中有機化學方程式匯總1. CH4 + Cl 2光照CH3Cl + HCl2. CH3Cl + Cl 2光照CH2Cl2 + HCl3. CH2Cl + Cl 2光照CHCl 3 + HCl4. CHCl 3 + Cl2光照CCl4+ HCl5. CH4高温 C +2H26.C H催化剂 C H+ C H3418161688加热、加压4 ↑+ Na233CaOCH7. CH COONa + NaOH△CO8. CH2 = CH2 + Br2CH2Br—CH2Br9. CH2 = CH2 + H2O 催化剂CH3CH2OH22+ HBr催化剂CH3—CH2Br 10. CH = CH△22+ H2催化剂CH3—CH311. CH = CH△22催化剂[ CH 2—CH2]n12. nCH = CH13. nCH =CH-CH=CH2催化剂[CH -CH=CH-CH ]22 2 n14. 2CH2 = CH2 + O2催化剂2CH3CHO15. CH≡CH + Br 2CHBr = CHBr16. CHBr = CHBr+ Br 2CHBr 2- CHBr 217. CH≡CH + HCl催化剂H 2C = CHCl△18. nCH2 = CH[ CH2-CH ] nCl Cl19.CH≡CH + H 2O 催化剂 CH3CHO20.CaC2 + 2H2OCH ≡CH↑+ Ca(OH)221.催化剂Br + HBr + Br222.+ HO-NO2浓硫酸NO2+H2O△23.+ HO-SO3H △SO3H+H 2O24.+ 3H2催化剂△CH3CH325.+3HO-NO2催化剂O2N NO2+3H O226.→NO3CH≡ CH227. CH3CH 2Br + H2O NaOH CH 3CH2OH + HBr28. CH3CH 2Br + NaOH H 2O CH 3CH2OH + NaBr29. CH3CH 2Br+ NaOH醇CH2 = CH2 + NaBr +H 2O△30.2CH3CH 2OH+2Na2CH3CH2ONa + H2↑31.2CH3CH 2OH+O2催化剂2CH3CHO + 2H2O △32OH浓硫酸CH2= CH2↑+ H2O32. CH CH170℃33.C2H5OH+C2H5OH 浓硫酸C2H5OC2H5+H2O140℃34.OH+NaOH ONa+H2O35.OH+H2O O-+H3O+36.ONa+H2O+CO2OH+ NaHCO3OH OHBr↓Br+3HBr37.+3Br2Br催化剂CH3CH2OH 38. CH3CHO + H 2△催化剂2CH3COOH 39. 2CH3CHO + O2△40. CH3CHO+2Ag(NH 3)2 OH △↓ +3NH3+H2O CH3COONH 4+2Ag41CH3CHO+2Cu(OH)2△CH3COOH+Cu 2O↓ +2H 2O42. 2CH3COOH+2Na2CH 3COONa+H2↑43.2CH3COOH+Na2CO32CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH 3COOH + Cu(OH) 2(CH 3COO) 2Cu + 2H 2O 47.CH 3COOH+CH 3CH 2OH浓硫酸 CH 3COOCH 2CH 3 +H 2O△ 48. CH 3COOCH 2CH 3 +NaOH CH 3COONa+CH 3CH 2OH49. nOHCH 2CH 2COO H →[ OCH 2CH 2C ] n +H 2O 50. C 6 H 12O 6 (s) + 6O 2 (g)6CO 2 (g) + 6H 2O (l) 51. C 6 H 12O 6 催化剂2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O 催化剂 C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖53. C 12H 22O 11 + H 2O 催化剂2C 6H 12O 6麦芽唐 葡萄糖54. (C 6H 10O 5)n + nH 2O催化剂 n C 6H 12O 6 淀粉葡萄糖 6 10 5 ) n 2 O 催化剂 6 12 6 55. (C H O + nH △n C H O 纤维素葡萄糖 56.C 17H 33COO-CH 2催化剂 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 加热、加压C 17H 35COO-CH C 17H 33COO-CH 2C 17H 35COO-CH 2 57. C 17H 35COO-CH 2CH 2-OH C 17H 35COO-CH +3NaOH3C 17H 35COONa+ CH-OH C 17H 35COO-CH 2O O CH 2-OH 58. CH 2OH COOH+CH 2OH COOHC — C 浓硫酸 O O 2 △光CH 2- CH 2 1.CH 4Cl 2 HCl CH 3 Cl CH 3Cl Cl 2光 HCl CH 2 Cl 2 2.3.4.5.6.7.8.CH 2CH CH CH 2Br29.10.11.12.13.14.15.16.17.HOCH 2 (CHOH ) 4 CHO2Ag (NH 3 ) 2 OH HOCH 2 (CHOH )4 COONH 42Ag3NH 3H 2O18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1 )、银镜反应( 2)、乙酸乙酯的水解( 3 )苯的硝化( 4)糖的水解(5 )、酚醛树脂的制取( 6)固体溶解度的测定凡是在不高于 100 ℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式总结(绝对全)

1.高中有机化学方程式总结绝对全2.CH4C2光照CH3CC2CH2C2C2CHC33C2CC42H218C8H16加热、加压催化剂光照光照光照NaOHCaOCH4↑Na2CO3△2=CH22=CH2H2OCH3CH2OH2=CH2HBr催化剂32△2=CH2H2催化剂CH3CH3△2=CH2[CH2CH2]n2=CH-CH=CH2[CH2-CH=CH-CH2]2=CH2≡CHBr2CHBr==CHBrBr2CHBr2-≡CHHC催化剂△H2C=2=CH[CH2-CH]≡CHH2O催化剂CH3CHO22H2OCH≡CH↑CaOH221Br2BrHBr22HO-NO2浓硫酸NO2H2O △催化剂催化剂催化剂23HO-SO3HSO3HH2O24CH3O2N3H2催化剂△CH3NO2NO2△253HO-NO2催化剂≡CH→H2OCH3CH2OHNaOHCH3CH2OHNaOH醇CH2=CH2NaBrH2O △H2ONaOH2Na2CH3CH2ONaH2↑O2催化剂2CH3CHO2H2O△2=CH2↑H2O170℃C2H5OHC2H5OC2H5H2O140℃NaOHONaH2OO-H3OH2OCO2OHNaHCO3OHOHBr37.3Br2Br↓3HBrH2催化剂CH3CH2OH△O2催化剂2CH3COOH△2AgNH32OHCH3COONH42Ag↓3NH3H2O41CH3CHO2CuOH2△CH3COOHCu2O↓2H2O△2Na2CH3COONaH2↑Na2CO32CH3COONaH2OCO2↑NaHCO3CH3COONaH2OCO2↑NaOHCH3COONaH2OCuOH2CH3COO2Cu2H2O浓硫酸△CH3CH2OHCH3COOCH2CH3H2O3NaOHCH3COONa→[OCH2CH2C]n66O2g6CO2g6H2O2CO2 11H2O催化剂C6H12O6C6H12O6蔗糖葡萄糖果糖11H2O催化剂2C6H12O6麦芽唐葡萄糖54C6H10O5nnH2O催化剂nC6H12O6淀粉葡萄糖55C6H10O5nnH2O催化剂nC6H12O6△纤维素葡萄糖2催化剂C17H33COO-CH3H2C17H35COO-CH加热、加压3NaOH3C17H35COONa浓硫酸CH2OHCOOH△CCOO2H2OCH2-CH21.CH4C2CH3CHC光CH3CC2CH2C2HC光2.3.4.5.6.7.8.CH2CHCHCH2Br29.10.11.12.13.14.15.16.17.HOCH2CHOH4CHO2AgNH32OHHOCH2CHOH4COONH42Ag3NH3H2O 18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式汇总(全)(已免费)

Ca催化催催化催化催催催高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO催化催NaO催化15. CH≡CH + Br2 CHBr = CHBr16. CHBr = CHBr+ Br2 CHBr2-CHBr217. CH≡CH + HCl H2C = CHCl18. nCH2 = CH [ CH2-CH ] nCl Cl19. CH≡CH + H2O CH3CHO20. CaC2 + 2H2O CH≡CH↑+ Ca(OH)2-2 +H2O-SO33H+H2O225. +3HO-NO22O26. 3CH≡H醇催化浓硫浓硫BrOH催化催化△27. CH3CH2Br + H2O CH3CH2OH + HBr28. CH3CH2Br + NaOH CH3CH2OH + NaBr29. CH3CH2Br+ NaOH CH2 = CH2 + NaBr +H2O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O+C2H5OH C2H5OC2H5+H2O34. OH+NaOH ONa+H2O2O O-+H3O+233738. CH3CHO + H2 CH3CH2OH39. 2CH3CHO + O2 2CH3COOH△催催催40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ +Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 33COO)2Cu + 2H 2O+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6催催化催化+浓硫+ 2H O O C —O OCH -麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2 57. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OH C 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOH CH 2OH COOH1.HCl Cl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+ O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
(完整版)高中有机化学方程式大全

(完整版)⾼中有机化学⽅程式⼤全光照光照光照光照⾼温 CaO △催化剂加热、加压催化剂△催化剂⾼中有机化学⽅程式⼤全1. CH 4 + Cl 2 CH3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 3 12. nCH 2 = CH 2 ] n13. nCH 2-CH=CH-CH 2] n14. 2CH 23CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O 23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+233738. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH3↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClCl CH Cl CH+→+324光HCl Cl CH Cl Cl CH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.10.11.12.13.14.15.16.17. OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应点燃光光光光浓硫酸170℃ 高温催化剂 △2-CH 2点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH点燃①苯与溴反应(溴苯) ②硝化反应+HO —NO 2 +H 2O (硝基苯) (3)加成反应(环己烷)。
5.甲苯(1)氧化反应甲苯的燃烧:C 7H 8+9O 2 7CO 2+4H 2O甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT ), 是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
二、烃的衍生物6.溴乙烷:(1)取代反应点燃+Br +HBrBr浓H 2SO 4 60℃—NO 2+3H CH 3| +3HNO 3 浓硫酸O 2N — CH 3 | —NO 2| NO 2+3H 2O溴乙烷的水解:C 2H 5—Br+H 2O C 2H 5—OH+HBr (2)消去反应溴乙烷与NaOH 溶液反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 7.乙醇(1)与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑(乙醇钠)(2)氧化反应乙醇的燃烧:2CH 3CH 2OH+O 22CH 3CHO+2H 2O (乙醛)(3)消去反应乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。
2C 2H 5OH C 2H 5—O —C 2H 5+H 2O (乙醚) 8.苯酚苯酚是无色晶体,露置在空气中会因氧化显粉红色。
苯酚具有特殊的气味,熔点 43℃,水中溶解度不大,易溶于有机溶剂。
苯酚有毒,是一种重要的化工原料。
(1)苯酚的酸性(苯酚钠)苯酚钠与CO 2反应:+CO 2+H 2 +NaHCO 3(2)取代反应+3Br 2 ↓+3HBr(三溴苯酚)(3)显色反应苯酚能和FeCl 3溶液反应,使溶液呈紫色。
9.乙醛乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
(1)加成反应 乙醛与氢气反应:CH 3—C —H+H 2 CH 3CH 2OH(2)氧化反应 乙醛与氧气反应:2CH 3—C —H+O 2 2CH 3COOH (乙酸)乙醛的银镜反应:CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2Ag+3NH 3+H 2O (乙酸铵)注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH 3)2OH (氢氧化二氨合银), 这是一种弱氧化剂,可以氧化乙醛,生成Ag 。
有关制备的方程式: Ag ++NH 3·H 2O===AgOH ↓++4NHAgOH+2NH 3·H 2O===[Ag(NH 3)2]++OH -+2H 2O乙醛还原氢氧化铜:CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O10.乙酸醇△催化剂△浓硫酸140℃ —OH +H 2O ONa —ONa OH—OH—BrBr — OH| Br | O || 催化剂△O || 催化剂△△△(1)乙酸的酸性乙酸的电离:CH 3COOH CH 3COO -+H + (2)酯化反应CH 3—C —OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O (乙酸乙酯)注意:酸和醇起作用,生成酯和水的反应叫做酯化反应。
11.乙酸乙酯乙酸乙酯是一种带有香味的物色油状液体。
(1)水解反应CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH(2)中和反应CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH附加:烃的衍生物的转化高中有机化学知识点总结 1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃)〔说明〕:(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
O||卤代烃 R —X醇 R —OH 醛 R —CHO 羧酸 RCOOH 酯RCOOR ’水解 酯化 氧化还原氧化 酯化 水解不饱和烃 加成消去消去加成浓硫酸 △ 无机酸3.能与Na反应的有机物有:醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物(2)含有羟基的化合物如醇和酚类物质(3)含有醛基的化合物(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)6.能使溴水褪色的物质有:(1)含有碳碳双键和碳碳叁键的烃和烃的衍生物(加成)(2)苯酚等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)(6)有机溶剂(如苯和苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
)7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解13.能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱和化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都是被氧气氧化。
14.显酸性的有机物有:含有酚羟基和羧基的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)17.能与NaOH溶液发生反应的有机物:(1)酚:(2)羧酸:(3)卤代烃(水溶液:水解;醇溶液:消去)(4)酯:(水解,不加热反应慢,加热反应快)(5)蛋白质(水解)18、有明显颜色变化的有机反应:1.苯酚与三氯化铁溶液反应呈紫色;2.KMnO4酸性溶液的褪色;3.溴水的褪色;4.淀粉遇碘单质变蓝色。
5.蛋白质遇浓硝酸呈黄色颜色反应1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag++Cl-=AgCl↓2、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑3、钠与硫酸铜溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑4、过氧化钠与水反应:2Na2O+2H2O=4Na++4OH-+O2↑5、碳酸氢盐溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O6、6、碳酸氢盐溶液与醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-7、氢氧化钙溶液与碳酸氢镁反应:Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓8、向碳酸氢钙溶液中加入过量的氢氧化钠:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32–9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH-=CaCO3↓+H2O10、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O12、澄清石灰水通入过量CO2:OH–+CO2=HCO3-13、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O14、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3•H2O16、碳酸钠溶液与盐酸反应:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O17、向氢氧化钠溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O18、过量的CO2通入氢氧化钠溶液中:CO2+OH–=HCO3-19、碳酸氢铵溶液中加入过量氢氧化钠溶液:NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O20、碳酸钙与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O21、碳酸钙与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O22、澄清石灰水与稀盐酸反应:H++OH–=H2O23、磷酸溶液与少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–24、磷酸溶液与过量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O25、碳酸镁溶于强酸:MgCO3+2H+=Mg2++CO2↑+H2O26、硫酸镁溶液跟氢氧化钡溶液反应:Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓27、硫酸溶液跟氢氧化钡溶液反应:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O28、硫酸氢钠溶液与氢氧化钡反应至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀:H++SO42–+OH–+Ba2+=BaSO4↓+H2O30、硫酸铝溶液中加入过量氢氧化钡溶液:2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H+=Mg2++2H2O32、铝跟氢氧化钠溶液反应:2Al+2OH–+2H2O=2AlO2–+3H2↑33、物质的量之比为1:1NaAl合金置于水中:Na+Al+2H2O=Na++AlO2–+2H2↑34、氧化铝溶于强碱溶液:Al2O3+2OH–=2AlO2–+H2O35、氧化铝溶于强酸溶液:Al2O3+6H+=2Al3++3H2O36、氢氧化铝与氢氧化钠溶液:Al(OH)3+OH–=AlO2–+2H2O37、氢氧化铝与盐酸溶液反应:Al(OH)3+3H+=Al3++3H2O38、硫酸铝溶液与碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑39、硫酸铝溶液与碳酸钠溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑40、氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+41、明矾溶液加热水解生成沉淀:Al3++3H2O=Al(OH)3↓+3H+42、氯化铝溶液与偏铝酸钠溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓43、偏铝酸钠溶液中加入氯化铁溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓44、偏铝酸钠溶液中加入少量盐酸:AlO2–+H++H2O=Al(OH)3↓45、偏铝酸钠溶液中加入过量盐酸:AlO2–+4H+=Al3++2H2O46、偏铝酸钠溶液中加入氯化铵溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑47、金属铁溶于盐酸中:Fe+2H+=Fe2++H2↑48、铁粉与氯化铁溶液反应:Fe+2Fe3+=3Fe2+49、铜与氯化铁溶液反应:Cu+2Fe3+=Cu2++3Fe2+50、硫化亚铁与盐酸反应:FeS+H+=Fe2++H2S↑51、硫化钠与盐酸反应:S2–+2H+=H2S↑52、硫化钠溶液中加入溴水:S2–+Br2=S↓+2Br–53、氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl–54、向硫酸铁的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+55、氯化铁溶液中滴加少量硫化钠溶液:2Fe3++S2–=S↓+2Fe2+56、硫化钠溶液中滴加少量氯化铁溶液:2Fe3++3S2–=S↓+2FeS↓57、氯化铁溶液中滴加少量碘化钾溶液:2Fe3++2I–=2Fe2++I258、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH–=Fe(OH)3↓59、氯化铁溶液跟过量氨水反应:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+60、氯化铁溶液与硫氰化钾溶液:Fe3++3SCN–=Fe(SCN)361、氯化铁溶液跟过量锌粉反应:2Fe3++3Zn=2Fe+3Zn2+62、锌与稀硫酸:Zn+2H+=Zn2++H2↑63、63、锌与醋酸:Zn+2CH3COOH=CH3COO–+Zn2++H2↑64、64、锌与氯化铵溶液:Zn+2NH4+=Zn2++NH3↑+H2↑65、65、氯化铁溶液加入碘化钾溶液:2Fe3++2I-=2Fe2++I266、66、硫酸亚铁溶液中加用硫酸酸化的过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O67、67、硫酸亚铁溶液中加用硫酸酸化的高锰酸钾溶液:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O68、68、四氧化三铁溶于浓盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O69、氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O70、70、氧化铁溶于氢碘酸溶液:Fe2O3+2I-+6H+=2Fe2++I2+3H2O71、71、用氯化铁与沸水反应制氢氧化铁胶体:Fe3++3H2O Fe(OH)3+3H+72、72、向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-73、73、向溴化亚铁溶液通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-74、74、向碘化亚铁溶液通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-75、75、向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-76、76、碘化钾溶液中加入氯水:2I-+Cl2=I2+2Cl-77、77、碘化钾溶液中加入过量氯水:I-+3Cl2+3H2O=6H++IO3-+6Cl-78、78、溴化钠溶液中加入氯水:2Br-+Cl2=Br2+2Cl-79、79、亚硫酸溶液中加入氯水:H2SO3+Cl2+H2O=4H++2Cl-+SO42-80、80、亚硫酸溶液中加入氯化铁:H2SO3+2Fe2++H2O=4H++2Fe2++SO42-81、81、亚硫酸溶液中加入双氧水:H2SO3++H2O2=2H++H2O+SO42-82、82、氯气通入水中:Cl2+H2O=H++Cl-+HClO83、83、氯气通入碳酸氢钠溶液中:Cl2+HCO3=Cl-+CO2+HClO84、84、亚硫酸钠溶液中加入溴水:SO32-+H2O+Br2=SO42-+Br-+2H+85、85、亚硫酸钠溶液中加入双氧水:SO32-+H2O2=SO42-+2H2O86、86、二氧化硫通入溴水中:SO2+Br2+2H2O=4H++2Br-+SO42-87、87、单质铁溶于过量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O88、88、过量单质铁溶于稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O89、89、单质铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O90、90、单质铜与浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O91、91、铜片插入硝酸银溶液:2Ag++Cu=2Ag+Cu2+92、92、用氨水吸收少量SO2:SO2+2NH3+H2O=2NH4++SO32-93、93、用氨水吸收过量的SO¬2 :SO2+NH3+H2O=NH4++HSO3-94、94、稀硝酸中通入SO2:3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+95、95、浓硝酸中通入SO2:SO2+2NO3-=SO42-+2NO2↑96、96、氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- NH3↑+H2O97、97、向次氯酸钙溶液中通入SO2:Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+98、98、用碳酸钠溶液吸收过量SO2:CO32-+H2O+2SO2=CO2↑+2HSO3-99、99、硫酸铜溶液中通入硫化氢:H2S+Cu2+=CuS↓+2H+100、100、硫酸铜溶液中加入硫化钠溶液:S2-+Cu2+=CuS↓101、101、电解饱和食盐水:2Cl-+2H2O 2OH-+H2↑+Cl2↑102、102、电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+103、103、电解氯化铜溶液:Cu2++2Cl- Cu↓+Cl2↑104、104、电解熔融氯化钠:2Na++2Cl-(熔融) 2Na+Cl2↑105、105、电解熔融氧化铝:4Al3+ +6O2- 4Al+3O2↑106、106、二氧化锰与浓盐酸共热:MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O 107、107、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O108、108、氯气通入热的氢氧化钾溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O109、109、次氯酸钙溶液通入过量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3- 110、110、次氯酸钠溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O111、111、氯酸钾与浓盐酸:ClO3-+5Cl-+6H+=3Cl2↑+3H2O112、112、硫化钠、亚硫酸钠混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O113、113、NO2溶于水:3NO2+H2O=2H++NO3-+NO↑114、114、NO2通入亚硫酸钠溶液:SO32-+NO2=SO42-+NO↑115、115、硫化钠的第一步水解:S2-+H2O HSO3-+OH-116、116、碳酸钠的第一步水解:CO32-+H2O HCO3-+OH-117、117、氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓118、118、硫溶于热的氢氧化钠溶液:3S+6OH-=2S2-+SO32-+3H2O119、119、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH 120、120、醋酸与氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O121、121、醋酸与氨水反应:CH3COOH+NH3•H2O=CH3COO-+NH4++2H2O122、122、苯酚溶于氢氧化钠溶液:C6H5OH+OH-=C6H5O-+H2O123、123、苯酚与氯化铁溶液反应:6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+124、124、苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH=C6H5OH+CH3COO-125、125、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-126、126、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-127、127、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-128、128、甲酸钠跟盐酸反应:HCOO-+H+=HCOOH129、29、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-130、130、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O131、131、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 132、132、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O133、133、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+134、134、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O135、135、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3 136、136、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH137、137、氯乙烷在氢氧化钠溶液中水解:CH3CH2Cl+OH-=CH3CH2OH+Cl-138、138、硝酸银溶液中滴入少量氨水:Ag++NH3•H2O=AgOH↓+NH4+139、139、硝酸银溶液中滴加氨水至过量:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O 140、140、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-= CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O+2Ag↓141、141、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓142、142、硫酸铜溶液中加入少量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ 143、143、硫酸铜溶液中加入过量氨水:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O 144、144、硫酸锌溶液中加入少量氨水:Zn2++2NH3•H2O=Zn(OH)2↓+2NH4+ 145、145、硫酸锌溶液中加入过量氨水:Zn2++4NH3•H2O=[Zn(NH3)4]2++4H2O。
