配位化学第三章
配位化学第三章(2)配合物分解

Werner 理论 基本要点
主价和副价 中心原子的氧化数和配位数 内界和外界 “[ ]”为内界,与内界保持电荷 平衡的其它简单离子为外界 空间构型
副价具有方向性,指向空间确定的位置
配位理论的重要贡献 •提出副价的概念,补充了当时不完善的化合价理论。 •提出的空间概念,创造性地把有机化学中的结构理 论扩展到无机物的领域,奠定了立体化学基础。
:NH3
: F-
:Cl-
[:C= N][:O-H]氰根离子 羟基
[:O-N=O] 亚硝基
Ii:多配位基配位体(polydentate): 配体中有多个配位原子能与中心离子形成多个配位键。 例如:
231
2-
双齿配体
O
O C C O
H2 C H2 N
CH2 NH2
O
乙二胺(en) 多齿配体
草酸根(OX)
能与除了Na+,K+,Rb+,Cs+等离子以外的大多数金属离子 如Ca2+, Mg2+等离子形成稳定的螯合物。 (1、可用于除去水中的Ca2+ , Mg2+离子来软化水 2、滴定分析)
291
螯合物特性: • 具有很高的稳定性; • 具有特征颜色; • 难溶于水而易溶于有机溶剂。
被广泛地用于沉淀分离、溶剂萃取、比色测定、 容量分析等分离、分析工作。
“链理论”
结论:链理论 • 如: CoCl · 3NH ,按照所提的结构式,有一个 Cl 3 3 不正确
可与AgNO3反应生成AgCl沉淀,但实际是中性分 子,电导为0,分子中的三个Cl-反应性都低。
51
后来,维尔纳用假设和实验证明了自己理论的正确,并获得了 1913年的诺贝尔化学奖 。
第3章配位化学-习题

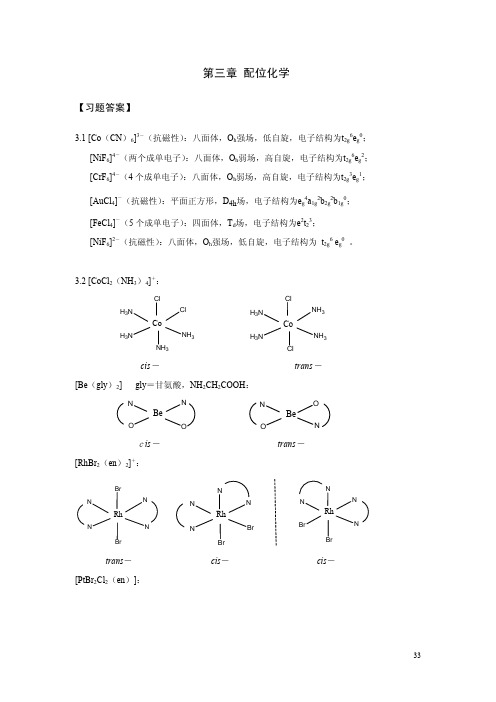
第三章 配位化学【习题】3.1 试判断下列配离子的几何构型和电子结构:[Co(CN)6]3-(抗磁性);[NiF6]4-(两个成单电子);[CrF6]4-(4个成单电子);[AuCl4]-(抗磁性);[FeCl4]-(5个成单电子);[NiF6]2-(抗磁性)3.2 画出下列各配合物(配离子)所有可能的异构体:[CoCl2(NH3)4]+,[Be(gly)2],[RhBr2(en)2]+,[PtBr2Cl2(en)],[Ir(C2O4)2Cl2]3-,[Cr(gly)3],[Pt(gly)2](gly=glycine,甘氨酸)3.3 已知配合物[M(A-B)2]和[M(A-B)2X2]型的配合物都是旋光活性的,请分别画出它们的几何结构。
3.4 紫红色的[Ti(H2O)6]3+在可见区的吸收光谱如教材中例题3-1的图所示,其最大吸收峰位置对应于20.3×103 cm-1,并在该最大吸收峰位置的右边(低频方向)出现一个肩峰,试用晶体场理论解释上述肩峰的由来。
3.5 下列配离子中哪些属于高自旋构型?(a)Mn(H2O)62+;(b)Fe(H2O)63+;(c)Co(NH3)63+;(d)Co(H2O)62+;(e)CoCl42-;(f)Fe(CN)64-3.6 下列配合物或配离子中属于低自旋构型的是(a)Fe(H2O)63+;(b)Co(H2O)62+;(c)Co(H2O)63+;(d)CoF63-3.7 对于CoF63-配离子,下面的哪项论述是正确的?(a)CoF63-的晶体场分裂能大;(b)F-为强场配体;(c)CoF63-是顺磁性的;(d)所有论述都不正确。
3.8 下列配离子中,哪一种可能产生Jahn-Teller效应?(a)Fe(CN)64-;(b)Fe(H2O)62+;(c)Cr(H2O)63+;(d)Co(NH3)63+;3.9 试画出配合物[Co(NO2)3(NH3)3]可能存在的几何异构体。
第三章 大环化合物配位化学和超分子化学(1)

2、金属离子的电荷 稳定常数:电荷的影响 碱土金属 (直径相近) > 碱金属(直径相近) 与冠醚形成配离子的金属离子: 并不限于第Ⅰ、Ⅱ主族的金属离子(见下表)。 能与冠醚15C5~24C8形成配离子的金属离子。 金属离子与冠醚分子形成配离子,静电作用+ 不同程度 的共价性。 金属离子电荷的大小还是影响这样的配离子的稳定系数 的重要因素之一。
金属离子和冠醚腔孔直径
金属离子 直径/pm 金属离子 直径/pm 冠醚 腔孔直径 /pm
Li
Na K
120
190 268
Mg
Ca Sr
130
198 220
12C4类
15C5类 18C6类
120-150
170-220 260-320
Rb
Cs NH4+
298
334 384
Ba
Pb Ti
270
210 238
增溶现象:冠醚和能与之形成配合物的盐(或其它离子化 合物,如NaOH)一起溶解在可以溶解该配合物的某种溶剂 中时,冠醚和盐二者的溶解度都比它们单独溶解在该溶剂 中时的溶解度为大。 如:固态KMnO4不溶于芳烃,但可溶于溶有DC18C6的苯 溶液中,所得紫色苯溶液的浓度超过0.02mol/l,此溶液 可氧化苯中的某些有机化合物。在溶剂中发生上述的增溶 现象时,盐的阴离子被认为不发生或只在非常小的程度上 发生溶剂化作用,阴离子以裸露状态或接近于裸露的状态 存在,从而可表现出特别活跃的反应性能。
配位化学 第3章 配合物性质与表征

3
章
配合物的性质与表征
The properties and spectroscopic characterization of coordination compounds
本章教学内容
配合物的性质
配合物的光谱表征
3.1
3.2
3.1 配合物的性质
在溶液中形成配合物时,常常出现颜色、溶解度、电 极电势以及pH 值的改变等现象。根据这些性质的变化,可 以帮助确定是否有配合物生成。 溶解度 一些难溶于水的金属氯化物,溴化物,碘化物,氰化物 可以依次溶解于过量的C1-,Br-,I-,CN-和氨中,形成可溶 性的配合物,如难溶的AgCl 可溶于过量的浓盐酸及氨水中。 金和铂之所以能溶于王水中,也是与生成配离子的反应有关。 Au + HNO3 + 4HCl = H[AuCl4]+ NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
酸碱性 一些较弱的酸如 HF 、 HCN 等在形成配合酸后,酸性往 往增强。 如: HF 与 BF3 作用生成配合酸 H[BF 4 ] ,而四氟硼酸的碱金 属盐溶液在水中呈中性,这就说明H[BF4 ]应为强酸。又如 弱酸HCN与AgCN形成的配合酸H[Ag(CN)2]也是强酸。这种 现象是由于中心离子与弱酸的酸根离子形成较强的配键, 从而迫使 H + 移到配合物的外界,因而变得容易电离,所以 酸性增强。 同一金属离子氢氧化物的碱性因形成配离子而有变化, 如[Cu(NH3)4](OH)2的碱性就大于Cu(OH)2。原因是 [Cu(NH3)4]2+的半径大于Cu2+离子的半径和OH-离子的结合 能力较弱,OH-离子易于解离。
第3章 配位化学PPT课件

第一节 配位化学基础
1.2 配合物的组成及命名
(1) 配合物的命名规则
(c) 同类配体(无机或有机类)按配位原子元素符号的英 文字母顺序排列。
[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(III) (d) 同类配体同一配位原子时,将含较少原子数的配体排 在前面。 [Pt(NO2)(NH3)(NH2OH)(Py)]Cl 氯化硝基·氨·羟氨·吡啶合铂(II)
3 第 章 配位化学
顺-[PtCl2(NH3)2]
目标&要求
掌握较复杂配合物的命名规则 掌握配合物的立体异构现象 掌握配合物化学键基本理论
(价键理论、晶体场理论、配体场理论、分子轨道理论)
了解新型配合物的类型及应用
一、配位化学基础 二、配位立体化学 三、配位化学理论 四、新型功能配合物及应用
第一节 配位化学基础
1.4 配合物的分类
按中心原子数目分类:
单核配合物和多核配合物
按配合物所含配体种类分类:
单一配体配合物和混合配体配合物
按配体的齿数分类:
简单配合物、螯合物、大环配合物等
按配合物价键特点分类:
经典配合物和非经典配合物
第二节 配位立体化学
2.1 配合物的几何构型 2.2 配合物的异构现象
CH2CH2NH2 NH
CH2CH2NH2
二乙三胺(dien)
第一节 配位化学基础
1.3 配体的基本类型及配位能力 四齿配体
二水杨醛缩乙二胺(Salen)
第一节 配位化学基础
1.3 配体的基本类型及配位能力 六齿配体
乙二胺四乙酸钠(EDTA)
第一节 配位化学基础
1.3 配体的基本类型及配位能力 冠醚 (大环醚)
配位化学-3

Oh
Td
D4h
D Eg,T2g E,T2 A1g,B1g, B2g,Eg
不同电子组态的谱项
组态 d1, d9 2D d2, d8 3F, 3P, 1G, 1D, 1S d3, d7 4F, 4P, 2H, 2G, 2F, 2×2D, 1P d4, d6 5D, 3H, 3G, 2×3F, 3D, 2×3P, 1I, 2×1G, 1F, d5
3T → 1A : 1g 1g
双禁阻跃迁
选律的松动
轨道对称性选律松动
relaxation
某些因素使微观状态波函数的奇偶性有所改变 例:四面体配合物的中心金属离子 dxy、dxz、dyz轨道 p轨道 ∴四面体配合物d-d吸收带比相应的八面体配合物强 自旋选律松动 轨-旋偶合强 均按T2变换,存在d-p混合
不同价态的金属离子之间常发生电荷迁移
Mm+→Mn+ (n>m) 例: 普鲁氏蓝KFe(Ⅲ)[Fe(Ⅱ)(CN)6]中:Fe(Ⅱ)→Fe(Ⅲ)电荷迁移
2. d-d光谱 (1) Tanabe-Sugano图(T-S图)
E和Dq以B为单位 B单位:cm-1 纯数
B:拉卡参数,电子互斥参数 纵坐标:E /B,横坐标:Δ /B 将基态的能量定为零 图上以基谱项为横坐标 具有相同dn组态的配合物离子通用一张图
(1) Tanabe-Sugano图(T-S图)
——弱场双禁阻跃迁
为什么?
d5组态电子成对能很大 少有低自旋 高自旋: 无自旋允许跃迁 ε < 0.1, ∴颜色都很浅 Fe3+:浅紫色 Mn2+:浅粉红色
Mn2+
6
6A
1g →
4T
(G) 18900cm-1 1g 23100cm-1
化学_朱文祥_第3章配位化学-习题答案
CoCl42-为正四面体构型。由于正四面体场的分裂能较小,所以(e)CoCl42-为高自旋。
3.6 配离子中的配体均为弱场配体,一般为高自旋构型。但是Co3+为d6组态,其与水分子配 位时产生的分裂能略大于电子成对能,因此(c)Co(H2O)63+为低自旋构型。
3.7 (c)的论述正确。F-为弱场配体,晶体场分裂能Δ小,CoF63-因采取高自旋构型而呈顺 磁性。
3.8 (b)Fe(H2O)62+产生Jahn-Teller效应。
3.9
H3N H3N
NO2 NH3
Co
NO2
NO2
mer-
H3N O2N
NO2
Co
NH3
NH3 NO2
fac-
3.10 具有平面四边形结构的配合物为(c)PtCl42—。
3.11 (a)4CoCl2· 6H2O + 4NH4Cl + 20NH3 + O2 → 4[Co(NH3)6]Cl3 + 26H2O (b)K2Cr2O7 + 7 H2C2O4 → 2K[Cr(C2O4)2(H2O)2]+ 6CO2 + 3H2O
3.17 粉红色固体用AgNO3溶液滴定时迅速生成 3 mol AgCl沉淀,说明 3 个Cl-在外界,粉红 色固体的化学式为 [Co(NH3)5(H2O)]Cl3,即三氯化五氨•一水合钴(Ⅲ)。受热外界的 1 个Cl-进入内界占据所失水分子的配位位点,因此紫色固体的化学式为 [CoC(l NH3)5]Cl2, 即二氯化一氯·五氨合钴(III)。
3 配位键和配位化合物

Dt=
4 9
D0
e d , d z2 x2 y2
dg
23
平面正方形D4h场
d orbitals
自由离子 d轨道
Es
D4h场
d b1g x2 y2
b2g d xy
a1g eg
dz2
d xz , d yz
y
-
+
+
x
-
dx2-y2
y
-+
x
+-
dxy
24
eg
t2
d
e
正四面体场
球对称场
t2g
正八面体场
b1g b2g
a1g eg
平面正方形场
25
2. 晶体场分裂能
分裂能D
配合物中一个电子由低能量的d轨道跃 迁到高能量的d轨道所需的能量
eg
影响分裂能大小的因素
o 中心原子 o 配体
d
Δ0 Eeg Et2g
Δ f g
f 为配体的因子,g 为中心原子的因子
t2g
26
① 配合物的几何构型
正八面体Oh场
四氯合金( Ⅲ )酸 六氰合铁(Ⅲ)酸钾 氯化二氨合银(Ⅰ)
[ Zn(NH3)4 ](OH)2
氢氧化四氨合锌(Ⅱ)
练习
[ Co(NH3)6 ]Cl2
[ CoCl(NH3)5 ]Cl
K2[ Co(SCN)4 ]
Na2[ SiF6 ]
K2[ Zn(OH)4 ]
[PtCl2(NH3)2 ]
10
3.1.4 配合物的类型
Fe3
FeCN6
2
深蓝色腾氏蓝
3.3.2 物质的分离
Cu2
配位化学第一组第三章作业

第三章配合物在溶液中的稳定性作业1.下列各组中,哪种配体与同一种中心离子形成的配合物稳定性较高,为什么?(1)Cl- , F-和Al3+(2)Br-,I-和Hg2+(3)2CH3NH2,en和Cu2+(4)Br-,F- 和Ag+(5)RSH,ROH和Pt2+(6)Cl-,OH-和Si4+(7)RSH,ROH和Mg2+解(1)F-与Al3+形成配合物更稳定,因为F-电负性大,离子半径更小(2)I-与Hg2+更稳定,因为碘离子的电负性较大,离子半径更小(3 )2CH3NH2与Cu2+形成的配合物更稳定,因为它的碱性比en更强与形成的配合物更稳定(4)Br-与Ag+形成的配合物更稳定,因为与Ag+形成配合物Br-变形性比F-强(5)RSH与Pt2+形成配合物更稳定,因为在与Mg2+形成配合物时S 的半径小于O的半径(6)OH-与Si4+形成的配合物更稳定,因为在与Si4+形成配合物时OH-的电荷比更多(7)RSH与Mg2+形成配合物更稳定,因为在与Mg2+形成配合物时S 的半径小于O的半径2.写出下列,配体与中心离子形成的配合物的稳定次序。
解(1)CH3NH2,en,NH2-NH2,NH2-OH和Cu2+en > CH3NH2 > NH2-NH2 > NH2OH(2)R3CCOOH,CH3COOH,Cl3CCOOH,I3CCOOH和Fe3+ R3CCOOH > CH3COOH > I3CCOOH > Cl3CCOOH(3)NH3,NH2-NH2,NH2-OH,R-OH和Ag+NH3 > NH2-NH2 > NH2-OH > R-OH(4)N, NH2与Zn2+N>NH2(5)NH2O2N,NH2CH3,NH2NO2与Cu2+NH2 CH3>NH2NO2>NH2O2N(6)NOH,NOHCH3与Ni2+NOHCH3>NOHCH33.下列二组试剂与同一种金属离子形成螯合物时,估计lg k的大小次序:解:(1)NH 2NO 2NH2CH3NH2NO2 2 > 3 > 1(2)1. 2.3. 4.3 > 2 > 1 > 4(3)M(en)3,M(Pn)3,M(dien)2M(en)3 > M(dien)2 > M(Pn)34.解释下列各胺与Cu(II)形成配离子稳定性的差别:配体lgk1(25oC)乙二胺10.551,2-二氨基丙烷10.651,3-二氨基丙烷9.981,2,3,-三氨基丙烷11.1解:当配位原子相同时,配体碱性越强,越易给出电子,形成的配合物往往越稳定。
第三章 配位化学

O ↓↑ HO − S ↓↑ O − OH
d.p反馈π键
能形成Л接受配体的有: 能形成Л接受配体的有:CO、CN-、-NO2、N2 R3P
、
、C2H4、R3As等。
说明
价键理论虽能解释许多配合物的配位数和空间 结构,解释配离子的稳定性、 结构,解释配离子的稳定性、磁性等某些基本性 质,但它有局限性,只能定性而不能量性,当配 但它有局限性,只能定性而不能量性, 位体不同时不能解释。 位体不同时不能解释。 稳定性d0<d1<d2<d3<d4<d5<d6<d7<d8<d9<d10 它不能 稳定性 解释配离子的颜色和某些结构。 解释配离子的颜色和某些结构。
无机化学
高自旋和低自旋
高自旋和低自旋配合物对于d5-8的中心离子如何 高自旋和低自旋配合物对于d 杂化成键? 杂化成键?
Fe3+
无机化学
[Fe(H2O)6]3+ 高自旋 配合物外轨型 sp3d2杂化 八面体 [Fe(CN)6]3- 低自旋 配合物内轨型 d2sp3杂化 八面体
高自旋d电子排布符合洪特规则。 高自旋d电子排布符合洪特规则。 未成对电子数与离子相同。 未成对电子数与离子相同。 低自旋d电子重排成对,不符合洪特规则。 低自旋d电子重排成对,不符合洪特规则。未成 对电子数与离子不相同。 对电子数与离子不相同。 外轨型:系用ns,np,nd轨道杂化成键。 外轨型:系用ns,np,nd轨道杂化成键。 ns,np,nd轨道杂化成键 内轨型:系用( 内轨型:系用(n-1)d,nd,np轨道 nd,np轨道 杂化成键。 杂化成键。
无机化学
八面体场
在八面体场中沿坐标轴方向伸展的dz 在八面体场中沿坐标轴方向伸展的dz2,dx2-y2 轨道,与配体处于迎头相碰状态, 轨道,与配体处于迎头相碰状态,故受配体电 场的强烈排斥而能差升高,而夹在坐标轴之间 场的强烈排斥而能差升高, dxy,dxz,dyz轨道则受到的排斥力较小 轨道则受到的排斥力较小, 的dxy,dxz,dyz轨道则受到的排斥力较小,能 差上升较少, 差上升较少,由于这三个轨道对配体有相同的 空间分布,因此能差相同, 空间分布,因此能差相同,形成一组三重简并 轨道。称为dε轨道。 dε轨道 轨道。称为dε轨道。而dz2,dx2-y2在八面体场 中具有相同的能量, 中具有相同的能量,所以形成另一组二重简并 轨道称dr轨道。 dr轨道 轨道称dr异构现象:化学式相同而结构式不同的 现象。 现象。
配位化学:第三章 生物氧化还原反应中的金属蛋白和金属酶

只要它有对称性合适的轨道,就可以和金属的d轨
道成键,从而在整个底物-金属-氧分子三元配 合物中形成一个扩展的分子轨道,使电子能够顺 利地从底物转移到分子氧。
• 二、生物氧化还原作用的类型
• 生物体的氧化还原作用主要有三大类型: • 1. 以氧(或其它物质)作为末端电子受体的电子传递过程。 • 这种过程的模式可表示为:
• 为了提高分子氧的活性,就必须设法产生单线态 氧,或者利用过渡金属催化剂的配位作用改变O2 的电子云分布。对于反应条件温和的生物体系, 后一种方法显然比较合适。
• 三元配合物:假设分子氧和可氧化底物都作为配体, 与过渡金属形成三元配合物,分子氧和过渡金属
原子之间形成σ配键, 当金属相应的d轨道充满
• 4. 加氧酶
• 加氧酶催化分子氧的氧原子直接加合到有机 物分子中。它按加合的氧原子数分双加氧和
单加氧酶两类。
• (1) 双加氧酶。双加氧酶催化分子氧的两个
氧43; O2
SO2H2
• 比如以铁为辅助因子的邻苯二酚酶可以催化 邻苯二酚开环反应:
•
OH
OH
+ O2* 邻 苯 二 酚
E = +0.68 V E = +1.77 V
• (3)四电子一步反应:
• 4H++O2+4e→2H2O • 在通常条件下,按(3)的方式四电子一步还原是很
少遇到的,仅在一些酶(如虫漆酶)体系中可进行 这种反应。双电子反应的电位(0.68V)不高。而四 步单电子还原的后三步虽然容易接受一个电子与 有机底物反应,但其第一步在热力学上是非常困 难的(-0.32 v), 这一反应的自由能ΔG>O,反应 是吸热的。通常双氧的还原是按(2)双电子或(1) 单电子步骤进行。
配位化学讲义 第三章(2) 群表示理论基础

第三节群表示的基及群的表示一、基本概念1、基:群元素作用的对象称为与它相应的群表示的基。
基可以有各种类型,如矢量(x,y,z),波函数(p x,p y,p z)2、群的表示:选定群表示的基以后,则分子点群中的每一个元素都与一个矩阵相对应,这些矩阵构成的矩阵群可以看作是点群的一个表示。
* 群的表示不是唯一的。
二、群的表示(可约与不可约表示)1、可约表示1)定理:设一组矩阵(E,A,B,C…)构成一个群的表示。
若对每个矩阵进行同样的相似变换:E´=X-1EXA´=X-1AXB´=X-1BX…………..则(E´,A´,B´……)也是群的一个表示。
证明(封闭性):若AB = CA´B´ = (X-1AX)(X-1BX) = X-1A(XX-1)BX = X-1(AB)X = X-1CX = C´若每个矩阵A´,B´,C´, … 均按同样的方式划分成方块,则可证明,每个矩阵的对应方块可以单独地相乘:A1´B1´=C1´A2´B2´=C2´A3´B3´=C3´………..因此各组矩阵E1´,A1´,B1´,C1´, …E2´,A2´,B2´,C2´, ……………………….本身都是一个群的表示。
因为用矩阵X可以把每个矩阵变换为一个新矩阵,所有新的矩阵按照同样的方式给出两个或多个低维表示。
因此我们称(E,A,B,C,…)为可约表示。
2、不可约表示若找不到矩阵X,按照上述方式约化给定表示的所有矩阵,这种表示称为不可约表示。
不可约表示具有特殊的重要性。
三、广义正交定理1、向量的正交1)向量及其标积。
向量的定义:向量标积:AθBA·B = A·Bcosθ2)向量正交若A·B = 0,则称A与B正交。
配位化学多媒体课件第三章

在密闭反应容器中,利用高温、高压条件 促使配位化合物形成。
微波合成法
利用微波辐射加速反应,提高配位化合物 的产率。
水热合成法
在高压水溶液中,通过控制温度和压力合 成配位化合物。
配位化合物的性质与特点
稳定性
配位化合物通常具有较高的热稳定性和化 学稳定性。
光学性质
某些配位化合物具有独特的光学性质,如 荧光、磷光等。
配位化学多媒体课件第三章
CONTENTS
• 配位化学概述 • 配位键理论 • 配位化合物的合成与性质 • 配位反应动力学与机理 • 配位化学的未来发展与挑战
01
配位化学概述
定义与特点
定义
配位化学是研究金属离子与配位 体之间相互作用及其形成配合物 的科学。
特点
配位化学具有多样性、复杂性和 规律性,涉及大量的实验和理论 计算,是化学领域中一个重要的 分支。
谢谢您的聆听
THANKS
催化剂
配位化合物可用作催化剂 ,促进有机合成和无机合 成反应的进行。
04
配位反应动力学与机理
配位反应的动力学基础
反应速率
配位反应的速率是研究配 位反应的重要参数,它受 到反应物浓度、温度、催
化剂等因素的影响。
反应机理
配位反应的机理研究有助 于深入了解反应过程,包 括反应的中间产物、能量
变化等。
动力学模型
详细描述
配位键的稳定性取决于中心原子和配位体的性质,如金属离子的半径越大,越容易形成稳定的配位键。此外,配 位数也影响配位键的稳定性,通常配位数越大,稳定性越高。同时,溶剂的极性也会影响配位键的稳定性,极性 溶剂有利于形成稳定的配位键。
03
配位化合物的合成与性质
第三章配位化学

几何异构
立体异构可分为几何异构和光学异构两种 1 几何异构
在配合物中, 配体可以占据中心原子周围的不同位置。所研 究的配体如果处于相邻的位置, 我们称之为顺式结构, 如果配体 处于相对的位置, 我们称之为反式结构。由于配体所处顺、反位 置不同而造成的异构现象称为顺-反异构。
很显然, 配位数为2的配合物, 配体只有相对的位置, 没有顺 式结构, 配位数为3和配位数为4的四面体, 所有的配位位置都是 相邻的, 因而不存在反式异构体, 然而在平面四边形和八面体配 位化合物中, 顺-反异构是很常见的。
例1. 命名及组成 (1) [Co Cl (NCS)(en)2]NO3
(1) 硝酸一氯·一异硫氰根·二(乙二胺)合钴 (Ⅲ) Co3+;Cl-、NCS-、en;Cl、N、N、N;配位数:6
(2) [CoCl2(NH3)3(H2O)]Cl
(2) 氯化二氯·三氨·一水合钴(Ⅲ) Co3+;Cl-、NH3、H2O;Cl、N、O;配位数:6
亚硝基配合物, 是通过O进行配位的。类似的例子还有 SCN-和CN-, 前者可用S或N进行配位, 后者可用C和
N进行配位。
从理论上说, 生成键合异构的必要条件是配体的两
个不同原子都含有孤电子对。如, :N≡C-S:-, 它的N和S
上都有孤电子对, 以致它既可以通过N原子又可以通过
S原子同金属相联结。
的核心,它们必须具有空的价轨道,通常是金属(尤 其是周期表中的过渡金属) 离子或原子。
配体:含有孤对电子的分子或离子均可作为配体的
配位原子。
配位数:直接同中心离子(或原子)相连的配位原
子数目叫中心离子(或原子)的配位数。
二、配合物的命名
1.总体原则:与无机化合物相似,先阴离子后阳离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实例:
[Ti(H2O)6]3+ K3[Mn(CN)6] K3[Fe(CN)6]
Ti3+: 3d1 Mn3+: 3d4 Fe3+: 3d5
µ=1.73 n =1 µ=3.18 n =2 µ=2.40 n =1
配位化学第三章
配合物的空间构型与中心离子的 杂化类型、配位数的关系
配位数 2
4
6
杂化
类型 sp
CN-的成键π2pz 轨道肩并肩重叠形成离域π键。
CN
NC
CN
Ni2+
配位化学第三章
NC
3.1.2 价键理论的应用
(1)解释了配合物的空间构型 (2)说明配合物的磁性 (3)比较同类配合物的稳定性
配位化学第三章
举例说明:
1. 已知[Ag(NH3)2]+的μm=0,用VB法说明其空
间结构。
4d
5s
5p
Ag+ [Kr]
4d
5p
[Ag(NH3)2]+
NH3 NH3 sp杂化 所以[Ag(NH3)2]+的空间构型为直线型。
配位化学第三章
2. [BeX4]2-的空间构型为四面体。为什么?
Be2+
1s
2s
2p
[BeX4]2-
1s
X- X- X- X-
sp3杂化
在[BeX4]2- 中,由于Be2+采取sp3杂化,所以 [BeX4]2-的 空间构型是正四面体。
dsp2
sp3 sp3d2或d2sp3
型空 间 构
直线形 平面正方形
四面体
八面体
举例:Ag(NH3)2 Ni(C)N24 NiCl24
配位化学第三章
Fe(CN36)
配位数
3
杂化 类型
型空 间 构
sp2
平面三角形
5
d2sp2或d4s dsp3
四方锥
三角双锥
举例:
HgI
3
SbCl52
配位化学第三章
Fe(CO)5
由于中心离子Fe3+采取3d 、 4s、4p 之间的杂 化, 所以形成的[Fe(CN)6]3- 配合物是内轨型的; Fe3+采取d2sp3杂化,所以形成的[Fe(CN)6]3-是正八 面体结构的配离子。
[Fe(CN)6]3- 配比位化学第[F三章eF6]3- 稳定。
由于CN-、NH3中的孤对电子对中心离子的d 电子斥力大,会使中心离子d电子成对(重排)。
对于[Ni(CN)4]2- 配离子的形成如下:已知μm=0
Ni2+ [Ar]
3d
4s
4p
[Ni(CN)4]2- [Ar]
3d
4p
dsp2杂化 CN-CN-CN-CN-
由于中心离子Ni2+采取dsp2 杂化,所以[Ni(CN)4]2配离子的空间构型为平面正方形。 Ni2+离子与4个 CN-形成4个σ配键,由于这9个原子在同一平面内 ,符合形成离域π键的配条位化学件第三,章 因此,在[Ni(CN)4]2-
中心离子M必须有接受电子对的空轨道,配 位体L至少有一对可提供的电子对或可提供的π 电子。
形成配合物时,中心离子所提供的空轨道 (s,p,d)必须首先进行杂化,形成一定数目的杂化 轨道,然后再接受配体提供的电子对成键;
配位化学第三章
如果中心离子采取(n-1)d、ns、np之间的杂化, 所形成的配合物叫内轨型配合物,如果中心离子采 取ns、np、nd之间的杂化,所形成的配合物叫外 轨型配合物;内轨型配合物比外轨型配合物稳定。
根据实验测定配合物的磁矩,然后利用公式:
m n(n2)
n:单电子数
计算出成单电子数 n 值,可以知道是否重排。
μm/BM
1.73 2.83
单电子数 n 1 2
3.87
3
4.90
4
5.92
配位化学第三章
5
中心离子d电子重排 (成对)以后,形成的配合 物往往是轨型配合物;此时配合物中,成单电 子数少,所以是低自旋配合物。如果中心离子d 电子不重排的,形成的配合物往往是外轨型配合 物。由于成单电子数多,所以是高自旋配合物。
配位化学第三章
3.1 价键理论 3.2 晶体场理论
配位化学第三章
3.1 价键理论
3.1.1 价键理论的要点 3.1.2 价键理论的应用 3.1.3 价键理论的局限性
配位化学第三章
3.1.1 价键理论的要点
中心离子M和配体L ,通过配位键相结合; 中心离子M是电子对的接受体,配体L是电子对 的给予体。
中还存在着π98 的离域π键,致使[Ni(CN)4]2-非常稳 定。 因为CN- 的分子轨道排布式为:
( ) 2 2 2 2 2 1 s 1 s 2s 2s 2py
22 2pz 2p
CN-除了σ2s的孤对电子与Ni2+形成σ配键外,π2pz也 有成对电子, Ni2+的4p轨道是空的。 Ni2+的4p与
配位化学第三章
3. 实验测得Ni(CO)4的μm= 0,用VB法说明其 空间构型和磁性。
Ni [Ar]
3d
4s
4p
Ni(CO)4
3d
sp3杂化
CO CO CO CO
在Ni(CO)4中,由于Ni采取sp3杂化, 所以 该配合物为正四面体构型;Ni(CO)4中无成单电 子,因此是抗磁性的。
配位化学第三章
F
F
F
Fe
F
因为Fe3+
F F
[Ar]
3d
4s
4p
F-的电子层结构:1s22s22p6 (2px22py22pz2) 配位化学第三章
Fe 3+与 F-键合形成[ FeF6 ]3-时,
Fe3+
3d
4s 4p
4d
[FeF6]3-
3d
4d…
sp3d2杂化
F- F- F- F- F- F-
由于中心离子Fe3+采取4s、4p 、 4d之间的杂化,
所以形成的[FeF6]3- 配合物是外轨型的; Fe3+采取 sp3d2杂化,所以形成的[FeF6]3-是正八面体结构的 配离子。
配位化学第三章
Fe 3+与 CN-键合形成 [ Fe(CN)6 ]3- 时,
Fe3+
3d
4s 4p
4d
[Fe(CN)6]3-
3d
4d…
d2sp3杂化 CN-CN-CN-CN-CN-CN-
练习题:实验测得Co(CN)63-中无成单电子, CoF63-中有四个成单电子,试用VB法 说明[Co(CN)6]3-和[CoF6]3-的杂化类型 和空间构型,比较两者的稳定性。
配位化学第三章
3.1.3 价键理论的局限性
由于杂化轨道有饱和性和方向性,所以配离子 的空间构型、中心离子的配位数以及配离子的稳 定性,主要由配位键形成时中心离子所采取的杂 化类型决定。
中心离子和配体之间除形成σ配键以外,如果 满足形成离域π键的条件,还可以形成离域π键, 致使配合物的稳定性大大增强。
配位化学第三章
例如:FeF63- 中,Fe 3+与 F-以配位键结合
