CH4 作业答案
最简单的有机化合物——甲烷习题及答案

最简单的有机化合物——甲烷习题及答案可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 C:12 O:16 S:32 Cl:35.5 一、选择题(本题包括15小题,每小题只有一个正确答案)1.下列有关甲烷的说法中错误的是( ) A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的B.天然气的主要成分是甲烷C.甲烷是没有颜色、没有气味的气体,极易溶于水D.甲烷与氯气发生取代反应所生成的产物四氯甲烷是一种效率较高的灭火剂2.下列关于甲烷性质的说法中,错误的是()A.甲烷是一种非极性分子B.甲烷分子具有正四面体结构C.甲烷分子具有极性键D.甲烷分子中H-C—H的键角为90℃3.下列物质在一定条件下可与CH4发生化学反应的是()A.氯水B.溴水C.氧气D.酸性KMnO4溶液4.将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是()A.CH3Cl B.CH2Cl2C.CCl4D.HCl5.下列气体在氧气中充分燃烧后,其产物既可使无水硫酸铜变蓝,又可使澄清石灰水变浑浊的是()A.SO2B.CH4C.H2D.CO6.下列有机物常温下呈液态的是()A.CH3(CH2)2CH3B.CH3(CH2)15CH3C.CHCl3D.CH3Cl7.正己烷的碳链是()A.直线形B.正四面体形C.锯齿形D.有支链的直线形8.下列数据是有机物的式量,其中可能互为同系物的一组是()A.16、30、58、72 B.16、28、40、52C.16、32、48、54 D.16、30、42、569.在同系物中所有同系物都是()A.有相同的分子量B.有不同的通式C.有相同的物理性质D.有相似的化学性质10.在常温常压下,取下列4种气态烃各1mol,分别在足量的氧气中燃烧,其中消耗氧气最多的是()A.CH4B.C2H6C.C3H8D.C4H1011.下列物质的分子中,属于正四面体结构的是()A.CCl4B.CHCl3C.CH2Cl2D.CH3Cl12.下列微粒中,与甲烷分子具有相同的质子数和相同的电子数的是()A.HCl B.NH3C.NH4+D.OH-13.光照对下列反应几乎没有影响的是()A.氯气与氢气的反应B.氯气与甲烷的反应C.甲烷与氧气的反应D.次氯酸的分解反应14.下列性质中不属于烷烃具有性质的是()A.燃烧产物只有CO2和H2OB.与卤素单质发生取代反应C.都溶于水D.通常不与强酸、强碱、强氧化剂反应15.将标准状况下的11.2L甲烷和22.4L氧气混合后点燃,恢复到原状况时,气体的总体积为()A.B.C.D.二、填空题(本题共5小题)16.甲烷的电子式为________,结构式为________。
烷烃的习题及答案

烷烃的习题及答案烷烃是有机化合物中最简单的一类,由碳和氢原子组成。
它们的分子结构特点是碳原子通过共价键连接成链状或环状结构,并且周围都是氢原子。
烷烃广泛存在于自然界中,例如天然气和石油中的成分就主要是烷烃。
烷烃的习题是有助于我们理解和掌握烷烃的结构和性质的重要工具。
下面我将为大家提供一些常见的烷烃习题及答案,希望对大家的学习有所帮助。
习题一:请写出以下分子式对应的烷烃名称。
a) CH4b) C2H6c) C3H8答案:a) CH4是甲烷,是最简单的烷烃,也是天然气的主要成分之一。
b) C2H6是乙烷,是一种常见的烷烃,广泛应用于燃气和燃料。
c) C3H8是丙烷,也是一种常见的烷烃,用作燃料和工业原料。
习题二:请判断以下说法的正确性。
a) 烷烃的分子式中,碳原子数比氢原子数多2。
b) 烷烃的分子式中,碳原子数比氢原子数少2。
c) 烷烃的分子式中,碳原子数和氢原子数相等。
答案:c) 烷烃的分子式中,碳原子数和氢原子数相等。
这是因为烷烃的一般分子式为CnH2n+2,其中n代表碳原子的数目。
习题三:请写出以下烷烃的结构式。
a) 丁烷b) 戊烷c) 己烷答案:a) 丁烷的结构式为CH3-CH2-CH2-CH3,其中CH3代表一个甲基基团,CH2代表一个亚甲基基团。
b) 戊烷的结构式为CH3-CH2-CH2-CH2-CH3。
c) 己烷的结构式为CH3-CH2-CH2-CH2-CH2-CH3。
习题四:请判断以下说法的正确性。
a) 烷烃的碳原子形成直链结构时,分子的空间构型是线性的。
b) 烷烃的碳原子形成环状结构时,分子的空间构型是线性的。
c) 烷烃的碳原子形成直链结构时,分子的空间构型是扭曲的。
答案:c) 烷烃的碳原子形成直链结构时,分子的空间构型是扭曲的。
这是因为碳原子的四个键角度是109.5度,所以当碳原子形成直链时,分子会发生扭曲以最大程度地减小碳原子之间的空间排斥。
习题五:请回答以下问题。
a) 丙烷和异丙烷有何区别?b) 乙烷和乙烯有何区别?答案:a) 丙烷和异丙烷的区别在于它们的分子结构不同。
关于甲烷的初中练习题

关于甲烷的初中练习题关于甲烷的初中练习题甲烷是一种无色、无臭的气体,也是天然气的主要成分之一。
它由一个碳原子和四个氢原子组成,化学式为CH4。
甲烷是一种温室气体,对地球的气候变化有着重要的影响。
下面是一些关于甲烷的初中练习题,帮助我们更好地了解这种气体。
问题一:甲烷的分子式是什么?答案:甲烷的分子式是CH4。
在甲烷分子中,一个碳原子与四个氢原子通过共价键相连。
问题二:甲烷的物理性质有哪些?答案:甲烷是一种无色、无臭的气体。
它的密度比空气小,能够在空气中上升。
甲烷的熔点为-182.5°C,沸点为-161.5°C。
问题三:甲烷在自然界中的存在形式有哪些?答案:甲烷在自然界中以多种形式存在。
它是天然气的主要成分之一,可以在地下沉积的油田和天然气田中找到。
此外,甲烷也存在于湖泊、河流和沼泽等水体中。
在这些水体中,甲烷是由微生物分解有机物质产生的。
问题四:甲烷对环境的影响是什么?答案:甲烷是一种温室气体,对地球的气候变化有着重要的影响。
它的温室效应比二氧化碳高约25倍。
甲烷的排放主要来自于人类活动,如化石燃料的燃烧、农业生产和废弃物处理。
减少甲烷排放对于减缓气候变化具有重要意义。
问题五:甲烷在生活中的应用有哪些?答案:甲烷在生活中有多种应用。
它是作为燃料的主要成分之一,被广泛用于煤气、炉灶和热水器等家用设备中。
此外,甲烷也被用作工业生产中的原料,如合成气体和合成化学品的制造。
问题六:如何减少甲烷排放?答案:减少甲烷排放对于减缓气候变化至关重要。
以下是一些减少甲烷排放的方法:1. 改善农业实践:减少农业生产中的甲烷排放,如改变农作物种植方式、改进牲畜饲养管理等。
2. 促进可持续能源发展:加大可再生能源的开发和利用,减少对化石燃料的依赖。
3. 加强废弃物管理:改善废弃物处理方式,如采用生物气化技术、回收利用有机废弃物等。
4. 提高能源利用效率:加强能源管理,提高能源利用效率,减少能源浪费。
高中化学甲烷练习题及答案

高中化学甲烷练习题及答案基础练习一、选择题1.下面列举了一些化合物的组成或性质,以此能够说明该化合物肯定属于有机物的是( )。
A.仅由碳、氢两种元素组成B.仅由碳、氢、氧三种元素组成C.在氧气中能燃烧,且只生成二氧化碳D.熔点低且不溶于水答案:A2.从19世纪20年代开始,人们用从非生物体内取得的物质合成了许多有机物。
下列属于最早合成的这一类物质是( )。
A.酒精B.尿素C.淀粉D.蛋白质答案:B3.以下关于甲烷的说法中,错误的是( )。
A.甲烷是一种非极性分子B.甲烷分子具有正四面体形结构C.甲烷分子中的四个C—H键是完全等价的键D.甲烷分子中具有非极性键答案:D4.下列甲烷的氯代物中,常温下是气体的是( )。
A.CH3C1B.CH2C12C.CHCl3l4答案:A5.在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是( )。
A.CH3C1B.CH2Cl2C.CHCl3l4答案:A6.下列物质在一定条件下能跟甲烷发生取代反应的是( )。
A.溴水B.溴蒸气C.氯气D.氯化氢答案:BC7.烃分子中的化学键( )。
A.只有非极性键B.可能只含有极性键C.同时含有极性键和非极性键D.可能同时含有极性键和非极性键答案:BD8.完全燃烧一定量的甲烷,燃烧产物先通过浓硫酸,再通过碱石灰,装有碱石灰的玻璃管增重8.8g,则原来的甲烷在标准状况下的体积为( )。
A.0.56LB.1.12LC.2.24LD.4.48L答案:D二、填空题9.组成有机物的元素,除主要的___________元素以外,多数有机物含___________,其次还可能含有___________、___________、___________、___________、___________等。
答案:碳;氢;氧;氮;卤素;硫;磷10.有机物种类繁多,目前从自然界发现和人工合成的有机物约有___________种,而无机物却只有万种,其原因是_________________________________。
CH4习题及答案.doc
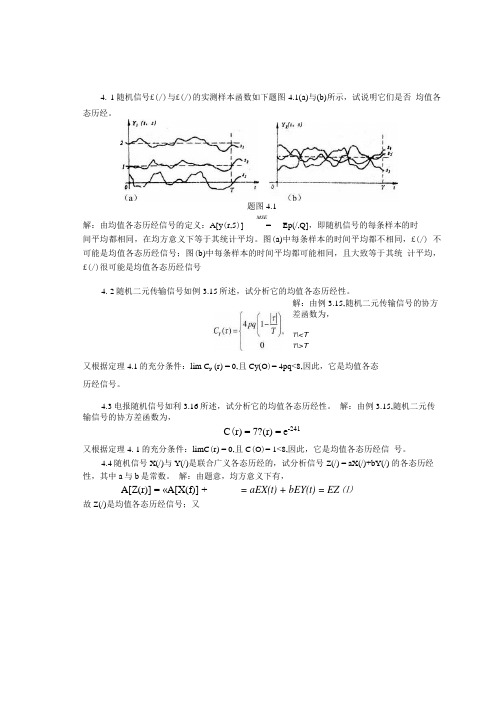
4. 1随机信号£(/)与£(/)的实测样本函数如下题图4.1(a)与(b)所示,试说明它们是否均值各态历经。
题图4.1MSE解:由均值各态历经信号的定义:A[y(r,5)] = Ep(/,Q],即随机信号的每条样本的时间平均都相同,在均方意义下等于其统计平均。
图(a)中每条样本的时间平均都不相同,£(/) 不可能是均值各态历经信号;图(b)中每条样本的时间平均都可能相同,且大致等于其统计平均,£(/)很可能是均值各态历经信号4. 2随机二元传输信号如例3.15所述,试分析它的均值各态历经性。
解:由例3.15,随机二元传输信号的协方差函数为,T\<TT\>T又根据定理4.1的充分条件:lim C y (r) = 0,且Cy(O)= 4pq<8,因此,它是均值各态历经信号。
4.3电报随机信号如利3.16所述,试分析它的均值各态历经性。
解:由例3.15,随机二元传输信号的协方差函数为,C(r) = 7?(r) = e-241又根据定理4. 1的充分条件:limC(r) = 0,且C(O)= 1<8,因此,它是均值各态历经信号。
4.4随机信号X(/)与Y(/)是联合广义各态历经的,试分析信号Z(/) = aX(/)+bY(/) 的各态历经性,其中a与b是常数。
解:由题意,均方意义下有,A[Z(r)] = «A[X(f)] + = aEX(t) + bEY(t) = EZ ⑴故Z(/)是均值各态历经信号;又A[Z(r + r)Z(O]=4[(aX (/ + ?■) + bY(t + C)(aX(/) + b Y(/))]=a~A[X(t + r)X(t)] + b2A[Y(t + r)y(Z)] + abA[X(t + r)Y(t)] + abA[Y(t + T)X(t)]=a2E[X(t + T)X(t)] + b2E[Y(t + r)Y(/)] + abE[X(t + r)y(O] + abE\Y(t +r)X(/)]=E[(aX (/ +『) +bY(/ +r))(aX(/) + bY(/))] = 7?z(r)因此,Z(/)是相关各态历经信号,也是广义各态历经。
计算机网络第二次作业答案全(第四第五章)

作业2姓名:符诗诗学号:20092166班级:计科三班CH4 数据链路层1.填空题1) 允许发送站发送多个帧而不需要马上应答,这就是__滑动窗口协议__。
滑动窗口协议需要一个____发送__窗口和一个___接收__窗口。
2)HDLC有三种不同类型的帧,分别称为__信息帧__、___监控帧__、___无编号帧__。
3)起止式异步通信规程将每个字符看成是一个独立的信息单元,字符中各个比特用固定的时钟频率传输,字符间的间隔是任意的。
每个字符由四个部分组成__起始位__、___数据位__、__奇偶校验位__、___停止位__。
4)常用的两种流量控制方法是___停等协议__、____滑动窗口协议________。
5)在实际的通信中,通常双方都有数据要发送给对方可以在数据段增加一个字段,专门用来携带给对方的应答信息,称为__捎带应答__。
6)HDLC的帧结构,它由__帧起始和停止标志____、__地址____、___控制___、___数据___和__CRC 校验____字段组成。
7) Internet的两个数据链路层协议是__SLIP_或____PPP__协议2.单项选择题(选出一个正确的答案,并将其号码填在题干的括号内。
)1) 在数据链路层传送的协议数据单元为(3 )(1)比特(2)报文分组(3)帧(4)报文2) 滑动窗口协议中,接收窗口保存的是( 2 )(1)可发送的帧序号(2)可接收的帧序号(3)不可发送的帧序号(4)不可接收的帧序号3) 在滑动窗口协议中,若窗口的大小为N位,则发送窗口的最大值为( 4 )(1)N (2) 2N(3)2N-1 (4)2N-13.判断正误:1) 同步传输时字符间不需要间隔(√)2) HDLC是面向字节的异步通信协议。
(╳)4.在面向比特同步协议(HDLC)的帧数据段中,为了实现数据的透明传输,采用“0”比特插入技术。
假定在数据流中包含:5F16、9E 16、71 16、7F 16、E1 16,请给出其原始比特序列和“0”比特插入后的比特序列。
甲烷烷烃专项练习题答案

甲烷烷烃专项练习题答案1. 等物质的量CH 4与Cl 2混合,光照后生成物中物质的量最多的是A .CH 3ClB .CH 2Cl 2C .CCl 4D .HCl2. 甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是A .CH 3Cl 不存在同分异构体B .CH 2Cl 2不存在同分异构体C .CHCl 3不存在同分异构体D .CH 4中C —H 键键角均相等3. 某同学写出的下列烷烃的名称中,不正确的是A .2,3-二甲基丁烷B .2,2-二甲基丁烷C .3-甲基-2—乙基戊烷D .2,2,3,3-四甲基丁烷4. 下列烷烃中,进行一氯取代反应后,只能生成三种沸点不同的有机产物的是A .(CH 3)2CHCH 2CH 2CH 3B .(CH 3CH 2)2CHCH 3C .(CH 3)2CHCH(CH 3)2D .(CH 3)3CCH 2CH 35. 已知二氯丁烷的同分异构体有9种,则八氯丁烷的同分异构体有A .7种 B. 8种 C . 9种 D .10种6. 将O 2、C 2H 6、Na 2O 2放入密闭容器中,在150℃时,电火花引发反应后,容器中的压强为0,将残留物溶于水,无气体逸出。
由此作出的正确结论是A .残留物中含有NaOH 、Na 2CO 3和NaHCO 3B .残留物中只含有Na 2CO 3C .残留物中含有Na 2CO 3和NaOHD .原混合物中O 2和C 2H 6的体积比为1:27. 下列五种烃 ①2—甲基丁烷②2,2—二甲基丙烷③戊烷④丙烷⑤丁烷,按它们的沸点由高到低的顺序排列正确的是A .①②③④⑤ B.②③④⑤① C.④⑤②①③ D.③①②⑤④8. 下列有机物的核磁共振氢谱只有一个峰的可能是A .C 2H 6 B.C 3H 8 C.C 4H 10 D.C 6H 149. 等质量的下列烃完全燃烧,生成CO 2和H 2O 时,耗氧量最多的是A.C 2H 6B.C 3H 8C.C 4H 10D.C 5H 1210. 下列各项叙述中不正确的是A.同系物具有相同的通式B.相邻两同系物的相对分子质量差是14C.同系物间互为同分异构体D.同系物具有相似的化学性质11. 在120℃时,某混合烃和过量O 2在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃可能是A.CH 4和C 2H 4B.C 2H 2和C 2H 4C.C 2H 4和C 2H 6D.C 3H 4和C 3H 612. 有一类组成最简单的有机硅化合物叫硅烷,它的分子组成与烷烃相似.下列说法中错误的是( )A.硅烷的分子通式可表示为Si n H 2n+2B.甲硅烷燃烧生成二氧化硅和水C.甲硅烷的密度大于甲烷D.甲硅烷的热稳定性强于甲烷13. 下列各组气体,在实验室可以用同样的一组发生装置来制取的是A .NO 、O 2、SO 2B .CO 2、H 2S 、CH 4C .NH 3、O 2、CH 4D .H 2、H 2S 、Cl 214. 有人设计了以下反应途径制H 2,假设反应都能进行,你认为最合理的是A . C 3H 8−−→−极高温3C +4H 2 B. C 3H 8+3H 2O −−−→−∆催化剂 3CO +7H 2 C. C 3H 8−−−→−高温脱氢C 3H 6+H 2 D. C 3H 8+5O 2→3CO 2+H 2O 2H 2O −−→−电解2H 2+O 215. A 盐和碱石灰反应,微热时放出一种气体B ,再经强热又放出一种气体C 。
Ch4气体和溶液习题解答

Ch4 气体和溶液习题解答1. 选择正确答案(1) ......................................................................................................................................................................... 下列物质中,可以作基准物质的是.......................................................... ••( C )A. Na2CO3 XH2OB. KMnO 4C. H2C2O2 2H2OD. Na z S z O s 5 H2O(2) 可以用直接法配制标准溶液的是................. ….................. .. ............ •…••••(C )A. 含量为99.9%的KMnO4B. 优级纯浓H2SO4C. 含量为99.9%的铜片D. 分析纯的Na2S2O3(3) 用KMnO4分光光度法测定低含量Mn的方法误差为2% ,使用称准至O.OOIg天平称取MnSO4。
若要配制成每毫升含0.2mg MnSO4的标准溶液,至少是配制溶液 ............................... •….(B )A. 50mLB. 250mLC. 100mLD. 500mL(4) 下列化合物不能用作基准物质的是………………………..………………………..…………… .….... (B )A. Ca2CO3B. KHC8H4O6C. Na2C2O2D. KMnO 4(5) 某基准物质A的摩尔质量为130g mo「1,用它标定0.02mol L「1的B溶液。
假定反应为5A + 2B = 2P,则每份基准物质的称取量(单位:g)应为…..................................... .….…..….(C )A. 0.02~0.03B. 0.06~0.07C. 0.1~0.2D. 0.2~0.4(6) 在温暖干燥的秋天,有人称取 2.9024g K262O7,溶解后转移入250mL容量瓶,稀释至刻度。
ch4作业答案

第4章作业一、选择题1.cache存储器的内容应与主存储器的相应单元的内容(A)A.保持一致B.可以不一致C.无关2.cache存储器的速度应比从主存储器取数据速度(A)A.快B.稍快C.相等D.慢3.虚拟存储器的逻辑地址位数比物理地址(A)A.多B.相等C.少4.EPROM是指(D)A.读写存储器B.只读存储器C.可编程的只读存储器D.可擦除可编程的只读存储器5.存储器是计算机系统的记忆设备,主要用于(D)。
A.存放程序B.存放软件C.存放微程序D.存放程序和数据6.在主存和CPU之间增加cache存储器的目的是(C)。
A.增加内存容量B.提高内存可靠性C.解决CPU和主存之间的速度匹配D.增加内存容量,同时加快存取速度7.外存储器与内存储器相比,外存储器(B)。
A.速度快,容量大,成本高B.速度慢,容量大,成本低C.速度快,容量小,成本高D.速度慢,容量大,成本高8.动态RAM的基本存储器件是(A)。
A.电容B.触发器C.字节D.扇区9.使用Cache的主要依据是(B)。
A.Cache容量大B.存储器访问的局部性C.内存容量不足D.Cache速度慢10.对于磁盘存储器来说,如下说法错误的是:(D)A.存储的数据分布在盘片的同心圆上,这些同心圆被称为磁道;B.从磁盘的圆心到磁盘的边缘,磁道上数据的密度逐渐降低;C.对于同一个磁盘,每个磁道上可存储的数据量是相同的;D.磁盘上的任何信息对用户来说都是可以访问的。
11.半导体静态存储器SRAM的存储原理是(A)。
A.依靠双稳态电路B.依靠定时刷新C.依靠读后再生D.信息不再变化12.某DRAM芯片,其存储容量为512K×8位,该芯片的地址线和数据线数目为(D)。
A.8,512 B.512,8C.18,8 D.19,813.主存与辅存的区别不包括(A)。
A.是否按字节或字编址B.能否长期保存信息C.能否运行程序D.能否由CPU直接访问14.某机字长32位,存储容量1MB,若按字编址,它的寻址范围是(C)。
材料科学基础课件-Ch4-作业答案

第四章 固体中原子及分子的运动 作业及答案1. 在一个富碳的环境中对钢进行渗碳,可以硬化钢的表面。
已知在1000℃下进行这种渗碳热处理,距离钢的表面1mm 处到2mm 处,碳含量从5at%减到4at%。
估计在近表面区域进入钢的碳原子的流入量J(atoms/m2s)。
(γ-Fe 在1000℃的密度为7.63g/cm3,碳在γ-Fe 中的扩散常数D0=2.0×10-5m2/s,激活能Q=142kJ/mol )解:首先,应把溶质碳原子的含量从原子分数转换为体积分数,故必须先求出溶剂铁原子的单位体积原子数236.023⨯10ρ=7.63⨯=55.858.232210⨯原子数(个)/cm 3 近似认为碳原子与铁原子共同占据铁的晶格,则121211203131812(/)ln(/)121203(8.314/158980)ln 0.5T T K T R Q x x ===--⨯⨯ 298.2310=-⨯原子数(个)/m 4D c in r-Fe 1000o C =611201420002.010exp() 2.9810/8.3141273Q RT D em s ----=⨯⨯=⨯⨯ 根据菲克第一定律:J D D x xρρ∂∆=-=-∂∆ 1129192(2.9810)(8.2310)2.4510()/()m s -=⨯⨯-⨯=⨯原子数个2. 在950℃下对纯铁进行渗碳,并希望在0.1mm 的深度得到0.9wt%的碳含量。
假设表面碳含量保持在1.20wt% ,扩散系数D γ-Fe=10-10m2/s 。
计算为达到此要求至少要渗碳多少时间。
解: 一维半无限长扩散初始条件 t=0 x>0, 00ρρ==x=0, t>0. 1.2s ρρ== ,0x ρ=∞=2120erf ωωωω-=-31.20.91.90erf --=-0.25erf =查表得0.2763= 所以 t=327(s)3. 已知Al 在Al2O3中扩散常数D0=2.8×10-3(m2/s),激活能477(KJ/mol ),而O (氧)在Al2O3中的D0=0.19(m2/s),Q=636(KJ/mol)。
固体物理CH4-习题解答

第四章习题试解1. 一维单原子晶格,在简谐近似下,考虑每一原子与其余所有原子都有作用,求格波的色散关系.解:设原子质量为m ,周期为a ,第n 个原子偏离平衡位置的位移为μn ,第n-k 与n+k 个原子偏离平衡位置的位移分别为μn-k ,μn+k ,其与第n 个原子间的弹性恢复力系数为β-k ,βk .n-k n-1 n n+1 n+k显然:k k ββ-=第n 个原子受n-k 和n+k 原子的合力为:第n 个原子受所有原子的合力为:振动的运动学方程可写为:代入振动的格波形式的解()i qna t nq Ae ωμ-= 有2()[()][()]()()(2)i qna t i q n k a t i q n k a t i qna t k km i Ae Ae Ae Ae ωωωωωβ-+----=+-∑色散关系即为2.聚乙烯链…—CH =CH —CH =CH…的伸张振动,可以采用一维双原子链模型来描述,原胞两原子质量均为M,但每个原子与左右邻原子的力常熟分别为β1和β2,原子链的周期为a .证明振动频率为证:如图,任意两个A 原子〔或B 原子〕之间的距离为a,设双键距离b 2,单键距离b 1 …—CH =CH —CH =CH —CH =CH —CH =CH —CH =CH …2n-2 2n-1 2n 2n+1 2n+2 AB Ab2 b1只考虑近邻作用的A,B 两原子的运动方程为A :222121221()()n n n n n M μβμμβμμ+-=---B : 21122212212()()n n n n n M μβμμβμμ++++=---将格波解()2i qna t n Ae ωμ-= 和2[()]21i q na b t n Be ωμ+-+= 代入以上运动方程,有 化简得:1221212()()0iqb iqb M A e e B ββωββ-+--+=同理:1221212()()0iqb iqb e e A M B ββββω--+++-=化为以A 、B 为未知数的线性齐次方程组,它的有解条件是从而得到3.求一维单原子链的振动模式密度g<ω>,若格波的色散可以忽略,其g<ω>具有什么形式,比较这两者的g<ω>曲线.解:一维情况q 空间的密度约化为L/2π,L=Na 为单原子链的长度,其中a 为原子间距,N 为原子数目.则在dq 间隔内的振动模式数目为2L dq π.dω频率间隔内的振动模式数目为 等式右边的因子2来源于ω〔q 〕具有中心反演对称,q ﹥0和q ﹤0区间是完全等价的.从而有 对于一维单原子链,只计入最近邻原子之间的相互作用时,有其中ωm 为最大频率.代入g <ω>得考虑ω=cq 〔德拜近似〕由q →0〔德拜近似下〕, 有111()222m m q qa qa a q ωωω==⋅=⋅ 即12m c a ω=⋅ 则有:12m d a dq ωω=⋅ 121()12m m NaN g a ωππωω==⋅ 〔常数〕考虑ω=ω0〔爱因斯坦近似〕显然有()000g ωωωωω∞=⎧=⎨≠⎩ 4.金刚石〔碳原子量为12〕的杨氏模量为1012N·m -2,密度ρ=3.5g·cm -3.试估算它的德拜温度ΘD =? 解:德拜温度D D B k ωΘ=223231()4()(2)2j V V g c c c ωωπωππ==, 2233()2V g c ωωπ== 近似看作弹性介质时,1/2410/C m s ⎛⎫=⨯ ⎪⎝⎭杨氏模量密度 每摩尔原子数目为N=6.02×1023,摩尔质量m=12g,则摩尔体积代入,得ωm =57.97×1013最后得 ΘD =4427K5.试用德拜模型求晶体中各声频支格波的零点振动能. 解:根据量子理论,各简谐振动的零点能为12ω 德拜近似下2233()2V g C ωωπ= 总零点能为034232301()2331444m m m E g d VV d C C ωωωωωωωωππ===⎰⎰ 由自由度确定的21/3[6()]m NC V ωπ=代回上式中6.一根直径为3mm 的人造蓝宝石晶体的热导率,在30K 的温度达到一个锐的极大值,试估计此极大值.〔蓝宝石在T ﹤﹤ΘD =1000K 时,c V =10-1T 3J·m -3·K -1〕解:m D B k ωΘ=→ωm =1.31×1014λ与晶格常数10-10m 近似时约为2.09×103,近似作为平均声速代入 热导率35.643103c l υκυ==⨯ 7.Na 和Cl 的原子量分别为23和37.氯化钠立方晶胞边长为0.56nm,在[100]方向可以看做是一组平行的离子链.离子间距d=0.28nm.NaCl 晶体的杨氏模量为5×1010N·m -2,如果全反射的光频率与q=0的光频模频率相等,求对应的光波波长.解:当q=0时,光频支频率为杨氏模量10510a β=⨯,且90.2810a -=⨯m故201.7910β=⨯,再同两原子质量一同代入频率式则波长02c πλω==1.53×10-14m8.立方晶体有三个弹性模量C 11,C 12和C 44.铝的C 11=10.82×1010N·m -2,C 44=2.85×1010N·m -2,铝沿[100]方向传播的弹性波纵波速度l υ=,横波速度t υ=,Al 的密度ρ=2.70×103kg·m -3.求德拜模型中铝的振动模式密度g<ω>.解:由题条件知36.3310l υ=⨯,33.2510t υ=⨯若所考虑的晶体体积为V,则。
甲烷、烷烃(习题练习含解析)

甲烷、烷烃一、选择题(每题有1-2个选项符合题意)1.下图是CH4、CCl4、CH3Cl的分子球棍模型图。
下列说法正确的是()A.CH4、CCl4和CH3Cl都是正四面体结构B.CH4、CCl4都是正四面体结构C.CH4和CCl4中的化学键完全相同D.CH4、CCl4的结构相同,性质也相同2.下列关于甲烷的说法正确的是()A.甲烷是含碳元素质量分数最高的有机物B.1 mol甲烷与1 mol Cl2反应恰好生成1 mol一氯甲烷C.CH2Cl2有和两种同分异构体D.有机物中的碳原子之间能以共价键结合,形成多种链状和环状3.等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论中,不正确的是()A.瓶中气体的黄绿色变浅B.瓶内壁有油状液滴生成C.生成物只有CH3Cl和HClD.此反应生成物可能是CH3Cl、CH2Cl2、CHCl3、CCl4和HCl的混合物4.下列烷烃的沸点是:甲烷,-162℃;乙烷,-89℃;丁烷;-1℃;戊烷,+36℃。
根据以上数字推断丙烷的沸点可能是()A.约-40℃B.低于-162℃C.低于-89℃D.高于+36℃5.下列说法正确的是()A.分子组成相差1个或若干个CH2原子团的物质互称为同系物B.相对分子质量相同的有机物是同分异构体C.碳原子之间只以单键相结合的链烃为烷烃D.分子式相同,结构相同的有机物一定是同一种物质6.下列各组内的物质不属于同系物的是()7.下列化学式只表示一种纯净物的是()A.C2H6B.C4H10C.C2H4Cl2D.C8.下列五种烃:①2-甲基丁烷、②2,2-二甲基丙烷、③戊烷、④丙烷、⑤丁烷,按它们的沸点由高到低的顺序排列正确的是()A.①>②>③>④>⑤B.②>③>⑤>④>①C.③>①>②>⑤>④D.④>⑤>②>①>③9.一定量CH4燃烧后得到的产物为CO、CO2、H2O(气),此混合物的质量为49.6g,当其缓慢通过无水CaCl2时,CaCl2的质量增加25.2g,则原混合物中CO2的质量为()A.12.5g B.13.2g C.19.7g D.24.4g10.将1 mol由两种气态烃组成的混合气体完全燃烧后得到1.5 mol CO2和2 mol H2O。
CH4 房地产评估

七、房地产评估前期工作
• • • • 明确房地产评估基本事项 拟订评估作业方案 实地勘察评估对象 收集评估所需资料
第二节
市场法的应用(掌握)
一、适用范围
市场法适用于活跃市场的交易性房地产。 在下列情况下,市场法往往难以适用: 1.没有发生房地产交易或在房地产交易发生较少的 地区 2.某些类型很少见的房地产或交易实例很少的房地 产,如古建筑等; 3.很难成为交易对象的房地产,如教堂、寺庙等; 4.风景名胜区土地; 5.图书馆、体育馆、学校用地等。
例 某城市某用途土地容积率修正系数见 容积率修正系数表
容积率 0.1 0.4 0.7 1.0 1.1 1.3 1.7 2.0 2.1 2.5 修正系数 0.5 0.6 0.8 1.0 1.1 1.2 1.6 1.8 1.9 2.1 如果确定比较案例宗地地价每平方米为3800元, 容积率为2.1,被估宗地规划容积率为1.7,则待 估宗地容积率修正计算如下: 经容积率修正后可比实例价格 =3800×1.6/1.9 =3800×容积率因素修正系数(1.6/1.9) =3200(元/平方米)
第一节 房地产评估概述
一、土地的特性
(一)土地 (二)土地的特性(掌握) 1.土地的自然特性 (1)土地位置的固定性 (2)土地质量的差异性 (3)土地效用的永续性
一、土地的特性
2.土地的经济特性 (1)土地经济供给的稀缺性 (2)土地产权的可垄断性
在土地所有权或使用权让渡时,就必然要求实现其垄断 利益,在经济上获得收益。
2、土地使用权转让
土地使用权转让是指土地使用者将土地使 用权再转移的行为,包括出售、交换和 赠与。凡未按土地使用权出让合同规定 的期限和条件投资开发、利用土地的, 土地使用权不得转让。 土地使用者之间 使用年限=出让年限-原土地使用者已使用 年限 过户登记
高中化学《甲烷》练习题(附答案解析)

高中化学《甲烷》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.光照条件下,下列各组物质中几乎没有反应的是()A.甲烷与溴蒸气B.甲烷和氧气C.氢气和氯气D.甲烷和氯气2.如图所示是四种常见有机物的空间填充模型示意图。
下列说法正确的是()A.甲能使酸性KMnO4溶液褪色B.乙可与溴水发生取代反应使溴水褪色C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键D.丁分子中含有碳碳双键3.下列化学用语或模型不正确的是()A.H2O的电子式∶B.CO2的结构式∶O=C=OC.CH4分子的空间充填模型∶SOD.硫酸铁的电离方程式∶Fe2(SO4)3=2Fe3++32-44.下列关于甲烷的说法不正确的是()A.甲烷分子的结构简式是CH4B.甲烷分子中4个C-H键完全等同,任意2个C-H键之间的夹角是90°C.甲烷分子中碳原子的最外层满足8电子稳定结构D.甲烷为正四面体结构5.下列叙述正确的是()A.甲烷分子的空间构型是正四面体,所以,CH2Cl2有两种不同构型B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色C.烷烃的分子通式为C n H2n+2D.正丁烷分子中所有的碳原子均在同一条直线上6.“西气东输”是我国为改善东部地区能源紧缺、开发大西北而实施的一项重大工程。
这里的“气”是指()A.氢气B.天然气C.一氧化碳D.水煤气7.设N A为阿伏加德罗常数的值,下列说法错误的是()A.1mol14NO和13CO混合气体中所含中子数为15N AB.1molNa218O2与足量水反应,最终水溶液中18O原子的数目为2N AC.2mol[Ag(NH3)2OH]中配位键个数为4N AD.标准状况下,11.2LCH4和22.4LCl2在光照条件下充分反应后的分子数为1.5N A8.下图是CH4、CCl4、CH3Cl的分子球棍模型图。
下列说法正确的是( )A.CH4、CCl4和CH3Cl都是正四面体结构B.CH4、CCl4、CH3Cl都难溶于水C.CH4、CCl4、CH3Cl都比水轻D.CH4、CCl4的结构相同,性质也相同9.下列选项中甲组为取代反应,乙组为加成反应的是A.A B.B C.C D.D10.下列有关甲烷的叙述错误的是()A.甲烷由碳、氢元素组成,属于共价化合物B.沼气、天然气、坑道气的主要成分都是甲烷C.实验室制取甲烷可用排水法收集KMnO溶液褪色D.甲烷能使酸性411.下列现象不是因为发生化学反应而产生的是( )A .将苯滴入溴水中,振荡后水层接近无色B .甲烷与氯气混合,光照一段时间后黄绿色消失C .乙烯使酸性KMnO 4溶液褪色D .乙烯使溴的四氯化碳溶液褪色12.由下列实验及现象推出相应结论正确的是( )A .AB .BC .CD .D 13.下列有关实验对应的方程式书写正确的是( )A .氢氧化铁胶体的制备:323Fe 3H O Fe(OH)3H +++↓+B .光照条件下,甲烷和足量的氯气反应:424CH 4Cl CCl 4HCl −−−→++光照 C .向“84”消毒液(有效成分为NaClO )中加入少量白醋可增强消毒效果:ClO H HClO -++=D .实验室制取乙烯,加热温度低于170℃时可能发生的反应:32322322CH CH OH CH CH OCH CH H O ∆−−−→+浓硫酸 二、填空题14.(1)相对分子质量最小的有机物的电子式_____;食醋中有机物的结构简式_____;糖尿病患者尿液中所含糖类的名称_____。
ch4不定积分习题答案_全

4.11.求下列不定积分(1)473337x dx x C ==+⎰⎰.(2)31222x dx xC --==-+⎰.(3)2332ln .ln 3x x dx x C x ⎛⎫+=++ ⎪⎝⎭⎰(4)715888.15x dx x C ==+⎰(5)315322222211)(3)(33)23.52x dx x x x dx x x x x C +=+--=+--+⎰⎰(6)24arcsin 4arctan .1dx x x C x ⎛⎫-=-+⎪+⎭⎰(7)113135222222242(2)2.35x x x dx x x x C -=-+=-++⎰ (8)42232233113arctan .11x x dx x dx x x C x x ⎛⎫++⎛⎫=+=++ ⎪ ⎪++⎝⎭⎝⎭⎰⎰ (9)22221111arctan .(1)1dx dx x C x x x x x ⎛⎫=-=--+ ⎪++⎝⎭⎰⎰(10)11221()2.x xx x e dx e x dx e x C --⎛=-=-+ ⎝⎰⎰(11)2352252252.2333ln 3xxx x x dx dx x C ⎛⎫⨯-⨯⎛⎫⎛⎫=-=-+ ⎪ ⎪ ⎪ ⎪⎛⎫⎝⎭⎝⎭⎝⎭⎪⎝⎭⎰⎰ (12)22cot (csc 1)cot .xdx x dx x x C =-=--+⎰⎰(13)2cos 11cos(sin ).222x x dx dx x x C +==++⎰⎰ (14)2sec (sec tan )(sec sec tan )tan sec .x x x dx x x x dx x x C -=-=-+⎰⎰(15)221111sec tan .1cos 22cos 22dx dx xdx x C x x ===++⎰⎰⎰(16)22cos 2cos sin (cos sin )sin cos .cos sin cos sin x x xdx dx x x dx x x C x x x x -==+=-+--⎰⎰⎰ (17)222222cos 2cos sin cos sin cos sin x x xdx dx x x x x -=⨯⨯⎰⎰22(csc sec )cot tan x x dx x x C =-=--+⎰.(18)22221cos 1cos 11(sec 1)(tan ).1cos 22cos 22x x dx dx x dx x x C x x ++==+=+++⎰⎰⎰ 2.一曲线通过点2(,3)e ,且在任一点处的切线斜率等于该点横坐标的倒数,求该曲线的方程.解 由题设,曲线上任一点的切线斜率为1()f x x '=,即()f x 是1x的一个原函数,所以有1()ln f x dx x C x==+⎰.又因为曲线通过点2(,3)e ,所以有23,1C C +==.因此,所求曲线方程为ln 1y x =+.3. 设()f x 的导函数是sin x ,求()f x 的原函数的全体. 解 由题设,()sin f x x '=,即有1()sin cos f x xdx x C ==-+⎰,于是()f x 的全体原函数为()112cos sin x C dx x C x C-+=-++⎰.4. 设()arccos xf x dx x C =+⎰,求()f x . 解 由题设,()()()arccos xf x dx x C ''=+⎰, 即()()xf x f x ==4.21.在括号中填入适当的系数,使下列等式成立:1(1)()(52).5dx d x =+21(2)(73).6xdx d x ⎛⎫=-- ⎪⎝⎭ 451(3)(23).10x dx d x ⎛⎫=+ ⎪⎝⎭()(4)2d= 11(5)(3ln ).3dx d x x ⎛⎫= ⎪⎝⎭ ()(6)1(2arcsin ).d x =--()(7)1dx d =-211(8)(arctan 3).193dx d x x ⎛⎫= ⎪+⎝⎭2.求下列不定积分22311(1)(21)(21)(21)(21).26x dx x d x x C +=++=++⎰⎰1111(2)(13)ln 13.133133dx d x x C x x =--=--+--⎰⎰2313(3)(35)(35).510d x x C =--=--+222211(4)().22xx x xe dx e d x e C ---=--=-+⎰⎰34442111(5)()ln 1.1212x dx d x C x x =-=--+--⎰⎰10210111(6)tan sec tan tan tan .11x xdx xd x x C ==+⎰⎰(7)22.C==+⎰21(8)(23).6x C=--=⎰(9)ln.C==+⎰⎰2211(10)arctan.11xx xx x x xedx dx de e Ce e e e-===++++⎰⎰⎰11(11)ln(ln)ln ln ln.ln ln(ln)ln(ln)dx d x x Cx x x x==+⎰⎰111(12)(1)ln(1).111x xx xx x xe edx dx dx d e x e Ce e e+-==-+=-+++++⎰⎰⎰⎰3231(13)cos(1sin)sin sin sin.3xdx x d x x x C=-=-+⎰⎰2111(14)cos(21)(cos(42)1)cos(42)(42)22411sin(42).82x dx x dx x d x dxx x C⎡⎤+=++=+++⎢⎥⎣⎦=+++⎰⎰⎰⎰2233sin cos11(15)cos sec.cos cos22x d xdx x C x Cx x-=-=+=+⎰⎰1(16)2csc2(2)ln csc2cot2ln tan.sin cos sin2dxdx xd x x x C x C x x x===-+=+⎰⎰⎰111112(17)ln.(1)(2)32131xdx dx Cx x x x x-⎛⎫=-=+⎪+--++⎝⎭⎰⎰222222110(45)40111(18)(45)8(45)(45)50(45)50(45)(45)18141ln(45)ln45.5045252545x xdx dx d x d x x x x xx C x Cx x⎡⎤--+==---⎢⎥----⎣⎦⎡⎤=-++=-+⨯+⎢⎥--⎣⎦⎰⎰⎰⎰(19)2120.21dx x-⎰21.21ln 22.(ln )xdx x x +⎰3、求下列不定积分:⎰;(1) dxx(2)(3) ;(4)(5) ⎰;2,,2tt x dx tdt===11ln1ln(1.11tdt dt t t C Ct t⎛⎫==-=-++=++⎪++⎝⎭⎰⎰(6) ;2,,2t x t dx tdt===31312222244(1)4(1)(1)4(1).33dt t t C C===+-++=-++⎰(7) ⎰解:65,6x t dx t dt==5323223266(1)(1)161116(1)2366ln116ln1.t t t t tdt dt dtt t t tt t dt t t t t CtC+-+-===+++=-+-=-+-+++=+⎰⎰⎰⎰(8)82(1)dxx x-⎰.4.31、 求下列不定积分: (1) sin x xdx ⎰;sin cos cos cos cos sin .x xdx xd x x x xdx x x x C =-=-+=-++⎰⎰⎰(2) arcsin xdx ⎰;(3) ln(1)x x dx -⎰;(4) x xe dx -⎰;.x x x x x x xe dx xde xe e dx xe e C ------=-=-+=--+⎰⎰⎰(5) cos x e xdx -⎰;(6) 2arctan x xdx ⎰;(7) cos2xx dx ⎰;(8) ln xdx ⎰;ln ln ln .xdx x x dx x x x C =-=-+⎰⎰(9) sin cos x x xdx ⎰;(10) 2tan x xdx ⎰;(11) 32ln xdx x⎰;333222323232ln 111ln ln 3ln 11111ln 3ln ln 3ln 2ln 1311ln ln 6ln .x dx xd x xdx x x x xx xd x x xd x x x x x x x x C x x xx =-=-+⎛⎫=--=--+ ⎪⎝⎭⎛⎫=---++ ⎪⎝⎭⎰⎰⎰⎰⎰(12) 2(arcsin )x dx ⎰;(13) 2x x e dx -⎰;(14) ⎰;(15) 2(1)sin 2x xdx -⎰;(16) 2ln(1)x dx +⎰;(17) 2sin 2xxedx -⎰;(18) cos(ln )x dx ⎰;(19) ln(x dx +⎰;ln(ln(ln(.x dx x x x x C =-=+⎰(20) 2sin x e xdx ⎰.习 题 4-41、 求下列不定积分: (1)31(1)x dx x +-⎰;(2)21(1)dx x x -⎰;22221(1)11(1)(1)(1)1111ln ln 1.1x x dx dx dx x x x x x x x dx x x C xx x x ⎛⎫-+==+ ⎪---⎝⎭⎛⎫=++=-+--+ ⎪-⎝⎭⎰⎰⎰⎰(3)2125dx x x ++⎰;22111111arctan .252222112x x dx d C x x x ++⎛⎫⎛⎫==+ ⎪ ⎪++⎝⎭⎝⎭+⎛⎫+ ⎪⎝⎭⎰⎰(4)332(1)x dx x x ++⎰;(5)221(1)(1)dx x x x +++⎰;22222222222211(1)(1)11121111(1)211211111ln 1ln(1)232111ln 12x x dx dx x x x x x x x dx dx d x x x x x x x x x d x x x x +⎛⎫=-⎪++++++⎝⎭+⎛⎫=+-+ ⎪+++++⎝⎭⎛⎫ ⎪ ⎪ ⎪⎛⎫+ ⎪ ⎪ ⎪=+++-+ ⎪⎛⎫+ ⎪ ⎪ ⎪+ ⎪ ⎪⎝⎭=++⎰⎰⎰⎰⎰⎰21rctan ln(1).x x C ⎛⎫⎛⎫+ ⎪ ⎪ ⎪-++ ⎪ ⎪⎝⎭(6)411dx x -⎰;42221111111111141121111ln arctan .412dx dx dx dx dx dx x x x x x x x x C x ⎛⎫=-=-- ⎪--+-++⎝⎭-=-++⎰⎰⎰⎰⎰⎰(7);(8) ⎰;222214,,1(1)t t t x dx dt t t --===++2222222224(1)11144(1)(1)1(1)t t dt dt dt dt t t t t ⎛⎫-+-==-=-- ⎪++++⎝⎭⎰⎰⎰⎰ 其中2tan 222421sec 11cos sin 2(1)sec 2211arctan sin 2(arctan )221arctan .21t u u dt du udu u u C t u t t C t t C t =⎛⎫===++ ⎪+⎝⎭⎛⎫=++ ⎪⎝⎭⎛⎫=++ ⎪+⎝⎭⎰⎰⎰所以,2214arctan arctan .212arctan .1t t t C t t t C t ⎛⎫⎛⎫=--++ ⎪ ⎪+⎝⎭⎝⎭⎛⎫=--+ ⎪+⎝⎭2arctan .C C ⎛=-+ ⎝=-(9) 13cos dx x +⎰;(10) 12sin dx x +⎰;(11) 213sin dx x +⎰;(12)11tandxx+⎰.(注:本资料素材和资料部分来自网络,仅供参考。
化学结构推题题库及答案

化学结构推题题库及答案1. 题目:请根据碳原子的杂化轨道理论,解释为什么甲烷(CH4)的碳原子是四面体构型。
答案:甲烷分子中的碳原子采用sp3杂化轨道,形成四个等价的杂化轨道,分别与四个氢原子的1s轨道重叠,形成四个等能量的σ键。
这四个σ键在空间中指向四面体的四个顶点,因此甲烷的碳原子呈现四面体构型。
2. 题目:请说明苯环结构中的化学键是如何形成的。
答案:苯环结构中的化学键由碳原子的sp2杂化轨道形成。
每个碳原子贡献一个sp2杂化轨道与相邻碳原子的sp2杂化轨道重叠,形成三个σ键。
剩余的未杂化的2p轨道在苯环平面上方和下方相互重叠,形成一个π键体系,这个π键体系是离域的,覆盖整个苯环。
3. 题目:解释什么是共振结构,并给出一个例子。
答案:共振结构是指一组具有相同原子连接但不同电子排布的路易斯结构。
这些结构不能独立存在,而是以共振杂化体的形式存在,共振杂化体是这些结构的混合体,具有这些结构的平均性质。
例如,苯酚的共振结构可以表示为两个极限形式,其中一个OH基团与苯环上的一个碳原子相连,另一个极限形式是OH基团的氧原子与苯环上的两个碳原子形成双键。
4. 题目:什么是等电子原理?请举例说明。
答案:等电子原理指的是具有相同原子数和价电子数的分子或离子,其化学性质相似。
例如,氮气(N2)和一氧化碳(CO)都是由两个原子组成,每个原子有5个价电子,因此它们具有相似的化学性质,如三键结构和相似的键能。
5. 题目:请解释什么是路易斯碱和路易斯酸,并给出一个例子。
答案:路易斯碱是指能够提供电子对的原子、分子或离子,而路易斯酸是指能够接受电子对的原子、分子或离子。
例如,氨(NH3)是一个路易斯碱,因为它可以提供其孤对电子;而硼(BH3)是一个路易斯酸,因为它可以接受氨分子提供的孤对电子,形成BH3NH3复合物。
6. 题目:什么是分子轨道理论?请简述其基本原理。
答案:分子轨道理论是一种描述分子中电子状态的理论,它基于原子轨道的线性组合来形成分子轨道。
作业参考答案

第一讲作业:已知燃气的体积组分为:H 2—48%,CO —20%,CH 4—13%,C 3H 6—1.7%,O 2—0.8%, N 2—12%,CO 2—4.5%; 混合燃气与空气的温度均为15℃;燃气的含湿量为11g/m 3干燃气,空气的含湿量为10g/m 3干空气;试计算:(1)混合干燃气的高热值、低热值; (2)混合湿燃气的高热值、低热值; (3)燃烧所需的理论空气量;(4)理论烟气量和α=1.2时的实际烟气量及烟气密度; (5)热量计温度(α=1.2);(6)编制α=1,α=1.2,温度400℃、800℃、1200℃、1600℃的烟气焓温表。
解:(1)查表得各燃气组分的低热值:H2:10232 CO:11986 CH4:34037 C3H6:83103 因此,混合燃气低热值为102320.48119860.2340370.13831030.01713146.121l H =⨯+⨯+⨯+⨯=查得各燃气高热值为:H2:12089 CO:11986 CH4:37768 C3H6:88819 因此,混合燃气高热值为120890.48119860.2377680.13888190.01714619.683h H =⨯+⨯+⨯+⨯=(2)对于湿燃气: 低热值:0.790.7913146.12112965.5880.790.0110.801w l l H H =⨯=⨯=+高热值:0.790.79(23530.011)(14619.68325.883)14444.440.790.0110.801w h h H H =+⨯⨯=+⨯=+(3)燃烧所需的理论空气量:[]010.5480.520213 4.5 1.70.8 3.183321V =⨯+⨯+⨯+⨯-= (4)实际烟气量:20.01(4.520133 1.7)0.436RO V =⨯+++⨯=[]20.01482133 1.7126.6(0.011 3.18330.01)1.266(1.21) 3.18330.010.853H O V =⨯+⨯+⨯+⨯+⨯+⨯-⨯⨯=20.79 3.18330.120.79(1.21) 3.1833 3.138N V =⨯++⨯-⨯= 20.21(1.21) 3.18330.134O V =⨯-⨯=实际烟气量:22220.4360.853 3.1380.134 4.561f RO H O N O V V V V V =+++=+++=(以上空气、燃气单位均为m3/m3干燃气) 烟气密度:0.8520.48 1.18550.20.68010.13 1.8140.0171.35470.008 1.18530.12 1.87420.0451g ρ=⨯+⨯+⨯+⨯+⨯+⨯+⨯=001.226()1 1.226 1.2 3.1833(0.011 1.2 3.18330.01)4.5611.257g g a f fV d V d V ρααρ+++=+⨯⨯++⨯⨯==(5)热量计温度(α=1.2) 假设温度为2100℃。
甲烷 烷烃练习题

甲烷烷烃练习题烷烃是指由碳氢化合物组成的一类有机化合物,其中最简单的就是甲烷。
甲烷的分子式为CH4,是一种无色、无味的气体。
在化学反应中,烷烃是一个重要的研究对象。
下面通过几道烷烃练习题来加深对甲烷及其他烷烃的理解。
1. 甲烷的化学式是什么?甲烷的化学式是CH4。
2. 甲烷的结构是什么样的?甲烷的结构是由一个碳原子和四个氢原子通过共价键连接而成的。
碳原子处于中心位置,四个氢原子均连接在碳原子周围。
3. 甲烷的常见用途有哪些?甲烷作为一种清洁燃料,常被用于家庭燃气、工业燃烧、发电站和运输工具等领域。
此外,甲烷还可用于合成有机化合物、制备化学品和气象领域的气象探空。
4. 请解释一下烷烃的命名规则。
烷烃的命名遵循一定的规则,以描述碳原子数和碳原子之间的连接方式。
通常,烷烃的名称以 "-ane" 结尾。
例如,甲烷是一种仅含有一个碳原子的烷烃,所以以 "-ane" 结尾,称为甲烷。
5. 请给出丙烷 (C3H8) 的结构和化学式。
丙烷的分子式为C3H8。
结构上,丙烷由三个碳原子和八个氢原子组成。
三个碳原子通过单键连接在一起,在每个碳原子周围连接着一定数量的氢原子。
6. 请用化学式表示戊烷。
戊烷的化学式为C5H12。
7. 请列举出前五个烷烃的名称和化学式。
前五个烷烃的名称和化学式如下所示:- 甲烷 (CH4)- 乙烷 (C2H6)- 丙烷 (C3H8)- 丁烷 (C4H10)- 戊烷 (C5H12)8. 请解释一下烷烃的物理性质。
烷烃是非极性的分子,通常为气体或液体。
它们具有较低的沸点和熔点,随着碳原子数的增加,这些数值也会相应增加。
此外,烷烃通常不溶于水,但可以与非极性溶剂如苯或乙醚相溶。
9. 请解释一下烷烃的化学性质。
烷烃的化学性质相对较稳定。
它们不容易发生反应,特别是像甲烷这样的单一烷烃。
然而,通过适当的条件和催化剂,烷烃可以发生反应,如氧化、卤代烷烃的取代反应等。
甲烷的性质 Word版含答案

第一节⎪⎪最简单的有机化合物——甲烷第一课时甲烷的性质——————————————————————————————————————[课标要求]1.了解有机化合物的概念。
2.掌握甲烷的分子结构,了解甲烷的物理性质及存在、用途。
3.掌握甲烷的化学性质,认识取代反应的特点。
1.甲烷分子具有正四面体结构,其中碳原子位于正四面体的中心,4个氢原子位于正四面体的四个顶点上。
2.甲烷结构与性质的记忆口诀:性质稳定是甲烷,光照氯代四连环;立体构型四面体,易燃防爆分解难。
3.甲烷与氯气的取代反应是分步进行的,每有1 mol氢原子被取代,需消耗1 mol 氯气。
4.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
甲烷的分子结构1.有机化合物和烃(1)有机化合物①概念:含有碳元素的化合物,简称有机物。
②组成:一定含有碳元素,常含有氢、氧元素,某些有机物还含有氮、硫、卤素、磷等元素。
(2)烃①概念:仅含碳和氢两种元素的有机物。
②典型代表物:最简单的烃是甲烷。
2.甲烷的分子结构(1)存在与用途①存在:是天然气、沼气、油田气和煤矿坑道气的主要成分。
②用途:是一种高效、低耗、污染小的清洁能源,还是一种重要的化工原料。
(2)分子结构①分子结构:分子式电子式结构式分子模型球棍模型比例模型CH4②空间结构分子结构示意图结构特点及空间构型4个C—H键的长度和强度相同,夹角相等,具有正四面体结构[特别提醒]甲烷分子不是平面结构,即5个原子不在同一平面内,而是呈正四面体结构。
1.已知甲烷的密度在标准状况下是0.717 g·L-1,含碳75%,含氢25%,利用这些数据怎样确定它的分子式?2.若甲烷分子中的一个氢原子被氯原子取代,得到的CH3Cl还是正四面体结构吗?3.根据甲烷的正四面体结构推测CH2Cl2的结构应该有几种?1.有机化合物组成和结构的表示方法表示方法(以甲烷为例) 含义分子式:CH4用元素符号表示物质分子组成的式子,可反映一个分子中原子的种类和数目最简式(实验式):CH4表示物质组成的各元素原子最简整数比的式子用小黑点等符号代替电子,表示原子最外层电子成键情况的式子①用短线表示成键的共用电子对②具有分子式所能表示的意义,能反映分子的结构③表示分子中原子的结合或排列顺序的式子,但不表示空间结构结构简式:CH4结构式的简便写法,着重突出结构特点球棍模型:小球表示原子,短棍表示化学键,展示了空间结构比例模型:表明了原子的相对大小和空间相对位置22.甲烷空间结构的拓展根据甲烷的正四面体结构推知,有机物分子中碳原子以4个单键与其他原子相连。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第4章作业
一、选择题
1. cache存储器的内容应与主存储器的相应单元的内容( A)
A.保持一致B.可以不一致
C.无关
2.cache存储器的速度应比从主存储器取数据速度( A)
A.快B.稍快
C.相等D.慢
3.虚拟存储器的逻辑地址位数比物理地址( A)
A.多B.相等
C.少
4.EPROM是指( D)
A. 读写存储器
B. 只读存储器
C. 可编程的只读存储器
D. 可擦除可编程的只读存储器
5.存储器是计算机系统的记忆设备,主要用于(D )。
A.存放程序
B.存放软件
C.存放微程序
D.存放程序和数据
6. 在主存和CPU之间增加cache存储器的目的是(C )。
A. 增加内存容量
B. 提高内存可靠性
C. 解决CPU和主存之间的速度匹配
D. 增加内存容量,同时加快存取速度7.外存储器与内存储器相比,外存储器( B)。
A.速度快,容量大,成本高
B.速度慢,容量大,成本低
C.速度快,容量小,成本高
D.速度慢,容量大,成本高
8.动态RAM的基本存储器件是( A)。
A. 电容
B. 触发器
C. 字节
D. 扇区
9.使用Cache的主要依据是( B)。
A. Cache容量大
B. 存储器访问的局部性
C. 内存容量不足
D. Cache速度慢
10.对于磁盘存储器来说,如下说法错误的是:(D )
A.存储的数据分布在盘片的同心圆上,这些同心圆被称为磁道;
B.从磁盘的圆心到磁盘的边缘,磁道上数据的密度逐渐降低;
C.对于同一个磁盘,每个磁道上可存储的数据量是相同的;
D.磁盘上的任何信息对用户来说都是可以访问的。
11.半导体静态存储器SRAM的存储原理是( A)。
A.依靠双稳态电路B.依靠定时刷新
C.依靠读后再生D.信息不再变化
12.某DRAM芯片,其存储容量为512K×8位,该芯片的地址线和数据线数目为( D )。
A.8,512 B.512,8
C.18,8 D.19,8
13.主存与辅存的区别不包括(A )。
A.是否按字节或字编址
B.能否长期保存信息
C.能否运行程序
D.能否由CPU直接访问
14.某机字长32位,存储容量1MB,若按字编址,它的寻址范围是( C )。
A. 1MB B. 512KB
C. 256K D. 256KB
15.Cache是( C )。
A.主存的一部分 B.为扩大存储容量而设置的
C. 为提高存储系统的速度
D.辅助存储器的一部分
16.某存储器芯片的存储容量为8K×8位,则它的地址线和数据线引脚相加的和为( C )
A. 12
B. 13
C. 21
D. 22
17.存储周期是指(C )。
A.存储器的读出时间B.存储器的写入时间
C.存储器进行连续读和写操作所允许的最短时间间隔
D.存储器进行连续写操作所允许的最短时间间隔
18.闪速存储器被称为(B )。
A. 光盘
B. 固态盘
C. 硬盘
D. 软盘
19.采用虚拟存储器的主要目的是( B )。
A. 提高主存储器的存取速度
B. 扩大主存储器的存储空间
C. 扩大外存储器的存储空间
D. 提高外存储器的存取速度
二、判断题
1.存储单元是存放一个二进制信息的存贮元。
(错)
2.磁盘存储器的平均存取时间与盘的转速无关。
(错)
3.CPU访问存储器的时间是由存储器的容量决定的,存储容量与越大,访问存储器所需的时间越长。
(错)
4.引入虚拟存储系统的目的是提高存储速度。
(错)注释:扩大主存
5.主存储器中,采用双译码结构的主要目的是降低成本.。
(对)
6.使用高速缓存的目的是增加逻辑地址空间。
(错)
7.计算机中使用Cache的目的是提高CPU读取数据的速度。
(对 )
8.高速缓存(Cache)可以看做主存的延伸,与主存统一编址,接受CPU的访问,但其速度要比主存高得多。
(错)注释:与主存不是统一编制。
9.Cache的工作是基于程序访问的局部性的。
(对)
10.Cache的功能全由硬件实现。
(对)
11.大多数个人计算机中可配置的内存容量受地址总线位数限制。
(对)12.磁盘上的信息,包括程序和数据,都只能读到或写入主存,而不能直接在磁盘和CPU之间进行信息交换。
(对)
13.磁盘盘面上各磁道的位密度不同,而磁道总容量相同。
(对)。
