大气环境化学(3)-9-29
【环境化学】环境污染物在环境各圈的迁移转化过程简介

环境化学第一章绪论第一节环境化学一、环境问题二、环境化学第二节环境污染物一、环境污染物的类别二、环境效应及其影响因素三、环境污染物在环境各圈的迁移转化过程简介表1-1环境化学分支学科划分注:①“环境生态学也可列为平行的另一个分支学科第二章大气环境化学第一节大气中污染物的迁移一、大气温度层结和密度层结二、辐射逆温层三、气块的绝热过程和干绝热递减率四、大气稳定度五、影响大气污染物迁移的因素第二节大气中污染物的转化一、光化学反应基础1 光化学反应过程 2 量子产率 3 大气中重要吸光物质的光离解二、大气中重要自由基的来源1.大气中HO和HO2自由基的浓度2.大气中HO和HO2的来源3.R、RO和RO2等自由基的来源三、氮氧化物的转化1 大气中含氮化合物2 氮氧化物的气相转化四、碳氢化合物的转化1 大气中主要的碳氢化合物2 碳氢化合物在大气中的反应表2-3 HO、O与烷烃反应的速度常数五、光化学烟雾1 光化学烟雾2 光化学烟雾形成的简化机制3 光化学烟雾的控制对策六、硫氧化物的转化及硫酸烟雾型污染 1 二氧化硫的气相氧化2 二氧化硫的液相氧化 3 硫酸烟雾型污染表2-6 伦敦型烟雾与洛杉矶烟雾的比较七、酸性降水 1 降水的PH 2 降水PH的背景值 3 降水的化学组成4 酸<a name=baidusnap0></a>雨的</B>化学组成5 影响酸雨形成的因素表2-7 世界某些降水背景点的pH值表2-8 国外部分地区降水化学成分(μmol/L) 注:本表摘自唐孝炎,1990。
表2-9 国内部分城市降水化学成分(μmol/L) 表2-9 国内部分城市降水化学成分(μmol/L) 注:本表摘自唐孝炎,1990。
表2-15 我国部分地区降水酸度和主要离子含量(μmol/L)表2-16 降水中离子浓度比较注:本表摘自王晓蓉,1993。
①北京和天津城区数据平均值。
②重庆铜元局和贵阳喷水池数据平均值。
环境化学

环境化学是主要研究有害化学物质在环境介质中的存在、化学特性、行为与效应及其控制的化学原理和方法的科学。
● 环境化学是化学学科的一个重要分支,也是环境学科的核心组成部分。
● 主要介绍有害化学物质在大气环境、水环境、土壤环境以及生物体内的迁移、转化以及效应(即大气环境化学、水环境化学、土壤环境化学等),同时,介绍一些目前环境学科领域最新研究成果和进展情况。
● 另外,环境化学是一门综合性非常强的学科,不但需要掌握其有关理论知识,还要具备一定的实验技能。
因此,除了学好环境化学课程外,还要重视环境化学实验。
哲学上——环境是一个相对的概念,是与某一中心或主体相对的客体。
当中心或主体不同的时候,相应的客体即环境的含义也有所不同。
● 英语environment,来自法浯envirommer,意为“环绕”或“包围”。
● 环境学科方面,环境一般是指:● ①一个生物个体或生物群体的周围的自然状况或物质条件——自然环境;● ②影响个体和群体的复杂的社会、文化条件——社会环境。
实际工作中——从工作需要出发给环境做出定义,例如:● 在我国的环境保护法中的环境是指:大气、水、土地、矿藏、森林、草原、野生动物、野生植物、水生植物、名胜古迹、风景游览区、温泉、疗养区、自然保护区、生活居住区等”。
● 在环境管理体系标准IS014001中对环境的定义是“组织活动的外部存在,包括空气、水、土地、自然资源、植物、动物、人,以及它们之间的相互关系”。
环境化学中的环境是泛指以人类为中心的周围自然环境要素的总称。
20世纪30-60年代震惊世界的八大公害事件:(1)马斯河谷烟雾事件(episode)(2)洛杉矾光化学烟雾事件(episode)(3)多诺拉烟雾事件(episode)(4)伦敦烟雾事件(London smog event) (5)四日市(哮喘)事件(event)(6)水俣病事件(event)(7)骨痛病事件(富山事件,event)(8)米糠油事件(event)目前,环保界谈“松”色变,心有余悸,应非常慎重对待化学品安全以及化工行业环保问题。
环境化学:第二章大气环境化学 3
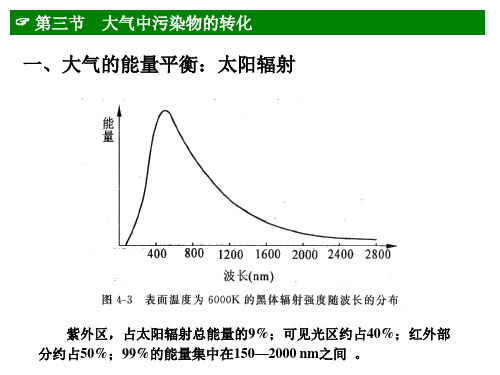
-4
λ < 120 nm
N2 + hν
N+N
120 160 200 240
λ (nm)
图2-29 O2吸收光谱(R. A. Bailey, 1978)
第三节 大气中污染物的转化
(2)臭氧的光离解
O + O2 + M 低碰于撞1反00应0 km的大气中,O3 + M
臭氧吸收1180 nm以下的光就可以离解,但主要 吸收290 nm以下的光,较长波长的光可以进入对流 层和地面。
A :B 能量 A+ + BA :B 能量 A·+B·
不对称裂解 对称裂解
自由基——由对称裂解生成的带单电子的原子或原子 团称为自由基。
第三节 大气中污染物的转化
2、自由基反应(free radical reaction)
凡是有自由基生成或由自由基诱发的反应都 叫做自由基反应。
CCl3F + hγ(175~220nm)
c. H2O2 + hν 2·OH
第三节 大气中污染物的转化
1、 HO 自由基的来源
HO最高含量出现在热带,因为那里温度高,太阳辐射强。
第三节 大气中污染物的转化
2、 HO2自由基的来源
a. 甲醛光解(主要来源):
HCHO + hν
H + HCO
H+O2 + M HCO+O2
HO2 + M HO2+CO
第三节 大气中污染物的转化
3、大气中重要吸光物质的光离解 4
(1) O2和N2的光离解
3
2
O2键能493.8KJ/mol。相
1
应波长为243nm。在紫外区 lgε
自考环境化学题目与答案

环境化学习题集及答案一、名词解释题环境污染: 是指由于自然或人为的(生产和生活)的原因往原先处于正常状态的环境中附加了物质、能量或生物体,其数量和强度超过了环境的自净能力,使环境质量变差,并对人们的健康或环境中某些有价值的物质产生有害影响者。
环境污染化学: 主要研究化学污染物在生态环境体系中的来源、转化、归宿及生态效应的学科,又分为大气、水体和土壤三个部分。
化学污染物:指由人类活动产生的与天然环境化学组分共存和相互作用又可能产生不良生态效应或健康效应的化学物质。
环境化学:是一门研究有害物质在环境介质中的存在形态、化学特性、行为和效应及其控制的化学原理和方法的科学。
污染物的迁移:污染物在环境中所发生的空间位移及其所有引起的富集、分散和消失的过程谓之污染物的迁移。
污染物的转化:污染物的转化是指污染物在环境中通过物理、化学或生物的作用改变存在形态或转变为另一种物质的过程。
酸雨: 酸性物质的湿沉降而形成pH<5.6的降水。
温室效应:大气中的浓度越来越高的CO2、H2O、CH4等物质具有使太阳辐射通过到达地面,却大量吸收了来自地面的长波辐射,从而使地面温度升高的现象。
光化学烟雾: 碳氢化合物和NOx等一次污染物在强烈太阳光作用下发生光化学反应而生成一些氧化性很强的二次污染物(如O3、PAN,硝酸等),这些反应物(一次污染物)和产物(二次污染物)的混合物(其中有气体和颗粒物)所形成的烟雾,称为光化学烟雾。
积聚膜:颗粒物的有效直径在0.05-2 μm范围内,主来源于爱根核膜的凝聚,燃烧过程所产生蒸汽冷凝、凝聚,以及由大气化学反应所产生的各种气体分子转化成的二次气溶胶等。
爱根核膜:爱根核膜:粒径小于0.05 μm,主要来源于燃烧过程所产生的一次气溶胶粒子和气体分子通过化学反应均相成核转换的二次气溶胶粒子,所以又称成核型。
敏化光解: 水体中存在的天然物质(如腐殖质等)被阳光激发,又将其激发态的能量转移给化合物而导致的分解反应;生物积累: 生物从周围环境中(水、土壤、大气)和食物链蓄积某种元素或难降解物质,使其在机体内的浓度超过周围环境中浓度的现象。
环境化学_戴树桂版_第二版_课件_1第一章

3)降雨中的环境化学 rainfall and Environ. Chem.
冲 刷 尘 埃 ? O2=O+O , SO3+H2O=H2SO4,NO2+H2O=HNO3
O+O2=O3 , O3=O2+O ,
4)原野湿地静悄悄 :栖息地、酸雨、臭氧层、疾病、化学污染物
一、环境问题—旧话重提
1、Environment
1)定义 环境是指与某一中心事物有关(相适应)的周
围客观事物的总和,中心事物是指被研究的对象。 对人类社会而言,环境就是影响人类生存和发展 的物质、能量、社会、自然因素的总和。
8
9
一定程度上,自然环境中适应的本质是化学物质作用结果
➢小麦种在麦仙翁(一种野草)群落中,产量明显提高; ➢ 羊角芹的种子同期它植物种子种植在一起,其它植物不会发芽; ➢ 黄鱼不能生长在淡水中; ➢ 鲤鱼不会生长在海水中; ➢ 人体血液中元素含量和地壳中元素的丰度具有高度的一致性; 2)分类:环境包括自然环境和社会环境两大部分。
(4)伦敦烟雾事件:发生在1952年12月5~8日,四天内中毒死亡4000 多人。
(5)四日市哮喘事件:1955年以来日本四日市石油提炼和工业燃油产生的 废气严重污染城市大气,哮喘病患者达817人,死亡36人。
(6)痛痛病事件:1955~1972年日本富山县内的锌、铅冶炼厂等排放的 含镉废水污染神通川水体,两岸居民利用河水灌溉农田,使稻米含镉,居 民食用含镉米和饮用含镉水而中毒,患者超过280人,死亡数十人。
环境化学
32学时
东华大学环境科学系:宋新山
Tel: 67792550;13044120556
E-mail:newmountain@
第3篇大气环境化学第1章大气成分

rs
es(T)
pes(T)
es(T)
p
qs p0 .e3s7(T 8e)s(T)esp(T)
2020/2/19
23
地球大气成分 V -水汽密度
纯水汽状态方程
e VRVT
假设纯水汽的状态方程式对湿空气中的水汽也适用,仍以e表示
水汽压,利用干空气的比气体常数Rd
e
1
V
r e pe
q e
p 0.378e
大气中通常e60hPa,可认为
r q e p
2020/2/19
17
地球大气成分-纯水汽的饱和水汽压
纯水汽的饱和水汽压仅与温度有关。
饱和水汽压随温度的变化率→
克拉珀龙-克劳修斯方程
des LV es dT RV T 2
式中 T-温度, e s ( T ) -纯水平液面时的饱和水汽压 RV-水汽的比气体常数 LV-相变(汽化)潜热。
500km:O,He,N2,H和 O2; 1000km:He,H和O
2020/2/19
34
大气的分层和结构-化学成分分层
外大气层
500km以上的热层顶开始的大气层(或 称逸散层)
(1)大气处于电离状态,质子含量大大超过 中性氢原子的含量
(2)空气粒子数稀少,中性粒子之间碰撞平 均自由程达到104m。
2020/2/19
35
大气的分层和结构-电磁特性分层
电离层 60km~500~1000km气层 太阳电磁辐射(主要是短于0.1m的
紫外线、X射线)和微粒辐射(从太阳 发出的质子、电子等及宇宙线粒子)的 作 )用电→离空(气正分离子子和和原自子由电(子N2),→O2产,生O与等 复合→平衡→形成电子数密度的垂直分 布
环境化学复习内容

《环境化学》习题与思考题一、填空题1. 环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。
2. 污染物在环境中所发生的空间位移称为迁移过程。
3. 污染物在环境中通过物理、化学或生物作用改变存在形态的过程称为转化的过程。
4. 世界环境日为_6月5日_。
5.造成环境污染的因素有物理的、化学的和生物的的三方面,其中化学物质引起的约占80%-90%。
6.环境中污染物的迁移主要有机械迁移、物理—化学迁移和生物迁移三种方式。
7.当今世界上最引人瞩目的几个环境问题_光化学烟雾__、_温室效应__、__臭氧层破坏__等是由大气污染所引起的。
8.根据温度垂直分布可将大气圈分为对流层、平流层、_中间层__、热层和逃逸层。
9. 许多大气污染事件都与逆温现象有关,逆温可分为_乱流逆温_、_下沉逆温_、_锋面逆温_。
10.气团的稳定性与_大气的垂直递减率_和_干绝热垂直递减率_两个因素有关。
11. 醛类光解是大气中HO2—自由基的重要来源。
12. 自由基在其电子壳层的外层有一个不成对电子,所以具有很高的活性和强氧化作用,其中以HO—和HO2—自由基最为重要。
13. 大气污染化学中所说的氮氧化物主要是指__NO_和__NO2__。
14.碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
15. 大气中主要温室气体有_CO2_、__CH4_等。
16. 污染物在大气中扩散取决于__热力学因素__、__动力因素_和_地形地貌_等因素。
18. 大气颗粒物按表面积与粒径分布关系分为三种粒度膜,分别是_Aitken核膜_、_积聚膜_和_粗粒子膜_。
19. 当大气中_O3_浓度比较高时,可以使烯烃生成二元自由基。
20. HNO2的光解是污染大气中_HO—_自由基的重要来源之一。
21. 清洁大气中HO的重要来源是___O3的分解____。
22. 烷基和空气中O2结合形成__过氧化烃_。
环境化学知识点

1.环境化学研究的容主要涉及:①有害物质在环境介质中存在的浓度水平和形态②潜在有害物质的来源,以及它们在个别环境介质中和不同介质间的环境化学行为③有害物质对环境和生态系统以及人体安康产生效应的机制和风险性④有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
2.环境化学的特点〔从学科研究任务来说〕是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
3.优先污染物毒性强、难降解、残留时间长、在环境中分布广的污染物〔我国首批68种,美国环保局率先公布129种〕5.“三致〞当前世界围最关注的化学污染物主要是持久性有机污染物,具有致突变、致癌变、和致畸变作用的所谓“三致〞化学污染物,以及环境分泌干扰物。
6.化学污染物元素、无机物、有机化合物和烃类、金属有机物和准金属有机化合物、含氧有机化合物、有机氮化合物、有机卤化物、有机硫化合物、有机磷化合物。
7.人类社会活动不同功能产生的污染物:工业、农业、交通运输、生活8. 污染物在环境中的迁移①机械迁移②物理-化学迁移③生物迁移按受污染物影响的环境要素分:大气污染物、水体污染物、土壤污染物按形态分:气体污染物、液体污染物、固体废弃物,按性质分:化学污染物、物理污染物、生物污染物第二章大气环境化学1.环境中的大气污染物种类很多:⑴按物理状态①气态污染物②颗粒物⑵按形成过程①一次污染物(直接从污染源排放的污染物质如CO,SO₂,NO)②二次污染物(由一次污染物经化学反响形成的污染物质如O₃,硫酸盐颗粒物)⑶按化学组成①含硫化合物:氧硫化碳(COS)二硫化碳(CS2)、二甲基硫[(CH3)₂S]、硫化氢(H ₂S), SO₂,SO₃,H₂SO₄、亚硫酸盐(MSO3)和硫酸盐〔MSO₄〕②含氮化合物:大气中存在的含量比较高的氮的氧化物主要包括氧化亚氮(N₂O是底层大气中含量最高的含氮化合物)、一氧化氮(NO)和二氧化氮(NO₂)来源:光化学反响、闪电、微生物固化、火山爆发森林火灾,人为污染:氮肥、炸药、燃料燃烧③含碳化合物:大气中含碳化合物主要包括CO、CO₂及有机的碳氢化合物和含氧烃类,如醛酮酸等④含卤素化合物2. SO2主要来源于含硫燃料的燃烧〔煤、石油〕,SO2参与了硫酸烟雾和酸雨的形成成为了重要的大气污染物3.对于一个城市或地区的空气污染,风向、风速并不是经常起决定行作用的因素,尤其是对于城市空气强污染期的形成,大气稳定度和低层逆温的作用可能更大。
一级学科名称 环境科学与工程、生态学 专业名称 环境科学、环境

陈能汪
黄金良
彭本荣
6
环境模型与信息系统
研究内容:环境模型,地理信息系统和遥感的应用、流域综合管理信息系统、城市环境管理信息系统、海洋管理信息系统等。
特色与意义:以流域综合管理信息系统、城市环境管理信息系统、海洋管理信息系统为特色,为管理的自动化和信息化服务。
曹文志(*)
江毓武
黄金良
张文舟
黄邦钦(*)
王大志(*)
焦念志(*)
7
环境海洋学
研究内容:环境海洋学是研究在全球变化背景下,人类社会发展与海洋环境和生态系统的相互作用规律、寻求人与海洋协调发展的学科。该专业包括河口近岸动力学、近海生物地球化学、近海生态学与生物多样性和海洋环境生态毒理学。
黄邦钦(*)
史大林(*)
李炎
陈炳章
陈能汪
刘广山
王文雄(*)
王新红
周克夫
洪海征
郭丰
王明华
陈荣
郁昂
6
海洋分子生态学
研究内容:分子生态学是20世纪90年代初发展起来的新兴交叉学科,是利用分子生物学技术与方法(包括DNA和蛋白质两个水平)研究生物对其所处环境的适应以及产生这种适应反应的分子机制。海洋分子生态学是围绕着海洋生态现象的分子活动规律这个中心进行的,特别是种群动态的分子机理。本研究方向目前的研究课题包括海洋生物(主要是微型生物)的遗传多样性、分子进化与分子系统学;海洋微型生物的分子鉴定;海洋初级生产过程的分子机制;浮游植物磷、氮代谢的酶学和分子基础;海洋生物修复环境污染的分子机制等。
三课程设置序号课程类型课程名称学期学分总学时授课语言任课教师职称公共学位英语春季秋季72中文研究生院统一安排中国特色社会主义理论与实践研究春季36中文研究生院统一安排自然辩证法概论秋季18中文研究生院统一安排专业学位环境科学前沿秋季54中文生态学前沿秋季54中文可持续发展进展秋季54中文环境化学春季54中文环境生态学秋季54中文环境监测春季54中文10环境管理秋季54中文11环境规划秋季54中文12环境经济学与环境政策春季54中文13环境工程学秋季54中文14生态工程原理与方法春季54中文15水污染控制工程专题秋季54中文16河口与沿岸海洋学春季54中文17海洋立体监测系统秋季54中文18流域与近海生物地球化学春季54中文19生态学研究技术与方法秋季54中文20咼级生态学秋季中文21湿地生态学秋季54中文22选修英文报告春季36中文23生物多样性及其保护秋季36中文24分子生态毒理学春季36中文25仪器分析及其实验技术秋季2336中文26环境变化研究方法春季36中文27数据统计分析与处理秋季36中文28放射性核素测量方法基础秋季36中文29环境评价秋季36中文30水文与水环境春季36中文31海岸带综合管理秋季36英文32gis在环境科学中的应用春季36中文33环境地理学
大气环境化学

大气环境化学绪论1.大气环境化学主要研究大气中对环境有影响的重要组分在大气中的来源、存在形式,迁移过程中的化学转化,归宿以及对大气质量的影响等。
2.大气环境化学的研究方法主要有:现场试验研究,实验室研究和模式计算。
3.一个大气即所有的污染问题都发生在同一个大气下,各种问题通过自由基化学或关键物种的化学过程而彼此相关联,应采取综合性的方法对各种相关的污染问题进行整体考虑,以避免在解决一个问题的同时又产生了新的问题。
第一章1.大气由还原性气氛向氧化性气氛转化。
2.大气分为对流层,平流层,中层,热层和外层。
3.对流层厚度随纬度季节不同而变化。
对流层集中了大气质量的3/4,90%以上的水汽集中在对流层中,大气中主要的天气现象都形成在此层内。
4.自对流层顶向上到55km左右的气层成为平流层。
平流层特点:1.空气没有垂直对流运动,平流运动占据显著优势;2.空气比下层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象;3.在高约15~35km的范围内,有厚约20km的臭氧层,因为臭氧吸收太阳辐射的紫外线,使得平流层温度升高。
5.大气组分按其停留时间长短可分为准永久性气体,可变化组分和强可变组分。
6.大气组分的浓度表示方法:1)混合比浓度:这种浓度表示法主要用于气态污染物,对于大气中的低浓度物质是适用的。
公式:p29 2)这种浓度表示方法用于比ppt还要低的浓度水平,如自由基浓度等,表示每立方厘米空气中有多少个分子、原子或自由基。
公式p29 3)质量浓度表示法:p307.自由基在其电子壳层的外层有一股不成对电子,它们对于增加第二个电子有很强的亲和力,因此能起强氧化剂的作用。
大气环境质量标准。
(2月份公布的新标准)第二章1.污染物来源:人为源有燃料燃烧,工业排放,固体废弃物的焚烧,农业活动排放,生物质。
天然源有自然尘,森林、草原火灾,火山活动,森林排放,海浪飞沫,海洋浮游植物、海洋表层。
2.大污染物的汇机制。
1)干沉降:重力沉降,与植物、建筑物或地面相碰撞而被捕获的过程;2)湿沉降:大气中的物质通过降水而落到地面的过程;3)化学反应去除:污染物在大气中通过化学反应生成其他气体或粒子而使原污染物在大气中消失;4)向平流层输送。
环境化学习题答案

《环境化学》习题与思考题一、填空题1. 环境科学主要是运用(1)和(2)的有关学科的理论、技术和方法来研究(3)。
2. 污染物在环境中所发生的空间位移称为(4)过程。
3. 污染物在环境中通过物理、化学或生物作用改变存在形态的过程称为(5)的过程。
4. 醛类光解是大气中(6)自由基的重要来源。
5. 自由基在其电子壳层的外层有一个不成对电子,所以具有很高的(7)和(8)作用,其中以(9)和(10)自由基最为重要。
6. 大气污染化学中所说的氮氧化物主要是指(11)和(12)。
7. 大气中主要温室气体有(13)、(14)等。
7. 污染物在大气中扩散取决于(15)、(16)和(17)等因素。
9. 大气按垂直结构分为(18)层、(19)层、(20)层、(21)层及(22)层。
10. 大气颗粒物按表面积与粒径分布关系分为三种粒度膜,分别是(23)、(24)和(25)。
11. 当大气中(26)浓度比较高时,可以使烯烃生成二元自由基。
12. HNO2的光解是污染大气中(27)自由基的重要来源之一。
13. 清洁大气中HO的重要来源是(28)。
14. 烷基和空气中O2结合形成(29)。
15. 大气中CH3自由基的主要来源是(30)和(31)的光解。
16. (32)作用是有机物从溶解态转入气相的一种重要迁移过程。
17. 水环境中胶体颗粒的吸附作用大体可分为(33)、(34)和(35)。
18. 水中的有机污染物一般通过(36)、(37)、(38)、(39)、(40)和(41)等过程进行迁移转化。
19. 在一般天然环境水中,(42)是决定电位物质,而在有机物累积的厌氧环境中,(43)是决定电位物质。
20. 吸附等温线表达了在一定条件下颗粒物表面上的(44)与溶液中溶质(45)之间的关系。
21. 胶体颗粒的聚集亦可称为(46)或(47)。
22. 有机污染物的光解过程分为三类,分别是(48)、(49)和(50)。
23. 典型土壤随深度呈现不同层次,分别为(51)层、(52)层、(53)层和(54)层。
环境化学复习题

1.按照大气温度、化学组成及其它性质在垂直方向上的变化,大气圈可以分为对流层、平流层、中间层、热层和逃逸层。
2.干沉降是大气中NOx最主要的消除方式。
(x)3.近地面大气中水汽和CO2量增加,它们会吸收地面长波辐射,在近地面与大气层间形成绝热层,使近地面热量得以保持,并导致全球气温升高,直接影响人类的生活和安全这就是所谓的温室效应。
4.光化学烟雾:含有氮氧化物和碳氢化合物等一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾。
(2)特征:蓝色烟雾,强氧化性,具有强刺激性,使大气能见度降低,在白天生成傍晚消失,高峰在中午或午后,污染区域往往在污染的下风向几十至几百公里处。
(3)形成条件:氮氧化物与碳氢化物的存在;大气湿度较低;强的阳光辐射;易发生在温度较高(24~32℃)的夏秋季晴天。
(4)污染物与产物的日变化曲线:清晨,大气中有固定源及汽车排放的NOx和烃类化合物,强光照射后NO2光解产生O.,随后一系列反应相继发生,产生O3及HO.,而HO.可以使烃类氧化为新的自由基,大部分生成RO2.、HO2.、RC(O)O2.,这些具有强氧化性的自由基将NO氧化为NO2,代替了O3的氧化,这样O3愈积愈多,同时在反应过程中,生成了一系列二次污染物如醛类、PAN等,与一次污染物NOx、烃类化合物混合形成了光化学烟雾。
下午,随着日光的减弱,NO2光解受到抑制,光化学反应趋于缓慢,产物浓度相继下降,光化学烟雾现象消失。
(5)控制对策:改进技术控制汽车尾气;改善能源结构;加强监测与管理。
5.能引起温室效应的气体主要有CO2、CH4、N2O、氯氟烃等。
6.自由基反应是大气化学反应过程中的核心反应。
光化学烟雾的形成,酸雨前体物的氧化,臭氧层的破坏等都与此有关;大气中重要的自由基有羟基自由基、过氧羟基自由基、烷氧自由基、过氧烷氧自由基。
7.自由基反应主要包括链引发,连传递,链终止三个阶段。
环境化学习题

环境化学习题第二章大气环境化学1. 何谓大气温度层结2. 逆温现象对大气中污染物的迁移有什么影响3. 何谓大气垂直递减率和干绝热垂直递减率如何用其判断大气稳定度4. 影响大气中污染物迁移的主要因素是什么5. 大气中有那些重要的吸光物质其吸光特征是什么6. 太阳的发射光谱和地面测得的太阳光谱有何不同为什么7. 大气中有哪些重要自由基其来源如何8. 大气中有哪些重要含氮化合物说明它们的天然和人为来源及对环境的污染。
9. 叙述大气中的NO转化为NO2的各种途径。
10. 大气中有哪些重要的碳氢化合物它们可发生哪些重要的光化学反应11. 碳氢化合物参与的光化学反应对各种自由基的形成有什么贡献12.说明光化学烟雾现象,解释污染物与产物的日变化曲线,并说明光化学烟雾产物的性质与特征。
13. 说明烃类在光化学烟雾形成过程中的重要作用。
14. 何谓有机物的反应活性如何将有机物按反应活性分类15. 简述大气中SO2氧化的几种途径。
16. 论述SO2液相氧化的重要性,并对各种催化氧化过程进行比较。
17. 说明酸雨形成的原因。
18. 确定酸雨pH界限的依据是什么19. 论述影响酸雨形成的因素。
20. 什么是大气颗粒物的三模态如何识别各种粒子模21. 说明大气颗粒物的化学组成以及污染物对大气颗粒物组成的影响。
22. 大气颗粒物中多环芳烃的种类,存在状态以及危害性如何23. 何谓温室效应和温室气体24. 说明臭氧层破坏的原因和机理。
第三章水环境化学1. 请推导出封闭和开放体系碳酸平衡中[H2CO3*]、[HCO3-]、[CO32-]的表达式,并讨论这两个体系之间的区别。
2. 请导出总酸度、CO2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总炭酸量和分布系数(α)的函数。
3. 向某一含有碳酸的水体加入重碳酸盐,问:①总酸度、②总碱度、③无机酸度、④酚酞碱度、⑤CO2酸度,是增加还、减少还是不变。
4. 在一个pH为,碱度为mmol/L的水体重,若加入碳酸钠是其碱化,问需要加多少mmol/L 的碳酸钠才能使水体pH值上升至。
《环境化学》课后习题解答

《环境化学》课后习题解答第一章绪论2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
3、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3.有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、PAH等;4.金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5.含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6.含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7.有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8.有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9.有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
环境化学填空

填空1.环境问题是在工业化过程中产生的,具体原因包括污染物排放和过度开发资源;2.可持续发展的战略思想是经济、社会和环境保护协调发展,其核心思想是:经济发展不能超过资源和环境的承载力;3在大气对流层中污染物易随空气发生垂直对流运动,在平流层中污染物易随地球自转发生水平运动;4.逆温层不利于污染物的传输。
5.当Γ<Γd时,大气处于稳定状态。
6.大气中重要自由基产生于光离解。
7.由若干个苯环稠和在一起的化合物称为多环芳烃;8.在有氮氧化物和碳氢化合物存在于大气中时可能发生光化学烟雾,该反应机制为:自由基引发、自由基转化和增殖、自由基氧化NO、链终止;9.平流层中的臭氧层能够吸收紫外线从而保护生物,维持生态平衡;10.洛杉矶烟雾也称为光化学烟雾。
11.伦敦烟雾也称为硫酸型烟雾。
12.当降水的pH值时,称为酸雨。
13.可吸入粒子是指粒径﹤10um的颗粒物;是指大气中的过氧乙酰硝酸酯污染物;15.水中异养生物利用自养生物产生的有机物为能源及材料构成生命体;16.导致痛痛病的污染物是Cd;17.导致水俣病的污染物是甲基汞。
18.腐殖质分子中含有多元环状结构,其上联接有 -OH -COOH -CHO等官能团;19.非离子型有机物可通过溶解作用分配到土壤有机质中;值在至之间时,水中碳酸的主要形态分别为CO2、H2CO3、HCO3-;21.水中无机污染物的迁移转化方式有吸附、凝聚絮凝、溶解沉淀、配合、氧化还原;22. 水中有机污染物的迁移转化方式有分配、水解、光解、挥发、生物降解;值低表示环境为有机碳性环境。
24.标化分配系数是以有机碳为基础表示的分配系数。
25.次生矿物由物理分化和化学分化而成;26.氧垂曲线可依次划分为清洁区及分解区、腐败区、恢复区及清洁区27.在S-P模型中,溶解氧有一个最低值称为极限溶解氧28.天然水中的颗粒物聚集的动力学方程分别称为为异向絮凝、同向絮凝、差速沉降絮凝。
29.次生铝硅酸盐由硅氧四面体层和铝氢氧八面体层构成,它们是高岭石、蒙脱石和伊利石。
2024年环境化学(带)

环境化学(带附件)环境化学是一门研究化学物质在环境中的存在、迁移、转化、归趋和影响的科学。
它是环境科学与化学的交叉学科,旨在揭示化学物质与环境的相互作用规律,为环境保护和污染控制提供科学依据。
本文将从环境化学的定义、研究内容、研究方法和发展趋势等方面进行阐述。
一、环境化学的定义环境化学是研究化学物质在环境中的行为、效应及其与环境相互作用的科学。
它关注化学物质在空气、水、土壤、生物等环境介质中的分布、迁移、转化、降解和生物可利用性等方面。
环境化学的研究对象包括自然环境中存在的化学物质和人类活动排放的化学物质。
二、环境化学的研究内容1.环境分析化学:研究环境中化学物质的检测、测定和监控方法,为环境化学研究提供数据支持。
2.环境污染化学:研究污染物的来源、排放、迁移、转化和归宿,探讨污染物的环境行为和生态效应。
3.环境生物化学:研究生物体与化学物质相互作用的规律,探讨化学物质对生物体的毒性、代谢和生物降解等过程。
4.环境催化化学:研究催化剂在环境污染物降解和资源化中的作用,为环境污染控制提供技术支持。
5.环境地球化学:研究地球表层环境中化学元素的分布、迁移和循环,探讨化学物质在地质历史演变中的作用。
6.环境化学污染控制:研究化学污染物的治理技术、政策和法规,为环境管理提供科学依据。
三、环境化学的研究方法1.采样与分析方法:采用现场采样、实验室分析和仪器检测等技术,获取化学物质在环境中的浓度、形态和分布等数据。
2.模型模拟方法:建立数学模型,模拟化学物质在环境中的迁移、转化和归趋过程,预测污染物的影响范围和程度。
3.实验室模拟方法:通过实验室模拟环境条件,研究化学物质的环境行为和生物效应。
4.现场监测方法:利用遥感、传感器等技术,实时监测环境中化学物质的浓度和分布。
5.联合研究方法:结合多种研究手段,从不同角度探讨化学物质与环境相互作用的过程和机制。
四、环境化学的发展趋势1.环境纳米化学:研究纳米材料在环境化学污染控制中的应用,探讨纳米技术在环境保护领域的潜力。
环境化学(第二版)课后习题参考答案

习题第一章绪论2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
3、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3.有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、PAH等;4.金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5.含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6.含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7.有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8.有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9.有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
环境化学总结

㈠基本概念:1.环境污染:由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,就叫做环境污染。
2.环境化学:环境化学是一门研究潜在有害化学物质在环境介质中的存在、行为,效应(生态效应、人体健康效应及其它环境效应)以及减少或消除其产生的科学。
3.环境物理效应:是由物理作用引起的环境效应,即环境物理效应。
3.热岛效应: 因燃烧而放出大量热量,再加街道和建筑群辐射的热量,使城市气温高于周围地带,称为热岛效应。
4.温室效应:大气中的CO2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应。
5.环境化学效应:在各种环境因素影响下,物质间发生化学反应产生的环境效应即为环境化学效应。
6.环境生物效应:环境因素变化导致生态系统变异而产生的后果即为环境生物效应。
8.平流层:平流层是指从对流层顶到海拔高度约50 km的大气层。
又称同温层。
9.中间层:中间层是指从平流层顶到80 km高度的大气层。
10.热层:热层是指从80 km到约500 km的大气层。
又叫电离层。
11.天气形势:指大范围气压的分布状况,局部地区气象条件总是受天气形势影响。
12.自由基的稳定性:是指自由基或多或少解离成较小碎片,或通过键断裂进行重排的倾向。
13.自由基的活性:是指一种自由基和其他作用物反应的难易程度。
15.碎裂:是指自由基碎裂生成一个稳定的分子和一个新的自由基。
16.重排:通常是邻近氧的c-c键断裂生成羰基和一个异构的自由基。
17.加成:是指自由基对饱和体系的加成,生成一个新的饱和自由基。
18.取代:是指自由基夺取其他分子中的氢原子或卤原子生成稳定化合物的过程。
19.光化学反应:分子、原子、自由基或离子吸收光子而发生化学反应,称为光化学反应。
20.光化学烟雾:含有氮氧化物和碳氢化合物等一次污染物的大气,在阳光照射下发生光化学反应产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾。
大气环境化学

HO·自由基氧化,不溶于水),不易在对流层被去 除,只可能扩散进入平流层 • 危害:破坏臭氧层p46;导致温室效应(吸收红 外线的能力比CO2强得多)p47
第37页,共127页,编辑于2022年,星期日
• 大气中污染物迁移是指由污染源排放的污染
• CH4的排放源主要分布在北半球 p42图
2-20
• CH4的浓度虽然有季节和若干年的周期变
化,但总体上逐年增加的趋势是十分明 显的
第35页,共127页,编辑于2022年,星期日
• 含卤素化合物:
• 主要指有机的卤代烃和无机的氯化物、氟化物, 其中以有机卤代烃对环境影响最为严重
• 简单卤代烃、氟氯烃类 • 常见为甲烷的衍生物,主要为天然来源(海洋
• 消除:最终转化成硝酸和硝酸盐经 干、湿沉降从大气中消除,其中湿
沉降是最主要的方式
第16页,共127页,编辑于2022年,星期日
• NOx的形成机理:
• 燃料中的含氮化合物在燃烧过程中
氧化生成NOx • 空气中的N2在燃烧过程中在高温条
件下氧化生成NOx p29
第17页,共127页,编辑于2022年,星期日
甲烷的来源、消除、浓度分布特征
第32页,共127页,编辑于2022年,星期日
• CH4有人为和天然来源 p39表2-2除燃烧
和原油天然气泄漏外,其它产生CH4的机 制都是厌氧细菌的发酵作用 • 反刍类动物
• 水稻田是中国大气中CH4的最大排放源, 排放量受多种因素影响
第33页,共127页,编辑于2022年,星期日
• 混合物中空气的量少于化学计量的量——富燃 料;反之则为贫燃料
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸烟雾型污染属于还原性混合物,
称还原性烟雾。
光化学烟雾与伦敦型烟雾的比较
八、酸性降水
20 世 纪 90 年 代 末 我 国 酸 雨 区 域 分 布
酸性降水是指通过降水将大气中的酸
性物质迁移到地面的过程,最常见的就
是酸雨,称湿沉降(wet deposition)。
(二元活性自由基)
HO2 SO2 HO SO3
CH 3O2 SO2 CH 3O SO3
CH3C (O)O2 SO2 CH3C (O)O SO3
c .被氧原子氧化:
NO2 hv NO O
K1
SO2 O SO3
K4
自由基对气相中SO2损耗的贡献(表 2-5)
空气质量日报(或周报)的主要内容 包括“空气污染指数”、“首要污染物”、 “空气质量级别”、“空气质量状况”等。
空气污染指数(Air Pollution Index,简称API)就 是将常规监测的几种空气污染物浓度简化成为单一的 数值形式,并分级表示空气污染程度和空气质量状况。 目前计入空气污染指数的项目暂定为:二氧化硫、一 氧化碳、二氧化氮、可吸入颗粒物和臭氧等。 不同地区的首要污染物有所不同。
会腐蚀文物古迹和建筑物
会危及人类健康
上图为叶子受酸雨侵害的情形:生斑、发黄
左图为显微镜观察叶子內部的组织: 细胞出现死亡
酸雨的一个间接影响就是溶解在水中的 有毒金属被水果,菜蔬和动物的组织吸 收, 吃下这些动植物会 对人类的产生 严重影响。例如,累积在动物器官和植 物组织中的汞与脑损伤、神经混乱是有 关联的。
3. 颗粒物的粒度和表面性质
粒度:粒径(直径)的大小;
当量直径、有效直径
空气动力学直径(Dp):与所研究粒子有相同终端落速度
的、密度为1的球体直径。
p Dp Dg K 0
Dg — —几何直径;
p — —忽略了浮力效应的颗粒密度; 0 — —参考密度( 0 1g/cm3) ;
K — —形状系数,当粒子为球状时,K 1.0;
M
M
(活性自由基)
HOSO2 O2 HO2 SO3
SO3 H 2O H 2 SO4
反应中生成的 HO2,通过反应
HO2 NO HO NO2
使得HO又再生,上述氧化过程又循环 进行,其决定步骤为SO2和HO的反应。
b. 与其他自由基的反应
CH 3CHOO SO2 CH 3CHO SO3
电中性原理: [H ] [OH ] [HCO 3 ] 2[CO 2 ] 3
] K W K H K1PCO2 2K H K1K 2 pCO2 [H [H ] [H ] [H ]2
解这个方程,得pH=5.6。
多年来,国际上一直将此值看作未受污染的大气水的 pH背景值。实际上,影响降水pH值的因素很多,近年来,倾 向于将pH=5.0作为酸雨的界限。
6%,石油含硫 0.5 - 3%。
天然来源主要是火山喷发。
1.SO2的氧化
SO2在大气中的氧化作用主 要通过两种途径:光化学氧化 作用和催化氧化作用。 (1)SO2的光化学氧化 1)直接光氧化: 低层大气光氧化形
成激发态分子,而不解离。
SO2 h (290 340 nm)1SO2 SO2 h (340 400 nm) 3 SO2
此反应中,Fe、Mn的盐类(包括硫酸盐和氯 化物)为催化剂,它们常以颗粒形态悬浮于污染大 气中,在湿度大时,颗粒物质可作为凝结核,或 发生水化作用变为溶液雾滴,这些液滴吸收SO2 和O2,使其在液相中进行一系列化学反应,就是 酸雨的形成。 但有两种情况:①液滴的酸性变高时,氧化 作用减缓,因SO2的溶解度减小;②当大气中有 足够的 (碱性)存在时,可增加SO2的氧化速度。
大气中SO2的转化分为:
阴天时,相对湿度高,颗粒物浓度大的条件下,SO2的转 化途径以催化氧化为主; 在睛天,相对湿度低,大气中同时含有氮氧化物和HC时, 尤其是颗粒物含量少时,SO2的转化途径则以光化学氧化 为主。SO2氧化后,立即与H2O反应生成H2SO4,如果大 气中存在NH3,则生成(NH4)2SO4,
返回
4. 防治酸雨的方法
提高能源利用率,减少污染气体的排放量 改变能源结构,加速发展无污染能源 “适应政策” 减少 SO2排放量 处理 SO2废气 ,方法如下:
A 氨-酸法: SO2 + NH3·2O == NH4HSO3 H SO2 + 2NH3·2O ==(NH4)2 SO3 + H2O H SO2 +(NH4)2 SO3+ H2O == NH4HSO3 生成的NH4HSO3和(NH4)2 SO3再用浓H2SO4分解,放出 的回收用于生产其他产品如硫酸等。 B 氨-亚硫酸氨法:此法吸收SO2后吸收液不用酸分解, 直接吸收母液加工成来亚硫酸铵。 C 氨-过氧化氢法:此法吸收SO2后直接生成硫酸铵。 D 钙基固硫法;在煤炭燃烧时加入CaO或CaCO3,使其 与硫离子或二氧化硫反应生成亚硫酸钙,并进一步被 氧化成硫酸钙。
返回
九、大气颗粒物
大气颗粒物处于气溶胶体系,即大气中均 匀地分散着各种固体或液体微粒,沉降速度 极小,常用粉尘、烟、煤烟、沉粒、轻雾、 浓雾、烟气等来描述。
1 大气颗粒物的分类 大气:各种固体或液体均匀地分散在空气中形成的一个 庞大的分散体系,也是气溶胶体系。 气溶胶体系中分散的各种粒子称为大气颗粒物。 有机物
我国70年代末期,北京,上海,南京,
重庆,贵阳等地均出现过,其中以西南
地区最为严重。
的含的工 SO2有 烟 厂 大尘排 量中放
工业上,大量使用含硫的化石燃料:如煤、石油等。
1.降水的pH背景值
未被污染的大气中,可溶于水并含 量较大的酸性气体是CO2, 如果只把CO2 作为影响天然水pH的因素,根据CO2(全
0 0 2 4 6 8
加入H+ (μmol/L )
图 北京、成都、重庆、贵阳城区总颗粒物缓冲曲线
1. 重庆的耗煤量只相当于北京的1/3,每年的SO2排放量 却为北京的2倍。 2. 重庆和贵阳的多山地形; 3. 颗粒物缓冲能力;
3.酸雨的危害
会使河水、湖泊等变酸,水生生物死亡
酸 雨
会使土壤酸化,造成森林死亡
所以大气中的SO2经过一系列的化学转化后,最终形成硫 酸或硫酸盐,以干、湿沉降方式降落到地球表面上。
2.硫酸烟雾型污染
由于煤燃烧而排放出来的SO2、颗粒物
以及由SO2氧化所形成的硫酸盐颗粒物所造成 的大气污染现象。
特点: 发生在冬季,气温低,湿度高,日光弱。 1952年12月伦敦烟雾
SO2转化为SO3的氧化反应主要靠
组成成分 大气颗粒物 状态
无机物
有生命 无生命 固态 液态
2. 大气颗粒物的来源
天然来源:地面扬尘、海浪溅出的浪沫、火山灰、森林 火灾、宇宙陨星尘埃、花粉、孢子 人为来源: 燃料燃烧煤烟、飞灰(Fly Ash)、气态污染物
生成机制:
一次颗粒物:直接由污染源排放的;
二次颗粒物:大气中的某些污染组分之间或这些组分与 大气成分之间发生反应而产生的颗粒物;
实验过程:
收 集 雨 水
测 量 雨 水 pH 值
通常测定酸雨含有如下几种离子:
+ + + H , Ca , NH4 , Na , K , SO42-, NO3-, Cl-, HCO3+ 2+
Mg
2+
我国酸雨中关键性离子组分是:SO42-, Ca2+, NH4+
2 影响酸雨形成的因素
(1) 酸性污染物的排放及转化条件; (2) 大气中的氨及其它碱性气体; 金属催化SO2氧化; 中和作用
4.空气质量日报
通过新闻媒介向全社会发布空气质量周报 是国务院环境保护委员会1997年1月做出的决定, 当时要求在全国46个环境保护重点城市发布空 气质量周报。 当年5月23日,南京市率先在当地新闻媒介 上发布空气质量周报,紧接着,上海、武汉、 沈阳……到1998年6月,46个城市全部推出了空 气质量周报。 这46个城市包括所有的直辖市、省会城市、 经济特区城市以及一部分重点旅游城市。
第二章 大气环境化学
第二节 大气污染物的转化
六、光化学烟雾
第二节 大气污染物的转化
七、硫氧化物的转化及硫酸烟雾型污染 八、酸性降水 九、大气颗粒物 十、温室气体和温室效应 十一、臭氧层的形成与损耗
七、硫氧化物的转化及硫酸烟雾型污染
含硫矿物燃料燃烧过程中直接排入
大气中的主要是二氧化硫,煤含硫 0.5-
球大气浓度为 330ml/m3)与纯水的平衡,
可以计算出降水的pH值。
KH=3.36X10-7
K1=4.45X10-7
K2=4.69X10-11
CO2水合平衡常数,即亨利定律常数 CO2(g) + H2O K1 KH H2CO3 二元酸H2CO3的一级电离常数 H2CO3 H + HCO3
-
KH
1SO
为单重态,不稳定,3SO2为三重 2
态是大气环境中重要的SO2物质形态,能 量较高的单重态分子跃迁到三重态或回 到基态:
1
SO2 M SO2 M
3
1
SO2 M SO2 M
原子轨道理论
原子是由原子核与核外电子组成,电子绕核作高速运 动,核外电子的轨道为1S、2S2P、3S3P、 4S3d4P……, 通常微观粒子处在能量最低的能级叫基态,原子较稳 定,基态的原子吸收了一定能量的光子,就会跃迁到较高 的能级上。 如果从2S跃迁到3S轨道,叫单重态。如果从2S仅跃 迁到2P(系间窜跃)或是从2S跃迁到3S又回到2P的,都叫 三重态,即从一个能级跃迁到另一能级的为单重态(从谱 线观察到的),而只在能级的系间窜跃的叫三重态,三重 态由于能量低,因此比较稳定,而单重态能量高,不稳定, 还会回迁到三重态或基态。
