大气环境化学总复习
环境化学复习资料(仅供参考_请注意核对)

环境工程化学复习第二章一、影响大气污染物迁移的因素1、风和大气湍流的影响;2、天气形势和地理地势的影响;(1)、海陆风;(2)、城郊风;(3)、山谷风、二、自由基也称游离基,是指由于共价键均裂而生成的带有未成对电子的碎片。
大气中常见的自由基如:HO·,HO2·,RO,RO2·,RC (O)O2三、与大气污染有直接关系的重要的光化学过程1、氧分子和氮分子的光解2、臭氧的光解3、NO2的光解4、亚硝酸和硝酸的光解5、二氧化硫对光的吸收6、甲醛的光解7、卤代烃的光解四、降水的化学组成无机物:土壤衍生物离子Al3+,Ca2+,Mg2+,Fe3+,Mn2+和硅酸盐等;海洋盐类离子Na+,Cl-,Br-,SO42-,HCO3-及少量K+,Mg2+,Ca2+,I-和PO43+;气体转化物SO42-,NO3-,NH4+,Cl-和H+;人为排放源As,Cd,Cr,Co,Cu,Pb,Mn,Mo,Ni,V,Zn,Ag,Sn和Hg等化合物。
五、酸雨的化学组成酸雨现象是大气化学过程和大气物理过程的综合效应。
酸雨中含有多种无机酸和有机酸,其中绝大部分是硫酸和硝酸,多数情况下以硫酸为主。
从污染源排放出来的SO2和NOx是形成酸雨的主要起始物,其形成过程为SO2+[O] →SO3SO3+H2O→H2SO4SO2+H2O→H2SO3H2SO3+[O] →H2SO4NO+[O] →NO22NO2+H2O→HNO3+HNO2式中:[O]——各种氧化剂六、影响酸雨形成的因素1、酸性污染物的排放及其转化条件2、大气中的NH33、颗粒物酸度及其缓冲能力4、天气形势的影响七、大气颗粒物的化学组成1、无机颗粒物(1)硫酸及硫酸盐颗粒物(2)硝酸及硝酸盐颗粒物2、有机颗粒物P126第四章农药的类型农药进入土壤的途径1)农药以颗粒剂形式施入土壤2)农药以种子处理剂进入土壤3)农药喷施被作物截获和散落到土壤4、农药在土壤环境中的扩散行为。
环境化学第二章大气环境化学复习知识点

第二章大气环境化学1、大气成分:按浓度分成三大类:(1)主要成分,浓度在1%以上量级,包括氮(N2),氧(O2)和氩(Ar);(2)微量成分(也称次要成分),浓度在1ppmv到1%之间,包括二氧化碳(CO2),水汽(H2O),甲烷(CH4),氦(He), 氖(Ne),氪(Kr)等;(3)痕量成分,浓度在1ppmv以下,主要有氢(H2),臭氧(O3),氙(Xe),一氧化二氮(N2O),氧化氮(NO),二氧化氮(NO2),氨气(NH3),二氧化硫(SO2),一氧化碳(CO)以及气溶胶等等。
此外,还有一些大气中本来没有的,纯属人为产生的污染成分,它们目前在大气中的浓度多为pptv的量级,如氟氯烃类化合物(常记为CFCs)等。
2、大气层的结构:对流层、平流层、中间层、热层、逸散层对流层特性:由于对流层大气的重要热源来自于地面长波辐射,因此离地面越近气温越高;离地面越远气温则越低。
在对流层中,高度每增加100m,气温降低0.6℃。
云雨的主要发生层,赤道厚两极薄。
平流层特征:在平流层内,大气温度上热下冷,空气难以发生垂直对流运动,只能随地球自转产生平流运动,平流层气体状态非常稳定。
在平流层内,进入的污染物因平流运动形成一薄层而遍布全球。
中间层特征:在中间层中,由于层内热源仅来自下部的平流层,因而气温随高度增加而降低,温度垂直分布特征与对流层相似;由于下热上冷,空气垂直运动强烈。
热层特征:在热层中,温度随高度增加迅速上升。
热层空气极稀薄,在太阳紫外线和宇宙射线辐射下,空气处于高度电离状态,该层也可以称为电离层。
逸散层:800km以上高空;空气稀薄,密度几乎与太空相同;空气分子受地球引力极小,所以气体及其微粒可以不断从该层逃逸出去。
3、逆温由于过程的不同,可分为近地面的逆温、自由大气逆温。
近地面的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温自由大气逆温:乱流逆温、下沉逆温、锋面逆温逆温的危害:在对流层中,由于低层空气受热不均,能够使气体发生垂直对流运动,致使对流层上下空气发生交换。
环境化学复习

第二章大气环境化学1、大气层的结构 Layers of the Atmosphere(英文)A、对流层troposphere对流层是大气的最底层,其厚度在赤道附近为16—18km;在中纬度地区为10—12km,两极附近为8—9km。
最显著特点是气温随海拔高度的增加而降低,大约每上升100m,温度降低0.6度。
另一个特点是密度大,大气总质量的3/4以上集中在对流层。
B、平流层stratosphere从对流层顶到海拔高度约为50km的大气层。
特点:①空气没有对流运动,平流运动占显著优势。
②空气比对流层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象③在高15—60km内,有约20km的一层臭氧层The Ozone Layer。
O2→O•+O•、O•+O2→O3、O3→O•+O2、O3+O•→2O2是臭氧光解的过程。
平流层温度随海拔高度的增加而增加。
C、中间层mesosphere从平流层顶到80km高度的大气层。
空气较稀薄,由于臭氧层消失,温度随海拔高度的增加而迅速降低。
D、热层(电离层)thermosphere从80km到约500km的大气层。
大气温度随海拔高度的增加而迅速增加。
2.大气中的主要污染物含硫化合物;含氮化合物;含碳化合物;含卤素化合物2、辐射逆温层Radiation inversion对流层大气的重要热源是来自地面的长波辐射,故离地面越近气温越高;离地面越远气温越低。
随高度升高气温的降低率称为大气垂直递减率:Γ=-dT/dz T—热力学温度K, z—高度当Γ=0 时,称为等温气层;当Γ<0 时,称为逆温气层。
这时气层稳定性强,对大气的垂直运动的发展起着阻碍作用。
根据逆温形成的过程不同,可分为两种:近地面层的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温;自由大气的逆温:乱流逆温、下沉逆温、锋面逆温气块在大气中的稳定度与大气垂直递减率(Γ)和干绝热垂直递减率(Γd)两者有关。
若Γ<Γd,表明大气是稳定的;若Γ>Γd,大气是不稳定;若Γ=Γd,大气处于平衡状态。
环境化学期末复习资料
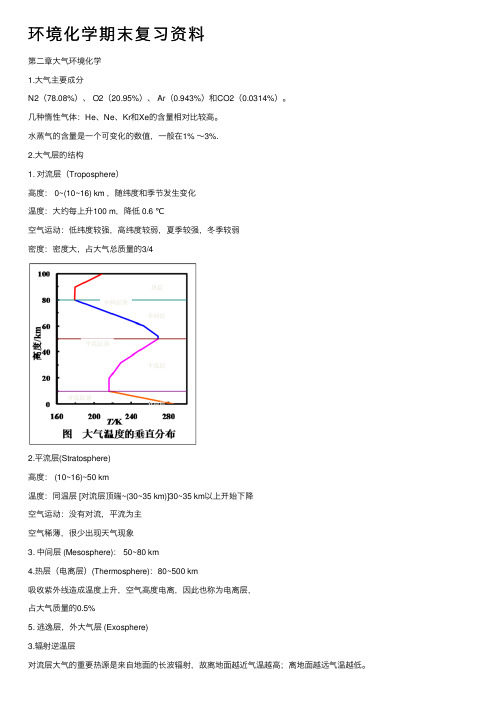
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。
环境化学期末复习重点

环境化学期末复习重点 Standardization of sany group #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#第二章1对流层:对流层是气的底层,其厚度在10~12km。
质量却占气总质量的3/4。
每升100m温度降低℃平流层:由对流层顶到50km左右高度称为平流层。
温随高度而升。
存在臭氧层中间层(过渡层):处于平流层顶至85 km左右的区域,温度随度升高而下降。
热层(电离层):中间层顶800km左右的区域。
温随高度而升。
逸散层:800km以上的高空2气污染物:是指由于人类活动或自然过程排大的并对人或环境产有害影响的那些物质。
颗粒物、二氧化硫、氮氧化物、碳氢化合物、一氧化碳。
3气稳定度:指气层的稳定程度,即气中某高度处的气块在垂直向上的相对稳定程度。
4影响气污染物迁移的因素:①风和大气湍流②天气形势和地理地势5气中污染物的转化:是污染物在气中经过化学反应,转化成无毒化合物,从而去除了污染或者转化成为毒性更大的二次污染物加重污染。
6光化学反应过程:分、原子、自由基或离吸收光子而发生的化学反应称为光化学反应。
7常见自由基:OH:主要源于臭氧光解O3+hv=O·+O2 O·+H2O=2·OH HNO2+hv=·OH+NO H2O2+hv=2·OHCH4+·O=CH3·+·OHO2:主要源于醛的光HCHO+hv =H·+HCO·H+O2+M=HO2· +M HCO·+O2=HO2 ·+CO CH3ONO+hv=CH3O·+NO CH3O·+O2=HO2 ·+HCOH H2O2+hv=2·OH ·OH+H2O2=HO2·+H2O ·OH+CO=CO2+·H ·H+O2=HO2 ·R. RO. RO2等:气中存在量最多的烷基自由基是甲基,主要来源于乙醛和丙酮的光解。
环境化学总复习题附答案但不完全

环境化学总复习题第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%;2、污染物的性质和环境化学行为取决于它们的化学性质和在环境中的迁移;3、环境中污染物的迁移主要有机械、物理化学和生物三种方式;4、人为污染源可分为工业、农业、交通运输和生活;二、选择题1、属于环境化学效应的是CA热岛效应 B温室效应 C土壤的盐碱化 D噪声2、五十年代日本出现的痛痛病是由A污染水体后引起的;A CdB HgC PbD As3、五十年代日本出现的水俣病是由B污染水体后引起的;A CdB HgC PbD As三、问答题1、环境中主要的化学污染物有哪些2、举例简述污染物在环境各圈的迁移转化过程;第二章大气环境化学一、填空1、写出下列物质的光离解反应方程式1NO2+ hν NO + O·2HNO2 + hν HO· + NO 或HNO2+ hν H· + NO23HNO3 + hν HO· + NO24H2CO + hν H· + HCO·或 H2CO + hν H2+ CO2、大气中的NO2可以转化为HNO3、N2O5和N2O3;3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者;4、乙烯在大气中与O3的的反应机理如下:O3 + CH2== CH2H2CO+H2COOCH2O3CH25、大气颗粒物的去除与颗粒物的粒度和_化学性质_有关,去除方式有干沉降和湿沉降 ;6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + Cl·Cl· + O3 O2+ ClO·ClO· +O O2+ Cl7、当今世界上最引人瞩目的几个环境问题_温室效应_、_臭氧层破坏_、_光化学烟雾_等是由大气污染所引起的;8、许多大气污染事件都与逆温现象有关,逆温可分为_辐射逆温_、_平流逆温_、_融雪逆温和地形逆温_;9、SO2的催化氧化速度与_催化剂_、_温度_和_浓度和PH离子强度_有关;10、大气中最重要的自由基为_HO·_;11、燃烧过程中NO的生成量主要与_燃烧温度_和_空燃比_有关;12、能引起温室效应的气体主要有_CO2_、_CH4_、_CO_、_氟氯烃_;13、CFC-11的分子式为_CFCl3_和_CF2ClBr_;14、大气的扩散能力主要受_风_和_湍流_的影响;15、按污染成因分,气溶胶可分为_一次气溶胶_和_二次气溶胶_;16、根据温度垂直分布可将大气圈分为对流层、平流层、_中间层_、热层和逃逸层;17、伦敦烟雾事件是由_SO2_和_颗粒物_引起的;18、大气中CH4主要来自_有机物的厌氧发酵_、_动物的呼吸作用_、_原油及天然气的泄漏_的排放;19、富集因子法可以推断气溶胶污染源,如EF地壳>10,则表示待查元素i________;20、降水中主要阴离子有_SO42-_、_NO3-_、_Cl-_、_HCO3-_;二、选择题1、由污染源排放到大气中的污染物在迁移过程中受到ABCD的影响; A风 B湍流 C天气形式 D地理地势2、大气中HO自由基的来源有ACD的光离解;A O3 B H2CO C H2O2D HNO23、烷烃与大气中的HO自由基发生氢原子摘除反应,生成B;A ROB R自由基C H2O D HO24、酸雨是指pHC的雨、雪或其它形式的降水;A <B <7.0C <D <5、辐射一定时间产生的A量可以衡量光化学烟雾的严重程度;A O3 B NO2C 碳氢化合物D SO26、大气逆温现象主要出现在D;A 寒冷的夜间B 多云的冬季C 寒冷而晴朗的冬天D 寒冷而晴朗的夜间7、大气中还原态气体如H2S主要被C氧化;A O2 B OH C O3D高价金属离子8、SO2的液相氧化有多种途径,其中B的效果最好;A O3氧化 B 催化氧化 C H2O2氧化 D 非催化氧化9、气溶胶中粒径Dm的颗粒,称为飘尘;A >10B <5C >15D <10三、问答题1、试述酸雨的主要成分、成因及危害,写出有关化学反应式;主要成分:酸雨中绝大部分是硫酸和硝酸,以硫酸为主成因:酸雨的形成涉及一系列复杂的物理、化学过程,包括污染物迁移过程、成云成雨过程以及在这些过程中发生的均相或非均相化学反应等;酸雨的危害:a.使水体酸化,造成江河湖泊的生态环境紊乱;b.使森林大片死亡;酸雨侵入树叶气孔,妨碍植物的呼吸;c.造成土壤矿物质元素流失,导致土壤贫瘠化,使农作物大面积减产;d.使土壤的有毒金属溶解出来,一方面影响植物生长,另一方面造成有毒金属迁移;e.腐蚀建筑物、文物等;2、写出光化学烟雾的链反应机制;3、为什么排放到大气中的CFCs能破坏臭氧层,写出有关化学反应式;3、试述大气中CO2等气体浓度上升,引起温室效应的原因;CO2起单向过滤器作用,可吸收地面辐射出的红外光,把能量截留于大气中,从而使大气温度升高,即温室效应;4、试比较伦敦烟雾和洛杉矶光化学烟雾的区别;第三章水环境化学一、填空1、天然水中的总碱度= HCO 3- +2 CO 3 2- + OH - — H +2、水环境中胶体颗粒物的吸附作用有 表面吸附 、 离子交换吸附 和 专属吸附3、有机污染物一般通过 挥发 、 吸附 、 水解 、光解和生物富集和降解等过程进行迁移转化;4、环境中某一重金属的毒性与其_游离金属浓度_、_配合作用_和_化学性质_有关;5、当水体pH 处于中性或碱性条件下,汞的甲基化产物是_CH 3Hg +_;6、_总氮_、_总磷_和_溶解氧_常衡量水体富营养化的指标;7、水体的自净作用可分为_物理自净_、_化学自净__和_生物自净_.8、碳水化合物生化水解的最终产物为_葡萄糖_,在氧气充足时,能进一步分解为_CO 2、水_;9、影响胶体微粒聚沉的因素有粒度、浓度、温度、水体pH 及流动状况,带相反电荷颗粒间的相互作用;10、适用于水体颗粒物对污染物吸附的等温式有_F 型_、__L 型_两种方程;其中_ L 型_可求饱和吸附量11、有机物的辛醇-水分配系数常用__Kow__表示;二、选择题1、海水中Hg 2+主要以___C____的形式存在;A HgOH 2, HgCl 2B HgCl 2, HgCl 3-C HgCl 42-D HgCl 3-, HgCl 42- 2、一般情况下,当水体DO___B___时,鱼类会死亡;A >LB < mg/LC >0D > mg/L3、当前最简单,也较流行的是将金属划分为溶解态和颗粒态,溶解态是能通过__C___um 孔径滤膜的部分; A B 0.22 C D4、河水中阴、阳离子的含量顺序为___B___;A Na +>Mg 2+>Ca 2+ HCO 3->SO 42->Cl -B Ca 2+>Na +>Mg 2+HCO 3->SO 42->Cl -C Na +>Ca 2+>Mg 2+ Cl ->HCO 3->SO 42-D Na +>Mg 2+>Ca 2+Cl ->SO 42->HCO 3-5、下列各种形态的汞化物,毒性最大的是___A___;A HgCH 32B HgOC HgD Hg 2Cl 26、影响水环境中颗粒物吸附作用的因素有 BCD ; A 溶解氧含量 B 颗粒物粒度 C 温度 D pH三、问答题1、重金属污染的特点是什么举例说明水体中金属迁移转化的影响因素; 毒性取决于游离或水合金属离子浓度,而非重金属总浓度;大部分稳定金属配合物及其与胶体颗粒结合态毒 性较低除脂溶性金属配合物外;进入水体后,迅速转入沉积物中;2、 某冶炼厂含铅废水经处理后排入河水中,测得排污口附近河水中铅的含量为~L,而在下游500米处河水中铅含量仅为3~4μg/L ,请解释其原因;3、 试述水体中有机污染物的迁移转化途径;一、分配作用吸附 :Lambert 研究了农药在土壤-水间的分配,认为当土壤有机质含量在%范围内其分配系数与沉积物中有机质的含量成正比;Karickhoff 研究了芳烃和氯代烃在水中沉积物中的吸着现象,发现当颗粒物大小一致时其分配系数与有机质的含量成正相关;即,沉积物对非离子有机物的吸附等温线为直线关系;二、挥发作用:许多有机物,特别是卤代脂肪烃和芳香烃,都具有挥发性,从水中挥发到大气中后,其对人体健康的影响加速,如CH 2Cl 2等; 挥发作用是指有机物质从溶解态转向气态的过程;挥发速率与有毒物的性质和水体特征有关;三、水解作用:1.水解作用是有机物与水之间最重要的反应;在反应中,化合物的官能团X -和水中的OH -发生交换:影响水解速率的因素在任一水溶液中,总有H2O 、H+和OH-,所以有机物的水解速率是其中性水解H2O 、酸催化水解H+和碱催化水解OH-的速率之和;四、光解作用:光解作用是真正意义上的有机物分解过程,因为它不可逆的改变了有机物的分子结构;污染物的光解速率依赖于许多化学和环境因素,其中主要取决于太阳光的辐射;光解过程一般可分为三类: a.直接光解 b.光敏化反应 c.光氧化反应五、生物降解作用:生物降解是引起有机污染物分解的最重要的环境过程之一;水环境中有机物的生物降解,依赖于微生物通过酶催化反应分解有机物;微生物降解的特点:微生物个体微小,比表面大,代谢速度快;微生物种类繁多,分布广泛,代谢类型多样;微生物的降解酶,微生物能合成各种降解酶,酶具有专一性,对环境中的污染物,可通过其灵活的代谢控制机制而降解转化之;微生物繁殖快,易变异,适应性强;4、 试述水体中汞甲基化的途径及影响因素,写出有关反应式;5、试解释用BOD 5、COD Cr 评价水环境质量时会掩盖有毒有害有机物污染的风险;第四章 土壤环境化学一、 填空1、土壤具有 缓和其酸碱度 发生激烈变化的能力,它可以保持土壤反应的相对稳定,称土壤的缓冲性能;2、土壤是由气、液、固三相组成的,其中固相可分为_土壤矿物质_、_土壤有机质_,两者占土壤总量的_91%-100%_;3、在旱地土壤中,镉的主要存在形式是_CdCO3_;3、重金属在土壤-植物系统中的迁移过程与重金属的_种类及其存在形态_及土壤的类型、_施肥_、_植物种类和生长发育期__有关;4、土壤对农药的吸附作用可分为_静电吸附_、_离子交换吸附_和_专属吸附_;5、土壤中有多种无机氨,其中NH4+和_NO3-_是植物摄取的主要形式;6、土壤中的大部分是有机氮,约占总氮的_90_%,有机氮能变成无机氮的过程叫做_矿化过程_;7、土壤中砷以三价或五价状态存在,其存在形态可分为可溶性砷、吸附、代换态砷及难溶态砷,可溶态砷主要为________和_______,一般占总砷的5~10%;8、土壤中铬是以__CdCO3______、__Cd3PO42______、___CdOH2_____、___Cd______四种形态存在;9、土壤中农药的残留量受到__土壤水分含量______、____土壤紧密度__、吸附及生物、化学降解等诸多因素的影响;10、土壤中存在着由土壤动物、_土壤微生物_和__细菌__组成的生物群体;11、土壤淹水条件下,镉的迁移能力_增强__;12、土壤及沉积物底泥对水中有机污染物的吸附作用adsorption包括_阳离子交换吸附作用、_阴离子交换吸附作用;13、农药在土壤中的迁移主要通过扩散和质体流动两个过程;二、选择题1、以下 ABCD 因素可以诱发重金属从沉积物中释放出来A 盐度升高B pH降低C 增加水中配合剂的含量D 改变氧化还原条件;2、土壤有机质的来源有 ABC ;A 树脂B 腐殖酸C 腐黑物D 矿物质3、腐植质胶体是非晶态的无定形物质,有巨大的比表面,其范围为___A_____;A 350-900m2/gB 650-800m2/gC 100-200m2/gD 15-30m2/g4、在土壤中,下列离子 C 的交换吸附能力最强;A Ca2+B Na+C Fe3+D H+三、问答题1、什么是土壤污染如何判别农药等污染物进入土壤后是怎样自净的2、进入土壤的农药是怎样迁移转化的3、举例说明影响土壤中农药残留量的因素;4、有机磷农药在环境中的主要转化途径;举例说明其原理;第五章生物体内污染物质的运动过程及毒性一、填空1、被动扩散是指脂溶性物质从高浓度侧向低浓度侧扩散通过有类脂层屏障的生物膜;2、酶促反应速率的影响因素有温度、 pH 和抑制剂 ;3、苯并a芘的致癌机理主要是形成芳基正碳离子,与DNA 碱基中的氮或氧结合,使之芳基化,导致DNA基因突变;4、生物富集是指生物通过非吞食方式,从周围环境蓄积某种元素或难降解的物质,使其在机体内的浓度超过周围环境中浓度的现象;5、碳原子数大于1的正烷烃,其微生物降解的途径有三种:通过烷基的末端氧化和次末端氧化、双端氧化 ;二、多项选择1、甲烷发酵是指有机酸、醇等化合物在细菌作用下,被转化为 ABCD ,进而经产甲烷菌作用产生甲烷;A 乙酸B 甲酸C 氢气D 二氧化碳2、下列烃类化合物中,最难被微生物降解的是 B ;A 环己烷B 苯C 己烷D 己烯3、下列芳香族化合物中,最难被微生物降解的是 B ;A 苯酚 B二氯甲苯 C 苯胺 D 苯甲酸4、LD表示的是 C ;50A 半数有效剂量B 半数有效浓度C 半数致死剂量D 半数致死浓度 5、两种毒物死亡率分别是M1和 M2, 其联合作用的死亡率M<M1+M2, 这种联合作用属于 D ;A 协同作用B 相加作用C 独立作用D 拮抗作用三、简答题1、试说明化学物质致突变、致癌和抑制酶活性的生化作用机理;第六章 典型污染物在环境各圈层中的转归与效应一、填空1、PAH 在紫外光照射下很容易 光解 和 氧化 ;也可以被微生物降解;2、气相汞的最后归趋是进入 土壤 和 海底沉积物 ;3、含氢卤代烃与 HO 自由基的反应是它们在对流层中消除的主要途径;5、由于有毒物质品种繁多,不可能对每一种污染物都制定控制标准,因而提出在众多污染物中筛选出潜在危险性大的 作为 优先研究和控制的对象 ,称之为优先污染物;6、Hg 的生物甲基化途径是:辅酶甲基钴氨素把 CH 3- 传递给Hg 2+CH 3Hg +,本身变为 水合钴氨素 ,后者再经还原失水变为五配位一价钴氨素,最后,辅酶 / 甲基四叶氢酸将 CH 3+ 转于五配位钴氨素,完成甲基钴氨素的再生,使Hg 的甲基化继续进行;二、多项选择1、下列砷化合物中,无毒性的是 CD ;A As 2O 3B CH 3AsOOH 2C CH 33AsO DCH 33As + CH 2COO - 2、下列多氯联苯中,最不易被生物降解的是D ;A 联苯B 四氯联苯C 三氯联苯D 六氯联苯3、表面活性剂含有很强的 B ,容易使不溶于水的物质分散于水体,而长期随水流迁移;A 疏水基团B 亲水基团C 吸附作用D 渗透作用三、问答题1、为什么Hg2+和CHHg+在人体内能长期滞留32、简述多氯联苯在环境中的主要分布、迁移与转化规律;3、表面活性剂对环境和人体健康的危害是什么。
环境化学复习资料

思考题:什么是环境化学?环境化学有哪些分支学科?大气环境化学:1、大气的主要层次是如何划分的,空气污染问题主要发生层是哪一层?臭氧主要集中在哪一层?2、大气中主要污染物有哪5类?含硫化合物含氮化合物含碳化合物含卤素化合物颗粒物3、硫燃烧产生二氧化硫的方程式?4、二氧化碳增加的危害?5、影响大气中污染物迁移的主要因素?风和大气湍流的影响天气形势和地理地势的影响6、什么是最大混合层高度?逆温较重时,最大混合层高度是增大还是减小?最大混合层高度的季节特征是什么?受热气块不断上升,直到其温度与周围温度相等,气块与周围大气达到中性平衡,气块停止上升。
这个高度就是最大混合高度减小冬季平均值最大混合层高度最小,夏初最大。
7、什么是光化学反应?分子,原子,自由基和离子吸收光子而发生的化学反应,分为初级和次级过程8、什么是自由基,自由基和离子有何区别?由于共价键均裂而生成带有未成对电子得碎片9、大气中重要自由基有哪些?HO·H02·R·烷基RO·烷氧基RO2·过氧烷基10、HO·在清洁大气和污染大气中的主要来源?清洁大气中O3的光解:O3+hv →O·+NO O·+H2O→2HO·11、大气中气态HNO3的主要来源是什么?12、什么是光化学烟雾,空气中有哪些污染物存在时易发生光化学烟雾?一般发生在什么时段?有何危害?13、什么是硫酸型烟雾污染?一般发生在哪个时段?光化学污染与硫酸型烟雾的主要区别?14、酸雨的概念?降水酸度主要来自那些物质?我国的酸雨主要是哪种类型?降水中对环境影响较大的离子有哪些?15、什么是大气颗粒物?什么是气溶胶粒子?水环境化学:1、简述天然水中的主要离子组成以及这些离子对天然水的酸度、碱度、硬度、矿化度的贡献?2、求氧在1.0130×105Pa、25℃,水中饱和溶解度?水在25℃时,蒸汽压0.03167×105Pa,干空气中氧含量为20.95%。
《环境化学》复习资料

《环境化学》复习资料1、过氧乙酰基硝酸酯(PAN)的生成1.乙醛光解产生乙酸基2.乙酰基与空气中O2结合形成过氧乙酰基.3.过氧乙酰基与No2化合生成PANps:PAN具有热不稳定性,遇热会分解而回到过氧乙.基和NO2,因而PAN的分解和合成之间存在着平衡.2、温室效应、气体概念大气中的co2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称为温室效应,能够引起温室效应的气体,称为温室气体.3、大气颗粒物消除方式并解释/(机制)①干沉降指颗粒物在重力作用下沉降或与其他物体碰撞后发生的沉降。
机制i通重力对颗粒物作用,使其降落在土、水等物体上 ii 粒径小于0.1um 靠布朗运动扩散相互碰撞成较大颗粒随大气湍流到地面去除。
②湿沉降.指通过阵雨,降雪等使颗粒物从大气中去除.机制 i 雨除:半径小于1um ii 冲刷:半径大于4um4、水中无机物的迁移转化方式:沉淀一溶解、氧化还原、配合作用、胶体形成、吸附一解吸.5、水环境中颗粒物的吸附作用.①表面吸附:胶体具有巨大的比表面和表面能..物理吸附②离子交换吸附:静电作用,胶体每吸附一部分阳离子,同时也放出等量其他阳离子,属于物理化学吸附,不受温度影响,可逆反应③专属吸附:除化学键外,尚有加强的憎水键、范德华力、氢键在起作用.在中性表面甚至在与吸附离子带相同电荷符号的表面也可吸~6、沉积物中重金属诱发适当的因素盐浓度升高。
氧化还原条件变化。
降低ph。
增加水中配合剂的含量7、腐殖质分为腐殖酸(不碱可酸)、富里酸(可可)、腐黑物(不不)8、光解过程分三类:直接光解、敏化光解、氧化反应敏化光解:水体中存在的天然物质腐殖质被阳光激发,又将其激发态的能量转移给化合物而导致的分解。
9、有机物在土壤中的吸着在在两种机理(只适用于非离子型农药)1.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用.而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度相关(因而放出热量小)2.吸附作用:即在非极性的有机溶剂中.即在非极性有机溶剂中,土壤、矿物质对有机物表面的吸附作用或干土壤矿物质对有机物…作用.10、生物降解作用→两种代谢模式区别①生长代谢:许多有毒物质可以像天然有机污染物作为微生物的生长基质:作为微生物唯碳源有滞后期②共代谢:某些有机污染物不能作为微生物的唯一碳源和能源,必须有另外的化合物存在提供微生物碳源和能源时,该有机物才能被降解.这是共代谢无滞后期11、重金属在土壤一植物体系中的迁移及其机制,从三大类(土壤、植物、重金属分析) 1.土壤理化性质:~PH越低,H+越多,活动性越强,加大了土壤中重金属向生物体迁移的数量.~土壤质地黏重,对重金属的吸附力强,降低了重金属的迁移转化能力~土壤中有机质含量高.对重金属吸附力强.降低了重金属转化能力.~还原条件下能力弱、氧化条件下能力强。
《环境化学》课程综合复习资料

《环境化学》课程综合复习资料一、填空题1. 由可见光(400nm<λ<780nm)引起光化学离解的物质键能是(c=3.0×108m/s,h=6.626×10-34J.s/光量子)。
2. 大气颗粒物有三种重要的表面性质:、和。
雨滴的形成就属于。
3. 水环境中的有机污染物一般通过、、、、生物富集和生物降解等过程进行迁移转化。
4. 根据土壤中H+离子的存在方式,土壤酸度可分为和潜在酸度,根据提取液的不同,潜在酸度分为和。
代换性是矿物质土壤潜在酸度的主要来源。
8. 由电介质促成的聚集称作,而由聚合物促成的聚集称作;根据DLVO理论把和考虑为仅有的作用因素。
12. 根据温度层结、密度层结和运动规律,可将大气划分为对流层、平流层、中间层和热层,其中随高度的增加气温升高的是和;随高度的增加气温降低的是和;臭氧主要分布在中;风、雨、雷电等天气现象发生在大气的中;内的空气处于高度电离状态,该层也称为电离层。
二、单项选择题1. 宣告一部分环境问题是由于贫穷造成的,并明确提出发展中国家要在发展中解决环境问题。
这是联合国组织第一次把环境问题与社会因素联系起来。
A.《里约环境与发展宣言》B.1987年发表的《我们的未来》C.《21世纪议程》D.1972年斯德哥尔摩人类环境会议2. 是无色气体,是低层大气中含量最高的含氮化合物。
A.NO2B. N2OC. NOD.NH33. 是大气中含量最高的碳氢化合物,约占碳氢化合物排放量的80%以上。
A.甲烷B.石油烃C.芳香烃D.萜类4. Fenton试剂的氧化机理是在酸性条件下,利用作为过氧化氢的催化剂,生成氢氧自由基。
A. Zn2+B. Cd2+C. Fe2+D. Fe3+5. 水体中常见的吸附等温线有三类,能给出饱和吸附量的等温线是。
A.F型B.L型C.H型D.W型6. 在我国的酸性降水中,含量最多的阴离子是。
A.SO42-B.NO3-C.Cl-D.HCO3-7. 天然水中常见主要离子总量作为水的总含盐量(TSD),而总含盐量不包括下列离子含量。
环境化学-复习重点总结

环境化学--重点总结逆温可分为近地面的逆温(辐射逆温、平流逆温、融雪逆温、地形逆温)、自由大气逆温(乱流逆温、下沉逆温、锋面逆温)H2S去除:HO·+H2S→H2O+·SH本底值(0.2~20)*10-9,停留时间1~4d。
CO2去除:1.土壤吸收:CO+1/2O2→CO2,CO+3H2→CH4+H2O。
2.与HO·自由基反应:CO+HO·→CO2+H·,H·+O2+M→HO2·+M,CO+HO2→CO2+HO·。
CH4去除:CH4+HO·→CH3·+H2O。
影响大气污染物迁移的因素:风和大气湍流的影响、由天气形势和地理地势造成的逆温现象以及污染物本身的特性。
自由基:(游离基)由于共价键均裂而生成的带有未成对电子的碎片。
常见自由基:HO·、HO2·、RO·、RO2·、RC(O)O2·。
光化学反应:分子、原子、自由基或离子吸收光子而发生的化学反应。
光化学烟雾:含有氮氧化物和碳氢化合物等一次污染物的大气,在阳光的照射下发生光化学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象。
(控制:控制反应活性高的有机物的排放、控制臭氧的浓度、控制汽车尾气的排放)光化学烟雾形成的简化机制:1.引发反应:NO2+hv→NO+O·、O·+O2+M→O3+M、NO+O3→NO2+O2。
2.自由基传递反应:RH+HO·→(O2)RO2+H2O、RCHO+HO·→(O2)RC(O)O2+H2O RCHO、RCHO+hv →(2O2)RO2·+HO2·+CO、HO2·+NO→NO2+HO·、RO2+NO→(O2)NO2+R’CHO+HO2·、RC(O)O2·+NO→(O2)NO2+RO2+CO2、3.终止反应:HO·+NO2→HNO3、RC(O)O2·+NO2→RC(O)O2NO2、RC(O)O2NO2→RC(O)O2·+NO2。
大气环境化学-总结

伦敦型烟雾和洛杉矶烟雾的比较
项目 伦敦型 颗粒物、SO2、硫酸雾等 煤 洛杉矶型 碳氢化合物、NOx、O3、 PAN、醛类 汽油、煤气、石油
概况
污染物 燃料
发生较早,至今已多次出现 发生较晚,发生光化学反应
季节
气温 湿度 日光 臭氧浓度 出现时间 毒性
冬
低(4℃以下) 高 弱 低 白天夜间连续
pH 4.3时,k H 2O2 1.3 103 pH 5.4时,k H 2O2 5.4 10 2 pH 6.6时,k H 2O2 27
24
3
2.5
二氧化硫的转化
2.二氧化硫的液相氧化
2-4 SO2被金属离子催化氧化
2SO2 2H 2O O2 2H 2 SO4
M
HC O O2 HO 2 CO
9
2.4 碳氢化合物的氧化与光化学烟雾
4.光化学烟雾 (photochemical smog)
汽车、工厂等污染源排入大气的碳氢化合物(HC)和 氮氧化物(NOx)等一次污染物在阳光中紫外线照射下发生
光化学反应生成一些氧化性很强的O3、醛类、PAN、HNO3
第一章 大气环境化学
了解大气层的结构,大气的运动规律,大气 中的主要污染物迁移。掌握污染物遵循这些规律 而发生的迁移过程,光化学反应基础,重要的大 气污染化学问题及其形成机制,特别重要的是污 染物参与光化学烟雾和硫酸型烟雾的形成过程和
机理。还应了解酸雨、温室效应以及臭氧层破坏
等全球性环境问题。
1
一、 大气中结构和性质
11
2.4 碳氢化合物的氧化与光化学烟雾
4.2 光化学烟雾的形成条件
大气中有氮氧化物和碳氢化合物存在;
环境化学期末复习题库

《环境化学》期末复习题库第一章绪论一、问答题1、环境中主要的化学污染物有哪些?2、当前人类生存面临的主要环境问题有哪些?3、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、问答题1、试述酸雨的主要成分、成因及危害,写出有关化学反应式。
并阐述重庆地区酸雨频率高,而北京酸雨频率低的原因。
2、写出光化学烟雾的链反应机制。
3、为什么排放到大气中的CFCs能破坏臭氧层,写出有关化学反应式。
4、说明臭氧层破坏的原因和机理。
5、试述大气中CO2等气体浓度上升,引起温室效应的原因。
6、试比较伦敦烟雾和洛杉矶光化学烟雾的区别。
7、简要叙述用富集因子法判断气溶胶粒子污染来源的基本原理、方法(步骤)。
8、影响污染物在大气中运动的主要因素有哪些?第三章水环境化学一、问答题3、水体污染物可分几类?4、试述水体中有机污染物的迁移转化途径。
5、试述水体中汞甲基化的途径及影响因素,写出有关反应式。
7、试解释用BOD5、COD Cr评价水环境质量时会掩盖有毒有害有机物污染的风险。
10、影响有机物光化学降解的因素有哪些?11、试述水的氧化还原限度及pE值。
二、计算1、若一个天然水体的pH为7.0。
碱度为1.4mmol/L,需加多少酸才能把水体的pH降低到6.0。
(碳酸平衡系数查看书本34页表2-6)7、与含21%O2的空气处于平衡的pH=7.00的水溶液,其pE值为多少?已知E = 20.75V8、书本P91页的第9题。
第四章土壤环境化学一、问答题1、有机磷农药在环境中的主要转化途径。
举例说明其原理。
2、进入土壤的农药是怎样迁移转化的?3、举例说明影响土壤中农药残留量的因素。
4、什么是土壤污染?如何判别?农药等污染物进入土壤后是怎样自净的?5、阐述As、Cd在土壤-植物体系中的迁移(存在形态、迁移、危害等)?6、什么是土壤的活性酸度与潜性酸度?试用它们二者的关系讨论我国南方土壤酸度偏高的原因。
第五章生物体内污染物质的运动过程及毒性一、简答题1、试说明化学物质致突变、致癌和抑制酶活性的生化作用机理。
环境化学复习2008422重点

《环境化学》复习之重点内容2008-4-22以*号及其多少表示其重要程度,而相对占考核分量较轻的内容略去。
第一章绪论⏹* 环境污染物的迁移和转化⏹污染物的迁移:污染物在环境中所发生的空间位移及其所引起的富集、分散和消失的过程。
三种方式:机械迁移、物理-化学迁移、生物迁移⏹污染物转化:指污染物在环境中通过物理、化学或生物的作用改变存在的形态或转变为另一种物质的过程。
转化方式多样,可通过物理、化学、生物等作用实现转化第二章大气环境化学* 大气圈结构的层次划分:按大气温度分布和运动情况[即大气的成层作用],根据大气温度随高度垂直变化的特征,将大气分为对流层、平流层、中间层、热成层(暖层)和逸散层五个层次。
⏹*对流层离地高度约10千米,它几乎集中大气质量的3/4, 对流层的温度随地面高度向上递减。
由于地表的热辐射构成下热上冷,造成对流层上下对流为主的大气。
相关:**温室气体(主要CO2、CH4和H2O(g))与温室效应⏹*平流层主要为大气平流运动,臭氧集中。
强烈的太阳紫外辐射几乎全被臭氧吸收,使平流层的温度开始随高度增加缓慢递增。
相关:**臭氧层耗竭(含Cl的氟代烃是原凶)⏹**大气污染大气污染的划分1. 根据大气污染物的来源,可划分为可划分为一次污染,二次污染两种类型。
2. 根据大气污染物的化学性质及大气环境状况,可划分为还原型和氧化型两种类型。
⏹* 大气污染物的种类根据大气污染物化学性质的不同,一般把大气污染物分为以下六类:①颗粒物(主要指粉尘、烟、雾等);②碳氧化物(主要指CO和CO2);③氮氧化物(主要指NO和NO2、N2O,用NO x表示);④硫氧化物(主要指SO2等,用SO x表示);⑤碳氢化合物(通常包括烷烃、烯烃、芳烃等有机物);⑥卤化物(主要指氟化氢、氯化氢、氟利昂等)。
⏹污染物的大气化学*光化学烟雾光化学烟雾是指各种生产设备(特别是汽车)排出废气中的碳氢化合物和氮氧化合物等一次污染物,在强烈光照(及合适的气象、地理环境)特定条件下,通过一系列复杂的光化学反应生成新的二次污染物,而形成的一种特殊烟雾现象。
环境化学复习资料第二章 大气环境化学 名词术语

第二章大气环境化学(重点)1.一次污染物(Primary pollutant)由污染源直接排入环境的、其物理和化学性状未发生变化的污染物,或称原发性污染物。
一次污染物是相对于二次污染物而言的。
二次污染物是由一次污染物转化而成。
有些污染物既可能是直接由污染源排出的一次污染物,又可能是在环境中转化而成的二次污染物,如大气中的三氧化硫,可能是由污染源直接排出的一次污染物,也可能是二氧化硫氧化生成的二次污染物。
环境污染主要是由一次污染物造成的,其来源清楚,可以采取措施加以控制。
2.二次污染物(Secondary pollutant)排入环境中的一次污染物在物理、化学因素或生物的作用下发生变化,或与环境中的其他物质发生反应所形成的物理、化学性状与一次污染物不同的新污染物,又称继发性污染物。
如一次污染物二氧化硫在环境中氧化成的硫酸盐气溶胶;汽车废气中的氧化氮、碳氢化合物等在日光的照射下发生光化学反应,生成的臭氧、过氧乙酰硝酸酯(PAN)、甲醛和酮类等;无机汞化合物通过微生物的作用转变成的甲基汞化合物;某些农药通过微生物或光解作用生成的降解产物等。
二次污染物对环境和人体的危害通常比一次污染物严重,例如甲基汞比汞或汞的无机化合物对人体健康的危害要大得多,光化学氧化剂对人体也有较大危害。
二次污染物的形成机制往往很复杂,在光化学烟雾和酸雨的形成的研究中,二次污染物形成机制的研究是一个重要的内容。
3.大气污染(空气污染Atmospheric pollution)大气中一次污染物或由它转化成的二次污染物的浓度达到了有害程度的现象。
自从人类用煤作燃料以后,大气污染的现象就存在了。
产业革命促进了工业的迅速发展,煤的消耗量急剧增多,工业区和城市的大气严重地受到了烟尘和二氧化硫的污染。
第二次世界大战以后,工业国家燃料消耗量继续增长,石油代替煤成为主要燃料,烟尘污染虽有所减轻,但二氧化硫的污染仍在继续发展。
1930年12 月比利时马斯河谷重工业区的烟雾事件,1948年10月美国多诺拉镇的烟雾事件,以及1952年12月的伦敦烟雾事件是大气污染的一些突出的典型事例。
《环境化学》(第二版)知识点总结和部分课后习题答案(共

《环境化学》(第二版)知识点总结和部分课后习题答案(共.doc《环境化学》(第二版)知识点总结和部分课后习题答案前言环境化学是一门研究化学物质在环境中的行为、分布、转化及其对生态系统和人类健康影响的科学。
本文档旨在总结《环境化学》(第二版)的核心知识点,并提供部分课后习题的答案,以帮助学生更好地理解和掌握课程内容。
第一部分:环境化学基础1.1 环境化学的定义和研究范畴环境化学的基本概念环境化学的研究领域1.2 环境污染物的分类有机污染物无机污染物放射性污染物1.3 环境化学的分析方法样品采集和处理污染物的检测技术第二部分:大气环境化学2.1 大气组成和结构大气层的划分大气成分及其作用2.2 大气污染现象雾霾酸雨温室效应2.3 大气污染物的化学行为气体扩散化学反应沉降过程第三部分:水环境化学3.1 水体的组成和特性淡水和海水的成分水体的物理化学性质3.2 水污染现象富营养化重金属污染有机污染物3.3 水处理技术物理处理化学处理生物处理第四部分:土壤环境化学4.1 土壤的组成和特性土壤的物理结构土壤的化学组成4.2 土壤污染现象土壤侵蚀土壤盐碱化土壤重金属污染4.3 土壤修复技术物理修复化学修复生物修复第五部分:固体废物处理与资源化5.1 固体废物的分类和管理城市垃圾工业固体废物危险废物5.2 固体废物的处理技术填埋焚烧回收利用5.3 资源化技术废物能源化材料化土地利用第六部分:环境化学案例分析6.1 典型环境化学事件工业污染事件农业污染事件生态破坏事件6.2 环境化学事件的影响分析对生态系统的影响对人类健康的影响6.3 环境化学事件的应对措施污染控制生态修复法律法规部分课后习题答案习题1:大气污染的化学原理习题概述答案解析习题2:水体富营养化的化学机制习题概述答案解析习题3:土壤污染的化学修复方法习题概述答案解析结语《环境化学》(第二版)为我们提供了一个全面了解环境化学的平台。
通过对知识点的总结和习题的解答,我们能够更深入地理解环境化学的原理和应用,为环境保护和可持续发展做出贡献。
大气环境化学概论

dT
dz
>0 =0:等温层 <0:逆温层
这时气层稳定性比较弱,有利于 污染物的迁移和扩散。
污染物的运动不受温度的影响
这时气层稳定性很强,对于大气 的垂直运动起着阻碍作用,不利 于污染物的迁移和扩散。
2.1 温度层结
第2节 大气中污染物的迁移
2.1.2 意义
研究大气温度层结可用于判断气块稳定情况、 气体垂直混合情况,并考察污染物扩散情况。
(23)高架连续点源地的面地轴面线最质大量质浓量度浓度
( xm,a0x ,
0,
H2) Q Q z euH2uyy
z
exp(
H2
2
2 z
)
2.3大气污染数学模式
2.3.2 有效源高的计算 有效源高H=烟囱高度h+烟羽抬升高度ΔH
经验关系式
H
vsd u
1.5
2.68105
p
Ts Ta Ts
d
H
▪大气污染物的概念 指由于人类活动或自然过程排入大气的并 对环境或人产生有害影响的那些物质。 ▪大气污染物的分类: 从形成过程:一次、二次污染物 从存在状态:气态和固体颗粒态的污染物
从化学组:含硫化合物、含氮化合物、 含碳化合物、含卤素化合物
第一节 大气的组成及其主要污染物
1.3大气中的主要污染物
少量的水汽和固体杂质。
第一节 大气的组成及其主要污染物
1.2 大气层的结构
对流层(troposphere) 平流层(stratosphere) 中间层(mesosphere) 热 层 (thermosphere ) 逸散层(escape layer)
第一节 大气的组成及其主要污染物
1.2 大气层的结构
大气环境化学_2023年学习资料

高度km-3000-散逸层-+-大气的分层-500-不-400-热成层-200-100-越往上氧、氦等气体 原子态越多-90-中问层项-80-电离层-紫外线的强烈照-70F-中间层-02-Ar-射,N,和O,产生02-60-不同程度的离解-平流层顶-Ne-He-Kr-H,-臭氧吸收-Xe-03-对流层顶-每升高100 -降低0.65℃-250-绝对温度K
第二章:大气环境化学鱼水人空-当前三大全球环境话题:气候变化、酸沉降、臭氧层损耗都发生在大气圈内-重点内容 -1污染物在大气中的迁移-气象基础:大气垂直分层、气象要素、气温绝热变化、大气稳定-度、大气混合层-O污染 迁移影响因素:混合层、地形、逆温、山谷风、海陆风等-O污染物迁移的数学模式:推导与应用-2污染物在大气中的 化-⑦光化学反应基础-O自由基反应和来源-⑦氮氧化物和碳氢化合物、硫氧化合物的转化-3几种代表性的大气环境 染问题-酸雨-0-温室效应
温度垂直递减率,干绝热递减率-0-高温暖气团倾向于从地表移动到低压的高处,-移动过程中,气团绝热膨胀并降温 如果气团中-没有水汽凝结,冷却速率为10℃/1000m,称为温-度的千绝热递减率ra)。-膨胀降温20℃而,一般气团中都含有水蒸气,气团上-升降温导致其中的水蒸气冷凝放潜热,抵消了气-团的膨胀降温,得到温度的垂 递减率r,冷-却速率为6.5℃/1000m。-压缩升温21℃-当污染源排放的污染刚进入大气环境的时-侯候, 视为一个绝热过程。
其中R=8.314丁.mo1-1.K-1,M气体摩尔质量(空气的摩尔体积为-22.41.m01-1,空气密 =1.29g.1-1,所以M=22.4*1.29=28.869gm01-1,所以R=R/M=287J.kg .K-1。-由1和2得到:-dp-pg-dz-R'T-dz=-8.1dz-R T-·∫六-Po-片-=>=-exn是7d-可见只要知道温度随高度的分函数形式,就可以推得气压随高度-的变化函数形式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大气环境化学(10学时)
(Atmosphere Environmental Chemistry)
1
本章重点
(1)大气中的主要污染物
(2)污染物在大气中迁移转化过程 (3)光化学烟雾和硫酸型烟雾的形成 过程和机理。
2
基本概念
1. 大气垂直分层、对流层大气组成及特点 2. 大气污染物的分类 3. 气溶胶(总悬浮颗粒物、飘尘、降尘、三模态、 化学组成、环境效应及危害) 4. 氟利昂类化合物及哈龙组成的确定、ODP、 PAN 5. 影响大气污染物迁移的因素(山风、谷风、海陆 风、城市热岛效应、气温垂直递减率、气团干绝 热减温率)、烟云抬升原因 6. 光化学第一定律、第二定律、量子效率、量子产 率 3 7. 自由基(大气中重要的自由基、来源)
基本概念
8. 光化学烟雾(污染物、特征、危害) 9. 硫酸烟雾(污染物、特征、危害) 10.酸雨及其危害 11.温室效应、温室气体 12.臭氧层损耗 13.气体污染物控制技术
4
基本原理和过程
1. 2. 3. 4. 5. 6. 7. 8. 9. 气溶胶粒子形成四阶段 卤代烃的光化学转化过程 汽车尾气污染大气中臭氧产生的光化学机制 臭氧耗损反应的三个基本途径(HO∙、NO、Cl∙构 成的催化循环) PAN的生成反应 根据ra 和 rd的正负及其相互关系判断大气稳定度 键能与断裂波长的计算 NO2的光解反应 卤代烃的光解反应及碳卤键断裂顺序
5
基本原理和过程
10.HO∙、 HO2∙ 、 R∙ 、RO∙ 、 RO2∙的来源 11.含NO、NO2的空气系统中发生的基本光化学反应 12. NO与O3及HO∙ 、CH3O∙ 、 CH3O2∙、 CH3COO2∙ 发生的氧化反应 13. 烷烃反应(四步) 14. 烯烃与羟基加成反应(四步)、与O3发生的加成 反应(两步) 15. 环烷烃、芳烃、含氧碳氢化合物的氢摘除反应 16. 光化学烟雾形成过程中的三类反应 17.酸雨的形成过程 6 18.南极臭氧空洞产生的四个机制
