山东省肿瘤医院
“质”的飞跃·_山东省肿瘤医院质子中心开启临床治疗

11月7日上午8点,位于济南国际医学中心(以下简称“医学中心”)的质子中心迎来首例临床病人,中国工程院院士、山东省肿瘤医院院长于金明把患者送进质子治疗舱。
随着质子设备的运转,作用于患者颈部肿瘤的布拉格峰精准释放。
这标志着山东省重大工程—— 质子中心正式进入临床治疗新阶段。
这意味着从2018年3月质子项目得到批复,到现在整整5年的建设,医学中心的“一号工程”“引爆项目”正式开启肿瘤治疗的“质子时代”,更多山东乃至全国肿瘤患者不用出国即可享受国际最尖端的放疗技术。
“当看到第一批3例患者顺利完成首次治疗,就好像看到孩子出生、自己当了爷爷一样,无比激动和幸福”,在于金明看来,这既是山东省肿瘤医院,也是医学中心,乃至全省、全国医疗界的一件喜事、好事。
质子梦圆,将给更多肿瘤患者带来生的希望。
A Massive Leap in Quality: The Proton Center of Shandong Cancer Hospital Starts Clinical Treatment文/黄真 图/刘悦琛(除署名外)“质”的飞跃·山东省肿瘤医院质子中心开启临床治疗精准爆破,肿瘤患者的福音作为放射治疗领域“新秀”,质子治疗被公认为是目前国际尖端的放射治疗技术,被誉为“放射治疗皇冠上的明珠”。
区别于传统化疗“杀敌一千、自损八百”的炸弹式疗法,质子则更像是“导弹”,能对肿瘤病灶进行精准“定点爆破清除”。
进入人体后,质子束初期运动速度快、能量沉积少,在射程末端,迅速形成一个陡峭的剂量高峰——布拉格峰,以“定向狙击”的方式来实现对肿瘤部位的精准打击,医生可以通过控制质子束的能量来调整布拉格峰在人体内停留的位置。
质子束在正常组织中沉积少、损伤小,因此治疗效果好、副反应小。
原则上来说,适合常规放疗的患者都可以在质子治疗中获益。
但是鉴于费用较高、资源有限,通常优先考虑预后更好、生存期更长的患者,如早期、局部晚期肿瘤患者。
山东省肿瘤医院2019年报名应聘登记表 .doc
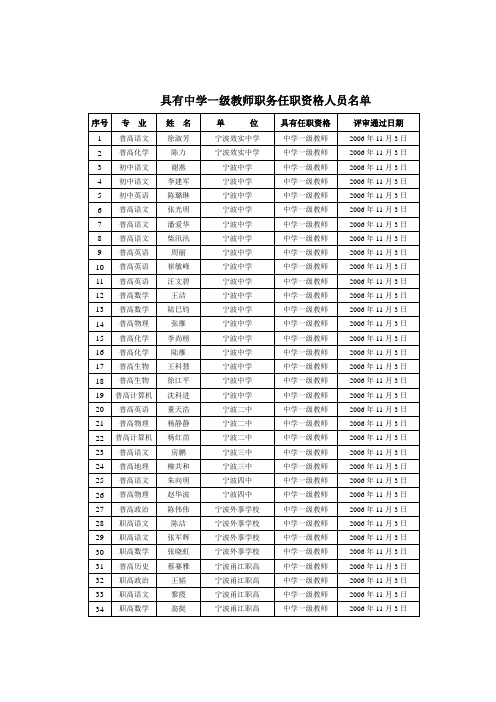
初中Байду номын сангаас文
朱燕虹
宁波三江中学
中学一级教师
2006年11月3日
131
初中数学
邬世凤
宁波三江中学
中学一级教师
2006年11月3日
132
初中社会
缪丽丽
宁波三江中学
中学一级教师
2006年11月3日
中学一级教师
2006年11月3日
77
初中政治
周彦俊
宁波翠柏中学
中学一级教师
2006年11月3日
78
初中语文
朱锦波
宁波翠柏中学
中学一级教师
2006年11月3日
79
初中语文
吕琰
宁波翠柏中学
中学一级教师
2006年11月3日
80
初中数学
陈萍
宁波翠柏中学
中学一级教师
2006年11月3日
81
初中数学
宋芳
宁波翠柏中学
111
初中音乐
杨晓芳
华茂外国语学校
中学一级教师
2006年11月3日
112
普高语文
范芝芝
华茂外国语学校
中学一级教师
2006年11月3日
113
普高英语
冯娜
华茂外国语学校
中学一级教师
2006年11月3日
114
普高物理
陈海燕
华茂外国语学校
中学一级教师
2006年11月3日
115
初中语文
孙雁
宁波东恩中学
中学一级教师
52
初中自然
朱五一
荣安实验中学
中学一级教师
2006年11月3日
53
常见肿瘤AJCC分期手册第八版(中文版)

常见肿瘤AJCC分期手册(第八版)目录(一)头颈部肿瘤鼻咽癌 (4)鼻腔和鼻窦肿瘤. (5)HPV 相关性(P16+) 口咽癌. (7)唇和口腔癌. (8)大涎腺肿瘤. (9)喉癌 (10)口咽(P16-)和喉咽癌 (12)头颈部的恶性黑色素瘤 (14)结膜癌 (15)结膜黑色素瘤 (16)泪腺癌 (17)葡萄膜黑色素瘤. (18)视网膜母细胞瘤. (20)眼睑癌 (21)眼眶肉瘤 (22)甲状腺肿瘤. (23)甲状腺髓样癌 (25)甲状旁腺癌. (26)(二)胸部肿瘤肺癌 (27)乳腺癌 (29)食管癌/食管与胃食管交界处肿瘤 (31)胸腺肿瘤 (34)恶性胸膜间皮瘤. (35)(三)腹部消化系统肿瘤肝癌 (36)肝内胆管细胞癌. (37)胆囊癌 (38)Vater 壶腹癌 (39)肝门胆管癌. (40)远端胆管癌. (41)胃癌 (42)胰腺癌 (44)结直肠癌. (45)阑尾肿瘤 (47)小肠癌 (49)肛门肿瘤 (50)(四)腹部泌尿系统肿瘤肾肿瘤 (51)肾盂和输尿管癌. (52)膀胱癌 (53)尿道癌 (54)(五)生殖系统肿瘤前列腺癌 (55)阴茎癌 (57)睾丸青春期后生殖细胞肿瘤及恶性性索间质肿瘤. (58)宫颈肿瘤 (60)卵巢、输卵管肿瘤和原发性腹膜癌 (62)子宫体肿瘤. (64)滋养叶细胞肿瘤. (65)阴道癌 (66)女性外阴癌. (67)(六)黑色素瘤、肉瘤及间质瘤皮肤恶性黑色素细胞瘤 (68)四肢和躯干软组织肉瘤 (70)乳腺肉瘤 (71)乳腺叶状肿瘤 (72)腹部和胸腔内脏器官软组织肉瘤 (73)腹膜后软组织肉瘤 (74)胆囊肉瘤 (75)肾肉瘤 (76)子宫体肉瘤. (77)胃肠道间质瘤. (79)(七)神经内分泌肿瘤结肠、直肠神经内分泌肿瘤 (80)空肠回肠神经内分泌肿瘤. (81)阑尾神经内分泌肿瘤. (82)肾上腺神经内分泌肿瘤 (83)十二指肠和Vater 壶腹神经内分泌肿瘤 (84)胃神经内分泌肿瘤 (85)胰腺神经内分泌肿瘤. (86)鼻咽癌骨肿瘤)适用于:鼻咽上皮性肿瘤。
“一体两翼”的现代医院扩建项目实践——山东省肿瘤医院放射肿瘤

57规划设计 |PLAN & DESIGNVolume 21 January 2020摘 要:针对山东省肿瘤医院放射肿瘤学科医疗及科研基地建设项目实例,从医院概况、背景研究、设计理念、总体规划、建筑设计、立面造型六个方面进行分析与阐述,旨为今后类似的放射类医疗及科研基地建设项目提供借鉴与参考。
关键词:医疗及科研基地;设计理念;建筑设计Abstract: Through the construction project of medical and scientific research bases of radiation oncology in Shandong Cancer Hospital, the article analyzes and elaborates from six aspects: hospital overview, background research, design concept, master plan, architectural design, and elevation design, provides reference for future radiological medical and scientific research base construction.Keywords:Medical and scientific research base; Design concept; Architectural design Doi:10.3969/j.issn.1671-9174.2020.01.004一、医院概况山东省肿瘤医院始建于1958年,是国内建院较早,集医疗、科研、教学和预防于一体并跨省区服务的省级肿瘤防治研究中心,是全国肿瘤医院中较早评审认定的“三级甲等医院”,是国家药品临床研究基地、山东省十大临床医学中心之一。
医院占地200000m 2,现有医疗区占地约131000m 2,办公和医疗用房97500m 2,医院目前编制床位1145张(图1)。
9-乳腺癌放疗计划-卢洁

乳腺癌适形调强放疗计划探讨山东省肿瘤医院卢洁乳腺癌术后放疗Ⅰ.保乳术后+放疗Ⅱ.根治术后+放疗Ⅰ保乳术后放射治疗计划⏹全乳+瘤床普通外照射⏹全乳+瘤床逐步加量调强计划⏹全乳+瘤床同步加量调强计划(SIB-IMRT)⏹全乳正向/逆向调强计划(IMRT-F/IMRT-I) ⏹部分乳腺计划(PBI)⏹旋转调强计划(RapidArc)靶区普通外照射射野图普通外照射剂量分布图普通外照射DVH图全乳+瘤床逐步加量调强计划(IMRT-F)⏹全乳的剂量:2Gy×25次,总量50Gy全乳做两个对穿切线大野,平均分配权重设计挡肺、挡高剂量区的子野调节大野及子野的权重比例⏹对瘤床采用电子线或X 线野进行加量照射瘤床的剂量:2Gy×7次全乳+瘤床逐步加量调强计划(IMRT-F)等中心位置⏹体中线标记和体侧标记连线的中点⏹射野等中心离肺边缘2cm–2.5cm对穿切线大野⏹以等中心为射野中心设计两个对穿切线野⏹两个大野平均分配权重子野的设计⏹设计挡肺、挡高剂量区的子野⏹调节对穿野和子野的权重,子野一般5-7MU瘤床加量电子线加量 X线切线野加量乳腺癌保留乳房术后瘤床同步X射线和电子线整合补量调强放疗剂量研究⏹选择10例保乳术后全乳+瘤床同步补量的患者,分别制定X线和电子线瘤床补量计划⏹电子线补量计划中受照剂量≥全乳处方剂量的患侧肺容积明显高于X线补量计划,有统计学意义(p=0.014)李建彬,马志芳,卢洁,等.中华放射医学与防护杂志,2006,26(5):479-482全乳+瘤床逐步加量调强计划(IMRT-F)DVH图全乳+瘤床同步加量调强计划(SIB-IMRT)⏹全乳做两个对穿切线大野,平均分配权重⏹设计挡肺、挡高剂量区的子野⏹调节大野及子野的权重比例⏹对瘤床加电子线或X 线野瘤床的剂量:2.15-2.2Gy×28次全乳的剂量:1.8Gy×28次,总量50.4Gy全乳+瘤床同步加量调强计划(SIB-IMRT)DVH图乳腺癌保乳术后正向与逆向调强放疗计划的比较6例左侧乳腺癌保乳术后放疗的患者⏹等中心、射野方向和射束能量⏹保证95%的靶区体积被处方剂量线包绕⏹靶区中不存在剂量线高于103%的剂量区域孙涛,卢洁,等.中华放射医学与防护杂志,2009,29(4):51-54全乳逆向调强计划(IMRT-I)⏹设计两个对穿切线野,两个切线野平均分配权重⏹限定30个子野,设定子野的面积≥9cm2,且每个子野的机器跳数>5MU,给予一定的优化条件⏹微调小子野的MLC形状,降低高剂量区,保证靶区中不存在剂量线高于103%的剂量区域剂量分布图DVH图乳腺癌保乳术后正向与逆向调强放疗计划的比较⏹靶区适形度和均匀性无统计学差异⏹逆向调强计划中左肺的V20、V30相比正向调强两种计划间无显著减少(p<0.05);心脏的V30统计学差异⏹逆向计划的机器跳数显著增加,有统计学意义部分乳腺计划(PBI)设四个非共面适形野,通过调整射野角度、床角以及射野权重,尽量减少乳腺内剂量热点及靶区外乳腺体积的照射范围。
常见肿瘤AJCC分期手册第八版(中文版)

常见肿瘤AJCC分期手册(第八版)目录(一)头颈部肿瘤鼻咽癌 (4)鼻腔和鼻窦肿瘤. (5)HPV 相关性(P16+) 口咽癌. (7)唇和口腔癌. (8)大涎腺肿瘤. (9)喉癌 (10)口咽(P16-)和喉咽癌 (12)头颈部的恶性黑色素瘤 (14)结膜癌 (15)结膜黑色素瘤 (16)泪腺癌 (17)葡萄膜黑色素瘤. (18)视网膜母细胞瘤. (20)眼睑癌 (21)眼眶肉瘤 (22)甲状腺肿瘤. (23)甲状腺髓样癌 (25)甲状旁腺癌. (26)(二)胸部肿瘤肺癌 (27)乳腺癌 (29)食管癌/食管与胃食管交界处肿瘤 (31)胸腺肿瘤 (34)恶性胸膜间皮瘤. (35)(三)腹部消化系统肿瘤肝癌 (36)肝内胆管细胞癌. (37)胆囊癌 (38)Vater 壶腹癌 (39)肝门胆管癌. (40)远端胆管癌. (41)胃癌 (42)胰腺癌 (44)结直肠癌. (45)阑尾肿瘤 (47)小肠癌 (49)肛门肿瘤 (50)(四)腹部泌尿系统肿瘤肾肿瘤 (51)肾盂和输尿管癌. (52)膀胱癌 (53)尿道癌 (54)(五)生殖系统肿瘤前列腺癌 (55)阴茎癌 (57)睾丸青春期后生殖细胞肿瘤及恶性性索间质肿瘤. (58)宫颈肿瘤 (60)卵巢、输卵管肿瘤和原发性腹膜癌 (62)子宫体肿瘤. (64)滋养叶细胞肿瘤. (65)阴道癌 (66)女性外阴癌. (67)(六)黑色素瘤、肉瘤及间质瘤皮肤恶性黑色素细胞瘤 (68)四肢和躯干软组织肉瘤 (70)乳腺肉瘤 (71)乳腺叶状肿瘤 (72)腹部和胸腔内脏器官软组织肉瘤 (73)腹膜后软组织肉瘤 (74)胆囊肉瘤 (75)肾肉瘤 (76)子宫体肉瘤. (77)胃肠道间质瘤. (79)(七)神经内分泌肿瘤结肠、直肠神经内分泌肿瘤 (80)空肠回肠神经内分泌肿瘤. (81)阑尾神经内分泌肿瘤. (82)肾上腺神经内分泌肿瘤 (83)十二指肠和Vater 壶腹神经内分泌肿瘤 (84)胃神经内分泌肿瘤 (85)胰腺神经内分泌肿瘤. (86)鼻咽癌适用于:鼻咽上皮性肿瘤。
中国抗肿瘤治疗相关恶心呕吐预防和治疗指南

中国抗肿瘤治疗相关恶心呕吐预防和治疗指南(2023版)恶心是以反胃和(或)急需呕吐为特征的状态。
呕吐是胃内容物经口吐出的一种反射动作。
根据临床上常用的不良事件通用术语标准5.0版标准,恶心分为1级(食欲下降,不伴进食习惯改变)、2级(经口摄食减少不伴有明显体重下降,脱水或营养不良)和3级(经口摄入能量和水分不足,需要鼻饲、全肠外营养或住院治疗)。
呕吐分为1级(不需要进行干预)、2级(门诊静脉补液,需要医学干预)、3级(需要鼻饲、全肠外营养或住院治疗)、4级(危及生命,需要紧急治疗)和5级(死亡)。
恶心、呕吐是抗肿瘤治疗的常见不良反应之一,70%以上的抗肿瘤患者会出现不同程度的恶心呕吐,严重的恶心呕吐可能导致患者发生脱水、电解质紊乱、营养缺乏等病症,影响患者抗肿瘤治疗的正常开展。
随着抗肿瘤治疗和抗肿瘤治疗相关恶心呕吐预防和治疗不断取得新的进展,制定适时、科学、规范、合理的抗肿瘤治疗相关恶心呕吐预防和治疗指南有利于保障抗肿瘤治疗的顺利进行。
因此,由中国抗癌协会癌症康复与姑息治疗专业委员会、中国抗癌协会肿瘤临床化疗专业委员会、中国抗癌协会肿瘤支持治疗专业委员会、中国临床肿瘤学会肿瘤支持与康复治疗专家委员会的专家遵循现有循证医学证据,参考国内外指南,结合中国临床诊疗实践,共同制定了《中国抗肿瘤治疗相关恶心呕吐预防和治疗指南(2023版)》,从抗肿瘤治疗相关恶心呕吐评估、处理、常用止吐药物及使用注意事项方面进行阐述,以期为中国抗肿瘤治疗相关恶心呕吐预防和治疗提供专业指导意见。
一、指南形成方法(略)二、抗肿瘤治疗相关恶心呕吐的评估(一)抗肿瘤治疗相关恶心呕吐的分类1.化疗相关性恶心呕吐:按照发生时间,通常将CINV 分为急性、延迟性、爆发性、难治性、预期性5种类型。
急性恶心呕吐:给予抗肿瘤药物(化疗药物)后24 h内发生的恶心及呕吐。
延迟性恶心呕吐:给予抗肿瘤药物(化疗药物)24 h之后发生的恶心及呕吐。
用药后48~72 h达到最强,可以持续6~7 d。
肿瘤诊疗质量控制中心关于开展2023年度结直肠癌诊疗质控指导评价的通知

肿瘤诊疗质量控制中心关于开展2023年度结直肠癌诊疗质控指导评价的通知各有关单位:为进一步规范全省结直肠癌诊疗,持续提升结直肠癌规范诊疗水平,结合2023年国家医疗质量安全改进目标“提高肿瘤治疗前TNM分期评估率”及肿瘤专业质量控制指标(2023年版)等完成情况,按照《**省医疗质量控制中心工作规范(试行)通知》(**卫医〔2021) 36号)等要求,经省医疗质量控制中心管理办公室第52次例会商定,**省肿瘤诊疗质量控制中心(以下简称“省质控中心”)决定开展2023年度结直肠癌诊疗质控指导评价工作。
现将有关事宜通知如下:一、指导评价单位全省开展结直肠癌诊疗工作的二级以上医疗机构(不含中医)。
二、指导评价时间(一)自查阶段2023 年3 月1—4 月20 日18: OO o(二)现场指导评价阶段2023年5月1日—2023年11月30日。
三、指导评价步骤(一)自查阶段L请医疗机构安排专人负责病历自查工作,选取2022 年1月1日—2022年12月31日主要诊断为结直肠恶性肿瘤(ICD编码为C18-C20)的出院病历。
自查病历为30份, 不足30人次时,自查病历数应为实际结直肠癌出院病历数。
具体要求如下:(1)手术治疗结直肠癌(ICD编码为C18-C20)病历20 份,其中,结肠癌(ICD编码为C18-C19)病历8份,直肠癌(ICD编码为C20)病历12份。
(2)应用靶向药物治疗结直肠癌(ICD编码为C18-C20)病历10份,其中,结肠癌(ICD编码为C18-C19)病历5 份,直肠癌(ICD编码为C20)病历5份。
2.医疗机构自查病历后,填写医疗机构病历自查表(附件1-3)。
3.医疗机构扫描二维码填写≪2023年**省结直肠癌诊疗摸底调查问卷》(附件4 ) o(二)现场指导评价阶段1.省质控中心将对自查表及问卷的填报情况进行整理、数据清洗、逻辑校验与统计分析。
根据统计结果遴选出有代表性的医疗机构开展现场指导评价,具体时间另行通知。
《国家级区域医疗中心设置标准》(肿瘤医院)

《国家级区域医疗中心设置标准》(肿瘤医院)LT目录1 基本情况 (1)2 运行绩效 (8)3 功能与任务 (9)4临床专科服务能力和技术标准 (11)4.1内科 (12)4.2头颈外科 (14)4.3胸外科 (17)4.4腹部外科 (19)4.5乳腺外科 (24)4.6泌尿外科 (25)4.7神经外科 (27)4.8骨科 (28)4.9妇科 (30)4.10放射治疗科 (31)4.11急诊科(或承担急诊功能的专科) (38)4.12麻醉科 (41)4.13 中医科 (43)5 医技科室服务能力 (44)5.1药剂科 (44)5.2检验科 (49)5.3病理科 (54)5.4内镜科 (58)5.5输血科 (60)5.6影像诊断科 (62)5.6核医学科 (68)6 医学教育 (70)7 科研能力 (72)8 质量与安全 (75)1 基本情况申报成为国家级区域医疗中心的医疗机构所处地理位置应交通便利,方便区域内人口就医,开展的诊疗科目必须齐全,有完善的医技科室与之配套,有满足医疗、教学和科研所需的医疗仪器设备,合理的人才梯队,较高的信息化管理水平,较强的医疗服务辐射力和影响力。
国家级区域医疗中心按以下六大区划分:华北地区:北京市、天津市、河北省、山西省、内蒙古自治区;东北地区:辽宁省、吉林省、黑龙江省、内蒙古自治区(蒙东);华东地区:上海市、江苏省、浙江省、安徽省、福建省、江西省、山东省;中南地区:河南省、湖北省、湖南省、广东省、广西壮族自治区、海南省;西南地区:重庆市、四川省、贵州省、云南省、西藏自治区;西北地区:陕西省、甘肃省、青海省、宁夏回族自治区、新疆维吾尔自治区;1.1地理位置地理优越,交通便利,3小时路面交通能够覆盖区域内人口≥ 70 %。
1.2床位规模⑴核定床位数必须≥ 1000 张;⑵内科、外科(指一级学科)占医院床位总数的百分比≥ 60 %;⑶重症加强治疗科(ICU)床位数占医院床位总数≥1 %;⑷急诊抢救床位占医院床位总数(含ICU)≥3%;⑸放射治疗科床位占医院总床位百分比≥10 %;⑹病床使用率≥90%。
肿瘤专科护理学习知识

肿瘤专科护理学习知识目录一、肿瘤基础知识和护理概述 (3)1.1 肿瘤的定义与分类 (4)1.2 肿瘤的病因与流行病学 (5)1.3 肿瘤的症状与体征 (5)1.4 肿瘤的诊断方法 (6)1.5 肿瘤的治疗原则 (7)二、肿瘤患者的护理需求 (8)2.1 心理护理 (9)2.2 营养支持 (10)2.3 休息与活动指导 (12)2.4 疼痛管理 (13)2.5 皮肤护理 (14)2.6 预防并发症的护理措施 (15)三、常见肿瘤的护理 (16)四、肿瘤治疗中的护理配合 (17)4.1 手术治疗护理 (18)4.2 化疗护理 (20)4.3 放疗护理 (21)4.4 靶向药物治疗护理 (22)4.5 免疫治疗护理 (24)五、肿瘤康复与护理 (25)5.1 康复目标与方法 (27)5.2 康复过程中的护理评估 (29)5.3 康复护理技术 (30)5.4 康复心理护理 (31)六、肿瘤护理中的专业技能 (32)6.1 护理文书书写 (33)6.2 护理沟通技巧 (34)6.3 护理科研能力 (35)6.4 护理教育能力 (36)七、肿瘤护理的最新进展 (38)7.1 国际肿瘤护理动态 (39)7.2 国内肿瘤护理新理念 (40)7.3 新技术在肿瘤护理中的应用 (41)八、肿瘤护理相关的法律法规与伦理 (43)8.1 医疗卫生法规与护理实践 (44)8.2 护理伦理在肿瘤护理中的应用 (45)8.3 患者知情同意与隐私保护 (46)九、肿瘤护理案例分析 (48)9.1 肿瘤患者护理案例介绍 (49)9.2 案例分析与讨论 (50)9.3 护理经验总结 (51)一、肿瘤基础知识和护理概述肿瘤学是医学研究的一个重要分支领域,涉及到对各类肿瘤的预防、诊断、治疗以及后续康复等多个环节。
肿瘤专科护理作为其中的重要组成部分,在肿瘤患者的治疗和康复过程中起着至关重要的作用。
本章节主要对肿瘤基础知识和护理概述进行介绍。
霍孝蓉《实用临床护理【三基】个案护理》

目录第一章急诊急救护理1.心跳呼吸骤停怠者的急救护理 (1)2. 创伤性休克患者的急救护理 (3)1 急性胸痛患者的急救护理……......................…............... '" 54. 急性腹痛患者的急救护理 (7)5. 有机磷农药中毒患者的急救护理............ (8)6. 百草枯中毒患者的急救护理 (10)7. AECOPD 患者的急救护理 (13)8. 急性脑卒中患者的急救护理 (15)9. 群体性创伤患者的急救护理 (17);第二章内科疾病护理第一节心血管内科 (19)1.冠心病患者的护理 (19)2. 心力衰竭患者的护理 (22)3. 心律失常患者的护理 (25)4. 先天性心脏病介入治疗患者的护理 (31)5. 重症心肌炎怠者的护理 (33)6. 扩张型心肌病患者的护理 (35)7. 心脏骤停患者的护理 (39)第二节呼吸科 (42)1.肺炎患者的护理............................................. (42)"2. 支气管哮喘患者的护理 (44)3. 支气管扩张患者的护理.............................. (46)4. 慢性支气管炎、慢性阻塞性肺气肿患者的护理 (48)5. 慢性肺源性心脏病患者的护理 (50)6. 呼吸衰竭患者的护理 (52)7. 原发性支气管肺癌患者的护理 (54)8. 自发性气胸患者的护理 (57)l 一一一一一一皇恩览愿提rn"是装"-气工;之室或黑一一一一~一2第三节消化科..................... 0.....0 0........ 0. (61)~1.消化性溃殇患者的护理 (61)2. 肝硬化患者的护理 (63)3. 消化道出血患者的护理 (66)4 急性膜腺炎患者的护理 (69)5. 溃荡性结肠炎患者的护理...............................................,. (72)6. 肝性脑病患者的护理...............................,,:..................Ir" (74)7. 原发性肝癌患者的护理 (76)第四节肾科 (79)1.急性肾炎患者的护理 (79)2. 慢性肾炎患者的护理 (80)3. 肾病综合征患者的护理 (82)\4. 尿路感染患者的护理 (85)5. 急性肾衰竭患者的护理 (87)6. 慢性肾衰竭患者的护理 (89)第五节内分泌科 (92)1.甲状腺功能减退症患者的护理 (92)2. 甲状腺功能亢进症患者的护理 (95)3 高尿酸血症与痛风患者的护理 (98)4. 骨质疏松症患者的护理 (101)5 库欣综合很患者的护理 (105)6. 糖尿病患者的护理 (107)糖尿病患者药物治疗与护理 (107)、住院患者低血糖的护理 (111)糖尿病阴症酸中毒患者的护理 (112)特殊情况的高血糖住院患者的护理 (115)娃娘糖尿病患者的护理 (117)第六节免疫科 (121)1.系统性红斑狼疮患者的护理 (121)2. 类风湿关节炎患者的护理 (123)3 肌炎/皮肌炎患者的护理 (125)第七节血液科 (127)L 贫血患者的观察与护理 (127)2. 出血性疾病患者的护理 (130):3. 急性粒细胞性白血病患者的护理 (133)且由jjl;4. 急性白血病合并弥散性血管内凝血(DIC) 患者的护理 (135)第八节神经内科 (140)1.脑出血患者的护理 (140)2. 脑梗死患者的护理 (142)3. 癫痛患者的护理 (144)4. 病毒性脑膜炎患者的护理 (146)5. 重症肌元力患者的护理 (148)6. 帕金森病患者的护理 (151)第三意外科疾病护理、第一节普通外科............................... .. (154)1.甲状腺疾病患者的护理 (154)2. 乳房疾病患者的护理... '.. (156)3. 腹外痛患者的护理 (160)4. 化服性腹膜炎患者的护理 (162)5. 腹部损伤患者的护理 (164)6. 胃癌患者的护理 (166)7. 急性阑尾炎患者的护理 (168)8. 肠梗阻患者的护理 (171)9. 大肠癌患者的护理.................. (173)10. 直肠胚管疾病患者的护理 (176)—1 1.原发性肝癌患者的护理...... ............... ....,. (178)12. 胆石症和胆道感染患者的护理 (181)13. 周围血管疾病患者的护理 (184)14. 膜腺肿瘤和壶腹部癌患者的护理 (186)第二节神经外科 (189)1. 颅内压增高患者的护理 (189)2. 急性脑痛患者的护理 (190)3. 脑积水患者的护理 (192)4. 颅脑损伤患者的护理 (194)5. 垂体瘤患者的护理 (196)6. 颅内动脉瘤患者的护理 (199)@第三节心胸外科 (201)1.胸部损伤肋骨骨折患者的护理 (201)2. 肺癌手术患者的护理 (203)3 一一-一一一一实用临床护穰:豆豆辈己τ工~1',案1tl!.3. 食管癌手术患者的护理 (205)4. 先天性心脏病手术患儿的护理 (208)5. 心脏疾病瓣膜置换术患者的护理 (210)6. 冠状动脉搭桥手术患者的护理 (213)7. 纵隔肿瘤(胸腺瘤)手术患者的护理...... (216)第四节泌尿外科 (218):1.肾损伤患者的护理...............................~....................,.. (218)2. 泌尿系结石患者的护理 (220)3. 肾肿瘤患者的护理 (222)4. 良性前列腺增生患者的护理 (224)5. 肾上腺疾病患者的护理 (227)6 膀肮癌患者的护理 (229)第五节骨科 (232)1.四肢骨折行石膏~定、牵引患者的护理 (232)2. 骨关节手术患者的护理 (235)3. 脊柱骨折和脊髓损伤患者的护理 (238)4. 颈椎病手术患者的护理 (241)-5. 下i腹椎疾病手术患者的护理 (244)6. 脊柱似j 凸疾病患者的护理 (247)7. 骨盆骨折患者的护理 (250)8. 关节脱位行牵引石膏托固定患者的护理 (253)9 骨关节感染疾病患者的护理 (256)10. 臂'肿瘤疾病患者的护理 (259)1 1.截肢手术患者的护理 (262)12. 手外伤患者的护理 (264)第四章妇产科疾病护理一一一一一-4第一节f字号↓ (268)%1.前景胎盘孕妇的护理 (268)2. 平产分娩后产妇的护理 (271)3 胎膜早破患者的护理 (273)4 先兆早产患者的护理 (276)5. 重度子痛前期患者的护理 (278)6. 娃振期糖尿病患者的护理 (281)7. 奴娇期肝内胆汁淤积症患者的护理 (284)……………M如鼠忌8. 产后出血患者的护理 (286)第二节妇科 (289)1.子宫脱垂患者的护理 (289)《2. 功能失调性子宫出血患者的护理......... (291)3. 宫颈癌患者的护理 (294)4. 卵巢肘s 瘤患者的护理 (296)5. 滋养细胞疾病患者的护理 (298)6. 异位娃振患者的护理 (301)第五章JL科疾病护理l 新生儿窒息复苏的护理 (304)2. 新生儿呼吸窘迫综合征的护理 (306)3. 新生儿败血症的护理 (309)4. 新生儿高胆红素血症的护理 (311)5. 营养性维生素D 缺乏性何俊病患儿的护理 (313)\6. 小儿腹泻的护理 (315)7. 支气管肺炎合并心衰患儿的护理 (317)8. 支气管略目指患儿的护理•...•.•••..••.••..•••.•.••••••.•••••••.••••••..••.• 3209. 先天性心脏病患儿的护理 (322)10 缺铁性贫血患儿的护理 (325)1 1.肾病综合征患儿的护理 (327)12. 糖尿病患儿的护理 (329)13. 化版性脑膜炎患儿的护理 (331)14. 过敏性紫瘫患儿的护理 (333)15. 手足口病患儿的护理 (335)16. 高热惊厥患儿的护理 (337);17 肠套叠患儿的护理 (339)18. 先天性巨结肠患儿的护理 (341)19. 先天性胆管扩张症患儿的护理 (344)20. 先天性心脏病患儿的护理 (346)2 1.发育性偷关节发育不良患儿的护理 (350)第六章重症监护1.心跳呼吸骤停患者的护理 (354)2. 创伤后感染性休克患者的护理 (359)5-一一一一实用临床护理"三基" 个案护理3. 急性重症膜腺炎患者的护理................ .. (364)^第七章肿瘤科疾病护理1.肿瘤患者常见症状的护理 (368)2. 肿瘤患者化学治疗的护理 (370)3. 化学治疗的静脉通路管理....... .......... . (372)4. 肿瘤患者放射治疗的护理 (373)5. 肿瘤患者生物治疗的护理 (375)第八章精神科疾病护理1.偏执型分裂症患者的护理... ,.. (378)2. 紧张型分裂症患者的护理 (382)3. 情感障碍(跺狂发作)患者的护理 (384)4. 情感障碍(抑郁发作〉患者的护理 (387),5. 酒依赖患者的护理 (390)6. 撩症患者的护理 (392)第九章传染科疾病护理1.病毒性肝炎患者的护理 (395)2. 流行性腮腺炎患者的护理 (397)3. 麻~患者的护理............... (399)4 艾滋病患者的护理 (401)5 百日i疾患者的护理 (403)6. 症疾患者的护理.......................................... (404)参考文献 (407)后记 (410)>…一一一一-6叫叫叫叩氮二:黑叩急援急翠堂里第一辈急诊急救护理一、心跳呼吸骤停患者的急救护理[知识要点}1.熟悉心撑骤停的11缸床表现。
山东省肿瘤医院专家名片

郭洪亮
山东 省肿瘤 医院 ( 济兖 路4 4 0 号 )周二 全天
石 掌 涛
山 东 省 肿 瘤 医 院 外 科 主 任 兼 外 科 七 病 区 主 任 ,主 任 医
师 ,硕 士 生 导 师 。
肝癌 、胰腺 癌 、胆 管癌 及胆囊 癌的诊 断与 治疗工 作 。熟 练掌握肝 右三 叶 、肝 左三 叶 、肝 中叶 、右 半肝切 除术 及胰 十二指 肠切 除术 、全
石学涛
肝癌专 业委 员会 委员 ,山东省 医师协 会普外分会 委员等 。
山东省 肿瘤 医院 ( 济 兖路4 4 0 号 )周一上午
胰切 除术 、高位 胆 管癌根 治术 等较复 杂手术 。每 年完 成肝肿 瘤切 除术
2 0 0 余 例 、胰 十二 指肠 切 除术 5 0 余 例 、胆管 肿瘤 切 除手 术 3 O 余例 。 兼任 山东省 肝胆 胰肿 瘤 防治 中心副主 任 ,山东省 抗癌协 会肝 胆肿瘤分 会候任 主任 委 员 ,山东省 普外 科学会 胰腺学 组副 组长 ,中 国抗 癌协 会
9 8 2 2 8 A
2 01 6
. ・
。
0医 院 外 科 四 病 区 主 任 , 主 任 医 师 。硕 士 生
导师。
胃 、结 直 肠 肿 瘤 的诊 断 和 治 疗 。从 事 胃肠 肿 瘤 外 科 工 作 2 0余 年 ,致力 于消 化道 肿瘤 的规范 化手术 及综 合治疗 ,擅 长各种 胃、结直 肠肿 瘤的 根治术 ,低 位直 肠癌 保留盆 神经 及保 留肛 门手术 ;对复杂 的 腹腔 肿瘤 及 胃肠 道 间质瘤 等具 有丰 富治疗 经验 。兼任 全国 大肠癌专 业 委 员会委 员 ,山东 省抗癌 协 会胃肠 外科分 会副主 任 委员 ,山东省 医师 协 会大肠 癌专 业委 员会 副主任 委员 、胃癌 专业 委员会 常委 ,山东省 医 学 会 胃肠 专业组 委员等 。获得 国家 、省科技进 步奖 多项 。
肿瘤科发展与展望 ppt课件

30年来,他始终秉承着“厚德,厚爱,仁心,仁
术”的高尚医德,用一颗仁爱之心与精湛的技术,
呵护着每位患者,为患年中国创业新锐诚信
王在峰教授
先锋”“单县十大优秀医生”以及“优秀教学能 手”等荣誉称号。
王雷
山医集团正大医院肿瘤内科主任 菏泽市抗癌协会第一届化疗专业委员会委员。 从事肿瘤内科20余年,擅长于消化道肿瘤、呼
吸道肿瘤、乳腺癌、前列腺癌综合化、规范化 治,对微创介入治疗有丰富的临床经验。 于2004年在单县中心医院学习胃肠镜操作及消 化道疾病诊治,曾多次与省内外知名专家交流 与学习。 2011年度被评为卫生系统先进个人. 2016年度被评为先进工作者。 视病人如亲人,得到同行专业及患者的好评。
对已出现远处转移的患者,若转移为单发孤立的 病灶,在行全身治疗的同时,有计划地行转移癌 与原发癌的切除,同样有望取得较好的疗效。
张绪春 (周五)
孙存昌 (周四)
单县中心医院肿瘤科 主任医师 成武县人民医院肿瘤科 主任医师
单县东大医院 单县中心医院 菏泽市立医院 济南千佛山医院 济南军区总医院 山东省肿瘤医院
技术骨干外出进修学习 请专家来我院坐诊、授课、手术等 通过通讯设备远程会诊、咨询、学习
肿瘤(tumor)是人体正常细胞在不同的始动与促进因素长 期作用下,发生过度增生和异常分化所形成的新生物。 也就是人体某部位的细胞在致癌因素作 用下,使一个或几个细胞的基因受到损伤产生突变,然 后这些细胞不按人体需要不受人体控制地活跃地无限制 地增生,这些无限增生的细胞常常在一起形成肿块,这 就是肿瘤。
肿瘤科简介
科室重点开展肿瘤的微创及无创技术, 主要有:微创介入、微波消融、高频热 疗、高强度超声聚焦治疗系统(海扶 刀)、靶向治疗、无痛苦化疗、中医中 药治疗等多种治疗技术;同时,采用国 际疼痛四阶梯治疗方法,建立“疼痛示 范病房”,提高晚期肿瘤患者生活质量, 真正达到无痛生活,深受广大患者及家 属的认可和信赖。
山东省肿瘤医院放疗病房楼及放疗中心等科室保洁方案(48页)

供应商:××集团山东物业管理有限责任公司(盖章) 日 期: 2008年 1 月 17 日
二、谈判响应文件签署授权委托书
本授权委托书声明:我000 系××集团山东物业管理有 限责任公司的法定代表人,现授权委托××集团山东物业管理有 限责任公司的 000 为我公司签署本项目的谈判响应文件的法 定代表人授权委托代理人,我承认代理人全权代表我所签署的 本项目的谈判响应文件的内容。
规格型号 单位 单价
90
把 40
90
个 15
60
把 28
60
个 14
套 35
个 12
个8
个 1.5
副3
个 39
个 15
把5
个 20
个 12
条2
个6
双 20
个 1.5
4分
米3
个3
个 0.5
个 35
年用量 60 72 36 180 80 300 50 60 360 20 60 180 30 60 2000 60 35 60 150 35 500 5
数量
6
4 1 1 2 6 4 4
1 1 1 3 2
单价 折旧年限 合计
700 350 3
900 3
1,200
1500 3
500
2800 3
933
1000 3
667
180 1
1,080
350 1
1,400
200 1
800
640 1280 2
6000 5
1,200
1000 3
333
300 3
300
600 3
序号
1.
2. 3. 4. 5.
肿瘤标记物在非手术治疗肺癌患者病理类型预测中的应用

肿瘤标记物在非手术治疗肺癌患者病理类型预测中的应用宋丽华;宋现让;冯斌;孙雅红;王秀荣;贾慧
【期刊名称】《山东医药》
【年(卷),期】2005(45)4
【摘要】非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)化疗方案有较大差异,根据病理类型选择合理的化疗方案是延长患者生存期的前提。
1997-1999年,我们利用肿瘤标记物预测内科治疗肺癌患者的病理类型,取得良好效果。
现报告如下。
【总页数】2页(P29-30)
【作者】宋丽华;宋现让;冯斌;孙雅红;王秀荣;贾慧
【作者单位】山东省肿瘤医院,山东,济南,250117;山东省肿瘤医院,山东,济
南,250117;山东省肿瘤医院,山东,济南,250117;山东省肿瘤医院,山东,济南,250117;山东省肿瘤医院,山东,济南,250117;山东省肿瘤医院,山东,济南,250117
【正文语种】中文
【中图分类】R734.2
【相关文献】
1.18F-FDG PET/CT的SUV值与肺癌患者的临床特征、病理类型及肿瘤标记物的关系研究 [J], 李艳;马红霞;王瑞峰;张少娟;张卫善;段小艺;郭佑民
2.不同病理分型肺癌患者外周血肿瘤标记物浓度变化比较 [J], 宋曙光;程岩
3.肿瘤标记物的分类、筛选及其在肿瘤病理诊断中的应用 [J], 吴人亮
4.PD-1/PD-L1免疫检查点抑制剂抗肿瘤疗效预测中肿瘤相关生物标记物和HPD
预测因子的应用 [J], 李阳;默峰;王涛;周晔;邓新娜;李庆霞
5.肿瘤标记物在肿瘤病理诊断中的应用 [J], 戚沛霖
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
山东省肿瘤医院
药物临床试验机构立项资料目录:器械
1.临床试验审批表(器械)
2.委托公函(申办方委托机构研究者、委托CRO、委托第三方检测等)
3.国家食品药品监督管理部门/医疗器械监督管理部门批准的检测报告
4.如有组长单位,提供组长单位伦理批件
5.申办者资质
6.产品自测报告
7.研究者手册//医疗器械临床试验须知
8.研究者简历(提供本医院研究者4到5人的简历,并注明是否经过GCP培训,是
否有证书)及方案摘要
9.临床试验方案/修正版(要求首页上有山东省肿瘤医院主要研究者的签字)
10.知情同意书//豁免知情同意申请
11.病历报告表(样表)//病例数据采集表
12.医疗器械说明书
13.提供医疗器械样品及其他资料
14.如果样本在外地检测的要提供检测实验室的名称和资质证明;如果样本要运到国
外的要提供卫生部允许其运到国外的证明文件
15.为受试者购买的保险资料
16.招募广告
(以上资料均需加盖申办者的红章;方案首页上要求有山东省肿瘤医院主要研究者的签字)
17.为项目整理资料需要,请自行准备A4打印纸一包,粉色、绿色隔页纸各100张,自粘性标贴(规格24*27mm)1包。
注意:
1.以上资料必须在每项首页上加盖申办者的红章(研究者简历及证书除外),资料只需提供1套。
外企提供资料时需提供中英文版本。
特别提示:凡是提交中英文资料的均以中文资料为准,请务必找专业人士认真反复翻译,语序和句子要符合GCP要求,医学关键词要符合医学辞典。
建议不要找翻译公司。
2.临床试验审批表需相关人员签字,请监查员提前联系机构获取审批表电子版;
3.相关资料的电子版请监查员发往:ywb234@;
4.该立项资料需CRA本人提交机构,不接受邮寄、代交等其他方式;
5.为规范项目管理,各项目申请需第一时间联系机构,由机构协调项目负责人,不允许私自联系项目负责人。
