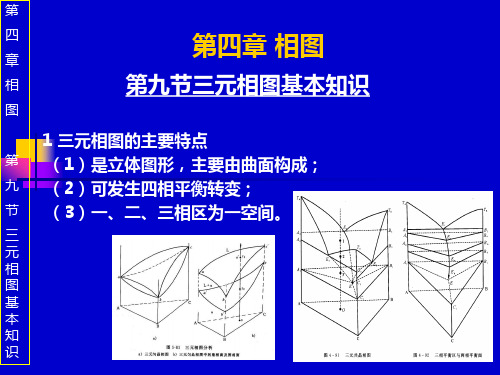
第四章 相图
合集下载
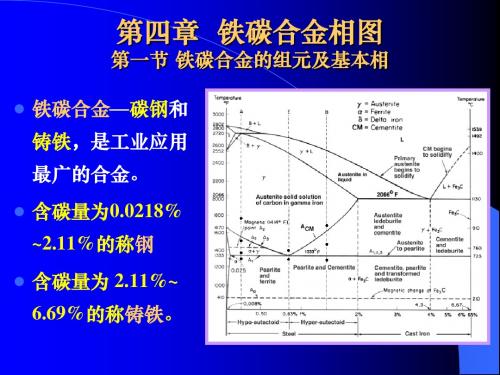
第四章铁碳相图

解度曲线 K GS: 先共析α 6.69 相析出线
0.0008Q
Fe
C%
Fe3C
L+δ
J点―包晶点
A 1495℃
δ
B
L
HN J
L+γ
L +Fe3C D
1495℃ 0.17% C
T
γ
2.1 1E
4.3 C
1148℃ F
C点―共晶点
G α+γ 0.77 PS
α 0.0218
γ +Fe3C
A1 727 ℃
2 可锻性:低碳钢塑性好,可锻性 好。随含碳量增加,可锻性变差。
3 铸造性: 共晶成分的铸铁流动性好,缩孔
集中,偏析小,铸造性好; 液相线和固相线距离越大,流动
性差,分散缩孔多,偏析大,铸造性 越差。所以,钢的铸造性差。
§2 碳钢 一 杂质元素对钢性能的影响
少量的锰、硅、硫、磷及微量的氧、氢、 氮等元素,它们会影响到钢的质量和性能。 (一)锰的影响
0.0218
Q
Fe
铁碳相图
L+γ
2.11 E
L L +Fe3C D
4.3 1148℃ F C
727γ℃SA1时γ 发+7F生(2eα73℃P共C+析F转e3C变6).6:=9KP
α+常Fe温3C下的组织构成:
P
C%
Fe3C
不同放大倍数 下P的显微组织
亚共析钢(0.4%C) L→δ L+δ→γ
L+δ
(四)磷的影响 —— 有害杂质元素, —— 矿石和生铁等炼钢原料带入。
磷在钢中固溶强化作用很强,但同时剧 烈地降低钢的韧性,尤其是低温韧性,使韧 脆转变温度升高,称为“冷脆”。
第四章 二元相图

铁碳相图和铁碳合金
铁-石墨相图:Fe-C; 铁-渗碳体相图:Fe-Fe3C。
1 铁碳合金中的组元和相 L, δ, A(γ), F(α), Fe3C(渗碳体)
46
2 Fe-Fe3C相图分析
点:16个。 线:两条磁性转变线;三条等温转变线; 其余三条线: GS,ES,PQ。
区:5个单相区,7个两相区,3个三相区。
5
4.1.4 二元相图的几何规律 (1)相区接触法则:两个单相区之间必定有一个由这两个相 组成的两相区,而不能以一条线接界。两个两相区必须以单 相区或三相水平线隔开。由此可以看出二元相图中相邻相区 的相数差一个(点接触除外)。 (2)在二元相图中,若是三相平衡,则三相区必为一水平 线.这条水平线与三个单相区的接触点确定了三个平衡相及 相浓度。每条水平线必与三个两相区相邻。 (3)如果两个恒温转变中有两个相同的相,则这两条水平 线之间一定是由这两个相组成的两相区。
39
2、 组元间形成化合物的相图 稳定化合物:具有一定熔点,在熔点以下不分 解的化合物。 3、具有异晶转变的相图 一个固相转变为另一个固相的转变称为异晶转 变也称同素异构转变。 4、具有固溶体形成中间相转变的相图 5、具有有序---无序转变的相图 6、具有磁性转变的相图
40
38
4.3二元相图的分析和使用 4.3.1 其他类型的二元相图 1、 其他类型的恒温转变相图 (1)熔晶转变相图 定义:一个固相在恒温下转变成一个液相和另一个固相的转 变。 (2)偏晶转变相图 定义:一个液相在恒温下分解为一个固相和另一个液相的转 变。 (3)共析转变相图 定义:一定成分的固相在恒温下生成另外两个一定成分的固 相的转变。 (4)包析转变相图 定义:两个一定成分的固相,在恒温下,转变为一个新的固 相的转变。
陶瓷物化第四章陶瓷相图详解.ppt

F=C-P+2 凝聚态系统的相律:不含气相或气相可忽略的系统称为凝聚态系统。压
力基本不影响凝聚态系统的平衡状态,n=1。 相律: F=C-P+1
第二节 单元系统
单元系统只有一个组分,即独立组分C=1。 根据相律: F = C-P + 2 =1-P+2 F=3-P
Pmax= 3-0 = 3,单元系统中平衡共存的最多相。三相共存点为无 变量点,系统为无变量状态。系统相数最少为1,单元系统最大自由 度为2。温度和压力是单元相图中两个独立变量,用温度和压力的二 维图表示单元系统的相平衡与二者的关系。
p=3 f=0
E(液相消失)[O , A+C]
1
b
T
M
a
L
L+A E A+C
P D
L+C
L+B
J
F
B+C
L C
B
A
C
B
• 同理可分析组成1的冷却过程。在转熔点P处,
L+BC时,L先消失,固相组 成点为D和F,其含量 由D、J、 F三点相对位置求出。P点是回吸点又是析晶终点。
4 低共熔点温度以下有化合物生成与分解的二元相图
α-石英 870α℃-鳞石英 1470℃α-方石英
573℃
163℃
180~270℃
β-石英
β-鳞石英 117℃
β-方石英
γ-鳞石英
二、 相律:
平衡体系中,自由度F、组分C和相数p的规律。
Gibbs提出,系统平衡时:
F C-P+n F : 自由度数,温度、压力、组分浓度等可能影响系统平衡
状态的变量,在一定数量内任意变化而不引起旧相消失 或新相产生的独立变量的数目。 C:独立组分数,构成平衡物系所有各相所需最少组分数。 P :相数。 n :影响系统平衡的外界因素,如温度、压力、电场等。 通常,外界因素主要是温度和压力,一般相律表示为:
力基本不影响凝聚态系统的平衡状态,n=1。 相律: F=C-P+1
第二节 单元系统
单元系统只有一个组分,即独立组分C=1。 根据相律: F = C-P + 2 =1-P+2 F=3-P
Pmax= 3-0 = 3,单元系统中平衡共存的最多相。三相共存点为无 变量点,系统为无变量状态。系统相数最少为1,单元系统最大自由 度为2。温度和压力是单元相图中两个独立变量,用温度和压力的二 维图表示单元系统的相平衡与二者的关系。
p=3 f=0
E(液相消失)[O , A+C]
1
b
T
M
a
L
L+A E A+C
P D
L+C
L+B
J
F
B+C
L C
B
A
C
B
• 同理可分析组成1的冷却过程。在转熔点P处,
L+BC时,L先消失,固相组 成点为D和F,其含量 由D、J、 F三点相对位置求出。P点是回吸点又是析晶终点。
4 低共熔点温度以下有化合物生成与分解的二元相图
α-石英 870α℃-鳞石英 1470℃α-方石英
573℃
163℃
180~270℃
β-石英
β-鳞石英 117℃
β-方石英
γ-鳞石英
二、 相律:
平衡体系中,自由度F、组分C和相数p的规律。
Gibbs提出,系统平衡时:
F C-P+n F : 自由度数,温度、压力、组分浓度等可能影响系统平衡
状态的变量,在一定数量内任意变化而不引起旧相消失 或新相产生的独立变量的数目。 C:独立组分数,构成平衡物系所有各相所需最少组分数。 P :相数。 n :影响系统平衡的外界因素,如温度、压力、电场等。 通常,外界因素主要是温度和压力,一般相律表示为:
第四章-二元合金相图

Pb WSn(%) Sn
G
t/s
70% Sn的过共晶合金的结晶过程分析
概括起来,过共晶合金平衡结晶过程为:
t1温度以上: 液态 L70 L
19
t1~ t2温度: 液相中析出 , t2温度时发生共晶反应: L61.9 t2温度以下: 初 Ⅱ
97.5
室温组织: 初 + Ⅱ + (+)共晶
一、相律
在恒压下,在纯固态或纯液态情况下,出现的相数 小于等于主元数。在液固共存(恒温)条件下出现 的相数小于等于主元数加一。因而,对二元合金, 固态下出现的相数为1或2,液固共存(恒温)条件 下恒温下出现的相数为2或3。
二、二元匀晶相图的分析
匀晶转变:在一定温度范围内由液相结 晶出单相的固溶体的结晶过程。 二元匀晶相图:指两组元在液态和固态 均无限互溶时的二元合金相图。 具有这类相图的合金系主要有Ni-Cu、 Cu-Au、Au-Ag、Mg-Cd、W-Mo等。
标注在温度— 成分坐标中 无限缓冷下测各 合金的冷却曲线 连接各相变点
确定各合金 的相变温度
确定相
如:0%Cu、20%Cu、40%Cu、60%Cu、80%Cu、100%Cu 六组合金。
Cu20% Cu60%Cu80% Cu Ni Cu40%
1600
1500
1400
1400 1300
L
(L+ )
T
Ni
WCu(%)
Cu
将铸件加热到低于固相线100~200℃的温 度,进行长时间保温,使偏析元素充分进行扩 散,以达到成分均匀化。
设A、B组元的熔点分别为1450℃和1080℃,它们 在液态和固态都无限互溶,则这两种组元组成的 二元相图叫作二元 相图;先结晶的固溶体 中含 组元多,后结晶的固溶体中含 组元多,这种成分不均匀现象称为 , 通过 工艺可以减轻或消除这种现 象。
G
t/s
70% Sn的过共晶合金的结晶过程分析
概括起来,过共晶合金平衡结晶过程为:
t1温度以上: 液态 L70 L
19
t1~ t2温度: 液相中析出 , t2温度时发生共晶反应: L61.9 t2温度以下: 初 Ⅱ
97.5
室温组织: 初 + Ⅱ + (+)共晶
一、相律
在恒压下,在纯固态或纯液态情况下,出现的相数 小于等于主元数。在液固共存(恒温)条件下出现 的相数小于等于主元数加一。因而,对二元合金, 固态下出现的相数为1或2,液固共存(恒温)条件 下恒温下出现的相数为2或3。
二、二元匀晶相图的分析
匀晶转变:在一定温度范围内由液相结 晶出单相的固溶体的结晶过程。 二元匀晶相图:指两组元在液态和固态 均无限互溶时的二元合金相图。 具有这类相图的合金系主要有Ni-Cu、 Cu-Au、Au-Ag、Mg-Cd、W-Mo等。
标注在温度— 成分坐标中 无限缓冷下测各 合金的冷却曲线 连接各相变点
确定各合金 的相变温度
确定相
如:0%Cu、20%Cu、40%Cu、60%Cu、80%Cu、100%Cu 六组合金。
Cu20% Cu60%Cu80% Cu Ni Cu40%
1600
1500
1400
1400 1300
L
(L+ )
T
Ni
WCu(%)
Cu
将铸件加热到低于固相线100~200℃的温 度,进行长时间保温,使偏析元素充分进行扩 散,以达到成分均匀化。
设A、B组元的熔点分别为1450℃和1080℃,它们 在液态和固态都无限互溶,则这两种组元组成的 二元相图叫作二元 相图;先结晶的固溶体 中含 组元多,后结晶的固溶体中含 组元多,这种成分不均匀现象称为 , 通过 工艺可以减轻或消除这种现 象。
第四章:二元相图

4.1相图的基本知识 4.1.3相律及杠杆定律
2.杠杆定律: 问题提出: ①当二元合金(成分已知)由两相组成时两相的相对重量是多少?
例:45钢(含C=0.45%),铁素体(F)和Fe3C两相各占多少? ②当二元合金两相相对重量已知时,合金成分是多少?
例:金相观察:F:95%; Fe3C:5%;求钢的含碳量? 杠杆定律可以解决此类问题。
纯金属结晶:在负的温度梯度下---------树枝晶。 在正的温度梯度下------平滑界面(平面长大)
固溶体合金,即使在正的温度梯度下,也会形成树枝晶-------是由于 成分过冷造成的。 (1)成分过冷概念:固溶体合金结晶时,由于液固界面前沿存在溶质 浓度梯度而改变了过冷情况,称为成分过冷。
(2) 产生原因: 以K0<1为例(图示说明) 过冷度:界面前沿液相实际温度<液相平衡结晶温 度 (3) 产生成分过冷的条件: (讨论成分过冷的影响)
④具有共晶转变的二元合金: Pb-Sn Pb-Sb Fe-C(C>2.11%) Al-Si Al-Cu Ag-Cu
第四章:二元相图
4.2.2共晶相图
1.相图分析
以Pb-Sn二元合金相图为例:
三个单相区:L、α、β α:Sn溶入Pb中固溶体 β: Pb溶入Sn中固溶体
AEB-液相线 E点:共晶合金 AMNB-固相线 ME之间:亚共晶 ; EN之间:过共晶合金 MF-Sn在Pb中溶解度曲线,随T↓,溶解度↓ NG- Pb在Sn中溶解度曲线
第四章:二元相图
4.2.2共晶相图
2.典型合金平衡结晶及组织
(2)共晶合金结晶过程(61.9%Sn) 在183℃,由61.9%Sn的液相,同时结 晶出α(19%Sn)和β(97.5%Sn)两 种固溶体。
2.杠杆定律: 问题提出: ①当二元合金(成分已知)由两相组成时两相的相对重量是多少?
例:45钢(含C=0.45%),铁素体(F)和Fe3C两相各占多少? ②当二元合金两相相对重量已知时,合金成分是多少?
例:金相观察:F:95%; Fe3C:5%;求钢的含碳量? 杠杆定律可以解决此类问题。
纯金属结晶:在负的温度梯度下---------树枝晶。 在正的温度梯度下------平滑界面(平面长大)
固溶体合金,即使在正的温度梯度下,也会形成树枝晶-------是由于 成分过冷造成的。 (1)成分过冷概念:固溶体合金结晶时,由于液固界面前沿存在溶质 浓度梯度而改变了过冷情况,称为成分过冷。
(2) 产生原因: 以K0<1为例(图示说明) 过冷度:界面前沿液相实际温度<液相平衡结晶温 度 (3) 产生成分过冷的条件: (讨论成分过冷的影响)
④具有共晶转变的二元合金: Pb-Sn Pb-Sb Fe-C(C>2.11%) Al-Si Al-Cu Ag-Cu
第四章:二元相图
4.2.2共晶相图
1.相图分析
以Pb-Sn二元合金相图为例:
三个单相区:L、α、β α:Sn溶入Pb中固溶体 β: Pb溶入Sn中固溶体
AEB-液相线 E点:共晶合金 AMNB-固相线 ME之间:亚共晶 ; EN之间:过共晶合金 MF-Sn在Pb中溶解度曲线,随T↓,溶解度↓ NG- Pb在Sn中溶解度曲线
第四章:二元相图
4.2.2共晶相图
2.典型合金平衡结晶及组织
(2)共晶合金结晶过程(61.9%Sn) 在183℃,由61.9%Sn的液相,同时结 晶出α(19%Sn)和β(97.5%Sn)两 种固溶体。
第四章 铁碳合金相图(全)

工程材料及热工处理
第四章 铁碳合金相图
主讲人: 刘 怿 凡
§4.1 固态合金的相结构
几个重要概念
1.合金
两种或两种以上的金属,或金属与非金属元素组成 的具有金属特性的物质
2.组元
组成合金的最基本的独立物质称为组元,可以是组 成合金的元素,也可以是化合物,有二元、三元等。
3.相
在合金中,凡成分相同、结构相同并以明显界面相 互分开的均匀组成部分,是合金中最基本的组成部分。
●白口铸铁硬度高、脆性大,不能切削加工,也不能锻造,但其耐 磨性好,铸造性能优良,适用于作要求耐磨、不受冲击、形状复杂 的铸件,例如拔丝模、冷轧辊、货车轮、犁铧、球磨机的磨球等。
§4.4 铁碳合金相图的应用
2.在铸造工艺方面的应用
根据Fe—Fe3C相图可以确定合金的浇注温度。浇注温度一般在 液相线以上50~100℃。
§4.1 固态合金的相结构
4.组织
用肉眼或显微镜观察到的金属材料的内部情景,包 括晶粒的大小、形状、相对数量和相对分布。“特殊形 态的微观形貌”
5.合金系
由相同组元配制的一系列成分不同的合金,组成一 个合金系统。
合金组织中的相结构决定合金的性能
§4.1 固态合金的相结构
合金的相结构
晶体结构、原子结构不同、组元相互作用不同——不同相结构
4.在热处理工艺方面的应用
Fe—Fe3C相图对于制订热处理工艺有着特别重要的意义。一些 热处理工艺如退火、正火、淬火的加热温度都是依据Fe—Fe3C相图 确定的。
§4.4 铁碳合金相图的应用
在运用Fe—Fe3C相图时应注意以下两点:
①Fe—Fe3C相图只反映铁碳二元合金中相的平衡状态,如含有其 它元素,相图将发生变化,与实际情况有较大差异。
第四章 铁碳合金相图
主讲人: 刘 怿 凡
§4.1 固态合金的相结构
几个重要概念
1.合金
两种或两种以上的金属,或金属与非金属元素组成 的具有金属特性的物质
2.组元
组成合金的最基本的独立物质称为组元,可以是组 成合金的元素,也可以是化合物,有二元、三元等。
3.相
在合金中,凡成分相同、结构相同并以明显界面相 互分开的均匀组成部分,是合金中最基本的组成部分。
●白口铸铁硬度高、脆性大,不能切削加工,也不能锻造,但其耐 磨性好,铸造性能优良,适用于作要求耐磨、不受冲击、形状复杂 的铸件,例如拔丝模、冷轧辊、货车轮、犁铧、球磨机的磨球等。
§4.4 铁碳合金相图的应用
2.在铸造工艺方面的应用
根据Fe—Fe3C相图可以确定合金的浇注温度。浇注温度一般在 液相线以上50~100℃。
§4.1 固态合金的相结构
4.组织
用肉眼或显微镜观察到的金属材料的内部情景,包 括晶粒的大小、形状、相对数量和相对分布。“特殊形 态的微观形貌”
5.合金系
由相同组元配制的一系列成分不同的合金,组成一 个合金系统。
合金组织中的相结构决定合金的性能
§4.1 固态合金的相结构
合金的相结构
晶体结构、原子结构不同、组元相互作用不同——不同相结构
4.在热处理工艺方面的应用
Fe—Fe3C相图对于制订热处理工艺有着特别重要的意义。一些 热处理工艺如退火、正火、淬火的加热温度都是依据Fe—Fe3C相图 确定的。
§4.4 铁碳合金相图的应用
在运用Fe—Fe3C相图时应注意以下两点:
①Fe—Fe3C相图只反映铁碳二元合金中相的平衡状态,如含有其 它元素,相图将发生变化,与实际情况有较大差异。
4 第四章 相图(二元)

配制合金系中几种不同成分合金 熔化后,测试其冷却曲线 根据曲线上的转折点,确定各合金的凝固温度 将上述数据引入以温度为纵轴,成分为横轴的坐标
平面中 连接意义相同的点,作出相应的曲线 曲线将图面分成若干区域----相区。经过金相组织分 析,测出各相区所含的相,将相的名称标注其中, 相图工作就完成
4,过共晶合金
★ E点以右,D点以左,为过共晶合金,与亚 共晶合金类似,白色卵形为初晶β,黑色为共 晶体(α+β)。 ★α,β,αⅡ,βⅡ,(α+β)称组织组成物 ★α,αⅡ为一个相。(α+β)两相混合物,称共晶 体。 ★求组织组成物的相对量,同样可用杠杆定理 标明各区的组织---组织分区图
四、共晶组织和初晶形貌 1,共晶组织的形貌
测试时要求合金的成分准确,纯度高,冷却
速度要慢0.5~1.5℃/min
下面是Ni-Cu合金相图,是最简单的相图之一
Ni 1500 1400 1300 1200 1100 1000 900 20% 40% Cu Cu
80% Cu 60% Cu
Cu
Ni 20 40 60 80 Cu Cu%
2.2. 使用二元合金相图的基本方法
2 > 2 ;此时 2 -2 <0
dG<0
当α相与β相彼此平衡时,在dG=0, 同理 :------------------------------
= =
1
2
2
1
1.3. 相律
相律是分析和使用相图的重要依据。凝集态
受压力影响很小,在恒压下:相平衡条件的 数学表达式:f=c-p+1 (在物理化学中也指出) 式中C为组元数,P为共存的平衡相数,f为自 由度数。 单元系(纯金属) f=1-2+1=0,自由度为1,表 明恒温下平衡熔化或凝固。 二元系C=2,当f=0,p=3,在恒定温度下处于三 相平衡;两相共存时,自由度数目为1,表明 平衡凝固或熔化就在一定温度范围
冶金物理化学 第四章 相图

上一内容 下一内容 回主目录
返回
2022/11/6
4.3三元系相图
4.3.1三元系浓度三角形的性质 浓度三角形的构成:如图4-9所示。 在图中,各字母及线的意义如下: 等边三角形顶点A、B、C分别代表纯物质;A的对边BC代表A成分为零;自A点
作BC边的垂线AD,并将其划分为5等份,则每份为20%;逆时针方向自C 至A,自A至B,自B至C分别代表A、B、C各组元浓度。
合,析出C,发生三元共晶反应:A+LP= AmBn+C。
上一内容 下一内容 回主目录
返回
2022/11/6
4.3三元系相图
上一内容 下一内容 回主目录
返回
2022/11/6
4.3三元系相图
上一内容 下一内容 回主目录
返回
2022/11/6
R1
4.3相图的基本规则
4.3.1相区邻接规则 相区与相区之间存在着什么关系?由相律和热力学可以得出: 相区邻接规则: 对n元相图,某区域内相的总数与邻接区域内相的总数之间有下述关系:
%C BN
上一内容 下一内容 回主目录
返回
2022/11/6
4.3三元系相图 WD FE
WE DF
4.直线规则 在三元系中,由两组成的体系D、E混合而成一个总体系F,则总体系F的组成 点一定在D、E两体系的连接线上,而且两体系的质量比由杠杆规则确定。
WD FE WE DF
其中,分别是体系D与E的质量。 如图4-14,以上规则可以证明。
反应得到的 G与T 的关系式,将所有元素与 1molO2 反应的G ~ T 画到一张 图上,如图2-1所示。
上一内容 下一内容 回主目录
返回
2022/11/6
物理化学第四章 相图(材料版)

d T TΔ Vm
Δ Hm - 摩尔相变热; Δ Vm - 相变时摩尔体积变化量
用于任何纯物质的两相平衡系统
对气-液或气-固两相平衡, DVm Vm ( g ) ,
并假定气体为理想气体:
d ln p = DHm dT RT 2
若 DHm可近似看作常数,则:
ln p = - DHm 1 + I RT
4.3 相 律
相律(phase rule):讨论平衡系统中相数、独立组分数与描述该平 衡系统的变数之间的关系。 相(phase):系统中,物理及化学性质完全均一的部分。相与相之间有 明显界面,界面两边的性质有突变。
相数(number of phases):系统中所包含相的总数,以符号 表示
气体: 一个系统中无论含有多少种气体,只能有一个气相; 液体:一个系统中可有一个或两个,一般不超过三个液相; 固体:系统中所含的不同种固体达到了分子程度的均匀混合,就形成了固溶
Φ =3
f = 1 单变量系统 f = 0 无变量系统
水的相图 水的相图是根据实验绘制的。以压力为纵坐标,温度为横坐标。
三个单相区 三条两相平衡线 一个三相点
三个单相区:温度和压力独立地有限度地变化不会引起相的改变。
三条两相平衡线:压力与温度只能改变一个,指定了压力,则温度由系统自定。
OA: 是气-液两相平衡线,即水的蒸气压曲线。它不能任意延长,终止于临 界点。临界点T=647K, p=2.2×107Pa,这时气-液界面消失。
独立组分数C = S - R = 2,相数Ф = 1,自由度 f = 2 - 1 + 2 = 3
(2) N2(g)、H2(g)和NH3(g),其中N2和H2均由NH3分解而来 解:物种数S = 3,独立反应数 R = 1,R' = 1
Δ Hm - 摩尔相变热; Δ Vm - 相变时摩尔体积变化量
用于任何纯物质的两相平衡系统
对气-液或气-固两相平衡, DVm Vm ( g ) ,
并假定气体为理想气体:
d ln p = DHm dT RT 2
若 DHm可近似看作常数,则:
ln p = - DHm 1 + I RT
4.3 相 律
相律(phase rule):讨论平衡系统中相数、独立组分数与描述该平 衡系统的变数之间的关系。 相(phase):系统中,物理及化学性质完全均一的部分。相与相之间有 明显界面,界面两边的性质有突变。
相数(number of phases):系统中所包含相的总数,以符号 表示
气体: 一个系统中无论含有多少种气体,只能有一个气相; 液体:一个系统中可有一个或两个,一般不超过三个液相; 固体:系统中所含的不同种固体达到了分子程度的均匀混合,就形成了固溶
Φ =3
f = 1 单变量系统 f = 0 无变量系统
水的相图 水的相图是根据实验绘制的。以压力为纵坐标,温度为横坐标。
三个单相区 三条两相平衡线 一个三相点
三个单相区:温度和压力独立地有限度地变化不会引起相的改变。
三条两相平衡线:压力与温度只能改变一个,指定了压力,则温度由系统自定。
OA: 是气-液两相平衡线,即水的蒸气压曲线。它不能任意延长,终止于临 界点。临界点T=647K, p=2.2×107Pa,这时气-液界面消失。
独立组分数C = S - R = 2,相数Ф = 1,自由度 f = 2 - 1 + 2 = 3
(2) N2(g)、H2(g)和NH3(g),其中N2和H2均由NH3分解而来 解:物种数S = 3,独立反应数 R = 1,R' = 1
第四章 二元包晶相图

+ L
L+ L+
三个两相区:L+、L+、+ ;
一个三相区:即水平线PDC 。
LC P D
1186C
1、相图分析
(3) 点:A、B分别为Pt、Ag的熔点。 P、D分别为Ag在Pt中和Pt 在Ag 中的最大溶解度点 E、F分别为室温下Ag在Pt中和Pt 在Ag中的溶解度点
L
L+
2
当温度降低到1186℃时,发生包晶反 应前相的相对量计算(L和α) :
+
L+
3、合金的结晶过程——b
⑵ Ⅱ合金(Ag含量在10.5%-42.4%)
2点以下: → Ⅱ
→ Ⅱ
Ⅱ
1
ⅠⅢ
L
L+
2
L+
室温组织:αⅠ+βII +β+αII
+
3、合金的结晶过程——c
+
3、合金的结晶过程——c
(3) Ⅲ合金(Ag含量在42.4%- 66.3% ) 2-3:剩余L →
Ⅰ
3-4: 3点以下: → Ⅱ
Ⅱ L+ ⅠⅢ
1 2 3
L
4
L+
室温组织:β+αII
+
(3) Ⅲ合金(Ag含量在42.4%- 66.3% )
1点以上:L 1-2之间:L+ Ⅰ 2点: LC +αP ⇄βD
Ⅱ
L+
反应后L 剩余, 完全消耗掉
ⅠⅢ
1 2 3
L
当温度降低到1186℃时,发生包晶反 应前相的相对量计算(L和α) :
L+ L+
三个两相区:L+、L+、+ ;
一个三相区:即水平线PDC 。
LC P D
1186C
1、相图分析
(3) 点:A、B分别为Pt、Ag的熔点。 P、D分别为Ag在Pt中和Pt 在Ag 中的最大溶解度点 E、F分别为室温下Ag在Pt中和Pt 在Ag中的溶解度点
L
L+
2
当温度降低到1186℃时,发生包晶反 应前相的相对量计算(L和α) :
+
L+
3、合金的结晶过程——b
⑵ Ⅱ合金(Ag含量在10.5%-42.4%)
2点以下: → Ⅱ
→ Ⅱ
Ⅱ
1
ⅠⅢ
L
L+
2
L+
室温组织:αⅠ+βII +β+αII
+
3、合金的结晶过程——c
+
3、合金的结晶过程——c
(3) Ⅲ合金(Ag含量在42.4%- 66.3% ) 2-3:剩余L →
Ⅰ
3-4: 3点以下: → Ⅱ
Ⅱ L+ ⅠⅢ
1 2 3
L
4
L+
室温组织:β+αII
+
(3) Ⅲ合金(Ag含量在42.4%- 66.3% )
1点以上:L 1-2之间:L+ Ⅰ 2点: LC +αP ⇄βD
Ⅱ
L+
反应后L 剩余, 完全消耗掉
ⅠⅢ
1 2 3
L
当温度降低到1186℃时,发生包晶反 应前相的相对量计算(L和α) :
第四章 相图(有我的备注)

D H m T2 - T1 D H m T2 × ln 对液-固两相平衡: p 2 - p1 = D Vm T1 D Vm T1
水的相图
单组分系统的相数与自由度
f = C – Φ + 2 = 1 - Φ + 2 = 3 -Φ 单相 两相 三相 Φ = 1 = 2 f = 2 f = 1 双变量系统 单变量系统
OD:是AO的延长线,是过冷水和水蒸气 的介稳平衡线。因为在相同温度下,过冷 水的蒸气压大于冰的蒸气压,所以OD线 在OB线之上。过冷水处于不稳定状态, 一旦有凝聚中心出现,立即全部变成冰。
O点:三相点(triple point),气-液-固 三相共存。三相点的温度和压力皆由系统 自定。
两相平衡线上的相变过程
系统的最小相数等于1
物种数(number of substance, S ):系统中所含的化学物质数。 独立组分数 (number of independent components, C ): 平衡系统中各相组成所需要最少的独立物种数。 若系统中无化学反应发生,则:组分数 (C) = 物种数(S) 若系统中有化学平衡存在,则: 组分数 (C) = 物种数(S) – 独立化学平衡关系式的个数(R)
思考题 计算下列系统的自由度:
(1) N2(g)、H2(g)和NH3(g) 解:物种数S = 3,独立反应数R = 1,没说就是没有浓度那个限制 独立组分数C = S - R = 2,相数Ф = 1,自由度 f = 2 - 1 + 2 = 3 (2) N2(g)、H2(g)和NH3(g),其中N2和H2均由NH3分解而来 解:物种数S = 3,独立反应数 R = 1,R' = 1 独立组分数C = S - R - R' =1,自由度 f = 1 – 1 + 2 = 2 (3) 水与水蒸气平衡 解:S = 1, R = 0, R‘ = 0, C = S – R - R’ = 1, Φ = 2, s是1不是2为什么R=0? f = C – Φ + 2 = 1 (变量为温度T或压力p ) (4) 101325Pa下,水与水蒸气平衡
第四章 相图热力学

13 Hunan Univ.
∆mixGl = nB∆SlGm,B* + RT(ncln xCl + nBln xBl)
用nC+nB 除上式,可得
∆mixGml = xBl ∆SlGm,B* + RT(xcln xCl + xBln xBl)
同理可得
∆mixGms = -xCs ∆SlGm,c* + RT(xcsln xCs + xBsln xBl)
根据偏摩尔量与组成的几何关系,GB可用下式求得
dGm G B Gm x B dx B
B G
C G
* m, B
RT ln xB G
E C
E B
* m ,C
RT ln xC G
31
Yuxi Chen Hunan Univ.
设温度T时α和β两相处于平衡,则
2)当体系处于两相或三相平衡时,各相的△mixGm-xB 曲线应具有公切线,切点对应的组成为平衡相的 组成。例如,E、F二相处于平衡时,应满足
其中 下标:mix表示“混合”,B表示B组元,m表示摩尔 (如摩尔自由能) 上标:E和F表示相 3) 相平衡体系中同一组分在各相的化学位、活度应 E F E F 相等。即 a a
由以上二式便可绘制TC~TB 间的△mixGms-xB 、 △mixGml-xC 曲线。
Yuxi Chen Hunan Univ.
14
4.2.2 绘制NiO-MgO完全固溶体相图
已知MgO及NiO的熔点分别为3073K和2233K,摩尔 熔化焓分别为77404 及52300J.mol-1,则△slGm*MgO 及△slGm* NiO 近似计算式为
由图4.2a可以看出,在T1温度时,自由能曲线为液态的 △mixGm-xB关系曲线。为求得与纯固态C平衡的液态组成,可从 纯固态C的状态点(xC=1,△mixGm=0)对△mixGm-xB曲线作 切线,切点对应的组成即为平衡液相的组成。 在aB-xB图中, mnp为C组元固相活度随浓度的变化。在T1温度时, 处于二相平 衡态中的固相为纯C,所以mn对应的活度为1。
∆mixGl = nB∆SlGm,B* + RT(ncln xCl + nBln xBl)
用nC+nB 除上式,可得
∆mixGml = xBl ∆SlGm,B* + RT(xcln xCl + xBln xBl)
同理可得
∆mixGms = -xCs ∆SlGm,c* + RT(xcsln xCs + xBsln xBl)
根据偏摩尔量与组成的几何关系,GB可用下式求得
dGm G B Gm x B dx B
B G
C G
* m, B
RT ln xB G
E C
E B
* m ,C
RT ln xC G
31
Yuxi Chen Hunan Univ.
设温度T时α和β两相处于平衡,则
2)当体系处于两相或三相平衡时,各相的△mixGm-xB 曲线应具有公切线,切点对应的组成为平衡相的 组成。例如,E、F二相处于平衡时,应满足
其中 下标:mix表示“混合”,B表示B组元,m表示摩尔 (如摩尔自由能) 上标:E和F表示相 3) 相平衡体系中同一组分在各相的化学位、活度应 E F E F 相等。即 a a
由以上二式便可绘制TC~TB 间的△mixGms-xB 、 △mixGml-xC 曲线。
Yuxi Chen Hunan Univ.
14
4.2.2 绘制NiO-MgO完全固溶体相图
已知MgO及NiO的熔点分别为3073K和2233K,摩尔 熔化焓分别为77404 及52300J.mol-1,则△slGm*MgO 及△slGm* NiO 近似计算式为
由图4.2a可以看出,在T1温度时,自由能曲线为液态的 △mixGm-xB关系曲线。为求得与纯固态C平衡的液态组成,可从 纯固态C的状态点(xC=1,△mixGm=0)对△mixGm-xB曲线作 切线,切点对应的组成即为平衡液相的组成。 在aB-xB图中, mnp为C组元固相活度随浓度的变化。在T1温度时, 处于二相平 衡态中的固相为纯C,所以mn对应的活度为1。
第四章相图

2) 溶质扩散难度>液相扩散难度-------
固相平均成分线偏离固相线程度>液相平均成分线偏离液相线程度
3) 固相扩散困难-----先后结晶部分保持各成分---偏析---影响性能-----(均匀化退火)
5微观偏析
高熔点物质---凝固时,先结晶-----先结晶部分高熔点组元多
---熔化时,后熔化-----先熔化部分低熔点组元多
固溶体:LS界面溶质重新分配---有偏析有成分过冷
平面状、胞状、树枝状
第三节二元共晶相图
一、 相图分析
1区域划分
区:单相区:三个 Lαβ
双相区:三个L+α,L+β,α+β
三相区:一个(水平线) L+α+β
线:共晶线:
液相线
固相线
固溶度曲线
点:共晶点
最大固溶度点
2相变反应
1粗糙—粗糙型
1) 形核—长大机制
形核条件---热力学条件&结构条件&能量条件&成分条件
形核机制:交替形核机制
A形核---B富集---B形核---A富集---A形核---……
长大条件:热力学条件&动力学条件
长大机制:短程横向扩散---满足成分要求
LS界面类型相同---满足长大速度相近
后期:L相富集程度很大---L相很少---L相浓度大---S相结晶出较多的溶质---S相浓度快速增大
2) 中速凝固
S相
L相:LS界面层扩散速度不够快---溶质原子不能完全扩散到远端
起始----初始瞬态区
中期:L相:界面层浓度稳定---远端浓度增加
S相:随界面浓度的稳定而稳定
固相平均成分线偏离固相线程度>液相平均成分线偏离液相线程度
3) 固相扩散困难-----先后结晶部分保持各成分---偏析---影响性能-----(均匀化退火)
5微观偏析
高熔点物质---凝固时,先结晶-----先结晶部分高熔点组元多
---熔化时,后熔化-----先熔化部分低熔点组元多
固溶体:LS界面溶质重新分配---有偏析有成分过冷
平面状、胞状、树枝状
第三节二元共晶相图
一、 相图分析
1区域划分
区:单相区:三个 Lαβ
双相区:三个L+α,L+β,α+β
三相区:一个(水平线) L+α+β
线:共晶线:
液相线
固相线
固溶度曲线
点:共晶点
最大固溶度点
2相变反应
1粗糙—粗糙型
1) 形核—长大机制
形核条件---热力学条件&结构条件&能量条件&成分条件
形核机制:交替形核机制
A形核---B富集---B形核---A富集---A形核---……
长大条件:热力学条件&动力学条件
长大机制:短程横向扩散---满足成分要求
LS界面类型相同---满足长大速度相近
后期:L相富集程度很大---L相很少---L相浓度大---S相结晶出较多的溶质---S相浓度快速增大
2) 中速凝固
S相
L相:LS界面层扩散速度不够快---溶质原子不能完全扩散到远端
起始----初始瞬态区
中期:L相:界面层浓度稳定---远端浓度增加
S相:随界面浓度的稳定而稳定
材料科学基础 第四章 相图(3)
第 十 一 节 三 元 共 晶 相 图
25
第 四 章 相 图
第十一节 三元共晶相图
二 组元在固态有限溶解的共晶相图
(3)变温截面 ) 3个三相区 个三相区 共晶相图特征: 共晶相图特征:水平线 ;两相共晶区特征:曲边三角形。 两相共晶区特征:曲边三角形。 1个三相区 个三相区 应用:分析合金结晶过程,确定组织变化. 应用:分析合金结晶过程,确定组织变化 局限性:不能分析成分变化。 成分在单变量线上,不在垂直截面上) 局限性:不能分析成分变化。(成分在单变量线上,不在垂直截面上)
第十一节 三元共晶相图
一 组元在固态互不相溶的共晶相图 (1)相图分析 ) 熔点;二元共晶点;三元共晶点。 点:熔点;二元共晶点;三元共晶点。 两相共晶线 液相面交线 两相共晶面交线 液相单变量线
液相区与两相共晶面交线
第 十 一
线:EnE
节 三 元 共 晶 相 图
14
第 四 章 相 图 第 十 一 节 三 元 共 晶 相 图
第十一节 三元共晶相图
一 组元在固态互不相溶的共晶相图 (1)相图分析 ) 液相面 固相面 面: 两相共晶面 三相共晶面 两相区: 个 两相区:3个 单相区: 个 区: 单相区:4个 三相区: 个 三相区:4个 四相区: 个 四相区:1个
15
第 四 章 相 图 第 十 一 节 三 元 共 晶 相 图
第 十 一 节 三 元 共 晶 相 图
26
第 四 章 相 图
第十一节 三元共晶相图
二 组元在固态有限溶解的共晶相图 合金结晶过程分析; 合金结晶过程分析; 相组成物相对量计算(杠杆定律、重心定律) (4)投影图 相组成物相对量计算(杠杆定律、重心定律) ) 组织组成物相对量计算(杠杆定律、 组织组成物相对量计算(杠杆定律、重心定律)
物理化学相图

上一页
下一页
目录
结束
2011-8-13
第四章 相图
• 右图中,自由度都为零的全部的点为 ( A. J、E1、C、E2、K B. M、E1、N、O、E2、P C. MN线、OP线(端点除外) 上各点及J、C、K D. MN线、OP线(包含端点) 上各点及J、C、K )
上一页
下一页
目录
结束
2011-8-13
第四章 相图
上一页
下一页
目录
结束
2011-8-13
第四章 相图
上一页
下一页
目录
结束
2011-8-13
第四章 相图
上一页
下一页
目录
结束
2011-8-13
第四章 相图
上一页
下一页
目录
结束
2011-8-13
第四章 相图
上一页
下一页
目录
结束
2011-8-13
第四章 相图
* *如图是FeO与SiO2的恒压相图,那么存在 几个稳 定化合物:( ) A. 1个 B. 2个 C. 3个 D. 4个
上一页
下一页
目录
结束
2011-8-13
第四章 相图
• 已知 2CO3-Na2SO4-H2O的三元相图如下 现有含 2SO4质量分数为 已知Na 的三元相图如下,现有含 质量分数为10%的 的三元相图如下 现有含Na 的 Na2CO3和Na2SO4的机械混合物若干 其物系点为 现欲将其分离提纯 试设计 的机械混合物若干,其物系点为 现欲将其分离提纯,试设计 其物系点为P,现欲将其分离提纯 工艺路线。图中实线是290 K时的相图;虚线为 时的相图; 时的相图。 工艺路线。图中实线是 时的相图 虚线为373 K时的相图。 时的相图
第四章 相图

⑶按溶质原子在溶剂中的分布特点分类
①无序固溶体:溶质原子在溶剂中任意分布,无规律性。 ②有序固溶体:溶质原子按一定比例有规律分布在溶剂晶
格的点阵或间隙里,具有长程有序的结构。
(4)按基体类型分类:
一次固溶体:以纯金属元素为溶剂形成的固溶体。
二次固溶体:以化合物为溶剂,组元元素之一为溶质而 形成的固溶体。
合金——两种或两种以上的金属或金属与非金属经冶炼、烧结 或其它方法组合而成并具有金属特性的物质。
组元——组成合金的最简单、最基本而且能独立存在的物质。 组元可以是金属和非金属,也可以是化合物。
相——合金中具有同一结构,成分性质完全相同的均匀组成部 分。单相、两相及多相合金。
一、固溶体
溶质原子完全溶入固态溶剂中,所生成的合金相与溶剂的晶格 结构相同,该合金相叫固溶体。固溶体的成分一般可在一定范围内 连续变化,随溶质的溶入,将引起溶剂晶格畸变,使合金强度硬度 升高,这便是固溶强化。
固溶体特点:
溶剂的点阵类型不变,溶质原子或是代替部分溶剂原子(置换 式固溶体),或是进入溶剂组元的间隙(间隙式固溶体)。
特征:
溶剂和溶质原子占据一个共同的布拉菲点阵,点阵类型和溶 剂点阵类型相同;
有一定的成分范围,组元的含量可在一定范围内改变而不会 导致固溶体点阵类型的改变;
具有比较明显的金属性质,固溶体的结合键主要是金属键。
(A)对于独立化学平衡数R,要注意“独立” 两个字。
例如:系统中含有C(s)、CO(g)、H2O(g)、CO2(g)、H2(g) 五种物质,可能存在的反应有:
①C(s)+H2O(g)=CO(g)+H2(g) ②C(s)+CO2(g)=2CO(g) ③CO(g)+H2O(g)=CO2(g)+ H2(g)
①无序固溶体:溶质原子在溶剂中任意分布,无规律性。 ②有序固溶体:溶质原子按一定比例有规律分布在溶剂晶
格的点阵或间隙里,具有长程有序的结构。
(4)按基体类型分类:
一次固溶体:以纯金属元素为溶剂形成的固溶体。
二次固溶体:以化合物为溶剂,组元元素之一为溶质而 形成的固溶体。
合金——两种或两种以上的金属或金属与非金属经冶炼、烧结 或其它方法组合而成并具有金属特性的物质。
组元——组成合金的最简单、最基本而且能独立存在的物质。 组元可以是金属和非金属,也可以是化合物。
相——合金中具有同一结构,成分性质完全相同的均匀组成部 分。单相、两相及多相合金。
一、固溶体
溶质原子完全溶入固态溶剂中,所生成的合金相与溶剂的晶格 结构相同,该合金相叫固溶体。固溶体的成分一般可在一定范围内 连续变化,随溶质的溶入,将引起溶剂晶格畸变,使合金强度硬度 升高,这便是固溶强化。
固溶体特点:
溶剂的点阵类型不变,溶质原子或是代替部分溶剂原子(置换 式固溶体),或是进入溶剂组元的间隙(间隙式固溶体)。
特征:
溶剂和溶质原子占据一个共同的布拉菲点阵,点阵类型和溶 剂点阵类型相同;
有一定的成分范围,组元的含量可在一定范围内改变而不会 导致固溶体点阵类型的改变;
具有比较明显的金属性质,固溶体的结合键主要是金属键。
(A)对于独立化学平衡数R,要注意“独立” 两个字。
例如:系统中含有C(s)、CO(g)、H2O(g)、CO2(g)、H2(g) 五种物质,可能存在的反应有:
①C(s)+H2O(g)=CO(g)+H2(g) ②C(s)+CO2(g)=2CO(g) ③CO(g)+H2O(g)=CO2(g)+ H2(g)
第四章 铁碳合金相图
珠光体
珠光体中的渗碳体称共析 渗碳体。 S点以下,共析 中析出 Fe3CⅢ,与共析Fe3C结合
不易分辨。室温组织为P.
Q
室温下,珠光体中两 相的相对重量百分比
是多少?
4L Q QL 6.69 0.77 88.5% 6.69 0.0008 Q Fe 3C 100% 88.5% 11.5%
S点,余下的
转变为P。
在共析温度下Fe3CⅡ的相对量?
过共析钢的结晶过程
组织转变:L
L+A
A
A+Fe3CII
P+Fe3CII
过共析钢室温组织为P+ Fe3C Ⅱ。 Fe3CⅡ量随含碳量而增加, 含碳量为2.11%时, Fe3CⅡ 量最大:
QFe C
3
II
2.11 0.77 100% 22.6% 6.69 0.77
⑵ 三条水平线:
HJB:包晶线LB+δH⇄ J
ECF:共晶线LC⇄ E+Fe3C
共晶产物是 与Fe3C的机械 混合物,称作莱氏体, 用Le 表示。为蜂窝状, 以Fe3C为
基,性能硬而脆。
莱氏体
PSK:共析线
L+δ
S ⇄FP+ Fe3C
δ+
L+ L+ Fe3C + + Fe3C
共析转变的产物是 与 Fe3C的机械混合物,称 作珠光体,用P表示。
F+ Fe3C
珠光体的组织特点是 两相呈片层相间分布, 性能介于两相之间。
珠光体
PSK线又称A1线 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 相图
合金是指由两个或两个以上元素或组元组成的, 具有金属特性的物质。
纯金属结晶时,相状态只与温度有关,且有固定 的凝固点。
在合金凝固过程中,除了温度变量以外,还有成 分变量,为了描述合金状态与温度与成分的关系, 需要借助于相图来表示。
相图是用来表示合金系中各合金结晶过程的 简明图解。又称平衡状态图。
在杠杆定律中,杠杆的支点是合金的成分,杠杆的端 点是所求的两平衡相(或两组织组成物)的成分。
杠杆定律只适用于两相区。
例(如图)
Q
0.53 0.45 100% 61.5% 0.58 0.45
QL
0.58 0.58
0.53 0.45
100%
38.5%
杠杆定律应用条件:
1 必须是在两相区; 2 必须是平衡转变。
1
2
⑵ 确定两平衡相的相对重量
设合金的重量为1,液相重量为QL,固相重量为Q。
则 QL + Q =1
液相重量 + 固相重量 = 合金重量
QL x1 + Q x2 =x 液相中B组元含量 + 固相中B组元含量
解方程组得:
= 合金中B组元含量
QL
x2 x x2 x1
Qα
x x1 x2 x1
式中的x2-x、x2-x1、x-x1即为相图中线段xx2 (ob)、
二、二元共晶相图
当两组元在液态下 完全互溶,在固态 下有限互溶,并发 生共晶反应时所构 成的相图称作共晶 相图。
以Pb-Sn相图为例进 行分析。
Pb-Sn合金相图
1、相图分析
⑴ 相:相图中有 L、、三种相, A
是溶质Sn在 Pb
B
中的固溶体,
是溶质Pb 在Sn中
的固溶体。
⑵ 相区:相图中
有三个单相区: L、、;三个两 A
相区: L+、
B
L+、 + ;一
个三相区:即水
平线CED。
⑶ 液固相线:液相线AEB,固相线ACEDB。A、B分 别为Pb、Sn的熔点。
⑷ 固溶线:溶解度
A
点的连线称固溶线。
相图中的CF、DG
B
线分别为Sn在Pb
中和Pb在Sn中的
固溶线。
固溶体的溶解度随 温度降低而下降。
T
L
L+α
wL
wo
wα
α
杠杆定律扩展应用:
Cu
x1 x
x2
Ni
w(Ni)%
1 已知合金及液、固相成分,可以求得液、固相的重量比; 2 已知合金、液相、固相成分以及液相或固相的重量,可以
求得另一相的重量; 3 若已知液、固相的重量比,合金及某一平衡相的成分,可
以求得另一平衡相的成分。
3、枝晶偏析
合金的结晶只有在缓慢冷却条 件下才能得到成分均匀的固溶 体。但实际冷速较快,结晶时 固相中的原子来不及扩散,使 先结晶出的枝晶轴含有较多的 高熔点元素(如Cu-Ni合金中的 Ni),后结晶的枝晶间含有较多 的低熔点元素(如Cu-Ni合金中 的Cu)。
19.2
结晶过程中两相相间形核, A
形成后向周围排出Sn, 使
C
周围Sn浓度提高,有助于
形成;反之亦反。
F
B
E
D
G
Pb原子 扩散
Sn原子 扩散
Pb-Sn共晶体长大示意图
共晶组织形 态
树枝状(Pb-Bi) 放射状(Cu-Cu3P)
针状(Al-Si)
Pb-Sn共晶组织
层片状(Al-CuAl2定向凝固) 条棒状(Sb-MnSb横截面)
螺旋状(Zn-Mg)
在共晶转变过程中,L、 、 三相共存, 三个相 的量在不断变化,但它们 各自成分是固定的。
共晶组织中的相称共晶相。 共晶转变结束时, 和 相的相对重量百分比为:
C(19.2)
E(61.9) D(97.5)
Q
ED CD
100%
97.5 61.9 100% 97.5 19.2
转变或匀晶反应。
随温度下降, 固溶体重量增 加,液相重量 减少。同时, 液相成分沿液 相线变化,固 相成分沿固相 线变化。
成分变化是通过原子扩散完成的。当合金冷却 到t3时,最后一滴L3成分的液体也转变为固溶 体,此时固溶体的成分又变回到合金成分3上 来。
液、固相线不仅是 相区分界线, 也是 结晶时两相的成分 变化线;匀晶转变 是变温转变。
x1x2 (ab)、 x1x(ao)的长度。
因此两相的相对重量百分比为:
QL
xx2 x1 x2
100%(
ob 100%) ab
Q
x1 x x1 x2
100%(
ao 100%) ab
两相的重量比为:
QL xx2 ( ob ) Q x1 x ao 或 QL x1 x Q xx2
上式与力学中的杠杆定律完全相似,因此称之为杠杆 定律。即合金在某温度下两平衡相的重量比等于该温 度下与各自相区距离较远的成分线段之比。
Pb原子 扩散
Sn原子 扩散
Pb-Sn共晶组织
共晶体长大示意图
具有共晶成分的合金称共晶合金。在共晶线上, 凡成分位于共晶点以左的合金称亚共晶合金, 位于共晶点以右的合金称过共晶合金。
A
凡具有共晶线
成分的合金液 体冷却到共晶
L+
B
C
D
温度时都将发
生共晶反应。
2、合金的结晶过程 ⑴ 含Sn量小于C点合金(Ⅰ合金)的结晶过程 在3点以前为匀晶转变,结晶出单相 固溶体, 这种从液相中结晶出的固相称一次相或初生相。
合金液体在2点以前为匀晶转变。冷却到2点,固相成
分变化到C点,液相成分变化到E点,此时两相的相对
重量为:
QL
(
QE
)
C2 CE
100%,
Q
2E CE
100%
在2点,具有E点成分的剩余液体发生共晶反应: L ⇄( + ) ,转变为共晶组织,共晶体的重量与转
变前的液相重量相等,即QE =QL。
反应结束后,在共晶温度下、 两相的相对重量百
L
三个相区,液相线
以上为液相区L ,
L
+
固相线以下为 固
溶体区,两条线之
间为两相共存的两
相区(L+ )。
1、合金的结晶过程 除纯组元外,其它成分合金结晶过程相
似,以Ⅰ合金为例说明。
当液态金属自高温
L
冷却到 t1温度时, 开始结晶出成分为 1的固溶体,其Ni
含量高于合金平均 成分。
这种从液相中结晶出单一固相的转变称为匀晶
几乎所有的相图都是通过实验得到的,最常 用的是热分析法。
3 二元相图的建立 关键:测定给定材料系中若干成分不同的合金的平衡凝固温度和相变温度 方法:热分析法,金相法、硬度法、磁性法等
例:热分析法(thermal analysis)测定二元Cu-Ni合金
1) 配置不同成分的Cu-Ni合金;Cu, 75Cu25Ni, 50Cu50Ni, 25Cu75Ni, Ni
室温下Ⅱ的相对重量百分比为:Q
F 4 100% FG
F
G
由于二次相析出温度较低,一般十分细小。 Ⅰ合金室温组织为 + Ⅱ 。 成分大于D点合金结晶过程与Ⅰ合金相似, 室温组织为
+ Ⅱ。
⑵ 共晶合金(Ⅱ合金)的结晶过程 液态合金冷却到E 点时同时被Pb和Sn饱和, 发生共晶
反应:LE ⇄(C+D) 。析出过程中两相相间形核、互 相促进, 因而共晶组织较细, 呈片、棒、点球等形状。
水平线PDC称包晶线,与该线成分对应的合金在该温度
下发生包晶反应: LC +α P ⇄β D 。该反应是液相L 包着固相α,新相β在L与α的界面上形核,并向L和 α两个方向长大。
在一定温度下, 由一个液相包着 一个固相生成另 一新固相的反应 称包晶转变或包 晶反应。
2、合金的结晶过程
① 包晶成分合金:匀晶包晶二次析出。
⑸ 共晶线:水平线CED叫做共晶线。 在共晶线对应的温度下(183 ℃),E点成分的合金同 时结晶出C点成分的固溶体和D点成分的固溶体, 形成这两个相的机械混
合物:LE ⇄(C + D)。
A
在一定温度下,由一定成分
B
的液相同时结晶出两个成
分和结构都不相同的固相
的转变过程称共晶转变或
共晶反应。
共晶反应的产物,即两 相的机械混合物称共晶 体或共晶组织。发生共 晶反应的温度称共晶温 度。代表共晶温度和共 晶成分的点称共晶点。
分比为:
Q
2D 100%, CD
Q
C 2 100% CD
温度继续下降,将从一次 和共晶 中析出Ⅱ ,从共 晶 中析出Ⅱ 。其室温组 织为Ⅰ+ ( + ) + Ⅱ 。
亚共晶合金的 结晶过程
⑷ 过共晶合金结晶过程 过共晶合金结晶过程与亚共
晶合金相似,不同的是一次相 为 , 二次相为 Ⅱ。 室温组织为Ⅰ+(+)+Ⅱ。
.2
温度降到3点以下, 固溶体被Sn过饱和,由于晶格 不稳,开始析出(相变过程也称析出)新相— 相。 由已有固相析出的新固相称二次相或次生相。
形成二次相的过程称二次析出,是固态相变的一种。
H
由 析出的二次 用Ⅱ 表示。
随温度下降, 和 相的成分分别沿CF线和DG线变
化, Ⅱ的重量增加。
2、杠杆定律 处于两相区的合金,不仅由相图可知道两平衡相的
成分,还可用杠杆定律求出两平衡相的相对重量。
现以Cu-Ni合金为例推导杠杆定律:
⑴ 确定两平衡相的成分:设合金成分为x,过x做成
分垂线。在成分垂线相当
于温度t 的o点作水平线, t
合金是指由两个或两个以上元素或组元组成的, 具有金属特性的物质。
纯金属结晶时,相状态只与温度有关,且有固定 的凝固点。
在合金凝固过程中,除了温度变量以外,还有成 分变量,为了描述合金状态与温度与成分的关系, 需要借助于相图来表示。
相图是用来表示合金系中各合金结晶过程的 简明图解。又称平衡状态图。
在杠杆定律中,杠杆的支点是合金的成分,杠杆的端 点是所求的两平衡相(或两组织组成物)的成分。
杠杆定律只适用于两相区。
例(如图)
Q
0.53 0.45 100% 61.5% 0.58 0.45
QL
0.58 0.58
0.53 0.45
100%
38.5%
杠杆定律应用条件:
1 必须是在两相区; 2 必须是平衡转变。
1
2
⑵ 确定两平衡相的相对重量
设合金的重量为1,液相重量为QL,固相重量为Q。
则 QL + Q =1
液相重量 + 固相重量 = 合金重量
QL x1 + Q x2 =x 液相中B组元含量 + 固相中B组元含量
解方程组得:
= 合金中B组元含量
QL
x2 x x2 x1
Qα
x x1 x2 x1
式中的x2-x、x2-x1、x-x1即为相图中线段xx2 (ob)、
二、二元共晶相图
当两组元在液态下 完全互溶,在固态 下有限互溶,并发 生共晶反应时所构 成的相图称作共晶 相图。
以Pb-Sn相图为例进 行分析。
Pb-Sn合金相图
1、相图分析
⑴ 相:相图中有 L、、三种相, A
是溶质Sn在 Pb
B
中的固溶体,
是溶质Pb 在Sn中
的固溶体。
⑵ 相区:相图中
有三个单相区: L、、;三个两 A
相区: L+、
B
L+、 + ;一
个三相区:即水
平线CED。
⑶ 液固相线:液相线AEB,固相线ACEDB。A、B分 别为Pb、Sn的熔点。
⑷ 固溶线:溶解度
A
点的连线称固溶线。
相图中的CF、DG
B
线分别为Sn在Pb
中和Pb在Sn中的
固溶线。
固溶体的溶解度随 温度降低而下降。
T
L
L+α
wL
wo
wα
α
杠杆定律扩展应用:
Cu
x1 x
x2
Ni
w(Ni)%
1 已知合金及液、固相成分,可以求得液、固相的重量比; 2 已知合金、液相、固相成分以及液相或固相的重量,可以
求得另一相的重量; 3 若已知液、固相的重量比,合金及某一平衡相的成分,可
以求得另一平衡相的成分。
3、枝晶偏析
合金的结晶只有在缓慢冷却条 件下才能得到成分均匀的固溶 体。但实际冷速较快,结晶时 固相中的原子来不及扩散,使 先结晶出的枝晶轴含有较多的 高熔点元素(如Cu-Ni合金中的 Ni),后结晶的枝晶间含有较多 的低熔点元素(如Cu-Ni合金中 的Cu)。
19.2
结晶过程中两相相间形核, A
形成后向周围排出Sn, 使
C
周围Sn浓度提高,有助于
形成;反之亦反。
F
B
E
D
G
Pb原子 扩散
Sn原子 扩散
Pb-Sn共晶体长大示意图
共晶组织形 态
树枝状(Pb-Bi) 放射状(Cu-Cu3P)
针状(Al-Si)
Pb-Sn共晶组织
层片状(Al-CuAl2定向凝固) 条棒状(Sb-MnSb横截面)
螺旋状(Zn-Mg)
在共晶转变过程中,L、 、 三相共存, 三个相 的量在不断变化,但它们 各自成分是固定的。
共晶组织中的相称共晶相。 共晶转变结束时, 和 相的相对重量百分比为:
C(19.2)
E(61.9) D(97.5)
Q
ED CD
100%
97.5 61.9 100% 97.5 19.2
转变或匀晶反应。
随温度下降, 固溶体重量增 加,液相重量 减少。同时, 液相成分沿液 相线变化,固 相成分沿固相 线变化。
成分变化是通过原子扩散完成的。当合金冷却 到t3时,最后一滴L3成分的液体也转变为固溶 体,此时固溶体的成分又变回到合金成分3上 来。
液、固相线不仅是 相区分界线, 也是 结晶时两相的成分 变化线;匀晶转变 是变温转变。
x1x2 (ab)、 x1x(ao)的长度。
因此两相的相对重量百分比为:
QL
xx2 x1 x2
100%(
ob 100%) ab
Q
x1 x x1 x2
100%(
ao 100%) ab
两相的重量比为:
QL xx2 ( ob ) Q x1 x ao 或 QL x1 x Q xx2
上式与力学中的杠杆定律完全相似,因此称之为杠杆 定律。即合金在某温度下两平衡相的重量比等于该温 度下与各自相区距离较远的成分线段之比。
Pb原子 扩散
Sn原子 扩散
Pb-Sn共晶组织
共晶体长大示意图
具有共晶成分的合金称共晶合金。在共晶线上, 凡成分位于共晶点以左的合金称亚共晶合金, 位于共晶点以右的合金称过共晶合金。
A
凡具有共晶线
成分的合金液 体冷却到共晶
L+
B
C
D
温度时都将发
生共晶反应。
2、合金的结晶过程 ⑴ 含Sn量小于C点合金(Ⅰ合金)的结晶过程 在3点以前为匀晶转变,结晶出单相 固溶体, 这种从液相中结晶出的固相称一次相或初生相。
合金液体在2点以前为匀晶转变。冷却到2点,固相成
分变化到C点,液相成分变化到E点,此时两相的相对
重量为:
QL
(
QE
)
C2 CE
100%,
Q
2E CE
100%
在2点,具有E点成分的剩余液体发生共晶反应: L ⇄( + ) ,转变为共晶组织,共晶体的重量与转
变前的液相重量相等,即QE =QL。
反应结束后,在共晶温度下、 两相的相对重量百
L
三个相区,液相线
以上为液相区L ,
L
+
固相线以下为 固
溶体区,两条线之
间为两相共存的两
相区(L+ )。
1、合金的结晶过程 除纯组元外,其它成分合金结晶过程相
似,以Ⅰ合金为例说明。
当液态金属自高温
L
冷却到 t1温度时, 开始结晶出成分为 1的固溶体,其Ni
含量高于合金平均 成分。
这种从液相中结晶出单一固相的转变称为匀晶
几乎所有的相图都是通过实验得到的,最常 用的是热分析法。
3 二元相图的建立 关键:测定给定材料系中若干成分不同的合金的平衡凝固温度和相变温度 方法:热分析法,金相法、硬度法、磁性法等
例:热分析法(thermal analysis)测定二元Cu-Ni合金
1) 配置不同成分的Cu-Ni合金;Cu, 75Cu25Ni, 50Cu50Ni, 25Cu75Ni, Ni
室温下Ⅱ的相对重量百分比为:Q
F 4 100% FG
F
G
由于二次相析出温度较低,一般十分细小。 Ⅰ合金室温组织为 + Ⅱ 。 成分大于D点合金结晶过程与Ⅰ合金相似, 室温组织为
+ Ⅱ。
⑵ 共晶合金(Ⅱ合金)的结晶过程 液态合金冷却到E 点时同时被Pb和Sn饱和, 发生共晶
反应:LE ⇄(C+D) 。析出过程中两相相间形核、互 相促进, 因而共晶组织较细, 呈片、棒、点球等形状。
水平线PDC称包晶线,与该线成分对应的合金在该温度
下发生包晶反应: LC +α P ⇄β D 。该反应是液相L 包着固相α,新相β在L与α的界面上形核,并向L和 α两个方向长大。
在一定温度下, 由一个液相包着 一个固相生成另 一新固相的反应 称包晶转变或包 晶反应。
2、合金的结晶过程
① 包晶成分合金:匀晶包晶二次析出。
⑸ 共晶线:水平线CED叫做共晶线。 在共晶线对应的温度下(183 ℃),E点成分的合金同 时结晶出C点成分的固溶体和D点成分的固溶体, 形成这两个相的机械混
合物:LE ⇄(C + D)。
A
在一定温度下,由一定成分
B
的液相同时结晶出两个成
分和结构都不相同的固相
的转变过程称共晶转变或
共晶反应。
共晶反应的产物,即两 相的机械混合物称共晶 体或共晶组织。发生共 晶反应的温度称共晶温 度。代表共晶温度和共 晶成分的点称共晶点。
分比为:
Q
2D 100%, CD
Q
C 2 100% CD
温度继续下降,将从一次 和共晶 中析出Ⅱ ,从共 晶 中析出Ⅱ 。其室温组 织为Ⅰ+ ( + ) + Ⅱ 。
亚共晶合金的 结晶过程
⑷ 过共晶合金结晶过程 过共晶合金结晶过程与亚共
晶合金相似,不同的是一次相 为 , 二次相为 Ⅱ。 室温组织为Ⅰ+(+)+Ⅱ。
.2
温度降到3点以下, 固溶体被Sn过饱和,由于晶格 不稳,开始析出(相变过程也称析出)新相— 相。 由已有固相析出的新固相称二次相或次生相。
形成二次相的过程称二次析出,是固态相变的一种。
H
由 析出的二次 用Ⅱ 表示。
随温度下降, 和 相的成分分别沿CF线和DG线变
化, Ⅱ的重量增加。
2、杠杆定律 处于两相区的合金,不仅由相图可知道两平衡相的
成分,还可用杠杆定律求出两平衡相的相对重量。
现以Cu-Ni合金为例推导杠杆定律:
⑴ 确定两平衡相的成分:设合金成分为x,过x做成
分垂线。在成分垂线相当
于温度t 的o点作水平线, t
