元素周期表专题复习共19页
元素周期表专题教育课件

第四面期第ⅥA 族。
第53号元素: 53-54=-1 第88号元素: 88-86 =2
第五周期第ⅦA 族。 第七周期第ⅡA 族。
第82号元素: 82-86 =-4
第六周期第ⅣA 族。
练习与思索:
1、推算原子序数为6、13、34、53、88旳 元素在周期表中旳位置。
2 3 457
IVA IIIA VIA VIIA IIA
元素旳化学性质主要决定于原子核外最外层电子 数,同步与原子半径也有亲密关系。
(1)碱金属化学性质旳相同性和递变性
①碱金属元素旳原子最外层上都是1个电子,易 失去(形成M+,化合价为+1价),使次外层变成最 外层而到达8个或2个电子旳稳定构造,所以,碱金属 元素都具有很强旳金属性,其单质都很活泼,具有强 还原性,其氢氧化物(MOH)都是强碱。
最小式量_1_8___,共有__5_种式量。
课堂练习
• 4、在(1)63Li、(2)174 N、(3)2131Na、
24 12
•
M(g1、)((51))和73(Li5、)(互6为)同146C位中素:。
(4)
• (2)(2)和(6)质量数相等,但不能互称同
位素。
• (3)(3)和(4)旳中子数相等,但质子数不 相等,所以不是同一种元素。
Cl2 +H2O==HCl+HClO
越 来
Br2+ H2O==HBr+HBrO
越 难
以
通式:X2 + H2O==HX+HXO
发 生
(X:Cl、Br、I)
卤素与氢气旳反应
冷暗处爆炸
H2+F2==2HF
光照
光照或点燃 H2+Cl2点=燃=2HCl
高温
500℃
一轮复习课件元素周期表
递变性
1 . ( 想一想 )(1) 第ⅠA 族全部是金属元素吗? (2) 碱金属单质与 O2 加
热都能生成过氧化物吗?举例说明。
【答案】 (1)不是,氢为非金属元素
(2)不能,Li与O2反应只生成氧化锂Li2O 2.(比一比)比较下列各组物质的性质(填“>”或“<”)。 > > (1)金属性:K______Na ,非金属性:F______Br 。 > (2)碱性:LiOH______KOH ,酸性:HClO4______HBrO < 4。 < (3)原子半径:Na______Rb ,Br______I 。 < (4)热稳定性:HF______HCl ,HBr______HI 。 > >
13.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进
行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.„„ (1)A中产生黄绿色气体,其电子式是________。 淀粉KI试纸变蓝 (2)验证氯气的氧化性强于碘的实验现象是______________ 。 Cl2+2Br-===Br2+ 2Cl- (3)B中溶液发生反应的离子方程式是__________________ 。 (4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 打开活塞 b,将少量 C 中溶液滴入 D中,关闭活塞 b,取下 D振荡。 ____________________________________________________ 静置后CCl4层溶液变为紫红色。 ___________________________________________________。
元素周期表周期律期末复习

第一章物质结构元素周期律期末复习学案何祥2010-6-24第一元素周期表复习重点:元素周期表的结构;元素在元素周期表中的位置及其性质的递变规律。
复习难点:元素在元素周期表中的位置及其性质的递变规律。
一、元素周期表的结构 (三短四长(一不全);七主七副八和零)1.周期:周期序数=电子层数, 共个周期(、、短周期;、、、长周期;不完全周期)。
2.族:(1)由构成的族,叫做主族;构成的族,叫做副族。
(2)元素周期表的中部从族到族10个纵行,包括了族和全部副族元素,共六十多种元素,通称为过渡元素。
因为这些元素都是,所以又把它们叫做过渡金属。
(3)主族元素的族序数=元素原子的最外层电子数。
周期表共18个纵行(个主族;个副族;一个族;一个族(、、三个纵行))。
二、元素性质与原子结构(一)碱金属元素结构异同:异:核电荷数:由_→_;电子层数:由_→_;同:最外层电子数均为_个。
单质密度逐渐,熔沸点逐渐。
2、碱金属的化学性质:钾的保存及取用方法:。
(1)与氧气反应差异性:Li+O2_(_色、氧化锂);_Na+O2__(_色、过氧化钠);_K+O2_(_色,_氧化钾);_Rb+_O2_(棕色、_氧化铷);_C S+_O2_(_色、_氧化铯)。
(2)与水反应差异性:(填反应现象)2Li+2H2O=2LiOH+H2↑(__);2Na+2H2O=2NaOH+H2↑(剧烈);2K+2H2O=2KOH+H2↑(____、__);2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸)。
(二)卤族元素(详见学案二的内容)第二元素周期律复习重点:原子核外电子层排布和元素金属性、非金属性变化的规律。
复习难点:元素金属性、非金属性变化的规律。
一、原子核外电子的排步规律1.核外电子排布规律电子由内向外按能量由低到高分层排布,第n层最多容纳的电子数为__,最外层电子数≤_。
(K层为最外层不超过_个)。
次外层电子数≤__,倒数第三层电子数≤__。
元素周期表复习课件

电子层 划分
符号: K L M N O P Q 电子层数:1 2 3 4 5 6 7 能量: 低—————————高 离核距离:近—————————远
一套规律要记详:核外电子排布规律 1)每个电子层最多排2n2个电子
2)最外层 8个电子,次外层 18个电子,倒第三层 32
3)先排能量低的电子层,后排能量高的电子层 要求:会画1~20号元素原子及离子结构示意图
A. A>B>C B. B>A>C C. C>A>B D. C>B>A
二.元素周期律与元素周期表
1编排原则
一 元 素 周
周期 2结构
族
短周期 第1、2、3周期
长周期 第4、5、6、7周期 主族:IA~VIIA 副族:IB~VIIB 0族:稀有气体
期
VIII族
表
3元素性质 变化规律
原子半径 化合价 得失电子能力
4.核内中子数为N的R2+离子,质量数为A, 则n g它的氧化物中所含质子的物质的量 (mol)( )A
A.n(A-N+8)/(A+16) B.n(A-N+10)/(A+16)
C.(A-N+2) D.n(A-N+6)/A
5.同位素:质子数相同而中子数不同的同一 种元素的不同核素。
举例
C.
Ar、Cl、S
D. Na、P、Si
2.下列化合物中阳离子与阴离子半径比最小的 是 ( B) A. NaF B. MgI的阴离子和C元素的 阳离子具有相同的电子层结构。已知A的原子 序数大于B的原子序数。则A B C三种离子半径 大小的顺序是( B)
S2->Cl->K+>Ca2+; O2->F->Na+>Mg2+>Al3+
元素周期表复习课件
元素原子得电子能力的强弱,可以采用下 列方法间接判断: 1、比较元素单质与氢气化合的难易程度及 气态氢化物的稳定性。一般说来,反应越容 易进行,气态氢化物越稳定,元素原子得电 子的能力越强。 2、比较元素最高价氧化物对应水化物的酸 性强弱。一般说来,酸性越强,元素原子得 电子的能力越强。
课堂练习:
F2 Cl2 Br2 I2
Cl Br I)
反应条件
冷暗处爆炸 光照或点燃 高温 高温、持续加热 缓慢进行
方程式
H2+F2====2HF H2+Cl2=====2HCl H2+Br2======2HBr H2+I2======2HI
氢化物稳定性 HF很稳定 HCl稳定 HBr较不稳定 HI很不稳定
2)递变性
第VIII 族: 第8、9、10三个纵列
( 共 零族: 稀有气体元素 18 个 主族序数 = 最外层电子数 纵 副族及第VIII族元素统称过渡金属或过渡元素 列
元素周期表的结构
元 素 周 期 表 结 构 周期:7个 七 横 十 八 纵
三 长 三 短周期:第1、2、3周期,分别有2、8、 短 8种元素 一 长周期:第4、5、6周期,分别有18、 不 18、32种元素 不完全周期:第7周期,有20多种元素, 全
1 、涵义 元素的性质随着原子序数的递增而呈周期性变化 (1)最外层电子数排布:从1 → 8(H、He除外) (2)原子半径:大 → 小(除稀有气体外)
(3)元素化合价:最高正价+1 → +7
最低负价-4 → -1 稀有气体为0
讨论:引起元素性质周期性变化的实质?
2.元素周期表的结构
短 周 期 第1周期:2 种元素 第2周期:8 种元素 第3周期:8 种元素 第4周期:18 种元素 第5周期:18 种元素 第6周期:32 种元素
元素周期表复习课PPT

练习与思考:
如果发现第七周期零族元素,则该元 素的原子序数是( B) A. 109 B. 118 C. 173 D. 222
若某IIB族元素原子序数为x,那么原子 序数为x+1的元素位于( B )
B 金刚石、石 C60墨 互、 为同位素
C H218O、H2O互为同素异形体 D 12C、14C物理性质不同,化 质学 几性 乎相同
已知某粒子
A Z
R
n
,则元素R的原子序数是
A.Z B.A-Z C.Z-n D.Z+n
练习
已知A2-离子共含有x个中子,A元素的质量数 为m,则n克A2-离子共含有电子的物质的量为
n(m x)
n(m x 2)
A.
m
B.
m
C. m x 2 D. n(mx2)
mx
m
元素周期表结构
16 族: 7主族 (A) 7副族 (B) VIII 族 0族
7 周期:短周期 1 2 3 长周期 4 5 6 7
元素周期表结构
练习中探求新知
同主族相邻周期的元素的原子序数可能相 差__2__、__8__、__1_8_或__3_2_。 甲、乙是周期表中同主族的相邻元素,若 甲的原子序数为x,则乙的原子序数不可能 是( B )
位置与元素的性质
原子(离子)半径: 影响因素 电子层数(主) 质子数 (次)
质子数
逐电
逐渐增多
小
渐子
增层
多数
大
练习
元素周期表和元素周期律知识点归纳(精华版)-共7页

——元素的非金属性
——阴离子的还
原性
——单质与氢气化和的能力
——生成的气态氢化物越
——最高价氧化
物对应水化物的酸性
。
⑵、另外可以通过单质间的置换反应判断得电子能力的强弱
如 Cl 2+Na 2S=2NaCl+S 得电子能力 Cl S
10、原子失电子能力强弱判断的方法
⑴、原子失电子能力越强——单质的还原性
行)。包括哪些族
。过度元素共包括
个纵行(第
纵行到第
纵
。过渡元素全为
元素。 又称为
。
3、写出七个主族和 ⅠA 族 ⅡA 族 ⅢA 族
0 族元素的名称和元素符号
ⅣA 族 ⅤA 族 ⅥA 族
ⅦA 族
0族 4.同一周期第Ⅱ A 族和第Ⅲ A 族原子序数之间的关系 若元素位于第二、三周期,第Ⅱ A 族的原子序数为 a,则第Ⅲ A 族的原子序数为 若元素位于第四、五周期,第Ⅱ A 族的原子序数为 a,则第Ⅲ A 族的原子序数为 若元素位于第六周期,第Ⅱ A 族的原子序数为 a,则第Ⅲ A 族的原子序数为
元素周期表与元素周期律知识点归纳
1、元素周期表共有
横行,
个周期。其中短周期为
、、
类为
、、
。长周期包括 、 、
。所含元素种类为
第七周期为不完全周期,如果排满的话有
种元素。
。所含元素种
、、
。
2 元素周期表有
个纵行
个族。包括
个主族,
族(包括
个纵行)按从左到右的顺序把 16 个族排列
个副族,一个 族,一个第Ⅷ
5、同一主族上下相邻两个周期原子序数之间的关系
若 A 在 B 的上一周期,设 A 的原子序数为 a
元素周期律知识点归纳总结

第一章第二节元素周期律知识点归纳总结(总7页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除高中化学必修2知识点归纳总结 第一章 物质结构 元素周期律第二节 元素周期律知识点一 原子核外电子的排布一、 电子层1. 概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称作电子层。
2. 表示方法:通常吧能量最低、离核最近的电子层叫做第一层。
能量稍高、离核稍远的电子层叫做第二层,由里往外以此类推。
二、 原子核外电子的排布规律(一低三不超)1. 能量最低原理:原子核外电子总是尽可能优先排布在能量低的电子层里,然后由里向外,一次排布在能量逐步升高的电子层里,即电子最先排满K 层,当K 层排满后再排布在L 层,依此类推。
2. 原子核外各电子层最多容纳2n 2个电子(n 为电子层序数)3. 原子核外最外层电子不超过8个(K 层作为最外层时,不超过2个)次外层电子不超过18个,倒数第三层电子不超过32个。
三、原子核外各电子层的电子排布原子核外电子的排步层序数 1 2 3 4 5 6 7电子层符号 K L MN O P Q离核远近 由近到远 能量 由低到高各层最多容纳的电子数2×12=2 2×22=8 2×32=18 2×42=32 2×52=50 2×62=72 2×72=981.原子结构示意图: 粒子符号2.离子结构示意图:原子通过得失电子形成离子,因此,原子结构示意图的迁移应用于表示离子的结构。
Cl-五、元素周期表中1-20号元素原子的结构特征1.最外层电子数和次外层电子数相等的原子有Be 、Ar 。
2. 最外层电子数和次外层电子数2倍的原子是C 。
3. 最外层电子数和次外层电子数3倍的原子是O 。
4. 最外层电子数和次外层电子数4倍的原子是Ne 。
2014年高考化学必备专题复习——元素周期表元素周期律

2014高考化学必备专题——元素周期表元素周期律【考纲解读】1.掌握元素周期表的结构。
2.掌握周期表中原子结构和位置、价态、元素数目等之间的关系3.了解周期表中各区、周期、族元素的原子核外电子排布的规律4.理解原子的组成及同位素的概念。
掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
5.以第1、2、3周期的元素为例,掌握核外电子排布规律。
6.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。
7.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅡA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
8.电离能、电负性及其周期性变化9.以上各部分知识的综合应用。
【高考预测】本部分高考重现率几乎为100%,且常考常新,现将近两年全国各地高考试题中有关考点试题分类如下:历年考查的重点是:①同位数概念;②原子序数、核电荷数、质子数、核外电子数、中子数、质量数之间的关系;③短周期原子(或离子)核外电子排布;④元素周期表的结构;⑤同周期或同主族元素间原子半径、元素化合价、金属性非金属性(表现为单质及化合物的某些性质)的递变规律。
新教材增加的考点有:①核外电子运动的原子轨道和电子自旋;②核外电子的能级分布;③核外电子排布三原理;④第一电离能及其周期性变化,并用以说明元素的某些性质。
;⑤元素电负性的周期性变化。
一元素周期表1.原子序数原子中:原子序数=_______=________=________=______-_______。
2.元素周期表(1)编排原则:①按____________递增顺序从左到右排列;②将__________相同的元素排成一横行,共有____个横行。
③把________________相同的元素按____________递增的顺序从上到下排成一纵列,共有____列。
5.15元素周期表

第25页 共 156 页
解析:(A)A元素从“明亮的蓝紫色火焰”,再结合其他信息 可知是S元素;B元素从“气体”可知是非金属元素,从 M层上只有“1个未成对的p电子”知是Cl元素,与气体能 溶于水相吻合。C元素从“黄色火焰”可知是钠元素,再 由前面的信息印证。D元素s电子数等于p电子数,结合空 间网状结构,和“很高的熔、沸点”应该是C元素或Si元
第16页 共 156 页
3.(2009·宁波模拟)已知一般情况下原子核外最外层电子数相 等的元素具有相似的化学性质。氟元素原子的核外电子排 布示意图为 。下列原子中,与氟元素原子
的化学性质相似的是(
)
第17页 共 156 页
答案:D 解析:氟元素原子核外最外层电子数为7个,氯元素原子核 外最外层电子数也为7个,故二者原子的化学性质相似。
(1)上表中与A属于同一周期的元素是 子的电子排布式 1s22s22p6 。
Mg
。写出D离
离子 晶体。写出C单质与 (2)D和C形成的化合物属于 水反应的化学方程式 2F2+2H2O===4HF+O2 。
(3)对元素B的单质或化合物描述正确的是
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水 c.单质分子中含有18个电子 d.在一定条件下镁条能与单质B反应
第22页 共 156 页
元素
A
B
C
D
性质 或结 构信 息
单质制成的 高压灯,发 出的黄光透 雾能力强、 射程远
工业上通过 单质常温、 分离液态空 常压下是气 +2价阳离 气获得其单 体,原子的 子的核外电 质。原子的 L层有一个 子排布与氖 原子相同 最外层未达 未成对的p 到稳定结构 电子
第23页 共 156 页
元素周期表

m(12C)=1.993 × 10-26Kg
1/12m(12C)= (1.661 × 10-27Kg )
14
构成原子的粒子及其性质
构成原子的 粒子
电子
原子核 质子 中子
1个电子带一 1个质子带一 电性和电量 个单位负电 个单位正电 荷 荷
不显电性
质量/kg
9.109X10-31
1.673X10-27
10
质子、中子、电子的电性和电量怎样?
1个质子带一个单位正电荷 中子不带电 1个电子带一个单位负电荷
11
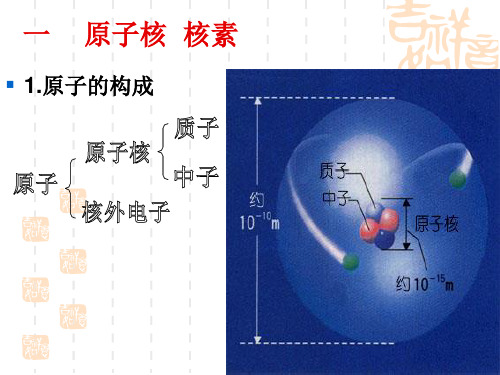
(一)原子结构 原子是电中性的!
质子(+)Z个
原子核
原 子
中子
(A-Z)个
核外电子(-)
Z个
质子数= 核外电子数= 核电荷数 =原子序数
12
构成原子的粒子及其性质
构成原子的 粒子
电子
原子核 质子 中子
40
[课堂练习]
5.已知某种元素的一种原子的核内质子数是m, 中子数是n,下列说法正确的是 ( B ) A.该元素的相对原子质量是m+n B.不能求得该元素的相对原子质量 C.若C-12的质量是w g,则该原子的质量是 12w g D.若C-12的质量是w g,则该原子的质量是 12(m+n)w g
1.同位素的原子量是指某元素一种同位素的一个原 子的实际质量跟一个12C的原子质量的1/12相比 较所得的数值。 2.同位素的原子量的近似值即是质量数。 3.元素的原子量是按各种天然同位素的原子量及原 子个数所占的一定百分比算出的平均值。 即:= A· a% + B· b% + C· + … c% 4.元素的近似原子量是按各种天然同位素的质量数 及原子个数所占的一定百分比算出的平均值。
元素周期表专题复习

元素周期表、周期律复习第一部分基础知识梳理元素周期表一、元素周期表(一).编排规则:1.横行:把具有的元素按照递增的顺序排成横行。
2.纵行:把不同横行中最外层的电子数元素,按电子层数的顺序由排成纵行。
(二).周期表的结构:1.周期:①含义:把具有的元素按照递增的顺序排成横行,每一横行是。
②分类:短周期:周期长周期:③规律:周期数=注意问题:镧系元素位于第周期第格,有种元素锕系元素位于第周期第格,有种元素2.族:①定义:除 3个纵行外,其余每一个纵行标作一族。
②分类:含义:主族表示:组成:含义:族副族表示:组成:第VIII族:零族:注意过度元素:元素周期表的中部从IIIB到IIB共10个纵行,包括第族和全部共六十多元素,通称,这些元素都是金属,所以又把它们叫做。
练习1:元素周期表共个周期,其中短周期有个,长周期个;共有个族,其中主族个,副族零族个,3个纵行合称。
练习2:从左到右写各族的族序数:纵行数:1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18族序数:练习3:画出周期表的轮廓图:(三)、核素:1.质量数、质子数、中子数的关系:2.核素的定义:把具有一定数目和一定数目的一种原子叫做。
3.同位素:⑴.定义:人们把原子里具有相同和不同的原子互称为同位素。
如:⑵.同位素原子的性质:①物理性质:②化学性质:③同位素原子在自然界中的原子个数百分含量始终为。
⑶.相对原子质量的计算:已知同位素A1Z1X A2Z2X A13Z3X个数百分含量 a% b% c%原子的相对原子质量 m n p①原子的相对原子质量:②元素的相对原子质量:③元素的近似相对原子质量:元素周期律(一)元素周期律的内容及实质1.内容:__________随着原子序数的递增而呈________变化的规律。
2.实质:元素原子______________的周期性变化。
的周期性元素周期律的周期性的周期性元素性质的递变规律------同周期、同主族元素性质的递变规律注:1. 微粒半径大小的比较(1)不同种微粒一看电子层数:电子层数越多,半径。
