初三化学化合物大全
初中常见化学式大全63224
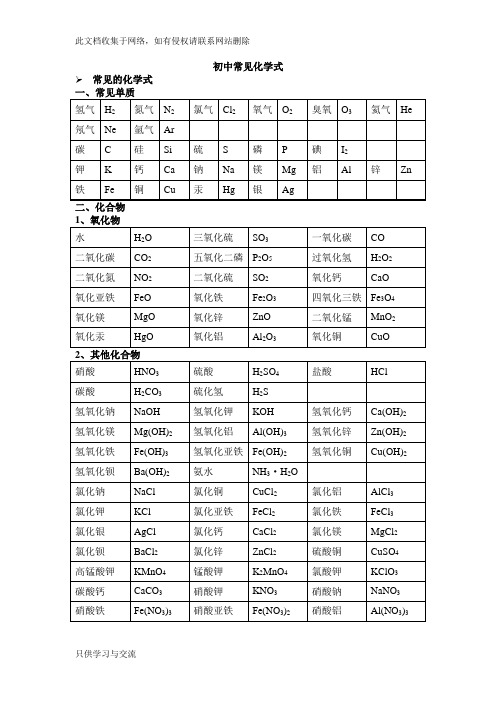
初中常见化学式➢常见的化学式初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2点燃 2CO9、二氧化碳通过灼热碳层:2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K22+O2↑172O 通电 2H2↑+O2↑1823 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4== ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2+CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2+3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233:Ca(OH)2+ CO2==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3+H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2+H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O+CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H22点燃 2H2O6. 红磷在空气中燃烧:2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:2点燃 CO29. 碳在氧气中不充分燃烧:2点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO22H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO215.3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H232O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑ 2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:34高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe23高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:34高温 3Fe+ 4CO2(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4= FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4= MgSO4+H2↑29. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2=== Cu(NO3)2+Hg(3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4=== Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3+H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3+3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2==== CuSO4+2H2O57. 硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4=== Na2SO4+H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4+BaCl2==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3=== CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO45H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H24·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O 3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4甲烷和天然气的燃烧2C2H2+ 5O点燃2H2O +4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水4氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ4MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu223Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳Zn+ H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H 2SO 4 =MgSO 4 +H 2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H 2SO 4=Al 2(SO4)3+ 3H 2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe 2O 3+3H 2 Δ 2Fe +3H 2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢Fe 3O 4 +4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译、试管壁有液体 冶炼金属、WO 3 +3H 2Δ W +3H 2O 冶炼金属钨、利用氢气的还原性 MoO 3 +3H 2 ΔMo +3H 2O 冶炼金属钼、利用氢气的还原性2Na+ Cl 2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、 H 2 +Cl 2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸CuSO 4 +2NaOH=Cu(OH)2↓+ Na 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验2C +O 点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因 点燃2CO 2 蓝色火焰 煤气燃烧 C+ CuO 高温2Cu+ CO 2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属2Fe 2O 3+ 3C 高温4Fe+ 3CO 2↑ 冶炼金属 Fe 3O 4 +2C 高温3Fe+ 2CO 2↑ 冶炼金属 C+ CO2 高温2COCO 2+ H 223 碳酸使石蕊变红 证明碳酸的酸性小学三语文教学论文 H 2CO 3 ΔCO 2↑+ H 2O 石蕊红色褪去Ca(OH)2 +CO 2= CaCO 3↓+ H 2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁 CaCO 3 +H 2O+ CO 2 = Ca(HCO 3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化 Ca(HCO 3)2Δ CaCO 3↓+ H 2O +CO 2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.2NaHCO 3ΔNa 2CO 3+ H 2O +CO 2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头 CaCO 3 高温 CaO +CO 2↑ 工业制备二氧化碳和生石灰 CaCO 3 2+ H 2O +CO 2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢 初中化学方程式汇总 一、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg+ O 2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe+ 2O 2 点燃 Fe 3O 4 3. 铜在空气中受热:2Cu+ O 2 加热 2CuO 4. 铝在空气中燃烧:4Al +3O2 点燃2Al 2O 3 5. 氢气中空气中燃烧:2H 2 +O 2 点燃 2H 2O 6. :4P +5O 2 点燃 2P 2O 5 7. 硫粉在空气中燃烧: S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧:2 点燃 CO 2 9. 碳在氧气中不充分燃烧:2 点燃 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O 2 点燃 2CO 211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O12. 酒精在空气中燃烧:C2H52点燃 2CO2+3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2↑14.加热高锰酸钾:2KMnO4加热 K242+O2↑(实验室制氧气原理1)15 H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+O2↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:44+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO282CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3== H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑33:Ca(OH)2 +CO2=== CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO235.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO32HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2+2H2O38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2+3H2O39.氢气中空气中燃烧:2H2+ O2点燃 2H2六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4= FeSO4+H2↑46. 镁和稀硫酸Mg +H2SO4= MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4= Al2(SO4)3+3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4+Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4+Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2== Cu(NO3)2+Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3+6HCl ==2FeCl3+3H2O57. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2+H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3+3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2+H2O+ CO2↑65.碳酸钠与稀盐酸反应: Na2CO3+2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反应:H2SO4+BaCl2== BaSO4↓+2HCl2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3+H2O70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4+H2O71.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+H2O72. 消石灰吸收二氧化硫:Ca(OH)2 +SO 2 == CaSO 3↓+ H 2O (2)碱 酸-------- 盐 水(中和反应,方程式见上) (3)碱 盐 -------- 另一种碱 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液) 金属单质------- 另一种金属 另一种盐 74. 铁和硫酸铜溶液反应:Fe+ CuSO 4 == FeSO 4 +Cu (2)盐 酸-------- 另一种酸 另一种盐75.碳酸钠与稀盐酸反应: Na 2CO 3 +2HCl == 2NaCl +H 2O+ CO 2↑ 碳酸氢钠与稀盐酸反应:NaHCO 3 +HCl== NaCl+ H 2O +CO 2↑ (3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl 一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。
初中化学常用化合物

初中化学常用化合物
哎呀,说起初中化学常用化合物,那可真是让我这个小学生好奇又有点头疼呢!
你想想,那些化合物就像是一个个神秘的小精灵,藏在化学的世界里,等着我们去发现。
就拿水来说吧,这可是我们生活中最常见的化合物啦!每天都要喝水,没有水我们可怎么活呀?水不就是由氢和氧组成的嘛,H₂O ,多简单的式子呀!可是你说怪不怪,这么普普通通的水,居然能有那么多神奇的变化。
冬天的时候能变成冰,这不就是固态嘛;加热又能变成水蒸气,这就成了气态。
这难道不像孙悟空会七十二变吗?
还有二氧化碳,CO₂,植物靠它进行光合作用,给我们制造氧气。
咱们呼吸产生的二氧化碳,要是太多了,不就成了让地球变暖的“小坏蛋”了吗?这就好像一群调皮的孩子,要是没人管,就会到处捣乱。
再说说氯化钠,就是咱们吃的盐啦!没有盐,饭菜都没味道。
可你知道吗,盐在化学实验里也有大用处呢!
还有硫酸铜,蓝色的晶体,多漂亮呀!就像蓝色的宝石。
老师做实验的时候,那颜色的变化,可把我们都看呆了!
哎呀,初中化学的常用化合物可真是太多太多啦,每一个都有自己独特的脾气和特点。
它们不就像我们班级里的同学吗?有的活泼,有的安静,有的调皮,有的乖巧。
我就在想,等我以后上了初中,学习化学的时候,是不是就能更加了解这些化合物的秘密啦?我相信一定能!。
初三化学有机化合物与它们的性质

初三化学有机化合物与它们的性质化学是我们生活中非常重要且广泛应用的一门科学。
其中,有机化合物是研究的重要内容之一。
它们是由碳元素与氢元素以及其他非金属元素构成的化合物,其在自然界与人类的生活中扮演着重要角色。
本文将介绍一些常见的有机化合物及其性质。
一、醇类化合物醇是一类含有羟基(-OH)的有机化合物。
它们可以通过碳酸酯的水解得到。
举例来说,乙醇(C2H6O)是最简单的醇类化合物。
醇类化合物常用作溶剂、消毒剂以及在医药领域中的应用。
醇类化合物的性质取决于其碳骨架的长度和官能团的位置。
一般来说,醇的物理性质与其分子量有关,分子量越大,沸点和溶解度越高。
纯醇类化合物通常无色,但会受到氧化而变色。
二、醛和酮类化合物醛和酮是具有羰基(-C=O)的有机化合物。
它们的差别在于羰基的位置。
醛中,羰基位于碳链的末端,而酮中则位于碳链的中间。
最简单的醛是甲醛(HCHO),最简单的酮是丙酮(CH3COCH3)。
醛和酮常用作溶剂、防腐剂以及某些合成反应的催化剂。
它们的物理性质与醇类化合物相似,但有一些差异。
醛和酮的沸点要高于相应的醇,这是由于碳链中的羰基给分子带来了额外的极性。
三、酸类化合物酸类化合物是具有羧基(-COOH)的有机化合物。
它们通常有酸性,并可以与碱反应生成盐和水。
最简单的有机酸是甲酸(HCOOH)。
酸类化合物在生物体内起着重要的作用,如进化、代谢和信号传递等。
此外,它们还被广泛用作工业上的催化剂、试剂和溶剂。
酸类化合物的物理性质因其结构和碳链长度而异,但总体来说,它们具有较高的沸点和溶解度。
四、酯类化合物酯是一类由羧酸和醇反应生成的有机化合物。
酯分子中的羧酸部分与醇分子中的羟基反应形成酯的酯键。
最简单的酯是甲酸甲酯(HCOOCH3)。
酯类化合物具有水合度低、挥发性强的特点,因此广泛应用于食品香料、溶剂和润滑油等领域。
五、烃类化合物烃是由碳和氢元素组成的有机化合物,不含其他元素。
根据碳原子间的连接方式,烃可分为饱和烃和不饱和烃两类。
(完整)初中常见化合物化学式

初中化学基础知识梳理宋辉婵初中常见化合物化学式1、常见的酸:无氧酸:氢氯酸HCl(盐酸)氢硫酸H2S 氢氟酸HF含氧酸:硫酸H2SO4硝酸HNO3碳酸H2CO3氯酸HClO3磷酸H3PO4 亚硫酸H2SO3有机酸:乙酸(醋酸)CH3COOH2、常见碱的化学式:可溶性碱:氢氧化钾KOH 氢氧化钠NaOH 氢氧化钙Ca(OH)2 氢氧化钡Ba(OH) 2 氢氧化铵(氨水)NH3·H2O不溶性碱:氢氧化铜Cu(OH) 2 氢氧化亚铁Fe(OH) 2氢氧化镁Mg(OH) 2 氢氧化铝Al(OH) 33、常见盐的化学式:硝酸盐:硝酸钾KNO3 硝酸钠NaNO3 硝酸铵NH4 NO3硝酸铜Cu(NO3)2 硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3硝酸铝Al(NO3)3硝酸银Ag NO3硝酸镁Mg(NO3)2硝酸钙Ca(NO3)2 硝酸锌Zn(NO3)2硫酸盐:硫酸钠Na2SO4硫酸钾K2SO4硫酸铵(NH4)2 SO4硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硫酸铜CuSO4硫酸铝Al2(SO4)3硫酸锌ZnSO4硫酸镁Mg SO4硫酸钙CaSO4 硫酸钡BaSO4碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3 碳酸铵(NH4) 2 CO3碳酸铜CuCO3 碳酸钙CaCO3 碳酸钡BaCO3碳酸镁MgCO3碳酸锌ZnCO3 碳酸亚铁FeCO3盐酸盐:氯化钠NaCl氯化钾KCl 氯化铵NH4 Cl氯化钙CaCl2氯化钡BaCl2 氯化锌ZnCl2氯化铝AlCl3氯化铜CuCl2氯化铁FeCl3氯化亚铁FeCl2氯化镁MgCl2氯化银AgCl其他常用盐:高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3 碱式碳酸铜Cu2(OH) 2CO3 常用氧化物的化学式:金属氧化物:氧化铁Fe2O3 氧化亚铁FeO 四氧化三铁Fe3O4氧化铜CuO 氧化亚铜Cu2O 氧化铝Al2O3氧化镁MgO 氧化锌ZnO 氧化钙CaO 氧化钠Na2O非金属氧化物:氧化氢(水)H2O一氧化碳CO二氧化碳CO2二氧化硫SO2 三氧化硫SO3一氧化氮NO 二氧化氮NO2五氧化二氮N2O5 五氧化二磷P2O5过氧化物:过氧化氢H2O2 过氧化钠Na2O2 过氧化钙CaO2其他:甲烷:CH4 甲醇CH3OH 乙醇:C2H5OH有刺激性气味的气体:NH3SO2HCl有毒的气体:CO污染性气体:CO SO2NO2(空气中原有的成分都不是污染性气体)常见物质的主要成分及俗名物质及主要成分:石灰石、大理石、鸡蛋壳、水垢:CaCO3食盐:NaCl 食醋:CH3COOH 铁锈:Fe2O3天然气、沼气、瓦斯:CH4 草木灰:K2CO3水煤气:(H2、CO)煤气:CO 焦炉煤气:(CH4、H2、CO)福尔马林:30%--40%的甲醛溶液生理盐水:0.9%的NaCl溶液碱石灰:CaO和NaOH的混合物常见物质的俗名:干冰:固态CO2水银:Hg 火碱、烧碱、苛性钠:NaOH纯碱、碱面、苏打:Na2CO3 小苏打:NaHCO3熟石灰、消石灰、石灰水的溶质:Ca(OH)2胆矾、蓝矾:CuSO4·5H2O 绿矾:FeSO4·7H2O酒精:乙醇C2H5OH 醋酸:乙酸CH3COOH工业盐:亚硝酸钠NaNO2 工业酒精:CH3OH常见物质的颜色:1、白色固体: MgO P2O5KClO3 KCl NaCl Na2CO3 NaOH Ca(OH)2 CaO 无水CuSO4 纯铁镁带2、黑色固体:CuO Fe3O4 MnO2K2MnO4铁粉碳粉石墨3、红色固体: 红磷(P) Cu 铁锈(Fe2O3)4、黄色:硫磺(S)5、绿色:碱式碳酸铜Cu2(OH) 2CO36、紫黑色:KMnO4常见的有色离子:1、Cu2+:存在的溶液呈蓝色2、Fe2+:存在的溶液呈浅绿色3、Fe3+:存在的溶液呈棕黄色MnO4ˉ:存在的溶液呈紫红色常见沉淀及其颜色:白色沉淀:CaCO3 、BaCO3、BaSO4 、AgCl(不溶于稀硝酸)Mg(OH) 2 、Al(OH) 3蓝色沉淀:Cu(OH) 2 Cu CO3红褐色沉淀:Fe(OH) 3常见气体的检验O2:带火星的木条,观察其是否复燃CO2:澄清的石灰水,观察其是否变浑浊H2:燃着的木条,观察期是否产生淡蓝色火焰H2O:无水CuSO4粉末,观察其是否变蓝NH3:湿润的红色石蕊试纸,观察其是否变蓝常见干燥剂的选择1、浓硫酸:酸性干燥剂,不能用来干燥碱性气体。
初中化学常见化合物知识总结

初中化学常见化合物知识总结化学是一门研究物质组成、结构、性质以及变化规律的科学。
在初中化学学习中,我们接触到了许多常见的化合物。
本文将对一些常见的化合物进行知识总结,旨在帮助初中学生更好地理解化学知识。
1. 水(H2O):水是生命之源,也是一种普遍存在的化合物。
水分子由两个氢原子和一个氧原子组成。
它具有高比热、高热导率和高表面张力等特性,使其在许多生活和工业应用中发挥重要作用。
2. 盐(NaCl):盐是一种常见的离子化合物。
盐可以通过饮食获取,也可以通过化学合成得到。
盐分子由一个钠离子和一个氯离子组成。
盐具有调味品的作用,同时在化学实验和工业生产中也有广泛的应用。
3. 酸(如盐酸、硫酸):酸是一类常见的化合物,其味道酸酸的。
酸可以与碱反应产生盐和水,这种反应被称为中和反应。
酸具有腐蚀性,并可以在化学实验和工业中用于溶解金属、清洁和消毒等方面。
4. 碱(如氢氧化钠):碱是与酸相对应的化合物,其味道苦。
碱可以中和酸,形成盐和水。
碱也具有腐蚀性,可用于清洁和除去腐蚀物等方面。
氢氧化钠是一种常见的碱,常用于肥皂制造和校准实验室酸度。
5. 二氧化碳(CO2):二氧化碳是一种常见的无机化合物,存在于大气中。
它是一种无色、无味、无毒的气体,常由燃烧或呼吸过程中产生。
二氧化碳是温室气体之一,过量排放会导致全球变暖和气候变化。
6. 氨(NH3):氨是一种常见的无机化合物,存在于氮肥中。
它是一种无色气体,具有刺激性气味。
氨具有碱性,可与酸发生中和反应。
氨在肥料中被植物吸收,起到促进植物生长的作用。
7. 酒精(乙醇,C2H5OH):酒精是一种常见的有机化合物,常见于酒类和洗手液中。
酒精具有挥发性和易燃性。
它在化学实验和医药领域中有广泛的应用,同时也是一种常见的毒品。
8. 糖类(如葡萄糖、果糖):糖类是一类常见的有机化合物,是身体能量的重要来源。
葡萄糖和果糖是常见的单糖,它们在体内可以通过新陈代谢产生能量。
糖类也是食物和饮料中的重要成分,提供甜味和能量。
初中化学常见化合物知识点整理

初中化学常见化合物知识点整理在初中化学学习过程中,我们会接触到许多常见的化合物。
本文将对一些常见化合物的知识点进行整理,帮助读者更好地理解和记忆这些化合物的性质和用途。
1. 水(H2O):水是由氧元素和氢元素组成的化合物。
水是生命之源,是地球上最常见的物质之一。
它具有许多独特的性质,如极性溶剂、高比热和表面张力。
2. 盐酸(HCl):盐酸是一种无机酸,由氢元素和氯元素组成。
盐酸是一种强酸,常用于实验室中进行酸碱滴定实验。
它可以与碱中和生成盐和水。
3. 硫酸(H2SO4):硫酸是一种无机酸,由氢元素、硫元素和氧元素组成。
硫酸是一种强酸,广泛应用于工业生产和实验室中。
它具有腐蚀性,需要注意安全使用。
4. 氨气(NH3):氨气是一种无机化合物,由氮元素和氢元素组成。
它具有刺激性气味,可以与水反应生成氨水。
氨气在工业上被用作肥料和制冷剂。
5. 氧气(O2):氧气是一种无色、无味的气体,是空气中最常见的成分之一。
氧气是化石燃料燃烧和生物呼吸的重要来源。
它还可以被用于氧化反应和呼吸设备中。
6. 二氧化碳(CO2):二氧化碳是一种无色、无味的气体,由碳元素和氧元素组成。
它存在于空气中和许多碳酸饮料中。
二氧化碳在光合作用中起着重要的角色。
7. 硝酸(HNO3):硝酸是一种无机酸,由氢元素、氮元素和氧元素组成。
硝酸是强氧化剂,具有腐蚀性。
它广泛用于制造肥料、火药和炸药。
8. 氯化钠(NaCl):氯化钠是一种无机化合物,由钠元素和氯元素组成。
氯化钠是食盐的主要成分,也被广泛用于食品加工和化学实验中。
9. 硝酸铜(Cu(NO3)2):硝酸铜是一种无机化合物,由铜元素、氮元素和氧元素组成。
硝酸铜常用于实验中作为试剂,并在制备镀铜、颜料和染料方面发挥重要作用。
10. 乙醇(C2H5OH):乙醇是一种有机化合物,由碳元素、氢元素和氧元素组成。
乙醇是一种重要的溶剂和工业原料,在制备酒精饮料和消毒剂方面具有广泛应用。
以上是初中化学学习中常见的一些化合物的知识点整理。
初中常见化合物化学式

初中化学基础知识梳理宋辉婵初中常见化合物化学式1、常见的酸:无氧酸:氢氯酸HCl(盐酸)氢硫酸H2S 氢氟酸HF含氧酸:硫酸H2SO4硝酸HNO3碳酸H2CO3氯酸HClO3磷酸H3PO4 亚硫酸H2SO3有机酸:乙酸(醋酸)CH3COOH2、常见碱的化学式:可溶性碱:氢氧化钾KOH 氢氧化钠NaOH 氢氧化钙Ca(OH)2 氢氧化钡Ba(OH) 2 氢氧化铵(氨水)NH3·H2O不溶性碱:氢氧化铜Cu(OH) 2 氢氧化亚铁Fe(OH) 2氢氧化镁Mg(OH) 2 氢氧化铝Al(OH) 33、常见盐的化学式:硝酸盐:硝酸钾KNO3 硝酸钠NaNO3 硝酸铵NH4 NO3硝酸铜Cu(NO3)2 硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3硝酸铝Al(NO3)3硝酸银Ag NO3硝酸镁Mg(NO3)2硝酸钙Ca(NO3)2 硝酸锌Zn(NO3)2硫酸盐:硫酸钠Na2SO4硫酸钾K2SO4硫酸铵(NH4)2 SO4硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硫酸铜CuSO4硫酸铝Al2(SO4)3硫酸锌ZnSO4硫酸镁Mg SO4硫酸钙CaSO4 硫酸钡BaSO4碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3 碳酸铵(NH4) 2 CO3碳酸铜CuCO3 碳酸钙CaCO3 碳酸钡BaCO3碳酸镁MgCO3碳酸锌ZnCO3 碳酸亚铁FeCO3盐酸盐:氯化钠NaCl氯化钾KCl 氯化铵NH4 Cl氯化钙CaCl2氯化钡BaCl2 氯化锌ZnCl2氯化铝AlCl3氯化铜CuCl2氯化铁FeCl3氯化亚铁FeCl2氯化镁MgCl2氯化银AgCl其他常用盐:高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸氢钠NaHCO3碳酸氢铵NH4HCO3 碱式碳酸铜Cu2(OH) 2CO3 常用氧化物的化学式:金属氧化物:氧化铁Fe2O3 氧化亚铁FeO 四氧化三铁Fe3O4氧化铜CuO 氧化亚铜Cu2O 氧化铝Al2O3氧化镁MgO 氧化锌ZnO 氧化钙CaO 氧化钠Na2O非金属氧化物:氧化氢(水)H2O一氧化碳CO二氧化碳CO2二氧化硫SO2 三氧化硫SO3一氧化氮NO 二氧化氮NO2五氧化二氮N2O5 五氧化二磷P2O5过氧化物:过氧化氢H2O2 过氧化钠Na2O2 过氧化钙CaO2其他:甲烷:CH4 甲醇CH3OH 乙醇:C2H5OH有刺激性气味的气体:NH3SO2HCl有毒的气体:CO污染性气体:CO SO2NO2(空气中原有的成分都不是污染性气体)常见物质的主要成分及俗名物质及主要成分:石灰石、大理石、鸡蛋壳、水垢:CaCO3食盐:NaCl 食醋:CH3COOH 铁锈:Fe2O3天然气、沼气、瓦斯:CH4 草木灰:K2CO3水煤气:(H2、CO)煤气:CO 焦炉煤气:(CH4、H2、CO)福尔马林:30%--40%的甲醛溶液生理盐水:0.9%的NaCl溶液碱石灰:CaO和NaOH的混合物常见物质的俗名:干冰:固态CO2水银:Hg 火碱、烧碱、苛性钠:NaOH纯碱、碱面、苏打:Na2CO3 小苏打:NaHCO3熟石灰、消石灰、石灰水的溶质:Ca(OH)2胆矾、蓝矾:CuSO4·5H2O 绿矾:FeSO4·7H2O酒精:乙醇C2H5OH 醋酸:乙酸CH3COOH工业盐:亚硝酸钠NaNO2 工业酒精:CH3OH常见物质的颜色:1、白色固体: MgO P2O5KClO3 KCl NaCl Na2CO3 NaOH Ca(OH)2 CaO 无水CuSO4 纯铁镁带2、黑色固体:CuO Fe3O4 MnO2K2MnO4铁粉碳粉石墨3、红色固体: 红磷(P) Cu 铁锈(Fe2O3)4、黄色:硫磺(S)5、绿色:碱式碳酸铜Cu2(OH) 2CO36、紫黑色:KMnO4常见的有色离子:1、Cu2+:存在的溶液呈蓝色2、Fe2+:存在的溶液呈浅绿色3、Fe3+:存在的溶液呈棕黄色MnO4ˉ:存在的溶液呈紫红色常见沉淀及其颜色:白色沉淀:CaCO3 、BaCO3、BaSO4 、AgCl(不溶于稀硝酸)Mg(OH) 2 、Al(OH) 3蓝色沉淀:Cu(OH) 2 Cu CO3红褐色沉淀:Fe(OH) 3常见气体的检验O2:带火星的木条,观察其是否复燃CO2:澄清的石灰水,观察其是否变浑浊H2:燃着的木条,观察期是否产生淡蓝色火焰H2O:无水CuSO4粉末,观察其是否变蓝NH3:湿润的红色石蕊试纸,观察其是否变蓝常见干燥剂的选择1、浓硫酸:酸性干燥剂,不能用来干燥碱性气体。
初中常见化合物化学式

初中常见化合物化学式
化学是一门研究物质结构、组成和性质的科学。
在研究化学过
程中,我们会遇到各种各样的化合物。
本文将介绍一些初中常见的
化合物以及它们的化学式。
盐类化合物
盐类化合物是由阳离子和阴离子组成的化合物。
常见的盐类化
合物有:
1. 氯化钠(NaCl):也被称为食盐,是一种晶体固体,呈白色
结晶。
2. 碳酸钠(Na2CO3):也被称为纯碱,常见于洗衣粉中,可
以中和酸性物质。
3. 硫酸铜(CuSO4):呈蓝色结晶,常用于制备其他铜化合物。
金属氧化物
金属氧化物由金属阳离子和氧阴离子组成。
以下是一些常见的
金属氧化物:
1. 氧化铁(Fe2O3):也被称为赤铁矿,呈红色固体,常见于
土壤和矿石中。
2. 氧化铝(Al2O3):也被称为氧化铝土,是铝的主要氧化物,常见于土壤和岩石中。
酸类化合物
酸类化合物含有H+离子,可以与碱发生中和反应。
以下是一
些常见的酸类化合物:
1. 硫酸(H2SO4):是一种无色液体,具有强酸性,常用于实
验室中。
2. 氢氯酸(HCl):也被称为盐酸,是一种无色气体,具有刺
激性气味,常用于清洗金属表面。
以上只是一些初中常见的化合物化学式。
在学习化学过程中,我们还会了解到更多种类的化合物和它们的化学式。
通过掌握这些化学式,我们可以更好地理解和应用化学知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学化合物大全
一、氧化物
氧化物是指由两种元素组成,其中一种元素为氧元素的化合物。
常见的氧化物包括:
1. 二氧化碳(CO2):无色无味的气体,能溶于水,形成碳酸。
2. 二氧化硫(SO2):无色有刺激性气味的气体,易溶于水,形成亚硫酸。
3. 三氧化硫(SO3):无色固体,有酸性氧化物的性质,与水反应生成硫酸。
4. 一氧化氮(NO):无色无味的气体,与氧气反应生成二氧化氮。
5. 二氧化氮(NO2):红棕色有刺激性气味的气体,与水反应生成硝酸和一氧化氮。
6. 氧气(O2):无色无味的气体,化学性质比较稳定,可助燃。
7. 臭氧(O3):蓝色有特殊气味的气体,化学性质活泼,能氧化其他物质。
二、酸碱盐
酸碱盐是初三化学的重要内容之一,常见的酸碱盐包括:
1. 盐酸盐酸盐酸(盐)包括各种金属离子(或铵根离子)和酸根离子构成的化合物。
根据酸根离子的不同,可以将盐分为正盐、酸式盐和碱式盐。
其中,正盐是指酸根离子与金属离子(或铵根离子)结合而成的化合物,例如氯化钠、硫酸钾等;酸式盐是指酸中的氢离子部分被金属离子(或铵根离子)取代后形成的化合物,例如碳酸氢钠、磷酸二氢钾等;碱式盐是指金属离子(或铵根离子)部分被酸根离子取代后形成的化合物,例如碱式碳酸铜等。
2. 酸是指在水中电离时阳离子完全是氢离子且能使紫色石蕊试液变红的化合物。
根据组成的不同,可以将酸分为有机酸和无机酸两大类。
其中,有机酸是指含有碳原子的酸性化合物,例如乙酸、苯甲酸等;无机酸是指不含有碳原子的酸性化合物,例如硫酸、盐酸盐酸等。
3. 碱是指在水中电离时阴离子完全是氢氧根离子的化合物。
根据组成的不同,可以将碱分为可溶性碱和不溶性碱两大类。
其中,可溶性碱是指能溶于水的碱,例如氢氧化钠、氢氧化钾等;不溶性碱是指不溶于水的碱,例如氢氧化铜、氢氧化铁等。
4. 盐是指由金属离子(或铵根离子)和酸根离子构成的化合物。
根据组成的不同,可以将盐分为正盐、酸式盐和碱式盐。
其中,正盐是指酸根离子与金属离子(或铵根离子)结合而成的化合物,例如氯化钠、硫酸钾等;酸式盐是指酸中的氢离子部分被金属离子(或铵根离子)取代后形成的化合物,例如碳酸氢钠、磷酸二氢钾等;碱式盐是指金属离子(或铵根离子)部分被酸根离子取代后形成的化合物,例如碱式碳酸铜等。
5. 铵盐是指由铵根离子和酸根离子构成的化合物。
铵盐一般都是晶体,易溶于水,常温下性质稳定。
常见的铵盐有氯化铵、硝酸铵、硫酸铵等。
6. 碱式盐是指在水中电离时阳离子是金属离子或铵根离子、阴离子是酸根离子之外的阴离子的化合物。
碱式盐一般不溶于水,但能与酸反应生成新的盐。
常见的碱式盐有碱式碳酸铜、碱式硫酸铬等。
