常见化合物颜色
高中阶段化合物,离子,单质的颜色大全

蓝CuO、CuS 黑FeSCN2+血红Fe(OH)3红褐Mn2+水红Cu2O红Fe(CN)64- 黄Fe(OH)2白Cr3+绿Cu(NH3)42+ 深蓝Fe(CN)63- 红MnS粉红Cr2+蓝白CrO42-黄KMnO4紫Fe3+浅黄CuSO4.5H2O 蓝Cr2O72-橙K2MnO4绿Fe2+绿Cu(OH)2蓝Cr2O3绿Ag2CrO4砖红Co2+无色Cu2[Fe(CN)6] 红蓝MnO2黑褐Cu+无色Zn3[Fe(CN)6]2白Co(H2O)62+红AgCl白1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
2、一些特殊物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、液态固态O2(淡蓝色)红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)绿色:FeSO4•7H2O、含Fe2+ 的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]无色气体:N2、CO2、CO、O2、H2、CH4有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2有臭鸡蛋气味:H2S3、常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)②蓝色沉淀:Cu(OH)2、CuCO3③红褐色沉淀:Fe(OH)3Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐⑤沉淀能溶于酸但没气体放出的:不溶的碱另外有一个较系统的中学常见物质颜色说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
初级中学化学常见物质的颜色和沉淀

(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮 18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体初中常见的化学方程式一、氧气的性质:1. 镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2. 铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中燃烧: 4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧: 2H2 + O2 点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧: C + O2 点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2 点燃 2CO10. 一氧化碳在氧气中燃烧: 2CO + O2 点燃 2CO211.玻义耳研究空气的成分实验 2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾: 2KMnO4 △ K2MnO4 + MnO2 +O2↑★13.氯酸钾和二氧化锰共热制取氧气 2KClO3 +MnO2 △2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★1.电解水(探究水的组成实验): 2H2O 通电 2H2↑+ O2 ↑2.生石灰溶于水: CaO + H2O = Ca(OH)23.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2.铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu★3.氢气还原氧化铜: H2 + CuO △ Cu + H2O四、碳和碳的氧化物:1. 碳在氧气中充分燃烧: C + O2 点燃 CO2★2.木炭还原氧化铜: C+ 2CuO 高温 2Cu + CO2↑3.焦炭还原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑4.煤炉的底层: C + O2 点燃 CO25.煤炉的中层: CO2 + C 高温 2CO6.煤炉的上部蓝色火焰的产生: 2CO + O2 点燃 2CO2★7.大理石与稀盐酸反应: CaCO3 + 2HCl = CaCl2 + H2O +CO2↑8.碳酸不稳定而分解: H2CO3 = H2O + CO2↑ 9.二氧化碳可溶于水: H2O + CO2=H2CO3★10.高温煅烧石灰石(工业制CO2):CaCO3 高温 CaO + CO2↑★11.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3 ↓+ H2O★12.一氧化碳还原氧化铜: CO+ CuO △ Cu + CO2★13.一氧化碳的可燃性: 2CO + O2 点燃 2CO2★14.碳酸钠与稀盐酸(灭火器的原理): Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★1.甲烷在空气中燃烧: CH4 + 2O2 点燃 CO2 + 2H2O★2.酒精在空气中燃烧: C2H5OH + 3O2 点燃 2CO2 +3H2O★3.氢气中空气中燃烧: 2H2 + O2 点燃 2H2O六、金属1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO2.铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中形成氧化膜: 4Al + 3O2 = 2Al2O3★5. 锌和稀硫酸(实验室制取氢气) Zn + H2SO4 = ZnSO4 + H2↑★6. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑7. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑8. 铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3H2↑9. 锌和稀盐酸 Zn + 2HCl = ZnCl2 + H2↑10. 铁和稀盐酸 Fe + 2HCl =FeCl2 + H2↑11. 镁和稀盐酸 Mg+ 2HCl = MgCl2 + H2↑12.铝和稀盐酸 2Al + 6HCl =2AlCl3 + 3 H2↑★13. 铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu14. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu15. 铜和硝酸汞溶液反应: Cu + Hg(NO3)2= Cu(NO3)2 + Hg★16.金属铁的治炼原理: 3CO+ 2Fe2O3 高温 4Fe + 3CO2↑七、酸、碱、盐★1. 氧化铁和稀盐酸反应: Fe2O3 + 6HCl =2FeCl3 + 3H2O★2. 氧化铁和稀硫酸反应: Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O3. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O4. 氧化铜和稀硫酸反应: CuO + H2SO4 =CuSO4 + H2O★5.盐酸和烧碱起反应: HCl + NaOH = NaCl +H2O★6. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 = CaCl2 + 2H2O7. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O8. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★9.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl=CaCl2+H2O+CO2↑★10.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑11.碳酸氢钠与稀盐酸反应: NaHCO3 + HCl= NaCl + H2O +CO2↑★12. 硫酸和氯化钡溶液反应: H2SO4 + BaCl2 == BaSO4 ↓+2HCl常见的化学式一、常见单质氢气 H2 氮气 N2 氯气 Cl2 氧气 O2 臭氧 O3 氦气He 氖气 Ne 氩气 Ar 碳 C 硅 Si 硫 S 磷 P 碘 I2 钾 K 钙 Ca 钠Na 镁 Mg 铝 Al 锌 Zn 铁 Fe 铜 Cu 汞 Hg 银 Ag二、化合物1、氧化物水 H2O 三氧化硫 SO3 一氧化碳 CO 二氧化碳 CO2 五氧化二磷 P2O5 过氧化氢 H2O2 二氧化氮 NO2 二氧化硫 SO2 氧化钙 CaO 氧化亚铁 FeO 氧化铁 Fe2O3 四氧化三铁 Fe3O4 氧化镁 MgO 氧化锌 ZnO 二氧化锰 MnO2 氧化汞 HgO 氧化铝 Al2O3 氧化铜 CuO 22、其他化合物硝酸 HNO3 硫酸 H2SO4 盐酸 HCl 碳酸 H2CO3 硫化氢 H2S 氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜 Cu(OH)2 氢氧化钡 Ba(OH)2 氨水 NH3·H2O 氯化钠 NaCl 氯化铜 CuCl2 氯化铝 AlCl3 氯化钾 KCl 氯化亚铁 FeCl2 氯化铁 FeCl3 氯化银 AgCl 氯化钙 CaCl2 氯化镁 MgCl2 氯化钡 BaCl2 氯化锌 ZnCl2 硫酸铜 CuSO4 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钙 CaCO3 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸铁 Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铝 Al(NO3)3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸铵 (NH4)2CO3 碳酸氢钠 NaHCO3 硫酸铁 Fe2(SO4)3 硫酸亚铁 FeSO4 硝酸银 AgNO3 硝酸钡 Ba(NO3)2 硝酸铵NH4NO3 硫酸钡 BaSO43、常见有机化合物甲烷CH4 乙醇C2H5OH 葡萄糖C6H12O6九年级化学知识点归纳一、概念剖析:1、酸定义:电离时产生的阳离子全部是H+的化合物。
化学常见化合物相对分子质量及颜色
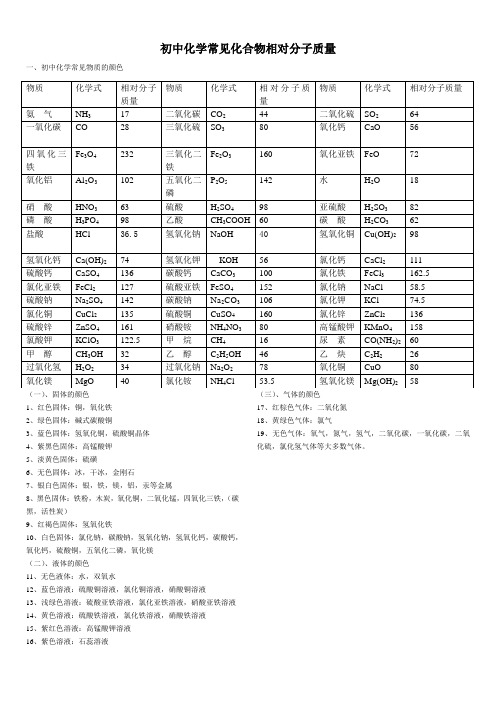
初中化学常见化合物相对分子质量一、初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
物质化学式相对分子质量物质化学式相对分子质量物质化学式相对分子质量氨气NH3 17 二氧化碳CO244 二氧化硫SO264 一氧化碳CO 28 三氧化硫SO380 氧化钙CaO 56四氧化三铁Fe3O4232 三氧化二铁Fe2O3160 氧化亚铁FeO 72氧化铝Al2O3102 五氧化二磷P2O5142 水H2O 18硝酸HNO363 硫酸H2SO498 亚硫酸H2SO382磷酸H3PO498 乙酸CH3COOH 60 碳酸H2CO362盐酸HCl 36.5氢氧化钠NaOH 40氢氧化铜Cu(OH)298氢氧化钙Ca(OH)274 氢氧化钾KOH 56 氯化钙CaCl2111 硫酸钙CaSO4136 碳酸钙CaCO3100 氯化铁FeCl3 162.5 氯化亚铁FeCl2127 硫酸亚铁FeSO4152 氯化钠NaCl58.5 硫酸钠Na2SO4142 碳酸钠Na2CO3106 氯化钾KCl 74.5 氯化铜CuCl2135 硫酸铜CuSO4160 氯化锌ZnCl2136 硫酸锌ZnSO4161 硝酸铵NH4NO380 高锰酸钾KMnO4 158 氯酸钾KClO3122.5 甲烷CH416 尿素CO(NH2)260甲醇CH3OH 32 乙醇C2H5OH 46 乙炔C2H226过氧化氢H2O234 过氧化钠Na2O278 氧化铜CuO 80氧化镁MgO 40 氯化铵NH4Cl 53.5 氢氧化镁Mg(OH)258。
(完整)初中化学常见物质颜色和沉淀

(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮 18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体初中常见的化学方程式一、氧气的性质:1. 镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2. 铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中燃烧: 4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧: 2H2 + O2 点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧: C + O2 点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2 点燃 2CO10. 一氧化碳在氧气中燃烧: 2CO + O2 点燃 2CO211.玻义耳研究空气的成分实验 2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾: 2KMnO4 △ K2MnO4 + MnO2 +O2↑★13.氯酸钾和二氧化锰共热制取氧气 2KClO3 +MnO2 △2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★1.电解水(探究水的组成实验): 2H2O 通电 2H2↑+ O2 ↑2.生石灰溶于水: CaO + H2O = Ca(OH)23.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2.铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu★3.氢气还原氧化铜: H2 + CuO △ Cu + H2O四、碳和碳的氧化物:1. 碳在氧气中充分燃烧: C + O2 点燃 CO2★2.木炭还原氧化铜: C+ 2CuO 高温 2Cu + CO2↑3.焦炭还原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑4.煤炉的底层: C + O2 点燃 CO25.煤炉的中层: CO2 + C 高温 2CO6.煤炉的上部蓝色火焰的产生: 2CO + O2 点燃 2CO2★7.大理石与稀盐酸反应: CaCO3 + 2HCl = CaCl2 + H2O +CO2↑8.碳酸不稳定而分解: H2CO3 = H2O + CO2↑ 9.二氧化碳可溶于水: H2O + CO2=H2CO3★10.高温煅烧石灰石(工业制CO2):CaCO3 高温 CaO + CO2↑★11.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3 ↓+ H2O★12.一氧化碳还原氧化铜: CO+ CuO △ Cu + CO2★13.一氧化碳的可燃性: 2CO + O2 点燃 2CO2★14.碳酸钠与稀盐酸(灭火器的原理): Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★1.甲烷在空气中燃烧: CH4 + 2O2 点燃 CO2 + 2H2O★2.酒精在空气中燃烧: C2H5OH + 3O2 点燃 2CO2 +3H2O★3.氢气中空气中燃烧: 2H2 + O2 点燃 2H2O六、金属1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO2.铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中形成氧化膜: 4Al + 3O2 = 2Al2O3★5. 锌和稀硫酸(实验室制取氢气) Zn + H2SO4 = ZnSO4 + H2↑★6. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑7. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑8. 铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3H2↑9. 锌和稀盐酸 Zn + 2HCl = ZnCl2 + H2↑10. 铁和稀盐酸 Fe + 2HCl =FeCl2 + H2↑11. 镁和稀盐酸 Mg+ 2HCl = MgCl2 + H2↑12.铝和稀盐酸 2Al + 6HCl =2AlCl3 + 3 H2↑★13. 铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu14. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu15. 铜和硝酸汞溶液反应: Cu + Hg(NO3)2= Cu(NO3)2 + Hg★16.金属铁的治炼原理: 3CO+ 2Fe2O3 高温 4Fe + 3CO2↑七、酸、碱、盐★1. 氧化铁和稀盐酸反应: Fe2O3 + 6HCl =2FeCl3 + 3H2O★2. 氧化铁和稀硫酸反应: Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O3. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O4. 氧化铜和稀硫酸反应: CuO + H2SO4 =CuSO4 + H2O★5.盐酸和烧碱起反应: HCl + NaOH = NaCl +H2O★6. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 = CaCl2 + 2H2O7. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O8. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★9.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl=CaCl2+H2O+CO2↑★10.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑11.碳酸氢钠与稀盐酸反应: NaHCO3 + HCl= NaCl + H2O +CO2↑★12. 硫酸和氯化钡溶液反应: H2SO4 + BaCl2 == BaSO4 ↓+2HCl常见的化学式一、常见单质氢气 H2 氮气 N2 氯气 Cl2 氧气 O2 臭氧 O3 氦气He 氖气 Ne 氩气 Ar 碳 C 硅 Si 硫 S 磷 P 碘 I2 钾 K 钙 Ca 钠Na 镁 Mg 铝 Al 锌 Zn 铁 Fe 铜 Cu 汞 Hg 银 Ag二、化合物1、氧化物水 H2O 三氧化硫 SO3 一氧化碳 CO 二氧化碳 CO2 五氧化二磷 P2O5 过氧化氢 H2O2 二氧化氮 NO2 二氧化硫 SO2 氧化钙 CaO 氧化亚铁 FeO 氧化铁 Fe2O3 四氧化三铁 Fe3O4 氧化镁 MgO 氧化锌 ZnO 二氧化锰 MnO2 氧化汞 HgO 氧化铝 Al2O3 氧化铜 CuO 22、其他化合物硝酸 HNO3 硫酸 H2SO4 盐酸 HCl 碳酸 H2CO3 硫化氢 H2S 氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜 Cu(OH)2 氢氧化钡 Ba(OH)2 氨水 NH3·H2O 氯化钠 NaCl 氯化铜 CuCl2 氯化铝 AlCl3 氯化钾 KCl 氯化亚铁 FeCl2 氯化铁 FeCl3 氯化银 AgCl 氯化钙 CaCl2 氯化镁 MgCl2 氯化钡 BaCl2 氯化锌 ZnCl2 硫酸铜 CuSO4 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钙 CaCO3 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸铁 Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铝 Al(NO3)3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸铵 (NH4)2CO3 碳酸氢钠 NaHCO3 硫酸铁 Fe2(SO4)3 硫酸亚铁 FeSO4 硝酸银 AgNO3 硝酸钡 Ba(NO3)2 硝酸铵NH4NO3 硫酸钡 BaSO43、常见有机化合物甲烷CH4 乙醇C2H5OH 葡萄糖C6H12O6九年级化学知识点归纳一、概念剖析:1、酸定义:电离时产生的阳离子全部是H+的化合物。
过渡金属化合物的颜色

常见过渡金属离子及化合物颜色:一.铜副族(IB):1.1铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr 黄↓;CuI 棕黄↓;Cu2SO4灰黑色(在水溶液中歧化)CuCN 白↓;Cu2O暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(浓溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑;CuS黑↓;CuSO4 无色;CuSO4·5H2O 蓝;Cu(OH)2 淡蓝↓;Cu(OH)2·CuCO3 墨绿;[Cu(H2O)4]2+蓝;[Cu(OH)4]2‐蓝紫;Cu(NH3)4]2+ 深蓝;[CuCl4]2‐黄;[Cu(en)2]2+ 深蓝紫;(CuCO3·Cu(OH) 2)亮红色(孔雀石)(Cu3 (CO3) 2 (OH) 2)蓝色(石青)K2[Cu(CO3)2](暗蓝色)、K2 [Cu(CO3)2]·2H2O(亮蓝色)K2[Cu(CO3)2]·4H2O(浅蓝绿色)炔铜红↓.1.2 银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6]白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3‐,[Ag(CN)2]‐无色.1.3 金化合物:HAuCl4·3H2O 亮黄晶体;KAuCl4·1.5H2O 无色片状晶体;Au2O3 黑;H[Au(NO3)4]·3H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.二.锌副族(IIB):2.1 锌化合物:ZnO 白(锌白颜料)↓;ZnI2 无色;ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性).2.2 镉化合物:CdO 棕灰↓;CdI2 黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl白↓;Hg2Cl2(甘汞) 白↓.2.3 汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);HgS 黑或红↓;Hg2NI·H2O 红↓;Hg2(NO3)2 无色晶体.三. 钪副族(IIIB):略四.钛副族(IVB):4.1 钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;H2TiO3 白色↓;TiO2 白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2·H2O 绿色晶体;TiCl4 无色发烟液体.4.2 锆、铪:MO2,MCl4 白.五. 钒副族(VB):5.1 钒化合物:V2+ 紫;V3+ 绿;V4+ 蓝;V5+ 黄;VO 黑;V2O3 黑;VO2 黄;V2O5 黄或砖红;水合V2O5 棕红;饱和V2O5 溶液(微溶) 淡黄.VO4^3‐黄。
无机化合物颜色大全(按颜色分类)

无机化合物颜色大全1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化成I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8—10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
一、单质绝大多数单质:银白色。
主要例外:镧系锕系及下表物质 Cu 紫红 O2无 Au 黄 S 黄 B 黄或黑 F2淡黄绿 C(石墨黑 Cl2黄绿 C(金刚石)无 Br2红棕 Si 灰黑 I2紫黑 H2无稀有气体无 P 白、黄、红棕。
二、氢化物 LiH等金属氢化物:白NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外: NO2棕红 N2O5和P2O5白 N2O3暗蓝 ClO 2 黄 大多数主族金属的氧化物:白 主要例外: Na 2O 2 浅黄 PbO 黄 K 2O 黄 Pb 3O 4 红 K 2O 2 橙 Rb 2O 亮黄 Rb 2O 2 棕 Cs 2O 橙红 Cs 2O 2 黄 大多数过渡元素氧化物有颜色 MnO 绿 CuO 黑 MnO 2黑 Ag 2O 棕黑 FeO 黑 ZnO 白 Fe 3O 4 黑 Hg 2O 黑 Fe 2O 3 红棕 HgO 红或黄 Cu 2O 红 V 2O 5 橙四、氧化物的水化物 大多数:白色或无色 其中酸:无色为主 碱:白色为主 主要例外: CsOH 亮黄 Fe(OH)3红褐 HNO 2 溶液亮蓝 Cu(OH)2 蓝 Hg(OH)2 桔红五、盐 大多数白色或无色 主要例外: K 2S 棕黄 CuFeS 2 黄 KHS 黄 ZnS 白 Al 2S 3 黄 Ag 2S 黑 MnS 浅红 CdS 黄 FeS 黑棕 SnS 棕 FeS 2 黄 Sb 2S 3 黑或橙红 CoS 黑 HgS 红 NiS 黑 PbS 黑 CuS 、Cu 2S 黑 Bi 2S 3 黑 FeCl 3·6H 2O 棕黄 Na 3P 红 FeSO 4·9H 2O 蓝绿 NaBiO 3 黄 Fe 2(SO 4)3·9H 2O 棕黄 MnCl 2 粉红 Fe 3C 灰 MnSO 4 淡红 FeCO 3 灰 Ag 2CO 3 黄 Fe (SCN )3 暗红 Ag 3PO 4 黄 CuCl 2 棕黄 AgF 黄 CuCl 2·7H 2O 蓝绿 AgCl 白 CuSO 4 白 AgBr 浅黄 CuSO 4·5H 2O 蓝 AgI 黄 Cu 2(OH )2CO 3 暗绿 盐溶液中离子特色: NO 2- 浅黄 Cu 2+或[Cu (H 2O )4]2+ 蓝 MnO 4-紫红 [CuCl 4]2- 黄 MnO 42- 绿 [Cu (NH 3)4]2+ 深蓝 Cr 2O72- 橙红 Fe 2+ 浅绿 CrO 42- 黄Fe 3+ 棕黄 非金属互化物 PCl 3 无 XeF 2、XeF 4、XeF6 无 PCl5 浅黄 氯水 黄绿 CCl 4 无 溴水 黄—橙 CS 2 无 碘水 黄褐 SiC 无或黑 溴的有机溶液 橙红—红棕 SiF 4 无 I 2的有机溶液 紫红六.其它 甲基橙 橙 C X H Y (烃)、C X H Y O Z 无(有些固体白色) 石蕊试液 紫 大多数卤代烃 无(有些固体白色) 石蕊试纸 蓝或红 果糖 无 石蕊遇酸 变红 葡萄糖 白 石蕊遇碱 变蓝 蔗糖 无 酚酞 无 麦芽糖 白 酚酞遇碱 红 淀粉 白 蛋白质遇浓HNO 3变黄 纤维素 白 I 2遇淀粉 变蓝 TNT 淡黄 Fe 3+遇酚酞溶液 紫 焰色反应 Li 紫红 Ca 砖红 Na 黄 Sr 洋红 K 浅紫(通过蓝色钴玻璃) Ba 黄绿 Rb 紫 Cu 绿 稀有气体放电颜色 He 粉红 Ne 鲜红 Ar 紫。
卤素单质及化合物的颜色

卤素单质及化合物的颜色
1.卤族元素它们自身的颜色
f2,淡黄绿色气体,没有水溶液,因为与水迅速反应,2f2+2h2o=4hf+o2。
cl2,黄绿
色气体,氯水淡黄绿色,因为在水中的溶解度不大。
br2,浅红棕色液体,蒸气红棕色,溴在水中溶解度并不大,所以溴水橙色,溴在有
机溶剂中的溶解度很大,所以溴的苯溶液、溴的ccl4溶液都就是橙红色。
i2,紫黑色液态,蒸气紫红色,碘在水中的溶解度不大,所以碘水棕黄色,碘在有机溶剂中的溶解度很大,所以碘的苯溶液、碘的ccl4溶液都就是紫红色,但碘的酒精溶液就是棕黄色的。
【注】溶液的颜色与浓稀有关,浓溶液颜色深,稀溶液颜色浅,如饱和溴水为红棕色,而很稀的溴水则为浅黄色。
2.常用化合物的颜色
它们的离子都是无色的,所以它们的化合物多数是无色,或白色固体。
agf就是可以溶水的,无色溶液,agcl就是白色结晶,agbr就是淡黄色结晶,agi就
是黄色结晶。
3.他们之间鉴别的方法
cl-、br-、i-的辨别可以用agno3溶液,根据产生的结晶的颜色相同展开辨别,白色
结晶cl-,淡黄色结晶br-,黄色结晶i-。
初中化学所有物质的颜色

初中化学所有物质的颜色颜色是化学中一种非常重要的性质,它不仅可以让我们感受到物质的美丽,还可以帮助我们了解物质的结构和性质。
下面我将为大家介绍一些常见物质的颜色。
1. 水:水是无色的。
它在日常生活中无处不在,我们喝的水、洗澡用的水都是无色的。
然而,当水中含有溶解物质时,它的颜色可能会变化,比如海水的颜色就是因为其中含有盐类等溶质的存在。
2. 空气:空气是无色的。
我们每天都呼吸着无色的空气,它给予我们生命的力量。
然而,当空气中存在污染物时,它的颜色可能变得灰蒙蒙的,给人一种不清新的感觉。
3. 铁:铁是灰色的。
铁是一种常见的金属元素,它的表面呈现出灰色的颜色。
当铁与氧气发生化学反应形成氧化铁时,铁的颜色会变成红棕色。
4. 硫磺:硫磺是黄色的。
硫磺是一种黄色的固体物质,它在高温下会熔化成黄色的液体。
硫磺在制造火药和药物等方面有着广泛的应用。
5. 石墨:石墨是黑色的。
石墨是一种形成于地壳深处的碳质矿物,它的颜色非常深沉,几乎是纯黑色的。
石墨是一种导电性很好的材料,被广泛应用于铅笔芯和电池等领域。
6. 木材:木材的颜色多种多样。
不同种类的木材具有不同的颜色,比如橡木呈现出淡黄色,红木呈现出红褐色,而黑檀木则是深黑色的。
7. 天然橡胶:天然橡胶是乳白色的。
当橡胶从橡胶树中流出时,它呈现出乳白色的颜色。
天然橡胶具有很好的弹性和耐磨性,被广泛应用于制作轮胎和橡胶制品等领域。
8. 盐:盐的颜色多种多样。
不同种类的盐具有不同的颜色,比如食用盐是白色的,海盐是灰色的,岩盐是粉红色的。
盐是一种重要的调味品,也是我们日常生活中必不可少的化学物质。
以上是一些常见物质的颜色介绍,它们展示了化学世界的多样性和美丽。
化学的研究不仅可以让我们了解物质的性质,还可以让我们欣赏到丰富多彩的颜色。
让我们一起探索化学的奥秘,发现更多美丽的颜色吧!。
化学中粉红色粉末

化学中粉红色粉末
粉红色粉末在化学中是一种很常见的颜色,它可以是来自一种有机化合物,也可以是来自一种无机物质。
一、粉红色的有机化合物
1. 聚苯乙烯(Polystyrene):它是一种结构简单的聚合物,由单位分子苯乙烯组成,它的分子量较小,通常为粉红色粉末状。
它以粉末状被广泛应用于塑料,包装,电子,电镀,印刷,制药等行业。
2. 环氧树脂(Epoxy Resin):它是一种普通的环氧树脂,是由环氧化合物,甲醛和甲醛树脂组成,它的形式有液体,胶体和粉末三种,其中粉末形式的一般是粉红色的。
它可以用于制造粘合剂,密封剂,涂料,树脂等。
3. 环氧乙烷(Epoxyethane):它是一种多环烃化合物,具有高分子量,它可以表现出粉末状,有时呈现出粉红色,它能够用于电子和电气工程,也可以用于制造塑料和涂料。
二、粉红色的无机物质
1. 硝酸钴(Cobalt nitrate):它是一种无机离子,其中含有钴离子和硝酸离子,通常为粉末状,呈粉红色,它用于制造染料,水溶剂,也可以用于抗菌剂。
2. 硫酸铋(Bismuth sulfate):它是一种无机化合物,由硫酸铵和硫酸盐组成,它是一种无色透明的粉末,有时会呈现出粉红色,它可以用于制造热敏塑料,染料,医药和农药等行业。
3. 硅酸铝(Aluminium silicate):它是一种复杂的无机物质,
通常呈粉末状,有时呈现出粉红色,它可以用于制造砖瓦,涂料,玻璃等行业。
初中化学常见物质的颜色和沉淀

(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮 18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体初中常见的化学方程式一、氧气的性质:1. 镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2. 铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中燃烧: 4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧: 2H2 + O2 点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧: C + O2 点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2 点燃 2CO10. 一氧化碳在氧气中燃烧: 2CO + O2 点燃 2CO211.玻义耳研究空气的成分实验 2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾: 2KMnO4 △ K2MnO4 + MnO2 +O2↑★13.氯酸钾和二氧化锰共热制取氧气 2KClO3 +MnO2 △2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★1.电解水(探究水的组成实验): 2H2O 通电 2H2↑+ O2 ↑2.生石灰溶于水: CaO + H2O = Ca(OH)23.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2.铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu★3.氢气还原氧化铜: H2 + CuO △ Cu + H2O四、碳和碳的氧化物:1. 碳在氧气中充分燃烧: C + O2 点燃 CO2★2.木炭还原氧化铜: C+ 2CuO 高温 2Cu + CO2↑3.焦炭还原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑4.煤炉的底层: C + O2 点燃 CO25.煤炉的中层: CO2 + C 高温 2CO6.煤炉的上部蓝色火焰的产生: 2CO + O2 点燃 2CO2★7.大理石与稀盐酸反应: CaCO3 + 2HCl = CaCl2 + H2O +CO2↑8.碳酸不稳定而分解: H2CO3 = H2O + CO2↑ 9.二氧化碳可溶于水: H2O + CO2=H2CO3★10.高温煅烧石灰石(工业制CO2):CaCO3 高温 CaO + CO2↑★11.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3 ↓+ H2O★12.一氧化碳还原氧化铜: CO+ CuO △ Cu + CO2★13.一氧化碳的可燃性: 2CO + O2 点燃 2CO2★14.碳酸钠与稀盐酸(灭火器的原理): Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★1.甲烷在空气中燃烧: CH4 + 2O2 点燃 CO2 + 2H2O★2.酒精在空气中燃烧: C2H5OH + 3O2 点燃 2CO2 +3H2O★3.氢气中空气中燃烧: 2H2 + O2 点燃 2H2O六、金属1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO2.铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中形成氧化膜: 4Al + 3O2 = 2Al2O3★5. 锌和稀硫酸(实验室制取氢气) Zn + H2SO4 = ZnSO4 + H2↑★6. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑7. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑8. 铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3H2↑9. 锌和稀盐酸 Zn + 2HCl = ZnCl2 + H2↑10. 铁和稀盐酸 Fe + 2HCl =FeCl2 + H2↑11. 镁和稀盐酸 Mg+ 2HCl = MgCl2 + H2↑12.铝和稀盐酸 2Al + 6HCl =2AlCl3 + 3 H2↑★13. 铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu14. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu15. 铜和硝酸汞溶液反应: Cu + Hg(NO3)2= Cu(NO3)2 + Hg★16.金属铁的治炼原理: 3CO+ 2Fe2O3 高温 4Fe + 3CO2↑七、酸、碱、盐★1. 氧化铁和稀盐酸反应: Fe2O3 + 6HCl =2FeCl3 + 3H2O★2. 氧化铁和稀硫酸反应: Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O3. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O4. 氧化铜和稀硫酸反应: CuO + H2SO4 =CuSO4 + H2O★5.盐酸和烧碱起反应: HCl + NaOH = NaCl +H2O★6. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 = CaCl2 + 2H2O7. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O8. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★9.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl=CaCl2+H2O+CO2↑★10.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑11.碳酸氢钠与稀盐酸反应: NaHCO3 + HCl= NaCl + H2O +CO2↑★12. 硫酸和氯化钡溶液反应: H2SO4 + BaCl2 == BaSO4 ↓+2HCl常见的化学式一、常见单质氢气 H2 氮气 N2 氯气 Cl2 氧气 O2 臭氧 O3 氦气He 氖气 Ne 氩气 Ar 碳 C 硅 Si 硫 S 磷 P 碘 I2 钾 K 钙 Ca 钠Na 镁 Mg 铝 Al 锌 Zn 铁 Fe 铜 Cu 汞 Hg 银 Ag二、化合物1、氧化物水 H2O 三氧化硫 SO3 一氧化碳 CO 二氧化碳 CO2 五氧化二磷 P2O5 过氧化氢 H2O2 二氧化氮 NO2 二氧化硫 SO2 氧化钙 CaO 氧化亚铁 FeO 氧化铁 Fe2O3 四氧化三铁 Fe3O4 氧化镁 MgO 氧化锌 ZnO 二氧化锰 MnO2 氧化汞 HgO 氧化铝 Al2O3 氧化铜 CuO 22、其他化合物硝酸 HNO3 硫酸 H2SO4 盐酸 HCl 碳酸 H2CO3 硫化氢 H2S 氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜 Cu(OH)2 氢氧化钡 Ba(OH)2 氨水 NH3·H2O 氯化钠 NaCl 氯化铜 CuCl2 氯化铝 AlCl3 氯化钾 KCl 氯化亚铁 FeCl2 氯化铁 FeCl3 氯化银 AgCl 氯化钙 CaCl2 氯化镁 MgCl2 氯化钡 BaCl2 氯化锌 ZnCl2 硫酸铜 CuSO4 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钙 CaCO3 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸铁 Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铝 Al(NO3)3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸铵 (NH4)2CO3 碳酸氢钠 NaHCO3 硫酸铁 Fe2(SO4)3 硫酸亚铁 FeSO4 硝酸银 AgNO3 硝酸钡 Ba(NO3)2 硝酸铵NH4NO3 硫酸钡 BaSO43、常见有机化合物甲烷CH4 乙醇C2H5OH 葡萄糖C6H12O6九年级化学知识点归纳一、概念剖析:1、酸定义:电离时产生的阳离子全部是H+的化合物。
中学化学中常见的各种带有颜色的物质

中学化学中常见的各种带有颜色的物质(单质、化合物、混合物)有哪些?[ 标签:单质, 化合物, 混合物 ]〃兲河シ靑風2009-05-01 14:55希望能全一些,包括气体和液体,最好能有化学式和名称满意答案好评率:45%一、单质1、金属:绝大多数为银白色。
Cu为紫红色,Au为黄色。
1、金属:绝大多数为银白色。
Cu为紫红色2、非金属chemedu 一、单质中学化学中常见的颜色http:hi.ba石墨:黑色金刚石:无色晶体硅:灰黑色1、金属:绝大多数为银白色。
Cu为紫红色氮气:无色磷:白、黄或红棕色中学化学中常见的颜色http:hi.ba 氧气:无色硫:黄色chemedu 一、单质氟气:淡黄绿色氯气:黄绿色chemedu 一、单质液溴:红棕色碘:紫黑中学化学中常见的颜色http:hi.ba二、氧化物1、金属氧化物:大多数主族金属氧化物为白色。
Na2O 石墨:黑色金刚石:无色晶体2 为淡黄色,Pb3O4为红色。
,Au为黄色。
2、非金属2、非金属氧化物:大多数过渡元素的金属氧化物有颜色。
chemedu 一、单质,Au为黄色。
2、非金属MnO2 :黑色石墨:黑色金刚石:无色晶体FeO:黑色Fe中学化学中常见的颜色http:hi.ba2O3 :红棕色石墨:黑色金刚石:无色晶体Fe3O4 :黑色chemedu 一、单质 CuO:黑色chemedu 一、单质 Cu2O:砖红色chemedu 一、单质 Ag2O:棕黑色chemedu 一、单质 ZnO:白色,Au为黄色。
2、非金属三、氧化物对应的水化物:大多数为白色或无色,其中酸以无色为主,碱以白色为主,例外的见下表。
,Au为黄色。
2、非金属 1、金属:绝大多数为银白色。
Cu为紫红色 Fe(OH)2 白色石墨:黑色金刚石:无色晶体 Fe(OH)3 红褐色石墨:黑色金刚石:无色晶体 Cu(OH)2蓝色石墨:黑色金刚石:无色晶体 HNO2 溶液亮蓝色石墨:黑色金刚石:无色晶体四、盐大多数为白色或无色,例外的见下表。
常见化合物颜色

CO(与血红蛋白结合),Cl2,Br2(气),F2(气),HF,氢氟酸等。
(2)毒性物质
NO(与血红蛋白结合),NO2,CH3OH,H2S。
苯酚、甲醛、二氧化硫、重铬酸盐、汞盐、可溶性钡盐、可溶性铅盐、可溶性铜盐等。
1常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
2一些特殊物质的颜色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)
蓝色:CuSO4?5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、
液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)
运用上述规律便于记忆溶液或结晶水合物的颜色。
(3)主族金属单质颜色的特殊性
ⅠA,ⅡA,ⅣA,ⅤA的金属大多数是银白色。
铯:带微黄色 钡:带微黄色
铅:带蓝白色 铋:带微红色
(4)其他金属单质的颜色
铜呈紫红色(或红),金为黄色,其他金属多为银白色,少数为灰白色(如锗)。
有臭鸡蛋气味:H2S
3常见一些变化的判断:
① 白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
② 蓝色沉淀:Cu(OH)2、CuCO3
③ 红褐色沉淀:Fe(OH)3
Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀
③ 难溶于水的
如:液态烃、醚和卤代烃。
(3)固体的水溶性(无机物略)
有机物中羟基和羧基具有亲水性,烃基具有憎水性,烃基越大,则水溶性越差,反而易I溶于有机溶剂中。如:甲酸、乙酸与水互溶,但硬脂酸、油酸分子中因—COOH比例过少反而不溶于水而溶于CCl4,汽油等有机溶剂。苯酚、三溴苯酚、苯甲酸均溶于苯。
物质颜色、化合物俗名、化学仪器及名称图

常见物质颜色汇总1.红色 Fe(SCN)]2+ (血红色); Cu 2O(砖红色); Fe 2O 3(红棕色); 红磷(红棕色); 液溴(深红棕色); Fe(OH)3 (红褐色); I 2的CCl 4溶液 (紫红色); MnO 4-(紫红色); Cu(紫红色); 在空气中久置的苯酚(粉红色).2.橙色: 溴水; K 2Cr 2O 7溶液.3.黄色: AgI(黄色); AgBr(浅黄色); K 2CrO 4(黄色); Na 2O 2(淡黄色); S(黄色); FeS 2(黄色);久置浓HNO 3(溶有NO 2); 工业浓盐酸(含Fe 3+); Fe 3+水溶液(黄色); 久置的KI 溶液(被氧化成I 2)4.绿色: Cu 2(OH)2CO 3; Fe 2+的水溶液; FeSO 4.7H 2O; Cl 2(黄绿色); F 2(淡黄绿色); Cr 2O 35.蓝色: Cu(OH)2; CuSO 4.5H 2O; Cu 2+的水溶液; I 2与淀粉的混合物.6.紫色: KMnO 4(紫黑色); I 2(紫黑色); 石蕊(pH=8--10); Fe 3+与苯酚的混合物.7.黑色: FeO, Fe 3O 4, FeS, CuS, Cu 2S, Ag 2S, PbS, CuO, MnO 2, C 粉.8.白色: Fe(OH)2, AgOH, 无水CuSO 4, Na 2O, Na 2CO 3, NaHCO 3, AgCl, BaSO 4, CaCO 3,CaSO 3 ,Mg(OH)2, Al(OH)3, 三溴苯酚, MgO, MgCO 3, 绝大部分金属等.一、 单质绝大多数单质:银白色。
主要例外:镧系锕系元素单质 Cu (紫红) O 2 (无 )Au ( 黄 )S ( 黄) B (黄或黑) F 2 (淡黄绿 )C 、石墨(黑 ) Cl 2( 黄绿) C (金刚石)(无) Br 2 (红棕) Si (灰黑) I 2 (紫黑) H 2 (无) 稀有气体(无) P ( 白、黄、红棕) 。
常见无机化合物颜色
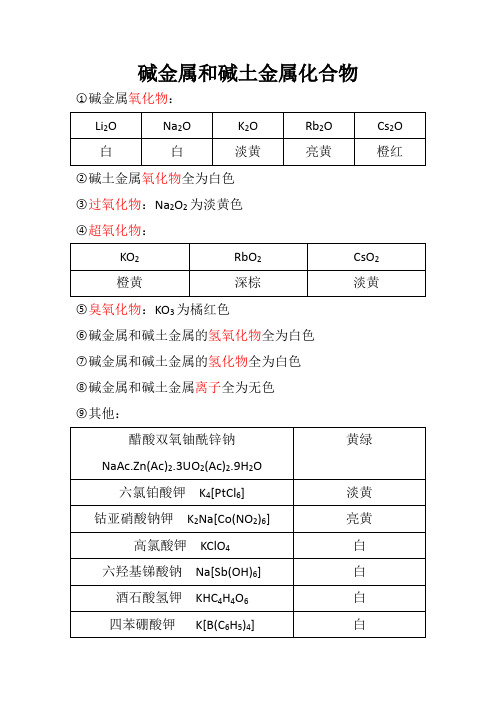
碱金属和碱土金属化合物○1碱金属氧化物:○2碱土金属氧化物全为白色○3过氧化物:Na2O2为淡黄色○4超氧化物:○5臭氧化物:KO3为橘红色○6碱金属和碱土金属的氢氧化物全为白色○7碱金属和碱土金属的氢化物全为白色○8碱金属和碱土金属离子全为无色○9其他:锗、锡、铅的化合物○1氧化物:○2氢氧化物:○3二卤化物:○4四卤化物:○5硫化物:○6铅的含氧酸盐:锑、铋的化合物○1氢化物都是无色的气体○2氧化物:○3三卤化物:○4五卤化物:○5硫化物:铜的化合物○1氧化物:○2氢氧化物:Cu(OH)2为蓝色○3硫化物:Cu2S为黑色○4卤化物:CuCl2在浓度很高时为黄绿色;浓时为绿色;稀时为蓝色;无水时为棕黄色○5配合物:○6其他:银和金的化合物○1银:○2金:锌族元素的化合物○1锌族M2+离子全为无色○2氧化物:○3硫化物:○4卤化物:○5配合物:钛的化合物钒的化合物○1氧化物:○2离子:铬的化合物○1Cr(Ⅲ):○2Cr(Ⅵ):锰的化合物○1Mn(Ⅱ):○2Mn(Ⅳ):○3Mn(Ⅵ)和Mn(Ⅶ):铁的化合物○1氧化物和氢氧化物:○2盐类:Fe(Ⅱ)一般为浅绿色;Fe(Ⅲ)一般为红棕色○3配合物:钴和镍的化合物○1氧化物:○2氢氧化物:○3盐类:○4配合物:铂系金属的化合物○1氧化物:○2卤化物:○3配合物:氯铂酸盐为黄色其他过渡金属化合物○1锆和铪的化合物:○2铌和钽的化合物:○3钼和钨的化合物:○4锝和铼的化合物:非金属元素的化合物。
初中化学常见物质的颜色和沉淀

初中化学常见物质的颜色(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O 4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2 白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
初中化学常见物质的颜色(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 9、红褐色固体:氢氧化10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体三、需熟记的口诀:化合价口诀:(正价)一价氢氯钾钠银,二价氧钙钡镁锌,三铝、四硅、五氮磷。
各种化合物的颜色

卤族(英VIIA):固体:I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3 橙;I2O5 白;I2O4黄(离子晶体);I4O9 黄(离子晶体).液体:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状.气体:F2 浅黄;(CN)2无色;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕;(SCN)n 砖红色固体.氧族(英VIA):固体:S 淡黄;Se 灰,褐;T e 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;T eO2 白(加热变黄);H2T eO3 白;T eBr2 棕;T eBr4 橙;T eI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;T eO3 橙色;H6T eO6 无色.液体:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO32-(aq) 无色;SO42-(aq) 无色;SeO2(l) 橙;T eO2(l) 深红.气体:O2 无色;O3 低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2T e 无色.卤化硫(未注明者均为无色):液体:SF6,S2F10,SCl4 淡黄;SCl2 红;S2Cl2 无色;S2Br2 红.气体:SF4 ;SF2 ;S2F2 .液体:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(英V A):固体:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X≠I) 白;SbI3 红;Sb2S3 橘红↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑.液体:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X≠I) 无色;.气体:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色.卤化氮(未注明者均为无色):固体:NBr3•(NH3)6 紫,爆炸性;NI3•(NH3)6 黑,爆炸性;液体:NCl3;无色气体:NF3;无色碳族(英IV A):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH)2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;GeF4 白;GeBr4 灰白;GeI4 黄;SnF2 白;SnCl2 白;SnBr2 淡黄;SnI2 橙;SnF4 白;SnBr4 无色;SnI4 红;PbF2 无色↓;PbCl2 白↓;PbF4 无色;GeS 红;GeS2 白;PbS 黑↓;PbS2 红褐;Pb(NO3)2 无色;Pb(Ac)2•3H2O 无色晶体;PbSO4 白↓;PbCO3 白↓;Liquid:CCl4 无色;CS2 无色;GeCl4 无色;SnCl4 无色;PbCl4 无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4 均为无色. 硼族(英IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3 玻璃状;H3BO3 无色片状;BN 白;NaBO2•4H2O 无色晶体;无水NaBO2 黄晶;Al2O3 白晶;AlF3 无色;AlCl3 白;AlBr3 白;AlI3 棕;Al(OH)3 白↓;Ga2O3 白↓;Ga(OH)3 白↓;GaBr3 白;GaI3 黄;In2O3 黄;InBr3 白;InI3 黄;TlOH 黄;Tl2O 黑;Tl2O3 棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓(与银相似);TlBr3 黄;TlI3 黑.Liquid:BCl3 无色发烟.Gas:硼烷无色;BF3 无色(有窒息气味).碱土金属(英IIA):氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2↓,Mg(OH)2↓. 盐:多为无色或白色晶体;BeCl2 浅黄;BaCrO4 黄↓;CaF2 白↓.碱金属(英IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红. 氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2 淡黄;KO2橙黄;RbO2深棕;CsO2 深黄;KO3 橘红.氢氧化物:白色,LiOH白↓.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3 Li3PO4LiKFeIO6 Na[Sb(OH)6]NaZn(UO2)3(Ac)9•6H2O 黄绿;M3[Co(NO2)6] 亮黄;MBPh4 MClO4 M2PtCl6 淡黄;(M=K,Rb,Cs)CsAuCl4.铜副族(英IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑↓;CuS黑↓;CuSO4 无色;CuSO4•5H2O蓝;[Cu(H2O)4]2+ 蓝;[Cu(OH)4]2- 蓝紫;深蓝;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓;Ag3[Fe(CN)6] 白↓; Ag+ ,[Ag(NH3)2]+ ,无色[Ag(S2O3)2]3- ,[Ag(CN)2]- 无色.金化合物:HAuCl4•3H2O 亮黄晶体;KAuCl4•1.5H2O 无色片状晶体; Au2O3 黑;H[Au(NO3)4]•3H2O 黄色晶体; AuBr 灰黄↓; AuI 柠檬黄↓.锌副族(I 英IB):.ZnI2 无色; ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性);K3Zn3[Fe(CN)6] 白;Zn3[Fe(CN)6]2 黄褐.镉化合物:CdO 棕灰↓;汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);(奈斯勒试剂产物)Hg2(NO3)2 无色晶体.ZnS 荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钛副族(英IVB):钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2•H2O 绿色晶体; TiCl4 无色发烟液体.锆、铪:MO2,MCl4 白.钒副族(英VB):钒化合物:V2+ 紫;V3+ 绿; VO2+ 蓝; V(OH)4- 黄; VO43- 黄; VO 黑; V2O3 灰黑; V2S3 棕黑; VO2 蓝色固体; VF4 绿色固体; VCl4 暗棕色液体; VBr4 洋红色液体; V2O5 黄或砖红; 水合V2O5 棕红;饱和V2O5溶液(微溶) 淡黄; [VO2(O2)2]3- 黄; [V(O2)3]3- 红棕.铬副族(英VIB):[CrO(O2)2]OEt2 蓝; CrO2Cl2 深红色液体; Na2Cr2O7,K2CrO7 橙红;Ag2CrO4 砖红↓; BaCrO4 黄↓; PbCrO4 黄↓.紫红Cr2(SO4)3•18H2O ; 绿色Cr2(SO4)3•6H2O ; 桃红Cr2(SO4)3; 暗绿[Cr(H2O)4Cl2]Cl ; 紫色[Cr(H2O)6]Cl3; 淡绿[Cr(H2O)5Cl]Cl2; [Cr(H2O)6]3+ 紫;[Cr(H2O)4(NH3)2]3+ 紫红; [Cr(H2O)3(NH3)3]3+ 浅红; [Cr(H2O)2(NH3)4]3+ 橙红; [Cr(NH3)5H2O]3+ 橙黄;[Cr(NH3)6]3+ 黄.钼、钨:MoO3 白;棕色MoCl3; 绿色MoCl5; MoS3 棕色↓;•6H2O 黄色晶状↓;H2WO4•xH2O 白色胶体.锰副族(英VIIB):无水锰盐(MnSO4) 白色晶体;六水合锰盐粉红;MnCO3 白↓; Mn3(PO4)2 白↓; KMnO4 紫红;铁系(第四周期VIII 族):黄;FeO 黑; Fe2O3 暗红; Fe(OH)2 白↓; Fe(OH)3 棕红↓; FeCl3 棕红晶体; 无水FeSO4 白; FeSO4•7H2O 绿;K4[Fe(CN)6](黄血盐) 黄色晶体; K3[Fe(CN)6](赤血盐) 红色晶体; Fe4[Fe(CN)6] 普鲁士蓝↓;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;CoO 灰绿; Co3O4 黑; Co(OH)3 棕↓; Co(OH)2 粉红↓; Co(CN)2 红;K4[Co(CN)6] 紫色晶体; Co2(CO)8 黄色晶体;[Co(SCN)6]4- 紫;氯化钴脱水变色:粉红CoCl2•6H2O(325K) ;紫红CoCl2•2H2O(3l3K) ; 蓝紫CoCl2•H2O(393K) ; 蓝CoCl2.[Ni(NH3)6]2+ 紫; Ni(OH)2 绿↓; Ni(OH)3 黑↓; 无水Ni(II)盐 黄; Na2[Ni(CN)4] 黄;K2[Ni(CN)4] 橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;Na2PtCl6 橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.。
过渡金属化合物的颜色

常见过渡金属离子及化合物颜色:一.铜副族(IB):1.1铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr 黄↓;CuI 棕黄↓;Cu2SO4灰黑色(在水溶液中歧化)CuCN 白↓;Cu2O暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(浓溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑;CuS黑↓;CuSO4 无色;CuSO4·5H2O 蓝;Cu(OH)2 淡蓝↓;Cu(OH)2·CuCO3 墨绿;[Cu(H2O)4]2+蓝;[Cu(OH)4]2‐蓝紫;Cu(NH3)4]2+ 深蓝;[CuCl4]2‐黄;[Cu(en)2]2+ 深蓝紫;(CuCO3·Cu(OH) 2)亮红色(孔雀石)(Cu3 (CO3) 2 (OH) 2)蓝色(石青)K2[Cu(CO3)2](暗蓝色)、K2 [Cu(CO3)2]·2H2O(亮蓝色)K2[Cu(CO3)2]·4H2O(浅蓝绿色)炔铜红↓.1.2 银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6]白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3‐,[Ag(CN)2]‐无色.1.3 金化合物:HAuCl4·3H2O 亮黄晶体;KAuCl4·1.5H2O 无色片状晶体;Au2O3 黑;H[Au(NO3)4]·3H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.二.锌副族(IIB):2.1 锌化合物:ZnO 白(锌白颜料)↓;ZnI2 无色;ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性).2.2 镉化合物:CdO 棕灰↓;CdI2 黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl白↓;Hg2Cl2(甘汞) 白↓.2.3 汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);HgS 黑或红↓;Hg2NI·H2O 红↓;Hg2(NO3)2 无色晶体.三. 钪副族(IIIB):略四.钛副族(IVB):4.1 钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;H2TiO3 白色↓;TiO2 白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2·H2O 绿色晶体;TiCl4 无色发烟液体.4.2 锆、铪:MO2,MCl4 白.五. 钒副族(VB):5.1 钒化合物:V2+ 紫;V3+ 绿;V4+ 蓝;V5+ 黄;VO 黑;V2O3 黑;VO2 黄;V2O5 黄或砖红;水合V2O5 棕红;饱和V2O5 溶液(微溶) 淡黄.VO4^3‐黄。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见物质的颜色的状态
1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)
2、KClO
3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色
3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色
4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
(高锰酸钾溶液为紫红色)
5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2 红褐色↓:Fe(OH)3白色↓:其余碱。
Cu CuO Cu2(OH)2CO3 CuSO4 Cu(OH)2 CuSO4溶液
红色黑色绿色蓝色蓝色蓝色
Fe Fe2O3 Fe3O4 Fe2+溶液Fe3+溶液Fe(OH)3
银白色红色黑色浅绿色黄色红褐色
在初三阶段,接触最多的沉淀可以总结为“六白”“一蓝”“一红褐”
“六白”CaCO3 Ag2 CO3 BaCO3 BaSO4 AgCl Mg(OH)2
“一蓝”Cu(OH)2
“一红褐” Fe(OH)3
一。
关键以下(1)Cu的:单质红色,CuO黑色,无水CuSO4白色,遇到水和其余二价铜蓝色
(2)Fe的:单质银白色,实验得到的单质黑色,二价铁浅绿色,三价铁中氧化铁红色,溶液黄色,Fe(OH)3沉淀红褐色
(3)白色的沉淀:BaCO3 CaCO3 BaSO4 AgCl ,其中前面两个虽不溶于水,但溶于酸且放出二氧化碳。
后面两个不溶于水,也不溶于酸。
一共14种物质,不用两小时可以记住。
记住这14种物质后,花两分钟再记住下列4种不常考到的
二。
比较少考到的颜色:KMnO4紫黑色;MnO2和C粉黑色;KClO3白色
一、初中阶段一共14种物质的颜色是关键:
(1) Cu的:单质红色,CuO黑色,无水CuSO4白色,遇到水和其余二价铜都是蓝色
(2)Fe的:单质银白色,实验得到的是单质黑色粉末状,二价铁浅绿色,三价铁中氧化铁红色,溶液黄色,Fe(OH)3沉淀红褐色
(3)白色的沉淀:BaCO3 、CaCO3 ,虽不溶于水,但溶于酸且放出二氧化碳。
BaSO4 、AgCl,两个不溶于水,也不溶于酸。
(4)黑色物质:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.
(5)比较少考到的颜色:KMnO4紫黑色;MnO2和C粉黑色;KClO3白色
二、在初三阶段,接触最多的沉淀可以总结为“六白”“一蓝”“一红褐”
“六白”CaCO3 Ag2 CO3 BaCO3 BaSO4 AgCl Mg(OH)2
“一蓝”Cu(OH)2
“一红褐” Fe(OH)3
三、记忆方法:
一般的:Cu 2+蓝色;Fe 2+浅绿;Fe 3+,氧化铁红色,溶液是黄色;MnO4 ‐紫色
四、基础:
黑色的:炭,二氧化锰,氧化铜,四氧化三铁,氧化亚铁
红色的:铜,高锰酸钾固体,氧化铁
蓝色的:氢氧化铜,硫酸铜晶体(无水硫酸是无色的)
红褐色的:氢氧化铁
黄色的:硫,氯化铁,硫酸铁
浅绿色的:硫酸亚铁,氯化亚铁
常见物质的颜色的状态
1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)
2、KClO
3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4 KMnO4为紫黑色
3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色
4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
(高锰酸钾溶液为紫红色)
5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3②碱:蓝色↓:Cu(OH)2
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)
(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)
7、有毒的,气体:CO 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)初中化学常见金属盐溶液的颜色
1:固体(或晶体)的颜色:
Mg,Fe,Zn,Ag`银白色
P(白),P2O5,CaO,MgO,KClO3,CuSO4,NaCl`白色
C,CuO,MnO2,Fe3O4`黑色
Cu,P(红),Fe2O3`红色
KMnO4`紫黑色
CuSO4•5H2O`蓝色
S`淡黄色
2:溶液中离子的颜色:
含Cu2+的盐溶液`蓝色
含Fe3+的盐溶液`棕黄色
含Fe2+的盐溶液`浅绿色
3:沉淀颜色:
CaCO3,BaCO3`白色`溶于酸
AgCl,BaSO4`白色`不溶于酸
Mg(OH)2`白色`溶于酸
Cu(OH)2`蓝色`溶于酸
Fe(OH)3`红褐色`溶于酸
二:火焰颜色:
H2,S在空气中燃烧:浅蓝色
CO,CH4在空气中燃烧:蓝色
S在氧气中燃烧:蓝紫色
P在空气中燃烧:红色
Mg在空气中燃烧:无火焰,发白色强光
P在氧气中燃烧:白色
三:离子的共存:
离子能否共存取决于两种离子相遇后能否生成水,气体或沉淀,若能生成上述物质
则离子不能共存.常见的有:
1:H+和OH-反应会生成H2O
2:H+和CO3(2-在数字3上面,打不起..)反应会生成H2CO3,分解后生成H2O和CO2气体
3:NH4+和OH-反应会生成H2O和NH3
4:Ca2+和CO3(2-在数字3上面,打不起..)反应会生成CaCO3沉淀,Cu2+,Fe3+与OH-反应会生成Cu(OH)2,Fe(OH)3沉淀,Ag+与Cl-反应以及Ba2+和SO4(2-在数字4上面,打不起..),生成AgCl和BaSO4,不溶于硝酸.
四:元素之最:
1:地壳中含量最多的元素:O 2:地壳中含量最多的金属元素:Al
3:形成化合物最多的元素:C 4:生物细胞中含量最多的元素:O
5:人体中含量最高的金属元素:Ca
五:物质之最:
1:密度最小的气体:H2 2:相对分子质量最小的物质:H2
3:相对分子质量最小的氧化物:H2O
4:空气中含量最多的气体:N2
5:单质硬度最大的物质:金刚石6:熔点最高的金属:W
7:导电性最强的金属:Ag 8:熔点最低的金属:Hg
9:人类冶炼最多的金属:Fe 10:最简单的有机物:CH4
六:特殊反应:
1:在空气中能自燃,燃烧产生大量白烟的是白磷.
2:溶于水显碱性的气体是NH3,显酸性的是CO2,SO2,SO3,,NO2
3:可以使黑色固体CuO还原成亮红色物质的还原性气体是H2,CO,还原性固体是C
4:遇碘变蓝的是含有淀粉的物质.。
