发酵工程 酶促反应动力学
酶催化反应的动力学和机理研究

酶催化反应的动力学和机理研究酶催化反应是生命体内和体外中许多化学反应中必不可少的过程,其在生命体的代谢过程中发挥着重要作用。
本文将从酶催化反应的动力学和机理两个方面来探讨酶催化反应的研究。
一、酶催化反应的动力学研究酶催化反应速率的大小与反应底物浓度、温度和酶浓度有关,且可根据它们之间的关系来进行动力学研究。
Michaelis-Menten方程是酶催化反应中最为著名的动力学方程,它是在1913年被Michaelis和Menten提出的。
Michaelis-Menten方程的表达式是:V = Vmax × [S] / (Km + [S])其中,V代表反应速率;Vmax代表酶催化反应最大速率;[S]代表底物浓度;Km代表酶催化反应的半饱和常数。
根据Michaelis-Menten方程,反应速率随着底物浓度的增加而增加,然而在达到一定的反应速率后,反应速率将不再随着底物浓度的增加而增加,其理由是因为酶分子位点的饱和度已接近饱和。
除了Michaelis-Menten方程,Lineweaver-Burk图也是酶催化反应中常用的动力学分析方法之一。
在Lineweaver-Burk图中,酶催化反应速率的倒数(1/V)与底物浓度的倒数(1/[S])之间的关系是直线,可根据该直线的斜率和截距求出Vmax和Km的值。
Lineweaver-Burk图可以很好地解决Michaelis-Menten方程因非线性而给实验带来的困难。
除了Michaelis-Menten方程和Lineweaver-Burk图外,还有其他动力学模型用于研究酶催化反应,如Briggs-Haldane方程和Hill方程等,它们在不同领域有不同的应用。
二、酶催化反应的机理研究酶催化反应机理研究是探讨酶如何影响反应路径的重要研究方向。
在酶催化反应中,酶在反应中发挥着非常重要的催化作用,它通过降低反应活化能来促使反应的进行。
酶与底物分子相互作用是导致酶催化反应发生的原因。
发酵过程中的微生物产酶与酶促反应研究

发酵过程中的微生物产酶与酶促反应研究发酵过程中的微生物产酶与酶促反应研究酶是一种具有特异性催化作用的生物大分子,广泛存在于自然界中。
酶促反应作为一种具有高效性、选择性和温和性的反应方式,在生化学、医药、食品等领域起着重要作用。
而发酵过程中的微生物产酶与酶促反应则是酶在生物体内产生和运用的一个重要方面。
本文将从微生物产酶的种类、酶促反应的机理以及应用前景等方面对该研究领域进行探讨。
微生物产酶的种类与特点多样,包括蛋白酶、淀粉酶、脂肪酶、纤维素酶等。
发酵过程中的微生物主要通过生长和代谢释放酶,其幅度与酶活性与生长状态与环境条件等因素相关。
酶的产生受到基因水平的调控,微生物内在的酶合成基因存在于其染色体上,遗传操作可以通过改变基因表达来调控酶的产生。
酶促反应是利用酶催化物质转化的一种反应方式。
酶作为催化剂,能够显著降低反应的能量损耗、提高化学反应的速率,同时,酶对反应底物具有选择性,从而可以有效控制反应的副产物和不良反应的生成。
酶促反应相比传统的催化剂反应具有更高的效率和更温和的条件,从而减少了对环境和资源的不良影响。
目前,酶促反应已经成功应用于医药领域,如合成药物、制备生物医用材料;食品领域,如酶制面包、奶酪等;以及能源领域,如利用酶促反应将纤维素转化为生物燃料等。
微生物产酶与酶促反应研究的应用前景广阔。
首先,在食品工业应用方面,微生物产酶已经被广泛应用于食品加工过程中,如酵素制面包、奶酪和果酱等,不仅改善了产品的品质,还增强了产品的营养价值。
其次,在生物医药领域,微生物产酶通过酶催化合成药物,不仅可以提高产物纯度,降低副作用,还可以缩短合成路径,降低成本,为药物研发和生产提供了新的途径。
此外,在环境工程领域,酶促反应被应用于废水处理、固体废物处理等环境保护方面,其低能耗和高效率的特点使其成为一种环保技术的热点。
虽然微生物产酶与酶促反应在各个领域已经获得了广泛的应用,但是仍然面临一些挑战。
首先,酶的高纯度和高活性的获取是制约其生产和应用的关键技术之一。
酶促反应动力学名词解释

酶促反应动力学名词解释
酶促反应动力学是研究酶催化反应速率、酶与底物之间的相互作用以及反应机制的科学领域。
酶是一种生物催化剂,能够加速化学反应的速率,而酶促反应动力学则是用来描述和解释酶催化反应速率的规律。
酶促反应动力学的主要研究内容包括反应速率、反应机理和酶动力学参数等。
反应速率是指单位时间内反应物转化为产物的量,可以通过测量底物浓度的变化来确定。
酶催化反应速率通常比非酶催化的速率高几个数量级,这是因为酶能够提供更适合反应进行的环境,如形成特定的活性位点、降低反应的活化能等。
反应机理是指酶催化反应中涉及的化学步骤和中间产物的生成过程。
酶催化的反应通常包括底物与酶结合形成底物-酶复合物、底物在酶的活性位点上发生化学反应、产物与酶解离的过程。
通过研究反应机理,可以更好地理解酶催化反应的特点和机制。
酶动力学参数是描述酶催化反应速率和酶与底物之间相互作用的定量指标。
常见的酶动力学参数包括最大反应速率(Vmax)、米氏常数(Km)和催化效率(kcat/Km)等。
Vmax表示在酶的浓度饱和状态下的最大反应速率,Km表示酶与底物结合的亲和力,kcat/Km则是酶催化反应的效率常数。
总的来说,酶促反应动力学的研究对于理解酶催化的反应机制、设计高效的酶催化反应以及开发新型药物和工业催化剂等方面具有重要的意义。
通过深入研究酶
促反应动力学,可以为生物工程、医药化学和工业生产等领域的应用提供理论和实践基础。
酶催化反应动力学建模

酶催化反应动力学建模一、引言酶催化反应动力学建模是化学、生物化学和生物学中重要研究领域之一。
酶催化反应动力学建模是对生物酶催化反应进行数学建模,以便了解和预测酶催化反应的速率和效果。
酶催化反应动力学建模可以应用于各种酶催化反应研究、药物设计和生化工程等领域。
本文将详细介绍酶催化反应动力学建模相关知识。
二、酶催化反应动力学概述酶催化反应动力学是对生物酶的催化效果进行定量分析的研究领域。
酶是生物体内的催化剂,能够显著提高化学反应的速率,并且对反应速率影响很大。
酶催化反应速率的测量和分析,有助于深入了解酶的结构与功能,并为酶的应用提供科学依据。
酶催化反应动力学与化学反应动力学类似。
在动力学研究中,主要关注反应速率与反应物浓度之间的关系。
酶催化反应动力学通过实验测定酶催化反应速率与底物浓度之间的关系,从而确定酶的催化效率、催化机制等生物学特性。
三、酶催化反应动力学建模酶催化反应动力学建模是对实验数据进行处理和分析,以得到酶催化反应的动力学参数和反应概率。
其中关键问题是如何建立反应模型,以便模拟和预测实验结果。
酶催化反应动力学建模主要分为以下几步。
1. 初步数据处理在实验数据处理中,需要先将实验数据进行初步处理,包括质量控制、信号处理、计算等步骤。
其中最关键的是原始数据质量的控制。
在数据处理时应注意检查实验条件,例如 pH、温度、反应时间、底物浓度等因素是否有误。
2. 构建反应模型构建反应模型是酶催化反应动力学建模的核心部分。
在该步骤中,需要选择适当的反应模型,根据实验数据进行参数拟合,确定反应模型中的参数,例如酶活性、酶底物结合能力等。
预测性能、酶-药物相互作用等也可以通过反应模型进行预测和分析。
3. 模型检验模型检验是酶催化反应动力学建模的重要步骤。
在模型检验中,需要评估反应模型与实验数据的匹配程度。
通常,可比较模型预测结果与实验结果进行验证。
检验结果将反馈到反应模型中,更新和改进反应模型参数和结构。
酶催化反应的动力学和热力学模型

酶催化反应的动力学和热力学模型酶催化反应是生命体系中关键的一环,它在细胞代谢、信号传导、免疫反应等生命活动中发挥着至关重要的作用。
酶催化反应的动力学和热力学模型则是研究这些反应本质和控制机制的关键工具。
本文将介绍酶催化反应的动力学和热力学背景,探讨几种常见的酶催化反应模型,并简述大分子反应的特点及控制机制。
一、酶催化反应的动力学和热力学背景酶催化反应是指在生物体内,酶作为催化剂促进化学反应的进行。
酶能够显著降低反应所需的能垒,从而提高反应速率。
这是因为酶与底物之间形成的酶底物复合物能够在化学反应中提供一个更加稳定的、能量较低的过渡态,从而降低反应所需的能量和活化能。
在酶催化反应中,反应速率是非常重要的一个参数。
反应速率和底物浓度、酶浓度、反应温度等因素相关,因此需要建立反应速率的动力学模型。
此外,酶催化反应的热力学特性也是研究的关键点之一,热力学模型的建立可以帮助我们理解反应的驱动力和热力学限制。
二、几种常见的酶催化反应模型1. 米高斯-明茨动力学模型米高斯-明茨动力学模型是最早提出的酶动力学模型之一。
这个模型假设底物结合酶的速率比化学反应速率快很多,因此酶底物复合物的形成是反应速率的控制步骤。
当底物浓度很低时,酶活性不会受到抑制。
但是随着底物浓度的增加,酶活性会逐渐达到饱和,反应速率也会趋于常数。
2. 酶抑制模型酶抑制模型是一种描述酶和抑制剂之间互作关系的动力学模型。
抑制剂可以直接地或者通过结合酶活性部位抑制酶的活性。
在酶活性被抑制的情况下,反应速率呈现非线性关系,其动力学方程可以写成一个双曲线形式。
3. 酶电化学模型酶电化学模型结合了动力学和电化学的理论,描述酶催化反应的电化学过程和催化剂对电极反应动力学的影响。
这种模型在电化学和生物传感领域有着广泛的应用。
三、大分子反应的特点及控制机制除了小分子酶催化反应,大分子反应也是生物体系中一种重要的反应类型。
大分子反应包括蛋白质合成和降解、DNA复制和修复等过程。
酶促反应动力学米氏方程

酶促反应动力学米氏方程摘要:1.酶促反应动力学的基本概念2.米氏方程的推导过程3.米氏方程的应用4.酶促反应动力学的影响因素5.总结正文:一、酶促反应动力学的基本概念酶促反应动力学是研究酶促反应速度及其影响因素的科学。
在酶促反应中,酶作为催化剂,可以降低反应所需的活化能,从而加速反应速率。
酶促反应动力学主要研究酶浓度、底物浓度、温度、pH、抑制剂和激活剂等因素对反应速率的影响。
二、米氏方程的推导过程米氏方程是描述酶促反应速度与底物浓度之间关系的经典方程。
其推导过程如下:1.假设酶分子的数量为[E],底物浓度为[S],酶促反应速度为v。
2.酶在催化过程中会与底物结合形成酶- 底物复合物(ES),此过程为慢反应。
3.酶- 底物复合物在达到一定程度后会分解为酶和产物,此过程为快反应。
4.根据慢反应和快反应的速率常数,可以得到酶促反应速度的表达式。
5.将表达式中的慢反应和快反应速率常数用米氏常数(Km)表示,即可得到米氏方程:v = (Km * [S]) / (Km + [S])三、米氏方程的应用米氏方程可以用于分析酶促反应的动态过程,预测反应速度与底物浓度的关系,以及研究酶的结构与功能。
此外,通过比较不同底物和酶的米氏方程,可以了解酶的专一性和底物选择性。
四、酶促反应动力学的影响因素酶促反应动力学受到多种因素的影响,主要包括:1.酶浓度:在一定范围内,酶浓度的增加会提高反应速率,但当酶浓度达到饱和时,反应速率不再随酶浓度增加而提高。
2.底物浓度:底物浓度的增加会提高反应速率,但当底物浓度达到一定程度时,反应速率不再随底物浓度增加而提高。
3.温度:温度的升高会加速反应速率,但过高的温度会导致酶失活,使反应速率降低。
4.pH:酶的活性受pH 值的影响,pH 值的改变会影响酶的催化效率。
5.抑制剂和激活剂:抑制剂会降低酶的催化效率,而激活剂会提高酶的催化效率。
五、总结酶促反应动力学是研究酶促反应速度及其影响因素的科学。
酶催化反应动力学

酶催化反应动力学一、引言酶是生物体内自然存在的一类生物催化剂,其作用是加速生物体内的化学反应。
酶的催化效率比非酶催化的反应高出成千上万倍,甚至数十百万倍。
这种高效的催化作用使得酶在生物体内的生命活动中扮演着不可或缺的角色。
酶催化反应动力学是研究酶催化反应速率以及影响反应速率的各种因素的科学。
它是生物化学反应工程、生物制药工程、生物农业工程、生物材料工程等学科的基础,也是生物医学、生物工程、生物安全等领域的热点研究课题。
二、酶催化反应动力学的基础概念1、酶催化反应速率:指单位时间内,单位体积中底物的消耗速率或产物的生成速率。
2、米氏方程:Michaelis-Menten方程是描述酶催化反应速率与底物浓度关系的经典方程,它揭示了酶的催化效率与底物浓度的关系。
3、酶的活性中心:酶分子中与底物结合并发生催化反应的部位,通常由多种氨基酸残基组成。
4、底物结合与释放:酶与底物的结合和释放是酶催化反应的重要环节,其速率受底物浓度、竞争性抑制剂、温度、pH等多种因素的影响。
三、影响酶催化反应速率的因素1、底物浓度:底物浓度是影响酶催化反应速率的主要因素之一。
在底物浓度较低时,反应速率随底物浓度的增加而线性增加;当底物浓度达到一定值时,反应速率达到最大值,此时即使再增加底物浓度,反应速率也不会再增加。
2、温度:温度对酶催化反应速率的影响较大。
在一定范围内,随着温度的升高,酶的活性增强,反应速率增大;但当温度超过一定范围后,高温会导致酶失活,反应速率反而下降。
3、pH:pH对酶催化反应速率的影响也较大。
每种酶都有其最适pH 值,在此pH值下,酶的活性最强,反应速率最大。
当pH值偏离最适范围时,酶的活性降低,反应速率下降。
4、抑制剂:抑制剂是能够降低酶催化反应速率的物质。
竞争性抑制剂通过与底物竞争结合酶的活性中心来降低反应速率;非竞争性抑制剂通过与酶活性中心外的位点结合来降低反应速率;反竞争性抑制剂通过与底物-酶复合物结合来降低反应速率。
酶促反应动力学(有方程推导过程)

酶促反应动力学(kinetics of enzyme- catalyzed reactions)是研究酶促反应速度及其影响因素的科学。酶促反应的影响因素主要包括酶的浓度、底物的浓度、pH、温度、抑制剂和激活剂等。
01
酶促反应动力学
02
3.4 酶促反应动力学
酶浓度的影响
在一定温度和pH下,酶促反应在底物浓度大于100 Km时,速度与酶的浓度呈正比。 酶浓度对速度的影响机理:酶浓度增加,[ES]也增加,而V=k3[ES],故反应速度增加。
,所以
(2)
将(2)代入(1)得:
(3)
当[Et]=[ES]时,
(4)
所以
将(4)代入(3),则:
01
Vmax指该酶促反应的最大速度,[S]为底
02
物浓度,Km是米氏常数,V是在某一底物浓
03
度时相应的反应速度。从米氏方程可知:
04
当底物浓度很低时
05
<< Km,则 V≌Vmax[S]/Km ,反应速度
〔E〕〔S〕
〔ES〕
〔E〕〔I〕
〔EI〕
ki
解方程①②③得: 〔ES〕=
〔E〕t
(1 + )+1
Km
〔S〕
〔I〕
Ki
又因vi=k3〔ES〕,代入上式得: Vi=
(1 + )+〔S〕
Km
〔I〕
Ki
Vmax〔S〕
〔I〕
Ki
很多药物都是酶的竞争性抑制剂。例如磺胺药与对氨基苯甲酸具有类似的结构,而对氨基苯甲酸、二氢喋呤及谷氨酸是某些细菌合成二氢叶酸的原料,后者能转变为四氢叶酸,它是细菌合成核酸不可缺少的辅酶。由于磺胺药是二氢叶酸合成酶的竞争性抑制剂,进而减少细菌体内四氢叶酸的合成,使核酸合成障碍,导致细菌死亡。抗菌增效剂-甲氧苄氨嘧啶(TMP)能特异地抑制细菌的二氢叶酸还原为四氢叶酸,故能增强磺胺药的作用。
发酵工程_6发酵动力学

首先研究微生物生长和产物合成限制因子;
建立细胞生长、基质消耗、产物生成模型;
确定模型参数;
实验验证模型的可行性与适用范围;
根据模型实施最优控制。
本章主要内容
分批发酵动力学 连续发酵动力学 补料分批发酵动力学
什么是分批发酵?
分批发酵:准封闭培养,指一次性投料、接种 直到发酵结束,属典型的非稳态过程。 分批发酵过程中,微生物生长通常要经历延滞 期、对数生长期、衰减期、稳定期(静止期) 和衰亡期五个时期。
菌体浓度X t1
dx 0, 0, x xmax dt
(浓度最大)
t5
t2
t3 时间 t
t4
图6-1 分批发酵时典型的微生物生长动力学曲线
此阶段次级代谢活跃,次级代谢物大量合成。
dying:
a
(比死亡速率 ,s-1)
假定整个生长阶段无抑制物作用存在,则微生物生长动 力学可用阶段函数表示如下:
反应器层次(过程工程)
基于细胞群体生长及产物合成对外部环境综合响应
采用一系列优化反应器发酵条件的方法
针对微生物发酵的表观动力学,通过研究微生物群 体的生长、代谢,定量反映细胞群体酶促反应体 系的宏观变化速率,主要包括:
细胞生长动力学 底物消耗动力学 产物合成动力学
发酵动力学研究的基本过程
Y*X/S表示底物的细胞绝对得率,也称理论细胞得率; m为细胞维持系数
扣除细胞量的影响,
qS
将qS用µ表示,可得
1 Y
* X /S
m
YX / S
1 Y
* X /S
m
1 YX / S
酶促反应的动力学研究

酶促反应的动力学研究酶促反应是一种在生物体内外广泛存在的一类化学反应,它通过酶的催化作用来提高反应速率,参与细胞代谢过程中的物质代谢、信号传导以及其他特定生理生化过程。
酶促反应的动力学研究,是探究生物体内化学反应的一个重要途径。
酶性质及反应动力学参数酶是一种宏观蛋白质,具有高度催化活性和专一性。
酶的催化活性可以通过反应速率(v)来体现,反应速率与酶底物浓度(c)和酶的量(e)成正比,反应速率与反应物浓度(s)成正比。
反应动力学参数通常包括酶的最大催化速率(Vmax)、酶的反应常数(Kcat)、酶的亲和力(Km)等。
酶活性的影响因素酶的活性受到多种因素的影响。
其中 pH 值、温度、离子浓度等是影响酶活性的主要因素。
不同的酶在催化反应过程中要求的反应条件不同。
例如,将 pH 值改变到酶的最适范围内,可以使酶活性达到最大值;而超过最适范围则酶活性会降低。
酶动力学研究方法酶动力学研究需要量化反应速率以及酶反应动力学参数。
常见的研究方法有:1. 利用光度计或荧光计在不同时间下测定反应物或产物的浓度变化,然后绘制成反应曲线。
通过反应曲线,可以计算出最大反应速率(Vmax)和亲和力常数(Km)。
2. 利用比色法、荧光法等直接测定反应物或产物的浓度,然后通过计算得出反应速率。
反应速率也可以通过酶质量测定得出。
3. 采用基于表面等离子共振技术的生物传感器,监测反应物与酶结合的变化。
这种方法可以检测微量生物分子间的相互作用,例如酶受体配对的识别。
4. 利用分子模拟等计算机模拟手段,模拟酶的结构特征、反应过程及与底物的相互作用。
酶促反应动力学研究的应用酶促反应动力学研究,除了提供对生物体内化学反应本质的认识,也被广泛应用于医学、农业、生物工程等领域。
在医学上,酶的活性与某些疾病的发生、发展密切相关。
例如血浆中的酶含量和活性与某些器官的疾病有关,如肝功能、心脏功能和胰腺炎等。
通过对酶活性的研究,可以为临床医生提供一定的预测和诊断手段。
发酵工程 第七章 发酵动力学

分批发酵动 力学
➢ 细胞生长动力学 ➢ 基质消耗动力学 ➢ 产物形成动力学
分批发酵动力学-细胞生长动力学
微生物生长特性通常以单位细胞浓度或细 胞数量在单位时间内的增加量来表示(μ、μn):
1 X
dX 或
dt
n
1 N
dN dt
Xt X0et 或 Nt N0ent
X—细胞浓度(g/L);N—细胞个数; t—生长时间; X0、Xt—初始微生物浓度和t时细胞浓度;
Decline(开始出现一种底物不足的限制):
(1)若不存在抑制物时
Monod 模型:
ms
Ks s
S—限制性基质浓度,mol/m3
Ks—底物亲和常数(也称半饱和速度常数),表示微 生物对底物的亲和力 , mol/m3 ; Ks越大,亲和力 越小, µ越小。
① 当S较高时,(对数期满足S>>10Ks),此时,µ= µm ② 当S较低时,(减速期, S<<10Ks),此时S↓,µ ↓
N0、Nt—初始细胞个数和t时细胞个数; —以细胞浓度表示的比生长速率;
n—以细胞数量表示的比生长速率。
分批发酵动力学-细胞生长动力学
lag: x不变, 即 dx 0, 0
dt
exp:(假定无抑制作用存在)
m
m
1 x
dx dt
ln x ln x 0 m t
x e x 0 mt
分批发酵动力学-细胞生长动力学
第七章 发酵动力学
生物反应分类
一、通过细胞培养,利用细胞产生的酶系统,把培养基中的物
质转化成新的细胞及其代谢产物。
底物
细胞
新的细胞 + 代谢产物
二、在酶的作用下,底物反应生成产物。
酶催化反应动力学分析

酶催化反应动力学分析酶是生物体内最常见的催化剂,能够加速化学反应的速率,使化学反应在生命体内发生。
酶结构复杂,需要在特定的温度、pH值和离子浓度等条件下才能发挥最佳催化作用。
酶催化反应动力学分析是研究酶催化反应特性和机理的重要手段。
本文将对酶催化反应动力学分析进行探讨。
一、酶催化反应动力学酶催化反应动力学是研究酶催化反应速率的学科,主要关注酶催化反应的速率常数。
速率常数即反应速度与物质浓度之间的关系。
酶催化反应基本上遵循米氏动力学(Michaelis-Menten,简称M-M)方程。
M-M方程是描述酶催化反应速率的一种数学表达式。
其中,Vmax表示酶反应速率的最大值,Km表示酶与底物结合能力的常数。
酶对底物的亲和力越强,则Km值越小,酶在底物浓度足够大的条件下,其反应速率趋向于最大值Vmax。
当底物浓度为Km时,反应速率的一半为Vmax/2。
公式:V=Vmax*[S]/(Km+[S])其中,V表示反应速率,[S]表示底物浓度。
二、酶催化反应动力学分析过程1.测定酶反应速率酶催化反应速率可以通过测定产生的产物量或消耗的底物量来反应。
通常需要对底物和产物的浓度进行测定分析。
比如,在酶催化下,葡萄糖可以被转化为葡萄糖酸,可以通过测定葡萄糖和葡萄糖酸的浓度来反应酶的催化速率。
2.绘制酶反应速率曲线在实验中,通常会对不同底物浓度下的反应速率进行测定,并将反应速率与底物浓度绘制成曲线。
根据M-M方程,当底物浓度充分大时,反应速率趋向于最大值Vmax。
曲线的最大值即为酶反应速率的最大值Vmax,曲线的一半处即为酶的底物浓度Km。
3.计算酶催化常数通过实验测定的结果,可以计算出酶的催化常数。
其中,Km越小,表示酶与底物结合的亲和力越强,反应速率越快;Vmax则表示酶催化反应的最大速率,与酶的浓度和酶的催化效率有关。
三、酶催化反应动力学分析在生物学中的应用酶催化反应动力学分析是生物学领域中的重要研究方法之一。
酶催化反应机理的研究可以帮助我们理解生物反应的基本特性,例如代谢反应和细胞信号转导等。
发酵过程动力学的基本概念

特点
流加发酵模型可以减少原材料 的浪费,提高发酵效率,但需 要精确控制流加速率和浓度。
应用
适用于大规模、长周期的发酵 生产,如某些酶制剂的生产。
分批补料发酵模型
定义
分批补料发酵模型是指在发酵过程中,反应物料分批 加入,以控制最佳的发酵条件。
特点
分批补料发酵模型结合了批式发酵和流加发酵的特点, 既可提高发酵效率,又可减少原材料的浪费。
此外,随着环保意识的提高,未来研究应关注发 酵过程的环保和可持续发展问题,探索如何降低 能耗、减少废弃物排放,实现绿色、低碳的生物 技术发展。
THANKS FOR WATCHING
感谢您的观看
发酵过程动力学的重要性
01
发酵过程动力学研究有助于深 入理解微生物生长、基质消耗 和产物生成的相互关系和变化 规律。
02
通过动力学模型,可以预测不 同操作条件下的发酵行为,为 发酵过程的优化和控制提供指 导。
03
动力学研究还有助于发现新的 发酵策略和工艺改进,提高发 酵效率和产物纯度,降低副产 物的生成。
未来研究方向
随着生物技术的不断发展,发酵过程动力学的研 究将更加深入和广泛,需要不断探索新的动力学 模型和方法,以适应不同类型和规模的发酵过程 。
针对不同微生物种类的发酵过程动力学研究也是 未来的一个重要研究方向,将有助于发现新的微 生物资源,拓展生物技术的应用领域。
未来研究应加强与计算机科学、数据科学等领域 的交叉融合,利用先进的数据分析技术和计算机 模拟技术,对发酵过程进行更加精准和深入的研 究。
1
通过优化补料策略,可以控制发酵过程中的物质 流和能量流,从而降低能耗和减少废气排放。
2
开发新型的传感器和控制系统可以帮助实现精确 的补料控制,从而降低能耗和减少废气排放。
生物反应工程 第二章 酶促反应动力学

EG
+B -B
-Q
+P
EQ
+Q
E
( EG:修饰过的酶 )
简单机制
+A +B
-Q
-P
E
-A
EA
-B
EAB
EPQ
+Q
EP
+P
E
双底物酶促反应动力学
反应机理:
解之,得
式中:
2.3 固定化酶促反应动力学
2.3.1 固定化酶促反应动力学基础 2.3.1.1 酶的固定化技术定义 酶的固定化技术是将水溶性的酶分子通过一定的方式,如静电 吸附,共价键等与载体如角叉菜胶、离子交换树脂等材料制成固 相酶的技术。 细胞的固定化技术: 为省去从微生物(或动、植物)中提取 酶的操作,确保酶的稳定性,采用直接固定化微生物细胞、动植 物细胞、组织技术。
2.3.2.2 内部扩散过程
具有大量内孔的球形固定化酶颗粒 dr r
内扩散效率因子
R
稳定状态下,对底物进行物料衡算:
流入量-流出量=反应量
整理,得
两侧同除
,得
当反应符合米氏方程规律时,
故, 令 , ,
, 上式可转化为无因次形式,得
边界条件:
, ,
该微分方程无解析解,只能用数ear Burk): 对米氏方程两侧取倒数,得
,以 作图,得一直线, 直线斜率为 ,截距为 ,根据直线 斜率和截距可计算出Km和rmax。
1/r
1/rmax
斜率-Km/rmax
-1/Km
1/CS
图2-2 双倒数法求解Km和rmax
2.2.2.2 抑制剂对酶促反应速率的影响 失活作用 抑制作用 竞争性抑制 非竞争性抑制
式中:
表明C*为Da准数的函数,即
酶促反应的动力学分析与模拟

酶促反应的动力学分析与模拟酶是一种重要的生物催化剂,可以加速生物体内的化学反应速率,促进生物体的正常生长和代谢过程。
酶促反应的动力学是研究酶在反应中所表现的动态过程及其机理的一门学科。
对于生物化学领域的研究者来说,深入理解酶促反应的动力学特性以及相应的模拟研究,不仅可以提高生物医学和生物工程的应用效果,还有助于更好地理解生物体的代谢机制,为生物医学和生物工程的研究提供有力支持。
1. 酶促反应动力学分析酶促反应的动力学特性是指在特定环境下,酶与底物反应的速率和动态过程,不同酶反应具有不同的反应动力学特性。
这些反应通常是多级反应,包括底物的结合、转化和产物的释放。
在这个过程中,催化活性的酶以及底物和产物组成了一个多催化物体系。
因此,酶反应机制在分析时需要考虑多种反应物之间的相互作用。
在酶催化反应中,底物与酶结合并形成酶底物复合物是反应速率的关键步骤。
当复合物形成后,底物开始发生转化并最终生成产物,而这个转化过程的速率大大受酶的活性水平和底物浓度的影响。
除此之外,温度、pH值、离子强度等环境因素也会影响酶反应的动力学特性,其中最主要的是温度。
酶活性与温度的关系可以通过活性温度曲线来体现。
在温度较低的情况下,酶的活性较低。
随着温度的升高,酶的活性不断增加,但当温度超过一定阈值后,酶的构象会发生改变,导致酶失去活性,反应速率下降。
因此,理解酶在不同条件下的活性变化和酶底物复合物转化过程是酶促反应动力学分析的核心。
2. 酶促反应的数学模拟酶促反应的动力学分析不仅仅可以通过实验方法来完成,还可以通过数学模拟方法来进行。
数学模拟是指利用计算机对酶反应过程进行建模和计算,从而分析体系内各分子间的相互作用,研究动力学特性及其机理。
在酶促反应的数学模拟中,需要考虑的参数有:酶的浓度、底物的浓度、酶的动力学性质、酶底物复合物的动态过程等等。
此外,数学模拟还需要结合各种因素对反应的影响因素,如温度、pH值等等。
通过数学模拟可以得到酶促反应的动态变化曲线以及四个重要的动力学参数:最大反应速率(Vmax)、酶的亲和力(Km)、酶反应速率常数(Kcat)和酶底物复合物解离常数(Kd)。
酶催化反应动力学

酶催化反应动力学酶是生物体内一类非常重要的催化剂,可以加速化学反应的速率,而不影响反应的化学平衡。
酶催化反应动力学,即研究酶催化反应速率的变化规律以及影响反应速率的因素。
本文将重点介绍酶催化反应动力学的基本概念、实验方法和相关影响因素。
一、酶催化反应速率酶催化反应速率是反应物转化为产物的速度。
在酶催化下,反应速率明显增加,可以达到每秒数百倍甚至上千倍。
反应速率由酶的浓度、底物浓度、反应温度和pH值等因素决定。
酶催化反应速率通常遵循麦克斯韦-玛尔计算公式,即速率v等于最大反应速率vmax与反应物浓度[S]的比例关系:v = vmax[S] / (Km + [S])。
其中Km称为米氏常数,表示反应物浓度为一半时的速率。
当[S]远大于Km时,速率v ≈ vmax,此时反应速率近似与反应物浓度成正比;当[S]远小于Km时,速率v ≈vmax[S]/Km,此时反应速率与反应物浓度成线性关系。
二、酶催化反应的实验方法进行酶催化反应动力学研究,需要了解反应速率及其影响因素。
实验方法主要包括测定酶催化反应速率的变化和测定酶的两个重要参数:最大反应速率vmax和米氏常数Km。
1. 测定酶催化反应速率的变化测定酶催化反应速率的变化,可以通过观察底物消失或产物增加的速度来确定。
常用的方法包括光度法、荧光法、比色法等。
这些方法都是通过测量反应物和产物的光学性质的变化,建立光学性质与反应速率之间的关系,来间接确定反应速率。
2. 测定最大反应速率vmax测定最大反应速率vmax是了解酶催化能力的重要指标。
最常用的方法是通过实验测量不同底物浓度下的反应速率,并将速率与底物浓度作图。
根据麦克斯韦-玛尔计算公式,绘制速率-底物浓度曲线,可以确定最大反应速率vmax。
3. 测定米氏常数Km米氏常数Km是衡量底物与酶结合力的指标。
测定Km的常用方法是选择一种底物,通过实验测量不同底物浓度下的反应速率,并将速率与底物浓度作图。
绘制速率-底物浓度曲线,可以确定Km。
酶促反应的动力学
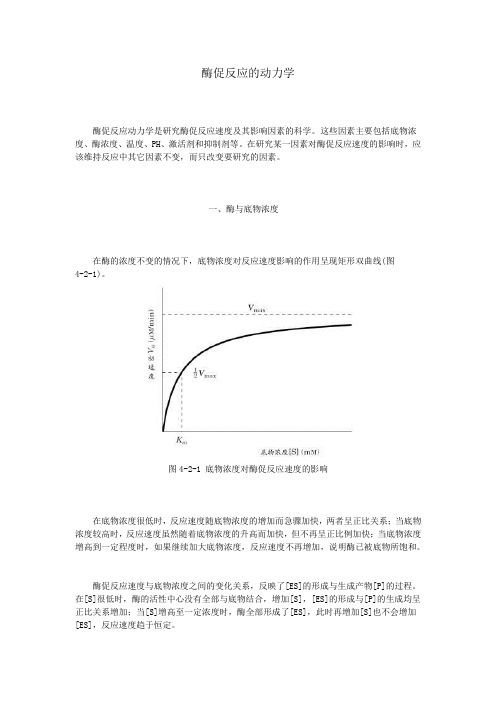
酶促反应的动力学酶促反应动力学是研究酶促反应速度及其影响因素的科学。
这些因素主要包括底物浓度、酶浓度、温度、PH、激活剂和抑制剂等。
在研究某一因素对酶促反应速度的影响时,应该维持反应中其它因素不变,而只改变要研究的因素。
一、酶与底物浓度在酶的浓度不变的情况下,底物浓度对反应速度影响的作用呈现矩形双曲线(图4-2-1)。
图4-2-1 底物浓度对酶促反应速度的影响在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系;当底物浓度较高时,反应速度虽然随着底物浓度的升高而加快,但不再呈正比例加快;当底物浓度增高到一定程度时,如果继续加大底物浓度,反应速度不再增加,说明酶已被底物所饱和。
酶促反应速度与底物浓度之间的变化关系,反映了[ES]的形成与生成产物[P]的过程。
在[S]很低时,酶的活性中心没有全部与底物结合,增加[S],[ES]的形成与[P]的生成均呈正比关系增加;当[S]增高至一定浓度时,酶全部形成了[ES],此时再增加[S]也不会增加[ES],反应速度趋于恒定。
(一)米氏方程为了解释底物浓度与酶促反应速度的关系,1913年Michaelis和Menten把图4-2-1归纳为酶促反应动力学最基本的数学表达式---米氏方程:V=Vmax[S]/(Km+[S])Vmax为反应的最大速度,[S]为底物浓度,Km是米氏常数,V是在某一底物浓度时相应的反应速度。
(二)米氏常数(Km)的意义:1.当反应速度为最大速度一半时,米氏方程可以变换如下:1/2Vmax=Vmax[S]/(Km+[S])所以 Km=[S]。
因此,Km值等于酶促反应最大速度一半时的底物浓度。
2.Km值可判断酶与底物的亲和力(Km值愈大,酶与底物的亲和力愈小;反之亦然)。
3.Km值是酶的特征性常数,只与酶的结构、酶所催化的底物和酶促反应条件有关,与酶的浓度无关。
酶的种类不同,Km值不同,同一种酶与不同底物作用时,Km值也不同。
生物学家研究酶催化反应的动力学

生物学家研究酶催化反应的动力学酶是一种生物催化剂。
它能够加速化学反应,而不会被反应所消耗。
酶对化学反应的加速作用是由于酶与底物之间的相互作用导致的。
生物学家一直在研究酶催化反应的动力学,以了解酶是如何加速化学反应的。
一、酶的动力学概述酶动力学的研究旨在揭示酶对化学反应的加速机制。
酶的动力学参数包括最大反应速率(Vmax)和底物浓度的一半时酶的反应速率(Km)。
这些参数能够揭示酶对化学反应的速率的影响。
如果我们知道了一个酶的动力学参数,我们就可以预测酶在不同底物浓度下的活性。
二、酶的运动学酶的运动学研究的是酶与底物的相互作用。
该领域的主要目标是了解酶如何与底物结合并进行催化。
酶结合底物的步骤涉及多种方式,包括酶亲和力、底物环境、反应物比例等参数。
研究酶在不同环境下对底物的亲和力和反应速率的响应,能够帮助我们更好的了解酶的催化机制。
三、酶的热力学酶的热力学研究的是酶和底物在不同温度和压力下的相互作用。
酶的活性受温度和压力的影响。
研究酶在不同温度下的酶催化速率,可以帮助我们预测酶在不同生物体系中的催化活性。
压力方面,高压下的酶反应是一种广泛的研究领域,其中包括酶晶体学、生物化学和分子模拟等领域。
四、酶的动力学研究方法酶的动力学研究方法包括酶动力学实验室、计算机模拟、独立组合模型等。
实验室中包括各种光谱技术、动态光散射、色谱分析等实验方法,用于测量酶反应速率,酶活性以及底物结合活性等参数。
计算机模拟则是利用计算机模拟程序在计算机上仿真实验,以便更好的理解酶的催化机理。
独立组合模型是表示酶与底物之间的相互作用的数学模型,也是酶学界中经常使用的一种工具,可以帮助人们更好的理解酶催化机构。
总之,生物学家对酶催化反应的动力学一直保持着高度的兴趣。
酶是生物学界中最重要的催化剂之一,它的研究成果不仅对生物技术研发具有重要影响,同时,对于生物医学、环境保护等领域也有重要的意义。
人类对酶催化反应的深入了解,将有助于我们更好的掌握生命系统的复杂性,为社会的发展带来更多的科技创新。
酶工程 第二章酶动力学 第一节酶促反应动力学

1913年前后,米彻利斯(Michaelis)和曼吞(Menten) 在前人工作的基础上,通过大量的定量研究,提出了酶促动力 学基本原理,并推导出了著名的米-曼氏方程,推导过程如下:
根据上述反应式,中间产物ES的生成速度(底物S的消失速度)
v1=k1[S][E]-k2[ES]
(2-1)
而ES的消失速度(产物P的生成速度) v2=k3 [ES],当反应达到 平衡时,即v1=v2时
第一节 酶促反应动力学
对许多酶的性质的观察和研究得知,在低的底物浓度[S]下, 反应速度(v)直接与底物浓度[S]成正比;在高底物浓度[S]下, 速度趋向于最大值(Vmax),此时反应速度与底物浓度[S]无关 (如图2-1)。
图2-1 单底物酶促反应的反应速度与底物浓度的关系
第一节 酶促反应动力学
图2-5 乒乓反应机理 实际上,多底物酶促反应动力学是非常复杂的,以上只是作以简要介绍, 有关详细内容,可查阅相关专著。
将米氏方程改写成以下形式
以 对作图,绘出曲线,横轴截距即为-值,纵轴截距则是 (图2-2)。
第一节 酶促反应动力学
图2-2 双倒数作图
第一节 酶促反应动力学
二、多底物动力学 通常情况下,酶催化反应涉及两个(少数情况下三个)底物。 现在我们考虑一个涉及两种底物和两种产物的酶促反应物反应。现在已知的生化反应 中有六成以上属于这一种反应。双底物反应的机理有下面三种 可能:
第一节 酶促反应动力学
1.有序反应机理(ordered reaction) 这种情况下,A和B分别可被说成是先导底物和后随底物,Q 是A的产物,最后被释放。A和Q竞争同游离酶E结合,但A和B则 不会(或者Q和B也不会)发生竞争(如图2-3)。依赖烟酰胺腺 嘌呤二核苷酸(NAD+或NADP+)的脱氢酶的反应就属于这种类型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶促反应动力学酶促反应动力学(kinetics of enzyme-catalyzed reactions):酶反应动力学主要研究酶催化的反应速度以及影响反应速度的各种因素。
在探讨各种因素对酶促反应速度的影响时,通常测定其初始速度来代表酶促反应速度,即底物转化量<5%时的反应速度。
1.底物浓度对反应速度的影响:⑴底物对酶促反应的饱和现象:由实验观察到,在酶浓度不变时,不同的底物浓度与反应速度的关系为一矩形双曲线,即当底物浓度较低时,反应速度的增加与底物浓度的增加成正比(一级反应);此后,随底物浓度的增加,反应速度的增加量逐渐减少(混合级反应);最后,当底物浓度增加到一定量时,反应速度达到一最大值,不再随底物浓度的增加而增加(零级反应)。
⑵米氏方程及米氏常数:根据上述实验结果,Michaelis & Menten 于1913年推导出了上述矩形双曲线的数学表达式,即米氏方程:ν= Vmax[S]/(Km+[S])。
其中,Vmax为最大反应速度,Km为米氏常数。
⑶Km和Vmax的意义:①当ν=Vmax/2时,Km=[S]。
因此,Km等于酶促反应速度达最大值一半时的底物浓度。
②当k-1>>k+2时,Km=k-1/k+1=Ks。
因此,Km可以反映酶与底物亲和力的大小,即Km值越小,则酶与底物的亲和力越大;反之,则越小。
③Km可用于判断反应级数:当[S]<0.01Km时,ν=(Vmax/Km)[S],反应为一级反应,即反应速度与底物浓度成正比;当[S]>100Km时,ν=Vmax,反应为零级反应,即反应速度与底物浓度无关;当0.01Km<[S]<100Km时,反应处于零级反应和一级反应之间,为混合级反应。
④Km是酶的特征性常数:在一定条件下,某种酶的Km值是恒定的,因而可以通过测定不同酶(特别是一组同工酶)的Km值,来判断是否为不同的酶。
⑤Km可用来判断酶的最适底物:当酶有几种不同的底物存在时,Km值最小者,为该酶的最适底物。
⑥Km可用来确定酶活性测定时所需的底物浓度:当[S]=10Km时,ν=91%Vmax,为最合适的测定酶活性所需的底物浓度。
⑦Vmax可用于酶的转换数的计算:当酶的总浓度和最大速度已知时,可计算出酶的转换数,即单位时间内每个酶分子催化底物转变为产物的分子数。
⑷Km和Vmax的测定:主要采用Lineweaver-Burk双倒数作图法和Hanes作图法。
2.酶浓度对反应速度的影响:当反应系统中底物的浓度足够大时,酶促反应速度与酶浓度成正比,即ν=k[E]。
3.温度对反应速度的影响:一般来说,酶促反应速度随温度的增高而加快,但当温度增加达到某一点后,由于酶蛋白的热变性作用,反应速度迅速下降。
酶促反应速度随温度升高而达到一最大值时的温度就称为酶的最适温度。
酶的最适温度与实验条件有关,因而它不是酶的特征性常数。
低温时由于活化分子数目减少,反应速度降低,但温度升高后,酶活性又可恢复。
4.pH对反应速度的影响:观察pH对酶促反应速度的影响,通常为一钟形曲线,即pH过高或过低均可导致酶催化活性的下降。
酶催化活性最高时溶液的pH值就称为酶的最适pH。
人体内大多数酶的最适pH在6.5~8.0之间。
酶的最适pH不是酶的特征性常数。
5.抑制剂对反应速度的影响:凡是能降低酶促反应速度,但不引起酶分子变性失活的物质统称为酶的抑制剂。
按照抑制剂的抑制作用,可将其分为不可逆抑制作用和可逆抑制作用两大类。
⑴不可逆抑制作用:抑制剂与酶分子的必需基团共价结合引起酶活性的抑制,且不能采用透析等简单方法使酶活性恢复的抑制作用就是不可逆抑制作用。
如果以ν~[E]作图,就可得到一组斜率相同的平行线,随抑制剂浓度的增加而平行向右移动。
酶的不可逆抑制作用包括专一性抑制(如有机磷农药对胆碱酯酶的抑制)和非专一性抑制(如路易斯气对巯基酶的抑制)两种。
⑵可逆抑制作用:抑制剂以非共价键与酶分子可逆性结合造成酶活性的抑制,且可采用透析等简单方法去除抑制剂而使酶活性完全恢复的抑制作用就是可逆抑制作用。
如果以ν~[E]作图,可得到一组随抑制剂浓度增加而斜率降低的直线。
可逆抑制作用包括竞争性、反竞争性和非竞争性抑制几种类型。
①竞争性抑制:抑制剂与底物竞争与酶的同一活性中心结合,从而干扰了酶与底物的结合,使酶的催化活性降低,这种作用就称为竞争性抑制作用。
其特点为:a.竞争性抑制剂往往是酶的底物类似物或反应产物;b.抑制剂与酶的结合部位与底物与酶的结合部位相同;c.抑制剂浓度越大,则抑制作用越大;但增加底物浓度可使抑制程度减小;d.动力学参数:Km值增大,Vm值不变。
典型的例子是丙二酸对琥珀酸脱氢酶(底物为琥珀酸)的竞争性抑制和磺胺类药物(对氨基苯磺酰胺)对二氢叶酸合成酶(底物为对氨基苯甲酸)的竞争性抑制。
②反竞争性抑制:抑制剂不能与游离酶结合,但可与ES复合物结合并阻止产物生成,使酶的催化活性降低,称酶的反竞争性抑制。
其特点为:a.抑制剂与底物可同时与酶的不同部位结合;b.必须有底物存在,抑制剂才能对酶产生抑制作用;c.动力学参数:Km减小,Vm降低。
③非竞争性抑制:抑制剂既可以与游离酶结合,也可以与ES复合物结合,使酶的催化活性降低,称为非竞争性抑制。
其特点为:a.底物和抑制剂分别独立地与酶的不同部位相结合;b.抑制剂对酶与底物的结合无影响,故底物浓度的改变对抑制程度无影响;c.动力学参数:Km值不变,Vm值降低。
6.激活剂对反应速度的影响:能够促使酶促反应速度加快的物质称为酶的激活剂。
酶的激活剂大多数是金属离子,如K+、Mg2+、Mn2+等,唾液淀粉酶的激活剂为Cl-。
影响反应速度的有六大因素:1酶浓度2底物浓度3温度4pH5激活剂6抑制剂,而1和2是内因,3-6是外因。
这个问题首先你要知道什么是Km值,先看一下推导:E+S->ES 平衡常数K1ES->E+S 平衡常数K2ES->P+E 平衡常数K3其中:E是酶 S是底物 P是产物开始时:ES生成速度:V1=K1[E][S]ES分解速度:V2=K2[ES]+K3[ES]=(K2+K3)[ES]在恒态时:V1=V2 => (K2+K3)[ES]=K1[E][S]=>(K2+K3)/K1=[E][S]/[ES]令:Km=(K2+K3)/K1即:Km=[E][S]/[ES]Km的意义:设V=1/2VmaxKm=[S]即Km是反应速度为最大反应速度一半时的底物浓度。
Km是酶的特征性常数:一个酶对一个特定的底物,有一个特定的Km与之对应。
注:Km与酶的浓度无关,与酶的性质有关,与底物浓度有关,同一酶对不同的底物有不同的Km值。
因此Km是酶的特征常数。
最适温度和pH只是影响因素。
用哲学的话说:外因通过内因起作用。
呵呵。
高达档案馆A.M.B.A.C.系统在米诺夫斯基粒子散布下的宇宙空间中,必然需要近距离缠斗之交战型态.如此在战斗中,传统宇宙战斗机受到搭载推进燃料限制,运作时间便极为短暂.例如宇宙战斗机在与敌机交会后,欲再次使机体与敌接触的状况,得朝行进中的反方向喷射,且一定非得藉由喷射以修正其机体方位不可.此时推进燃料的消耗量是极大的,在旧型宇宙战斗机的情形,180"姿势变化要在2.5秒进行,约30次即会耗尽推进燃料.而由于在无大气存在的宇宙空间,不会受到空气阻力或摩擦等阻碍的关系,此虽有利于加速时的机体速度保持,却造成机体运动时极端不利的影响. 有鉴于此,MS的开发厂商,吉翁尼克(ZIONIC)公司的技术群,研究出「AMBAC系统」(Active Mass Balance Auto-Control,主动凭质量运动自动控制姿势)来克服此一问题. 相对于传统战机欲变换其机体姿势,而利用向量火箭喷射的状况,AMBAC系统则可藉由使手或脚高速移动所产生的反作用力,而改变机体的方位与姿势.由运用米诺夫斯基物理学之强力核融合系统,与将所产生动力传达至各关节传动部分之微波系统,使如MS般巨大的机体,也可快速运动其手脚,拜此之赐,将可实现3秒内作180"的机体姿势转换.如以此方式运作,由于也可以在几乎不消耗推进燃料的情形下控制机体,便能够大幅地延长作战的行动时间.再者,如果能擅用MS的四肢,也可不用到推进燃料而作加速与移动.举例而言,操作者可藉助「踢」向漂浮在宇宙空间的陨石、残骸等大质量物体,而获得推进机体的效果.再者,具有手臂与手部的MS,将获得更多的优越点.在各种不同的战术性场合中,能够因应状况的需求而自由地更换所持武装.在此之外,如配备高精密度的操控手臂,不单是战斗,并可同时进行种种的大型作业.当局更判断,如进一步加以改良,也可作为陆战武器而广泛地运用.米诺夫斯基(Minovsky)粒子在UC 0065年米诺夫斯基物理学会的研究员在研究米洛夫斯基型反应堆时发现了一个奇怪的电磁波现象,这个现象完全不能用传统的物理学来解释。
在随后数年中,他们找出了原因:在helium-3反应时产生了一种新型的粒子,这种粒子随后被命名为米诺夫斯基粒子。
米诺夫斯基粒子有着接近0的静止质量,以及,像其他粒子一样当动能增加时它的质量也增加、可以携带正负电荷的特性。
I-力场(I-field)当把米诺夫斯基粒子散布到空气或空间中时,带有电荷的米洛夫斯基粒子会由于之间的排斥力自发地形成成空间的格状结构,这种粒子散布状况被叫做I-力场。
I-力场能造成干涉的效果,叫做米洛夫斯基效应,可以阻挡低频率的电磁波例如雷达核微波的传递--甚至连红外线都可以影响,但不能完全阻挡。
I-力场自己是布可见的,只能检测到它的存在。
只要一带电荷,I-力场就不能透过金属、水、地表、以及其他任何可以导电的物质。
然而,在贴近地面的地方,利用这种特性可以在地面和战舰的底部之间产生一种I-力场的垫子,构成一个反重力的浮力场。
这个原理被用作一年战争中米洛夫斯基飞行器系统的基础并最终成为所有宇宙战舰的标准配臵,但后来几十年内还是未能实现能够装备在机动战士上面的米洛夫斯基飞行系统的小型化。
I力场的另一个运用,也就是大家最为熟悉的,就是I-力场防御屏。
屏障发生器在自己周围产生一个浓密的I-力场形成一个可以抵御米洛夫斯基物理学光束武器的攻击的屏障。
这个屏障对于激光和类似导弹的物理攻击不起作用,而在屏障内,光束武器还是可以发挥它们本来的致命效果。
米加(Maga)粒子米加粒子为正、负米诺夫斯基粒子融合后所产生的基本粒子。
于粒子加速器内发生的米诺夫斯基粒子,其电荷由T力(T Force)构成立方格结。
此立方格结构透过强力的I力场(Force)压缩,米诺夫斯基粒子「退缩」,正、反两个米诺夫斯基粒子融合,并成为米加粒子。
使此时立方格结构缩小的米诺夫斯基粒子,质量增大至表面之上。
