鲁教版五四制八年级化学全册课件:氧气(共27张PPT)
合集下载
氧气(第2课时)课件----八年级化学鲁教版(五四学制)全一册

实验三:氧气与蜡烛反应
蜡烛在氧气中燃烧比在空气中更剧烈,产物为水和二氧化碳, 文字表达式:石蜡+氧气 点燃 二氧化碳和水
【实验总结】 (1)在空气中能燃烧的物质在氧气中燃烧更剧烈(如木炭、石蜡), 一些在空气中不易燃烧的物质在氧气中却能燃烧(如铁丝)。 (2)物质与氧气发生化学反应时,单位体积的空间里氧分子数 目越多,反应就越剧烈。
提示:大多数物质与氧气在特定情况下才能反应,一般情况下 能够“和平共处”,只是因为缺乏必需的条件,如点燃或加热。
(2)如果空气的组成不是现在的样子,而是氧气占78%,氮气 占21% ,世界会是什么样的?
提示: ①植物生存困难,动植物进化可能变异; ②火灾急速蔓延,难以扑灭,损失难以估计; ③食物快速氧化变质; ......
自然界中的氧循环
O3
H2O
O2
日光
CO2
臭氧层
1.自然界中氧气主要产生与消耗的途径 产生途径----光合作用
消耗途径----呼吸作用、燃料的燃烧
大气中的O2
呼吸 作用
大气中的O2
可燃物 的燃烧
2.氧循环的意义
(1)维持了相对恒定的大气含氧量。 (2)构建了陆地、海洋和大气等环境的物质和能量平衡。 (3)为生态系统的正常运转提供可靠的资源保障。
2.发生高原反应,吸氧可使症状得到缓解。吸氧可以帮助人克服 高原反应的原因是 ( C ) A.氧气是无色、无味的无毒气体 B.氧气可以燃烧 C.吸氧为人体呼吸提供了适量氧气 D.氧气可以支持燃烧
3.下列说法中正确的是( B ) A.红磷在氧气中能燃烧,在空气中不能燃烧 B.硫在氧气中燃烧后生成有刺激性气味的气体 C.镁条在氧气中燃烧时,火星四射,生成黑色固体 D.木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光
第二节 氧气的性质(课件)-八年级化学全一册(鲁教版五四学制2024)

氧化物
非金属氧化物 H2O CO2 SO2
氧元素在自然界中的循环,广泛存 在于物质的天然转化、人工转化以 及生命活动过程中。
观察思考4-4
了解自然界中的养循环
观察右图,看看氧元素在自然界里是怎样循环的。 思考:1.自然界中氧气产生与消耗的途径主要有哪些? 2.氧气是性质比较活泼 的气体,自然界中很多物质 在常温下就能与氧气发生化 学反应,那为什么大气中氧 气的含量没有越来越低呢?
物质跟氧气发生化学反应时,单位体积的空间里分子的数目越多
(即氧气浓度越大),反应就越剧烈。
3.氧气与硫反应:将硫放在燃烧匙,在酒精灯上点燃,然后把盛有燃
着硫的燃烧匙伸进充满氧气的集气瓶里,(瓶中预先留少量水),观
察现象。
吸收产生的二氧化 硫,防止污染空气
发出微弱的淡蓝色火焰,有刺 硫丝在空气燃烧 激性气味气体产生,放出热量
第四单元
我们周围的空气
第二节 氧气的性质
目 录
重点:氧气的化学性质
CONTENTS
1 了解氧气的物理性质
2
认识氧气的化学性质,学习探究气体性质 的方法
3
认识碳、硫、铁等物质与氧气反应的现象 及文字表达式
难点:探究归纳氧气的化学性质
课堂导入
氧气与世间万物如影随形,动 植物呼吸、燃料燃烧、钢铁冶 炼等都需要氧气。这些变化虽 然发生的场所和产生的现象各 不相同,但都与氧气的性质有 关。
探究新知
氧气是氧元素最常见的单质形态, 是空气的主要成分之一。
观察思考4-3
氧气的物理性质
观察集气瓶中的氧气,并结合下列给出的数据
和你的生活经验,归纳氧气的物理性质。
在标准状况(0℃、1.01×105Pa)下,氧气
氧气课件—八年级化学鲁教版(五四学制)全一册

鲁教版
§4—2 性质活泼的氧气
第二课时 氧气的性质
学习目标
◇知识与技能 认识氧气的性质。
◇过程与方法
学习探究气体性质的方法。 ◇情感、态度与价值观
增强对化学现象的探究愿望,培养学习化
学的兴趣。
重难点解读
△重点:氧气的化学性质。
△难点:氧气的化学性质。
氧
冶给 的
气
炼病 蓝 钢人 色
的
铁
输 氧
钢 瓶
主
要
嫦 娥
用
一 号
途
卫 星 发
射
`` `
视察一瓶氧气
放的视 置色察 方态氧 法味气
资料:
卖鱼市场上,鱼池的水中鱼能自由的 游泳呼吸,但过一段时间卖鱼人就要向 水池中舀水或通入氧气.
任务一:氧 气 的 物 理 性 质
1、色、味、态:
20℃,101kPa
在通常情况下是无色、无味的气体
0又是氧化反应
任务四:自然界中的氧循环
阅读课文P92—93,了解氧在自然界中的氧循环。
1、在自然界中通过氧气以及各种含氧化合物 的天然或人工转化形成持续、稳定的氧循环。
2、缓慢氧化:反应缓慢,甚至不易被觉察的 氧化反应。
当堂训练
1.通常状况下,氧气是一种_无__色__、_无__味__的_气___体,密度 _比__空__气__大__,不___易__溶于水。
结论
石蜡+氧气 点燃 二氧化碳+水
氧气能与多种化合物反应
石蜡在氧气中燃烧
想一想
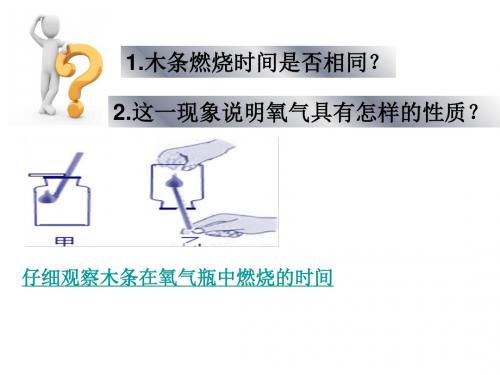
上面的实验中物质在空气中燃烧与在 氧气中燃烧现象一样么?这说明了什么?
物质在空气中燃烧主要是与空气 中的氧气反应,反应的剧烈程度取 决于氧气的含量,氧气含量越高, 燃烧越剧烈。
§4—2 性质活泼的氧气
第二课时 氧气的性质
学习目标
◇知识与技能 认识氧气的性质。
◇过程与方法
学习探究气体性质的方法。 ◇情感、态度与价值观
增强对化学现象的探究愿望,培养学习化
学的兴趣。
重难点解读
△重点:氧气的化学性质。
△难点:氧气的化学性质。
氧
冶给 的
气
炼病 蓝 钢人 色
的
铁
输 氧
钢 瓶
主
要
嫦 娥
用
一 号
途
卫 星 发
射
`` `
视察一瓶氧气
放的视 置色察 方态氧 法味气
资料:
卖鱼市场上,鱼池的水中鱼能自由的 游泳呼吸,但过一段时间卖鱼人就要向 水池中舀水或通入氧气.
任务一:氧 气 的 物 理 性 质
1、色、味、态:
20℃,101kPa
在通常情况下是无色、无味的气体
0又是氧化反应
任务四:自然界中的氧循环
阅读课文P92—93,了解氧在自然界中的氧循环。
1、在自然界中通过氧气以及各种含氧化合物 的天然或人工转化形成持续、稳定的氧循环。
2、缓慢氧化:反应缓慢,甚至不易被觉察的 氧化反应。
当堂训练
1.通常状况下,氧气是一种_无__色__、_无__味__的_气___体,密度 _比__空__气__大__,不___易__溶于水。
结论
石蜡+氧气 点燃 二氧化碳+水
氧气能与多种化合物反应
石蜡在氧气中燃烧
想一想
上面的实验中物质在空气中燃烧与在 氧气中燃烧现象一样么?这说明了什么?
物质在空气中燃烧主要是与空气 中的氧气反应,反应的剧烈程度取 决于氧气的含量,氧气含量越高, 燃烧越剧烈。
鲁教版(五四制)化学八年级全册:4.2氧气第1课时课件

在空气中燃烧
在氧气中燃烧
硫在 空气 中燃 烧
【现象】1、产生微弱的淡蓝色火焰 2、放热 3、生成有刺激性气味气体
硫在 氧气 中燃 烧
【现象】 1、发出明亮的蓝紫色火焰 2、放热 3、生成有刺激性气味气体
点燃
文字表达式: 硫 + 氧气 → 二氧化
硫
点燃
S + O2 → SO2
思考: 硫在氧气里燃烧,为 什么集气瓶底要留少量水?
文字表达式:
铁 + 氧气 Fe + O2
点燃 点燃
四氧化三铁 Fe3O4
思考: (1)做这个实验时,为了实验成功,铁丝上为什么 系一根火柴棒?还要将铁丝绕成螺旋状,为什么?
引燃铁丝。增大与氧气的接触面积聚热使铁丝容 易燃烧。
思考:(2)实验前为什么在瓶底放一些水或铺 一层细沙?
为了防止燃烧时溅落的熔融物炸裂瓶底。
一、氧气的性质
一般指颜色、状态、气味、熔点、沸点、硬 度和密度、是否溶于水等。
1、物理性质
①色、味、态:
②密度:
无色无味气体(标准状况)
③水溶性: ④熔沸点:
比空气密度略大
不易溶于水
气体物理性质的归纳一般包含三部分: ①色、 味、态②密度③水溶性
⑤三态转化: (淡蓝色)液态氧
101kPa, -183℃
碳 + 氧气
点燃 二氧化碳
C + O2
点燃
CO2
思考:木炭和硫分别在空气里燃烧和在 氧气里燃烧的现象不同,这说明什么?
说明燃烧的剧烈程度跟氧气的含量有 关,氧气含量越高,燃烧越剧烈。
(3)铁丝(银白色色固体)与氧气反应(实验2-4)
在空气中:铁丝不能燃烧, 发生红热现象。
八年级下册化学课件4.2《氧气》|鲁教版(五四制)4 (共22张PPT)

是( B)
A、氧气可供登山运动员呼吸 B、液氧用于宇航飞行器发动机的燃料 C、氧气用于气焊、气割时气体燃料的助燃剂
D、氧气可用于炼钢
7、关于下面的反应,说法正确的是( A )
A、是氧化反应,不是化合反应 B、是氧化反应,也是化合反应 C、不是氧化反应,是化合反应 D、不是氧化反应,也不是化合反应
防止火柴燃烧消耗过多的氧气而使铁丝 不能顺利燃烧
④预先在集气瓶中装少量水或在瓶底铺一薄层
细沙: 防止熔化物溅落炸裂集气瓶底
2.铁在氧气中燃烧
现 象:
(1)在氧气中剧烈燃烧,火星四射
(2)放出大量的热
(3)生成一种黑色固体 [不能说生成四氧化三铁]
文字表达式:
点燃
铁 + 氧气
四氧化三铁
3.与石蜡反应
分析
点燃
碳 + 氧气
二氧化碳
铁 + 氧气 点燃 四氧化三铁
石蜡 + 氧气 点燃 水 + 二氧化碳 磷 + 氧气 点燃 五氧化二磷
氧化反应:
很多物质能跟氧气发生反应,这些反应 是氧化反应
化合反应:
两种或两种以上的物质生成另一种物质 的反应。
A+BC ﹙多变一)
综上所述: 氧气能跟很多物质反应,是一种化
水 + 二氧化碳
4.与磷的反应 现 象:
(1)在空气中燃烧产生大量白烟
(2)在氧气中燃烧的更旺,发出白光 放出热量,产生大量白烟。
文字表达式:
点燃
磷 + 氧气
五氧化二磷
思考:木炭、石蜡在氧气中燃烧比在 空气中燃烧更加剧烈,为什么?
答:氧气比空气的纯度高,氧气 含量高。
物质在纯氧中接触到氧分子的几 率更大,反应就更剧烈。
A、氧气可供登山运动员呼吸 B、液氧用于宇航飞行器发动机的燃料 C、氧气用于气焊、气割时气体燃料的助燃剂
D、氧气可用于炼钢
7、关于下面的反应,说法正确的是( A )
A、是氧化反应,不是化合反应 B、是氧化反应,也是化合反应 C、不是氧化反应,是化合反应 D、不是氧化反应,也不是化合反应
防止火柴燃烧消耗过多的氧气而使铁丝 不能顺利燃烧
④预先在集气瓶中装少量水或在瓶底铺一薄层
细沙: 防止熔化物溅落炸裂集气瓶底
2.铁在氧气中燃烧
现 象:
(1)在氧气中剧烈燃烧,火星四射
(2)放出大量的热
(3)生成一种黑色固体 [不能说生成四氧化三铁]
文字表达式:
点燃
铁 + 氧气
四氧化三铁
3.与石蜡反应
分析
点燃
碳 + 氧气
二氧化碳
铁 + 氧气 点燃 四氧化三铁
石蜡 + 氧气 点燃 水 + 二氧化碳 磷 + 氧气 点燃 五氧化二磷
氧化反应:
很多物质能跟氧气发生反应,这些反应 是氧化反应
化合反应:
两种或两种以上的物质生成另一种物质 的反应。
A+BC ﹙多变一)
综上所述: 氧气能跟很多物质反应,是一种化
水 + 二氧化碳
4.与磷的反应 现 象:
(1)在空气中燃烧产生大量白烟
(2)在氧气中燃烧的更旺,发出白光 放出热量,产生大量白烟。
文字表达式:
点燃
磷 + 氧气
五氧化二磷
思考:木炭、石蜡在氧气中燃烧比在 空气中燃烧更加剧烈,为什么?
答:氧气比空气的纯度高,氧气 含量高。
物质在纯氧中接触到氧分子的几 率更大,反应就更剧烈。
鲁教版(五四制)八年级化学全册4.22氧气 课件(18张PPT)

要求:仔细观看实验视频, 注意实验步骤,现象。
4.氧气的检验:
验证O2:
用带火星的木条伸入瓶中,若木 条复燃,此瓶盛氧气。
验满:
用带火星的木条平放在集气瓶口, 木条复燃则已满。
(2012淄博)实验室制取气体时,首先要选择反应物,明确如何控制反应 条件,然后确定气体发生和收集装置,还要考虑装置是否符合环保、安 全等要求.请回答以下问题:
高锰酸钾(KMnO4)氯酸钾(KClO3) 过氧化氢(H2O2) _甲__烷__(__C_H__4_)_____
_氯__化__钠__(__N__a_C_l_) 水(H2O)
活动天地4-3
收集证据,对比分析 :
物质
条件
现象
结论
过
氧 ①常 温
不复燃 没有氧气放出
化
氢 ②加 热
溶
液 ③ 加入二氧 化锰
(1)实验室制取氧气时,下列物质不能
直接作为原料的是②⑥ (填序号),判断的依据
是 化学反应前后元素种类不变 .
①水(H2O) ②氯化钠(NaCl) ③氯酸钾(KClO3)④高锰酸钾(KmnO4) ⑤过氧化氢(H2O2)⑥甲烷(CH4) (2)当确定了实验室制取某种气体的化学反应原理后,还应该考虑
原料是否容易获得、反应速率是否适中 等因素(写一项即可).选择气体的 收集方法时,以下气体性质中不需要考虑的因素是①③(填序号).① 颜色 ②密度 ③可燃性 ④溶解性
H2O + O2
2、实验装置
选择该发生装置和收集装 置的理论依据?
3.制取氧气的操作步骤:
1.按照自下而上、从左到右的顺序安装实验装置并检查装置 的气密性。 2.先向锥形瓶中加入约0.1g二氧化锰,再向分液漏斗中加入 约15ml过氧化氢溶液,并将盛满水的集气瓶倒入水槽中。 3.打开分液漏斗的活塞,将过氧化氢溶液缓缓滴入锥形瓶中, 待导管有气泡连续、均匀产生时,再把导管伸入集气瓶中。集 满后用玻璃片在水面下盖住瓶口,移出水面,正放在实验台上。
4.氧气的检验:
验证O2:
用带火星的木条伸入瓶中,若木 条复燃,此瓶盛氧气。
验满:
用带火星的木条平放在集气瓶口, 木条复燃则已满。
(2012淄博)实验室制取气体时,首先要选择反应物,明确如何控制反应 条件,然后确定气体发生和收集装置,还要考虑装置是否符合环保、安 全等要求.请回答以下问题:
高锰酸钾(KMnO4)氯酸钾(KClO3) 过氧化氢(H2O2) _甲__烷__(__C_H__4_)_____
_氯__化__钠__(__N__a_C_l_) 水(H2O)
活动天地4-3
收集证据,对比分析 :
物质
条件
现象
结论
过
氧 ①常 温
不复燃 没有氧气放出
化
氢 ②加 热
溶
液 ③ 加入二氧 化锰
(1)实验室制取氧气时,下列物质不能
直接作为原料的是②⑥ (填序号),判断的依据
是 化学反应前后元素种类不变 .
①水(H2O) ②氯化钠(NaCl) ③氯酸钾(KClO3)④高锰酸钾(KmnO4) ⑤过氧化氢(H2O2)⑥甲烷(CH4) (2)当确定了实验室制取某种气体的化学反应原理后,还应该考虑
原料是否容易获得、反应速率是否适中 等因素(写一项即可).选择气体的 收集方法时,以下气体性质中不需要考虑的因素是①③(填序号).① 颜色 ②密度 ③可燃性 ④溶解性
H2O + O2
2、实验装置
选择该发生装置和收集装 置的理论依据?
3.制取氧气的操作步骤:
1.按照自下而上、从左到右的顺序安装实验装置并检查装置 的气密性。 2.先向锥形瓶中加入约0.1g二氧化锰,再向分液漏斗中加入 约15ml过氧化氢溶液,并将盛满水的集气瓶倒入水槽中。 3.打开分液漏斗的活塞,将过氧化氢溶液缓缓滴入锥形瓶中, 待导管有气泡连续、均匀产生时,再把导管伸入集气瓶中。集 满后用玻璃片在水面下盖住瓶口,移出水面,正放在实验台上。
鲁教版五四制八年级化学课件第二节氧气

( 2 ) CO2二氧化碳是一种无色气体,高温时能产生氧气, 成本高,且产生的氧气不易与二氧化碳分离。
(3)H2O2过氧化氢又称双氧水,是一种无色的液体,常 温下就可生成氧气和水,反应速度适中,价格低廉。 (4)HgO氧化汞是一种红色粉末,加热时能产生氧气, 同时产生有毒的物质汞。 ( 5 ) H2O水在通电的条件下能产生氧气,成本高,反应 速度太慢。
氯酸钾
二氧化锰
加 热
加 热
氯化钾 + 氧气
高锰酸钾
锰酸钾+二氧化锰+氧气
根据反应原理,我们应该怎样组装仪器?
用高锰酸钾、氯酸钾制取氧气的装置 (固固加热型) 铁 架 台
试管 酒 精 灯
棉 花
集气瓶
发生装置
常见类型:
固固加热型
固液不加热型
选择依据: 依据反应物的状态、反应发生的条件
二、氧气的性质
加热 高温
氧Hale Waihona Puke 汞二氧化硅 二氧化碳+水
点燃
过氧化氢
二氧化锰
水 + 氧气
2、下列化学反应既属于化合反应又属于氧化反应的是 ( A)
A。硫 + 氧气
B。蜡烛 + 氧气 C。碱式碳酸铜 D。乙炔 + 氧气
点燃 点燃 加热 点燃
二氧化碳
二氧化碳 + 水 氧化铜 + 二氧化碳 +水 二氧化碳 + 水
以上反应既不属于氧化反应又不属于化合反应的是: (
四氧化三铁 水+二氧化碳
点燃
想一想:这三个反应有什么共同点吗?
点燃
碳+氧气 铁+氧气 石蜡+氧气
点燃 点燃
2022年鲁教版(五四制)化学八年级全一册- 氧气的性质、氧循环 课件

界中的氧循环 学生自主学习完成学案内容。
目的:最后一个部分内容相对简单, 所以从培养学生自主学习能力着手, 最后由组长带领交流。
六、检测巩固 目的:对知识的及时巩固。
课堂小结
本节课最大的收获是学生找到学习的 方法和学习的乐趣。在完成本节课后我 布置了一个挑战作业,家庭实验制氧气, 用身边的仪器,用药店的药品(双氧 水),很多同学都去想、去尝试并且成 功了,还应用了不同的催化剂,自制了 铁架台、石棉网,那么我敢说,这节课 他真的掌握了!
药品的状态 反应条件
2、选择气体收集装置的依据: 气体的溶解性 气体的密度
目的:通过小组合作,找出实 验室制氧气的仪器装置。
二、小组合作与展示
目的:通过小组合作,找出实 验室制氧气的方法。可以小组 派代表上台说明本组想法。
三、教师点拨
1、视频播放:实验室制取氧气。
2、教师补充高锰酸钾制氧气视频。
由于本节课有实验,所以先观看视频 了解注意事项,学生再动手实验。这样把 理论与实践相结合。
问题引入
1、同学们通过查阅资料对于氧气了解了 多少呢? 2、通过课下小组讨论活动天地4-2,你认 为哪些物质可以在实验室中制氧气?依据 是什么? 目的:初步认识氧气,为实验室制氧气选 择好药品。
合作探究
一、实验室制取气体物质的思路分析 1、制取气体时选择发生装置的依据:
4.2.2 氧气的性质、氧循环
教学目标
1.在实验室中动手实验制得氧气,体会制取 气体的一般思路和方法。 2.在实验探究中获得研究气体性质的一般思 路和方法。 3.学生能乐于主动参与实验探究,感悟氧循 环对人类的意义,培养学生环保意识和社会 责任感。
教学方法
首先采用谈话法引入本课,然后实行讨论 和图片展示相结合的教学方法,不断引导 与启发学生。
目的:最后一个部分内容相对简单, 所以从培养学生自主学习能力着手, 最后由组长带领交流。
六、检测巩固 目的:对知识的及时巩固。
课堂小结
本节课最大的收获是学生找到学习的 方法和学习的乐趣。在完成本节课后我 布置了一个挑战作业,家庭实验制氧气, 用身边的仪器,用药店的药品(双氧 水),很多同学都去想、去尝试并且成 功了,还应用了不同的催化剂,自制了 铁架台、石棉网,那么我敢说,这节课 他真的掌握了!
药品的状态 反应条件
2、选择气体收集装置的依据: 气体的溶解性 气体的密度
目的:通过小组合作,找出实 验室制氧气的仪器装置。
二、小组合作与展示
目的:通过小组合作,找出实 验室制氧气的方法。可以小组 派代表上台说明本组想法。
三、教师点拨
1、视频播放:实验室制取氧气。
2、教师补充高锰酸钾制氧气视频。
由于本节课有实验,所以先观看视频 了解注意事项,学生再动手实验。这样把 理论与实践相结合。
问题引入
1、同学们通过查阅资料对于氧气了解了 多少呢? 2、通过课下小组讨论活动天地4-2,你认 为哪些物质可以在实验室中制氧气?依据 是什么? 目的:初步认识氧气,为实验室制氧气选 择好药品。
合作探究
一、实验室制取气体物质的思路分析 1、制取气体时选择发生装置的依据:
4.2.2 氧气的性质、氧循环
教学目标
1.在实验室中动手实验制得氧气,体会制取 气体的一般思路和方法。 2.在实验探究中获得研究气体性质的一般思 路和方法。 3.学生能乐于主动参与实验探究,感悟氧循 环对人类的意义,培养学生环保意识和社会 责任感。
教学方法
首先采用谈话法引入本课,然后实行讨论 和图片展示相结合的教学方法,不断引导 与启发学生。
山东教育出版社(五四制)初中八年级化学全一册全套PPT课件

④不把滴管放实验台或其他地方,以免沾污滴管。
实验室很多化学药品都是易燃、易爆、有腐蚀性或有毒的。
6
实验室化学药品的取用原则:
三不 原则 节约 原则
①不能用手直接接触药品;②不要把鼻孔凑到容 器口去闻药品;③不得品尝任何药品的味道。 按照实验要求取用药品,如未说明用量,一般取
最少量。液体取1~2mL,固体盖满试管底部即可。
化学变化的基本特征是有新物质生成,常表现为
发光、放热、颜色改变、放出气体、生成沉淀等。
可以根据这些现象推断是否发生化学变化。
化学变化还伴随着能量的变化,表现
为热能、光能和电能的释放或吸收。
储存 能量
化学 反应
释放 能量
电能
化学变化的同时会发生物理变化——蜡烛燃烧
蜡烛受热融化 蜡烛燃烧生成 水和二氧化碳
探究步骤 点燃前
对 现 象 的 观 察 和 描 述 白色块状固体,质软,无气 味,难溶于水,密度比水小 蜡烛熔成液态;火柴梗燃烧部位分为三部分, 外层焦黑,内层发黄;放出大量热;生成能 使澄清石灰水变浑浊的气体和无色的液滴 有白烟且可被点燃
燃烧时
熄灭后
【提出问题】蜡烛刚熄灭时,总会有一缕白烟冒出, 它的成分是什么? 提出如下假设: A、白烟是燃烧时生成的二氧化碳;
课堂小结
体验化学探究
发现问题 观察 蜡烛 燃烧 现象 提出 探究 问题
解决问题
探究反思 得 出 结 论
猜 想 与 假 设
设 计 实 验
实 验 验 证
分 析 数 据
三 思 而 后 行
实 验 报 告
知能训练
1.我们研究和发展化学学科的最基本的手段 是( ) A.精确运算 B.大胆推测 C.科学实验 D.逻辑推理
4.2.2 氧气的性质、氧循环课件-八年级化学鲁教版(五四学制)全一册

3.铁丝燃烧的实验步骤:取一段螺旋状的普通细铁丝铁丝,将 火柴棒塞入铁丝中并固定;用镊子将铁丝夹住,然后将整个铁 丝放在酒精灯上点燃,等火柴完全烧尽时将铁丝由集气瓶口向 下慢慢深入。
硫在氧气中的反应
发出明亮的蓝紫色火焰,放出热 量,生成一种无色有刺激性气味 气体(二氧化硫)
木炭与氧气反应
剧烈燃烧,发出白光,放出热量 生成一种使澄清石灰水变浑 浊的无色气体
探究氧气的化学性质
1.木炭燃烧的实验步骤:用坩埚钳取一小块木炭片,放在酒精灯 外焰上加热至红热时,迅速将红热的木炭由集气瓶口向下慢慢 深入。待燃烧停止后加入少量澄清石灰水并震荡。
2.蜡烛燃烧的实验步骤:在空气中点燃一根蜡烛,然后用燃烧 匙将其由集气瓶口向下慢慢深入。待燃烧停止后加入少量澄清 石灰水并震荡。
第四单元
4.2.2 氧气的性质、氧循环
目录
CONTENTS
1
学习目标
2
重点与难点
3
教学内容
4
课后练习
学习目标
重点与难点
课堂引入
氧气的制取
新知讲解
一、认识氧气的性质 1、物理性质: (通常状况下)
无色、无味、气体 密度比空气大 不易溶于水(1L水约溶解30mL氧气) 沸点是-183℃、熔点是-218℃ 液态氧为淡蓝色,固态氧为淡蓝色雪花状
铁在氧气中的反应
剧烈燃烧,放热,火星四射, 生成黑色固体
氧化反应:物质与氧气发生的反应属于氧化反应。
石。
通过以上实验分析你能否总结氧气化学性质?
氧气是一种化学性质 比较活泼 的气体。
C + O2 点燃
Fe + O2 点燃 石蜡 + O2 点燃
炉法和电炉法。转炉法以氧气和铁水的反应为主,适合生产中低 品质的钢材;而电炉法则通过电能和氧气的加热来提炼钢水,适 合生产高品质的钢材。
硫在氧气中的反应
发出明亮的蓝紫色火焰,放出热 量,生成一种无色有刺激性气味 气体(二氧化硫)
木炭与氧气反应
剧烈燃烧,发出白光,放出热量 生成一种使澄清石灰水变浑 浊的无色气体
探究氧气的化学性质
1.木炭燃烧的实验步骤:用坩埚钳取一小块木炭片,放在酒精灯 外焰上加热至红热时,迅速将红热的木炭由集气瓶口向下慢慢 深入。待燃烧停止后加入少量澄清石灰水并震荡。
2.蜡烛燃烧的实验步骤:在空气中点燃一根蜡烛,然后用燃烧 匙将其由集气瓶口向下慢慢深入。待燃烧停止后加入少量澄清 石灰水并震荡。
第四单元
4.2.2 氧气的性质、氧循环
目录
CONTENTS
1
学习目标
2
重点与难点
3
教学内容
4
课后练习
学习目标
重点与难点
课堂引入
氧气的制取
新知讲解
一、认识氧气的性质 1、物理性质: (通常状况下)
无色、无味、气体 密度比空气大 不易溶于水(1L水约溶解30mL氧气) 沸点是-183℃、熔点是-218℃ 液态氧为淡蓝色,固态氧为淡蓝色雪花状
铁在氧气中的反应
剧烈燃烧,放热,火星四射, 生成黑色固体
氧化反应:物质与氧气发生的反应属于氧化反应。
石。
通过以上实验分析你能否总结氧气化学性质?
氧气是一种化学性质 比较活泼 的气体。
C + O2 点燃
Fe + O2 点燃 石蜡 + O2 点燃
炉法和电炉法。转炉法以氧气和铁水的反应为主,适合生产中低 品质的钢材;而电炉法则通过电能和氧气的加热来提炼钢水,适 合生产高品质的钢材。
《氧气》教学课件28 鲁教版共21页PPT

《氧气》教学课件28 鲁教版
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
Байду номын сангаас
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充满思想的劳动。——乌申斯基
谢谢!
56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
Байду номын сангаас
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充满思想的劳动。——乌申斯基
谢谢!
氧气 PPT教学课件28 鲁教版
•
13、认识到我们的所见所闻都是假象,认识到此生都是虚幻,我们才能真正认识到佛法的真相。钱多了会压死你,你承受得了吗?带,带不走,放,放不下。时时刻刻发悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
剧烈燃烧,发出白光,放出大量热
澄清石灰水变浑浊
③实验结论 木炭和氧气在点燃的条件下反应生成二氧化碳
④文字表达式
点燃
碳+氧气
二氧化碳
C O2
CO2
温馨提示: 反数应越的多剧,深烈反入程 应分度 越析 与 剧粒烈子的有效碰撞次数有关,碰撞氧气次的浓度
参照下边的微观示意图回答木炭在空气中燃烧和在氧气中燃烧剧烈 程度明显不同,原因是什么?
3.某同学做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋状,
一端系在一根铁丝上,另一端系上一根火柴。点燃火柴后迅速把铁
丝连同火柴一起插入集气瓶下部(如图所示),但不见铁丝燃烧,
反复实验均未成功。 导致失败的原因可能有(
)
A. 铁丝表面有锈迹,影响了反应的进行
B. 点燃火柴后立即将它伸入瓶内,火柴燃烧消耗了氧气,不利于铁 丝的燃烧
•
17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。
•
18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。
•
19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大自然中氧气的含量会随着生物的呼吸 和物质的燃烧等而减少,但又会随着植物的 光合作用而增加,周而复始地进行循环,这 就是自然界中的氧循环。
氧化反应:
初中阶段,我们将物质与氧气发生的反应叫做氧 化反应。
氧气在氧化反应中提供氧,它具有氧化性。
缓慢氧化:进行得很慢,不容易被察觉的氧化 反应叫缓慢氧化。
例如:金属的锈蚀、动植物体的腐烂、塑料的 老化等
氧气
01
学习目标
CONTENT
02
在实验探究中归纳、概括出氧气的 主要化学性质。
在实验探究中获得研究气体性质的 一般思路和方法。
1 氧气的物理性质
自主学习
阅读课本87页活动天地4-4。 (1)结合实际的生活经验,填写 表格并思考表格下面的两个思考题。 (2)尝试归纳氧气的物理性质
氧气的物理性质 无色、无味、气体 密度比空气大 不易溶于水(1L水约溶解30mL氧气) 沸点是-183℃、熔点是-218℃
③待火柴即将燃尽时再将铁丝伸入氧气瓶中:
防止火柴燃烧消耗集气瓶中过多的氧气而使 铁丝无法燃烧
④待火柴即将燃尽时再将铁丝伸入氧气瓶中: 防止高温的熔化物溅落炸裂集气瓶底
(3)蜡烛在氧气中燃烧,然后倒入澄清石灰水
现象:剧烈燃烧,放热,发白光,集气瓶内壁有 水珠,生成能使澄清石灰水变浑浊的气体
文字表达式:
纯氧中:氧气浓度大; 与氧气接触面积大。
物质与氧气发生化学反应时,单位体积
的空间里氧分子数目越多,反应就越剧烈。
学霸练习册
1、证明集气瓶里盛的是氧气,其最简便的方法是( C )
A、能使蜡烛燃烧的是氧气 B、测定密度,若密度大于空气的是氧气 C、放入带火星的木条,可使木条复燃的是氧气 D、放入发红的木炭后加入澄清石灰水,可使石灰水变浑浊
液态氧为淡蓝色,固态氧为淡蓝色雪花状
1、关于氧气的物理性质叙述正确的是( B ) A.易溶于水 B.标准状况下密度比空气大
C.可供呼吸 D.标准状况下能变成淡蓝色液体
2、 鱼可以在河水中生存,是因为:
______河__水__中__溶__解__了__一__部__分__氧__气________ 3、 为什么可用排水法收集氧气? ___氧__气__不__易__溶__于__水___,__不__与__水__反__应_____ 4、 充满氧气的集气瓶为什么应瓶口向上放 在桌面上?___氧__气__密__度__比__空__气__大_______
B.铁丝在氧气中燃烧 D.蜡烛在氧气中燃烧
4、下列关于实验现象的描述正确的是( C )
A. 红磷在氧气中燃烧,产生大量的白雾 B. 红磷在氧气中燃烧生成五氧化二磷固体 C. 镁带在空气中燃烧,发出耀眼的白光,放出大 量的热,生成白色固体 D. 铁丝在氧气中剧烈燃烧,火星四射,生成四氧
化三铁
5、下列物质中属于氧化物的是( B )
O2
CO2
氧气H2具O 有氧化性,与氧气发生的反应属于氧化反应
1.可燃物在氧气里燃烧比在空气里燃烧要剧烈。 2.某些在空气中不能燃烧的物质,在氧气中却能燃烧。 说明: 1.氧气的化学性质比较活泼。 2.物质在空气中燃烧,实际是跟其中的氧气发生反应。 由于空气中的氧气含量相对较少,因此在空气中燃烧不 如氧气中剧烈
下列变化中,不属于缓慢氧化的是( B )
A.钢铁生锈
B.黑火药爆炸
C.呼吸作用
D.用粮食酿酒
【小结】
氧气的化学性质比较活泼,能与多种单质和化合物反应。
碳 + 氧气 点燃 二氧化碳
与非金属单质反应
C O2
CO2
点燃
铁 + 氧气
四氧化铁
与金属单质反应
Fe O2
Fe3O4
石蜡 + 氧气 点燃 二氧化碳 + 水 与化合物反应
石蜡 + 氧气
点 燃
O2
二氧化碳 + 水 CO2 H2O
实验证明,木炭、铁丝、蜡烛等都能在氧 气中燃烧,这说明氧气能与碳、铁、石蜡 等发生化学反应。
非 金 属 单
点燃
磷 + 氧气
五氧化二磷
P O2
P2O5
点燃 氢气 + 氧气 水
仅由两种元素组成 的化合物,且其中 一种元素是氧元素。
质
H2
O2
H2O
文字表达式:
碳 + 氧气
点 燃
二氧化碳
C O2
CO2
化合反应
(2)铁在氧气中的反应
空气中
氧气中
不反应
剧烈燃烧,放热,火星四射,生成黑色固体
点
文字表达式: 铁 + 氧气 燃 Fe O2
四氧化三铁 Fe3O4
化合反应
操作注意事项: ①火柴的作用: 引燃铁丝
② 将 铁 丝 绕 成 螺 旋 状 :增大铁丝与氧气的接触面积
2 氧气的化学性质
物质的化学性质是该物质发生化学变化的过程 中表现出来的。 根据组成物质的元素种类,我们把纯净物分为 单质和化合物。
为了研究氧气的化学性质,我们从单质和化合 物中选出一部分物质,观察是否能与氧气发生 化学反应。
(1)木炭与氧气反应
在空气中
在氧气中
加入石灰水 并振荡
持续红热,放出热量 剧烈燃烧,发出白光,放出热量 生成一种使澄清石灰水变浑浊的无色气体
A. H2SO4
B. H2O
C.NaOH
D.HCl
6、下列关于氧气用途说法正确的是( B )
A. 氧气能助燃,可用于登山和潜水
B. 氧气可供动物呼吸
C. 氧气可用于做焊接金属的保护气
D. 氧气可用于灭火
3 自然界中的氧循环
结合生活实际和生无可学习过的,思考: 在大自然中,消耗氧气的途径主要有哪些?产生氧 气的途径主要是什么?
金 铁 + 氧气 点燃 四氧化三铁
氧化物
属 单 质
化 合 物
Fe O2 镁 + 氧气
点燃
Fe3O4 氧化镁
氧气是一种化
Mg O2 石蜡 + 氧气
O2 甲烷 + 氧气 CH4 O2
点 燃
点 燃
MgO
学性质比较活
二氧化碳 + 水 泼的气体。
CO2
H2O
二氧化碳 + 水
CO2
H2O
思考:木炭、铁丝、蜡烛在空气中反应 与在氧气中反应剧烈程度明显不同,原 因是什么?
的一瓶一定是氧气
2、(多选)下列有关氧气性质的说法中错误的是( BD)
A、氧气是一种化学性质比较活泼的气体 B、它能跟所有物质发生化学反应 C、在氧化反应中一般都有热量放出 D、物质跟氧气的反应都能发光放热
3、某同学做物质在氧气中燃烧的实验方法如
下图所示,其中不合理的是( B )
A.木碳在氧气中燃烧 C.红磷在氧气中燃烧
氧化反应:
初中阶段,我们将物质与氧气发生的反应叫做氧 化反应。
氧气在氧化反应中提供氧,它具有氧化性。
缓慢氧化:进行得很慢,不容易被察觉的氧化 反应叫缓慢氧化。
例如:金属的锈蚀、动植物体的腐烂、塑料的 老化等
氧气
01
学习目标
CONTENT
02
在实验探究中归纳、概括出氧气的 主要化学性质。
在实验探究中获得研究气体性质的 一般思路和方法。
1 氧气的物理性质
自主学习
阅读课本87页活动天地4-4。 (1)结合实际的生活经验,填写 表格并思考表格下面的两个思考题。 (2)尝试归纳氧气的物理性质
氧气的物理性质 无色、无味、气体 密度比空气大 不易溶于水(1L水约溶解30mL氧气) 沸点是-183℃、熔点是-218℃
③待火柴即将燃尽时再将铁丝伸入氧气瓶中:
防止火柴燃烧消耗集气瓶中过多的氧气而使 铁丝无法燃烧
④待火柴即将燃尽时再将铁丝伸入氧气瓶中: 防止高温的熔化物溅落炸裂集气瓶底
(3)蜡烛在氧气中燃烧,然后倒入澄清石灰水
现象:剧烈燃烧,放热,发白光,集气瓶内壁有 水珠,生成能使澄清石灰水变浑浊的气体
文字表达式:
纯氧中:氧气浓度大; 与氧气接触面积大。
物质与氧气发生化学反应时,单位体积
的空间里氧分子数目越多,反应就越剧烈。
学霸练习册
1、证明集气瓶里盛的是氧气,其最简便的方法是( C )
A、能使蜡烛燃烧的是氧气 B、测定密度,若密度大于空气的是氧气 C、放入带火星的木条,可使木条复燃的是氧气 D、放入发红的木炭后加入澄清石灰水,可使石灰水变浑浊
液态氧为淡蓝色,固态氧为淡蓝色雪花状
1、关于氧气的物理性质叙述正确的是( B ) A.易溶于水 B.标准状况下密度比空气大
C.可供呼吸 D.标准状况下能变成淡蓝色液体
2、 鱼可以在河水中生存,是因为:
______河__水__中__溶__解__了__一__部__分__氧__气________ 3、 为什么可用排水法收集氧气? ___氧__气__不__易__溶__于__水___,__不__与__水__反__应_____ 4、 充满氧气的集气瓶为什么应瓶口向上放 在桌面上?___氧__气__密__度__比__空__气__大_______
B.铁丝在氧气中燃烧 D.蜡烛在氧气中燃烧
4、下列关于实验现象的描述正确的是( C )
A. 红磷在氧气中燃烧,产生大量的白雾 B. 红磷在氧气中燃烧生成五氧化二磷固体 C. 镁带在空气中燃烧,发出耀眼的白光,放出大 量的热,生成白色固体 D. 铁丝在氧气中剧烈燃烧,火星四射,生成四氧
化三铁
5、下列物质中属于氧化物的是( B )
O2
CO2
氧气H2具O 有氧化性,与氧气发生的反应属于氧化反应
1.可燃物在氧气里燃烧比在空气里燃烧要剧烈。 2.某些在空气中不能燃烧的物质,在氧气中却能燃烧。 说明: 1.氧气的化学性质比较活泼。 2.物质在空气中燃烧,实际是跟其中的氧气发生反应。 由于空气中的氧气含量相对较少,因此在空气中燃烧不 如氧气中剧烈
下列变化中,不属于缓慢氧化的是( B )
A.钢铁生锈
B.黑火药爆炸
C.呼吸作用
D.用粮食酿酒
【小结】
氧气的化学性质比较活泼,能与多种单质和化合物反应。
碳 + 氧气 点燃 二氧化碳
与非金属单质反应
C O2
CO2
点燃
铁 + 氧气
四氧化铁
与金属单质反应
Fe O2
Fe3O4
石蜡 + 氧气 点燃 二氧化碳 + 水 与化合物反应
石蜡 + 氧气
点 燃
O2
二氧化碳 + 水 CO2 H2O
实验证明,木炭、铁丝、蜡烛等都能在氧 气中燃烧,这说明氧气能与碳、铁、石蜡 等发生化学反应。
非 金 属 单
点燃
磷 + 氧气
五氧化二磷
P O2
P2O5
点燃 氢气 + 氧气 水
仅由两种元素组成 的化合物,且其中 一种元素是氧元素。
质
H2
O2
H2O
文字表达式:
碳 + 氧气
点 燃
二氧化碳
C O2
CO2
化合反应
(2)铁在氧气中的反应
空气中
氧气中
不反应
剧烈燃烧,放热,火星四射,生成黑色固体
点
文字表达式: 铁 + 氧气 燃 Fe O2
四氧化三铁 Fe3O4
化合反应
操作注意事项: ①火柴的作用: 引燃铁丝
② 将 铁 丝 绕 成 螺 旋 状 :增大铁丝与氧气的接触面积
2 氧气的化学性质
物质的化学性质是该物质发生化学变化的过程 中表现出来的。 根据组成物质的元素种类,我们把纯净物分为 单质和化合物。
为了研究氧气的化学性质,我们从单质和化合 物中选出一部分物质,观察是否能与氧气发生 化学反应。
(1)木炭与氧气反应
在空气中
在氧气中
加入石灰水 并振荡
持续红热,放出热量 剧烈燃烧,发出白光,放出热量 生成一种使澄清石灰水变浑浊的无色气体
A. H2SO4
B. H2O
C.NaOH
D.HCl
6、下列关于氧气用途说法正确的是( B )
A. 氧气能助燃,可用于登山和潜水
B. 氧气可供动物呼吸
C. 氧气可用于做焊接金属的保护气
D. 氧气可用于灭火
3 自然界中的氧循环
结合生活实际和生无可学习过的,思考: 在大自然中,消耗氧气的途径主要有哪些?产生氧 气的途径主要是什么?
金 铁 + 氧气 点燃 四氧化三铁
氧化物
属 单 质
化 合 物
Fe O2 镁 + 氧气
点燃
Fe3O4 氧化镁
氧气是一种化
Mg O2 石蜡 + 氧气
O2 甲烷 + 氧气 CH4 O2
点 燃
点 燃
MgO
学性质比较活
二氧化碳 + 水 泼的气体。
CO2
H2O
二氧化碳 + 水
CO2
H2O
思考:木炭、铁丝、蜡烛在空气中反应 与在氧气中反应剧烈程度明显不同,原 因是什么?
的一瓶一定是氧气
2、(多选)下列有关氧气性质的说法中错误的是( BD)
A、氧气是一种化学性质比较活泼的气体 B、它能跟所有物质发生化学反应 C、在氧化反应中一般都有热量放出 D、物质跟氧气的反应都能发光放热
3、某同学做物质在氧气中燃烧的实验方法如
下图所示,其中不合理的是( B )
A.木碳在氧气中燃烧 C.红磷在氧气中燃烧
