高中化学常见物质除杂方法归纳
高中化学常见物质除杂方法归纳

原物所含杂质除杂质试剂除杂质的方法(一)1 N2O2 灼热的铜丝网洗气2 CO2H2S硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2HCl饱和小苏打溶液洗气5 H2SHCl饱和NaHS溶液洗气6 SO2HCl 饱和NaHSO3溶液洗气7 Cl2HCl饱和NaCl溶液洗气8 CO2 SO2饱和小苏打溶液洗气9 碳粉MnO2浓盐酸加热后过滤10 MnO2 碳粉----------- 加热灼烧11 碳粉CuO盐酸或硫酸过滤12 Al2O3Fe2O3NaOH溶液(过量),再通CO2过滤、加热固体13 Fe2O3 Al2O3NaOH溶液过滤14 Al2O3 SiO2盐酸NH3•H2O 过滤、加热固体15 SiO2ZnO盐酸过滤16 CuOZnONaOH溶液过滤17 BaSO4BaCO3稀硫酸过滤18 NaOH Na2CO3Ba(OH)2溶液(适量)过滤19 NaHCO3Na2CO3通入过量CO2 ------20 Na2CO3 NaHCO3 ------- 加热21 NaClNaHCO3 盐酸蒸发结晶22 NH4Cl (NH4)2SO4 Ba Cl2溶液(适量)过滤23 FeCl3 FeCl2通入过量Cl2 -----24 FeCl3 CuCl2铁粉、Cl2 过滤25 FeCl2FeCl3 铁粉过滤26 Fe(OH)3胶体FeCl3(半透膜)渗析27 CuSFeS稀盐酸或稀硫酸过滤28 I2NaCl------ 升华29 NaCl NH4Cl ------- 加热30 KNO3NaCl蒸馏水重结晶31 乙烯SO2、H2O 碱石灰洗气32 乙烷乙烯溴水洗气33 溴苯溴稀NaOH溶液分液34 硝基苯NO2稀NaOH溶液分液35 甲苯苯酚NaOH溶液分液36 乙醛乙酸饱和Na2CO3溶液蒸馏37 乙醇水新制生石灰蒸馏38 苯酚苯NaOH溶液、CO2分液39 乙酸乙酯乙酸饱和Na2CO3溶液分液40 溴乙烷乙醇蒸馏水分液41 肥皂甘油食盐过滤42 葡萄糖淀粉(半透膜)渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
高中化学常见物质除杂方法归纳

原物所含杂质除杂质试剂除杂质的方法1 N2 O2灼热的铜丝网洗气2 CO2 H2S 硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2 HCl 饱和小苏打溶液洗气5 H2S HCl 饱和NaHS溶液洗气6 SO2 HCl 饱和NaHSO3溶液洗气7 Cl2 HCl 饱和NaCl溶液洗气8 CO2 SO2饱和小苏打溶液洗气9 碳粉 MnO2浓盐酸加热后过滤10 MnO2碳粉 ----------- 加热灼烧11 碳粉 CuO 盐酸或硫酸过滤12 Al2O3 Fe2O3 NaOH溶液(过量),再通CO2过滤、加热固体13 Fe2O3 Al2O3 NaOH溶液过滤14 Al2O3 SiO2盐酸 NH3•H2O 过滤、加热固体15 SiO2 ZnO 盐酸过滤16 CuO ZnO NaOH溶液过滤17 BaSO4 BaCO3稀硫酸过滤18 NaOH Na2CO3 Ba(OH)2溶液(适量)过滤19 NaHCO3 Na2CO3通入过量CO2 ------20 Na2CO3 NaHCO3 ------- 加热21 NaCl NaHCO3 盐酸蒸发结晶22 NH4Cl (NH4)2SO4 Ba Cl2溶液(适量)过滤23 FeCl3 FeCl2通入过量Cl2 -----24 FeCl3 CuCl2铁粉、Cl2过滤25 FeCl2 FeCl3铁粉过滤26 Fe(OH)3胶体 FeCl3(半透膜)渗析27 CuS FeS 稀盐酸或稀硫酸过滤28 I2 NaCl ------ 升华29 NaCl NH4Cl ------- 加热30 KNO3 NaCl 蒸馏水重结晶31 乙烯 SO2、H2O 碱石灰洗气32 乙烷乙烯溴水洗气33 溴苯溴稀NaOH溶液分液34 硝基苯 NO2稀NaOH溶液分液35 甲苯苯酚 NaOH溶液分液36 乙醛乙酸饱和Na2CO3溶液蒸馏37 乙醇水新制生石灰蒸馏38 苯酚苯 NaOH溶液、CO2分液39 乙酸乙酯乙酸饱和Na2CO3溶液分液40 溴乙烷乙醇蒸馏水分液41 肥皂甘油食盐过滤42 葡萄糖淀粉(半透膜)渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
化学除杂方法

化学除杂方法
化学除杂方法是指通过化学反应将杂质转化为可分离的物质,从而达到除杂的目的。
常用的化学除杂方法有:
1. 沉淀法:通过加入适当的沉淀剂,使杂质转化为沉淀,然后过滤分离。
2. 酸碱法:通过加入酸或碱,使杂质转化为可溶性盐或气体,然后分离。
3. 氧化还原法:通过加入氧化剂或还原剂,使杂质转化为气体或沉淀,然后分离。
4. 络合法:通过加入络合剂,将杂质转化为可溶性络合物,然后分离。
5. 吸附法:通过使用吸附剂吸附杂质,然后分离。
6. 分液法:通过将混合物中的液体和固体或两种不相溶的液体分开,达到除杂的目的。
7. 蒸馏法:通过将混合物中的不同组分在不同的温度下进行蒸馏,达到除杂的目的。
8. 结晶法:通过将混合物中的可溶性固体在溶剂中的溶解度随温度变化而分离,达到除杂的目的。
9. 磁铁法:通过磁铁将混合物中的磁性物质和无磁性物质分离。
10. 渗析法:通过使用半透膜袋将混有离子或分子杂质的胶体分离,达到除杂的目的。
不同的化学除杂方法适用于不同的杂质和物质,需要根据实际情况选择合适的方法。
高中化学除杂方法

高中化学除杂方法高中化学除杂方法指的是通过物理或化学手段将混合物中的杂质分离出来,使得混合物中只剩下所需的纯净物质的方法。
以下是高中化学常用的几种除杂方法:1. 过滤法过滤法是最常见的除杂方法之一。
通过将固体颗粒混合物放置在过滤纸上,溶液通过过滤纸孔隙,而固体颗粒则被滞留在过滤纸上,从而达到分离纯净溶液的目的。
常用的过滤器还有玻璃棉等。
2. 蒸馏法蒸馏法是利用液体混合物的不同沸点进行分离的方法。
混合物经过加热蒸发,再通过冷凝器冷却凝结,从而区分其沸点不同的组分。
蒸馏法适用于分离液体混合物,如酒精和水的分离等。
3. 结晶法结晶法是通过溶解物质在溶液中的溶解度差异来分离物质的方法。
将溶液加热使其溶解,然后冷却慢慢结晶,使得溶质从溶液中析出。
通过过滤或离心等方式分离出结晶物质。
4. 萃取法萃取法是利用两种不同的溶剂把混合物中的成分分离开来的方法。
通过不同成分在不同溶剂中的溶解度差异,使得目标成分可以被其中一种溶剂提取出来,从而达到分离的目的。
5. 色谱法色谱法是一种物质分离和分析的方法,通过分配系数差异分离组分。
常见的色谱方法有气相色谱、液相色谱等。
这些方法通过将需分析物质溶解在载气或溶剂上,并通过固定相与移动相的不同作用力来实现分离目的。
6. 电解法电解法是利用电流对混合物进行分解和分离的方法。
通过将混合物溶解在适当电解质溶液中,外加电流后,根据不同物质的导电性与电解过程中物质的还原反应和氧化反应,来达到分离的目的。
7. 气体吸附法气体吸附法利用吸附剂对混合物中的组分进行吸附的方法。
混合物通过吸附剂时,吸附剂与不同组分吸附能力不同,可以实现物质的分离。
除了以上几种常用的除杂方法,还有一些其他的方法,如离心、凝胶电泳、析出法等。
每种除杂方法都有其适用的场合和实验条件,教师或实验者在实验中要根据具体情况合理选择、使用这些除杂方法。
高中化学有机物常见“除杂方法”大全

高中化学有机物常见“除杂方法”大全1、气态烷(气态烯、炔)除杂试剂:溴水、浓溴水、溴的四氯化碳溶液操作:洗气注意:酸性高锰酸钾溶液不可。
原理:气态烯、炔中不饱和的双键、叁键可与上述除杂试剂发生反应,生成不挥发的溴代烷2、汽油、煤油、柴油的分离(说白了就是石油的分馏)除杂试剂:物理方法操作:分馏原理:各石油产品沸点范围的不同。
3、乙烯(CO2、SO2、H2O、微量乙醇蒸气)除杂试剂:NaOH溶液-浓硫酸操作:洗气原理:CO2、SO2可与NaOH反应生成盐而被除去,乙醇蒸气NaOH溶液中的水后溶被除去,剩余水蒸气可被浓硫酸吸收。
4、乙炔(H2S、PH3、H2O)除杂试剂:CuSO4溶液-浓硫酸操作:洗气原理:H2S、PH3可与CuSO4溶液反应生不溶物而被除去,剩余水蒸气可被浓硫酸吸收。
5、甲烷、一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷的分离除杂试剂:物理方法操作:分馏原理:沸点不同。
)6、溴苯(Br2除杂试剂:NaOH溶液操作:分液可与NaOH溶液反应生成盐,系强极性离子化合物,不溶原理:Br2于苯而溶于水(相似相容原理)。
、水)7、硝基苯(HNO3除杂试剂:水、操作:分液原理:等于是用水萃取硝基苯中的硝酸,具体原理见“萃取”。
TNT、苦味酸除杂可使用相同操作。
8、气态卤代烃(卤化氢)除杂试剂:水操作:洗气(需使用防倒吸装置)原理:卤化氢易溶于水,可被水吸收,气态卤代烃不溶于水。
9、乙醇(水或水溶液)除杂试剂:CaO、碱石灰操作:蒸馏原理:CaO与水反应生成不挥发的Ca(OH)2,故只会蒸馏出无水的乙醇。
10、苯(苯酚)除杂试剂:NaOH溶液操作:分液原理:苯酚可与NaOH溶液反应生成苯酚钠,系强极性离子化合物,不溶于苯而溶于水(相似相容原理)。
11、乙酸乙酯(乙醇、乙酸、水)除杂试剂:浓硫酸+饱和Na2CO3溶液操作:蒸馏+分液原理:乙酸与乙醇发生可逆的酯化反应生成乙酸乙酯和水,四者共同存在于反应容器当中。
高中化学实验常见除杂

高中化学实验常见除杂一说化学大家就会觉得化学很繁多,其实在学习化学中,还是须要积累的,我整理了中学化学试验常见除杂,希望能帮助到大家。
必修教材有机物除杂(括号内为杂质)1.乙烷或甲烷(乙烯) 溴水洗气解析:乙烯能与溴水发生加成反应生成1,2-二溴乙烷变成了液体,而乙烷不能。
2.乙醇(少量水) 加入新制的生石灰蒸馏解析:水与CaO反应生成氢氧化钙,乙醇易挥发,加热蒸馏即可得到乙醇。
点评:氧化钙除去较多的水分,乙醇和水属于互溶的液体,实行蒸馏的方法3、乙醇(乙酸) 加入新制的生石灰或NaOH 蒸馏解析:乙酸与CaO反应生成乙酸钙,乙醇易挥发,加热蒸馏即可得到乙醇。
4.溴苯(溴) 氢氧化钠溶液分液解析:Br2 +2NaOH=NaBr+NaBrO+H2O,生成的盐NaBr和NaBrO 都易溶于水进入水层,而溴苯在常温常压下不与NaOH反应,而且难溶于通过分液取下层既能得到溴苯。
5. 硝基苯(混酸) 氢氧化钠溶液或水分液解析:利用浓硫酸和浓硝酸易与氢氧化钠溶液反应或易溶于水的性质使混酸进入水层,硝基苯难溶于水,密度大于水,在下层。
6.乙酸乙酯(乙酸、乙醇) 饱和碳酸钠溶液分液解析:乙醇溶解在碳酸钠溶液中,乙酸与碳酸钠溶液反应均进入水层,乙酸乙酯不溶于水,在上层,通过分液即可分别。
7.肥皂(甘油) 饱和食盐水盐析、过滤解析:加入饱和食盐水使肥皂发生盐析,再通过过滤滤出肥皂即可。
有机物的分别8. 淀粉溶液(纯碱) 蒸馏水渗析法解析:淀粉溶液是胶体,胶体中混有的小分子或离子可以用渗析法除去。
选修教材有机物除杂9. 苯(苯甲酸) 氢氧化钠溶液分液解析:苯甲酸能与NaOH反应生成苯甲酸钠,苯甲酸钠易溶于水,而苯不溶于水,通过分液取上层就能得到苯。
10. 苯(苯酚) 氢氧化钠溶液分液解析:原理与1类似,苯酚能与NaOH应生成苯酚钠,苯酚钠易溶于水。
11. 苯(乙苯) 酸性高锰酸钾溶液和氢氧化钠溶液分液解析:先用酸性高锰酸钾溶液将乙苯氧化为苯甲酸,再用氢氧化钠溶液将苯甲酸转化为苯甲酸钠溶于水层,分液即可。
除杂高中化学总结

除杂高中化学总结高中化学学科是自然科学的一支,主要研究物质的组成、性质、变化规律以及物质与能量之间的关系。
在学习化学的过程中,我们常常会遇到各种各样的杂质,而除杂就成为了化学实验和应用中一项非常重要的工作。
除杂的目的是为了提高化学实验的准确性,确保所得到的结果是可靠的。
本文将从实验方法、实验技巧以及实验注意事项三个方面总结高中化学中的除杂方法。
一、实验方法1. 溶解法:当我们需要将混合物中的某种物质分离出来时,可以利用溶解法进行除杂。
首先,将混合物溶解在适当的溶剂中,然后根据不同物质的溶解度,通过过滤、蒸发、结晶等方法将目标物质提取出来。
2. 气体法:对于气体混合物的除杂,可以利用气体的不同性质进行分离。
例如,通过液体吸附剂吸附气体混合物中的某种气体,然后再通过蒸馏或者减压等方法将目标气体从吸附剂上除去。
3. 离心法:对于固体颗粒较大的混合物,可以利用离心机的离心力将颗粒沉淀下来,然后再用溶剂进行洗涤,最后通过干燥将目标物质分离出来。
二、实验技巧1. 使用合适的实验器材:在进行除杂实验时,需要使用适当的实验器材。
例如,选择合适的滤纸、漏斗、过滤瓶等来进行过滤操作,选择适当的温度和压力来进行蒸发和减压操作。
2. 注意操作的顺序:在进行除杂实验时,需要注意操作的顺序。
一般来说,先进行溶解操作,然后再进行过滤、蒸发、结晶等操作,以确保实验的顺利进行。
3. 操作要细心:在进行除杂实验时,需要细心操作,避免操作不当导致实验失败或者结果不准确。
例如,过滤操作时要保持滤纸的整齐,避免出现漏斗堵塞或者过滤不彻底的情况。
三、实验注意事项1. 安全第一:在进行除杂实验时,安全是首要考虑的因素。
要正确佩戴实验室安全设备,如实验服、手套、护目镜等,避免对身体和环境造成伤害。
2. 遵守实验规范:在进行除杂实验时,要遵守实验规范,按照实验步骤进行操作,不随意更改实验条件和步骤,以免影响实验结果的准确性。
3. 垃圾分类:在进行除杂实验时,要注意将废弃物进行分类处理,按照实验室的规定进行正确的垃圾分类,保持实验环境的整洁和卫生。
高中化学除杂方法大全

高中化学除杂方法大全1、气态烷(气态烯、炔)除杂试剂:溴水、浓溴水、溴的四氯化碳溶液操作方式:洗气注意:酸性高锰酸钾溶液不可。
原理:气态烯、炔中不饱和的双键、叁键可以与上述细粒试剂出现反应,分解成不溶解的溴代烷2、汽油、煤油、柴油的分离(说白了就是石油的蒸馏)操作:分馏原理:各石油产品沸点范围的相同。
3、乙烯(co2、so2、h2o、微量乙醇蒸气)细粒试剂:naoh溶液 - 浓硫酸操作:洗气原理:co2、so2可以与naoh反应分解成盐而被除去,乙醇蒸气naoh溶液中的水后水溶性被除去,余下水蒸气可以被浓硫酸稀释。
4、乙炔(h2s、ph3、h2o)细粒试剂:cuso4溶液 - 浓硫酸操作:洗气原理:h2s、ph3可以与cuso4溶液反应生不溶物而被除去,余下水蒸气可以被浓硫酸稀释。
5、甲烷、一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷的分离操作方式:蒸馏原理:沸点不同。
6、溴苯(br2)除杂试剂:naoh溶液操作方式:分液原理:br2可与naoh溶液反应生成盐,系强极性离子化合物,不溶于苯而溶于水(相似相容原理)。
7、硝基苯(hno3、水)除杂试剂:水、操作方式:分液原理:等于是用水萃取硝基苯中的硝酸,具体原理见“萃取”。
tnt、苦味酸细粒可以采用相同操作方式。
8、气态卤代烃(卤化氢)细粒试剂:水操作:洗气(需使用防倒吸装置)原理:卤化氢易溶于水,可以被水稀释,气态卤代烃不溶水。
9、乙醇(水或水溶液)细粒试剂:cao、碱石灰操作:蒸馏原理:cao与水反应分解成不溶解的ca(oh)2,故只可以酿造出来浓硫酸的乙醇。
10、苯(苯酚)细粒试剂:naoh溶液操作:分液原理:苯酚可以与naoh溶液反应分解成苯酚钠,系强极性离子化合物,不溶苯而溶水(相近兼容原理)。
11、乙酸乙酯(乙醇、乙酸、水)细粒试剂:浓硫酸+饱和状态na2co3溶液操作:蒸馏+分液原理:乙酸与乙醇出现对称的酯化反应分解成乙酸乙酯和水,四者共同存有于反应容器当中。
高中化学常见物质除杂方法归纳

高中化学常见物质除杂方法归纳高中化学常见物质除杂方法归纳在实验室中,常见的化学试剂和物质往往会受到一些杂质的影响,这些杂质可能来自于制备过程中的外界环境、原材料本身的污染或者是副反应的产物。
为了得到纯净的物质,科学家们发展了一系列方法去除杂质。
下面将对高中化学常见物质除杂方法进行归纳。
一、固体物质的除杂方法1. 溶剂重结晶法:根据杂质和所制固体物质在溶剂中的溶解度不同,通过重结晶的方式将杂质从固体物质中分离出来。
首先将含杂质的固体物质溶解在适当的溶剂中,过滤以去除不溶的杂质,然后加热溶液使溶剂挥发,逐渐结晶出净化的固体物质。
例如,可以利用溶液结晶去除硫酸铜中的杂质。
2. 溶解法:对于易溶于溶剂的纯段杂质,可以通过将固体物质溶解后过滤去除杂质,然后再将溶液经过蒸发结晶得到纯净的固体物质。
例如,可以利用溶解-蒸发结晶法去除钠盐溶液中的杂质。
3. 磁分离法:对于含有铁磁性杂质的固体物质,可以利用磁性分离器将杂质分离出来。
例如,可以利用磁性分离器分离出含有铁屑的纯铁。
4. 精制法:对于物质中含有无机氧化物杂质的固体物质,可以通过加入还原剂、吸附剂或气体进行处理,将杂质转化为易溶于溶剂的形式,并利用净化剂去除杂质。
例如,可以利用氟化氢气体将酸式钛酸铵中的杂质氧化为易溶于水的氧化物,然后通过过滤或沉淀去除杂质。
二、液体物质的除杂方法1. 蒸馏法:根据不同液体物质的沸点差异,通过升华-冷凝循环流化交换,将杂质从液体物质中分离出来。
例如,可以利用常压蒸馏法除去乙醇中的水。
2. 溶剂萃取法:根据相溶度差异,通过溶剂与杂质的选择性亲和力,将杂质从液体物质中提取出来。
例如,可以利用乙醚将饱和盐酸溶液中的酚提取出来。
3. 气相透析法:通过杂质在气体中的挥发性差异,将杂质从液体物质中挥发出来。
例如,可以利用气相透析法除去溴水中的溴。
4. 易溶物质沉淀法:对于液体物质中的杂质,如果其中存在一种或多种物质易溶解于特定的试剂中,可以通过加入沉淀试剂使其反应形成难溶物质,从而将杂质和沉淀物一同分离出来。
高中化学除杂归纳

高中化学除杂归纳高中化学除杂归纳化学作为自然科学的一个重要分支,主要研究物质的组成、结构,以及物质的性质和变化规律。
在化学实验和分析过程中,经常会有一些杂质的存在,而对于这些杂质的除去,是化学实验和分析的重要环节。
本文将就高中化学中常见的除杂方法进行归纳和总结。
一、溶剂洗涤法溶剂洗涤法是指通过使用适当的溶剂,将杂质溶解到溶液中,从而实现除去杂质的目的。
这种方法适用于不同溶液中的溶解度差异较大的杂质。
常用溶剂洗涤法有以下几种:1.萃取萃取是指通过溶剂将待测溶液中的物质进行分离,一般使用两种不相互溶解的溶剂。
常见的萃取方法有分液漏斗法、液液萃取法等。
2.煅烧煅烧是指将待测溶液中的溶质加热,使其转变为气态或易挥发物质,通过加热后产生的气体的挥发性差异,从而实现了杂质的除去。
二、吸附法吸附法是指通过吸附剂吸附待测溶液中的杂质,从而将其分离出来。
常用的吸附剂有活性炭、硅胶等。
常见的吸附法有以下几种:1.过滤过滤是将溶液通过不同孔径的过滤膜或过滤芯,从而实现杂质的分离。
常见的过滤方法有重力过滤、吸力过滤等。
2.离心离心是利用离心机产生的离心力,将溶液中的杂质沉淀到离心管底部,从而实现杂质的除去。
三、沉淀法沉淀法是指通过加入适当的沉淀剂,使待测溶液中的杂质生成沉淀物,从而实现分离的目的。
常见的沉淀法有以下几种:1.氯化钡法氯化钡法适用于溶液中存在钡离子时进行除钡。
通过加入氯化钡溶液,生成难溶的氯化钡沉淀,将溶液中的钡离子与其他离子分离。
2.氟化钙法氟化钙法适用于溶液中存在钙离子时进行除钙。
通过加入氟化钙溶液,生成难溶的氟化钙沉淀,将溶液中的钙离子与其他离子分离。
3.饱和溶液法饱和溶液法适用于存在难溶性盐类时进行除杂。
通过加入少量溶剂无法溶解的溶质,使溶液达到饱和浓度,从而生成沉淀,实现杂质的除去。
总结以上就是高中化学中常见的除杂方法进行的归纳和总结。
各种除杂方法各有优缺点,需要根据具体情况选择合适的方法。
对于实验和分析过程中的杂质处理,需要注意控制变量,以确保实验的准确性和可靠性。
高中化学除杂方法
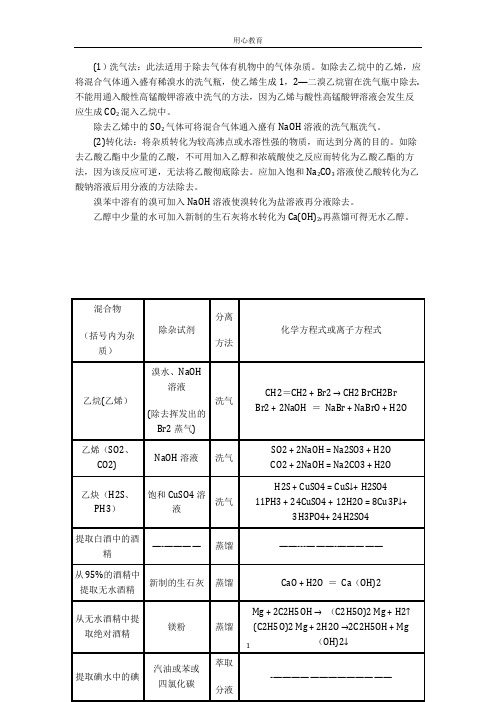
(1)洗气法:此法适用于除去气体有机物中的气体杂质。
如除去乙烷中的乙烯,应将混合气体通入盛有稀溴水的洗气瓶,使乙烯生成1,2—二溴乙烷留在洗气瓶中除去.不能用通入酸性高锰酸钾溶液中洗气的方法,因为乙烯与酸性高锰酸钾溶液会发生反应生成CO2混入乙烷中。
除去乙烯中的SO2气体可将混合气体通入盛有NaOH溶液的洗气瓶洗气。
(2)转化法:将杂质转化为较高沸点或水溶性强的物质,而达到分离的目的。
如除去乙酸乙酯中少量的乙酸,不可用加入乙醇和浓硫酸使之反应而转化为乙酸乙酯的方法,因为该反应可逆,无法将乙酸彻底除去。
应加入饱和Na2CO3溶液使乙酸转化为乙酸钠溶液后用分液的方法除去。
溴苯中溶有的溴可加入NaOH溶液使溴转化为盐溶液再分液除去。
乙醇中少量的水可加入新制的生石灰将水转化为Ca(OH)2,再蒸馏可得无水乙醇。
一.常见除杂1。
N2(O2)——灼热的铜丝2Cu+O2=2CuO2.CO2(H2S)——用饱和NaHCO3溶液NaHCO3+H2S=NaHS+H2O+CO2↑3。
CO2(CO)——灼热的氧化铜CuO+CO=Cu+CO24。
CO2(HCl)-—用饱和NaHCO3溶液NaHCO3+HCl=NaCl+H2O+CO2↑5。
H2S(HCl)——用饱和NaHS溶液NaHS+HCl=NaCl+H2S6.SO2(HCl)——用饱和NaHSO3溶液NaHSO3+HCl=NaCl+H2O+SO2↑7.Cl2(HCl)——用饱和食盐水,HCl易溶而Cl2不溶8.MnO2(碳粉)——1。
将混合物在氧气中点燃C+O2=CO22.通入灼热的氧化钙C+CaO=Ca+CO2↑(条件:高温)3。
通入灼热的氧化铁3C+2Fe2O3=3CO2↑+ 4Fe9。
碳粉(MnO2)——加浓盐酸MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O10。
C(CuO)-—加稀盐酸CuO+2HCl=CuCl2+H2O11。
Al2O3(Fe2O3)方法一:将固体混合物溶于过量的氢氧化钠溶液,过滤除去氧化铁,留下滤液。
高中化学常见除杂归纳

高中化学常见除杂归纳
除杂是化学分析手段之一,其作用是把有用成分从有害物质中分离出来,从而实现化学反应,结合其他检测方法得到合理的结论。
高中化学常见除杂可以分为蒸馏法、沉淀法、滤过法以及萃取法。
蒸馏法是化学分析常用的一种除杂法,它利用具有不同截留点的物质有着不同的沸点,通过蒸馏的方法,以过滤后的物质作为恒沸点的原料,以蒸发出物有着更高沸点的物质,实现对原材料的除杂。
沉淀法是将溶液中的有用成分和有害成分隔离的一种手段,它使用沉淀剂将溶液中的不溶物分离,实现有用物质和有害物质分离。
滤过是通过用滤纸或滤膜将溶液中不需要的物质滤除而实现分离的方法,通过此方法进行除杂可以简化实验步骤,提高工作效率。
萃取法是混合溶液中的可溶物质的分离的有效的方法,它是将溶液和提取液(通常是有机溶剂)混合,并使用分子交换膜或其他物理条件使一种成分混合到提取液,把另一成分留在另一溶液。
总之,高中化学常见除杂包括蒸馏法、沉淀法、滤过法以及萃取法,它们是用来辅助分析化学反应,用于分离和提取有用物质,从而减少对有害物质的污染,实现化学反应的顺利进行。
高中化学常见除杂方法总结

高中化学常见除杂方法总结原物所含杂质除杂质试剂除杂质的方法1 N2 O2灼热的铜丝网洗气2 CO2 H2S 硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2 HCl 饱和小苏打溶液洗气5 H2S HCl 饱和NaHS溶液洗气6 SO2 HCl 饱和NaHSO3溶液洗气7 Cl2 HCl 饱和NaCl溶液洗气8 CO2 SO2饱和小苏打溶液洗气9 碳粉 MnO2浓盐酸加热后过滤10 MnO2碳粉 ----------- 加热灼烧11 碳粉 CuO 盐酸或硫酸过滤12 Al2O3 Fe2O3 NaOH溶液(过量),再通CO2过滤、加热固体13 Fe2O3 Al2O3 NaOH溶液过滤14 Al2O3 SiO2盐酸 NH3•H2O 过滤、加热固体15 SiO2 ZnO 盐酸过滤16 CuO ZnO NaOH溶液过滤17 BaSO4 BaCO3稀硫酸过滤18 NaOH Na2CO3 Ba(OH)2溶液(适量)过滤19 NaHCO3 Na2CO3通入过量CO2 ------20 Na2CO3 NaHCO3 ------- 加热21 NaCl NaHCO3 盐酸蒸发结晶22 NH4Cl (NH4)2SO4 Ba Cl2溶液(适量)过滤23 FeCl3 FeCl2通入过量Cl2 -----24 FeCl3 CuCl2铁粉、Cl2过滤25 FeCl2 FeCl3铁粉过滤26 Fe(OH)3胶体 FeCl3(半透膜)渗析27 CuS FeS 稀盐酸或稀硫酸过滤28 I2 NaCl ------ 升华29 NaCl NH4Cl ------- 加热30 KNO3 NaCl 蒸馏水重结晶31 乙烯 SO2、H2O 碱石灰洗气32 乙烷乙烯溴水洗气33 溴苯溴稀NaOH溶液分液34 硝基苯 NO2稀NaOH溶液分液35 甲苯苯酚 NaOH溶液分液36 乙醛乙酸饱和Na2CO3溶液蒸馏37 乙醇水新制生石灰蒸馏38 苯酚苯 NaOH溶液、CO2分液39 乙酸乙酯乙酸饱和Na2CO3溶液分液40 溴乙烷乙醇蒸馏水分液41 肥皂甘油食盐过滤42 葡萄糖淀粉(半透膜)渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
高中化学中常见的除杂方法介绍

高中化学中常见的除杂方法介绍化学是一门研究物质变化和性质的科学,而除杂方法则是化学实验中常用的一种技术手段。
除杂方法主要用于去除实验中的杂质,以保证实验结果的准确性和可靠性。
本文将介绍高中化学中常见的除杂方法。
一、过滤法过滤法是最常用的除杂方法之一。
它通过过滤纸或滤膜,将固体杂质与溶液分离。
过滤法适用于固体颗粒较大且不溶于溶液的情况。
在实验中,我们通常使用漏斗和过滤纸进行过滤。
首先,将漏斗放置在一个容器上,然后将过滤纸折叠成适当的形状放置在漏斗内。
接下来,将含有杂质的溶液缓慢倒入漏斗中,溶液通过过滤纸时,固体杂质会被留在过滤纸上,而纯净的溶液则会通过漏斗流入容器中。
二、沉淀法沉淀法是一种通过沉淀形成的固体颗粒与溶液分离的除杂方法。
它适用于溶液中存在悬浮物或可沉淀物的情况。
在实验中,我们通常使用离心机对溶液进行离心,将悬浮物或沉淀物沉淀下来。
首先,将含有杂质的溶液放置在离心机中,然后以较高的速度旋转离心机,使固体颗粒向底部沉淀。
最后,将上清液倒掉,留下的沉淀即为除去杂质后的纯净物质。
三、蒸馏法蒸馏法是一种通过不同的沸点将混合物中的杂质与纯净物质分离的除杂方法。
它适用于混合物中存在沸点差异较大的成分的情况。
在实验中,我们通常使用蒸馏装置进行蒸馏。
首先,将混合物放入蒸馏烧瓶中,然后加热烧瓶。
不同沸点的成分会在不同温度下汽化,并通过冷凝器冷却后变为液体。
纯净物质会在较低温度下冷凝,而杂质则会在较高温度下冷凝。
最后,通过收集液体,我们可以得到纯净物质。
四、结晶法结晶法是一种通过溶解度差异将溶液中的杂质与纯净物质分离的除杂方法。
它适用于溶液中存在溶解度差异较大的成分的情况。
在实验中,我们通常使用结晶皿进行结晶。
首先,将含有杂质的溶液加热,使其溶解。
然后,逐渐降低温度,溶液中的纯净物质会先结晶出来,而杂质则会留在溶液中。
最后,通过过滤或离心,我们可以得到纯净的结晶物质。
除了以上介绍的常见除杂方法,还有一些其他的方法,如萃取法、吸附法等。
高中化学除杂总结大全

高中化学除杂总结大全除杂是指在实验室中,利用熔融分析、沉淀分析和溶剂分析等方法,对混合物中的物质进行分离和分析,以获得单一物质或少量物质的称为除杂。
除杂的过程中还需要加入一些添加剂,以促进被检测物质的分离和分析,提高检测效率。
二、高中化学除杂实验1、熔融分析熔融分析是指通过改变混合物中物质的温度,将它们分离出来的一种分析方法。
它是指通过改变混合物中物质的温度,将它们分离出来的一种分析方法。
常见的熔融分析方法有熔融熔融分析法、熔点测定法和热失重法等。
2、沉淀分析沉淀分析是指在溶液中添加沉淀剂,将沉淀后的物质以沉淀形式离心分离,以此达到分离和分析物质的目的。
实验中,可以在溶液中加入沉淀剂,如氯化钙、氯化镁等,使溶液中某种物质沉淀,再使沉淀物离心分离,实现物质的分离和分析。
3、溶剂分析溶剂分析是指在混合物中利用溶剂的挥发性来分离和分析物质的一种分析方法。
实验中,可以把混合物放入不同溶剂中蒸馏,利用溶剂挥发性不同、表面张力差异等物理化学性质,将混合物中某一成分从溶液中分离出来,达到分离单一物质的目的。
三、注意事项在高中化学除杂实验中,应该注意以下几点:1、应使用符合要求的添加剂,以促进被检测物质的有效分离。
2、在除杂实验中,应根据溶液的性质选择合适的溶剂,以防止混合物的反应。
3、在除杂实验中,应小心操作,以免发生意外伤害。
4、在实验完成后,应注意清洁实验仪器,以保证下次实验的取得良好效果。
四、总结高中化学除杂实验是一种专业的分析方法,它可以分离和分析混合物中的物质,可以获得更准确的检测数据。
为了获得更可靠的检测数据,在除杂实验中,应该注意选择合理的添加剂,操作熟练,注意仪器的清洁度,以获得理想的实验结果。
高中的化学常见物质除杂方法归纳.docx

原物所含杂质除杂质试剂除杂质的方法1 N 2O2灼热的铜丝网洗气2 CO2H2S硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2HCl饱和小苏打溶液洗气5 H 2S HCl饱和 NaHS溶液洗气6 SO2HCl饱和 NaHSO3溶液洗气7 Cl 2HCl饱和 NaCl 溶液洗气8 CO SO2饱和小苏打溶液洗气29 碳粉MnO2浓盐酸加热后过滤10MnO碳粉-----------加热灼烧211碳粉CuO盐酸或硫酸过滤12 Al 2O3Fe 2O3 NaOH 溶液(过量),再通CO2过滤、加热固体13 Fe O Al2O NaOH溶液过滤23314 Al 2O3SiO2盐酸 NH 3?H2O过滤、加热固体15 SiO 2ZnO盐酸过滤16 CuO ZnO NaOH溶液过滤17 BaSO4BaCO3稀硫酸过滤18 NaOH Na2CO3Ba ( OH)2溶液(适量)过滤19 NaHCO3Na2CO3通入过量 CO2------20Na 2CO3NaHCO 3-------加热21 NaCl NaHCO3盐酸蒸发结晶22 NH4Cl(NH 4) 2SO4Ba Cl 2 溶液(适量)过滤23FeCl 3FeCl2通入过量 Cl 2-----24FeCl3CuCl2铁粉、 Cl 2过滤25FeCl 2FeCl3铁粉过滤26Fe(OH) 3胶体FeCl3(半透膜)渗析27 CuS FeS稀盐酸或稀硫酸过滤28I 2NaCl------升华29NaCl NH4Cl-------加热30 KNO NaCl蒸馏水重结晶331乙烯SO2、H2 O碱石灰洗气32乙烷乙烯溴水洗气33溴苯溴稀 NaOH溶液分液34硝基苯NO2稀 NaOH溶液分液35甲苯苯酚NaOH溶液分液36乙醛乙酸饱和 Na2CO3溶液蒸馏37乙醇水新制生石灰蒸馏38苯酚苯NaOH溶液、 CO2分液39乙酸乙酯乙酸饱和 Na2CO3溶液分液40溴乙烷乙醇蒸馏水分液41肥皂甘油食盐过滤42葡萄糖淀粉(半透膜)渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、 SO2等,水蒸气要在最后除去。
高中化学除杂总结大全

高中化学除杂总结大全除杂质的方法第一,要知道除杂质的原则,除掉杂质的同时,不能生成新的杂质。
第二,要背物质的溶解性表,这样才能很好、很快的找到形成沉淀的离子例如氢氧化钠混有碳酸钠,阴离子不同,而碳酸根与很多的阳离子都能形成沉淀,常用的可以是氢氧化钙。
这样,反应后就将碳酸钠除掉,生成了氢氧化钠,也不生成新的杂质。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
除杂题是初中化学的常见题,它灵活多变,可以综合考察学生的解题能力。
现列举几种方法:1 物理方法1.l 过滤法.原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。
如:氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。
如果要获得杂质碳酸钙,可洗涤烘干。
练习1 下列混合物可以用溶解、过滤、蒸发操作来分离的是:()A.CaCO3 CaO B.NaCl KNO3 C.NaNO3 BaSO4 D.KCl KClO31.2 结晶法.原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。
例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
练习2 下列混合物适宜用结晶法分离的是:()A.NaNO3 Na2CO3 B.NaNO3 NaCl C.NaOH Mg(OH)2 D.NaCl BaSO42. 化学方法:原理(一)、加入的试剂只与杂质反应,不与原物反应。
(二)、反应后不能带入新的杂质。
高中化学除杂方法

(1)洗气法:此法适用于除去气体有机物中的气体杂质。
如除去乙烷中的乙烯,应将混合气体通入盛有稀溴水的洗气瓶,使乙烯生成1,2-二溴乙烷留在洗气瓶中除去。
不能用通入酸性高锰酸钾溶液中洗气的方法,因为乙烯与酸性高锰酸钾溶液会发生反应生成CO2混入乙烷中。
除去乙烯中的SO2气体可将混合气体通入盛有NaOH溶液的洗气瓶洗气。
(2)转化法:将杂质转化为较高沸点或水溶性强的物质,而达到分离的目的。
如除去乙酸乙酯中少量的乙酸,不可用加入乙醇和浓硫酸使之反应而转化为乙酸乙酯的方法,因为该反应可逆,无法将乙酸彻底除去。
应加入饱和Na2CO3溶液使乙酸转化为乙酸钠溶液后用分液的方法除去。
溴苯中溶有的溴可加入NaOH溶液使溴转化为盐溶液再分液除去。
乙醇中少量的水可加入新制的生石灰将水转化为Ca(OH)2,再蒸馏可得无水乙醇。
一.常见除杂1..N2(O2) ——灼热的铜丝2Cu+O2=2CuO2.CO2(H2S)——用饱和NaHCO3溶液NaHCO3+H2S=NaHS+H2O+CO2↑3.CO2(CO)——灼热的氧化铜CuO+CO=Cu+CO24.CO2(HCl)——用饱和NaHCO3溶液NaHCO3+HCl=NaCl+H2O+CO2↑5.H2S(HCl)——用饱和NaHS溶液NaHS+HCl=NaCl+H2S6.SO2(HCl)——用饱和NaHSO3溶液NaHSO3+HCl=NaCl+H2O+SO2↑7.Cl2(HCl)——用饱和食盐水,HCl易溶而Cl2不溶8.MnO2(碳粉)——1.将混合物在氧气中点燃C+O2=CO22.通入灼热的氧化钙C+CaO=Ca+CO2↑(条件:高温)3.通入灼热的氧化铁3C+2Fe2O3=3CO2↑+ 4Fe9.碳粉(MnO2)——加浓盐酸MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O10.C(CuO)——加稀盐酸CuO+2HCl=CuCl2+H2O11.Al2O3(Fe2O3)方法一:将固体混合物溶于过量的氢氧化钠溶液,过滤除去氧化铁,留下滤液。
化学除杂方法总结高中

化学除杂方法总结高中高中化学中,除杂方法是实验中非常重要的一部分。
为了得到纯净的化合物或溶液,常常需要去除其中的杂质。
下面将介绍几种常用的化学除杂方法。
一、晶体分离法晶体分离法是一种通过晶体生长的方式来分离纯净化合物的方法。
常见的晶体分离方法有溶液结晶法、熔融结晶法和蒸发结晶法等。
其中,溶液结晶法是最常用的一种方法。
它的基本原理是将含有杂质的溶液加热,使得溶质溶解,然后冷却溶液,使溶质结晶出来。
通过重复结晶的过程,可以得到更纯净的化合物。
二、过滤法过滤法是一种通过过滤来去除溶液中的固体杂质的方法。
常见的过滤方法有简单过滤、石棉滤纸过滤和玻璃纤维过滤等。
其中,简单过滤是最常用的一种方法。
它的原理是将含有杂质的溶液倒入漏斗中,通过滤纸的孔隙,将杂质滤除,得到纯净的溶液。
三、蒸馏法蒸馏法是一种通过蒸发和冷凝的方式来分离液体混合物的方法。
常见的蒸馏方法有简单蒸馏和分馏蒸馏等。
其中,简单蒸馏是最常用的一种方法。
它的原理是将液体混合物加热,使其中的易挥发成分蒸发,然后将蒸汽冷凝,得到纯净的液体。
四、萃取法萃取法是一种通过溶剂选择性提取物质的方法。
常见的萃取方法有溶剂萃取和液液萃取等。
其中,溶剂萃取是最常用的一种方法。
它的原理是将含有杂质的溶液与溶剂混合,通过溶质在溶剂中的溶解度不同,使溶质从溶液中转移到溶剂中,从而实现杂质的除去。
五、离心法离心法是一种通过离心机的离心力来分离混合物的方法。
常见的离心方法有普通离心和高速离心等。
其中,普通离心是最常用的一种方法。
它的原理是通过离心机的高速旋转,使混合物中的固体颗粒沉积到离心管的底部,从而实现杂质的分离。
六、电泳法电泳法是一种通过电场作用来分离溶液中的物质的方法。
常见的电泳方法有直流电泳和凝胶电泳等。
其中,凝胶电泳是最常用的一种方法。
它的原理是通过将溶液中的物质置于凝胶中,然后通过电场的作用,使物质在凝胶中迁移,从而实现杂质的分离。
总结起来,高中化学中常用的除杂方法有晶体分离法、过滤法、蒸馏法、萃取法、离心法和电泳法等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原物所含杂质除杂质试剂除杂质的方法
1 N2O2灼热的铜丝网洗气
2 CO2 H2S 硫酸铜溶液洗气
3 CO CO2石灰水或烧碱液洗气
4 CO2HCl 饱和小苏打溶液洗气
5 H2S HCl 饱和NaHS溶液洗气
6 SO2HCl 饱和NaHSO3溶液洗气
7 Cl2HCl 饱和NaCl溶液洗气
8 CO2SO2饱和小苏打溶液洗气
9 碳粉MnO2浓盐酸加热后过滤
10 MnO2碳粉----------- 加热灼烧
11 碳粉CuO 盐酸或硫酸过滤
12 Al2O3Fe2O3NaOH溶液(过量),再通CO2过滤、加热固体
13 Fe2O3Al2O3NaOH溶液过滤
14 Al2O3SiO2盐酸NH3H2O 过滤、加热固体
15 SiO2ZnO 盐酸过滤
16 CuO ZnO NaOH溶液过滤
17 BaSO4BaCO3稀硫酸过滤
18 NaOH Na2CO3Ba(OH)2溶液(适量)过滤
19 NaHCO3Na2CO3通入过量CO2 ------
20 Na2CO3NaHCO3------- 加热
21 NaCl NaHCO3 盐酸蒸发结晶
22 NH4Cl (NH4)2SO4Ba Cl2溶液(适量)过滤
23 FeCl3FeCl2通入过量Cl2-----
24 FeCl3CuCl2铁粉、Cl2过滤
25 FeCl2FeCl3铁粉过滤
26 Fe(OH)3胶体FeCl3(半透膜)渗析
27 CuS FeS 稀盐酸或稀硫酸过滤
28 I2NaCl ------ 升华
29 NaCl NH4Cl ------- 加热
30 KNO3NaCl 蒸馏水重结晶
31 乙烯SO2、H2O 碱石灰洗气
32 乙烷乙烯溴水洗气
33 溴苯溴稀NaOH溶液分液
34 硝基苯NO2稀NaOH溶液分液
35 甲苯苯酚NaOH溶液分液
36 乙醛乙酸饱和Na2CO3溶液蒸馏
37 乙醇水新制生石灰蒸馏
38 苯酚苯NaOH溶液、CO2分液
39 乙酸乙酯乙酸饱和Na2CO3溶液分液
40 溴乙烷乙醇蒸馏水分液
41 肥皂甘油食盐过滤
42 葡萄糖淀粉(半透膜)渗析
气体除杂的原则:
(1)不引入新的杂质
(2)不减少被净化气体的量
注意的问题:
(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
(2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:
1杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开
2吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去
3沉淀过滤法;欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可
4加热升华法;欲除去碘中的沙子,即可用此法
5溶液萃取法;欲除去水中含有的少量溴,可采用此法
6结晶和重结晶;欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体
7分馏蒸馏法;欲除去乙醚中少量的酒精,可采用多次蒸馏的方法
8分液法;欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离
9渗析法;欲除去胶体中的离子,可采用此法。
如除去氢氧化钠胶体中的氯离子。
