物理化学第一章 习题及答案
物理化学第一章课后答案

物理化学核心教程(第二版)参考答案第一章气体一、思考题1. 如何使一个尚未破裂而被打瘪的乒乓球恢复原状采用了什么原理答:将打瘪的乒乓球浸泡在热水中,使球壁变软,球中空气受热膨胀,可使其恢复球状。
采用的是气体热胀冷缩的原理。
2. 在两个密封、绝热、体积相等的容器中,装有压力相等的某种理想气体。
试问,这两容器中气体的温度是否相等答:不一定相等。
根据理想气体状态方程,若物质的量相同,则温度才会相等。
3. 两个容积相同的玻璃球内充满氮气,两球中间用一玻管相通,管中间有一汞滴将两边的气体分开。
当左球的温度为273 K,右球的温度为293 K时,汞滴处在中间达成平衡。
试问:(1)若将左球温度升高10 K,中间汞滴向哪边移动(2)若两球温度同时都升高10 K, 中间汞滴向哪边移动答:(1)左球温度升高,气体体积膨胀,推动汞滴向右边移动。
(2)两球温度同时都升高10 K,汞滴仍向右边移动。
因为左边起始温度低,升高10 K所占比例比右边大,283/273大于303/293,所以膨胀的体积(或保持体积不变时增加的压力)左边比右边大。
4. 在大气压力下,将沸腾的开水迅速倒入保温瓶中,达保温瓶容积的左右,迅速盖上软木塞,防止保温瓶漏气,并迅速放开手。
请估计会发生什么现象答:软木塞会崩出。
这是因为保温瓶中的剩余气体被热水加热后膨胀,当与迅速蒸发的水汽的压力加在一起,大于外面压力时,就会使软木塞崩出。
如果软木塞盖得太紧,甚至会使保温瓶爆炸。
防止的方法是灌开水时不要太快,且要将保温瓶灌满。
5. 当某个纯物质的气、液两相处于平衡时,不断升高平衡温度,这时处于平衡状态的气-液两相的摩尔体积将如何变化答:升高平衡温度,纯物的饱和蒸汽压也升高。
但由于液体的可压缩性较小,热膨胀仍占主要地位,所以液体的摩尔体积会随着温度的升高而升高。
而蒸汽易被压缩,当饱和蒸汽压变大时,气体的摩尔体积会变小。
随着平衡温度的不断升高,气体与液体的摩尔体积逐渐接近。
物理化学第一章 习题及答案

第一章 热力学第一定律一、 填空题1、一定温度、压力下,在容器中进行如下反应:Zn(s)+2HCl(aq)= ZnCl 2(aq)+H 2(g)若按质量守恒定律,则反应系统为 系统;若将系统与环境的分界面设在容器中液体的表面上,则反应系统为 系统。
2、所谓状态是指系统所有性质的 。
而平衡态则是指系统的状态 的情况。
系统处于平衡态的四个条件分别是系统内必须达到 平衡、 平衡、 平衡和 平衡。
3、下列各公式的适用条件分别为:U=f(T)和H=f(T)适用于 ;Q v =△U 适用于 ;Q p =△H 适用于 ; △U=dT nC 12T T m ,v ⎰适用于 ; △H=dT nC 21T T m ,P ⎰适用于 ; Q p =Q V +△n g RT 适用于 ;PV r=常数适用于 。
4、按标准摩尔生成焓与标准摩尔燃烧焓的定义,在C (石墨)、CO (g )和CO 2(g)之间, 的标准摩尔生成焓正好等于 的标准摩尔燃烧焓。
标准摩尔生成焓为零的是 ,因为它是 。
标准摩尔燃烧焓为零的是 ,因为它是 。
5、在节流膨胀过程中,系统的各状态函数中,只有 的值不改变。
理想气体经节流膨胀后,它的 不改变,即它的节流膨胀系数μ= 。
这是因为它的焓 。
6、化学反应热会随反应温度改变而改变的原因是 ;基尔霍夫公式可直接使用的条件是 。
7、在 、不做非体积功的条件下,系统焓的增加值 系统吸收的热量。
8、由标准状态下元素的 完全反应生成1mol 纯物质的焓变叫做物质的 。
9、某化学反应在恒压、绝热和只做膨胀功的条件下进行, 系统温度由T 1升高到T 2,则此过程的焓变 零;若此反应在恒温(T 1)、恒压和只做膨胀功的条件下进行,则其焓变 零。
10、实际气体的μ=0P T H〈⎪⎭⎫ ⎝⎛∂∂,经节流膨胀后该气体的温度将 。
11、公式Q P =ΔH 的适用条件是 。
12、若某化学反应,只做体积功且满足等容或等压条件,则反应的热效应只由 决定,而与 无关。
第一章 题解答 物理化学

第一章习题解答1.1 物质的体膨胀系数αV与等温压缩率κT的定义如下:试导出理想气体的、与压力、温度的关系解:对于理想气体:PV=nRT , V= nRT/P求偏导:1.2 气柜储存有121.6kPa,27℃的氯乙烯(C2H3Cl)气体300m3,若以每小时90kg的流量输往使用车间,试问储存的气体能用多少小时?解:将氯乙烯(M w=62.5g/mol)看成理想气体:PV=nRT , n= PV/RT n=121600⨯300/8.314⨯300.13 (mol)=14618.6molm=14618.6⨯62.5/1000(kg)=913.66 kgt=972.138/90(hr)=10.15hr1.3 0℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度?解:将甲烷(M w=16g/mol)看成理想气体:PV=nRT , PV =mRT/ M w甲烷在标准状况下的密度为=m/V= PM w/RT=101.325⨯16/8.314⨯273.15(kg/m3)=0.714 kg/m31.4 一抽成真空的球形容器,质量为25.0000g。
充以4℃水之后,总质量为125.0000g。
若改充以25℃,13.33kPa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
水的密度按1 g.cm-3计算。
(答案来源:)解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M wM w= mRT/ PV=(25.0163-25.0000)⨯8.314⨯300.15/(13330⨯100⨯10-6) M w =30.51(g/mol)1.5 两个容器均为V的玻璃球之间用细管连接,泡内密封着标准状况下的空气。
若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接细管中的气体体积,试求该容器内空气的压力。
《物理化学》课后习题第一章答案

习题解答第一章1. 1mol 理想气体依次经过下列过程:(1)恒容下从25℃升温至100℃,(2)绝热自由膨胀至二倍体积,(3)恒压下冷却至25℃。
试计算整个过程的Q 、W 、U ∆及H ∆。
解:将三个过程中Q 、U ∆及W 的变化值列表如下:过程 QU ∆ W(1) )(11,初末T T C m V - )(11,初末T T C m V -0 (2)(3) )(33,初末T T C m p - )(33,初末T T C m v - )(33初末V V p -则对整个过程:K 15.29831=末初T T = K 15.37331==初末T T Q =)(11,初末-T T nC m v +0+)(33,初末-T T nC m p=)初末33(T T nR -=[1×8.314×(-75)]J =-623.55JU ∆=)(11,初末-T T nC m v +0+)(33,初末-T T nC m v =0W =-)(33初末V V p -=-)初末33(T T nR - =-[1×8.314×(-75)]J =623.55J因为体系的温度没有改变,所以H ∆=02. 0.1mol 单原子理想气体,始态为400K 、101.325kPa ,经下列两途径到达相同的终态:(1) 恒温可逆膨胀到10dm 3,再恒容升温至610K ; (2) 绝热自由膨胀到6.56dm 3,再恒压加热至610K 。
分别求两途径的Q 、W 、U ∆及H ∆。
若只知始态和终态,能否求出两途径的U ∆及H ∆?解:(1)始态体积1V =11/p nRT =(0.1×8.314×400/101325)dm 3=32.8dm 3 W =恒容恒温W W +=0ln12+V V nRT=(0.1×8.314×400×8.3210ln +0)J =370.7JU ∆=)(12,T T nC m V -=[)400610(314.8231.0-⨯⨯⨯]J =261.9J Q =U ∆+W =632.6J H ∆=)(12,T T nC m p -=[)400610(314.8251.0-⨯⨯⨯]=436.4J (2) Q =恒压绝热Q Q +=0+)(12,T T nC m p -=463.4J U ∆=恒压绝热U U ∆+∆=0+)(12,T T nC m V -=261.9J H ∆=恒压绝热H H ∆+∆=0+绝热Q =463.4J W =U ∆-Q =174.5J若只知始态和终态也可以求出两途径的U ∆及H ∆,因为H U 和是状态函数,其值只与体系的始终态有关,与变化途径无关。
《物理化学》课后习题第一章答案

习题解答第一章1. 1mol 理想气体依次经过下列过程:(1)恒容下从25℃升温至100℃,(2)绝热自由膨胀至二倍体积,(3)恒压下冷却至25℃。
试计算整个过程的Q 、W 、U ∆及H ∆。
解:将三个过程中Q 、U ∆及W 的变化值列表如下:过程 QU ∆ W(1) )(11,初末T T C m V - )(11,初末T T C m V -0 (2)(3) )(33,初末T T C m p - )(33,初末T T C m v - )(33初末V V p -则对整个过程:K 15.29831=末初T T = K 15.37331==初末T T Q =)(11,初末-T T nC m v +0+)(33,初末-T T nC m p=)初末33(T T nR -=[1×8.314×(-75)]J =-623.55JU ∆=)(11,初末-T T nC m v +0+)(33,初末-T T nC m v =0W =-)(33初末V V p -=-)初末33(T T nR - =-[1×8.314×(-75)]J =623.55J因为体系的温度没有改变,所以H ∆=02. 0.1mol 单原子理想气体,始态为400K 、101.325kPa ,经下列两途径到达相同的终态:(1) 恒温可逆膨胀到10dm 3,再恒容升温至610K ; (2) 绝热自由膨胀到6.56dm 3,再恒压加热至610K 。
分别求两途径的Q 、W 、U ∆及H ∆。
若只知始态和终态,能否求出两途径的U ∆及H ∆解:(1)始态体积1V =11/p nRT =(0.1×8.314×400/)dm 3=32.8dm 3 W =恒容恒温W W +=0ln12+V V nRT=(0.1×8.314×400×8.3210ln +0)J =370.7JU ∆=)(12,T T nC m V -=[)400610(314.8231.0-⨯⨯⨯]J =261.9J Q =U ∆+W =632.6J H ∆=)(12,T T nC m p -=[)400610(314.8251.0-⨯⨯⨯]=436.4J (2) Q =恒压绝热Q Q +=0+)(12,T T nC m p -=463.4J U ∆=恒压绝热U U ∆+∆=0+)(12,T T nC m V -=261.9J H ∆=恒压绝热H H ∆+∆=0+绝热Q =463.4J W =U ∆-Q =174.5J若只知始态和终态也可以求出两途径的U ∆及H ∆,因为H U 和是状态函数,其值只与体系的始终态有关,与变化途径无关。
物理化学 答案 第一章_习题解答

-
知此气体的 Cp,m=29.10 J·K 1,求过程的ΔU、ΔH、Q 和 W 。 解: (1)等容
ΔU = n ⋅ Cv ,m (T2 − T1 ) = 1 × (29.1 − 8.314) × 75 = 1559 J ΔH = n ⋅ C p ,m (T2 − T1 ) = 1 × 29.1 × 75 = 2183 J
η = −Wr / Q1 = (T1 − T2 ) / T1 = (500 − 300) / 600 = 40%
第二个卡诺热机效率
η ′ = −Wr / Q1′ = (T1 − T2′) / T1 = (500 − 250) / 600 = 50%
∵
η =η′
∴两个热机的效率不相同
(2)第一个热机吸收的热量: Q1 =
γ =1.4,试求 Cv,m。若该气体的摩尔热容近似为常数,试求在等容条件下加热该气体至 t2=
80℃所需的热。 解:∵ γ =
C p,m Cv , m
=
Cv , m + R Cv , m
= 1.4
∴ Cv, m =
R
γ
=
8.314 = 20.79 J ⋅ K -1 ⋅ mol-1 0.4
Qv = n ⋅ Cv ,m ⋅ ΔT = =
4
3 3 ⎧ ⎧ ⎪V1 = 5dm ⎪V2 = 6dm Q (可 ) = 0 ⎯⎯⎯⎯ → ⎨ ⎨ ⎪T1 = 298.15 K ⎪T2 = 278.15 K ⎩ ⎩
由理想气体绝热可逆过程方程式可知
T2 / T1 = (V1 / V2 ) Cv ,m =
R / Cv , m
物理化学习题及答案

第一章热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于()(A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消答案:B2.关于焓的性质, 下列说法中正确的是()(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
3.涉及焓的下列说法中正确的是()(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
4.下列哪个封闭体系的内能和焓仅是温度的函数()(A) 理想溶液(B) 稀溶液(C) 所有气体(D) 理想气体答案:D5.与物质的生成热有关的下列表述中不正确的是()(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
6.dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是()(A) 等容过程 (B)无化学反应和相变的等容过程 (C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程答案:D7.下列过程中, 系统内能变化不为零的是()(A) 不可逆循环过程 (B) 可逆循环过程 (C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程答案:D。
物理化学习题--1

第一章 化学热力学基本定律与函数复习思考题1. 状态函数有何特点,当体系进行任一循环过程时,其状态函数的变化值是多少?2. 设有一封闭体系,当其始、末态确定之后,判断下列各种物理量是否有确定的值。
(1) W(Q=0); (2)Q; (3)Q(W=0); (4)Q-W。
3. 试证明在无有效功的恒容过程中ΔU=QV。
此过程中的ΔH又是多少(用公式表示)?是否仍可用过程热来量度?4. 将273.15 K 、1 mol 的冰缓缓加热,使其在恒压下蒸发为373.15 K 的水蒸气,此过程热用T C p O)d H (2373.15K K 15.273m ,⎰计算对不对?5. 对1 mol 理想气体,从同一始态(p、T 、V )出发,分别进行恒温可逆膨胀或绝热可逆膨胀至相同体积的末态,其所做的膨胀功哪一过程大?6. 1 mol 气体从同一始态出发,分别进行恒温可逆膨胀或恒温不可逆膨胀达到相同的末态,由于恒温可逆膨胀时所做的功Wr 大于恒温不可逆膨胀时的体积功Wir ,则Q r >Q ir 。
对否? 为什么?7. 任一气体从同一始态出发分别经绝热可逆膨胀或绝热不可逆膨胀达到体积相同的末态,而末态的压强相同吗?8. 说明下列热化学方程式能表明什么。
CH 3CH 2OH (l )+CH 3COOH (l )==== CH 3COOC 2H 5(l)+H 2O(l)Θm r H ∆(298K )= 8 238.30 J ·mol -1 当此反应达到平衡时,乙醇、乙酸、脂及水的物质的量分别为31、31、32及32mol ,求32mol 的乙醇与适量乙酸转化为脂及水所吸收的热。
9. 热为过程函数,为何计算化学反应的恒压热效应Qp 时又只取决于始、末态?10. 在标准状态下,CO (g,Θp )+21O 2(g,Θp )==== CO 2(g, Θp )的Θm r H ∆(298K)值即为Θm r H ∆(CO 2,g,298K),对否? 2H 2(g,Θp )+O 2(g,Θp )====2H 2O(g, Θp )的Θm r H ∆(298K )值等于Θm f H ∆(H2O,g,298K),并等于Θm c H ∆(H 2,298K ),对不对? 11. 298.15 K 、Θp 下,液氮的标准生成热为零吗?12. 试指出下列公式的适用条件:(1) ⎰∆+∆=∆ΘΘ21d )()(1m r 2m r T T p TC T H T H ;(2) RT Q Q V p )g (B m ,m ,∑+=ν13. 含有放射性元素物质的蜕变反应的热效应可用各物质的标准生成焓计算吗? 为什么?14. 如果不断地将理想气体进行恒温膨胀,则所吸收的热全部转变为功,这不就是单一热源也能做功的实例吗?如何解释?15. 在同一始、末态间,可逆过程的热温商大于不可逆过程的热温商,即“可逆过程的熵变化值大于不可逆过程的熵变化值”。
物理化学第一、二章习题+答案

第一章 气 体1 两个容积均为V 的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100℃,另一个球则维持0℃,忽略连接细管中气体。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
2 一密闭刚性容器中充满了空气,并有少量的水。
但容器于300 K 条件下大平衡时,容器内压力为 kPa 。
若把该容器移至 K 的沸水中,试求容器中到达新的平衡时应有的压力。
设容器中始终有水存在,且可忽略水的任何体积变化。
300 K 时水的饱和蒸气压为 kPa 。
解:将气相看作理想气体,在300 K 时空气的分压为由于体积不变(忽略水的任何体积变化), K 时空气的分压为由于容器中始终有水存在,在 K 时,水的饱和蒸气压为 kPa ,系统中水蒸气的分压为 kPa ,所以系统的总压()()K 15.373,O H P air P P 2+== + KPa =第二章 热力学第一定律1. 1mol 理想气体经如下变化过程到末态,求整个过程的W 、Q 、△U 、△H.解:KnR V P T K nR V P T KnR V P T 7.243314.81101105.20262437314.811010105.20267.243314.8110101065.202333333322233111=⨯⨯⨯⨯===⨯⨯⨯⨯===⨯⨯⨯⨯==---恒容升温过程:W 1= 0 J恒压压缩过程:W 2= -P 外(V 3-V 1) = ×103×(1-10)×10-3= kJ恒容1 mol 理想气体P 2= KPa V 2=10dm 3T 2=1 mol 理想气体P 1= KPa V 1=10 dm 3 T 1=1 mol 理想气体P 3= KPa V 3=1 dm 3 T 3=恒压J W W W k 24.1821=+=T 3=T 1, ()()J 0T T C n H J 0T T C n U 13m .P 13m .v =-⋅⋅=∆=-⋅⋅=∆, 根据热力学第一定律J W U Q 8.24k 1-24.18-0==-∆=2. 在一带活塞的绝热容器中有一固定的绝热隔板。
第五版物理化学第一章习题答案

第一章气体的pVT关系1.1 物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.2 气柜内贮有121.6 kPa,27℃的氯乙烯(C2H3Cl)气体300 m3,若以每小时90 kg的流量输往使用车间,试问贮存的气体能用多少小时?解:假设气柜内所贮存的气体可全部送往使用车间。
1.3 0℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度?解:将甲烷(M w=16g/mol)看成理想气体:PV=nRT , PV =mRT/ M w甲烷在标准状况下的密度为=m/V= PM w/RT=101.325⨯16/8.314⨯273.15(kg/m3)=0.714 kg/m31.4 一抽成真空的球形容器,质量为25.0000g充以4℃水之后,总质量为125.0000g。
若改充以25℃,13.33 kPa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
水的密度1g·cm3计算。
解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M wM w= mRT/ PV=(25.0163-25.0000)⨯8.314⨯300.15/(13330⨯100⨯10-6)M w =30.51(g/mol)1.5 两个容积均为V 的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.6 0℃时氯甲烷(CH 3Cl )气体的密度ρ随压力的变化如下。
试作p p-ρ图,用外推法求氯甲烷的相对分子质量。
1.7 今有20℃的乙烷-丁烷混合气体,充入一抽成真空的200 cm3容器中,直至压力达101.325 kPa,测得容器中混合气体的质量为0.3897 g。
物理化学(第一章)作业及答案

每次物理化学作业及答案§1.1 热力学基本概念第一周(1) 练习1“任何系统无体积变化的过程就一定不对环境作功。
”这话对吗?为什么?答:不对,应该是无体积变化的过程,系统就一定不对环境作体积功。
系统和环境之间交换能量的方式,除体积功外,还有非体积功,如电功,表面功等.2“凡是系统的温度下降就一定放热给环境,而温度不变时则系统既不吸热也不放热。
”这结论正确吗?举例说明之。
答:不正确。
系统的温度下降,内能降低,可以不放热给环境.例如: (13页例1-4) 绝热容器中的理想气体的膨胀过程,温度下降释放的能量,没有传给环境,而转换为对外做的体积功.而温度不变时则系统既不吸热也不放热。
不对, 等温等压相变过程,温度不变,但需要吸热(或放热), 如一个大气压下,373.15K 下,水变成同温同压的水蒸汽的汽化过程,温度不变,但需要吸热。
3在一绝热容器中盛有水,其中浸有电热丝,通电加热。
将不同对象看作系统,则上述加热过程的Q或W大于、小于还是等于零?⑴以电热丝为系统Q<0; W>0;⑵以水为系统; Q>0;W=0;⑶以容器内所有物质为系统Q=0; W>0;⑷将容器内物质以及电源和其它一切有影响的物质看作整个系统。
Q=0;W=0.4在等压的条件下,将1mol理想气体加热使其温度升高1K,试证明所作功的数值为R。
证明:∵等压过程则P1=P2=P e∴W=-p(V2-V1)=-p[ nR(T+1)/p- nRT/p]= -p×(nR/p)= -R51mol理想气体,初态体积为25dm3,温度为373.2K,试计算分别通过下列四个不同过程,等温膨胀到终态体积100dm3时,系统对环境作的体积功。
(1)向真空膨胀。
(2)可逆膨胀。
(3)先在外压等于体积50dm3时气体的平衡压力下,使气体膨胀到50dm3,然后再在外压等于体积为100dm3时气体的平衡压力下使气体膨胀到终态。
(4)在外压等于气体终态压力下进行膨胀。
物理化学习题及答案

物理化学习题及答案第一章热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于(A) 单纯状态变化(B) 相变化(C) 化学变化(D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上 (B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消答案:B2.关于焓的性质, 下列说法中正确的是(A) 焓是系统内含的热能, 所以常称它为热焓(B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
3.涉及焓的下列说法中正确的是(A) 单质的焓值均等于零(B) 在等温过程中焓变为零(C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
4.下列哪个封闭体系的内能和焓仅是温度的函数(A) 理想溶液 (B) 稀溶液 (C) 所有气体 (D) 理想气体答案:D5.与物质的生成热有关的下列表述中不正确的是(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
6.dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是 (A) 等容过程(B)无化学反应和相变的等容过程(C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程答案:D7.下列过程中, 系统内能变化不为零的是(A) 不可逆循环过程(B) 可逆循环过程 (C) 两种理想气体的混合过程(D) 纯液体的真空蒸发过程答案:D。
关于物理化学习题及答案

第一章热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于()(A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量2(C) D。
因焓3(D) (pV) 45(A)(D)6.(D)7(A)答案:D W=0,故由热力学第一定律ΔU=Q+W得ΔU=Q,蒸发过程需吸热Q>0,故ΔU>0。
8.第一类永动机不能制造成功的原因是()(A) 能量不能创造也不能消灭 (B) 实际过程中功的损失无法避免 (C) 能量传递的形式只有热和功 (D) 热不能全部转换成功答案:A9.盖斯定律包含了两个重要问题, 即()(A) 热力学第一定律和热力学第三定律 (B) 热力学第一定律及热的基本性质(C) 热力学第三定律及热的基本性质 (D) 热力学第一定律及状态函数的基本特征答案:D10.当某化学反应ΔrCp,m <0,则该过程的()r m H T ∆$随温度升高而( )(A) 下降 (B) 升高 (C) 不变 (D) 无规律 答案:A 。
根据Kirchhoff 公式,()/r m r p m d H T dT C ∆=∆$可以看出。
11.在下面涉及盖斯定律的表述中, 不正确的是( )(A) 对在等温等压且不做非体积功的条件下, 发生的各个化学反应过程和相变过程, 可使用盖斯定律(B) 对在等温等容且不做功的条件下, 发生的各个化学反应过程, 可使用盖斯定律(C) 同一物质在盖斯定律涉及的几个反应中都出现时, 只要无溶解等现象, 相态不同也可加减(D) 利用盖斯定律求某个反应的热效应时可引入一些别的反应,设想一些中间步骤, 无论实际反应是否按这些中间步骤进行都可以12答案:C =Q ,说13(A) 答案:C (D )等B14(A)15(A) ∑+∑Wi ,16.与物质的燃烧热有关的下列表述中不正确的是(A) 可燃性物质的燃烧热都不为零 (B) 物质的燃烧热都可测定,所以物质的标准摩尔燃烧焓不是相对值(C) 同一可燃性物质处于不同状态时,其燃烧热不同 (D) 同一可燃性物质处于不同温度下,其燃烧热之值不同答案:B 。
物理化学课后习题答案(全)

第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
物理化学上册习题答案

第一章 气体的pVT 关系1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1T T pV p V V T V V⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系?解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p V V pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121、6kPa 、27℃的氯乙烯(C 2H 3Cl)气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯==每小时90kg 的流量折合p 摩尔数为 133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H Cn/v=(14618、623÷1441、153)=10、144小时1-3 0℃、101、325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CH ρ1-4 一抽成真空的球形容器,质量为25、0000g 。
充以4℃水之后,总质量为125、0000g 。
若改用充以25℃、13、33kPa 的某碳氢化合物气体,则总质量为25、0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
物理化学习题及答案

第一章热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于()(A) 单纯状态变化(B) 相变化(C) 化学变化(D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量2(C) D。
因焓3(A)(D) (pV) 45(A)(D)6.(D)7(A)答案:D。
W=0,故由热力学第一定律ΔU=Q+W得ΔU=Q,蒸发过程需吸热Q>0,故ΔU>0。
8.第一类永动机不能制造成功的原因是()(A) 能量不能创造也不能消灭(B) 实际过程中功的损失无法避免(C) 能量传递的形式只有热和功(D) 热不能全部转换成功答案:A9.盖斯定律包含了两个重要问题, 即()(A) 热力学第一定律和热力学第三定律(B) 热力学第一定律及热的基本性质(C) 热力学第三定律及热的基本性质(D) 热力学第一定律及状态函数的基本特征答案:D10.当某化学反应ΔrCp,m <0,则该过程的()r mH T ∆$随温度升高而( ) (A) 下降 (B) 升高 (C) 不变 (D) 无规律 答案:A 。
根据Kirchhoff 公式,()/r m r p m d H T dT C ∆=∆$可以看出。
11.在下面涉及盖斯定律的表述中, 不正确的是( )(A) 对在等温等压且不做非体积功的条件下, 发生的各个化学反应过程和相变过程, 可使用盖斯定律(B) 对在等温等容且不做功的条件下, 发生的各个化学反应过程, 可使用盖斯定律(C) 同一物质在盖斯定律涉及的几个反应中都出现时, 只要无溶解等现象, 相态不同也可加减(D) 利用盖斯定律求某个反应的热效应时可引入一些别的反应,设想一些中间步骤, 无论实际反应是否按这些中间步骤进行都可以12答案:C U =Q ,13(A) 答案:C (D )等B 的热与从14(A)15(A) ∑+∑Wi ,16.与物质的燃烧热有关的下列表述中不正确的是(A) 可燃性物质的燃烧热都不为零 (B) 物质的燃烧热都可测定,所以物质的标准摩尔燃烧焓不是相对值(C) 同一可燃性物质处于不同状态时,其燃烧热不同 (D) 同一可燃性物质处于不同温度下,其燃烧热之值不同答案:B 。
物理化学习题答案(1-5章)

第一章 热力学定律思考题1. 设有一电炉丝浸入水槽中(见下图),接上电源,通以电流一段时间。
分别按下列几种情况作为体系,试问ΔU 、Q 、W 为正、为负,还是为零?①以水和电阻丝为体系; ②以水为体系; ③以电阻丝为体系; ④以电池为体系;⑤以电池、电阻丝为体系; ⑥以电池、电阻丝和水为体系。
答:该题答案列表如下。
2. 任一气体从同一始态出发分别经绝热可逆膨胀和绝热不可逆膨胀达到体积相同的终态,终态压力相同吗?答:不同。
膨胀到相同体积时,绝热可逆与绝热不可逆的终态温度和压力不同。
3. 熵是量度体系无序程度大小的物理量。
下列情况哪一种物质的摩尔熵值更大?(1)室温下纯铁与碳钢; (2)100℃的液态水与100℃的水蒸气; (3)同一温度下结晶完整的金属与有缺陷的金属;(4)1000℃的铁块与1600℃铁水。
答:温度相同的同一种物质,气、液、固态相比(例如水蒸气、液态水和冰相比),气态的微观状态数最大,固态的微观状态数最小,液态居中,因此,摩尔熵气态最大,液态次之,固态最小;同类物质,例如,氟、氯、溴、碘,分子量越大摩尔熵越大;分子结构越复杂熵越大;分子构象越丰富熵越大;同素异形体或同分异构体的摩尔熵也不相同。
(1)、(2)、(3)和(4)均是后者摩尔熵值大。
4. 小分子电解质的渗透压与非电解质的渗透压哪个大?为什么?电解质的稀溶液是否有依数性?其渗透压公式是怎样的?答:非电解质的渗透压大。
因为非电解质不能电离,通过半透膜的几率就小,这样就造成膜两侧的浓差增大,使渗透压增大。
小分子电解质的稀溶液有依数性,但不显著。
稀溶液以浓度代替活度,()RT RT 212c 1c 1c 2c +=∆=π,若c 1>>c 2,RT 1c 2=π;若c 2>>c 1,RT 1c =π,c 1、c 2分别为溶液一侧和溶剂一侧的浓度。
5. 下列物理量中,哪一组是广度性质的状态函数?(1). C p ,C v ,S ,H m (2). U m ,T ,P ,V m (3). V m ,H m ,μ,U (4). H ,V ,U ,G答:(4)组,即H ,V ,U ,G 是广度性质的状态函数。
第一章 习题解答 物理化学

第一章习题解答1.1 物质的体膨胀系数αV与等温压缩率κT的定义如下:试导出理想气体的、与压力、温度的关系解:对于理想气体:PV=nRT , V= nRT/P求偏导:1.2 气柜储存有121.6kPa,27℃的氯乙烯(C2H3Cl)气体300m3,若以每小时90kg的流量输往使用车间,试问储存的气体能用多少小时?解:将氯乙烯(M w=62.5g/mol)看成理想气体:PV=nRT , n= PV/RT n=121600⨯300/8.314⨯300.13 (mol)=14618.6molm=14618.6⨯62.5/1000(kg)=913.66 kgt=972.138/90(hr)=10.15hr1.3 0℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度?解:将甲烷(M w=16g/mol)看成理想气体:PV=nRT , PV =mRT/ M w甲烷在标准状况下的密度为=m/V= PM w/RT=101.325⨯16/8.314⨯273.15(kg/m3)=0.714 kg/m31.4 一抽成真空的球形容器,质量为25.0000g。
充以4℃水之后,总质量为125.0000g。
若改充以25℃,13.33kPa的某碳氢化合物气体,则总质量为25.0163g。
试估算该气体的摩尔质量。
水的密度按1 g.cm-3计算。
(答案来源:)解:球形容器的体积为V=(125-25)g/1 g.cm-3=100 cm3将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ M wM w= mRT/ PV=(25.0163-25.0000)⨯8.314⨯300.15/(13330⨯100⨯10-6) M w =30.51(g/mol)1.5 两个容器均为V的玻璃球之间用细管连接,泡内密封着标准状况下的空气。
若将其中一个球加热到100℃,另一个球则维持0℃,忽略连接细管中的气体体积,试求该容器内空气的压力。
物化第一章习题
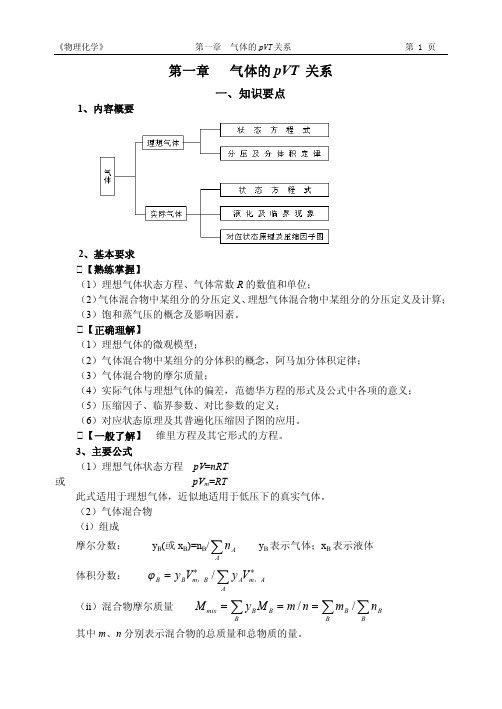
M RT / p 8.315J K 1mol 1 273.15K 22.237 10 6 kg m 3 Pa 1 50.5 10 3 kg mol 1 50.5g mol 1
22.8 22.7
1.7 今有 20℃的乙烷-丁烷混合气体,充入一 抽成真空的 200cm3 容器中,直至压力达 101.325kPa, 测得容器中混合气体的质量为 0.3897g。试求该混合气 体中两种组分的摩尔分数及分压力。 解:已知 T=293.15K V=0.2dm3=2.0×10-4m3 p=101.325kPa m=0.3897g=3.897×10-4kg
《物理化学》
第一章 气体的 pVT 关系
第 4 页
因为 pV=(m/Mg)RT 所以 Mg =mRT/pV=8.315Pam3mol-1K-1×298.15K×0.0163g/13330Pa×0.0001m3 =30.31 gmol-1 1.5 两个容积均为 V 的玻璃球泡之间用细管连接, 泡内密封着标准状况下的空气。 若将其中一个球加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该 容器内空气的压力。
25.331 0.56660
2.3074 1.5263 1.1401 /g.dm 解:当气体符合理想气体的行为时 p mRT /(VM ) 所以 M RT / p
对于实际气体,只有当压力 p 趋近于零时上述关系才成立,即 由题所给数据计算出在不同压力下的/p 值。列表如下: p/kPa
n
A A
A
yB 表示气体;xB 表示液体
B y BVm ,B / y AVm,A
(ii)混合物摩尔质量
M mix y B M B m / n m B / n B
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7、在 、不做非体积功的条件下,系统焓的增加值 系统吸收的热量。
8、由标准状态下元素的
4、按标准摩尔生成焓与标准摩尔燃烧焓的定义,在C(石墨)、CO(g)和CO2(g)之间, 的标准摩尔生成焓正好等于 的标准摩尔燃烧焓。标准摩尔生成焓为零的是 ,因为它是 。标准摩尔燃烧焓为零的是 ,因为它是 。
3、下列各公式的适用条件分别为:U=f(T)和H=f(T)适用于 ;v=△U适用于 ;p=△H适用于 ; △U=?nCv,mdT适用于 ; T2T1
△H=?nCP,mdT适用于 ; T1T2
p=V+△ngRT适用于 ;PV=常数适用于 。
5、在节流膨胀过程中,系统的各状态函数中,只有 的值不改变。理想气体经节流膨胀后,它的 不改变,即它的节流膨胀系数μ= 。这是因为它的焓 。
6、化学反应热会随反应温度改变而改变的原因是 ;基尔霍夫公式可直接使用的条件是 。
应系统为 系统;若将系统与环境的分界面设在容器中液体的表面上,则反应系统为 系统。
2、所谓状态是指系统所有性质的 。而平衡态则是指系统的状态 的情况。系统处于平衡态的四个条件分别是系统内必须达到 平衡、 平衡、 平衡和 平衡。
