医疗器械产品技术要求模板
第一类医疗器械备案,血糖仪产品技术要求(模板)

第一类医疗器械备案,血糖仪产品技术要求(模板)第一类医疗器械备案,血糖仪产品技术要求(模板)1. 引言本文档旨在提供第一类医疗器械备案的模板,具体针对血糖仪产品的技术要求进行规定。
2. 产品描述2.1 产品名称:血糖仪2.2 产品功能:测量人体血糖水平2.3 产品规格:详细列出产品的尺寸、重量、外观等相关特征2.4 适用人群:明确产品适用的人群范围3. 技术要求3.1 测量准确性:要求血糖仪的测量结果具有高准确性,误差范围符合相关标准要求。
3.2 可靠性和稳定性:血糖仪应具备可靠、稳定的性能,能够在长期使用过程中保持一致的测量结果。
3.3 可操作性:血糖仪应易于操作,具备明确的测量步骤和清晰的用户界面。
3.4 电源要求:明确血糖仪所需的电源类型和电池寿命要求。
3.5 数据处理和存储:血糖仪应具备数据处理和存储功能,能够记录、保存和导出测量结果。
3.6 安全性和生物相容性:血糖仪的材料和设计应符合相关的安全性和生物相容性要求,确保对用户无害。
3.7 耐用性和清洁性:血糖仪应具备良好的耐用性,易于清洁和消毒,以确保产品的长期使用效果和卫生安全。
4. 相关认证和标准列出相关的认证和标准,如ISO 等。
5. 许可要求5.1 申请材料:明确申请第一类医疗器械备案所需的材料清单。
5.2 审核程序:解释备案的审核程序和时间线。
5.3 批件核发:描述获得备案批件后的相关步骤和要求。
6. 结论本文档提供了第一类医疗器械备案的血糖仪产品技术要求的模板,可作为制定具体备案要求的参考。
根据实际情况,可以相应调整和补充相关内容。
参考文献:[1] XXX标准[2] XXX认证要求。
医疗器械产品技术要求(精美模板)

标题:医疗器械产品技术要求(精美模板)一、概述随着科技的不断发展,医疗器械产品在医疗领域发挥着越来越重要的作用。
为了确保医疗器械产品的质量和安全性,我国制定了严格的产品技术要求。
本文将详细介绍医疗器械产品技术要求的相关内容,以供广大医疗器械研发和生产单位参考。
二、医疗器械产品技术要求的主要内容1. 产品性能要求医疗器械产品性能要求包括产品功能、性能指标、使用寿命等方面的内容。
产品功能要求是指产品应具备的基本功能,如诊断、治疗、监测等;性能指标要求是指产品在各种工况下的性能表现,如准确度、稳定性、灵敏度等;使用寿命要求是指产品在正常使用条件下的预期使用寿命。
2. 产品安全要求医疗器械产品安全要求包括电气安全、生物相容性、机械强度等方面的内容。
电气安全要求是指产品在正常使用和单一故障条件下的电气安全性能;生物相容性要求是指产品与人体组织接触时,不产生有害作用的性能;机械强度要求是指产品在运输、使用过程中,不发生损坏的性能。
3. 产品适用范围医疗器械产品适用范围是指产品可以安全、有效地使用的具体疾病、症状、人群等。
产品适用范围应明确、具体,避免产生歧义。
4. 产品使用方法医疗器械产品使用方法包括产品安装、操作、维护、清洗、消毒等方面的内容。
产品使用方法应详细、明确,确保医务人员和患者能够正确、安全地使用产品。
5. 产品标签和说明书医疗器械产品标签和说明书是产品的重要组成部分,应包括产品名称、型号、规格、生产日期、有效期、生产企业、产品性能、使用方法、注意事项等内容。
标签和说明书应采用清晰、易懂的语言,方便医务人员和患者正确理解和使用产品。
三、医疗器械产品技术要求的编制和审查1. 编制要求医疗器械产品技术要求编制应遵循以下原则:(1)科学性:技术要求应基于充分的科学依据,确保产品性能和安全;(2)合理性:技术要求应考虑实际使用需求,确保产品在实际应用中的有效性;(3)明确性:技术要求应明确、具体,避免产生歧义;(4)可操作性:技术要求应具有可操作性,方便研发和生产单位进行产品设计和生产;(5)可追溯性:技术要求应具有可追溯性,方便监管部门进行产品监管。
产品技术要求模板

产品技术要求模板医疗器械产品技术要求编号:产品名称(见本指导原则正文第错误!未找到引用源。
条第错误!未找到引用源。
款)1.产品型号/规格及其划分说明1.1.产品型号……1.2.产品规格按照随机文件和说明书,制造商应载明电源/电池规格。
按照随机文件和说明书,制造商应载明患者应用附件的示意图/彩色图片、结构、规格、原材料、灭菌信息等。
1.2.1.1.电源/电池规格交流电源的规格,例如,额定电压、额定电流、额定功率等。
内部电池的规格,例如,电池类型(镍氢电池、锂离子电池等),额定电流,最长供电时间等。
1.2.2.附件的规格1.2.2.1.附件的结构示意图/彩色图片……1.2.2.2.附件的原材料按照附件的结构示意图/彩色图片,制造商应载明各部分的原材料。
1.2.2.3.附件的规格附件的物理尺寸和面积、导线的规格等。
1.2.2.4.灭菌附件制造商应载明灭菌包装附件的灭菌方法和灭菌有效期。
1.3.产品型号的划分说明……1.4.产品分组/分类信息制造商应按照YY 0505-2012和GB 9706.8-2009载明产品分组/分类信息,为1组B类。
1.5.软件组件1.5.1.名称制造商应按照软件描述文档载明软件组件的名称。
1.5.2.发布版本制造商应按照软件描述文档载明软件组件的发布版本。
1.5.3.版本命名规则制造商应按照软件描述文档载明软件完整版本的全部字段及字段含义。
2.性能指标2.1.……2.1.1.…………2.2.安全和性能标准全面执行GB 9706.1-2007、GB 9706.8-2009、GB 9706.15-2008(如适用)、YY 0505-2012、YY 0709-2009(如适用)、YY/T 0196-2005标准(如适用),产品主要安全特征见附录A。
3.检验方法3.1.……3.1.1.…………3.2.安全和性能标准按照2.2项对应的方法,进行全面检验,应符合2.2的要求。
4.术语(如适用)4.1.……4.1.1.…………(分页)附录A产品主要安全特征1.按防电击类型分类:2.按防电击的程度分类:3.按对进液的防护程度分类:4.按在与空气混合的易燃麻醉气或与氧或氧化亚氮混合的易燃麻醉气情况下使用时的安全程度分类:5.按运行模式分类:6.设备的额定电压和频率:7.设备的输入功率:8.设备是否具有对除颤放电效应防护的应用部分:9.设备是否具有信号输出或输入部分:10.永久性安装设备或非永久性安装设备:11.电气绝缘图:制造商应在电气绝缘图中标明各绝缘路径。
医疗器械软独立软件注册产品技术要求模板

医疗器械产品技术要求医疗器械产品技术要求编号:产品名称1. 产品型号/规格及其划分说明1.1 软件型号规格1.2 软件发布版本1.3 版本命名规则明确软件完整版本的全部字段及字段含义2. 性能指标2.1 通用要求2.1.1 处理对象明确软件的处理对象类型,如图像(如、、、、等)、数据(如心电、血压、血氧、血糖等)2.1.2 最大并发数明确软件的最大并发用户数、患者数2.1.3 数据接口明确软件的通用数据接口(如、7)、产品接口(可联合使用的独立软件、医疗器械硬件)2.1.4 特定软硬件明确软件完成预期用途所必备的独立软件、医疗器械硬件2.1.5 临床功能依据说明书明确软件全部临床功能纲要(注明可选)2.1.6 使用限制依据说明书明确软件的使用限制2.1.7 用户访问控制明确软件的用户访问控制管理机制2.1.8 版权保护明确软件的版权保护技术2.1.9 用户界面明确软件的用户界面类型2.1.10 消息明确软件的消息类型2.1.11 可靠性明确软件出错后数据保存与恢复能力2.1.12 维护性明确软件向用户提供的维护信息类型2.1.13 效率明确软件在典型配置条件下完成典型临床功能所需的时间2.1.14 运行环境明确软件运行所需的硬件配置、软件环境和网络条件,包括服务器(如适用)和客户端的要求2.2 质量要求符合25000.51第5章要求2.3 专用要求(如适用)注:依据相应标准条款逐条描述2.3.1 0775(如适用)……2.4 安全要求(如适用)注:列明相应安全标准名称即可2.4.1 0709(如适用)2.4.2 0637(如适用)2.4.3 0721(如适用)……3. 检验方法3.1 通用要求符合性检验通过检查说明书、实际操作验证2.1的符合性。
3.2 质量要求符合性检验依据25000.51第7章方法验证2.2的符合性。
3.3 专用要求检验方法(如适用)3.3.1依据0775的方法进行检验(如适用)。
医疗器械产品技术要求格式简洁范本

医疗器械产品技术要求格式医疗器械产品技术要求格式1. 引言2. 范围3. 规范引用[标准名称1]:描述标准内容1[标准名称2]:描述标准内容24. 术语和定义术语1:定义1术语2:定义25. 产品设计要求本章节描述了医疗器械产品的设计要求。
5.1. 结构设计产品的结构设计应满足以下要求:要求1:描述要求1要求2:描述要求25.2. 外观设计产品的外观设计应满足以下要求:要求1:描述要求1要求2:描述要求26. 性能指标要求本章节描述了医疗器械产品的性能指标要求。
6.1. 精确度产品的精确度应满足以下要求:要求1:描述要求1要求2:描述要求26.2. 稳定性产品的稳定性应满足以下要求:要求1:描述要求1要求2:描述要求27. 使用方法本章节描述了医疗器械产品的使用方法。
7.1. 操作流程产品的操作流程应满足以下要求:1. 步骤1:描述步骤12. 步骤2:描述步骤27.2. 注意事项产品的使用时应注意以下事项:注意事项1:描述注意事项1注意事项2:描述注意事项28. 实施要求本章节描述了医疗器械产品的实施要求。
8.1. 质量控制产品的质量控制应满足以下要求:要求1:描述要求1要求2:描述要求28.2. 产品验证产品的验证应满足以下要求:要求1:描述要求1要求2:描述要求29. 维护和保养本章节描述了医疗器械产品的维护和保养要求。
9.1. 维护措施产品的维护措施应满足以下要求:要求1:描述要求1要求2:描述要求29.2. 保养周期产品的保养周期应满足以下要求:要求1:描述要求1要求2:描述要求210.。
医疗器械产品技术要求报告

3.6.6 紫外吸光度 在 250nm~320nm 波长范围内按 GB/T 14233.1-2008 中 5.7 的规定进行, 应 符合 2.6.5 的要求。 3.6.7 环氧乙烷残留量 按 GB/T 14233.1-2008 第九章的规定进行,应符合 2.6.6 要求。 3.7 密封性能 3.7.1 血室承受压力 将器件装满脱气蒸馏水,放置于 37℃±1℃,除与压力测试装置连接的接口 外,所有接口均应封闭。对产品施加 60kPa 的正压,并封闭测试装置。10min 后, 记录压力值并目视检查产品是否有泄露。 3.7.2 滤出腔室承受压力 将器件装满脱气蒸馏水,放置于 37℃±1℃,除与压力测试装置连接的接口 外,所有接口均应封闭。对产品施加正压 60kPa,负压低于大气压 60 kPa,并封 闭测试装置。10min 后,记录压力值并目视检查产品是否有泄露。 3.8 渗透性能 3.8.1 血浆滤过率 按附录 B 的方法进行,应符合 2.8.1 的规定。 3.8.2 总蛋白筛选系数 按附录 C 的方法进行,应符合 2.8.2 的规定。 3.9 耐温性能 将血浆分离器放入 0℃冰箱中 30min, 立即放入 50℃恒温箱 3h, 取出后恢复 至室温进行观察,并按 3.8 进行试验,应符合 2.9 的规定。
1
2. 性能指标 2.1 外观 血浆分离器的外壳应透明,表面光洁,液体通道内不得有肉眼可见的杂质。 2.2 尺寸 血浆分离器的有效膜面积应不低于公称面积的 90%。 2.3 血室容量 血浆分离器的血室容量应在制造商规定的范围内。 2.4 拉伸强度 血浆分离器空心纤维的拉伸强度应在制造商规定的范围 2.5 微粒脱落 血浆分离器内腔应洁净, 100mL 洗脱液中 15µm~25 µm 的微粒数不得超过 200 个,大于 25 µm 的微粒数不得超过 100 个。 2.6 化学性能 2.6.1 还原物质(易氧化物) 20mL 检验液与同批空白对照液消耗高锰酸钾[c(KMnO4)=0.002mol/L]的体积 之差应不超过 2.0mL。 2.6.2 金属离子 2.6.2.1 当用原子吸收分光光度计(AAS)或相当的方法进行测定时,检验液中 钡、铬、铜、铅、锡的总量应不超过 1µg/mL,镉的含量应不超过 0.1µg/mL 2.6.2.2 当用比色法测定时,检验液所呈现的颜色应不超过质量浓度ρ(Pb2+) 1µg/mL 的标准对照液。 2.6.3 酸碱度 检验液与同批空白对照液 pH 值之差应不超过 1.5。 2.6.4 蒸发残渣 50mL 检验液蒸发残渣的总量应不超过 2mg。 2.6.5 紫外吸光度 检验液的吸光度应不大于 0.1。 2.6.6 环氧乙烷残留量 血浆分离器如用环氧乙烷灭菌,环氧乙烷残留量应不大于 10 µg
有源治疗设备产品技术要求【范本模板】

医疗器械产品技术要求编号:X X X X X 治疗设备1. 产品型号/规格及其划分说明1。
1 产品型号:XXX1。
2 规格:a) 尺寸 15x20x25 cm b)重量:3kg1.1。
1产品型号划分说明:1.1.2 产品组成:产品主要由三部分组成,主机,连接光纤,XXX。
2. 性能指标2.1 主要性能指标2.1。
1 设备功率 a)输入电源 a。
c.220V、50Hz 50/60 Hzb) 功率 40VA±15%2。
1。
2 LEDXXa)功率:10W±15%b)波长范围 425nm-475nm (蓝光)2.1.3 XXXXa) XXX表面尺寸 130x200mmb)XXX有效表面 110x160mmc)连接光纤长度 1。
5m2.1.4 设备总辐照度1)正常模式:28 μ W/cm²/n m (±25%)~1400μW/cm²(±25%) (425—475 n m)2)强化模式:45μW/ cm²/n m (±25%)~2250μW/cm²(±25%) (425—475 n m)2.1.5 设备总辐照度的均匀性:设备总辐照度均匀性应不大于0。
02。
2.1。
6 设备噪声:应不超过60dB。
2。
1.7 设备与患者接触表面温度:设备运行时XXX表面温度应不超过43℃2.2辅助功能指标2.2。
1 工作指示灯功能a)绿色指示灯:当设备在正常运行时,指示灯应是绿色.b)红色指示灯: 当设备电量不足或运行故障时,指示灯颜色应是红色。
2。
2.2 警报提示功能:a)表明主电源电力不足,设备指示灯应是红色,同时蜂鸣器应发出声响。
b)在运行模式中,连接光疗毯失败,指示灯应是红色,同时蜂鸣器应发出声响. c)在设定的治疗时间结束时,设备蜂鸣器会发出声音信号。
2.3 安全性能指标2。
3。
1安全性能指标:应符合GB 9706.1—2007以及YY XXXX-2008的要求。
医疗器械产品技术要求
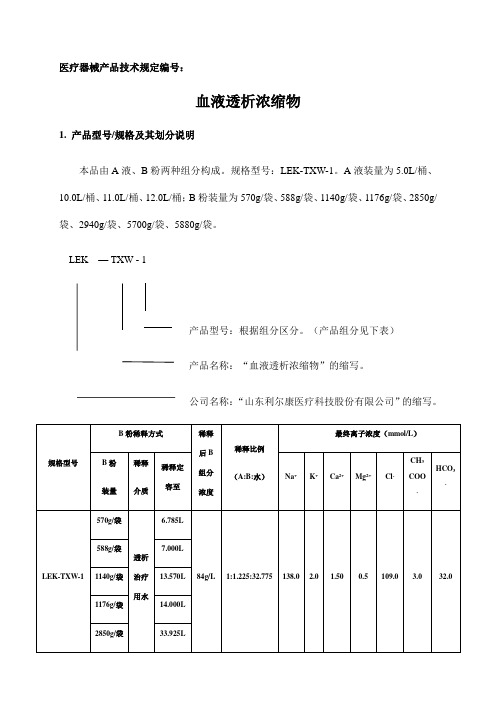
医疗器械产品技术规定编号:血液透析浓缩物1. 产品型号/规格及其划分说明本品由A液、B粉两种组分构成。
规格型号:LEK-TXW-1。
A液装量为5.0L/桶、10.0L/桶、11.0L/桶、12.0L/桶;B粉装量为570g/袋、588g/袋、1140g/袋、1176g/袋、2850g/袋、2940g/袋、5700g/袋、5880g/袋。
LEK — TXW - 1产品型号:根据组分区分。
(产品组分见下表)产品名称:“血液透析浓缩物”的缩写。
公司名称:“山东利尔康医疗科技股份有限公司”的缩写。
注:稀释用水为血液透析和相关治疗用水。
2. 结构组成本品A液由氯化钠、氯化钾、氯化镁、氯化钙、冰醋酸等原料组成;B粉由碳酸氢钠组成。
2.1 氯化钠别名:食盐化学式:NaCl 相对分子质量:58.44管制类型:不管制CAS号:7647-14-5 EINECS号:231-598-3本品为无色、透明的立方形结晶或白色结晶性粉末;无臭,味咸。
生产血液透析浓缩物所采购的医用级氯化钠的各项技术指标均符合《中华人民共和国药典》四部(2023年版)药用辅料氯化钠项下的各项技术指标规定。
2.2 氯化钾别名:- 化学式:KCl 相对分子质量:74.45管制类型:不管制CAS号:7447-40-7 EINECS号:231-211-8本品为无色长棱形、立方形结晶或白色结晶性粉末;无臭。
生产血液透析浓缩物所采购的医用级氯化钾的各项技术指标均符合《中华人民共和国药典》四部(2023年版)药用辅料氯化钾项下的各项技术指标规定。
2.3氯化钙别名:- 化学式:CaCl2·2H2O 相对分子质量:147.02管制类型:不管制CAS号:10043-52-4 EINECS号:233-140-8本品为白色、坚硬的碎块或颗粒;无臭;极易潮解。
生产血液透析浓缩物所采购的医用级氯化钙的各项技术指标均符合《中华人民共和国药典》四部(2023年版)药用辅料氯化钙项下的各项技术指标规定。
医疗器械产品技术要求模板范例

医疗器械产品技术要求编号:××××××电动手术台1.产品型号/规格及其划分说明1.1 型号xx-x-x设计序号产品分类x电动xx汉字拼音字头1.2 组成手术台由多节式台面(头板、背板、臀板、腿板) 、立柱、底座、液压传动系统、控制器和配套件组成。
配套件有搁臂板、肩托板、腿托架2.性能指标2.1 工作条件:a)环境温度 -20℃~+50℃;b)相对湿度 30%~80%;c)大气压力 700 hPa~1060hPa;d)电源电压 AC220V±22V;e)频率 50Hz±1Hz。
2.2 外观2.2.1 手术台的外观应平整光滑,表面不得有锋棱、毛刺、凹凸缺陷。
无露底、起泡、裂纹、流挂、脱落等现象。
2.2.2 手术台的电镀件表面应光滑,色泽应均匀,不允许擦伤、烧痕、针孔、毛刺和可见的裂纹;2.2.3 手动机构应灵活可靠。
手术台移动灵活,刹车制动可靠。
2.3 基本参数详见表1。
表1手术台面均载135Kg.,各功能动作应平稳。
2.5. 渗漏手术台液压系统应无渗漏现象。
手术台台面按照3.2规定方法检验,液压系统历时5h(气压系统历时1h),手术台下降距离不得大于8mm。
2.6 动作平稳性手术台各种动作变换应该平稳,不得产生抖动现象。
2.7 台面摆动量空载下,台面呈现最高位置时,应保持水平,取下头板、搁臂板和所有配套件后,应符合下列要求:纵向摆动量应不大于15mm;横向摆动量应不大于10mm;水平侧向摆动量应不大于18mm。
2.8 拆装头板、搁臂板,腿板和所有配套件装卸应方便、锁止应可靠。
2.9 材料台面和台垫应选用能透过X射线的材料制成,便于透视摄影。
2.10 噪声手术台在载有按全工作负荷时,其运动噪声在一米距离处,不得大于65dB(A)。
2.11 电磁兼容性应符合YY 0505—2012的要求和0570-2005中36.101的要求.2.12 电气安全要求手术台电气安全应符合GB9706.1-2007的要求,产品主要特征见附录A。
(完整版)医疗器械产品技术要求

一次性使用微量泵连接管技术要求医疗器械产品技术要求编号:一次性使用微量泵连接管1.0产品型号/规格及其划分说明:1.1产品型号:3*150cm1.2产品规格:管路公称内径为1.4mm,长度为1800mm。
1.3适用范围:适用于ICU、手术室需要使用麻醉药物进行手术的病人,本产品与多通道微量泵配合进行使用,用于多种药物近端混合给药,减少了药物混合时间,提高了麻醉功效,解决了临床上同时使用多根延长管凌乱、易打结等临床问题,便于医护人员进行操作,检查。
1.4 结构组成:一次性使用微量泵连接管(以下简称连接管)由管路、鲁尔接头、护帽、药液过滤器(可选配)、逆流阀(可选配)、止流夹(可选配)组成,产品典型结构示意图见图1。
1-管路 2-鲁尔接头 3-护帽 4-药液过滤器 5-逆流阀 6-止流夹图1 一次性使用微量泵连接管结构示意图。
1.5 材料:各零部件均为高分子材料。
2.0性能指标:2.1物理指标2.1.1外观:连接管表面应平整、洁净、无破损,无杂质。
2.1.2管路:由塑料制成的软管应柔软,透明,光洁,无杂质。
其透明度能看清气泡。
2.1.3护帽:连接管两端及鲁尔接头应有护帽,护帽应牢靠,但要易于拆除。
2.1.4药液过滤器:应有一药液过滤器,过滤器对乳胶粒子得滤除率应不小于80%。
2.1.5止流夹:在使用过程中不损伤延长管,在止流夹阻断状态下通入20kPa的液压15s 应无液体通过。
2.1.6接头:应符合GB/T 1962.2的要求。
2.1.7密封性:应无气体泄漏现象。
2.2化学指标2.2.1 金属离子含量:钡、铬、铜、铅、锡总含量不超过1μg/ml。
镉含量不超过0.1μg/ml。
2.2.2 酸碱度:一次性使用微量泵连接管浸提液的PH值与空白对照液之差不得超过1.0。
2.2.3 易氧化物:一次性使用微量泵连接管浸提液与等体积的空白对照液相比,0.002mol/L的高锰酸钾溶液消耗量之差应≤0.5mL。
2.2.4 环氧乙烷残留量:环氧乙烷灭菌,其残留量应不大于0.5mg。
医疗器械产品技术要求格式

医疗器械产品技术要求格式第一篇:医疗器械产品技术要求格式附件医疗器械产品技术要求格式医疗器械产品技术要求编号(宋体小四号,加粗):产品名称(宋体小二号,加粗)1.产品型号/规格及其划分说明(宋体小四号,加粗)(如适用)1.1 ……(宋体小四号)1.1.1 …………2.性能指标(宋体小四号,加粗)2.1 ……(宋体小四号)2.1.1 …………3.检验方法(宋体小四号,加粗)3.1 ……(宋体小四号)3.1.1 …………4.术语(宋体小四号,加粗)(如适用)4.1 ……(宋体小四号)4.2…………(分页)附录A……(宋体小四号,加粗)(如适用)1.……(宋体小四号)1.1 ……第二篇:医疗器械产品技术要求编写指导原则医疗器械产品技术要求编写指导原则根据《医疗器械监督管理条例》等相关规定,制定本指导原则。
一、基本要求(一)医疗器械产品技术要求的编制应符合国家相关法律法规。
(二)医疗器械产品技术要求中应采用规范、通用的术语。
如涉及特殊的术语,需提供明确定义,并写到“4.术语”部分。
(三)医疗器械产品技术要求中的检验方法各项内容的编号原则上应和性能指标各项内容的编号相对应。
(四)医疗器械产品技术要求中的文字、数字、公式、单位、符号、图表等应符合标准化要求。
(五)如医疗器械产品技术要求中的内容引用国家标准、行业标准或中国药典,应保证其有效性,并注明相应标准的编号和年号以及中国药典的版本号。
二、内容要求医疗器械产品技术要求的内容应符合以下要求:(一)产品名称。
产品技术要求中的产品名称应使用中文,并与申请注册(备案)的中文产品名称相一致。
(二)产品型号/规格及其划分说明。
产品技术要求中应明确产品型号和/或规格,以及其划分的说明。
对同一注册单元中存在多种型号和/或规格的产品,应明确各型号及各规格之间的所有区别(必要时可附相应图示进行说明)。
对于型号/规格的表述文本较大的可以附录形式提供。
(三)性能指标。
1.产品技术要求中的性能指标是指可进行客观判定的成品的功能性、安全性指标以及质量控制相关的其他指标。
医疗器械产品技术要求

医疗器械产品技术要求编号:XXXXXX1产品型号/规格及其划分说明1.1型号命名P 2 0 0设计序号产品代号1.2结构组成(不同型号如有结构组成的差异,应分型号列明)XXXXXX(以下简称XX)主要有X射线管组件(组合式)、限束器、操作台、影像处理系统、C形臂及可移动机架、医用X射线影像增强器组成。
1.3型号说明(如有多个型号此条适用,列表标明型号间差异)表1 型号说明1.4工作条件a)环境温度:10℃-40℃;b)相对湿度:30%-75%;c)大气压力:700 hPa-1060 hPa。
d)电源:AC 220V±22V;50Hz±1Hze)额定输入功率:xxVA。
2性能指标2.1外观2.2XXX……….2. X安全要求XXX安全要求应符合GB 9706.1-2007的要求,产品主要特征见附录C。
(9706.1适用设备)XXX安全要求应符合GB 4793.1-2007的要求,产品主要特征见附录C。
(4793.1适用设备)2. X电磁兼容(9706.1适用设备)电磁兼容应符合YY 0505-2012的要求。
2. X电磁兼容(4793.1适用设备)电磁兼容应符合GB/T 18268.1-2010的要求。
2. X电磁兼容(体外诊断类适用设备)电磁兼容应符合GB/T 18268.1-2010及GB/T 18268.26-2010的要求。
2. X环境实验按GB/T 14710-2009中规定的气候环境Ⅱ组、机械环境Ⅱ组的要求及表X进行实验,应符合要求。
表X 实验要求及检验工程3检验方法3.1外观用正常或矫正视力观察以及用手感检查,结果应符合2.1的要求。
……………….3.X 安全要求按GB 9706.1—2007中的规定进行。
(9706.1适用设备)按GB 4793.1-2007中的规定进行。
(4793.1适用设备)3.X电磁兼容(9706.1适用设备)电磁兼容实验按YY0505-2012的要求进行。
医疗器械产品技术要求格式

医疗器械产品技术要求格式1. 引言本文档旨在规定医疗器械产品的技术要求,以确保产品的质量和安全性。
本文档适用于所有医疗器械产品的研发、制造和销售过程。
2. 术语和定义在本文档中,以下术语和定义适用:医疗器械:指任何设备、仪器、器具、材料或其他物品,用于预防、诊断、治疗、缓解或监测疾病、损伤或生理过程的目的。
技术要求:指医疗器械产品在设计、制造和使用中需要满足的技术要求和规范。
3. 技术要求详细说明3.1 设计要求医疗器械产品的设计应符合相关的技术标准、法规和行业规范。
设计应考虑产品的功能、性能、安全性、可靠性和易用性。
设计应满足用户的需求和期望,并具有良好的人机工程学特性。
3.2 材料要求所使用的材料应符合相关的法规和标准,且具有足够的生物相容性。
材料的选择应考虑产品的用途、工作环境和预期使用寿命。
3.3 制造要求制造过程应符合相关的质量管理体系和标准。
制造工艺应能够确保产品的质量和一致性。
制造过程中的关键参数应进行监控和记录。
3.4 标识和包装要求医疗器械产品应在产品上标示清晰的标识、标志和警示语。
包装应符合相关的标准和法规,以确保产品在运输和存储过程中的安全性和完整性。
4. 验证和验证要求验证和验证应符合相关的方法和标准,以确保产品的性能和安全性满足要求。
验证和验证应包括材料测试、功能测试和耐久性测试等方面。
5. 审核和记录要求设计、制造和验证过程应进行审核和记录。
相关记录应保留并随时可查。
6. 产品维护和售后服务要求医疗器械产品的维护和售后服务应提供相关的技术支持和培训。
产品的维修和更换应符合相关的规范和流程。
7. 附录本文档的附录中包含了相关的参考资料和标准,供参考和使用。
以上是医疗器械产品技术要求的文档格式。
请根据实际情况和要求进行适当的修改和补充。
医疗器械产品技术要求模板

医疗器械产品技术要求模板为提高医疗器械技术审评的规范性和科学性,指导医疗器械注册人/备案人进行产品技术要求的编写,根据《医疗器械监督管理条例》《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》等规定,制定本指导原则。
一、适用范围本指导原则适用于申请注册或备案的医疗器械产品,包括体外诊断试剂产品。
本指导原则仅对医疗器械产品技术要求的格式和内容提出一般要求,不对具体产品的具体要求进行规定。
指导原则中给出的示例仅供参考,相关监管机构及注册人/备案人应根据具体情形进行细化。
二、基本要求(一)产品技术要求的编制应符合国家相关法律法规。
(二)产品技术要求应采用规范、通用的术语。
如涉及特殊的术语,需提供明确定义,并写入“4.术语”部分。
直接采用相关标准、指导原则中的术语或其他公认术语的,不需要在技术要求“4.术语”部分重复列明。
不应使用与上述术语名称相同但改变了原义的自定义术语。
(三)产品技术要求中检验方法各项内容的编号原则上应与性能指标各项内容的编号相对应。
(四)产品技术要求中的文字、数字、公式、单位、符号、图表等应符合相关标准化要求。
(五)如产品技术要求中的内容引用国家标准、行业标准的,应注明相应标准的编号和年代号。
三、主要内容产品技术要求的内容一般包括产品名称,型号、规格及其划分说明(必要时),性能指标,检验方法,术语(如适用)及附录(如适用)。
(一)产品名称产品技术要求中的产品名称应使用中文,并与申请注册或备案的产品名称相一致。
(二)型号、规格及其划分说明产品技术要求中应明确产品型号、规格。
对同一注册单元中存在多种型号、规格的产品,应明确不同型号、规格的划分说明(推荐采用图示和/或表格的方式),表述文本较多的内容可以在附录中列明。
对包含软件的产品,应明确软件发布版本和软件完整版本命名规则。
(三)性能指标1. 产品技术要求中的性能指标是指可进行客观判定的成品的功能性、安全性指标。
对产品安全有效性不产生实质性影响的项目可不在技术要求性能指标处列明。
医疗器械产品技术要求模板范例

医疗器械产品技术要求编号:××××××电动手术台1.产品型号/规格及其划分说明1.1 型号xx-x-x设计序号产品分类x电动xx汉字拼音字头1.2 组成手术台由多节式台面(头板、背板、臀板、腿板) 、立柱、底座、液压传动系统、控制器和配套件组成。
配套件有搁臂板、肩托板、腿托架2.性能指标2.1 工作条件:a)环境温度 -20℃~+50℃;b)相对湿度 30%~80%;c)大气压力 700 hPa~1060hPa;d)电源电压 AC220V±22V;e)频率 50Hz±1Hz。
2.2 外观2.2.1 手术台的外观应平整光滑,表面不得有锋棱、毛刺、凹凸缺陷。
无露底、起泡、裂纹、流挂、脱落等现象。
2.2.2 手术台的电镀件表面应光滑,色泽应均匀,不允许擦伤、烧痕、针孔、毛刺和可见的裂纹;2.2.3 手动机构应灵活可靠。
手术台移动灵活,刹车制动可靠。
2.3 基本参数详见表1。
表1手术台面均载135Kg.,各功能动作应平稳。
2.5. 渗漏手术台液压系统应无渗漏现象。
手术台台面按照3.2规定方法检验,液压系统历时5h(气压系统历时1h),手术台下降距离不得大于8mm。
2.6 动作平稳性手术台各种动作变换应该平稳,不得产生抖动现象。
2.7 台面摆动量空载下,台面呈现最高位置时,应保持水平,取下头板、搁臂板和所有配套件后,应符合下列要求:纵向摆动量应不大于15mm;横向摆动量应不大于10mm;水平侧向摆动量应不大于18mm。
2.8 拆装头板、搁臂板,腿板和所有配套件装卸应方便、锁止应可靠。
2.9 材料台面和台垫应选用能透过X射线的材料制成,便于透视摄影。
2.10 噪声手术台在载有按全工作负荷时,其运动噪声在一米距离处,不得大于65dB(A)。
2.11 电磁兼容性应符合YY 0505—2012的要求和0570-2005中36.101的要求.2.12 电气安全要求手术台电气安全应符合GB9706.1-2007的要求,产品主要特征见附录A。
(精品文档推荐)医疗器械产品技术要求模板

医疗器械产品技术要求医学影像处理软件20X X-X X-X X发布20X X-X X-X X实施XXXX信息科技有限公司医疗器械产品技术要求编号:医学影像通讯与存储系统1 产品型号规格及其划分说明1.1 软件型号规格XX1.2 发布版本产品发布版本:V1.0产品完整版本:V1.0.01.3 版本命名规则本公司软件产品命名规则为V X.Y.Z•X:为发行版本,表示重大增强类软件更新,初始值为1,当软件进行了重大增强类软件更新,该号码加1,Y和Z归0。
•Y:为子版本号,表示轻微增强类软件更新,初始值为0,当软件进行了轻微增强类软件更新,该号码加1,Z归0。
•Z:为修正版本号,表示纠正类软件更新,初始值为0,当软件进行了纠正类软件更新,该号码加1。
1.4 产品适用范围产品用于人体诊查图像、数据的管理、查看、传输和贮存,不包括自动诊断部分。
2 性能指标2.1 通用要求2.1.1 处理对象针对医学影像(包括核磁、CT、超声、X光机、胃肠机、CR、DR、乳腺机、PET、DSA、牙片机、彩色多普勒超声、内窥镜、阴道镜、耳鼻喉镜、胃镜、肠镜等设备产生的图像)进行处理。
2.1.2 最大并发数系统运行的网络环境在100M/1000M局域网情况下,支持并发读取影像数据的最大用户数为50。
2.1.3 数据接口产品通过DICOM标准接口与医疗设备进行影像传输,支持通过标准HL7或数据库接口与第三方系统交互,支持模拟视频信号接口。
2.1.4 特定软硬件2.1.5 临床功能2.1.5.1 结构组成产品主要由光盘和软件组件组成,其中软件组件版本号为V5.0,主要包括:放射影像模块、超声影像模块、内镜影像中心模块、病理影像中心模块、DICOM 模块、DICOM WorkList服务程序模块、DICOM服务程序模块。
2.1.5.2 放射影像模块主要用于传送病人图像信息,主要组成:①普通设置,设置实体名称,设置端口号;②高级设置,需要用户密码登陆。
