南京工业大学无机与分析化学试卷下A
无机分析化学期末试卷(A)(1)

⽆机分析化学期末试卷(A)(1)⼀、选择题1.AgCl、AgBr、AgI的颜⾊依次加深,能解释这⼀现象的是( )。
(A) 晶格能(B) 杂化轨道理论(C) 离⼦极化(C) 分⼦轨道理论2.下列物质不是离⼦型化合物的是( )。
(A) BeCl2;(B) RbCl;(C) CsBr;(D) SrO。
3.下列性质哪⼀个不是过渡元素的通性( )。
(A) (n-1)d电⼦参加成键( B) 元素具有多种氧化态(C) 良好的配合物形成体(D) 单质熔点很低4.[Co(en)2(NH3)2]3+ 中⼼离⼦的配位数是( )。
(A) 3 (B) 4 (C) 5 (D) 65.采⽤EDTA滴定溶液中的Ca2+,Mg2+的⼲扰是⽤下列哪个⽅法去除( )。
(A) 掩蔽剂(B) 预先分离(C) 调整溶液pH (D) ⽆法去除6.BaCrO4溶于浓HCl后溶液的颜⾊及Cr的存在形式最合理是哪⼀种:( )。
(A) 绿⾊,CrO2-(B)黄⾊,CrO42-(C) 绿⾊,Cr3+ (D) 橙⾊,Cr2O72-7.在使⽤⾦属指⽰剂时,若MIn⾮常稳定,使得溶液颜⾊难以发⽣变化,这种现象称为( )。
(A) 指⽰剂的封闭现象(B) 指⽰剂的僵化现象(C) 指⽰剂的酸效应(D) 指⽰剂的副反应8.已知lgK BiY-=27.94,lgK FeY-=25.90,lgK FeY2-=14.33;⽤EDTA滴定Bi3+时,要消除Fe3+的⼲扰,最合适的掩蔽⽅法是( )。
(A) 沉淀掩蔽法;(B) 氧化还原掩蔽法;(C) 配位掩蔽法;(D) 没有合适的掩蔽法。
9.某元素的原⼦最外层只有两个l = 0的电⼦,该元素在周期表中必不属于()。
(A) s区元素(B) ds区元素(C) d区元素(D) p区元素10.在分⼦晶体中,分⼦内原⼦之间的结合⼒是()。
(A) 共价键(B) 离⼦键(C) ⾦属键(D) 范德华⼒11.[NiCl4]-的磁矩为2.828 (BM),该配离⼦的杂化类型和空间构型为()。
无机及分析化学A考试题答案

无机及分析化学A考试题答案一、选择题(每题2分,共20分)1. 下列哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 钾答案:C2. 哪种化合物的化学式为H2O?A. 氢气B. 氧气C. 水D. 过氧化氢答案:C3. 以下哪个是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠答案:C4. 哪种元素属于碱土金属?A. 锂B. 钠C. 钙D. 钡答案:C5. 哪种化合物是共价化合物?A. NaClB. MgOC. HClD. Fe2O3答案:C6. 哪种元素的电子排布为1s2 2s2 2p6 3s2 3p6 4s2?A. 碳B. 氧C. 镁D. 钙答案:D7. 哪种元素的原子序数为30?A. 锌C. 砷D. 硒答案:B8. 哪种化合物的化学式为CO2?A. 一氧化碳B. 二氧化碳C. 一氧化氮D. 二氧化氮答案:B9. 哪种元素属于过渡金属?A. 铁B. 铜C. 氦答案:A10. 哪种化合物是离子化合物?A. H2OB. NH3C. NaClD. CH4答案:C二、填空题(每题2分,共20分)11. 元素周期表中,第IA族元素的名称是______。
答案:碱金属12. 元素周期表中,第VIIA族元素的名称是______。
答案:卤素13. 摩尔质量的单位是______。
答案:g/mol14. 化学方程式2H2 + O2 → 2H2O中,水的摩尔比是______。
答案:215. 元素周期表中,第IIIB族元素的名称是______。
答案:镧系元素16. 元素周期表中,第VIII族元素的名称是______。
答案:铂族元素17. 原子中,质子数等于______。
答案:原子序数18. 元素周期表中,第VA族元素的名称是______。
答案:氮族元素19. 摩尔浓度的单位是______。
答案:mol/L20. 元素周期表中,第VIB族元素的名称是______。
答案:氧族元素三、简答题(每题10分,共30分)21. 简述什么是化学计量学。
无机及分析化学期末考试卷A及答案
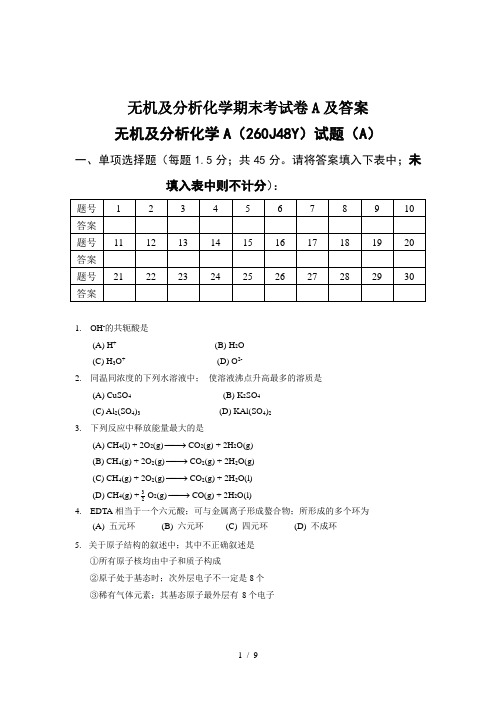
无机及分析化学期末考试卷A 及答案 无机及分析化学A (260J48Y )试题(A )一、单项选择题(每题1.5分;共45分。
请将答案填入下表中;未填入表中则不计分):1. OH -的共轭酸是(A) H + (B) H 2O(C) H 3O + (D) O 2-2. 同温同浓度的下列水溶液中; 使溶液沸点升高最多的溶质是(A) CuSO 4 (B) K 2SO 4 (C) Al 2(SO 4)3 (D) KAl(SO 4)2 3. 下列反应中释放能量最大的是(A) CH 4(l) + 2O 2(g)−→−CO 2(g) + 2H 2O(g) (B) CH 4(g) + 2O 2(g)−→−CO 2(g) + 2H 2O(g) (C) CH 4(g) + 2O 2(g)−→−CO 2(g) + 2H 2O(l) (D) CH 4(g) +23O 2(g)−→−CO(g) + 2H 2O(l) 4. EDTA 相当于一个六元酸;可与金属离子形成螯合物;所形成的多个环为(A) 五元环 (B) 六元环 (C) 四元环 (D) 不成环 5. 关于原子结构的叙述中;其中不正确叙述是①所有原子核均由中子和质子构成②原子处于基态时;次外层电子不一定是8个 ③稀有气体元素;其基态原子最外层有 8个电子④最外层电子数为2的原子一定是金属原子(A) ①②④ (B) ①②③ (C) ②③ (D) ①③④6. 0.100 mol·kg -1 KCl 溶液在稍高于 -0.372℃时结冰; 对这个现象的解释是(水的K f = 1.86K·kg·mol -1)(A) KCl 未完全缔合 (B) 离子互吸 (C) 离子互斥 (D) 溶液蒸气压下降 7. 已知 Zn(s) +21O 2(g) = ZnO(s)m r H ∆ 1 = -351.5 kJ·mol -1 Hg(l) +21O 2(g) = HgO(s ;红)m r H ∆ 2 = -90.8 kJ·mol -1 则 Zn(s) + HgO(s ;红) = ZnO(s) + Hg(l) 的m r H ∆为(kJ·mol -1) (A) 442.3 (B) 260.7 (C) -260.7 (D) -442.38. 有一原电池:Pt│Fe 3+(1 mol·dm -3);Fe 2+(1 mol·dm -3)‖C e 4+(1 mol·dm -3);Ce 3+(1 mol·dm -3)│Pt 则该电池的电池反应是 (A) Ce 3+ + Fe 3+ = Ce 4+ + Fe 2+ (B) Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+ (C) Ce 3+ + Fe 2+ = Ce 4+ + Fe (D) Ce 4+ + Fe 3+ = Ce 3+ + Fe 2+9. 电池反应:H 2(g ;100kPa) + 2AgCl(s)−→−2HCl(aq) + 2Ag(s) E = 0.220 V ;当电池的电动势为0.358 V 时;电池溶液的pH 为 (A) 2H p E E -(B)059.0220.0358.0-(C)059.02220.0358.0⨯-(D) 010. 体系对环境作 20 kJ 的功;并失去 10kJ 的热给环境;则体系内能的变化是(A) +30 kJ (B) +10 kJ (C) −10 kJ (D) −30kJ 11. 由下列反应设计的电池不需要惰性电极的是 (A) H 2(g) + Cl 2(g) = 2HCl(aq) (B) Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+ (C) Zn + Ni 2+ = Zn 2+ + Ni (D) Cu + Br 2 = Cu 2+ + 2Br -12. pH = 9.0的含有5.0 ⨯ 10-2 mol / L NaCN和1.0 ⨯ 10-2 mol / L Hg(NO3)2的溶液中;叙述CN-的物料平衡方程式正确的是[ HCN 的p K a = 9.21 ;生成Hg(CN)42-络合物]( A ) [ CN- ] + 4[ Hg(CN)42- ] = 5.0 ⨯10-2( B ) [ CN- ] + [ Hg(CN)42- ] = 5.0 ⨯10-2( C ) [ CN- ] + [ HCN ] + 4[ Hg(CN)42- ] = 5.0 ⨯10-2( D ) [ CN- ] + [ HCN ] + [ Hg(CN)42- ] = 5.0 ⨯10-213. 今有1L含0.1mol H3PO4和0.3mol Na2HPO4的溶液;其pH应当是(H3PO4的p K a1~p K a3分别为2.12、7.20、12.36)(A) 2.12 (B) (2.12+7.20)/2 (C) 7.20 (D) (7.20+12.36)/214. 某铁矿试样含铁约50%左右;现以0.01667mol/L K2Cr2O7溶液滴定;欲使滴定时;标准溶液消耗的体积在20 mL至30 mL;应称取试样的质量范围是[A r(Fe)=55.847](A) 0.22至0.34g (B) 0.037至0.055g(C) 0.074至0.11g (D) 0.66至0.99g15. 以下产生误差的四种表述中;属于随机误差的是(1)指示剂变色点与化学计量点不一致(2)滴定管读数最后一位估计不准(3)称量过程中天平零点稍有变动(4)天平的砝码未经校准(A)1;2 (B)3;4 (C)2;3 (D)1;416. 为标定Na2S2O3溶液的浓度宜选择的基准物是(A) 分析纯的H2O2(B) 分析纯的KMnO4(C) 化学纯的K2Cr2O7(D) 分析纯的K2Cr2O717. 某反应在标准态和等温等压条件下;在任何温度都能自发进行的条件是(A) Δ r H m>0 Δ r S m>0 (B) Δ r H m<0 Δ r S m<0(C) Δ r H m>0 Δ r S m<0 (D) Δ r H m<0 Δ r S m>018. 某1L含0.2mol Na3PO4和0.3mol HCl的溶液;其pH应当是(H3PO4的p K a1~p K a3分别为2.12、7.20、12.36)(A) 2.12 (B) (2.12+7.20)/2 (C) 7.20 (D) (7.20+12.36)/219. 0.05 mol/L SnCl2溶液10 mL 与0.10 mol/L FeCl3溶液20 mL 相混合;平衡时体系的电位是[已知此条件时 ϕ' (Fe 3+/Fe 2+)= 0.68 V ; ϕ' (Sn 4+/Sn 2+)= 0.14 V] (A) 0.14 V (B) 0.32 V (C) 0.50 V (D) 0.68 V 20. 下列表述中;最能说明系统误差小的是 (A) 高精密度(B) 与已知的质量分数的试样多次分析结果的平均值一致 (C) 标准差大(D) 仔细校正所用砝码和容量仪器等 21. 以下物质必须采用间接法配制标准溶液的是(A) K 2Cr 2O 7 (B) Na 2S 2O 3 (C) Zn (D) H 2C 2O 4·2H 2O 22. 下列溶液中不能组成缓冲溶液的是(A) NH 3 和 NH 4Cl (B) H 2PO 4-和 HPO 42-(C) HCl 和过量的氨水 (D) 氨水和过量的 HCl23. 今有(a)NaH 2PO 4;(b)KH 2PO 4和(c)NH 4H 2PO 4三种溶液;其浓度c (NaH 2PO 4) = c (KH 2PO 4)= c (NH 4H 2PO 4) = 0.10mol/L ; 则三种溶液的pH 的关系是[已知 H 3PO 4的p K a1~p K a3分别是2.12、7.20、12.36; p K a (NH 4+) = 9.26] (A) a = b = c (B) a <b <c (C) a = b >c (D) a = b <c 24. 用铈量法测定铁时; 滴定至 50% 时的电位是[已知 ϕ' (Ce 4+/Ce 3+)= 1.44 V ; ϕ' (Fe 3+/Fe 2+)= 0.68 V] (A) 0.68 V (B) 1.44 V (C) 1.06 V (D) 0.86 V25. 用Ce 4+滴定Fe 2+;当体系电位为0.68V 时;滴定分数为 [ ϕ' (Ce 4+/Ce 3+)=1.44V ; ϕ' (Fe 3+/Fe 2+)=0.68V] (A) 0 (B) 50% (C) 100% (D) 200%26. 当两电对的电子转移数均为2时;为使反应完全度达到99.9%;两电对的条件电位至少大于(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V 27. 摩尔吸光系数(ε)的单位为(A) mol/(L·cm) (B) L/(mol·cm) (C) mol/(g·cm) (D) g/(mol·cm)28. 用EDTA 滴定Mg 2+;采用铬黑T 为指示剂;少量Fe 3+的存在将导致 (A) 终点颜色变化不明显以致无法确定终点(B) 在化学计量点前指示剂即开始游离出来;使终点提前 (C) 使EDTA 与指示剂作用缓慢;终点延长 (D) 与指示剂形成沉淀;使其失去作用 29. 对条件电位无影响的因素是:(A) 副反应 (B) 温度 (C) 滴定过程 (D) 离子活度系数 30. 下列哪个因素不影响氧化还原速度:(A) 反应物浓度 (B) 溶液温度 (C) 催化剂 (D) 指示剂的敏感性二、填空题(每空1.5分;共30分):1. 符号“5p ”表示电子的主量子数n 等于_______ ;角量子数l 等于______ ;该电子亚层最多可以有____种空间取向;该电子亚层最多可容纳____个电子。
无机及分析化学期末考试卷A及答案

无机及分析化学期末考试卷A 及答案无机及分析化学A (260J48Y )试题(A )一、单项选择题(每题1.5分,共45分。
请将答案填入下表中,未填入表中则不计分):1. OH -的共轭酸是(A) H + (B) H 2O(C) H 3O + (D) O 2-2. 同温同浓度的下列水溶液中, 使溶液沸点升高最多的溶质是(A) CuSO 4 (B) K 2SO 4 (C) Al 2(SO 4)3 (D) KAl(SO 4)2 3. 下列反应中释放能量最大的是(A) CH 4(l) + 2O 2(g)−→−CO 2(g) + 2H 2O(g) (B) CH 4(g) + 2O 2(g)−→−CO 2(g) + 2H 2O(g) (C) CH 4(g) + 2O 2(g)−→−CO 2(g) + 2H 2O(l) (D) CH 4(g) +23O 2(g)−→−CO(g) + 2H 2O(l) 4. EDTA 相当于一个六元酸,可与金属离子形成螯合物,所形成的多个环为(A) 五元环 (B) 六元环 (C) 四元环 (D) 不成环 5. 关于原子结构的叙述中,其中不正确叙述是①所有原子核均由中子和质子构成②原子处于基态时,次外层电子不一定是8个 ③稀有气体元素,其基态原子最外层有 8个电子④最外层电子数为2的原子一定是金属原子(A) ①②④ (B) ①②③ (C) ②③ (D) ①③④6. 0.100 mol·kg -1 KCl 溶液在稍高于 -0.372℃时结冰, 对这个现象的解释是(水的K f = 1.86K·kg·mol -1)(A) KCl 未完全缔合 (B) 离子互吸 (C) 离子互斥 (D) 溶液蒸气压下降 7. 已知 Zn(s) +21O 2(g) = ZnO(s)m r H ∆ 1 = -351.5 kJ·mol -1 Hg(l) +21O 2(g) = HgO(s,红)m r H ∆ 2 = -90.8 kJ·mol -1 则 Zn(s) + HgO(s,红) = ZnO(s) + Hg(l) 的m r H ∆为(kJ·mol -1) (A) 442.3 (B) 260.7 (C) -260.7 (D) -442.38. 有一原电池:Pt│Fe 3+(1 mol·dm -3),Fe 2+(1 mol·dm -3)‖C e 4+(1 mol·dm -3),Ce 3+(1 mol·dm -3)│Pt 则该电池的电池反应是 (A) Ce 3+ + Fe 3+ = Ce 4+ + Fe 2+ (B) Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+ (C) Ce 3+ + Fe 2+ = Ce 4+ + Fe (D) Ce 4+ + Fe 3+ = Ce 3+ + Fe 2+9. 电池反应:H 2(g,100kPa) + 2AgCl(s)−→−2HCl(aq) + 2Ag(s) E = 0.220 V,当电池的电动势为0.358 V 时,电池溶液的pH 为 (A) 2H p E E -(B)059.0220.0358.0-(C)059.02220.0358.0⨯-(D) 010. 体系对环境作 20 kJ 的功,并失去 10kJ 的热给环境,则体系内能的变化是(A) +30 kJ (B) +10 kJ (C) −10 kJ (D) −30kJ 11. 由下列反应设计的电池不需要惰性电极的是 (A) H 2(g) + Cl 2(g) = 2HCl(aq) (B) Ce 4+ + Fe 2+ = Ce 3+ + Fe 3+ (C) Zn + Ni 2+ = Zn 2+ + Ni (D) Cu + Br 2 = Cu 2+ + 2Br -12. pH = 9.0的含有5.0 ⨯ 10-2 mol / L NaCN和1.0 ⨯ 10-2 mol / L Hg(NO3)2的溶液中,叙述CN-的物料平衡方程式正确的是[ HCN 的p K a = 9.21 , 生成Hg(CN)42-络合物]( A ) [ CN- ] + 4[ Hg(CN)42- ] = 5.0 ⨯10-2( B ) [ CN- ] + [ Hg(CN)42- ] = 5.0 ⨯10-2( C ) [ CN- ] + [ HCN ] + 4[ Hg(CN)42- ] = 5.0 ⨯10-2( D ) [ CN- ] + [ HCN ] + [ Hg(CN)42- ] = 5.0 ⨯10-213. 今有1L含0.1mol H3PO4和0.3mol Na2HPO4的溶液,其pH应当是(H3PO4的p K a1~p K a3分别为2.12、7.20、12.36)(A) 2.12 (B) (2.12+7.20)/2 (C) 7.20 (D) (7.20+12.36)/214. 某铁矿试样含铁约50%左右,现以0.01667mol/L K2Cr2O7溶液滴定,欲使滴定时,标准溶液消耗的体积在20 mL至30 mL,应称取试样的质量范围是[A r(Fe)=55.847](A) 0.22至0.34g (B) 0.037至0.055g(C) 0.074至0.11g (D) 0.66至0.99g15. 以下产生误差的四种表述中,属于随机误差的是(1)指示剂变色点与化学计量点不一致(2)滴定管读数最后一位估计不准(3)称量过程中天平零点稍有变动(4)天平的砝码未经校准(A)1,2 (B)3,4 (C)2,3 (D)1,416. 为标定Na2S2O3溶液的浓度宜选择的基准物是(A) 分析纯的H2O2(B) 分析纯的KMnO4(C) 化学纯的K2Cr2O7(D) 分析纯的K2Cr2O717. 某反应在标准态和等温等压条件下,在任何温度都能自发进行的条件是(A) Δ r H m>0 Δ r S m>0 (B) Δ r H m<0 Δ r S m<0(C) Δ r H m>0 Δ r S m<0 (D) Δ r H m<0 Δ r S m>018. 某1L含0.2mol Na3PO4和0.3mol HCl的溶液,其pH应当是(H3PO4的p K a1~p K a3分别为2.12、7.20、12.36)(A) 2.12 (B) (2.12+7.20)/2 (C) 7.20 (D) (7.20+12.36)/219. 0.05 mol/L SnCl2溶液10 mL 与0.10 mol/L FeCl3溶液20 mL 相混合, 平衡时体系的电位是[已知此条件时 ϕ' (Fe 3+/Fe 2+)= 0.68 V , ϕ' (Sn 4+/Sn 2+)= 0.14 V] (A) 0.14 V (B) 0.32 V (C) 0.50 V (D) 0.68 V 20. 下列表述中,最能说明系统误差小的是 (A) 高精密度(B) 与已知的质量分数的试样多次分析结果的平均值一致 (C) 标准差大(D) 仔细校正所用砝码和容量仪器等 21. 以下物质必须采用间接法配制标准溶液的是(A) K 2Cr 2O 7 (B) Na 2S 2O 3 (C) Zn (D) H 2C 2O 4·2H 2O 22. 下列溶液中不能组成缓冲溶液的是(A) NH 3 和 NH 4Cl (B) H 2PO 4-和 HPO 42-(C) HCl 和过量的氨水 (D) 氨水和过量的 HCl23. 今有(a)NaH 2PO 4,(b)KH 2PO 4和(c)NH 4H 2PO 4三种溶液,其浓度c (NaH 2PO 4) = c (KH 2PO 4) =c (NH 4H 2PO 4) = 0.10mol/L, 则三种溶液的pH 的关系是[已知 H 3PO 4的p K a1~p K a3分别是2.12、7.20、12.36; p K a (NH 4+) = 9.26] (A) a = b = c (B) a <b <c (C) a = b >c (D) a = b <c 24. 用铈量法测定铁时, 滴定至 50% 时的电位是[已知 ϕ' (Ce 4+/Ce 3+)= 1.44 V , ϕ' (Fe 3+/Fe 2+)= 0.68 V] (A) 0.68 V (B) 1.44 V (C) 1.06 V (D) 0.86 V25. 用Ce 4+滴定Fe 2+,当体系电位为0.68V 时,滴定分数为 [ ϕ' (Ce 4+/Ce 3+)=1.44V , ϕ' (Fe 3+/Fe 2+)=0.68V] (A) 0 (B) 50% (C) 100% (D) 200%26. 当两电对的电子转移数均为2时,为使反应完全度达到99.9%,两电对的条件电位至少大于(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V 27. 摩尔吸光系数(ε)的单位为(A) mol/(L·cm) (B) L/(mol·cm) (C) mol/(g·cm) (D) g/(mol·cm)28. 用EDTA 滴定Mg 2+,采用铬黑T 为指示剂,少量Fe 3+的存在将导致 (A) 终点颜色变化不明显以致无法确定终点(B) 在化学计量点前指示剂即开始游离出来,使终点提前 (C) 使EDTA 与指示剂作用缓慢,终点延长 (D) 与指示剂形成沉淀,使其失去作用 29. 对条件电位无影响的因素是:(A) 副反应 (B) 温度 (C) 滴定过程 (D) 离子活度系数 30. 下列哪个因素不影响氧化还原速度:(A) 反应物浓度 (B) 溶液温度 (C) 催化剂 (D) 指示剂的敏感性二、填空题(每空1.5分,共30分):1. 符号“5p ”表示电子的主量子数n 等于_______ ,角量子数l 等于______ ,该电子亚层最多可以有____种空间取向,该电子亚层最多可容纳____个电子。
南京工业大学无机分析化学题库试题9

南京工业大学无机分析化学题库试题9一、选择题1. 在[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数为(A) 3 (B) 4(C) 5 (D) 62. [Cu(NH3)4]2+为内轨型配合物、平面四方形构型,其磁矩为:(A) 5.75?SUB>B (B) 3.87?SUB>B (C) 1.73?SUB>B (D) 0?SUB>B\3. Fe2+有6个3d电子,配合物[Fe(CN)6]4-,△o= 395kJ?mol-1;Ep=213kJ?mol-1。
则晶体场稳定化能CFSE等于(kJ?mol-1):(A) -522 (B) -470.4 (C) -948 (D) -3094. 取同浓度的Cu2+-EDTA配合物溶液两份,分别用A:pH=10的NaOH溶液和B:pH=10的氨缓冲溶液。
条件稳定常数分别记作K'CuY,A和K'CuY,B,正确的是:(A) K'CuY,A = K'CuY,B (B) K'CuY,A > K'CuY,B (C) K'CuY,A < K'CuY,B (D) 无法确定5. 在pH = 10.00的溶液中,用EDTA滴定Ca2+和Mg2+混合液,测定的是:(A) Ca2++Mg2+的量(B) Ca2+-Mg2+的量(C) Mg2+的量(D) Ca2+的量6. 三溴苯酚C6H2(OH)Br3中C的氧化数是:(A) +1/3 (B) -1/3(C) +2/3 (D) -2/37. 被KMnO4污染的滴定管应用哪种溶液洗涤?(A) 重铬酸洗液(B) Na2CO3 (C) 洗衣粉(D) H2C2O48. 为了提高φCu2+/Cu+,可采用下列哪项措施?(A) 加HCl (B) 加NH3水(C) 加H2SO4(D) 以上三项均不可以9. 电极电位对判断氧化还原反应的性质很有用,但它不能判断(A) 氧化还原的次序(B) 氧化还原反应速率(C) 氧化还原反应方向(D) 氧化还原能力大小10. 在[H+] =1.00 mo l?L-1溶液中,已知φo MnO4 -/ Mn 2+ = 1.45V,φoFe3+/Fe2+= 0.68V,以MnO4-滴定Fe2+,其化学计量点的电位为:(A) 0.77V (B) 1.06V (C) 1.32V (D) 1.45V 11. 可以用作标定KMnO4标准溶液的基准物质是:(A) CaCO3 (B) K2S2O8 (C) SnCl2 (D) Na2C2O412. 用KMnO4溶液滴定H2O2时,发现有沉淀生成,原因是:(A) pH太大,生成MnO2沉淀(B) 溶液酸度太大,形成HMnO4沉淀(C) H2O2生成了沉淀物(D) pH太大,生成Mn(OH)2沉淀13. 下列说法正确的是:(A) 聚集速度越大越易形成晶体沉淀(B) 过饱和度越大,定向速度越大(C) 聚集速度越小越易形成晶体沉淀(D) 过饱和度越小,定向速度越大14. 25℃时,KspΘ(Ag2SO4) = 1.2×10-5,KspΘ(AgCl) = 1.8×10-10,KspΘ(BaSO4)=1.1×10-10,将等体积、浓度分别为0.0010 mol?L-1的Ag2SO4与2.0×10-6 mol?L-1的BaCl2溶液混合,将会有:(A) Ag2SO4沉淀生成(B) 只生成AgCl沉淀(C) 只生成BaSO4沉淀(D) 同时生成BaSO4和AgCl沉淀15. 进行重量法分析,下列说法正确的是:(A) 称量形式和沉淀形式应一致(B) 对溶度性大的沉淀可用大量水洗涤(C) 对非晶型沉淀可用冷水洗涤(D) 对非晶型沉淀可用热溶液洗涤16. pH=3.5时用莫尔法测定Cl-含量,则测定结果(A) 偏高(B) 偏低(C) 无影响(D) 不确定17. 下列物质不能氧化浓盐酸得到氯气的是:A) Ni(OH)3 (B) Fe(OH)3(C) Co(OH)3 (D) MnO218. 碱性BaCl2溶液与K2Cr2O7溶液混合生成的沉淀是:(A) 黄色BaCrO4 (B) 橙色BaCrO4(C) 黄色BaCr2O7 (D) 橙色BaCr2O719. 已知Ca(OH)2的KspΘ=5.5×10-8,则其饱和溶液的pH为:(A) 2.43 (B) 2.62 (C) 11.38 (D) 11.5720. 某物质由阴、阳离子组成,不溶于水但可溶于有机溶剂,这种物质称作:(A) 离子化合物(B) 离子对化合物(C) 螯合物(D) 配合物二、填充题1. 0.2736g的纯Cu(M = 63.55)定容250.00mL,取25.00mL,标定EDTA。
南京工业大学无机与分析化学试卷(下、A)

南京工业大学 无机与分析化学 试卷(下、下、A)A)(一页开卷一页开卷))2012—2013学年第二学期学年第二学期 使用班级使用班级 :全校相关专业:全校相关专业学院学院 专业专业 学号学号 姓名姓名题号题号 一 二 三 四 五 六 七 总分总分 得分得分一 、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中)将答案填入答题表中)题号题号12 3 4 5 6 7 8 9 10 答案答案 题号题号 11 12 13 14 15 16 17 18 19 20 答案答案1. 取同浓度的Zn 2+-EDTA 配合物的溶液两份,分别用A :用NaOH 溶液控制pH=10.0,其条件稳定常数记作K'ZnY ZnY,A ,A ,B :用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY ZnY,B ,B ,。
正确的关系式是:正确的关系式是:2. 佛尔哈德法测定Cl -时,使用的指示剂是:时,使用的指示剂是:(A) Ag 2CrO 4 (B) 二氯荧光黄二氯荧光黄 (C) 甲基橙 (D) FeNH 4(SO 4)2 3. 在下列物质中,不能将KI 氧化成I 2的是:的是: (A) KIO 3 (B) FeNH 4(SO 4)2 (C) Fe(NH 4)2(SO 4)2 (D) CuSO 44. 下列说法正确的是:下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大非构晶离子的盐浓度越大,沉淀溶解度越大 (B) 非构晶离子的盐浓度越大,沉淀溶解度越小非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小两种沉淀的溶度积相比,溶度积小的溶解度也小 (D) 不同种类沉淀的溶解度越大,溶度积也越大不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo (V) H 2PO 2-____-2.25V ____P 4_______________PH 3 |_____________-1.23V -1.23V____________| 可计算电对P 4/ PH 3的标准电极电位φo P4/PH3为:为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V 6. 在配离子[Co(C 2O 4)2(en)]-中(en 为H 2N-CH 2-CH 2-NH 2),中心离子Co 3+的配位数是:的配位数是:(A) 3 (B) 4 (C) 5 (D) 6 7. 用Na 2C 2O 4标定KMnO 4,加入第一滴KMnO 4时,KMnO 4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO 4很快退色,最有效的措施是:很快退色,最有效的措施是:(A) 加大H 2C 2O 4浓度浓度(B) 加大酸度加大酸度 (C) 事先加入Mn 2+ (D) 加快滴KMnO 4的速度的速度opH lgαY(H)pH lgαY(H)pH lgαY(H)0.0 23.64 5.0 6.45 10.0 0.45 1.0 18.01 6.0 4.65 11.0 0.07 2.0 13.51 7.0 3.32 12.0 0.01 3.0 10.60 8.0 2.27 4.0 8.44 9.0 1.28 17. 碘量法中所用的指示剂为:碘量法中所用的指示剂为: (A) 淀粉溶液淀粉溶液 (B) 二甲酚橙二甲酚橙 (C) 亚甲基蓝亚甲基蓝 (D) 二苯胺磺酸钠二苯胺磺酸钠18. 晶形沉淀陈化的主要目的是:晶形沉淀陈化的主要目的是:(A) 增大沉淀的溶解度增大沉淀的溶解度 (B) 小颗粒长大,使沉淀更纯净小颗粒长大,使沉淀更纯净 (C) 避免后沉淀现象避免后沉淀现象 (D) 形成非晶型沉淀形成非晶型沉淀19. 当含有Mg 2+、Na +、Ag +、Al 3+离子混合液流过阳离子交换树脂时,最先流出和最后流出的离子分别是:的离子分别是:(A) Na +,Mg 2+(B) Ag +,Al 3+(C) Na +,Al 3+(D) Mg 2+,Ag +20. 已知M 与EDTA(Y)的lg K MY = 13.2,在pH = 5.0的HAc-NaAc 缓冲溶液中,αY(H) =106.45;αM(L) =102.4;αM(OH) =100.4;则在此条件下,lgK’MY 为:为: (A) 6.75 (B) 4.35 (C) 3.95 (D) 2.95 二、填空和简单计算(每题2分) 1. 称取0.3581g 的ZnO(M = 81.38)定容250.00mL ,吸取该溶液20.00mL ,用EDTA 溶液滴定。
南京工业大学无机分析化学题库试题1

南京工业大学无机分析化学题库试题1第二学期模拟试卷一、选择题1. 配合物[Cu(NH3)4]SO4的导电性和加入Ba2+后的现象是:(A) 导电、有沉淀(B) 导电、无沉淀(C) 不导电、有沉淀(D) 不导电、无沉淀2. 当0.01mol氯化铬(III)(CrCl3·6H2O)在水溶液中用过量的硝酸银处理时,有0.02mol 氯化银沉淀析出,此样品的分子式应表示为:(A) [Cr(H2O)6]Cl3 (B) [CrCl(H2O)5]Cl2 (C) [CrCl2(H2O)4]Cl (D)[CrCl3(H2O)3]3. 根据晶体场理论,形成高自旋配合物的理论判据是:(A) 晶体场分裂能>电子成对能(B) 电离能>电子成对能(C) 晶体场分裂能>成键能(D) 电子成对能>晶体场分裂能4. 有关EDTA酸效应的叙述中,正确的是:(A) pH越大,αY(H)越大(B) pH越大,αY(H)越小(C) pH值愈大,酸效应系数愈大(D) 酸度越大,酸效应系数愈小5. 关于EDTA滴定法滴定突跃的说法不正确的是(忽略金属离子的水解):(A) pH越大,突跃范围越小(B) KMY越大,突跃范围越大(C) M或Y浓度约达,突跃范围越大(D) pH越大,突跃范围越大6. 在化学反应Mn(NO3)2 + PbO2 + HNO3→HMnO4 + Pb(NO3)2中,还原剂是:(A) Pb(NO3)2 (B) PbO2 (C) Mn(NO3)2 (D) HMnO47. 原电池(-)Zn│Zn2+(mo l?L-1 )‖Ag+(mo l?L-1 )│Ag(+),已知:φoAg+/Ag=0.80V,φoZn2+/Zn=-0.76V,在298.15 K 时,该电池的反应平衡常数lgKθ为:(A) 26.4 (B) 52.9 (C) 63.3 (D) 79.8. Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O;能斯特方程表达式是:(A) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059lg [Cr2O72-](B) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/3 lg [Cr2O72-][H+]14/[ Cr3+](C) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/3 lg [Cr2O72-][H+]14/[ Cr3+]2(D) φCr2O72-/Cr2+ = φoCr2O72-/Cr3+ + 0.059/6 lg [Cr2O72-]/[ Cr3+]29. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 加快滴KMnO4的速度(D) 加热10. φo Cr2O72-/ Cr3+ = 1.33V,φoFe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+]=1mol·L-1)滴淀突跃范围为:(A) 0.86~1.15V (B) 0.86~1.33V (C) 0.68~1.33V (D) 0.68~1.14V11. 可以用作标定Na2S2O3标准溶液的基准物质是:(A) KBrO3 (B) K2S2O8 (C) ZnO (D) 无水Na2CO312. 下列测定中需要加热的有:(A) KMnO4溶液测定H2O2 (B) KMnO4法测定MnO2(C) 碘量法测定Na2S (D) 溴量法测定苯酚13. 晶形沉淀陈化的目的是:(A) 增大沉淀的溶解度(B) 小颗粒长大,使沉淀更纯净(C) 避免后沉淀现象(D) 形成非晶型沉淀14. BaSO4在稀硫酸、氯化钠、EDTA和水中溶解度从大到小的顺序为:(A) EDTA>NaCl> H2O>稀H2SO4 (B) EDTA>NaCl>稀H2SO4>H2O(C) NaCl>稀H2SO4>H2O> EDTA (D) 稀H2SO4>NaCl>EDTA>H2O15. 进行重量法分析,下列说法正确的是:(A) 欲使沉淀净化,洗涤水量越多越好(B) 非晶型沉淀,一定用热溶液洗涤(C) 沉淀的洗涤剂只能是蒸馏水(D) 沉淀的体积越大越易洗净16. 下列哪组试剂是佛尔哈德法测定Cl-时全需使用?(A) FeNH4(SO4)2、K2CrO4 (B) KSCN、FeNH4(SO4)2(C) Fe(NH4)2(SO4)2 、硝基苯(D) K2CrO4、硝基苯17. 锰形成多种氧化态的化合物,其中最稳定的是:(A) 酸性介质中的Mn (Ⅱ) (B) 酸性介质中的Mn (Ⅶ)(C) 中性介质中的Mn (Ⅳ) (D) 中性介质中的Mn (Ⅵ)18. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+ (B) Cu2+和Zn2+ (C) Fe3+和Cr3+ (D) Cr3+和Zn2+19. K+与四苯硼钠可以形成晶体沉淀,这种沉淀是:(A) 离子化合物(B) 螯合物(C) 分子晶体化合物(D) 离子对化合物20. 用等体积萃取并要求一次萃取率不小于99%,则分配比最小为:(A) 50 (B) 100 (C) 99 (D) 199二、填充题1. 配合物[Co(en)3]Cl3(en为乙二胺简写符号)的名称为______________________。
无机与分析化学 试卷

南京工业大学无机与分析化学样卷(下)卷(一页开卷)学年第二学期使用班级化工、材料、生工、环境、轻化各专业学院专业学号姓名一、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中)1. Pb-EDTA(无色)、Pb-二甲酚橙(红色)、二甲酚橙(黄色)。
用EDTA滴定Pb2+,终点时,溶液的颜色如何突变?(A) 无色→红色 (B) 黄色→红色(C) 红色→黄色 (D) 红色→无色2. 可与Cu2+形成螯合物的配体是:(A) CN- (B) EDTA (C) NO2- (D) CO3. 欲使BaCO3在水溶液中溶解度增大,可采用的方法是:(A) 加入1.0 mol·L-1NaOH (B) 加入1.0 mol·L-1Na2CO3(C) 加入0.10 mol·L-1BaCl2(D) 降低溶液的pH值4. EDTA与Ca2+、Fe2+、Fe3+配合物稳定常数的次序是:(A) Ca2+>Fe2+>Fe3+ (B) Fe3+>Ca2+>Fe2+ (C) Fe2+>Fe3+>Ca2+ (D) Fe3+>Fe2+>Ca2+5. 碘量法中所用的指示剂为:(A)二甲酚橙(B) 淀粉溶液(C) 亚甲基蓝(D) 二苯胺磺酸钠6. [FeF6]3-为外轨型配合物。
其中心原子的杂化轨道类型和理论磁矩为:(A) 4s14p34d2;5.92 µB(B) 3d24s14p3;1.73 µB(C) 4s14p34d2;1.73 µB(D) 3d24s14p3;5.92 µB7. 在pH = 12.00的溶液中,用EDTA滴定Ca2+和Mg2+混合液,测定的是:(A) Mg2+的量(B) Ca2+的量(C) Ca2+-Mg2+的量(D) Ca2++Mg2+的量8. 从氧元素的电位图φo(V) O20.682V H2O2?H2O| 1.23V |求φo(H2O2/H2O)为:(A) 1.912V (B) 0.956V (C) 0.548V (D) 1.778V9. 已知M的lg K MY=13.2,pH=5的氨缓冲溶液中,αY(H) =106.45;αM(L) =102.4;αM(OH) =100.4;则在此条件下,lgK'MY为:(A) 6.75 (B) 4.35 (C) 3.95 (D) 2.9510. 在下列物质中,哪一个不能将KI氧化成I2:(A)KBrO3 (B)FeNH4(SO4)2(C)Fe(NH4)2(SO4)2(D)CuSO411. Cr2+有4个3d电子,配位体为水时,△o = 13876cm-1;E p = 27835cm-1。
南京工业大学无机分析化学试题

南京工业大学无机分析化学试题一、选择题1.可与Cu2+形成螯合物的配体是(A) CN- (B) EDTA (C) -NO2 (D) CO2. [FeF6]3-为外轨型配合物。
其中心原子的杂化轨道类型和磁矩为:(A) 4s14p34d2;5.75μB (B) 3d24s14p3;1.73μB(C) 4s14p34d2;1.73μB (D) 3d24s14p3;5.75μB3. Cr2+有4个3d电子,配位体为水时,△o = 13876cm-1;Ep = 27835cm-1。
则[Cr(H2O)6]2+自旋状态和磁矩的正确结论是:(A) 高自旋;2.83μB (B) 低自旋;2.83μB (C) 高自旋;4.90μB (D) 低自旋;4.90μB4. EDTA与Ca2+、Mg2+、Al3+配合物稳定常数的次序是:(A) Al3+>Ca2+>Mg2+ (B) Ca2+>Mg2+>Al3+ (C) Mg2+>Al3+>Ca2+ (D) Al3+>Mg2+>Ca2+5. 若配制EDTA溶液时所用的水中含有Ca2+,以ZnO为基准物质标定EDTA溶液(pH =4.50),然后用此标准溶液在pH = 10.00左右滴定试样中的Zn2+,测定结果:(A) 偏高(B) 偏低(C) 正常(D) 不确定6. 在氧化还原反应中,产物中氧原子数比反应物增加,反应介质为:(A) 酸性(B) 碱性(C) 中性(D) 酸性或碱性均可7. 为了明显提高铜锌原电池的电动势,采取的正确措施是:(A) 在ZnSO4溶液中加固体酸(B) 在CuSO4溶液中加水(C) 在ZnSO4溶液中加氨水(D) 在CuSO4溶液中加氨水8. Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O;下列哪个措施可提高φCr2O72-/Cr3+?(A) 提高pH (B) 提高酸度(C) 提高Cr3+的浓度(D) 将Cr2O72-转化为CrO42-9. 用KMnO4定量氧化还原性物质时,调节溶液酸度使用的是:(A) HAc (B) HCl (C) HNO3 (D) H2SO410. φo MnO4-/ Mn2+ = 1.45V,φoSn4+/Sn2+= 0.15V,以KMnO4滴定Sn2+,([H+]=1mol·L-1)滴至50%时的电极电位为:(A) 0.73V (B) 0.15V (C) 0.80V (D) 0.65V11. 可以用作标定KMnO4标准溶液的基准物质是:(A) CaCO3 (B) Fe(NH4)2(SO4)2 (C) K2S2O8 (D) SnCl212. 用KMnO4溶液滴定H2O2时,发现有沉淀生成,原因是:(A) pH太大,生成MnO2沉淀(B) 溶液酸度太大,形成HMnO4沉淀(C) H2O2生成了沉淀物(D) pH太大,生成Mn(OH)2沉淀13. 下列说法正确的是:(A) 聚集速度越大越易形成晶体沉淀(B) 过饱和度越大,定向速度越大(C) 聚集速度越小越易形成晶体沉淀(D) 过饱和度越小,定向速度越大14. 在CaC2O4沉淀中加入同体积、同浓度的液体,溶解度最大的是:A) NH3(B) KNO3 (C) EDTA (D) NaCl15. 进行重量法分析,下列说法正确的是:(A) 沉淀必须在灼烧后才能称量(B) 沉淀只能在烘干后称量(C) 氢氧化物必须在灼烧后才能称量(D) 氢氧化物可在烘干后称量16. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4 (B) 二氯荧光黄(C) Fe(NH4)2(SO4)2 (D) FeNH4(SO4)217. 实验室用来洗涤玻璃仪器的洗液组成是:(A) 浓盐酸和硝酸(B) 浓硫酸和重铬酸钾(C) 硝酸和重铬酸钾(D) 硝酸和硫酸18. 碱性BaCl2溶液与K2Cr2O7溶液混合生成的沉淀是:(A) 黄色BaCrO4 (B) 橙色BaCrO4 (C) 黄色BaCr2O7 (D) 橙色BaCr2O719. 阴离子交换树脂可分离下列哪组物质?(A) 氯化钠和氯化钾(B) 苯酚和醋酸(C) 氯化钠和溴化钠(D) 水和NaOH20. 用等体积萃取并要求一次萃取率不小于99%,则分配比最小为:(A) 50 (B) 100 (C) 99 (D) 199二、填充题1. 配合物[Co(en)3]Cl3(en为乙二胺简写符号)的名称为______________________。
2020-2021某大学《无机及分析化学》期末课程考试试卷A(含答案)

第 1页,共 6页2020-2021《无机及分析化学》期末课程考试试卷A适用专业: 考试日期:试卷所需时间:120分钟 闭卷 试卷总分100分 一、 选择题(单项选择,每小题2分,共50分)1、 海水比淡水更难结冰是因为海水的( )。
A 、沸点上升B 、凝固点下降C 、渗透压高 2、 下列哪种电解质对负溶胶的凝结能力最大( )。
A 、NaClB 、MgSO 4C 、FeCl 33、 甲烷的燃烧热是- 965.6kJ· mol -1,其相应的热化学方程式是( )。
A. C(g) + 4H(g) = CH 4(g) △r H θ298(1) = - 965.6 kJ· mol -1 B. CH 4(g) + 3/2 O 2(g) = CO(g) + 2H 2O(l) △r H θ298(1) = - 965.6 kJ· mol -1l C. CH 4(g) + 2 O 2(g) = CO 2(g) + 2H 2O(l)△r H θ298(1) = - 965.6 kJ· mol -14、 对于基元反应::2NO + O 2 = 2NO 2 ,速率方程正确的为:( ) A. v=kc 2(NO)c(O 2) B. v=2kc(NO)c(O 2) C. v=kc(NO)c(O 2)5、 对于任意可逆反应,下列条件能改变平衡常数的是( )A. 增加反应物浓度B. 增加生成物浓度C. 加入催化剂。
6、 已知下列反应及其标准平衡常数:C(s) +H 2O(g) CO(g) +H 2(g) K 1θ CO(g) +H 2O(g) CO 2(g)+ H 2(g) K 2θ C(s)+2H 2O(g)CO 2(g)+ 2H 2(g) K 3θ试确定下列关系式中正确的是( )A. K 3θ= K 1θ×K 2θB. K 1θ= K 2θ× K 3θC. K 2θ= K 1θ× K 3θ7、 Ca 3(PO 4)2的溶度积K sp θ的表示式为:( ) A. K sp θ = c(Ca 2+)c(PO 43-)B. K sp θ= c(Ca 2+)2c(PO 43-)2C. K sp θ = c(Ca 2+)3c(PO 43-)28、 判断化学反应自发的标准不正确是( )。
南京工业大学 无机与分析化学 试卷(下、A)

南京工业大学无机与分析化学试卷(下、A)(一页开卷)2012—2013学年第二学期使用班级:全校相关专业学院专业学号姓名一1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。
正确的关系式是:2. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)23. 在下列物质中,不能将KI氧化成I2的是:(A) KIO3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO44. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小(D) 不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3|_____________-1.23V____________|可计算电对P4/ PH3的标准电极电位φo P4/PH3为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是:(A) 3 (B) 4 (C) 5 (D) 67. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+(B) Cu2+和Zn2+(C) SO42-和Cl-(D) Fe3+和Al3+9. φo Cr2O72-/ Cr3+ = 1.33V,φo Fe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+] = 2mol·L-1)滴至70%时,溶液的电极电位为:(A) 0.70V (B) 1.01V (C) 1.35V (D) 0.67V10. 已知lgK MY =14.51,[M] = 0.010mol·L-1。
2021年无机及分析化学期末考试试题及答案A卷

一、单项选择题(务必填入下表中!每题1分,40分)A. 溶液的蒸气压下降B. 溶液的沸点升高C. 溶液的凝固点降低D. 溶液具有渗透压2.热力学第一定律的表达式为A. H=U+PVB. G=H-TSC. △U=Q+WD. △r G m=-RTlnK3. 如果一个反应的吉布斯自由能变为零,则反应A. 能自发进行B. 是吸热反应C. 是放热反应D. 处于平衡状态4. 对于基元反应::2NO + O2 = 2NO2,若将体系的压力由原来的1大气压增大到2大气压,则正反应的速度为原来的A. 2倍B. 4倍C. 6倍D. 8倍5. 下列叙述中正确的是A. 溶液中的反应一定比气相中反应速率大;B. 反应活化能越小,反应速率越大;C. 增大系统压力,反应速率一定增大;D. 加入催化剂,使Ea(正)和Eb(逆)减少相同倍数。
6. 已知反应:(1)SO2(g) + 1/2O2(g) SO3(g) 的标准平衡常数为Kθ1(2) SO3(g) + CaO(s) CaSO4(s) 的标准平衡常数为Kθ2求反应:(3) SO2(g) + 1/2O2(g)+ CaO(s) CaSO4(s) 的标准平衡常数Kθ3。
A. Kθ1Kθ2=K°3B. Kθ3=Kθ1/Kθ2C. Kθ3=Kθ2/Kθ1D. 不能判断7.下列说法中正确的是A. 色散力仅存在于非极性分子之间B. 极性分子之间的作用力称为取向力C. 诱导力仅存在于极性分子于非极性分子之间D. 分子量小的物质,其熔点、沸点也会高于分子量大的物质8. 铁原子的价电子构型是A. 4s2B. 4s24d6C. 3d64s2D. 3s23p63d69.基态11Na原子最外层电子的四个量子数应是A. 4,1,0,+1/2或-1/2B. 4,1,1,+1/2或-1/2C. 3,0,0 ,+1/2或-1/2D. 4,0,0 ,+1/2或-1/210.下列哪种分子的偶极矩等于零?A. NH3B. H2SC. H2OD. CH411.下列各数中有效数字位数为四位的是A. 0.0101B. c(OH-)= 0.0235 mol·L-1C. pH = 3.102D. NaHCO3%= 25.3012. 可以用直接法配制标准溶液的是A. 含量为99.9%的铜片B. 优级纯浓H2SO4C. 含量为99.9%的KMnO4D. 分析纯Na2S2O313.滴定分析法要求相对误差为±0.1%,若称取试样的绝对误差为0.0002g,则一般至少称取试样A. 0.1gB. 0.2g;C. 0.3gD. 00.4g14. 下列说法正确的是A.准确度越高则精密度越好B.精密度越好则准确度越高C.只有消除系统误差后,精密度越好准确度才越高D.只有消除系统误差后,精密度才越好15.由等浓度HB和B-组成的缓冲系,若B-的K bΘ=1.0×10-10,则此缓冲溶液的pH值为A. 4.00B. 5.00C. 7.00D. 10.0016. H CO3-的共轭酸是A. H+B. OH-C. CO32-D.H2CO317. 在酸碱滴定中,选择指示剂可不必考虑的因素是A.pH突跃范围 B. 指示剂的变色范围C.指示剂的颜色变化 D. 指示剂的分子结构18. 某物质的化学式是AB3,其溶解度S和容度积常数K spΘ的关系式是A. K spΘ=2S2B. K spΘ=2S3C. K spΘ=27S4D. K spΘ=4S219. 下列配离子在强酸中能稳定存在的是A. [Fe(C2O4)]3-B. [AlF6]3-C. [Mn(NH3)6]2+D. [AgCl2]-20. 标定过程中使用的基准物质需要符合的条件不包括哪个A. 纯度要达到98%以上B. 具有确定的化学组成并且性质稳定C. 反应能够定量进行D. 摩尔质量较大。
南京工业大学《无机化学(1)》2019-2020学年第一学期期末试卷

2. 无机化合物的化学式通常用什么表示: A) 分子式 B) 化学式 C) 结构式
D) 分子结构式
(3 分)
3. 下列哪种化合物属于酸式盐: A) NaCl B) NaNO3 C) Na2SO4 D) NaHCO3 (3 分)
4. 无机化合物的物理性质主要包括:
A) 外形、颜色、熔点、沸点
B) 密度、溶解性、导电性
6. 下列哪种化合物属于碱式盐: A) NaCl B) NaNO3 C) Na2SO4 D) Na2CO3 (3 分)
7. 无机化合物的化学性质主要包括: A) 酸碱性质、氧化还原性质、催化性质 B) 溶解性质、导电性质、磁性质 C) 热稳定性质、光学性质、电池性质 D) 以上所有 (3 分)
8. 下列哪种反应属于-neutralization 反应: A) 2Na + Cl2 → 2NaCl B) CaO + H2O → Ca(OH)2 C) 2H2 + O2 → 2H2O D) NaOH + HCl → NaCl + H2O (3 分)
15. 无机化合物在工业生产中的应用有什么特点?请简述其类型和 应用。 (8 分)
Part III: 应用题(30 分)
每题 15 分,共 2 题
16. 某无机化合物的化学式为 K2Cr2O7,要求写出其分子式、化学 式和电子式。 (15 分)
17. 某工业生产过程中需要使用 NaOH 和 HCl 反应生成 NaCl 和 H2O。请写出该反应的化学方程式,并简述其应用。 (15 分)
南京工业大学《无机化学(1)》2019-2020 学年第一学期期末试卷
无机化学(1)期末试卷 考试时间:120 分钟 总分:100 分 适用专业:化学工程、应用化学、材料科学与工程等 Part I: 多选题(30 分) 每题 3 分,共 10 题
无机分析化学期末试卷(A)(1)

一、选择题1.AgCl、AgBr、AgI的颜色依次加深,能解释这一现象的是( )。
(A) 晶格能(B) 杂化轨道理论(C) 离子极化(C) 分子轨道理论2.下列物质不是离子型化合物的是( )。
(A) BeCl2;(B) RbCl;(C) CsBr;(D) SrO。
3.下列性质哪一个不是过渡元素的通性( )。
(A) (n-1)d电子参加成键( B) 元素具有多种氧化态(C) 良好的配合物形成体(D) 单质熔点很低4.[Co(en)2(NH3)2]3+ 中心离子的配位数是( )。
(A) 3 (B) 4 (C) 5 (D) 65.采用EDTA滴定溶液中的Ca2+,Mg2+的干扰是用下列哪个方法去除( )。
(A) 掩蔽剂(B) 预先分离(C) 调整溶液pH (D) 无法去除6.BaCrO4溶于浓HCl后溶液的颜色及Cr的存在形式最合理是哪一种:( )。
(A) 绿色,CrO2-(B)黄色,CrO42-(C) 绿色,Cr3+ (D) 橙色,Cr2O72-7.在使用金属指示剂时,若MIn非常稳定,使得溶液颜色难以发生变化,这种现象称为( )。
(A) 指示剂的封闭现象(B) 指示剂的僵化现象(C) 指示剂的酸效应(D) 指示剂的副反应8.已知lgK BiY-=27.94,lgK FeY-=25.90,lgK FeY2-=14.33;用EDTA滴定Bi3+时,要消除Fe3+的干扰,最合适的掩蔽方法是( )。
(A) 沉淀掩蔽法;(B) 氧化还原掩蔽法;(C) 配位掩蔽法;(D) 没有合适的掩蔽法。
9.某元素的原子最外层只有两个l = 0的电子,该元素在周期表中必不属于()。
(A) s区元素(B) ds区元素(C) d区元素(D) p区元素10.在分子晶体中,分子内原子之间的结合力是()。
(A) 共价键(B) 离子键(C) 金属键(D) 范德华力11.[NiCl4]-的磁矩为2.828 (BM),该配离子的杂化类型和空间构型为()。
南京工业大学无机与分析化学试卷下A

南京工业大学无机与分析化学试卷(下、A)(一页开卷)2012—2013学年第二学期使用班级:全校相关专业学院专业学号姓名一1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。
正确的关系式是:2. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)23. 在下列物质中,不能将KI氧化成I2的是:(A) KIO3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO44. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小(D) 不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3|_____________-1.23V____________|可计算电对P4/ PH3的标准电极电位φo P4/PH3为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是:(A) 3 (B) 4 (C) 5 (D) 67. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+(B) Cu2+和Zn2+(C) SO42-和Cl-(D) Fe3+和Al3+9. φo Cr2O72-/ Cr3+ = 1.33V,φo Fe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+] = 2mol·L-1)滴至70%时,溶液的电极电位为:(A) 0.70V (B) 1.01V (C) 1.35V (D) 0.67V10. 已知lgK MY =14.51,[M] = 0.010mol·L-1。
南京工业大学无机分析化学题库试题10

南京工业大学无机分析化学题库试题10一、选择题1. 配合物[PtCl2(NH3)2]能与C2O42-反应形成了螯合物,则[PtCl2(NH3)2]应为:(A) 左旋光异构体(B) 右旋光异构体(C) 顺式异构体(D) 反式异构体2. 螯合物[Fe(C2O4)3]3-的磁矩为5.75μB,其空间构型和中心原子的杂化轨道类型是:(A) 八面体型和sp3d2杂化(B) 八面体型和d2sp3杂化(C) 三角双锥型和sp3d2杂化(D) 三角形和sp2杂化3. 若Co3+的电子成对能为21000cm-1,F-和NH3的配位场分裂能分别为13000cm-1和23000cm-1,判断[CoF6]3-和[Co(NH3)6]3+配离子的自旋状态:(A) 高自旋、高自旋(B) 高自旋、低自旋(C) 低自旋、高自旋(D) 低自旋、低自旋4. EDTA与Ca2+、Fe3+、Al3+配合物稳定常数的次序是:(A) Ca2+>Fe3+>Al3+ (B) Al3+>Ca2+>Fe3+ (C) Fe3+>Al3+>Ca2+ (D) Al3+>Fe3+>Ca2+5. M与EDTA配合物组成是:(A) M?H4Y (B) M?H2Y2- (C) M?HY3- (D)M?Y4-6. 物质OF2中的O的氧化数是:(A) +2 (B) +1 (C) -1 (D) -27. 原电池(-)Zn│Zn2+(mo l?L-1 )‖Ag+(mo l?L-1 )│Ag(+),已知:φoAg+/Ag=0.80V,φoZn2+/Zn=-0.76V,在298.15 K 时,该电池的反应平衡常数lgKθ为:(A) 26.4 (B) 52.9 (C) 63.3 (D) 79.78. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4______-0.89V____PH3电对φH2PO2-/PH3的标准电极电位为:(A) -1.57V (B) -1.23V (C) -4.92V (D) -1.91V9. 用Na2C2O4标定KMnO4时,由于反应速度不够快,因此滴定时要维持足够的酸度和温度,但酸度和温度过高时,又会发生:(A) H2C2O4分解(B) H2C2O4析出(C) H2C2O4挥发(D) H2C2O4与O2反应10. φo Cr2O72-/ Cr3+ = 1.33V,φoFe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+]=1mol ?L-1)滴至40%时的电极电位为:(A) 0.65V (B) 1.01V (C) 0.11V (D) 0.67V11. 用H2C2O4标定KMnO4时,所用的指示剂为:(A) 二甲酚橙(B) 淀粉溶液(C) KMnO4 (D) 二苯胺磺酸钠12. 用K2Cr2O7滴定Fe2+, K2Cr2O7的计量单元等于其摩尔质量除以:(A) 3 (B) 5 (C) 6 (D) 713. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 沉淀的溶度积小者,溶解度一定小(D) 沉淀的溶解度大者,其溶度积一定大14. 在CaC2O4沉淀中加入同体积、同浓度的液体,溶解度最大的是:(A) NH3 (B) KNO3 (C) EDTA (D) NaCl15. 进行重量法分析,下列说法正确的是:(A) 欲使沉淀净化,洗涤水量越多越好(B) 非晶型沉淀,一定用热溶液洗涤(C) 沉淀的洗涤剂只能是蒸馏水(D) 沉淀的体积越大越易洗净16. 莫尔法测定Cl-时,使用的指示剂是:(A) K2CrO4 (B) 二氯荧光黄(C) Fe(NH4)2(SO4)2 (D) FeNH4(SO4)217. 锰形成多种氧化态的化合物,其中最稳定的是:(A) 酸性介质中的Mn (Ⅱ) (B) 酸性介质中的Mn (Ⅶ)(C) 中性介质中的Mn (Ⅳ) (D) 中性介质中的Mn (Ⅵ)18. 溶液中加入适量氨水有绿色沉淀生成,氨水过量时得到蓝色溶液的是(A) Cr(Ⅲ) (B)Ni(Ⅱ) (C) MnO42- (D) Fe2+19. 某物质由阴、阳离子组成,不溶于水但可溶于有机溶剂,这种物质称作:(A) 离子化合物(B) 离子对化合物(C) 螯合物(D) 配合物20. 用等体积萃取并要求一次萃取率大于94%,则分配比最小为:(A) 19 (B) 38 (C) 9.5 (D) 95二、填充题1. 配合物Li[AlH4]的名称为______________________。
大学《无机化学与化学分析》期末试卷A卷附答案

大学《无机化学与化学分析》期末试卷A卷附答案2008级普通化学课程试题(A卷)题号一二三四五总分分数合分人:复查人:分数评卷人一、填空题:(每空1分,共20分)1.恒温恒压下,满足___________________的化学反应能够自发进行。
2.在CaCO3饱和溶液中,加入Na2CO3溶液,结果导致____________________________,这种现象称为_________________。
3.某元素的原子序数为25,其外层电子构型是___________________,位于周期表_____区_____族,其+3价离子共有_________个不成对电子。
4.NH3、PH3、AsH3三种物质中,分子间色散力最大的是______________,沸点最低的是____________。
5.C2H2中,存在_____个σ键和_____个π键,键角 HCC=______。
6.根据分子轨道理论,分子轨道是由组成分子的各原子的原子轨道________而成,这些原子轨道必须满足________________原则、________________原则和________________原则。
7.在下列六种化合物:NaCl,KCl,BaO,H2O,SiF4,SiI4中,熔点最高的是________,晶体熔化时需克服______________;熔点最低的是________,晶体熔化时需克服_______________。
分数评卷人二、单选题:(每题2分,共30分)(说明:将正确答案填写在下表中,不要写在题后......)1 2 3 4 5 6 7 8 9 10 11 12 13 14151.下列不属于状态函数的是:A. UB. QC. SD. p2.若升高温度后,反应的K?升高,则在此温度下此反应:A. Δr G?m >0 B. Δr S?m>0 C. Δr H?m>0 D. Δr U?m>03.4.在298K,下列反应中?r H?m 与?r G?m最接近的是:A. CCl4(l) + 2H2O(g) = CO2(g) + 4HCl(g)B. CaO(s) + CO2(g) = CaCO3(s)C. Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)D. 2Na(s) + 2H+(aq) + 2H2O(l) = 2Na+(aq) + 2OH-(aq) + H2(g)5.反应C(s)+O2(g)=CO2(g)为放热反应,欲增加正反应速率,下列措施无用的是:A. 增加O2的分压B. 升温C. 加催化剂D、减少CO2的分压6.7.往HAc溶液中加入一些NaAc晶体,可能发生以下变化,①HAc的K?a 值增大②HAc的K?a值减小③溶液的pH值增大④溶液的pH值减小⑤HAc的解离度减小其中正确的是:A. ①④⑤B. ②③C. ②④⑤D. ③⑤8.将一定浓度氨水稀释一倍,pH将:A. 增加0.5B. 增加0.2C. 减小0.5D. 减小0.29.pH=3的某一元酸与pH=11的NaOH等体积混合,所得溶液的pH必定不可能...为:A. 5B. 7C. 910.在一个氧化还原反应中,若两电对的电极电势值差很大,则可判断:A. 该反应是可逆反应B. 该反应的反应速度较小C. 该反应能剧烈地进行D. 该反应的反应趋势很大11.下列关于原子电子结构的表述中正确的是A. 原子中的电子有确定的飞行轨道B. 电子波函数的平方表示电子在空间某一点处的电子几率密度C. 电子波函数的空间外形被称为电子云D. 一个电子的行为可以用n、l、m三个量子数完全描述12.同一原子中,可能存在下列哪组量子数的两个电子:A. (1,1,0,+?)和(1,0,0,-?)B. (2,0,1,+?)和(2,0,0,-?)C. (3,2,0,-?)和(3,2,1,-?)D. (1,0,0,-?)和(1,0,0,-?)13.某原子中,同时存在以下电子,其中能量最高的是:A. 3, 0, 0, -?B. 4, 1, 0, -?C. 3, 2, 0, -?D. 3, 1, 0, ?14.下列离子中,磁性最强的是A. C2-2B. Be2-2C. N2+2D. O2+215.在气态C2中,最高能量的电子所处的分子轨道是A. σ2pB. σ*2p C. π2p D. π*2p16.熔融SiO2晶体时,需要克服的主要是:A. 离子键B. 氢键C. 共价键D. 范德华力17.在[PtCl2(en)2]2+中,Pt的氧化数和配位数分别为:A. +4 和4B. +6和6C. +6和4D. +4和6三、判断题:(每题1分,共10分)(说明:认为陈述正确的在下表内打“√”;否则打“×”)分数评卷人1 2 3 4 5 6 7 8 9 101.焓变是由等压过程得到的热力学函数,因此只有在等压过程中才存在2.放热且熵减小的反应,是高温自发而低温下非自发的反应3.催化剂能加快反应达到平衡的速率,是由于改变了反应的历程,降低了活化能。
南京工业大学无机分析化学题库试题2

一、选择题1. 配位化合物的内界,若有多种无机配体和有机配体,其命名顺序为:(A) 无机阴离子-无机分子-有机配体(B) 无机分子-无机阴离子-有机配体(C) 有机配体-无机分子-无机阴离子(D) 有机配体-无机阴离子-无机分子2. [Cu(NH3)4]2+为内轨型配合物、平面四方形构型,其磁矩为:(A) 5.75?SUB>B (B) 3.87?SUB>B (C) 1.73?SUB>B (D) 0?SUB>B3. Fe2+有6个3d电子,配合物[Fe(CN)6]4-,△o= 395kJ·mol-1;Ep=213kJ·mol-1。
则晶体场稳定化能CFSE等于(kJ·mol-1):(A) -522 (B) -470.4 (C) -948 (D) -3094. 在等年度的Ca2+、Mg2+、Al3+、Fe3+溶液中,加入EDTA溶液,首先与EDTA形成配合物的是:(A) Ca2+ (B) Mg2+ (C) Al3+ (D) Fe3+5. 在pH = 12.00的溶液中,用EDTA滴定Ca2+和Mg2+混合液,测定的是:(A) Mg2+的量(B) Ca2+的量(C) Ca2+-Mg2+的量(D) Ca2++Mg2+的量6. 物质Fe3O4中的Fe的氧化数是(A) +2 (B) +3 (C) +4/3(D) +8/37. 已知: Fe3++ e = Fe2+φo = 0.77V;Zn2++ 2e = Zn φo = -0.76 VFe2++ 2e = Fe φo = -0.44V;Al3++ 3e = Al φo = -1.66 V上述物质中还原性最强的是(A) Zn (B) Fe2+(C) Fe (D) Al8. 人们规定标准电极在标准状态下的电极电位为0。
标准电极是:(A) 甘汞电极(B) 银电极(C) 氢电极(D) 铂电极9. 用能斯特方程φ=φθ+ (0.0592/n)lgC(氧化型)/C(还原型)计算φCr2O72-/Cr3+的电极电位时,说法不正确的是:(A) 温度应为298 K (B) Cr3+浓度增大则φ减小(C) H+浓度的变化对φ无影响(D) Cr2O72-浓度增大,则φ增大10. φo MnO4-/ Mn2+ = 1.45V,φoSn4+/Sn2+= 0.15V,以MnO4-滴定Sn2+,([H+]=1mol·L-1)其化学计量点的电极电位为:(A) 0.80V (B) 1.48V (C) 1.30V(D) 1.08V11. 可以直接配制的标准溶液是:(A) K2Cr2O7 (B) K2S2O8 (C) Na2S2O3 (D) Ce(SO4)212. 碘量法用纯Cu标定Na2S2O3标准溶液,将Cu溶解说Cu2+所用的溶剂为:(A) HNO3 (B) HCl (C) 浓H2SO4 (D) HCl + H2O213. 下列说法正确的是:(A) 聚集速度越大越易形成晶体沉淀(B) 过饱和度越大,定向速度越大(C) 聚集速度越小越易形成晶体沉淀(D) 过饱和度越小,定向速度越大14. 在下列措施中,不能增加ZnS沉淀溶液中Zn2+浓度(mol·L-1)的措施是:(A) 加HNO3 (B) 加水(C) 加Cu2+ (D) NaCl15. 下列说法不正确的是:(A) 称量形式的组成必须单一(B) 沉淀形式溶度积一定要小(C) 沉淀剂不纯对重量分析法无影响(D) 加入的沉淀剂的量不必准确16. 法扬司法测定Cl-时,使用的指示剂是:(A) Ag2CrO4 (B) 二氯荧光黄(C) Fe(NH4)2(SO4)2 (D) FeNH4(SO4)217. 工业上五氧化二钒的主要用途是做(A) 吸附剂(B) 表面活性剂(C)催化剂(D)氧化剂18. 下列离子的颜色为粉红色的是(A) [Fe(H2O)6]2+ (B) [Ni(H2O)6]2+ (C) [Ni(NH3)6]2+ (D) [Co(H2O )6]2+19. 阴离子交换树脂可分离下列哪组物质?(A) 氯化钠和氯化钾(B) 苯酚和醋酸(C) 氯化钠和溴化钠(D) 水和NaOH20. 用薄层层析法,以苯-乙酸乙酯为展开剂分离黄连素时,已知比移值为0.41,溶剂前沿距离为24.5 cm,则斑点中心只原点的距(A) 10.0cm (B) 14.5cm (C)10.3cm (D) 无法确定二、填充题1. 配离子[Co(NH3)4(NO2)Cl]+的名称为_____________________(若有多个答案,用”;“号间隔。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
南京工业大学无机与分析化学试卷(下、A)(一页开卷)2012—2013学年第二学期使用班级:全校相关专业学院专业学号姓名题号一二三四五六七总分得分一、每题只有一个答案是正确的,请选择(每题2分,将答案填入答题表中)题号12345678910答案题号11121314151617181920答案1. 取同浓度的Zn2+-EDTA配合物的溶液两份,分别用A:用NaOH溶液控制pH=10.0,其条件稳定常数记作K'ZnY,A,B:用氨-氯化铵缓冲溶液控制pH= 10.0,条件稳定常数记作K'ZnY,B,。
正确的关系式是:2. 佛尔哈德法测定Cl-时,使用的指示剂是:(A) Ag2CrO4(B) 二氯荧光黄(C) 甲基橙(D) FeNH4(SO4)23. 在下列物质中,不能将KI氧化成I2的是:(A) KIO 3 (B) FeNH4(SO4)2(C) Fe(NH4)2(SO4)2(D) CuSO44. 下列说法正确的是:(A) 非构晶离子的盐浓度越大,沉淀溶解度越大(B) 非构晶离子的盐浓度越大,沉淀溶解度越小(C) 两种沉淀的溶度积相比,溶度积小的溶解度也小(D) 不同种类沉淀的溶解度越大,溶度积也越大5. 从磷元素的电位图φo(V) H2PO2-____-2.25V____P4_______________PH3|_____________-1.23V____________|可计算电对P4/ PH3的标准电极电位φo P4/PH3为:(A) -1.02V (B) -1.74V (C) -0.89V (D) -1.16V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是:(A) 3 (B) 4 (C) 5 (D) 67. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是:(A) 加大H2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是:(A) Cr3+和Cu2+(B) Cu2+和Zn2+(C) SO42-和Cl-(D) Fe3+和Al3+9. φo Cr2O72-/ Cr3+ = 1.33V,φo Fe3+/Fe2+= 0.68V,以K2Cr2O7滴定Fe2+,([H+] = 2mol·L-1)滴至70%时,溶液的电极电位为:(A) 0.70V (B) 1.01V (C) 1.35V (D) 0.67V10. 已知lgK MY =14.51,[M] = 0.010mol·L-1。
EDTA酸效应αY(H)如下表:EDTA在不同pH时酸效应系数的对数值lgαY(H)pH lgαY(H)pH lgαY(H)pH lgαY(H)0.0 23.64 5.0 6.45 10.0 0.451.0 18.01 6.0 4.65 11.0 0.072.0 13.51 7.0 3.32 12.0 0.013.0 10.60 8.0 2.274.0 8.44 9.0 1.28对M可进行准确滴定的最低pH为:(A) 3.0 (B) 4.0 (C) 5.0 (D) 6.011. Fe2+有6个3d电子,配合物[Fe(CN)6]4-的晶体场分裂能△o = 395kJ·mol-1;电子成对能E p = 213kJ·mol-1。
则晶体场稳定化能CFSE等于(kJ·mol-1):(A) -522 (B) -470.4 (C) -948 (D) -30912. 下列关于氧化还原概念的叙述,错误的是:(A) 化学反应中反应物共用电子对的偏移,也称氧化还原反应(B) 氧化数减少的过程,称为被还原(C) 氧化和还原必须同时发生(D) 失电子的反应物,由于它的氧化数增加,因此是氧化剂13. 欲使难溶物CaC2O4在水溶液中溶解度增大,可采用的方法是:L-1的氨水(B) 降低溶液的pH值(A) 加入 1.0 mol·L-1的K2C2O4溶液(D) 加入CaCl2溶液(C) 加入0.10 mol·14. 配离子[Ni(CN)4]2-的磁矩等于0.0μB,其空间构型和中心原子Ni的杂化轨道类型为:(A) 正四面体和sp3杂化(B) 八面体和d2sp3杂化(C) 八面体和sp3d2杂化(D) 平面正方形和dsp2杂化15. 有一含有CaF2(s)(K sp=1.5×10-10)与CaSO4(s)(K sp=7.1×10-5)的饱和溶液,其中[SO42-] =1.3×10-4 mol·L-1,则溶液中[F-]等于(mol·L-1):(A) 3.3×10-5(B) 1.6×10-5(C) 8.0×10-6(D) 0.03316. 用薄层层析法,以苯-乙酸乙酯为展开剂分离黄连素时,测得溶剂前沿离斑点中心的距离为14.6㎝,溶剂前沿离原点距离为23.2 cm,则其比移值R f为:(A) 3.7 (B) 0.59 (C) 0.63 (D) 0.3717. 碘量法中所用的指示剂为:(A) 淀粉溶液(B) 二甲酚橙(C) 亚甲基蓝(D) 二苯胺磺酸钠18. 晶形沉淀陈化的主要目的是:(A) 增大沉淀的溶解度(B) 小颗粒长大,使沉淀更纯净(C) 避免后沉淀现象(D) 形成非晶型沉淀19. 当含有Mg2+、Na+、Ag+、Al3+离子混合液流过阳离子交换树脂时,最先流出和最后流出的离子分别是:(A) Na+,Mg2+(B) Ag+,Al3+(C) Na+,Al3+(D) Mg2+,Ag+20. 已知M与EDTA(Y)的lg K MY = 13.2,在pH = 5.0的HAc-NaAc缓冲溶液中,αY(H) =106.45;αM(L) =102.4;αM(OH) =100.4;则在此条件下,lgK’MY为:(A) 6.75 (B) 4.35 (C) 3.95 (D) 2.95二、填空和简单计算(每题2分)1. 称取0.3581g的ZnO(M = 81.38)定容250.00mL,吸取该溶液20.00mL,用EDTA溶液滴定。
终点时,用去EDTA溶液20.34mL。
EDTA溶液的浓度为__________mol·L-1。
2. 完成方程式___Zn + __HNO3(极稀) = _____ + __NH3↑+ _______。
10-10。
则在CaF2的饱和溶液中,[F-]= mol·L-1,3. 已知CaF2的溶度积为K SP = 1.1×CaF2的溶解度为mol·L-1。
4. 二羟基·四水合铝(Ⅲ)离子的离子式为_____________,铝的配位数是__________。
5. EDTA滴定Al3+时,先定量加入过量的EDTA,加热煮沸后再用Zn2+标准溶液滴定多余的EDTA。
这种滴定法称作_____滴定法。
6. 称取0.3251g的K2Cr2O7(M = 294.2),溶解、加酸和KI,用标定Na2S2O3溶液滴定,终点时用去Na2S2O3溶液35.81mL。
该Na2S2O3溶液的浓度为__________mol·L-1。
7. 分配比 D = 23,相比为2,萃取M一次后,留在水相中的M占原总量的______%。
8. 已知MgF2的K sp = 6.4×10-7,CaF2的K sp = 1.1×10-10,化学反应MgF2 + Ca2+ = CaF2+ Mg2+的平衡常数K = _____________。
9. Pt的配合物A的组成是PtCl4·(NH3)4;配合物B的组成是PtCl4·(NH3)2。
在1mol的A中加入AgNO3,有2mol的AgCl沉淀生成;而B不生成AgCl沉淀。
加入NaOH,均无NH3生成。
配合物A的结构式为________________。
B的结构式为_____________________。
10. 在pH=10时,铬黑T(EBT)是蓝色的,而Mg-EBT是红色的。
用EDTA滴定Mg2+,铬黑T(EBT) 为指示剂,滴至终点时,溶液从___色突变为____色。
11. [Fe(CN)6]4-是内轨型配离子,Fe2+的轨道杂化类型是____________,磁矩是_________μB。
12. 在进行EDTA滴定时,指示剂变色缓慢而使滴定终点延后。
这种现象称作指示剂的____________。
三、简答题(每题4分)1. 写出标准状态下的铜锌原电池的表示式。
并算出电池的电动势。
已知:Φo Cu2+/Cu=0.34V;φo Zn2+/Zn = -0.76V。
2. 用基准物CaCO3标定EDTA,HCl溶解CaCO3时,为什么要加热至不冒小气泡为止?四、由NaCl(M = 58.44)、NaBr(M = 102.9)和其他惰性物质组成的混合物0.8652g,溶解后定容至100.0mL,制成液样,取液样25.00mL,加入过量的AgNO3沉淀为AgCl(M = 143.2)和AgBr(M = 187.8),烘干后,称量,沉淀质量为0.4351。
另取液样25.00mL,用0.1527mol·L-1的AgNO3标准溶液滴定,终点时,消耗AgNO3标准溶液17.01mL。
求原样品中NaCl和NaBr的百分含量。
(本题8分)五、称取含有Fe2O3(M= 159.7)和Al2O3(M= 102.0) 和其它情性物质组成的试样0.1543g,溶解后,在pH = 2.0时,以磺基水杨酸为指示剂,用0.02246mol·L-1的EDTA标准溶液滴至终点。
消耗EDTA标准溶液11.23 mL。
然后加入上述EDTA标准溶液25.00mL,加热煮沸并调节pH = 4.5,以二甲酚橙为指示剂,用0.02141 mol·L-1的Zn2+标准溶液滴定过量的EDTA。
终点时,消耗Zn2+标准溶液 5.27mL。
求原试样中Fe2O3和Al2O3的百分含量。
(本题8分)六、将1.526g钢样中的铬氧化成K2Cr2O7试液,在此试液中加入0.1328mol·L-1的FeSO4标准溶液L-1的KMnO4标准溶液滴定过量的FeSO4 。
用去25.00mL,然后用C(KMnO4) = 0.02145mol·KMnO4标准溶液 6.53mL。
计算钢样中铬(M = 52.00)的百分含量。
(本题8分)七、在0.1023g铝样品中,加入NH3-NH4Ac缓冲溶液使其pH= 9.0。
