无菌药品生产所需的洁净区可分为以下4个级别
附录1试题库及答案

名词解释:1 动态:指生产设备按预定的工艺模式运行并有规定数量的操作人员在现场操作的状态。
2 单向流:指空气朝着同一个方向,以稳定均匀的方式和足够的速率流动。
单向流能持续清除关键操作区域的颗粒。
3 静态:指所有生产设备均已安装就绪,但没有生产活动且无操作人员在场的状态。
4 密封:指将容器或器具用适宜的方式封闭,以防止外部微生物侵入。
填空1 洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
2 无菌药品生产所需的洁净区可分为4个级别,分别是A、B、C、D3 应当对微生物进行动态监测,评估无菌生产的微生物状况。
监测方法有沉降菌法、定量空气浮游菌采样法和表面取样法(如棉签擦拭法和接触碟法)等。
4 工作服及其质量应当与生产操作的要求及操作区的洁净度级别相适应,其式样和穿着方式应当能够满足保护产品和人员的要求。
5 为减少尘埃积聚并便于清洁,洁净区内货架、柜子、设备等不得有难清洁的部位。
门的设计应当便于清洁。
6 应设送风机组故障的报警系统。
应当在压差十分重要的相邻级别区之间安装压差表。
压差数据应当定期记录或者归入有关文挡中。
7 热力灭菌通常有湿热灭菌和干热灭菌。
8 指无菌配制和灌装等高风险操作A级洁净区所处的背景区域是B级。
高风险操作区A级,指无菌药品生产过程中重要程度较低操作步骤的洁净区是C级和D级判断1 C级洁净区和D级洁净区没有动态监测的要求。
(×)2 应当根据产品及操作的性质制定温度、相对湿度等参数,这些参数不应对规定的洁净度造成不良影响。
( √ )3 应当制定适当的悬浮粒子和微生物监测警戒限度和纠偏限度。
操作规程中应当详细说明结果超标时需采取的纠偏措施。
(√)4 为了方便检查和监督工作,监督和管理人员可在无菌生产的洁净区进行随时进入。
(×)5 个人外衣不得带入通向B级或C级洁净区的更衣室。
每位员工每次进入A/B 级洁净区,应当更换无菌工作服;或每班至少更换一次,但应当用监测结果证明这种方法的可行性。
2010版GMP无菌及非无菌要求的制剂生产洁净度要求

09版GMP无菌及非无菌要求的制剂生产洁净度要求无菌药品生产所需的洁净区可分为以下4个级别:A级:相当于100级(层流)高风险操作区,如:灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级:相当于100级(动态)指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级(相当于10,000级)和D级(相当于100,000级)指生产无菌药品过程中重要程度较次的洁净操作区。
以上各级别空气悬浮粒子的标准规定如下表:注:(a)指根据光散射悬浮粒子测试法,在指定点测得等于和/或大于粒径标准的空气悬浮粒子浓度。
应对A级区“动态”的悬浮粒子进行频繁测定,并建议对B级区“动态”也进行频繁测定。
A级区和B级区空气总的采样量不得少于1米3,C级区也宜达到此标准。
(b)生产操作全部结束,操作人员撤离生产现场并经15~20分钟自净后,洁净区的悬浮粒子应达到表中的“静态”标准。
药品或敞口容器直接暴露环境的悬浮粒子动态测试结果应达到表中A级的标准。
灌装时,产品的粒子或微小液珠会干扰灌装点的测试结果,可允许这种情况下的测试结果并不始终符合标准。
(c)为了达到B、C、D级区的要求,空气换气次数应根据房间的功能、室内的设备和操作人员数决定。
空调净化系统应当配有适当的终端过滤器,如:A、B和C级区应采用不同过滤效率的高效过滤器(HEPA)。
(d)本附录中“静态”及“动态”条件下悬浮粒子最大允许数基本上对应于ISO14644-10.5μm悬浮粒子的洁净度级别。
(e)这些区域应完全没有大于或等于5μm的悬浮粒子,由于无法从统计意义上证明不存在任何悬浮粒子,因此将标准设成1个/米3,但考虑到电子噪声、光散射及二者并发所致的误报因素,可采用20个/米3的限度标准。
药厂洁净区划分abcd级的标准是什么
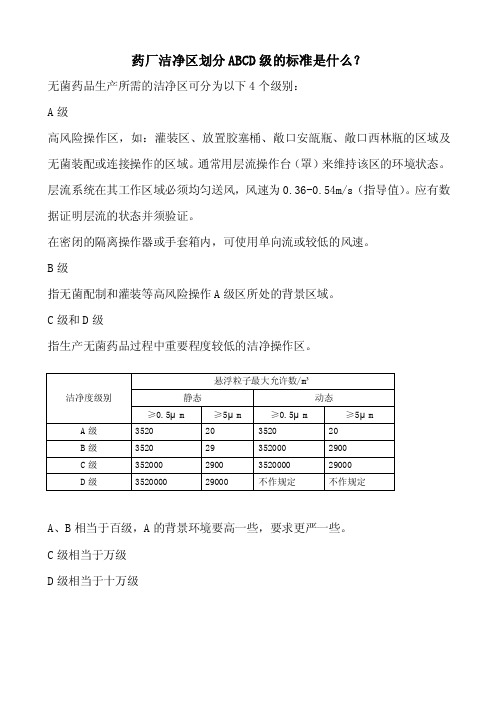
药厂洁净区划分ABCD级的标准是什么?无菌药品生产所需的洁净区可分为以下4个级别:A级高风险操作区,如:灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级和D级指生产无菌药品过程中重要程度较低的洁净操作区。
A、B相当于百级,A的背景环境要高一些,要求更严一些。
C级相当于万级D级相当于十万级文案编辑词条B 添加义项?文案,原指放书的桌子,后来指在桌子上写字的人。
现在指的是公司或企业中从事文字工作的职位,就是以文字来表现已经制定的创意策略。
文案它不同于设计师用画面或其他手段的表现手法,它是一个与广告创意先后相继的表现的过程、发展的过程、深化的过程,多存在于广告公司,企业宣传,新闻策划等。
基本信息中文名称文案外文名称Copy目录1发展历程2主要工作3分类构成4基本要求5工作范围6文案写法7实际应用折叠编辑本段发展历程汉字"文案"(wén àn)是指古代官衙中掌管档案、负责起草文书的幕友,亦指官署中的公文、书信等;在现代,文案的称呼主要用在商业领域,其意义与中国古代所说的文案是有区别的。
在中国古代,文案亦作" 文按"。
公文案卷。
《北堂书钞》卷六八引《汉杂事》:"先是公府掾多不视事,但以文案为务。
"《晋书·桓温传》:"机务不可停废,常行文按宜为限日。
" 唐戴叔伦《答崔载华》诗:"文案日成堆,愁眉拽不开。
"《资治通鉴·晋孝武帝太元十四年》:"诸曹皆得良吏以掌文按。
"《花月痕》第五一回:" 荷生觉得自己是替他掌文案。
GMP培训试题(1)

GMP培训试题(1)药品⽣产质量管理规范(G M P)(2010年版)试题(2011年7⽉)说明1、本试题满分为120分,考试时间为120分钟。
2、试卷分为填空题、单选题、多选题、判断题、名词解释、改正题、简答题等七类。
3、本试卷覆盖内容为2010年版GMP。
⼀、填空题(本部分共10⼩题,每空1分,共15分)【例】《药品⽣产质量管理规范(2010年修订)》⾃ 2011年3⽉1⽇起施⾏。
1、关键⼈员应当为企业的全职⼈员,⾄少应当包括企业负责⼈、⽣产管理负责⼈、质量管理负责⼈和质量受权⼈。
2、质量管理部门可以分别设⽴质量保证部门和质量控制部门。
3、主要固定管道应当标明内容物名称和流向。
4、质量风险管理是在整个产品⽣命周期中采⽤前瞻或回顾的⽅式,对质量风险进⾏评估、控制、沟通、审核的系统过程。
5、除稳定性较差的原辅料外,⽤于制剂⽣产的原辅料(不包括⽣产过程中使⽤的溶剂、⽓体或制药⽤⽔)和与药品直接接触的包装材料的留样应当⾄少保存⾄产品放⾏后⼆年。
6、⾮⽆菌原料药精制、⼲燥、粉碎、包装等⽣产操作的暴露环境应当按照 D级洁净区的要求设置。
7、⽆菌药品按⽣产⼯艺可分为两类:采⽤最终灭菌⼯艺的为最终灭菌产品;部分或全部⼯序采⽤⽆菌⽣产⼯艺的为⾮最终灭菌产品。
8、⽆菌药品⽣产所需的洁净区可分为以下 4 个级别。
9、注射剂浓配⼯序应当⾄少在 D级洁净区内完成。
10、⽣产⾎液制品⽤原料⾎浆的采集、检验、贮存和运输应当符合《中华⼈民共和国药典》中“⾎液制品⽣产⽤⼈⾎浆”的规定和卫⽣部《单采⾎浆站质量管理规范》。
⼆、单选题(本部分共10⼩题,每题都只有⼀个正确答案,每题1.5分,共15分)【例】《药品⽣产质量管理规范(2010年修订)》⾃起施⾏。
( D )A. 2011年6⽉1⽇B. 2011年5⽉1⽇C. 2011年4⽉1⽇D. 2011年3⽉1⽇11、洁净区与⾮洁净区之间、不同级别洁净区之间的压差应当不低于帕斯卡。
GMP洗瓶岗位试题库

1.注射用水表压力正常,但目测水压不足时,立即按F11停车,首先检查针头是否堵塞,如果堵塞,则疏通针头。如果针头没有堵塞,则通知电工检查节水阀是否异常。
12.每周生产结束后,用(绸布包住丝光毛巾蘸注射用水)擦隧道烘箱网带及(侧面小网带),注意(顺网带方向),以免将绸布磨掉毛,时间(不少于40分钟)。将隧道烘箱(冷却段和预热段层流罩)及(冷却段视窗)擦拭干净,至(光亮无污迹)。
13.。分装辅助与洗瓶辅助当面交接原粉时,首先按照(分装生产指令)逐字核对(原药批号),检查(原粉桶是否有磕碰后的凹坑、褶皱或破损),检查(原粉桶胶盖密封情况,封检章是否完整,胶盖是否破损),若是袋包装,则整袋检查原粉袋是否破损及密封情况,无误后再用(75%酒精清洁布)擦原粉桶/袋,擦好后整齐摆放在二缓的原粉架上,要求(原药批号朝外放置,以便核对,同时清点数量)(复方原粉需将每袋原粉重量相加,和生产指令的原粉总重核对是否一致)
每周生产结束后,用丝光毛巾擦洗干净后,用(1:256NPD溶液或0.1%新洁尔灭浸泡20分钟),再用清水冲洗干净,生产过程中(可以打开外盖加液封,禁止打开洁净地漏内盖,以免对环境产生污染)。
6.按照工艺要求,洗瓶岗位
压缩空气压力:0.06-0.12MP注射用水压力:0.10-0.20MP
循环水压力:0.20-0.25MP溢流压力:0.01-0.05MP。
29.在洁净区内进行设备维修时,如所规定的洁净度或无菌状态遭到破坏,应对该区域进行必要的清洁、消毒或灭菌后,方可重新开始生产操作。
30.在现实和可能条件下,生产设备及辅助装置的设计和安装方式,应便于在洁净区外操作、保养和维修。需灭菌的设备应尽可能在完全装配后进行灭菌。
31. A、B级区应使用灭菌的消毒剂和清洁剂。
GMP附录《无菌药品》试卷测试题库含答案

GMP附录《无菌药品》试卷测试题库含答案一、填空题(每空2分、共 30分):1.无菌药品是指法定药品标准中列有检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
[填空题] *_________________________________(答案:无菌)2.无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低、和的污染。
生产人员的、及其是达到上述目标的关键因素。
[填空题] *_________________________________(答案:微生物、各种微粒、热原、技能、所接受的培训、工作态度)3.无菌药品按生产工艺可分为两类,采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为。
[填空题] *_________________________________(答案:非最终灭菌产品)4.无菌药品生产所需的洁净区可分为以下4个级别: 。
[填空题] * _________________________________(答案:A级、B级、C级、D级)5.进入无菌生产区的生产用气体(如压缩空气、氮气,但不包括可燃性气体)均应经过,应当定期检查除菌过滤器和呼吸过滤器的完整性。
[填空题] *_________________________________(答案:除菌过滤)6.无菌生产工艺的验证应当包括试验。
此试验的首次验证,每班次应当连续进行3次合格试验。
[填空题] *_________________________________(答案:培养基模拟灌装)7.应当按照操作规程和,尽可能减少对洁净区的污染或将污染物带入洁净区。
[填空题] *_________________________________(答案:更衣、洗手)8.应当通过验证确认灭菌设备腔室内待灭菌产品和物品的。
[填空题] * _________________________________(答案:装载方式)10.无菌药品包装容器的密封性应当经过验证,避免产品遭受污染。
gmp洁净abcd分级标准

gmp洁净abcd分级标准
药厂洁净区可分为ABCD四个级别的区域,医药工业洁净区是以微粒和微生物为主要控制对象,同时还应对其环境温湿度、压差、照度、噪声等作出规定。
医药工业洁净厂房的空气洁净度等级见GMP(2010),规定为ABCD四个等级。
那么,药厂洁净区划分ABCD 级别的标准是什么呢?
A级:高风险操作区
如:灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域须均匀送风,风速为0.36-0.54m/s(指导值)。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级:指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级和D级:指生产无菌药品过程中重要程度较低的洁净操作区。
空气悬浮粒子按ABCD级别的标准规定如下表:
总结:A、B相当于百级洁净区,A的背景环境要高一些,要求更严一些。
C级相当于万级洁净区,D级相当于十万级洁净区。
为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米,A级洁净区空气悬浮粒子的级别为ISO4.8,以≥5.0um的悬浮粒子为限度标准。
B级洁净区(静态)空气悬浮粒子的级别为ISO5,同时包括表中两种粒径的悬浮粒子。
对于C级洁净区(静态和动态)而言,空气悬浮粒子的级别为ISO7和ISO8。
对于D级洁净区(静态)空气悬浮粒子的级别为ISO8。
测试方法可参照ISO14644-1。
制药空调净化系统基础知识

空调系统过滤器
中效过滤器 初效过滤器
高效过滤器
空调系统阀门
疏水阀
比例调节阀
自动风阀
空调系统常用仪表
微压差计
温湿度计
温湿度传感器
压差传感器
温湿度传感器
空调系统原理
臭氧发 生器
温湿 度探
头
空调系统组成
03
空调系统常见问题处理
温湿度异常
夏季(制冷季) 温度高:冷冻水供水温度、流量压力、蒸汽是否泄露。 湿度高:冷冻水供水温度、流量压力、蒸汽供应是否正常。 温度低:冷冻水阀门是否泄露。 湿度低:蒸汽阀门泄露。
洁净区换气次数要求
A级:无换气次数要求,但要求气流速度达 0.36-0.54m/s,且为单向流(层流)。
B级:40-60次/h C级:20-40次/h D级:10-20次/h
洁净区温湿度要求
当药品生产工艺有温湿度要求应根据工艺确定。生产 工艺无要求的企业可根据作业人员舒适度、产品特性、人 员数量及操作等条件综合确定。
温湿度Байду номын сангаас常
冬季(制热季) 温度低:蒸汽供应不足。 湿度低:加湿蒸汽供应不足、温度偏高。 温度高:蒸汽阀是否泄露。 湿度高:加湿蒸汽阀是否泄露、温度偏低。
压差异常
压差低:门未关严、彩钢板有泄露、总送风降低(滤网阻 塞)、高效过滤器堵塞、送风阀关小、排风阀开大、排风机 频率变大、排风箱过滤器破损、相对房间压力变小或变大等。
公司洁净区级别
药品生产质量管理规范(2010年)
第四十八条:口服液体和固体制剂、腔道用药(含直肠用药 )、表皮外用药 品等非无菌制剂生产的暴露工序区域及其直接接触药品的包装材料最终处 理的暴露工序区域,应当参照“无菌药品”附录中 D级洁净区的要求设置, 企业可根据产品的标准和特性对该区域采取适当的微生物监控措施。
gmp洁净abcd分级标准

可分为以下4个级别:A级高风险操作区,如:灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级和D级指生产无菌药品过程中重要程度较低的洁净操作区。
洁净区的空气又称洁净室的空气,是指悬浮粒子、微生物数控制在一定范围之内的区域空间的空气。
空气的洁净程度可以分成不同等级,各项科研、生产活动对空气的洁净程度也是不同的。
例如在细菌培养、细胞培养时对空气的洁净程度要求相对高一些,这些实验操作一般都在超净台中操作,我们可以认为超净台的空气接近无菌的。
概念释义悬浮粒子、微生物数控制在一定范围之内的区域空间的空气。
空气的洁净程度可以划分成不同的等级。
一般超净台灭菌后里面的空气是趋于无菌达到洁净的标准可进行相关的生物学实验操作。
药品生产对空气的洁净程度非常高,该区域叫做GMP洁净区,也是我们所谓的洁净区的空气。
GMP洁净区等级划分中国新版GMP洁净度级别-2010新版GMP洁净区等级划分:《药品生产质量管理规范(2010年修订)》(新版GMP)于2011年3月1日起施行,本文主要介绍新版GMP中关于洁净度等级中的A、B、C、D四个级别,以及新版GMP与98版中关于洁净度等级的区别。
GMP中A、B、C、D级控制上有动静态之分,而百级、万级、十万级则基本无动静态之分,两者之间有着明显的差异。
新版GMP参照ISO14644中规定具体标准如下:新版GMP采用了欧盟和最新WHO 的A、B、C、D分级标准,并对无菌药品生产的洁净度级别提出了非常具体的要求。
静态测量:是指所有设备均已安装就绪,但未运行且没有操作人员在现场的状态。
动态测量:是指生成设备均按预定的工艺模式运行且有规定数量的操作人员在现场操作的状态。
GMP常态化工作 无菌药品

无菌药品1、无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
2、无菌药品分为最终灭菌产品和非最终灭菌产品。
3、无菌药品生产中每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理物料被微粒或微生物污染的风险。
4、洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
5、无菌药品生产所需的洁净区可以分为以下四个级别:A级:高风险操作区B级:A级洁净区所处的背景区域C级和D级:指无菌药品生产过程中重要程度较低的操作步骤的区域6、A,B,C,D级空气悬浮粒子的标准为:洁净度级别悬浮粒子最大允许数\立方米静态动态≥0.5um≥5.0um≥0.5um≥5.0umA级352020352020 B级35202935200029007、应按要求对洁净区的悬浮粒子和微生物进行动态监测。
8、灌装或分装时,由于产品本身产生粒子或液滴,因此,允许灌装点≥5.0um 的悬浮粒子出现不符合标准的情况。
9、在A 级和B 级洁净区,连续或有规律的出现少量≥5.0um 的悬浮粒子时,应进行调查。
10、生产结束,操作人员撤离生产区并经15~20(指导值)分钟的自净时间后,洁净区内的悬浮粒子应达到上表中的“静态”标准。
11、微生物动态监测方法:沉降菌法、定量空气浮游菌采样法和表面取样法。
12、洁净区内微生物动态监测标准:洁净度级别浮游菌(cfu\m 3)沉降(Ø90mm )Cfu\4小时表面微生物接触(Ø55mm )Cfu\碟5指手套Cfu\手套A 级<1<1<1<1B 级10555C 级1005025-D 级20010050-注:表中各数值均为平均值;单个沉降碟的暴露时间可以少C 级3520002900352000029000D 级352000029000不作规定不作规定于4小时,同一位置可使用多个沉降碟连续进行监测并累计计数。
《药品生产质量管理规范(2010年修订)》附录:无菌药品

附录1:无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。
中国新版GMP洁净度级别新版GMP洁净区等级划分

中国新版G M P洁净度级别新版G M P洁净区等级划分Standardization of sany group #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#中国新版GMP洁净度级别-2010新版GMP洁净区等级划分《药品生产质量管理规范(2010年修订)》(新版GMP)于2011年3月1日起施行,本文主要介绍新版GMP中关于洁净度等级中的A、B、C、D四个级别,以及新版GMP与98版中关于洁净度等级的区别。
GMP中A、B、C、D级控制上有动静态之分,而百级、万级、十万级则基本无动静态之分,两者之间有着明显的差异。
新版GMP参照ISO14644中规定具体标准如下:新版GMP采用了欧盟和最新WHO的A、B、C、D分级标准,并对无菌药品生产的洁净度级别提出了非常具体的要求。
静态测量:是指所有设备均已安装就绪,但未运行且没有操作人员在现场的状态。
动态测量:是指生成设备均按预定的工艺模式运行且有规定数量的操作人员在现场操作的状态。
无菌药品的生产所需的洁净区可以分为4个级别: 2010新版GMP洁净区等级划分A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
?B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区中国 GMP(2010修订)2010年版GMP附录1 无菌药品,第三章,第九条……洁净区各级别空气悬浮粒子的标准规定如下表:新版GMP洁净度等级A、B、C、DA级洁净区?洁净操作区的空气温度应为20-24℃?洁净操作区的空气相对湿度应为45%-60%?操作区的风速:水平风速≥s?垂直风速≥s?高效过滤器的检漏大于%?照度:>300lx-600lx?噪音:≤75db(动态测试)B级洁净区?洁净操作区的空气温度应为20-24℃?洁净操作区的空气相对湿度应为45%-60%?房间换气次数:≥25次/h压差:?B级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
新版GMP附录1无菌药品考试及抢答题和应

药品生产质量管理规范(2010年版)附录1 无菌药品考试题部门:姓名:日期:分数:一、填空题(每空1分,共45分)1.无菌药品是指法定药品标准中列有检查项目的制剂和原料药,包括无菌制剂和。
2.无菌药品的生产须满足其质量和预定用途的要求,应当、和的污染。
、及其是达到上述目标的关键因素。
3.无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当并监测压差。
4.洁净区的设计必须符合相应的要求,包括达到和的标准。
5.无菌药品生产所需的洁净区可分为那4个级别::A级区单向流系统在其工作区域必须均匀送风,风速为。
6.生产操作全部结束、操作人员撤出生产现场并经自净后,洁净区的悬浮粒子应当达到表中的“静态”标准。
7.评估无菌生产的微生物状况的监测方法有、和等。
8.无菌生产的隔离操作器所处的环境至少应为洁净区。
9.凡在洁净区工作的人员(包括清洁工和设备维修工)应当定期,使无菌药品的操作符合要求。
培训的内容应当包括和方面的基础知识。
未受培训的外部人员(如外部施工人员或维修人员)在生产期间需进入洁净区时,应当对他们进行特别详细的是。
10.从事无菌药品生产的员工应当随时报告任何可能的异常情况,包括污染的类型和程度。
11.工作服及其质量应当与及相适应,其式样和穿着方式应当能够满足保护产品和人员的要求。
12.A/B级洁净区的着装要求:应当用将所有头发以及胡须等相关部位全部遮盖,应当塞进衣领内,应当戴以防散发飞沫,必要时戴防护目镜。
13.个人外衣不得带入通向B级或C级洁净区的更衣室。
每位员工每次进入A/B级洁净区,应当。
14.无菌生产的洁净区内禁止设置水池和地漏。
15.气锁间两侧的门同时打开。
16.关键设备,如灭菌柜、空气净化系统和工艺用水系统等,应当经过,并进行计划性维护,经方可使用。
17.无菌原料药精制、无菌药品配制、直接接触药品的包装材料和器具等最终清洗、A/B级洁净区内消毒剂和清洁剂配制的用水应当符合的质量标准。
药厂洁净区划分ABCD

ABCD洁净区环境要求
A级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%操作区的风速:水平风速≥0.54m/s 垂直风速≥0.36m/s高效过滤器的检漏大于99.97%照度:>300lx-600lx噪音:≤75db(动态测试)
药厂洁净区划分ABCD
导读:药厂洁净区划分ABCD,医药工业洁净室和洁净区是以微粒和微生物为主要控制对象,同时还应对其环境温度、湿度、GMP (2010)压差、照度、噪声等作出规定。
医药工业洁净厂房的空气洁净度等级的划分见GMP(2010),规定为ABCD四个等级药厂洁净区划分ABCD:
A级:高风险操作区,如:.灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。通常用层流操作台(罩)来维持该区的环境状态。层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。应有数据证明层流的状态并须验证。在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h压差:B级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。高效过滤器的检漏大于99.97%照度:>300lx-600lx噪音:≤75db(动态测试)
C级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h压差:C级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。高效过滤器的检漏大于99.97%照度:>300lx-600lx噪音:≤75db(动态测试)
中国新版GMP洁净度级别新版GMP洁净区等级划分

中国新版GMP洁净度级别-2010新版GMP洁净区等级划分药品生产质量管理规范2010年修订新版GMP于2011年3月1日起施行,本文主要介绍新版GMP中关于洁净度等级中的A、B、C、D四个级别,以及新版GMP与98版中关于洁净度等级的区别;GMP中A、B、C、D级控制上有动静态之分,而百级、万级、十万级则基本无动静态之分,两者之间有着明显的差异;新版GMP参照ISO14644中规定具体标准如下:新版GMP采用了欧盟和最新WHO的A、B、C、D分级标准,并对无菌药品生产的洁净度级别提出了非常具体的要求;静态测量:是指所有设备均已安装就绪,但未运行且没有操作人员在现场的状态;动态测量:是指生成设备均按预定的工艺模式运行且有规定数量的操作人员在现场操作的状态;无菌药品的生产所需的洁净区可以分为4个级别: 2010新版GMP洁净区等级划分A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台罩维持该区的环境状态;单向流系统在其工作区域必须均匀送风,风速为指导值;应当有数据证明单向流的状态并经过验证;在密闭的隔离操作器或手套箱内,可使用较低的风速;B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域;C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区中国 GMP2010修订2010年版GMP附录1 无菌药品,第三章,第九条……洁净区各级别空气悬浮粒子的标准规定如下表:新版GMP洁净度等级A、B、C、DA级洁净区洁净操作区的空气温度应为20-24℃洁净操作区的空气相对湿度应为45%-60%操作区的风速:水平风速≥s垂直风速≥s高效过滤器的检漏大于%照度:>300lx-600lx噪音:≤75db动态测试B级洁净区洁净操作区的空气温度应为20-24℃洁净操作区的空气相对湿度应为45%-60%房间换气次数:≥25次/h压差:B级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差;高效过滤器的检漏大于%照度:>300lx-600lx噪音:≤75db动态测试C级洁净区洁净操作区的空气温度应为20-24℃洁净操作区的空气相对湿度应为45%-60%房间换气次数:≥25次/h压差:C级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差; 高效过滤器的检漏大于%照度:>300lx-600lx噪音:≤75db动态测试D级洁净区洁净操作区的空气温度应为18-26℃洁净操作区的空气相对湿度应为45%-60%房间换气次数:≥15次/h压差:100,000级区相对室外≥10Pa,高效过滤器的检漏大于%照度:>300lx-600lx噪音:≤75db动态测试。
gmp车间洁净度等级标准

gmp车间洁净度等级标准GMP车间的洁净度标准一般分为ABCD四个等级,不同等级的洁净程度不同,一般由药品的生产工艺来决定应该应该使用哪种标准的洁净车间,不同等级的洁净车间的适用范围也有所不同。
洁净度A级用于高风险作业区,如:灌装区、放胶塞区、敞口包装容器区和无菌装配区等区域。
其单向流区工作区必须均匀送风,其风速为0.36m/s~0.54m/s。
确认A级,每个测点的采样量不得少于1m3。
洁净度为ISO4.8级,并以≥5.0m悬浮粒子的浓度为限度标准。
采样管的长度要短,以勉≥5.0?m的粒子沉降,影响测试结果。
单向流应采用等动力采样。
2、B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
B级的适用范围:洁净度B级用于洁净度A级区域的背景区域。
静态洁净度为ISO5级。
3、C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
C级和D级的适用范围:C级和D级用于无菌药品生产过程中工艺要求洁净较低的区域。
C级静态和动态分别为ISO7级和ISO8级。
D级静态为ISO8级。
动态可采用培养基模拟灌装过程以证明达到动态洁净度级别。
GMP洁净车间空气洁净度等级,“药品生产质量管理规范”(GMP)中规定:药品生产的洁净厂房内的生产环境参数。
如:温度和相对湿度以及压差等均是由生产工艺决定的,一般温度为18℃~24℃,相对湿度为45%~65%。
在“药品生产质量管理规范”(GMP)的实施指南中规定的比较具体。
即药品生产洁净厂房中的温度和相对湿度是以穿洁净工作服的操作人员不产生不舒服、不舒适为基准的。
1、A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域。
应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
药厂洁净区划分ABCD

药厂洁净区划分ABCD药厂洁净区划分ABCD导读:药厂洁净区划分ABCD,医药工业洁净室和洁净区是以微粒和微生物为主要控制对象,同时还应对其环境温度、湿度、GMP (2010)压差、照度、噪声等作出规定。
医药工业洁净厂房的空气洁净度等级的划分见GMP(2010),规定为ABCD四个等级药厂洁净区划分ABCD:A级:高风险操作区,如:.灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级:指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级和D级:指生产无菌药品过程中重要程度较低的洁净操作区。
洁净度级别悬浮粒子最大允许数/m³静态动态≥0.5μm≥5μm≥0.5μm≥5μmA级352020352020B级3520293520002900C级3520002900352000029000D级352000029000不作规定不作规定A、B相当于百级,A的背景环境要高一些,要求更严一些。
C级相当于万级D 级相当于十万级制药厂ABCD洁净区环境要求A级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%操作区的风速:水平风速≥0.54m/s 垂直风速≥0.36m/s高效过滤器的检漏大于99.97%照度:>300lx-600lx噪音:≤75db(动态测试)B级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h 压差:B级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
高效过滤器的检漏大于99.97%照度: >300lx-600lx噪音:≤75db(动态测试)C级洁净区洁净操作区的空气温度应为 20-24℃洁净操作区的空气相对湿度应为 45%-60%房间换气次数:≥25次/h 压差:C级区相对室外≥10Pa,同一级别的不同区域按气流流向应保持一定的压差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
09版GMP无菌及非无菌要求的制剂生产洁净度要求
无菌药品生产所需的洁净区可分为以下4个级别:
A级:相当于100级(层流)
高风险操作区,如:灌装区、放置胶塞桶、敞口安瓿瓶、敞口西林瓶的区域及无菌装配或连接操作的区域。
通常用层流操作台(罩)来维持该区的环境状态。
层流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s。
应有数据证明层流的状态并须验证。
在密闭的隔离操作器或手套箱内,可使用单向流或较低的风速。
B级:相当于100级(动态)
指无菌配制和灌装等高风险操作A级区所处的背景区域。
C级(相当于10,000级)和D级(相当于100,000级)
指生产无菌药品过程中重要程度较次的洁净操作区。
注:
(a)指根据光散射悬浮粒子测试法,在指定点测得等于和/或大于粒径标准的空气悬浮粒子浓度。
应对A级区“动态”的悬浮粒子进行频繁测定,并建议对B级区“动态”也进行频繁测定。
A级区和B级区空气总的采样量不得少于1米3,C级区也宜达到此标准。
(b)生产操作全部结束,操作人员撤离生产现场并经15~20分钟自净后,洁净区的悬浮粒子应达到表中的“静态”标准。
药品或敞口容器直接暴露环境的悬浮粒子动态测试结果应达到表中A级的标准。
灌装时,产品的粒子或微小液珠会干扰灌装点的测试结果,可允许这种情况下的测试结果并不始终符合标准。
(c)为了达到B、C、D级区的要求,空气换气次数应根据房间的功能、室内的设备和操作人员数决定。
空调净化系统应当配有适当的终端过滤器,如:A、B和C级区应采用不同过滤效率的高效过滤器(HEPA)。
(d)本附录中“静态”及“动态”条件下悬浮粒子最大允许数基本上对应于ISO14644-1
0.5μm悬浮粒子的洁净度级别。
(e)这些区域应完全没有大于或等于5μm的悬浮粒子,由于无法从统计意义上证明不存在任何悬浮粒子,因此将标准设成1个/米3,但考虑到电子噪声、光散射及二者并发所致的误报因素,可采用20个/米3的限度标准。
在进行洁净区确认时,应达到规定的标准。
(f)须根据生产操作的性质来决定洁净区的要求和限度。
温度、相对湿度等其它指标取决于产品及生产操作的性质,这些参数不应对规定的洁净度造成不良影响。
洁净区微生物监控的动态标准(a)如下:
注:
(a)表中各数值均为平均值。
(b)可使用多个沉降碟连续进行监控,但单个沉降碟的暴露时间可以少于4小时。
第十三条无菌药品的生产操作应在符合下表中规定的相应级别的洁净区内进行,未列出的操作可参照下表在适当级别的洁净区内进行:
注:
(a)此处的高污染风险是指产品容易长菌、灌装速度很慢、灌装用容器为广口瓶、容器须暴露数秒后方可密闭等状况;
(b)此处的高污染风险是指产品容易长菌、配制后需等待较长时间方可灭菌或不在密闭容器中配制等状况。
非无菌操作:
口服液体、固体、腔道用药(含直肠用药)、表皮外用药品、非无菌的眼用制剂暴露工序及其直接接触药品的包装材料最终处理的暴露工序区域,应参照“无菌药品”附录中D级洁净区的要求设置与管理。
3.5 高效过滤器尺寸
3.5.1 中国经典484系列
1965年,国产高效过滤器亮相于蚌埠,它的外形尺寸为484×484×220mm。
当时,研制者设计的安装模数为500×500mm,考虑到需预留周边吊杆的位置,确定了过滤器的断面为484×484mm。
另一种说法是,当时测绘了一只英国过滤器,它的尺寸是484×484mm。
484mm尺寸过滤器的早期商品代号是GS-01和GB-01。
其中,S代表“石棉纤维”,B 代表“玻璃纤维”,G代表“过滤器”,01代表边框长484mm。
这里的GB与今天人们说的“国标”毫不相干。
484mm是中国高效过滤器的经典。
在相当长的时间内,484×484×220mm是国产高效过
滤器的主流。
3.5.2 中国630系列
中国高效过滤器的另一流行尺寸为630×630×220mm。
与484mm产生的背景类似,研制者确定的安装模数为650mm,减去安装间隙,就成了630mm。
630mm的派生尺寸为315mm,945mm和1260mm。
630mm过滤器的早期商品代号为GS-03和GB-03,其中03代表边框长630mm。
3.5.3 中国特有的320mm
320×320×260mm过滤器的早期商品代号为GS-02和GB-02。
这一规格曾与484mm和630mm系列并存,但现在已经很少见了,偶尔遇到,过滤器的厚度也不再是260mm而是220mm。
3.5.4 不成功的国标尺寸
在1992年的一份国家标准中,标准的制定者规定高效过滤器的外框边长为:400、500、600、700、800、900mm。
这套标准尺寸从未得到过市场的认可,连标准起草者们也不按那套尺寸去要求他们自己参与的工程项目。
3.5.5 国际流行的610mm
自20世纪40年代高效过滤器问世以来,发达国家的高效过滤器外框宽度始终以610mm (24英寸)为主。
80年代,进口过滤器随成套设备进入中国。
90年代,610mm这一尺寸在国内流行。
今天,610mm反客为主。
610mm的派生尺寸为203、305、762、915、1219、1524、1829mm(8”,12”,30”,36”,48”,60”,72”)。
610系列传统有隔板过滤器的厚度有292mm和150 mm两种,后者主要用于洁净室末端过滤器。
现在,平板式无隔板高效过滤器取代了传统有隔板过滤器在洁净室中的位置,平板式高效过滤器的厚度多在65~100之间。
空调器内使用的高效过滤器的厚度仍是292mm。
宽度尺寸为610mm和305mm两种,有些过滤器以610mm和305mm为安装模数,实际尺寸略小些。
3.5.6 高效过滤器的额定风量
习惯上,国产484×484×220mm过滤器的额定风量标为1000m3/h,630×630×220mm 过滤器的额定风量为1500m3/h,320×320×260mm过滤器额定风量为500m3/h。
这些额定风量其实是最大允许风量,实际使用中人们经常对这些额定数据打折扣。
许多客户按风量论价钱,因此卖过滤器的人不会主动挤掉额定数据中的“水分”。
搞设计的人对制造者的大话已经听惯了,设计时乘个“保险系数”将水分挤掉就可以了。
610mm系列过滤器的风量数据比较实在,一般无须考虑保险系数。
单向流洁净室过滤风速一般在0.2~0.5m/s之间,过滤器测试是在0.45m/s的条件下进行的。
这时的过滤器讲的是额定风速,而不再是额定风量。
3.5.7 设计师的对策
今后若干年内,610mm、484mm、630mm、三套尺寸系列会在中国并存。
鉴于此,设计师可按照自己的偏好,在这三套系列中任选其一。
但是,要避免在同一工程中混用不同尺寸系列的过滤器,因为那样会给设计、施工、以及日后的维护和备件选购带来麻烦。
