高中化学选修三 全套课件
合集下载
人教版高中化学选修三课件:物质结构与性质 (共46张PPT)

例题5
(4)请用原子结构的知识解释C燃烧时发出
黄色的原因:
。
燃烧时,电子获得能量从能量低的轨道
跃迁到能量高的轨道上,跃迁到能量高的轨
道的电子处于不稳定状态,随即跃迁回原来
轨道,并向外界释放能量(光能)
2
微
粒 间
化学 键
作
用
与
物
质
的
分子
性
性质
质
共价键
配位键和配位 化合物 金属键
σ键和π键 键参数 杂化轨道理论
例题4
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高
化合价氧化物的水
化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分
子呈正四面体结构,W的氧化物的晶体类型
是
;
(2)Q的具有相同化合价且可以相互转变的氧化物
是
;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物
(子Cu4。2)+已形往知成硫N配酸F3离铜与子溶N,H液3其的中原空加因间入是构过_型量__都氨_是水__三,__角可__锥生__形成_,_[C_单u。(NNFH32不)2]易2+与配离 解析:NF3分子中氟原子非金属性强是吸电子的,使得 氮原子上的孤对电子难于与Cu2+形成配位键。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请 解释原因__________。 解析: Cu2O和Cu2S均为离子化合物,离子化合物的熔点 与离子键的强弱有关。 由于氧离子的例子半径小于硫离子的离子半径,所以亚铜 离子与氧离子形成的离 子点键比C强u于2S亚的铜高离。子与硫离子形成的离子键,所以Cu2O的熔
A.共价键的方向性 B.共价键的饱和性 C.共价键原子的大小 D.共价键的稳定性
23离子键、配位键与金属键-安徽省太和第一中学高中化学选修三教学课件(共45张PPT)

离子键、配位键与金属键
3、离子键的特征 (1)无方向性
Na+Cl-CNl- aN+ CaN+lNa- +Ca+l- Na+ CNla- +CNal-CNC+ NlalC--+alN-+ CaCN+lla--+CNlaC-+l-Na+
氯化钠晶体的结构
离子键、配位键与金属键
(2)无饱和性
氯化钠晶体的结构
2、配合物
配体有 孤电子对
配位键的存在是配合物与其它物质最本质的区别。
离子键、配位键与金属键
(1)概念:由提供孤电子对的配体与接受孤电子对的中心原子 以配位键结合形成的化合物称为配合物。
离子键、配位键与金属键
内界(配离子)
Cu(NH3)4 2 + SO42-
中 配配 心 位位 原 原体 子子
配 位 数
(3)结构表示式 A→B
其中,A表示能够提供孤对电子的原子,B表示具有能够接受孤对电 子的空轨道的原子。
H
例: [H N H]+
H 练习:写出水合氢离子的电子式和结构式。
(4)配位键是一种特殊的共价键。
离子键、配位键与金属键
(5)配位键与共价键的区别与联系 ①配位键一定是共价键,但共价键不一定是配位键。 ②配位键与共价键只是在形成过程上有所不同:但形成后与其他
离子键、配位键与金属键
由于离子键没有方向性和饱和性,因此以离子键相结合的化合物 倾向于形成晶体,使每个离子周围排列尽可能多的带异性电荷的 离子,达到降低体系能量的目的。
注意:阳离子与阴离子半径比值越大,离子周围所能容纳带异性电 荷离子的数目就越多。
人教版高中化学选修三《物质结构与性质》优质课件【全套】

1926年,奥地利物理学家薛定谔等 以量子力学为基础提出电子云模型
质子(正电) 原子核 原子 (正电) 中子(不带电)
不显 电性 核外电子 分层排布
(负电) 与物质化学性质密切相关
学与问
核外电子是怎样排布的?
二、能层与能级
1、能层
电子层
能层名称 一 二 三 四 五 六 七 能层符号 K L M N O P Q
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
32
数 2n2 2n2
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s
→ 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
一、开天辟地——原子的诞生
1、原子的诞生
宇宙大爆炸2小时:大量氢原子、少量氦原子 极少量锂原子
140亿年后的今天: 氢原子占88.6% 氦原子为氢原子数1/8 其他原球中的元素
绝大多数为金属元素 包括稀有气体在内的非金属仅22种 地壳中含量在前五位:O、Si、Al、Fe、Ca
22 钛 Ti 1s2 2s22p6 3s23p63d2 4s2
序数 名称 符号 K
L
M
N
1 氢 H 1s1
2 氦 He 1s2
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5
硼
B 1s2 2s22p1
6
人教版高中化学选修3课件-原子结构与元素周期表

知识点二 元素周期表的分区
1.根据原子的外层电子结构特征分区 (1)周期表中的元素可根据原子的外层电子结构特征划分为 如下图所示的 5 个区。
①s 区元素:最外层只有 1~2 个 s 电子,价电子分布在 s 轨道上,价电子构型为 ns1~2,包括ⅠA 族、ⅡA 族的所有元素。
②p 区元素:最外层除有两个 s 电子外,还有 1~6 个 p 电 子(He 无 p 电子),价电子构型为 ns2np1~6,包括ⅢA→ⅦA 族和 零族的所有元素。
a.元素的分区规律:按照元素的原子核外电子最后排布的能 级分区,如 s 区元素的原子的核外电子最后排布在 ns 能级上,d 区、ds 区元素的原子核外电子最后排布在n-1d 能级上。
b.s 区、p 区均为主族元素包括稀有气体,且除 H 外,非 金属元素均位于 p 区。
c.应根据外围电子排布判断元素的分区,不能根据最外层电 子排布判断元素的分区。p 区中,He 的外围电子排布1s2较特 殊。
第一章
原子结构与性质
第二节 原子结构与元素的性质
第一课时 原子结构与元素周期表
[学习目标] 1.通过碱金属和稀有气体的元素核外电子排布 对比进一步认识电子排布和价电子层的含义。
2.通过元素周期表认识周期表中各区、各周期、各族元素 原子核外电子的排布规律。
3.通过“螺壳上的螺旋”体会周期表中各区、各周期、各 族元素的原子结构和位置间的关系。
①原子序数-稀有气体原子序数(相近且小)=元素所在的 纵行数。第 1、2 纵行为ⅠA、ⅡA 族,第 3~7 纵行为ⅢB~ⅦB 族,第 8~10 纵行为Ⅷ族,第 11、12 纵行为ⅠB、ⅡB 族,第 13~17 纵行为ⅢA~ⅦA 族,第 18 纵行为 0 族。而该元素的周 期数=稀有气体元素的周期数+1。
高中化学鲁科版选修三课件:第2章 第1节 共价键模型(32张PPT)

方向性。
( ×)
2.下列物质的分子中既含有 σ 键,又含有 π 键的是 ( )
①CH4 ②NH3 ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③ B.③④⑤⑥
C.①③⑥ D.③⑤⑥
解析:
答案:
3.下列物质中,只有极性键的是_②__③__⑤__⑥___,只有非极性键的是 _①___,既含有极性键,又含有非极性键的是_④__⑦____。 ①H2 ②HCl ③NH3 ④H2O2 ⑤CO2 ⑥CCl4 ⑦C2H6 解析:同种元素的原子间形成非极性键,不同种元素的原子间形 成极性键,H2O2 的 2 个氧原子间存在非极性键,C2H6 分子中碳 原子间存在非极性键。
2. N≡N 的键能 为 945 kJ·mol-1, N—N 单键 的键能为 160 kJ·mol-1,计算说明 N2 中的___π___键比___σ___键稳定 (填“σ”或“π”)。 解析:N≡N 中有一个 σ 键和两个 π 键,其中 σ 键的键能是 160 kJ·mol - 1, 则 π 键 键 能 =945-2 160 kJ·mol- 1=392.5 kJ·mol-1,键能越大,共价键越稳定,故 π 键比 σ 键稳定。
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2021/11/192021/11/192021/11/192021/11/19
1.σ 键和 π 键的区别是什么? 提示:σ 键是原子轨道“头碰头”重叠成键,π 键是原子轨道 “肩并肩”重叠成键。 2.σ 键是否一定比 π 键强度大? 提示:否。
3.极性键和非极性键的区别是什么? 提示:前者成键的共用电子对发生偏移,后者成键的共用 电子对不发生偏移。
人教版高中化学选修三课件:第一章 第二节 第二课时 元素周期律(29张PPT)

电负性
1.电负性 (1)概念 ①键合电子:原子中用于形成 化学键 的电子。 ②电负性:用来描述不同元素的原子对 键合电子 吸引力 的大小。电负性越大的原子,对键合电子的吸引力 越大 。 (2)衡量标准 电负性是由美国化学家 鲍林 提出的,他以氟的电负性为 4.0 作为相对标准,得出了各元素的电负性。
5.已知元素的电负性和原子半径一样,也是元素的一种基本性质,下表给
出14种元素的电负性:
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8
1.离子半径大小比较的规律 (1)同种元素的离子半径:阴离子大于原子,原子大于阳离 子,低价阳离子大于高价阳离子。如r(Cl-)>r(Cl),r(Fe)>r(Fe2+) >r(Fe3+)。 (2)电子层结构相同的离子,核电荷数越大,半径越小。如 r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。 (3)带相同电荷的离子,电子层数越多,半径越大。如r(Li+) <r(Na+)<r(K+)<r(Rb+)<r(Cs+),r(O2-)<r(S2-)<r(Se2-)<r(Te2-)。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)电负性是人为规定的一个相对数值,不是绝对标准 ( √ )
(2)元素电负性的大小反映了元素对键合电子引力的大小( √ )
(3)元素的电负性越大,则元素的非金属性越强
ቤተ መጻሕፍቲ ባይዱ
(√ )
(4)同一周期电负性最大为稀有气体元素
人教版高中化学选修三课件:第三章 第一节 晶体的常识(26张PPT)

谢谢观赏
You made my day!
我们,还在路上……
解析:甲中X位于立方体体心,有1个,Y位于立方体的
顶点,实际有
1 8
×4=
1 2
个,N(X)∶N(Y)=1∶
1 2
=2∶1,
故甲的化学式为X2Y;乙中A有
1 8
×8=1个,B有
1 2
×6
=3个,C在体心,有1个,故N(A)∶N(B)∶N(C)=
1∶3∶1;丙中D点被8个同样的晶胞共用,故结合E的个
解析
解析:晶胞中的粒子分为4种:①体心上的粒
子完全属于该晶胞;②面心上的粒子
1 2
属于该
晶胞;③棱上的粒子
1 4
属于该晶胞;④顶点上
的粒子
1 8
属于该晶胞。本题粒子Y位于体心,粒子X位于顶
点,所以该晶体的化学式为Y2X(或XY2)。观察图,4个X和1
个Y构成了一个正四面体,故∠XYX=109°28′。
D.粉末状固体一定不是晶体 解析:晶体的特点有:内部粒子排列得高度有序性、
有自范性和各向异性。当晶体的晶粒较小时,即为粉
末状,故D不正确。
答案:D
3.某物质的晶体内部一截面上原子的排布情况
如右图所示,则该晶体的化学式可表示为
()
A.A2B
B.AB
C.AB2
D.A3B
解析:由该晶体一截面上原子的排布情况可知,每一个A
数是8个。
返回
“课时跟踪检测”见“课时跟踪检测(九)” (单击进入电子文档)
•不习惯读书进修的人,常会自满于现状,觉得没有什么事情需要学习,于是他们不进则退2022年4月13日星期三2022/4/132022/4/132022/4/13 •读书,永远不恨其晚。晚比永远不读强。2022年4月2022/4/132022/4/132022/4/134/13/2022 •正确的略读可使人用很少的时间接触大量的文献,并挑选出有意义的部分。2022/4/132022/4/13April 13, 2022 •书籍是屹立在时间的汪洋大海中的灯塔。
You made my day!
我们,还在路上……
解析:甲中X位于立方体体心,有1个,Y位于立方体的
顶点,实际有
1 8
×4=
1 2
个,N(X)∶N(Y)=1∶
1 2
=2∶1,
故甲的化学式为X2Y;乙中A有
1 8
×8=1个,B有
1 2
×6
=3个,C在体心,有1个,故N(A)∶N(B)∶N(C)=
1∶3∶1;丙中D点被8个同样的晶胞共用,故结合E的个
解析
解析:晶胞中的粒子分为4种:①体心上的粒
子完全属于该晶胞;②面心上的粒子
1 2
属于该
晶胞;③棱上的粒子
1 4
属于该晶胞;④顶点上
的粒子
1 8
属于该晶胞。本题粒子Y位于体心,粒子X位于顶
点,所以该晶体的化学式为Y2X(或XY2)。观察图,4个X和1
个Y构成了一个正四面体,故∠XYX=109°28′。
D.粉末状固体一定不是晶体 解析:晶体的特点有:内部粒子排列得高度有序性、
有自范性和各向异性。当晶体的晶粒较小时,即为粉
末状,故D不正确。
答案:D
3.某物质的晶体内部一截面上原子的排布情况
如右图所示,则该晶体的化学式可表示为
()
A.A2B
B.AB
C.AB2
D.A3B
解析:由该晶体一截面上原子的排布情况可知,每一个A
数是8个。
返回
“课时跟踪检测”见“课时跟踪检测(九)” (单击进入电子文档)
•不习惯读书进修的人,常会自满于现状,觉得没有什么事情需要学习,于是他们不进则退2022年4月13日星期三2022/4/132022/4/132022/4/13 •读书,永远不恨其晚。晚比永远不读强。2022年4月2022/4/132022/4/132022/4/134/13/2022 •正确的略读可使人用很少的时间接触大量的文献,并挑选出有意义的部分。2022/4/132022/4/13April 13, 2022 •书籍是屹立在时间的汪洋大海中的灯塔。
高中化学选修三全套课件共201张PPT)

气态氢化物的稳定性
越稳定,非金属性越强 最高价氧化物对应水化物——最高价含氧酸
酸性强弱
酸性越强,非金属性越强
5、化合价
主族元素族序数=最高正价=价电子数 F、O
非金属最低负化合价=主族元素族序数—8
同周期的主族元素从左至右 化合价由+1→+7, -4 →0递增 巩固练习见资料
第二章 分子的结构与性质
b.电子云扩展程度 同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态 ②原子轨道与能级 ndz2轨道 ns轨道 ns能级 ndx2 y2轨道 npx轨道 简 并 nd 能级 np 轨道 ndxy轨道 y np能级 轨 ndxz轨道 npz轨道 道 ndyz轨道
复习 元素:具有相同核电荷数的一类原子的总称 核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子 核电荷数=核内质子数=核外电子数=原子序数
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表 (一课时)
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
—
同一能级中的轨道能量相等,称为简并轨道
③原子轨道的电子云轮廓图
s轨道的电子云轮廓图 npx轨道电 子云轮廓图 npy轨道电 子云轮廓图 npz轨道电 子云轮廓图
nd轨道电子云轮廓图
五、泡利原理和洪特规则
核外电子的基本特征 主量子数 角量子数 磁量子数
量 子 化 描 述
能层
能级 轨道 自旋
大范围 小范围
3、原子的认识过程
古希腊哲学家留基伯和德谟克立特
化学选修三《原子结构与元素的性质》PPT课件(原文)

❖ 5、掌握原子半径的变化规律 ❖ 6、能说出元素电离能的涵义,能应用元素的电离
能说明元素的某些性质
❖ 7、进一步形成有关物质结构的基本观念,初步认 识物质的结构与性质之间的关系
❖ 8、认识主族元素电离能的变化与核外电子排布的 关系
❖ 9、认识原子结构与元素周期系的关系,了解元素 周期系的应用价值
(G)碱 酸 s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
最高价氧化物对应的水化物的酸性逐渐
;
(横行) 第6周期:32 种元素 查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这
些元素的电负性解释对角线规则。
元素(除第一周期外)是 __碱_金__属___, 1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
试确定32号元素在周期表中的位置。 d区元素:包含第IIIB族到VIII族元素。
最外层电
子排布为_n_s____,每一周期的最后一种元素都 1 每个纵行的价电子层的电子总数是否相等?主族元素的价电子数和族序数有何关系?
样多,而是随着周期序号的递增渐渐增多。
元素周期系周期发展像螺壳上的螺旋
一、原子结构与元素周期表
1. 为什么副族元素又称为过渡元素?
副族元素处于金属元素向非金属元素过渡的 区域,因此,又把副族元素称为过渡元素。
2.为什么在元素周期表中非金属元素主要集中在右上角 三角区内(如图)?处于非金属三角区边缘的元素常被 称为半金属或准金属。为什么?
镧 La – 镥 Lu 共15 种元素称镧系元素 已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
电负性相差不大的两种非金属元素化合,通常形成共价键;
能说明元素的某些性质
❖ 7、进一步形成有关物质结构的基本观念,初步认 识物质的结构与性质之间的关系
❖ 8、认识主族元素电离能的变化与核外电子排布的 关系
❖ 9、认识原子结构与元素周期系的关系,了解元素 周期系的应用价值
(G)碱 酸 s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
最高价氧化物对应的水化物的酸性逐渐
;
(横行) 第6周期:32 种元素 查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这
些元素的电负性解释对角线规则。
元素(除第一周期外)是 __碱_金__属___, 1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
试确定32号元素在周期表中的位置。 d区元素:包含第IIIB族到VIII族元素。
最外层电
子排布为_n_s____,每一周期的最后一种元素都 1 每个纵行的价电子层的电子总数是否相等?主族元素的价电子数和族序数有何关系?
样多,而是随着周期序号的递增渐渐增多。
元素周期系周期发展像螺壳上的螺旋
一、原子结构与元素周期表
1. 为什么副族元素又称为过渡元素?
副族元素处于金属元素向非金属元素过渡的 区域,因此,又把副族元素称为过渡元素。
2.为什么在元素周期表中非金属元素主要集中在右上角 三角区内(如图)?处于非金属三角区边缘的元素常被 称为半金属或准金属。为什么?
镧 La – 镥 Lu 共15 种元素称镧系元素 已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
电负性相差不大的两种非金属元素化合,通常形成共价键;
2020高中化学人教版选修三教学课件:1-1-1 能层与能级 构造原理与电子排布式(共49张)

④次外层电子数目不能超过 18 个(K 层为次外层时不能
超过 2 个),倒数第三层电子数目不能超过 32 个。
(说明:以上规律是互相联系的,不能孤立地理解。)
(2)能级交错现象
由构造原理可知,从第三层开始各能级不完全遵循能层顺
序,产生能级交错排列,即产生“能级交错现象”。
如 : E3d >
E4s , E5d >
课堂互动探究 K
师生互动 合作探究
知识点一 能层与能级
1.能层 多电子原子中,原子核外电子是分层排布的。请完成下表:
2.能级
(1)任一能层的能级都是从 s 能级开始,能级数目等于
该 能层序数 。N 能层有
4 个能级,能级符号依次为
4s、4p、4d、4f 4d、4f 能层最多容纳的电子数为: 10 、
(2)电子排布式:
①电子排布式是用核外电子分布的能级及各能级上的电子
数 表 示 电 子 排 布 的 式 子 。 如 Al 原 子 的 电 子 排 布 式 是
1s22s22p63s23p1,Ca 原子的电子排布式是 1s22s22p63s23p64s2。
②简化电子排布式:将电子排布式中的内层电子排布用相应 的稀有气体元素符号加方括号来表示,而得到的式子称为简化电 子排布式。如碳、镁、钙的简化电子排布式分别为[He]2s22p2、 [Ne]3s2、[Ar]4s2。
[答案] C
2.(1)写出下列原子的电子排布式和简化的电子排布式。 简化的电子
元素原子 电子排布式 排布式
N Mg S Ti (2)X 元素的+1 价阳离子的核外电子排布与氩原子相同,则 X 元素的原子核外电子排布式为________。
[解析] (1)根据原子核外电子排布遵循的规律书写原子核 外电子排布式,注意从 3d 能级开始出现能级交错现象。
人教版高中化学选修三第一章第一节 原子结构 课件(共54张PPT)
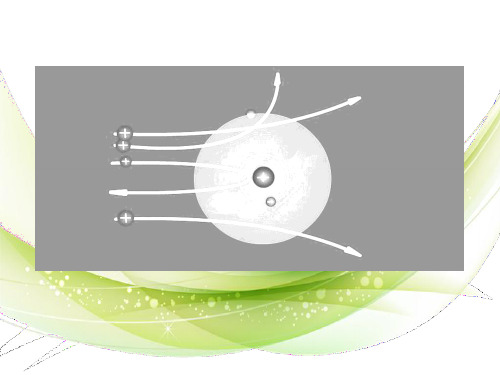
二、10电子微粒和18电子微粒 1.10电子微粒
【典例3】 已知A、B、C、D四种物质分别是由短周 期元素组成的微粒,它们之间有如图所示的转化关系,且A 是一种含有18电子的微粒,C是一种含有10电子的微粒。请 完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的 化学方程式:________________;
是O2置换H2S中的S。问题(4)中H、O形成的原子个数为1:1 的化合物是H2O2,N、H形成的化合物分子中电子数也为18 的分子只能是N2H4。
[答案] (1) (2)X(或氧) 2H2S+O2===2H2O+2S↓ (3)NH4HSO4
点燃 (4)N2H4+2H2O2=====N2+4H2O
2.(2012·长沙模考)下列有关化学用语使用正确的是 ()
A.硫原子的结构示意图: B.11H2、12H2、31H2是氢的三种同位素 C.原子核内有10个中子的氧原子:188O D.金刚石和石墨、甲烷和乙烷都属于同素异形体
解析 硫原子的结构示意图应为
A项错误。同位
素的研究对象是原子,但B选项中三种粒子是氢的单质,故
(4)若D是一种含有22个电子的分子,则符合如图关系的 A的物质有________(写化学式,如果是有机物则写相应的结 构简式)。
[解析] 本题把指定电子数目的有关微粒作为命题素 材,着重考查考生的有序思维能力。寻找10电子、18电子、 22电子微粒,必须从元素周期表出发,遵循由原子到分子, 再到离子的思考途径,列出相应的微粒。关于18电子微粒的 推断,对有序思维的要求更高,技巧性更强,我们可以以推 断10电子微粒的思路来进行分析,对数字18作一拆分,把18 拆成9+9,找出F2后会使18电子微粒的推断打开一个大“空
人教版高中化学选修3课件-价层电子对互斥理论

应用价层电子对互斥模型如何将分子分类?
【点拨】 应用价层电子对互斥模型将分子分成两大类:一 类是中心原子上的价电子都用于形成共价键,如 CO2、CH2O、 CH4 等分子中的 C 原子,它们的立体构型可应用中心原子周围 的原子数来预测;一类是中心原子上有孤电子对(未用于形成共 价键的电子对)的分子,如 H2O 和 NH3 中心原子上的孤电子对也 要占据中心原子周围的空间,并参与互相排斥,因而 H2O 分子 呈 V 形,NH3 分子呈三角锥形。
( C) A.CH4、CS2、BF3 B.CO2、H2O、NH3 C.C2H4、C2H2、C6H6 D.CCl4、BeCl2、PH3
解析:题中的 CH4 和 CCl4 为正四面体形分子,NH3 和 PH3 为三角锥形分子,这几种分子的所有原子不可能都在同一平面 上,CS2、CO2、C2H2 和 BeCl2 为直线形分子,C2H4 为平面形分 子,C6H6 为平面正六边形分子,这些分子都是平面形结构,故 选 C。
6.下列说法中正确的是( D ) A.NO2、SO2、BF3、NCl3 分子中没有一个分子中原子的 最外层电子都满足了 8 电子稳定结构 B.P4 和 CH4 都是正四面体形分子,且键角都为 109°28′
2.四原子分子(AB3 型)
3.五原子分子(AB4 型) 最常见的为 正四面体 109°28′ 。
形,如
CH4、CCl4 等,键角为
二、价层电子对互斥理论
1.内容
价层电子对互斥理论认为,分子的立体结构是 “价层电子对”相互排斥的结果。价层电子对是指分子中的
中心原子 上的电子对,包括 中心原子上的孤电子对 。
第三步:分子或离子的立体构型的确定 确定分子或离子的中心原子上的价层电子对数后,再依据 上表,即可确定分子或离子的立体构型。 (2)用价层电子对互斥理论判断共价分子结构的实例
高中化学人教版选修三:1.1原子结构(共44张PPT)

核外电子分成不同的能层。 电子层 (2)能层的表示方法及各能层最多容纳的电子数如下:
能层 一 二 三 M 四 五 六 P 七 …… Q ……
K ___ L 符号 ___ 最多 电子 数
N ___ O ___
பைடு நூலகம்
各能层最多容纳的电子数为 2n2 ______
2.能级 能量 的不同, (1)根据多电子原子中同一能层电子_________ 将它们分成不同的能级。 (2)能级的表示方法及各能级最多容纳的电子数如下:
四、能量最低原理、基态与激发态、光谱
1.能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理 能使整个原子的能量处于最低状态,简称____________ 能量最低原理 。 2.基态与激发态: 基态原子: 处于最低能量的原子 (稳定)
发射光谱
电子放 出能量
激发态原子:基态原子的电子吸收能量后电子会跃迁到 较高的能级,变为激发态原子。 (不稳定)
电子云
知识回顾
原子:是化学变化中最小的粒子 化学反应的实质:是原子的重新组合。 质子(+) 原子结构: 原子核 中子(不带电) 原子 核外电子(-) 核电荷数(z)= 核内质子数= 核外电子数
{
{
质量数(A) = 质子数(Z) + 中子数(N) 原子核外电子排布: (1)核外电子总是尽量先排布在能量较低的电子层; (2)原子核外各电子层最多容纳2n2个电子。 (3)原子最外层电子数目不能超过8个(K层为最外层时不能超过2个 电子)。 (4)次外层电子数目不能超过18个(K层为次外层时不能超过2个), 倒数第三层电子数目不能超过32个。
A.ClB. C. D.1s22s22p63s23p6
3、构造原理揭示的电子排布能级顺序,实质是各能级能量高低。 若以E(nl)表示某能级的能量,以下各式中正确的是( )AB A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(5s)>E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)>E(3d) 4、某元素原子的价电子构型为3s23p4, 则此元素在周期表的位置是 第3周期,第VIA族 ____________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
—
同一能级中的轨道能量相等,称为简并轨道
③原子轨道的电子云轮廓图
s轨道的电子云轮廓图 npx轨道电 子云轮廓图 npy轨道电 子云轮廓图 npz轨道电 子云轮廓图
nd轨道电子云轮廓图
五、泡利原理和洪特规则
核外电子的基本特征 主量子数 角量子数 磁量子数
量 子 化 描 述
能层
能级 轨道 自旋
大范围 小范围
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
②周期的组成
短 周 期 长 周 期 周期序数 起始原子序数 终止原子序数 元素种类 1 2 2 一 3 10 8 二 11 18 8 三 19 36 18 四 37 54 18 五 55 86 32 六 87 118/112 32/26 七
键型 项目
成键方向 牢固程度 成键判断规 律
σ键
π键
沿轴方向“头碰头” 电子云形状 轴对称 强度大,不易断
平行方向“肩并肩”
镜像对称 强度较小,易断
单键是σ键,双键中一个 σ键,另 一个是π键,共价三键中一个是σ键, 另两个为π键。
饱和性 共价键特征 方向性
σ键 共价键类型 (按电子云 重叠方式分)
观察表2-1 某些共价键的键能
同种元素形成的共价键的键能: ④结论: 单键<双键<叁键 σ键键能> π键键能
2、键长
①定义: 形成共价键的两个原子间的核间距
共价半径:同种原子的共价键键长的一半 稀有气体为单原子分子,无共价半径
②意义: 键长越短,键能越大,分子越稳定
观察表2-2 某些共价键的键能
同周期的主族元素从左至右
化合价由+1→+7, -4 →0递增
第二章
分子的结构与性质
第一节 共价键
一、共价键
1、化学键及其分类
相邻原子或离子之间强烈的相互作用 金属键 金属晶体 分子晶体
按成键方式分为: 共价键
离子键
离子晶体
2、共价键
共价键:分子内原子间通过共用 电子对形成的相互作用 作用 共用电子对 本质: (两单个电子形成一对电子)
同周期主族元素:从左至右原子半径递减 同主族元素:从上至下原子半径递增 电子层结构相同的离子原子序数小的半径大!
2、电离能
①第一电离能 气态电中性基态原子失去一个电子转 化为气态基态正离子所需最低能量 同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能 利用逐级电离能判断化合价
3、电负性
键合电子:参与化学键形成
原子的价电子 孤对电子:未参与化学键形成 ①电负性 不同元素的原子对键合电子吸引能力 电负性越大,对键合电子吸引能力越大 同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用 一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性 对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述 小黑点:概率密度 单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
②电子云轮廓图
电子出现的概率约为90%的空间 即精简版电子云 ③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形 nd能级的电子云轮廓图:多纺锤形
2、电子排布式
①电子排布式
例:写出Zn的电子排布式 Zn为30号元素,电子共30个 依据构造原理 1s2 2s2 2p6 3s2 3p6 4s2 3d10
书写时:1s2 2s2 2p6 3s2 3p6 3d10 4s2 写出K Ca Ti Co Ga Kr Br的电子排布式
Zn:1s2 2s2 2p6 3s2 3p6 3d10 4s2
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性 同主族元素从上至下 金属性增强,非金属性减弱 同周期的主族元素从左至右 金属性减弱,非金属性增强
金属性强弱的判断依据
跟水(酸)反应置换出氢的难易程度
越容易发生,金属性越强 最高价氧化物对应水化物——最高价氢氧化物 碱性强弱 最高价氢氧化物碱性越强,金属性越强
发生:分子内原子之间 于绝大多数物质中 存在: 酸、碱、盐、非金属氧化物 氢化物、有机物、非金属单质
3、共价键分类
按共用电子对的偏移 极性共价键 不同原子 成键 非极性共 同种原子 价键 成键
σ键
按成键方式 按电子云 重叠方式 π键
4、σ键
定义: 两个原子轨道沿键轴方向 以“头碰头”的方式重叠
H
第七周期也称为不完全周期
镧系:57~71 锕系:89~103
2、族 元素周期表的纵行
A结尾 ,ⅠA~ⅦA 7 主族:
族 16
B结尾 , ⅢB~ⅦB,ⅠB,ⅡB 7 副族: 1 Ⅷ族:
1 0族:
副族、Ⅷ族通称过渡元素,过渡金属 特点: 主族元素族序数=原子最外层电子数 一些族的别名
3、分区 按最后填入电子所属能级符号
能层:
一 K
二 L
三 M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f…… 能层中能级的数量不超过能层的序数 ②能量关系 EK﹤EL ﹤ EM ﹤ EN Ens﹤Enp ﹤ End ﹤ Enf Ens﹤E(n+1) s ﹤ E(n+2) s ﹤ E(n+3) s Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
①平面三角型: 3、HCHO SO ②三角锥型: 3 NH
3、五原子分子的空间结构
①四面体:CCl4、 CH4 ②其它等
二、价层电子对互斥(VSEPR)理论
ds区除外
s区 ⅠA、ⅡA 1、2 两列 d区 ⅢB~ⅦB、 Ⅷ 3 ~ 7、8 ~ 10 八列 ds区 ⅠB、ⅡB 11、12两列 p区 ⅢA~ⅦA、O 13 ~ 17、18 六列 f区
二、元素周期律
元素周期律:元素的性质随着原子序数 的递增而呈周期性的变化
1、原子半径
决定因素 层数 层数多半径大 电子间斥力大 核电 核电荷数大半径小 正负电荷 荷数 间引力大
3、光谱
①吸收光谱 光亮普带上的孤立暗线 电子吸收能量跃迁时产生 ②发射光谱 暗背景下的孤立亮线 电子释放能量跃迁时产生 同种原子的两种光谱是可以互补的
第一章
原子的结构与性质
第二节 原子结构与元素性质
元素:具有相同核电荷数的一类原子的总称
核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子 核电荷数=核内质子数=核外电子数=原子序数
99.7%
2、地球中的元素
绝大多数为金属元素 包括稀有气体在内的非金属仅22种
地壳中含量在前五位:O、Si、Al、Fe、Ca
3、原子的认识过程
古希腊哲学家留基伯和德谟克立特
思辨精神
原子:源自古希腊语Atom,不可再分的微粒
1803年 道尔顿(英) 原子是微小的不可分割的实心球体
1897年,英国科学家福 电子绕核旋转的原子结构模型
1913年,丹麦科学家玻尔 行星轨道的原子结构模型
1926年,奥地利物理学家薛定谔等 以量子力学为基础提出电子云模型
质子 (正电) 中子 (不带电) 原子 不显 电性 核外电子 分层排布 (负电) 与物质化学性质密切相关 原子核 (正电)
能层 K
L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 数
能层 2 电子 2n2 数
2 8
6
2
6
10
2
6
10 14 32 2n2
18
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
二、能层与能级
1、能层
能层名称 电子层
一 二
L
三
M
四
N
五
O
六
P
七
Q
能层符号 K
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层 能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
简 化 Zn:[Ar] 3d10 4s2 ②简化电子排布式 Ar
价层电子:主族、0族元素最外层 副族、Ⅷ族最外层和次外层
写出K Ca Ti Co Ga Kr Br的简化电子排布式
③特殊规则 例:写出Cr和Cu的电子排布式 全满规则 半满规则
四、电子云与原子轨道
1、电子云 薛定谔等 以量子力学为基础
b.电子云扩展程度 同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义 电子在原子核外的一个空间运动状态 ②原子轨道与能级 ndz2轨道 ns轨道 ns能级 ndx2 y2轨道 npx轨道 简 npy轨道 并 nd能级 ndxy轨道 np能级 轨 ndxz轨道 npz轨道 道 ndyz轨道
s-s s-p p-p
同一能级中的轨道能量相等,称为简并轨道
③原子轨道的电子云轮廓图
s轨道的电子云轮廓图 npx轨道电 子云轮廓图 npy轨道电 子云轮廓图 npz轨道电 子云轮廓图
nd轨道电子云轮廓图
五、泡利原理和洪特规则
核外电子的基本特征 主量子数 角量子数 磁量子数
量 子 化 描 述
能层
能级 轨道 自旋
大范围 小范围
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
②周期的组成
短 周 期 长 周 期 周期序数 起始原子序数 终止原子序数 元素种类 1 2 2 一 3 10 8 二 11 18 8 三 19 36 18 四 37 54 18 五 55 86 32 六 87 118/112 32/26 七
键型 项目
成键方向 牢固程度 成键判断规 律
σ键
π键
沿轴方向“头碰头” 电子云形状 轴对称 强度大,不易断
平行方向“肩并肩”
镜像对称 强度较小,易断
单键是σ键,双键中一个 σ键,另 一个是π键,共价三键中一个是σ键, 另两个为π键。
饱和性 共价键特征 方向性
σ键 共价键类型 (按电子云 重叠方式分)
观察表2-1 某些共价键的键能
同种元素形成的共价键的键能: ④结论: 单键<双键<叁键 σ键键能> π键键能
2、键长
①定义: 形成共价键的两个原子间的核间距
共价半径:同种原子的共价键键长的一半 稀有气体为单原子分子,无共价半径
②意义: 键长越短,键能越大,分子越稳定
观察表2-2 某些共价键的键能
同周期的主族元素从左至右
化合价由+1→+7, -4 →0递增
第二章
分子的结构与性质
第一节 共价键
一、共价键
1、化学键及其分类
相邻原子或离子之间强烈的相互作用 金属键 金属晶体 分子晶体
按成键方式分为: 共价键
离子键
离子晶体
2、共价键
共价键:分子内原子间通过共用 电子对形成的相互作用 作用 共用电子对 本质: (两单个电子形成一对电子)
同周期主族元素:从左至右原子半径递减 同主族元素:从上至下原子半径递增 电子层结构相同的离子原子序数小的半径大!
2、电离能
①第一电离能 气态电中性基态原子失去一个电子转 化为气态基态正离子所需最低能量 同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能 利用逐级电离能判断化合价
3、电负性
键合电子:参与化学键形成
原子的价电子 孤对电子:未参与化学键形成 ①电负性 不同元素的原子对键合电子吸引能力 电负性越大,对键合电子吸引能力越大 同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用 一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性 对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述 小黑点:概率密度 单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
②电子云轮廓图
电子出现的概率约为90%的空间 即精简版电子云 ③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形 nd能级的电子云轮廓图:多纺锤形
2、电子排布式
①电子排布式
例:写出Zn的电子排布式 Zn为30号元素,电子共30个 依据构造原理 1s2 2s2 2p6 3s2 3p6 4s2 3d10
书写时:1s2 2s2 2p6 3s2 3p6 3d10 4s2 写出K Ca Ti Co Ga Kr Br的电子排布式
Zn:1s2 2s2 2p6 3s2 3p6 3d10 4s2
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性 同主族元素从上至下 金属性增强,非金属性减弱 同周期的主族元素从左至右 金属性减弱,非金属性增强
金属性强弱的判断依据
跟水(酸)反应置换出氢的难易程度
越容易发生,金属性越强 最高价氧化物对应水化物——最高价氢氧化物 碱性强弱 最高价氢氧化物碱性越强,金属性越强
发生:分子内原子之间 于绝大多数物质中 存在: 酸、碱、盐、非金属氧化物 氢化物、有机物、非金属单质
3、共价键分类
按共用电子对的偏移 极性共价键 不同原子 成键 非极性共 同种原子 价键 成键
σ键
按成键方式 按电子云 重叠方式 π键
4、σ键
定义: 两个原子轨道沿键轴方向 以“头碰头”的方式重叠
H
第七周期也称为不完全周期
镧系:57~71 锕系:89~103
2、族 元素周期表的纵行
A结尾 ,ⅠA~ⅦA 7 主族:
族 16
B结尾 , ⅢB~ⅦB,ⅠB,ⅡB 7 副族: 1 Ⅷ族:
1 0族:
副族、Ⅷ族通称过渡元素,过渡金属 特点: 主族元素族序数=原子最外层电子数 一些族的别名
3、分区 按最后填入电子所属能级符号
能层:
一 K
二 L
三 M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f…… 能层中能级的数量不超过能层的序数 ②能量关系 EK﹤EL ﹤ EM ﹤ EN Ens﹤Enp ﹤ End ﹤ Enf Ens﹤E(n+1) s ﹤ E(n+2) s ﹤ E(n+3) s Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
①平面三角型: 3、HCHO SO ②三角锥型: 3 NH
3、五原子分子的空间结构
①四面体:CCl4、 CH4 ②其它等
二、价层电子对互斥(VSEPR)理论
ds区除外
s区 ⅠA、ⅡA 1、2 两列 d区 ⅢB~ⅦB、 Ⅷ 3 ~ 7、8 ~ 10 八列 ds区 ⅠB、ⅡB 11、12两列 p区 ⅢA~ⅦA、O 13 ~ 17、18 六列 f区
二、元素周期律
元素周期律:元素的性质随着原子序数 的递增而呈周期性的变化
1、原子半径
决定因素 层数 层数多半径大 电子间斥力大 核电 核电荷数大半径小 正负电荷 荷数 间引力大
3、光谱
①吸收光谱 光亮普带上的孤立暗线 电子吸收能量跃迁时产生 ②发射光谱 暗背景下的孤立亮线 电子释放能量跃迁时产生 同种原子的两种光谱是可以互补的
第一章
原子的结构与性质
第二节 原子结构与元素性质
元素:具有相同核电荷数的一类原子的总称
核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子 核电荷数=核内质子数=核外电子数=原子序数
99.7%
2、地球中的元素
绝大多数为金属元素 包括稀有气体在内的非金属仅22种
地壳中含量在前五位:O、Si、Al、Fe、Ca
3、原子的认识过程
古希腊哲学家留基伯和德谟克立特
思辨精神
原子:源自古希腊语Atom,不可再分的微粒
1803年 道尔顿(英) 原子是微小的不可分割的实心球体
1897年,英国科学家福 电子绕核旋转的原子结构模型
1913年,丹麦科学家玻尔 行星轨道的原子结构模型
1926年,奥地利物理学家薛定谔等 以量子力学为基础提出电子云模型
质子 (正电) 中子 (不带电) 原子 不显 电性 核外电子 分层排布 (负电) 与物质化学性质密切相关 原子核 (正电)
能层 K
L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 数
能层 2 电子 2n2 数
2 8
6
2
6
10
2
6
10 14 32 2n2
18
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
二、能层与能级
1、能层
能层名称 电子层
一 二
L
三
M
四
N
五
O
六
P
七
Q
能层符号 K
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层 能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
简 化 Zn:[Ar] 3d10 4s2 ②简化电子排布式 Ar
价层电子:主族、0族元素最外层 副族、Ⅷ族最外层和次外层
写出K Ca Ti Co Ga Kr Br的简化电子排布式
③特殊规则 例:写出Cr和Cu的电子排布式 全满规则 半满规则
四、电子云与原子轨道
1、电子云 薛定谔等 以量子力学为基础
b.电子云扩展程度 同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义 电子在原子核外的一个空间运动状态 ②原子轨道与能级 ndz2轨道 ns轨道 ns能级 ndx2 y2轨道 npx轨道 简 npy轨道 并 nd能级 ndxy轨道 np能级 轨 ndxz轨道 npz轨道 道 ndyz轨道
s-s s-p p-p
