(完整word版)胶体金法各种方法法原理
胶体金法各种方法法原理

胶体金法各种方法法原理胶体金(colloidal gold)是一种常见的纳米材料,广泛应用于生物医学、光电子学以及化学分析等领域。
胶体金法则是制备胶体金纳米颗粒的一种常用方法,它包括了各种不同的制备方法。
本文将详细介绍胶体金法的各种方法和原理。
一、胶体金法的概述胶体金法是指利用化学还原或还原剂将金离子还原成金原子并使其聚集形成胶体金颗粒的过程。
胶体金颗粒具有良好的可控性和活性,可以通过调节制备条件来控制其形状、尺寸和表面性质,便于在各个领域的应用中发挥优越性能。
二、化学还原法化学还原法是制备胶体金的一种常见方法。
其原理是通过将金离子与还原剂反应,使金离子还原为金原子,形成胶体金颗粒。
常用的还原剂有氨水、柠檬酸等。
这种方法制备的胶体金颗粒形状和尺寸较均匀,可以通过调节还原剂浓度、反应时间和温度等参数来控制颗粒的大小和形状。
三、光化学法光化学法是一种利用光照射来控制胶体金纳米颗粒形成的方法。
在该方法中,金离子在紫外光照射下被激发产生自由电子,然后与还原剂发生反应,形成胶体金颗粒。
这种方法具有反应速度快、颗粒形状可调控等优点。
光化学法的适应范围广,可以制备不同形状和尺寸的胶体金颗粒。
四、微乳液法微乳液法是一种利用乳化剂将金离子包裹在微乳液中,通过还原剂将金离子还原为金原子,最终生成胶体金颗粒的方法。
微乳液具有稳定性好、溶剂消耗少等特点,在胶体金制备中广泛应用。
该方法不受金离子浓度的限制,能够制备出较大尺寸的胶体金颗粒。
五、溶胶-凝胶法溶胶-凝胶法是一种将金离子逐渐转化为胶体金的方法。
首先,将金离子转化为胶态溶胶,然后通过加热或干燥使其凝胶,最终形成胶体金凝胶。
该方法可以制备出较大尺寸的胶体金颗粒,也可用于制备具有复杂结构的胶体金材料。
六、电化学法电化学法是一种利用电化学反应制备胶体金的方法。
在电化学细胞中,金阳极上的金离子被还原为金原子,并在阴极表面聚集形成胶体金颗粒。
该方法具有较高的纯度和良好的控制性能,可用于制备高质量的胶体金。
胶体金层析

胶体金层析
胶体金层析(Colloidal Gold Lateral Flow Assay)是一种常见的生物分析技术,用于快速检测目标物质的存在与浓度。
它基于胶体金颗粒的特性以及层析技术的原理进行分析。
下面是胶体金层析的一般工作原理:
1.测试带制备:测试带由多个不同的部分构成。
首先,一端
是样品区,通常涂有对目标物质特异性的抗体、抗原或寡
核苷酸等。
另一端则为控制区,涂有与标志物相关的分子,例如标记有金颗粒的抗体。
2.样品添加:将待测样品添加到样品区,然后样品开始在测
试带上向前移动。
3.结合和迁移:如果存在目标物质,它们将与标记在样品区
上的特异性分子(如抗体)结合。
这导致了目标物质与标
记物的复合物的形成。
4.分离和层析:复合物进入项目/测试带的下一段,该段使
用孔径大小选择性地提取复合物。
这一过程称作层析,其
中胶体金颗粒不会通过,但复合物会再次结合到控制区的
标志分子上,形成可见的线条。
5.结果解读:如果样品中存在目标物质,控制区会显示出一
条可见的线条,表明测试带正常工作。
另外,在样品区如
果出现一条额外的线条,表示目标物质检测到了。
胶体金层析技术相对简单、快速、便携,并且不需要复杂的仪
器设备。
它被广泛应用于医疗诊断、食品安全、环境检测等领域,例如孕妇试纸、感染病毒的快速检测、农产品污染的监测等。
胶体金法的定义和分类

胶体金是一种常用的标记技术,是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
在临床使用的免疫印迹技术几乎都使用其标记。
同时在流式、电镜、免疫、分子生物学以至生物芯片中都可能例用到。
1971年Faulk和Taytor将胶体金引入免疫化学,此后免疫胶体金技术作为一种新的免疫学方法,在生物医学各领域得到了日益广泛的应用。
目前在医学检验中的应用主要是免疫层析法(immunochromatogra-phy)和快速免疫金渗滤法(Do t-immuogold filtration assay DIGFA),用于检测HBsAg、HCG和抗双链DNA抗体等,具有简单、快速、准确和无污染等优点。
免疫胶体金技术的基本原理:胶体金是由氯金酸(HAuCl4)在还原剂如白磷、抗坏血酸、枸橼酸钠、鞣酸等作用下,可聚合成一定大小的金颗粒,并由于静电作用成为一种稳定的胶体状态,形成带负电的疏水胶溶液,由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
胶体金除了与蛋白质结合以外,还可以与许多其它生物大分子结合,如SPA、PHA、ConA 等。
根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,因而使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
吸附机理可能是胶体金颗粒表面负电荷,与蛋白质的正电荷基团因静电吸附而形成牢固结合。
用还原法可以方便地从氯金酸制备各种不同粒径、也就是不同颜色的胶体金颗粒。
这种球形的粒子对蛋白质有很强的吸附功能,可以与葡萄球菌A蛋白、免疫球蛋白、毒素、糖蛋白、酶、抗生素、激素、牛血清白蛋白多肽缀合物等非共价结合,因而在基础研究和临床实验中成为非常有用的工具。
胶体金是一种什么实验方法

胶体金是一种什么实验方法胶体金是指由纳米级金粒子组成的胶体溶液。
胶体是一种介于溶液和固体之间的物质状态,由一种或多种物质在另一种物质中形成的微粒子分散体系。
金是一种非常重要的贵金属,具有良好的热导性、电导性和化学稳定性,因此广泛应用于光学、电子学、生物医学等领域。
胶体金的实验方法主要包括物理还原法、化学还原法、光化学法等多种方法。
其中,物理还原法是最常用的制备胶体金的方法之一。
该方法的原理是通过外加还原剂来还原金离子,使其形成金原子,然后金原子自行聚集形成纳米粒子。
这种方法一般利用某些常见的还原剂如氢气、亚硫酸钠等将金盐还原成金纳米颗粒。
例如,可以将金盐(如氯金酸)加入溶剂中,然后逐滴加入还原剂,在适当的温度和pH条件下,金离子得到还原成金纳米颗粒,形成胶体金溶液。
化学还原法是另一种制备胶体金的方法。
这种方法的原理是将金离子与某些还原剂(如多肽、某些有机物)反应,使金离子还原成金原子并形成纳米颗粒。
这种方法一般需要控制反应条件如温度、pH值等,以得到所需的粒子尺寸和分散度。
光化学法是利用光化学反应原理制备胶体金的方法。
这种方法一般采用可见光、紫外光等光源来激发金离子,产生电子和空穴,然后通过还原剂将金离子还原成金原子,并形成纳米颗粒。
这种方法具有选择性、快速和可控性的优点。
制备胶体金的实验方法一般需要精确控制反应条件,如温度、pH值、反应时间等,以控制金纳米颗粒的粒径和分散度。
同时,还需要选择合适的还原剂、溶剂和金盐等试剂,以确保高效、可重复的制备过程。
胶体金的应用非常广泛,主要包括生物医学领域、光学传感、催化剂等。
在生物医学领域中,胶体金被用作生物标记物或药物载体,通过对其表面进行功能修饰,可以实现对生物分子的检测、分离和治疗。
在光学传感领域,胶体金具有强烈的表面等离子共振吸收和散射性质,可用于制备表面增强拉曼散射(SERS)基底,实现对低浓度分子的检测,并被应用于环境监测、食品安全等方面。
在催化剂领域,胶体金纳米颗粒具有良好的催化性能,可用于催化剂的制备和催化反应的促进。
胶体金层析法

胶体金层析法
胶体金层析法(Colloidal Gold Lateral Flow Assay)是一种常见的免疫层析检测技术,也被称为“快速测试纸条”或“快速诊断试纸条”。
这种技术被广泛用于医学诊断、食品安全检测、环境监测等领域。
下面是胶体金层析法的基本原理和步骤:
原理:
1.抗原-抗体反应:根据抗原和抗体之间的特异性结合原理,将被检测的分
子(如蛋白质、病毒抗原等)与特异性抗体结合。
2.胶体金标记:抗体或抗原被标记上胶体金颗粒,使其呈现颜色。
3.层析效应:在试纸条上形成的吸附带将试剂中的标记复合物隔离出来,
通过毛细管作用,使其沿着试纸条上的纵向扩散。
步骤:
1.取得待检样本(如血液、尿液、食品提取物等)。
2.将待检样本加入试剂盒中,与试剂中的抗体或抗原相结合。
3.混合物通过毛细管效应在试纸条上扩散。
4.当待检样本中存在目标分子时,会与试纸条上的抗体或抗原结合,形成可
见的标记复合物。
5.标记复合物在试纸条上的特定区域显示出色带,从而进行目标物的定性或
半定量检测。
这种技术具有简单、快速、便携、成本低等优点,在诊断和快速检测中应用广泛。
例如,它被用于临床诊断、药物滥用检测、感染病原体检测(如流感、艾滋病毒等)以及食品安全检测等领域。
胶体金法的定义和分类

胶体⾦法的定义和分类胶体⾦是⼀种常⽤的标记技术,是以胶体⾦作为⽰踪标志物应⽤于抗原抗体的⼀种新型的免疫标记技术,有其独特的优点。
近年已在各种⽣物学研究中⼴泛使⽤。
在临床使⽤的免疫印迹技术⼏乎都使⽤其标记。
同时在流式、电镜、免疫、分⼦⽣物学以⾄⽣物芯⽚中都可能例⽤到。
1971年Faulk 和Taytor将胶体⾦引⼊免疫化学,此后免疫胶体⾦技术作为⼀种新的免疫学⽅法,在⽣物医学各领域得到了⽇益⼴泛的应⽤。
⽬前在医学检验中的应⽤主要是免疫层析法(immunochromatogra-phy)和快速免疫⾦渗滤法(Dot-immuogold filtration assay DIGFA),⽤于检测 HBsAg、HCG 和抗双链DNA抗体等,具有简单、快速、准确和⽆污染等优点。
免疫胶体⾦技术的基本原理:胶体⾦是由氯⾦酸(HAuCl4)在还原剂如⽩磷、抗坏⾎酸、枸橼酸钠、鞣酸等作⽤下,可聚合成⼀定⼤⼩的⾦颗粒,并由于静电作⽤成为⼀种稳定的胶体状态,形成带负电的疏⽔胶溶液,由于静电作⽤⽽成为稳定的胶体状态,故称胶体⾦。
胶体⾦在弱碱环境下带负电荷,可与蛋⽩质分⼦的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋⽩质的⽣物特性。
胶体⾦除了与蛋⽩质结合以外,还可以与许多其它⽣物⼤分⼦结合,如SPA、PHA、ConA 等。
根据胶体⾦的⼀些物理性状,如⾼电⼦密度、颗粒⼤⼩、形状及颜⾊反应,加上结合物的免疫和⽣物学特性,因⽽使胶体⾦⼴泛地应⽤于免疫学、组织学、病理学和细胞⽣物学等领域。
胶体⾦标记,实质上是蛋⽩质等⾼分⼦被吸附到胶体⾦颗粒表⾯的包被过程。
吸附机理可能是胶体⾦颗粒表⾯负电荷,与蛋⽩质的正电荷基团因静电吸附⽽形成牢固结合。
⽤还原法可以⽅便地从氯⾦酸制备各种不同粒径、也就是不同颜⾊的胶体⾦颗粒。
这种球形的粒⼦对蛋⽩质有很强的吸附功能,可以与葡萄球菌A蛋⽩、免疫球蛋⽩、毒素、糖蛋⽩、酶、抗⽣素、激素、⽜⾎清⽩蛋⽩多肽缀合物等⾮共价结合,因⽽在基础研究和临床实验中成为⾮常有⽤的⼯具。
胶体金法各种方法法原理

胶体金法各种方法法原理胶体金法(Colloidal Gold Method)是一种将金颗粒制备成胶体溶液,然后用于检测有机分子、生物分子或其他物质的方法。
胶体金法具有简单、高灵敏度和高选择性的特点,被广泛应用于生物医学研究、医学诊断、环境监测等领域。
以下是胶体金法的几种常用方法及其原理。
一、化学还原法化学还原法是制备胶体金的最常用方法之一、该方法通过在溶液中添加金金属离子和还原剂,使金离子在还原剂的作用下还原成金原子,进而形成金核并在溶液中仅稳定存在。
该方法需要在适当的条件下控制还原剂的加入量、反应温度和pH值等因素,以调整金颗粒的大小和分散度。
二、绿潮法绿潮法是一种可以通过氢沉淀法将金离子还原为金金属,从而制备胶体金的方法。
该方法的步骤包括:首先将金金属溶解在盐酸中,得到金离子溶液;接着,加入氢氧化钠或氢氧化钾作为沉淀剂,将溶液中的金离子还原成金原子并形成沉淀;最后,通过分散沉淀并调整pH值,得到胶体金。
三、还原沉淀法还原沉淀法是一种将可溶性金离子还原为金颗粒的方法。
该方法的步骤包括:首先,将金离子溶解在溶剂中,得到金离子溶液;接着,在溶液中加入还原剂,使金离子还原成金原子并形成沉淀;最后,通过溶解沉淀并调整pH值,得到胶体金。
四、可逆沉淀法可逆沉淀法是一种将金金属还原成金颗粒的方法。
该方法的步骤包括:首先,将金金属溶解在酸性溶液中,得到金离子溶液;接着,通过加入溶液中的其中一种阴离子或氧化还原物质,使金离子还原成金颗粒并形成沉淀;最后,通过转化溶解沉淀并调整pH值,得到胶体金。
五、微乳液逆微乳液法微乳液逆微乳液法是一种将金金属还原成金颗粒的方法。
该方法的步骤包括:首先,在水/油微乳液中,使用其中一种还原剂将金离子还原成金原子;接着,通过控制溶剂的性质、表面活性剂浓度和温度等因素,使金原子在微乳液中形成有序排列并聚集为金颗粒;最后,通过逆微乳液法将金颗粒从微乳液中分离出来。
该方法制备的胶体金颗粒具有较小的颗粒大小和较高的分散度。
胶体金的原理

胶体金的原理
胶体金是一种应用广泛的纳米材料,具有许多独特的物理化学性质,因此在生物医学、光学、电子学等领域有着重要的应用价值。
胶体金的制备方法多种多样,其中最常见的方法是通过还原金盐溶液来制备胶体金。
在这个过程中,金离子被还原成金原子,形成纳米级的金颗粒悬浮在溶液中,形成胶体溶液。
胶体金的独特性质主要源于其纳米级尺寸和表面等离子共振效应。
首先,由于其纳米级尺寸,胶体金表现出与宏观金材料完全不同的物理化学性质。
其比表面积大大增加,使得其在催化、传感、生物学等领域有着独特的应用优势。
其次,胶体金的表面等离子共振效应使得其在可见光范围内呈现出鲜艳的颜色,这一性质被广泛应用于生物标记、光学材料等领域。
胶体金的制备方法和性质使得其在生物医学领域有着广泛的应用。
首先,胶体金纳米颗粒具有良好的生物相容性,可以作为药物载体用于药物输送。
其次,在生物分子检测和诊断中,胶体金纳米颗粒的表面等离子共振效应使得其可以作为生物标记物,用于生物分子的检测和成像。
此外,胶体金还可以用于光热治疗、光学成像等领域。
除了在生物医学领域,胶体金还在光学、电子学等领域有着广泛的应用。
在光学领域,胶体金的表面等离子共振效应使得其可以用于制备纳米光学材料,用于传感、光学信息处理等领域。
在电子学领域,胶体金的纳米尺寸和良好的导电性使得其可以用于制备纳米电子器件,用于传感、储存等应用。
总之,胶体金作为一种重要的纳米材料,在生物医学、光学、电子学等领域有着广泛的应用前景。
通过深入研究其制备方法和性质,可以进一步拓展其在各个领域的应用,推动纳米技术的发展与创新。
胶体金法原理

胶体金法原理胶体金法是一种利用胶体金颗粒作为信号标记物的生物分析技术,它在生物医学领域具有广泛的应用前景。
胶体金是指在溶液中形成的微米级金颗粒,其直径一般在1-100纳米之间。
胶体金颗粒具有良好的生物相容性、稳定性和可调控性,可以作为生物分析中的标记物,用于检测生物分子、细胞和组织等。
胶体金法原理的核心在于利用胶体金颗粒的表面增强效应和表面等离子共振效应,通过检测其光学信号来实现对待测物的定量分析。
首先,胶体金颗粒具有表面增强效应,即当胶体金颗粒与待测物相互作用时,其表面电磁场会在一定程度上增强待测物的光学信号。
这种增强效应可以使待测物的信号得到放大,从而提高检测灵敏度。
其次,胶体金颗粒还具有表面等离子共振效应,即当胶体金颗粒的尺寸和形状满足特定条件时,会产生强烈的表面等离子共振吸收峰。
这种吸收峰的位置和强度与胶体金颗粒的尺寸、形状及周围介质的折射率等因素有关,可以用于对胶体金颗粒进行表征和定量分析。
胶体金法的原理基于上述光学效应,通过将待测物与胶体金颗粒进行特异性反应,使胶体金颗粒发生可测的光学信号变化,从而实现对待测物的定量分析。
一般来说,胶体金法的操作步骤包括,首先,将胶体金颗粒与特定的生物分子(如抗体、DNA探针等)进行功能化修饰,使其具有特异性识别能力;然后,将待测物与功能化的胶体金颗粒进行反应,形成特定的免疫复合物或DNA复合物;最后,通过检测胶体金颗粒的光学信号变化,实现对待测物的定量分析。
胶体金法具有灵敏度高、特异性强、操作简便等优点,已被广泛应用于临床诊断、生物学研究、环境监测等领域。
例如,在临床诊断中,胶体金法可用于检测肿瘤标志物、病原微生物、药物残留等,具有快速、准确、非侵入性的特点;在生物学研究中,胶体金法可用于检测细胞分子的表达、定位和相互作用,为研究细胞生物学过程提供重要手段;在环境监测中,胶体金法可用于检测水质污染、大气污染等,具有高灵敏度和实时监测的优势。
总之,胶体金法作为一种新型的生物分析技术,具有广阔的应用前景。
几种胶体金技术详解(完整版)资料

几种胶体金技术详解(完整版)资料(可以直接使用,可编辑优秀版资料,欢迎下载)胶体金免疫分析技术详解随着免疫分析日益广泛应用于以临床为主以及非临床领域的诊断工业,免疫分析正在向两个方向发展:一类为全自动化的免疫分析;另一类为以硝酸纤维膜为载体的快速免疫分析。
前者需要价格昂贵的全自动仪器及与仪器严格配套的各种试剂盒,目前只能在医疗及检测中心应用,虽也能较快速给出结果,但仍需一定时间,不适合远离医疗及检测中心的地区,更不能用于“患者床旁检验”和普查的需要,在酶免疫分析的基础上,主要以硝酸纤维素膜为载体的快速诊断方法迅速和广泛地发展起来。
这类方法目前在文献及市场上的命名还很不统一。
它实际上属于快速斑点免疫结合分析,主要有以下两种方法:斑点免疫渗滤分析DIFA 和斑点免疫层析分析DICA。
本篇主要介绍以金作为标志物的胶体金免疫分析技术。
金标记免疫分析技术也称免疫胶体金技术,是于1971年建立的一种信号显示技术。
此技术最初用于免疫电镜检查,由胶体金颗粒标记抗原或抗体,与组织或细胞中相应的抗体或抗原相结合,在电子显微镜的检查时可起特异的示踪作用。
此后,此技术与银染技术相结合建立的免疫金银染色法,使抗原抗体特异反应信号可在光学显微镜下观察。
近10多年来,利用硝酸纤维素膜(NC)等为固相载体,以胶体金标记的抗原或抗体与特异配体的反应在膜上进行,建立了快速的金标记免疫渗滤技术和金标记免疫层析技术,并在传染病、心血管病、风湿病、自身免疫病的免疫学检测中广泛应用。
胶体金是指金微小粒子(0-100nm)分散在另一种物质中所形成的体系,通常指金以微小粒子分散在溶液中所形成的金溶胶,用此金溶胶标记蛋白质(抗原、抗体或SPA、SPG),胶体金颗粒具有高电子密度的特性,故在金标蛋白的抗原抗体结合处,显微镜下可见黑褐色颗粒;当这些标记物在相应的标记处大量聚集时,可在载体膜上呈现红色或粉红色斑点,从而用于抗原或抗体物质的半定量或定性。
胶体金法——精选推荐

胶体⾦法摘要免疫胶体⾦技术是四⼤免疫标记技术之⼀,问世⼆⼗多年来发展⼗分迅速,在⽣物医学各研究领域特别是在医学检验中得到了⽇益⼴泛的应⽤。
本⽂从胶体⾦技术的基本原理、制备⽅法、标记技术和实际应⽤等⼏个⽅⾯对胶体⾦技术作了较系统介绍。
1971年Faulk 和Taytor将胶体⾦引⼈免疫化学,此后免疫胶体⾦技术作为⼀种新的免疫学⽅法,在⽣物医学各领域得到了⽇益⼴泛的应⽤。
⽬前在医学检验中的应⽤主要是免疫层析法( immunochromatogra-phy)和快速免疫⾦渗滤法(D ot-immuogold filtration assay DIGFA),⽤于检测HBsAg 、HCG 和抗双链DNA抗体等,具有简单、快速、准确和⽆污染等优点。
免疫胶体⾦技术的基本原理氯⾦酸(HAuCl4)在还原剂作⽤下,可聚合成⼀定⼤⼩的⾦颗粒,形成带负电的疏⽔胶溶液。
由于静电作⽤⽽成为稳定的胶体状态,故称胶体⾦。
胶体⾦标记,实质上是蛋⽩质等⾼分⼦被吸附到胶体⾦颗粒表⾯的包被过程。
吸附机理可能是胶体⾦颗粒表⾯负电荷,与蛋⽩质的正电荷基团因静电吸附⽽形成牢固结合。
⽤还原法可以⽅便地从氯⾦酸制备各种不同粒径、也就是不同颜⾊的胶体⾦颗粒。
这种球形的粒⼦对蛋⽩质有很强的吸附功能,可以与葡萄球菌A蛋⽩、免疫球蛋⽩、毒素、糖蛋⽩、酶、抗⽣素(antibiotic)、激素、⽜⾎清⽩蛋⽩多肽缀合物等⾮共价结合,因⽽在基础研究和临床实验中成为⾮常有⽤的⼯具。
免疫⾦标记技术(Immunogold labelling techique) 主要利⽤了⾦颗粒具有⾼电⼦密度的特性,在⾦标蛋⽩结合处,在显微镜下可见⿊褐⾊颗粒,当这些标记物在相应的配体处⼤量聚集时,⾁眼可见红⾊或粉红⾊斑点,因⽽⽤于定性或半定量的快速免疫检测⽅法中,这⼀反应也可以通过银颗粒的沉积被放⼤,称之为免疫⾦银染⾊。
胶体⾦的制备⽅法胶体⾦的制备⼀般采⽤还原法,常⽤的还原剂有柠檬酸钠、鞣酸、抗坏⾎酸、⽩磷、硼氢化钠等。
几种胶体金技术详解

几种胶体金技术详解胶体金免疫分析技术详解随着免疫分析日益广泛应用于以临床为主以及非临床领域的诊断工业,免疫分析正在向两个方向发展:一类为全自动化的免疫分析;另一类为以硝酸纤维膜为载体的快速免疫分析。
前者需要价格昂贵的全自动仪器及与仪器严格配套的各种试剂盒,目前只能在医疗及检测中心应用,虽也能较快速给出结果,但仍需一定时间,不适合远离医疗及检测中心的地区,更不能用于“患者床旁检验”和普查的需要,在酶免疫分析的基础上,主要以硝酸纤维素膜为载体的快速诊断方法迅速和广泛地发展起来。
这类方法目前在文献及市场上的命名还很不统一。
它实际上属于快速斑点免疫结合分析,主要有以下两种方法:斑点免疫渗滤分析DIFA和斑点免疫层析分析DICA。
本篇主要介绍以金作为标志物的胶体金免疫分析技术。
金标记免疫分析技术也称免疫胶体金技术,是于1971年建立的一种信号显示技术。
此技术最初用于免疫电镜检查,由胶体金颗粒标记抗原或抗体,与组织或细胞中相应的抗体或抗原相结合,在电子显微镜的检查时可起特异的示踪作用。
此后,此技术要在液相中经过扩散作用,逐渐与吸附在固相表面的抗体结合。
同时,标记抗体也需要同样的扩散结合过程形成抗体-抗原-标记抗体复合物,故需时间较长。
故此技术做到了名副其实的POCT。
原理:将氯金酸(HAuCl4)用还原法制成一定直径的金溶胶颗粒(胶体金),标记金黄色葡萄球菌A蛋白(SPA)或抗体,用于免疫印迹、免疫组织化学定位或快速免疫渗滤、免疫层析实验。
金标记免疫渗滤技术的原理同一般的免疫斑点试验,也是用已知抗原或抗体包被NC膜,再用金标记抗体或抗原来进行快速快速测定,阳性时斑点呈胶体金的红色。
改进之处为采用了渗滤装置,更加简便。
金标记免疫层析则是利用NC膜条状纤维的毛细管作用,使样品在涌动中与金标记物及包被在NC膜上的抗原或抗体结合,出现呈色的阳性信号。
胶体金的制备:在溶液中金颗粒呈圆形,边缘平整,界线十分清楚。
金颗粒表面带有大量负电荷,由于静电的排斥力,使其在水中保持稳定状态,形成稳定的胶体,所以称其为胶体金。
胶体金技术

常用几种蛋白质标记时胶体金所 用的pH值
蛋白质 PH
抗体(γ球蛋白)
单克隆抗体 SPA(葡萄球菌蛋白) 亲合层析的IgG 链霉抗生物素蛋白 破伤风毒素 霍乱毒素
9.0
8.2 6.0 7.6 6.6 6.9 6.9
胶金体的优点
1.结果直观 利用肉眼可见的红色,在不需要 任何仪器的情况下对抗原进行检测,方便基层 单位和现场使用。 2.灵敏度高 达到酶联免疫吸附试验(ELISA) 相似的灵敏度,如果加入增敏试剂可超过 ELISA1~2个数量级。· 3.速度快 一个样品的检测时间一般为3~5分钟 4 检测多元化 在同一膜上固定多种反应物, 一次测定可同时得到一组结果
1.枸橼酸三钠还原法
Fra bibliotek(1)10nm胶体金粒的制备: 取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠 水溶液3ml,加热煮沸30min,冷却至4℃,溶液呈红 色。 (2)15nm胶体金颗粒的制备: 取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠 水溶液2ml,加热煮沸15min~30min,直至颜色变红。 冷却后加入0.1Mol/L K2CO30.5ml,混匀即可。 (3)15nm、18nm~20nm、30nm或50nm胶体金颗粒 的制备: 取0.01%HAuCl4水溶液100ml,加热煮沸。根据需要 迅速加入1%枸橼酸三钠水溶液4ml、2.5ml、1ml或 0.75ml,继续煮沸约5min,出现橙红色。这样制成的 胶体金颗粒则分别为15nm、18~20nm、30nm和50nm。
免疫胶体金在免疫学中的应用
胶体金标记技术由于标记物的制备简 便,方法敏感、特异,不需要使用放射 性同位素,或有潜在致癌物质的酶显色 底物,也不要荧光显微镜,它的应用范 围广,除应用于光镜或电镜的免疫组化 法外,更广泛地应用于各种液相免疫测 定和固相免疫分析以及流式细胞术等。
胶体金法的定义和分类

胶体金是一种常用的标记技术,是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
在临床使用的免疫印迹技术几乎都使用其标记。
同时在流式、电镜、免疫、分子生物学以至生物芯片中都可能例用到。
1971年Faulk 和Taytor将胶体金引入免疫化学,此后免疫胶体金技术作为一种新的免疫学方法,在生物医学各领域得到了日益广泛的应用。
目前在医学检验中的应用主要是免疫层析法(immunochromatogra-phy)和快速免疫金渗滤法(Dot-immuogold filtration assay DIGFA),用于检测 HBsAg、HCG 和抗双链DNA抗体等,具有简单、快速、准确和无污染等优点。
免疫胶体金技术的基本原理:胶体金是由氯金酸(HAuCl4)在还原剂如白磷、抗坏血酸、枸橼酸钠、鞣酸等作用下,可聚合成一定大小的金颗粒,并由于静电作用成为一种稳定的胶体状态,形成带负电的疏水胶溶液,由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
胶体金除了与蛋白质结合以外,还可以与许多其它生物大分子结合,如SPA、PHA、ConA 等。
根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,因而使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
吸附机理可能是胶体金颗粒表面负电荷,与蛋白质的正电荷基团因静电吸附而形成牢固结合。
用还原法可以方便地从氯金酸制备各种不同粒径、也就是不同颜色的胶体金颗粒。
这种球形的粒子对蛋白质有很强的吸附功能,可以与葡萄球菌A蛋白、免疫球蛋白、毒素、糖蛋白、酶、抗生素、激素、牛血清白蛋白多肽缀合物等非共价结合,因而在基础研究和临床实验中成为非常有用的工具。
实验六胶体金免疫层析技术

简 介
胶体金(Colloidal gold)是氯金酸(HAuCl4)的水溶胶,利用HAuCl4在还原剂(柠檬酸钠)的作用下,聚合成特定大小的金颗粒,形成带负电的疏水胶溶液,由于静电作用成为一种稳定的胶体状态,故称胶体金。
胶体金的质量判定标准
简 介
质量好的胶体金:溶液呈红色,胶体金颗粒为球形,大小均一,无棱角。 质量差的胶体金:溶液呈紫色,大小不一,形状各异。
胶体金试纸条诊断技术
实验目的
掌握胶体金试纸条诊断技术的原理、使用方法及结果的判定
胶体金试纸条诊断是采用胶体金免疫层析技术研制而成,该技术是90年代初在免疫渗滤技术的基础上建立的一种简易快速的免疫学检测技术,最先用于人绒毛膜促性腺激素(HCG)的测定和乙型肝炎病毒表面抗原(HBsAg)等检测。
过剩的免疫金复合物继续前行,至参照区与固相抗小鼠IgG结合(免疫金复合物中的单克隆抗体为小鼠IgG),而显出红色质控线条(R)。 测 定
阴性标本则无反应线条,而仅显示质控线条。 测 定
简捷快速:操作简单,一般只要5-10min 就会出结果,而其它方法如ELISA需要1-2h,PCR 需要时间更长。
结果易于判定:阴、阳性呈色很明显,肉眼很容易判断。
特异性好:因为该技术大多用单克隆抗体标记,这决定了它具有很好的特异性。
胶体金快速诊断技术的特点
病毒性疾病:传染性法氏囊病、禽流感、新城疫、犬细小病毒、猪瘟等。 寄生虫疾病:血吸虫病、旋毛虫病、囊虫病、恙虫病。 细菌性疾病:霍乱弧菌、类鼻疽。
胶体金快速诊断技术的应用
01
胶体金标记的原理:胶体金在碱性条件下带负电荷,与蛋白质分子的正电荷基团藉静电吸引而形成牢固结合。
02
胶体金标记技术(Immunogold labeling technique)是以胶体金作为示踪标记物应用于抗原抗体反应的一种新型免疫标记技术。
胶体金法原理

胶体金法原理
胶体金法原理是一种利用胶体金颗粒的表面增强效应进行光谱分析的方法。
其原理主要涉及胶体金颗粒的两个特性:表面等离激元共振和颜色效应。
在胶体金溶液中,胶体金颗粒的表面存在着大量的自由电子。
当光线通过胶体金颗粒表面时,这些自由电子可以与光子发生相互作用,并引起表面等离激元共振。
这种现象可以导致光强在某些特定波长附近出现明显的增强。
通过调整胶体金颗粒的大小和形状,可以使得这种表面等离激元共振发生在可见光谱范围内。
这样,当我们用可见光照射胶体金溶液时,胶体金颗粒会选择性地吸收一部分光线,使得溶液呈现出明显的颜色。
利用这种颜色效应,我们可以根据溶液的颜色变化来推测其成分或测定某种物质的浓度。
例如,在生物医学领域中,胶体金法可以用于检测生物分子的存在与否,通过溶液颜色的变化来实现目标分析物的定量检测。
总之,胶体金法利用胶体金颗粒的表面增强效应,通过光谱分析实现对目标物质的检测与定量。
这种方法具有简单、快速、灵敏等优点,在生物医学、环境监测等领域有着广泛的应用前景。
胶体金检测原理范文

胶体金检测原理范文胶体金(Colloidal Gold)是指金属纳米粒子,其中金属纳米粒子的大小一般在1~100纳米之间。
胶体金具有良好的可溶性和生物相容性,因此被广泛应用于生物医学领域,并且常常用于检测生物分子的存在和浓度。
胶体金检测原理是基于其特殊的光学性质和生物分子的特异性识别,通过测量光学信号来实现生物分子的定量检测。
胶体金检测的基本原理是基于表面增强共振散射(Surface-Enhanced Resonance Scattering,SERS)效应和局域化表面等离子体共振(Localized Surface Plasmon Resonance,LSPR)效应。
当胶体金纳米粒子与特定的生物分子结合时,它们的表面等离子体共振频率会引起光散射强度的明显增强,使得胶体金的颜色由红色转变为蓝色或紫色。
这种光学信号的变化可以通过肉眼观察或仪器测量来实现生物分子的检测。
胶体金检测的过程一般包括以下几个步骤:首先,将待测的生物分子与胶体金标记物结合,通常可以通过特异的抗体-抗原或配体-受体结合来实现。
然后,将胶体金-生物分子复合物投入到待测样品中,胶体金纳米颗粒将与待测样品中的目标生物分子结合。
接下来,通过离心或者其他分离方法,将胶体金复合物从样品中分离出来。
最后,通过观察胶体金纳米颗粒的颜色变化或者使用仪器测量其吸收光谱,来实现对生物分子的定量检测。
胶体金检测的优点包括灵敏度高、选择性强、操作简单、成本低廉等。
它可以用于快速检测各种生物分子,如蛋白质、核酸、药物、激素、细胞因子等,并且可以应用于临床诊断、药物研发、食品安全等领域。
此外,胶体金纳米粒子可以通过改变其大小和表面修饰,来实现对检测灵敏度和特异性的调控,从而满足不同应用场景的需求。
综上所述,胶体金检测原理是基于其特殊的光学性质和生物分子的特异性识别,通过测量光学信号来实现生物分子的定量检测。
胶体金检测具有灵敏度高、选择性强、操作简单和成本低廉等优点,因此在生物医学领域有着广泛的应用前景。
(完整word版)胶体金法各种方法法原理
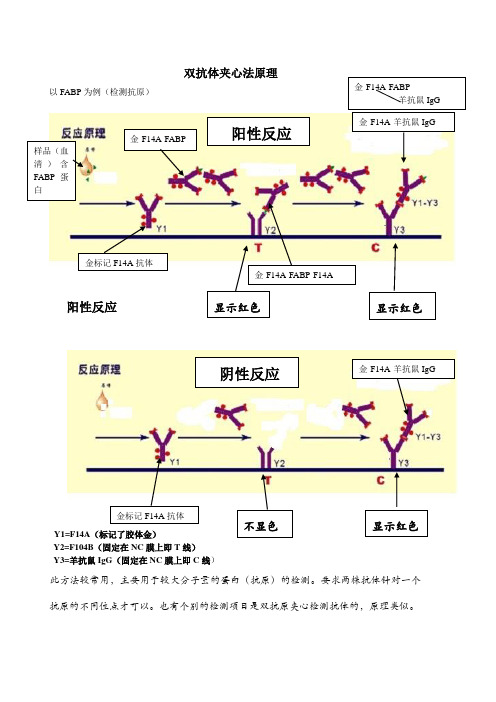
双抗体夹心法原理以FABP 为例(检测抗原)阳性反应Y1=F14A (标记了胶体金)Y2=F104B (固定在NC 膜上即T 线)Y3=羊抗鼠IgG (固定在NC 膜上即C 线)此方法较常用,主要用于较大分子量的蛋白(抗原)的检测。
要求两株抗体针对一个抗原的不同位点才可以。
也有个别的检测项目是双抗原夹心检测抗体的,原理类似。
样品(血清)含FABP 蛋白金标记F14A 抗体金-F14A-FABP金-F14A-FABP-F14A金-F14A-羊抗鼠IgG金-F14A-FABP羊抗鼠IgG显示红色 显示红色金标记F14A 抗体不显色 显示红色金-F14A-羊抗鼠IgG阴性反应阳性反应竞争法原理以吗啡为例(检测抗原)阳性反应Y1=胶体金标记的吗啡单抗 Y2=吗啡-BSA 偶联物 Y3=羊抗鼠此方法主要用于小分子抗原(毒品、农药、肽链等)的检测。
由于抗原分子量小不能直接固定于NC 膜上,常常用化学方法把小分子偶联到BSA 等大分子物质上再固定于NC 膜上。
此结果与双抗原夹心法相反,阴性CT 两条都是红线,阳性只有C 线一条红线。
金-吗啡抗体-吗啡吗啡-BSA金标记吗啡抗体显示红色不显色金-吗啡抗体-吗啡羊抗鼠样品(尿液)含吗啡显示红色显示红色 金标记吗啡抗体金-吗啡抗体-羊抗鼠阴性尿液抗体-吗阴性反应阳性反应间接法原理以HIV 为例(检测抗体)此方法主要用于血清中抗体检测,纯化或者重组的抗原固定于NC 膜上,标记多为蛋白A(ProteinA 或叫SPA ,抗体Fc 端结合而与其它蛋白质不结合)。
此方法要求胶体金过量,一般来说样品再加入前需要稀释或者加极少量后再加缓冲液。
斑点免疫渗滤法使用就是间接法。
显示红色 显示红色显示红色不显色。
免疫胶体金技术

免疫胶体金技术(一) 原理免疫胶体金技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。
胶体金是由氯金酸(HAuCl)在还原剂如白磷、抗坏血酸、枸橼酸钠、鞣酸等作用下,聚合成为特定大小的金颗粒,并4由于静电作用成为一种稳定的胶体状态,称为胶体金。
胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
胶体金除了与蛋白质结合以外,还可以与许多其它生物大分子结合,如SPA、PHA、ConA等。
根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,因而使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。
(二) 胶体金的制备根据不同的还原剂可以制备大小不同的胶体金颗粒。
常用来制备胶体金颗粒的方法如下。
1(枸橼酸三钠还原法(1)10nm胶体金粒的制备:取0.01,HAuCl水溶液100ml,加入1,枸橼酸三钠水溶液3ml,加热煮4沸30min,冷却至4?,溶液呈红色。
(2)15nm胶体金颗粒的制备:取0.01,HAuCl水溶液100ml,加入1,枸橼酸三钠水溶液2ml,加热4煮沸15min,30min,直至颜色变红。
冷却后加入0.1Mol/L KCO0.5ml,混匀即可。
23(3)15nm、18nm,20nm、30nm或50nm胶体金颗粒的制备:取0.01,HAuCl水溶液100ml,加热煮4沸。
根据需要迅速加入1,枸橼酸三钠水溶液4ml、2.5ml、1ml或0.75ml,继续煮沸约5min,出现橙红色。
这样制成的胶体金颗粒则分别为15nm、18,20nm、30nm和50nm。
2(鞣酸—枸橼酸钠还原法A液:1,HAuCl水溶液1ml加入79ml双馏水中混匀。
4B液:1,枸橼酸三钠4ml,1,鞣酸0.7ml,0.1Mol/L KCO液0.2ml,混合,加入双馏水至20ml。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双抗体夹心法原理
以FABP 为例(检测抗原)
阳性反应
Y1=F14A (标记了胶体金)
Y2=F104B (固定在NC 膜上即T 线)
Y3=羊抗鼠IgG (固定在NC 膜上即C 线)
此方法较常用,主要用于较大分子量的蛋白(抗原)的检测。
要求两株抗体针对一个抗原的不同位点才可以。
也有个别的检测项目是双抗原夹心检测抗体的,原理类似。
样品(血清)含FABP 蛋白
金标记F14A 抗体
金-F14A-FABP
金-F14A-FABP-F14A
金-F14A-羊抗鼠IgG
金-F14A-FABP
羊抗鼠IgG
显示红色 显示红色
金标记F14A 抗体
不显色 显示红色
金-F14A-羊抗鼠IgG
阴性反应
阳性反应
竞争法原理
以吗啡为例(检测抗原)
阳性反应
Y1=胶体金标记的吗啡单抗 Y2=吗啡-BSA 偶联物 Y3=羊抗鼠
此方法主要用于小分子抗原(毒品、农药、肽链等)的检测。
由于抗原分子量小不能直接固定于NC 膜上,常常用化学方法把小分子偶联到BSA 等大分子物质上再固定于NC 膜上。
此结果与双抗原夹心法相反,阴性CT 两条都是红线,阳性只有C 线一条红线。
金-吗啡抗体-吗啡
吗啡-BSA
金标记吗啡抗体
显示红色
不显色
金-吗啡抗体-吗啡
羊抗鼠
样品(尿液)含吗啡
显示红色
显示红色 金标记吗啡抗体
金-吗啡抗体-羊抗鼠
阴性尿液抗体-吗
阴性反应
阳性反应
间接法原理
以HIV 为例(检测抗体)
此方法主要用于血清中抗体检测,纯化或者重组的抗原固定于NC 膜上,标记多为蛋白A(ProteinA 或叫SPA ,抗体Fc 端结合而与其它蛋白质不结合)。
此方法要求胶体金过量,一般来说样品再加入前需要稀释或者加极少量后再加缓冲液。
斑点免疫渗滤法使用就是间接法。
显示红色 显示红色
显示红色
不显色。
