人教版高中化学选修四第一章
人教版高中化学选修四第一章 第二节 燃烧热 能源

第二节燃烧热能源[核心素养发展目标] 1.宏观辨识与微观探析:在理解反应热和中和热的基础上,从宏观上理解辨识燃烧热的概念,能正确书写关于燃烧热的热化学方程式,学会关于燃烧热的相关计算。
2.科学态度与社会责任:在日常生活和化工生产中,形成科学合理利用化学反应中能量变化的意识和能源节约意识,认识化学在解决能源危机中的重要作用。
一、燃烧热1.燃烧热的概念在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。
燃烧热的单位是kJ·mol-1。
2.燃烧热的意义甲烷的燃烧热为890.31 kJ·mol-1,或ΔH=-890.31 kJ·mol-1,它表示25 ℃、101 kPa时,1 mol 甲烷完全燃烧生成CO2和液态H2O时放出890.31 kJ的热量。
3.燃烧热的计算由燃烧热定义可知:25 ℃、101 kPa时,可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热,即Q放=n(可燃物)×|ΔH|;或变换一下求物质的燃烧热:ΔH=-Q放n(可燃物)。
此公式中的ΔH是指物质的燃烧热,而不是指一般反应的反应热。
例1下列热化学方程式中能表示可燃物燃烧热的是( )A .CO(g)+12O 2(g)===CO 2(g) ΔH =-283 kJ·mol -1B .CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH =-802.3 kJ·mol -1C .2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol -1 D .2H 2(g)+O 2(g)===2H 2O(g) ΔH =-484.0 kJ·mol -1 答案 A解析 表示燃烧热的热化学方程式要求1 mol 纯物质完全燃烧,生成稳定的燃烧产物。
符合要求的只有A 项。
特别提示——书写表示燃烧热的热化学方程式的注意事项 (1)注意燃烧热的符号,ΔH 一定为负值,单位为kJ·mol -1。
人教版高中化学选修四第一章第二节中和热燃烧热课件(共14张PPT)

燃中烧和热热 燃能烧源热
二、燃烧热
1.定义:在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放 出的热量,叫做该物质的燃烧热。 2.理解: ①燃烧热属于反应热,也用ΔH表示,单位也为 kJ/mol。 叙述时直接读出“数值” 如甲烷的燃烧热为890.31kJ/mol 也可用ΔH表示,如ΔH=-890.31kJ/mol ②燃烧热的测定条件通常是101kPa.
热量。
4. 若是弱酸和弱碱在发生中和反应的同时还要发生电离,电离要吸收热量,
故放出的热量均不完全是中和热。
中 小学班 级安全 教育工 作计划 范文
作 为 班 主 任 ,班级安 全工作 职责重 大,务必 常抓不 懈,富 有实效 。今年 ,我班将 进一步 认 真 学 习 贯 彻加强 学校安 全工作 的有关 文件,以 学生安 全工作 为中心 ,避免各类事故
燃中烧和热热 燃能烧源热
【练习】已知: 2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ/mol H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol 求氢气的燃烧热。
注意H2为1mol,生成水为液态 答案:氢气的燃烧热ΔH= -285.8 kJ/mol
化学 ·选修 4
第一章第二节 中和热 燃烧热
燃中烧和热热 燃能烧源热
学习目标
1.理解中和热、燃烧热的概念 2.会书写中和热、燃烧热的热化学方程式 教学重点 中和热、燃烧热的概念。 教学难点 中和热、燃烧热的热化学方程式的书写
燃中烧和热热 燃能烧源热
复习引入 写热化学方程式 ⑴1L1mol/L稀盐酸和1L1mol/LNaOH溶液发生中和反应放出的热量 为57.3kJ。
的 发生。
人教版高中化学选修四第一章重要知识点总结
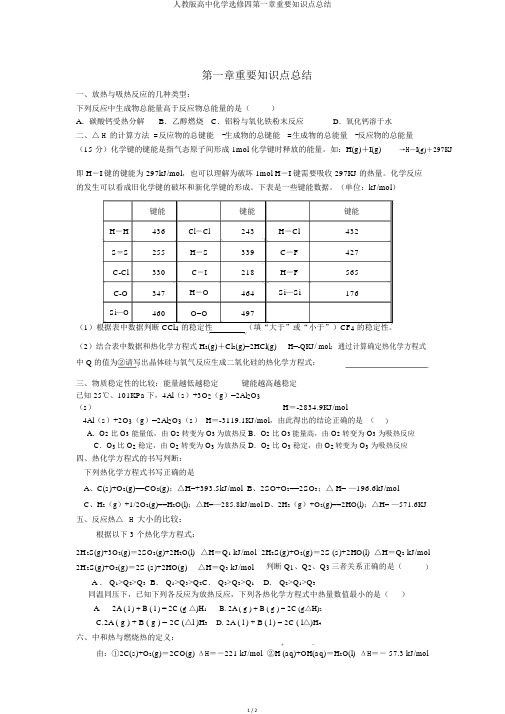
第一章重要知识点总结一、放热与吸热反应的几种类型:下列反应中生成物总能量高于反应物总能量的是()A.碳酸钙受热分解B.乙醇燃烧C.铝粉与氧化铁粉末反应D.氧化钙溶于水二、△ H 的计算方法 =反应物的总键能-生成物的总键能=生成物的总能量-反应物的总能量(15 分)化学键的键能是指气态原子间形成 1mol 化学键时释放的能量。
如:H(g)+I(g)→H-I(g)+297KJ即 H-I 键的键能为 297kJ/mol,也可以理解为破坏 1mol H-I 键需要吸收 297KJ的热量。
化学反应的发生可以看成旧化学键的破坏和新化学键的形成。
下表是一些键能数据。
(单位:kJ/mol)键能键能键能H-H 436 Cl-Cl 243 H-Cl 432S=S 255 H-S 339 C-F 427C-Cl 330 C-I 218 H-F 565C-O 347 H-O 464 Si—Si 176Si—O 460 O=O 497(1)根据表中数据判断 CCl4的稳定性(填“大于”或“小于”)CF4的稳定性。
(2)结合表中数据和热化学方程式 H2(g)+Cl2(g)=2HCl(g) H=-QKJ/ mol;通过计算确定热化学方程式中 Q 的值为②请写出晶体硅与氧气反应生成二氧化硅的热化学方程式:三、物质稳定性的比较:能量越低越稳定键能越高越稳定已知 25℃、101KPa下,4Al(s)+3O2(g)=2Al2O3(s)H=-2834.9KJ/mol4Al(s)+2O3(g)=2Al2O3(s) H=-3119.1KJ/mol,由此得出的结论正确的是()A.O2比 O3能量低,由 O2转变为 O3为放热反 B.O2比 O3能量高,由 O2转变为 O3为吸热反应C.O3比 O2稳定,由 O2转变为 O3为放热反 D.O2比 O3稳定,由 O2转变为 O3为吸热反应四、热化学方程式的书写判断:下列热化学方程式书写正确的是A、C(s)+O2(g)==CO2(g);△H=+393.5kJ/molB、2SO+O2==2SO3;△ H= —196.6kJ/molC、H2(g)+1/2O2(g)==H2O(l);△H=—285.8kJ/molD、2H2(g)+O2(g)==2HO(l);△H= —571.6KJ五、反应热△H 大小的比较:根据以下 3 个热化学方程式:2H 2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=Q1 kJ/mol 2H2S(g)+O2(g)=2S (s)+2HO(l) △H=Q2 kJ/mol2H 2S(g)+O2(g)=2S (s)+2HO(g) △H=Q3 kJ/mol 判断 Q1、Q2、Q3三者关系正确的是()A . Q1>Q2>Q3 B. Q1>Q3>Q2C. Q3>Q2>Q1 D. Q2>Q1>Q3同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是()A.2A ( l ) + B ( l ) = 2C (g △)H1 C.2A ( g ) + B ( g ) = 2C (△l )H3B. 2A ( g ) + B ( g ) = 2C (g△H)2 D. 2A ( l ) + B ( l ) = 2C ( l△)H4六、中和热与燃烧热的定义:由:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol+-②H (aq)+OH(aq)=H2O(l) ΔH=- 57.3 kJ/mol可知:()A.①的反应热为 221 kJ/mol B.稀硫酸与 Ba(OH)2稀溶液反应的中和热为 57.3 kJ/molC.碳的燃烧热大于 110.5 kJ/mol D.稀醋酸与稀 NaOH溶液反应生成 1 mol 水,放出 57.3 kJ热量七、 n mol 可燃物放出的热量 =n 乘以它的燃烧热已知 H2(g)、C2H4(g)和 C2H5OH(1)的燃烧热分别是 -285.8 kJ·mol-1、-1411.0 kJ·mol-1和-1366.8 kJ mol-1,则由等质量的各物质放出的热量比()A .4.8:1.5:1B. 1:3.2:1.5 C. 3.2:5:1D.1.5:1:2八、能源探究问题:未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。
《盖斯定律及应用》教学设计(含解析)人教版高中化学选修4

盖斯定律的内容、理解及应用。
教学难点
盖斯定律的理解及应用
教学过程
教学步骤、内容
教学方法
【引入】1840年,盖斯(G·H·Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。
【互动】
【典例】已知:
①2C(s)+O2(g)===2CO(g)ΔH=-221.0 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为()
A.+262.6 kJ·mol-1B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1D.+131.3 kJ·mol-1
【答案】 D
【解析】 根据盖斯定律,由题意知:
①×1/2-②×1/2得:ΔH=(-221.0 kJ·mol-1)×1/2-(-483.6 kJ·mol-1)×1/2=+131.3 kJ·mol-1。
【提问】请观察思考:ΔH、ΔH1、ΔH2之间有何关系?
【交流】不管化学反应是一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。这就是盖斯定律。
【投影】讲述盖斯的生平事迹。盖斯是俄国化学家,早年从事分析化学研究,1830年专门从事
化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的能量。1836年经过多次试验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1860年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求计算反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
人教版高中化学选修四第一章 第三节 化学反应热的计算

第三节化学反应热的计算[核心素养发展目标] 1.证据推理与模型认知:构建盖斯定律模型,理解盖斯定律的本质,形成运用盖斯定律进行相关判断或计算的思维模型。
2.科学态度与社会责任:了解盖斯定律对反应热测定的重要意义,增强为人类科学发展而努力的意识与社会责任感。
一、盖斯定律1.盖斯定律的理解(1)大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
(2)化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(3)始态和终态相同反应的途径有如下三种:ΔH =ΔH 1+ΔH 2=ΔH 3+ΔH 4+ΔH 5 2.盖斯定律的应用 根据如下两个反应Ⅰ.C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ·mol -1 Ⅱ.CO(g)+12O 2(g)===CO 2(g) ΔH 2=-283.0 kJ·mol -1选用两种方法,计算出C(s)+12O 2(g)===CO(g)的反应热ΔH 。
(1)虚拟路径法反应C(s)+O 2(g)===CO 2(g)的途径可设计如下:则ΔH =-110.5 kJ·mol -1。
(2)加合法①写出目标反应的热化学方程式,确定各物质在各反应中的位置, C(s)+12O 2(g)===CO(g)。
②将已知热化学方程式Ⅱ变形,得反应Ⅲ: CO 2(g)===CO(g)+12O 2(g) ΔH 3=+283.0 kJ·mol -1;③将热化学方程式相加,ΔH 也相加:Ⅰ+Ⅲ得, C(s)+12O 2(g)===CO(g) ΔH =ΔH 1+ΔH 3,则ΔH =-110.5 kJ·mol -1。
(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数;(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减(带符号);(3)将一个热化学方程式颠倒时,ΔH的“+”“-”号必须随之改变,但数值不变。
高中化学 人教版选修4 课件:第一章 第一节 第1课时 化学反应与能量变化(37张PPT)

由于ΔH与反应完成的物质的量有关,所以方程式中化学
式前面的化学计量数必须与ΔH相对应,如果化学计量数加倍, 则ΔH也要加倍。当反应逆向进行时,其反应热与正反应的反 应热数值相等,符号相反。
栏 目 链 接
(4)与反应热的关系:
恒压 条件下,反应的热效应等于________ 焓变 。因此, ________ 我们常用________ ΔH 表示反应热。
(5)焓变(ΔH)的正负与吸热、放热反应的关系: < 0( 填“>”或“<” ) ,即 若为放热反应, ΔH________ ΔH为________( 填“+”或“-”)。 - > 0( 填“>”或“<” ) ,即 若为吸热反应, ΔH________ ΔH为+ ________(填“+”或“-”)。
(2)吸热反应:反应完成时,生成物释放的总能量 小于 反应物吸收的总能量的反应。由于反应时吸收环境 ________ 升高 ,故ΔH________0( > 能量而使反应体系的能量________ 填“<” + 填“+”或“-”)。 或“>”),即ΔH为________(
栏 目 链 接
应用 思考 1.浓硫酸溶于水放出热量,是放热反应吗?NH4NO3晶 体溶于水吸收热量,是吸热反应吗? 提示:放热(吸热)反应是指放出(吸收)热量的化学反应, 而浓H2SO4溶于水是浓溶液的稀释过程,NH4NO3溶于水是
栏 目 链 接
溶解过程,没有新物质生成,都不是化学反应,故浓硫酸溶
于水不是放热反应,NH4NO3晶体溶于水不是吸热反应。
2.任何化学反应都有反应热吗?为什么?
提示:任何化学反应都有反应热。这是由于在化学反应 过程中,当反应物分子间的化学键断裂时,需要克服原子间 的相互作用,这需要吸收能量;当原子重新结合成生成物分
高中化学选修四第一章 热化学概论

第一章 第一节 化学反应与能量的变化教学目标知识与技能:1.使学生了解化学反应中能量转化的原因和常见的能量转化形式;2.认识化学反应过程的物质变化和能量变化;3.了解反应热和焓变的涵义;4.能正确认识、书写热化学方程式。
过程与方法:1.通过对学习资料的查找与交流,培养学生获取信息、理解信息并得出结论的能力以及语言表达能力;2.通过从化学键的角度分析化学反应,引导学生分析引起反应热的本质。
情感态度与价值观:培养学生从微观的角度理解化学问题。
教学重点:热化学方程式的书写和反应热与键能教学难点:反应热与键能教学过程:第一节 化学反应和能量变化一、概念1.化学反应及其能量变化任何一个化学反应中,反应物所具有的总能量与生成物所具有的总能量总不会相等的。
在新物质产生的同时总是伴随着能量的变化。
2.放热反应和吸热反应(1)放热反应:即有热量放出的化学反应,其反应物的总能量大于生成物的总能量。
(2)吸热反应:即吸收热量的化学反应,其反应物的总能量小于生成物的总能量。
3.化学反应中的能量变化示意图对于该“示意图”可理解为下列形式:由能量守恒可得:反应物的总能量:生成物的总能量+热量(放热反应)应物的总能量:生成物的总能量-热量(吸热反应)4.热化学方程式的书写:(1)热化学方程式必须标有热量变化。
(2)热化学方程式中必须标明反应物和生成物的状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。
(3)热化学方程式中各物质的系数只表示各物质对应的物质的量,因此,有时可用分数表示,但要注意反应热也发生相应变化。
5.书写热化学方程式时明确以下问题:(1)反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa 和25℃时的数据。
(2)物质的聚集状态不同,反应吸收和放出的热量不同,因此要注明反应物和生成物的聚集状态。
(3)热化学方程式中的热量数据,是与各化学计量数为物质的量时相对应的,不是几个分子反应的热效应。
(完整版)化学选修4(新人教版)

(完整版)化学选修4(新人教版)新人教版《化学反应原理》全册知识点归纳第一章化学反应与能量一、焓变反应热1.反应热(Q):一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol(3)△H=H(生成物)-H(反应物)3.微观角度解释产生原因:化学键断裂——吸热化学键形成——放热放出热量的化学反应。
(放热>吸热)△H为“-”或△H<0吸收热量的化学反应。
(吸热>放热)△H为“+”或△H>0注:(高中阶段Q与△H二者通用)(4)影响晗变的主要因素:①发生变化的物质的物质的量,在其他条件一定时与变化物质的物质的量程正比。
②物质的温度和压强☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸或水的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH)2?8H2O与NH4Cl②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等二、热化学方程式书写化学方程式注意要点:①热化学方程式必须标出能量变化。
②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)③热化学反应方程式要指明反应时的温度和压强。
④热化学方程式中的化学计量数可以是整数,也可以是分数⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变三、燃烧热1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
燃烧热的单位用kJ/mol表示。
※注意以下几点:①研究条件:101kPa②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1mol④研究内容:放出的热量。
(ΔH<0,单位kJ/mol)四、中和热1.概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学学习材料(精心收集**整理制作)人教版选修4第一章《化学反应与能量》测试题广州市高二化学中心组提供2008.9 本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,考试时间40分钟。
第一部分选择题(共50分)一、选择题(每小题5分,每小题有1.~.2.个.选项符合题意,错选0分,漏选2分,共50分。
)1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。
下列属于未来新能源标准的是①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦⑧2.下列说法中正确的是A.在化学反应过程中,发生物质变化的同时不一定发生能量变化B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0D.ΔH的大小与热化学方程式的计量系数无关3.下列过程中△H小于零的是A. 氯酸钾分解制氧气B. 氯化铵分解得氨气C.碳酸钙分解得二氧化碳D. 实验室制备氢气4.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。
且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为A.920 kJ B.557 kJ C.436 kJ D.188 kJ5.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H46.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H =-57.3KJ·mol-1。
分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是A.△H1>△H2>△H3B.△H1<△H2<△H3C.△H1>△H2=△H3D.△H1=△H2<△H37.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。
这现象说明了A. 该反应是吸热反应B. 该反应是放热反应C. 铁粉和硫粉在常温下难以发生反应D. 硫化亚铁的总能量高于铁粉和硫粉的总能量8.以N A代表阿伏加德罗常数,则关于热化学方程式C2H2 ( g ) +5/2O2 ( g ) →2CO2 ( g )+H2O ( l )△H = —1300kJ / mol 的说法中,正确的是A. 当10 N A个电子转移时,该反应放出1300kJ的能量B. 当1 N A个水分子生成且为液体时,吸收1300kJ的能量C. 当2 N A个碳氧共用电子对生成时,放出1300kJ的能量D. 当8 N A个碳氧共用电子对生成时,放出1300kJ的能量9.下列说法或表示法正确的是A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B.由C(石墨)→C(金刚石) ΔH = +119 kJ·mol—1可知,石墨比金刚石稳定C.在稀溶液中:H++OH-===H2O ΔH = -57.3 kJ·mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJD.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)===2H2O(l)ΔH = +285.8 kJ·mol—110.一些盐的结晶水合物,在温度不太高时就有熔化现象,即熔溶于自身的洁净水中,又同时吸收热量。
他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。
故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。
现有几种盐的结晶水合物有关数据如下:根据上述数据和实用性考虑,实际运用时常采用的物质应该是A.① B.②C.③ D.④高二班姓名学号成绩第二部分非选择题(共50分)二、非选择题(共50分)11。
(12分)实验室利用右图装置进行中和热的测定,请回答下列问题:(1)在操作正确的前提下,提高中和热测定准确性的关键是(2)做1次完整的中和热测定实验,温度计需使用次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?(3)请为本实验设计数据记录表格:12.(15分)已知化学反应N2+3H2=2NH3的能量变化如图所示,(1)1mol N 和3mol H 生成1mol NH3① Na2S2O3·5H2O ②CaCl2·6H2O ③Na2SO4·10H2O ④ Na2HPO4·10H2O 熔点/℃40~50 29.92 32.38 35.1 熔化热/kJ· mol-149.7 37.3 77 100.1(g)是--------------------------------能量的过程(填“吸收”或“释放”)。
(2)12N2(g)+32H2(g)=NH3(g);△H= ;(3)N2(g)和H2生成NH3(1)的热化学方程式为------------------------------------------------------13.(13分)某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺,因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。
”(已知煤炭的燃烧热为-393.15 kJ/mol,氢气的燃烧热为-242 kJ/mol,一氧化碳的燃烧热为-283 kJ/mol)(1)写出该同学看到燃烧现象所涉及到的所有热化学反应方程式;;你认为该同学的结论是否正确,请简要说明理由。
14.(10分)已知2H2(g)+ O2(g)===2H2O(l)ΔH = —571.6 kJ·mol—1CO(g) + 1/2O2(g) == CO2(g) △H = -283 kJ·mol—1某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,求原混合气体中H2和CO的物质的量。
人教版选修4第一章《化学反应与能量》测试题参考答案一、选择题(每小题5分,每小题有1.~.2.个.选项符合题意,错选0分,漏选2分,共50分。
)题号 1 2 3 4 5 6 7 8 9 10答案 B C D C C B BC AD BC C二、非选择题(共50分)11.(1)保温(2分)(2)3次(2分)不同意,因为不同的温度计误差不同。
(3分)(3)(5分)温度实验次数起始温度t1/℃终止温度t2/℃温度差(t2—t1)/℃HCl NaOH 平均值12312(1)释放(2)(a-b) kJ·mol-1(3)N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-113.(1)C(s) +O2 (g) =CO2(g) △H = -393.15 kJ/mol (2分)H2 (g) +1/2 O2 (g) =H2O (l) △H = -242 kJ/mol(2分)CO(g) +1/2 O2 (g) =CO2(g) △H = -283 kJ/mol(2分)C(g) +H2O (l) =CO(g) +H2 (g) △H = +131.85 kJ/mol(4分)(2)不正确。
因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关。
(3分)14.n(H2) ==0.2mol n(co)==0.20mol备选题1.下列反应中反应物总能量高于生成物总能量的是A.二氧化碳与碳生成一氧化碳B.碳与水蒸气生成一氧化碳和氢气C.碳酸钙受热分解D.盐酸与氢氧化钠反应2.氢气是人类最理想的能源。
已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是A.2H2 + O2==2H2O;△H= –142.9 kJ/molB.2H2(g) + O2(g)==2H2O(l);△H= – 142.9 kJ/molC.2H2(g) + O2(g) 2H2O(l);△H=– 571.6 kJ/molD.2H2(g) + O2(g) 2H2O(l);△H = + 571.6 kJ/mol3.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g) + 1/2O2(g) == H2O (l) △H = -285.8 KJ/molCO(g) + 1/2O2(g) == CO2(g) △H = -283 KJ/molC8H18 (l) + 25/2O2(g) == 8CO2(g) + 9H2O (l) △H = -5518 KJ/molCH4 (g) + 2O2(g) == CO2(g) + 2H2O (l) △H = -890.3 KJ/mol相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是A.H2(g) B.CO(g) C.C8H18 (l) D.CH4 (g)4.下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/molB.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=+566.0kJ/mol C.需要加热才能发生的反应一定是吸热反应D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热5.下列有关能量转换的说法正确的是反应过程能量(kJ/mol )反应物分子 生成物 分子 活化 分子反应物的总能量(E 1) 生成物的 总能量(E 2)(Ⅰ)(Ⅱ) 活化分子的最低能量12A 、煤燃烧是化学能转化为热能的过程B 、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能C 、动物体内葡萄糖被氧化成CO 2是热能转变成化学能的过程D 、植物通过光合作用将CO 2转化为葡萄糖是太阳能转变成热能的过程 6.已知:(1)Zn (s )+1/2O 2(g )==ZnO(s),ΔH = -348.3kJ/mol(2)2Ag(s)+1/2 O 2(g )== Ag 2O(s),ΔH = -31.0kJ/mol 则Zn (s )+ Ag 2O(s) == ZnO(s) + 2Ag(s) 的ΔH 等于A .-317.3kJ/molB .-379.3kJ/molC .-332.8 kJ/molD .317.3 kJ/mol 7.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是 ①CH 3OH(g)+H 2O(g) = CO 2(g)+3H 2(g) △H = + 49. 0 kJ ·mol -1②CH 3OH(g)+1/2O 2(g) = CO 2(g)+2H 2(g) △H =-192. 9 kJ ·mol -1下列说法正确的是A .CH 3OH 的燃烧热为192. 9 kJ ·mol -1B .反应①中的能量变化如右图所示C .CH 3OH 转变成H 2的过程一定要吸收能量D .根据②推知反应:CH 3OH(l) +1/2O 2(g) = CO 2(g) +2H 2(g) △H >-192. 9kJ ·mol -18.(16分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。
