无机化学 氢和氢化物 PPT课件
无机化学课本不完全总结课件

第十章 氢、碱金属和碱土金属一、1、氢气的制备:实验室:Zn+2HCl=ZnCl2+H2↑军事上:CaH2 +2H2O → Ca (OH )2 + 2H2↑2、氢化物氢化物共分为离子型、共价型、过渡型离子型氢化物是极强的还原剂:TiCl4+4NaH Ti +4NaCl +2H2↑ LiH 能在乙醚中同B3+ Al3+ Ga3+ 等的无水氯化物结合成复合氢化物,如氢化铝锂的生成。
4LiH + AlCl3乙醚 Li[AlH4] + 3LiCl 氢化铝锂遇水发生猛烈反应Li[AlH4]+4H2O=LiOH↓+Al(OH)3↓+4H2↑二、 碱金属与碱土金属(铍、镁除外)元素溶于液氨,生成溶剂合电子和阳离子成具有导电性的深蓝色溶液。
碱金属 M(S) + (x+y)NH3 M+(NH3)x + e-(NH3)y碱土金属 M(S) + (x+2y)NH3 M2+(NH3)x + 2e-(NH3)2KNO3+10K=6K20+N2↑碱土金属氧化物也可以由他们的碳酸盐或硝酸盐加热分解得到。
CaCO3CaO +CO2↑ 2Sr(NO3)22SrO +4NO2+O2↑过氧化物与超氧化物过氧化物是含有过氧基(—O —O —)的化合物,可看作是H2O2的衍生物。
除铍外,所有碱金属和碱土金属都能形成离子型过氧化物。
2Na +O2 Na2O2 除锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。
K +O2=KO2臭氧化物在低温下通过O3与粉末状无水碱金属(除Li 外)氢氧化物反应,并用液氨提取,即可得到红色的MO3固体:3MOH(S)+2O3(g)=2MO3(s)+MOH ·H2O(s)+1/2O2(g)三、氢氧化物碱金属和碱土金属的氧化物(除BeO 、MgO 外)与水作用,即可得到相应的氢氧化物,并伴随着释放出大量的热:M2O +H2O=2MOHMO+H2O=M(OH)2碱金属和碱土金属的氢氧化物的碱性碱金属和碱土金属氢氧化物[除Be (OH )2外]均成碱性,同族元素氢氧化物碱性均随金属金属元素原子序数的增加而增强。
无机化学元素及化合物

六、卤化物
卤素有很强的氧化性。其它元素和氟形 成氟化物,其它元素往往表现出最高氧化态。 F → I,氧化性减弱。其它元素和 I 化合时, 表现出较低的氧化态,如CuI。 大多数金属卤化物可以由元素的单质直 接化合生成。 nX2 + 2M = 2MXn
1)
2) 3)
4.
活泼金属生成离子型化合物; 与电负性小的非金属元素化合成 极性共价键; 配位键 除F 外,Cl、Br、I 可显示正氧化 态,氧化数为+1、+3、+5、+7
三、卤素单质及性质
1、氟 氟是最活泼的非金属元素,氟单质是目前已知的最强氧化剂。 与金属反应:在高温和低温可以和所有的金属直接反应生成高价 氟化物。 nF2+2M = 2MFn 与非金属反应:氟几乎能与所有非金属(氧、氮除外)直接化合 2F2 + S = SF4 (SF6) 2F2 + Si = SiF4 3F2 + 2P = 2PF3 (PF5) 甚至能氧化极不活泼的稀有气体氙,也能在523 K与氟反应生成 氟化物: F2 + Xe = XeF2 (XeF4、XeF6) • 氟是人体形成强壮的骨骼和预防龋齿所必需的微量元素。 • 氟化物无论是气态、液态还是固态都对皮肤有严重的灼伤,这是 由于氟化物的水解产生氟化氢的缘故。 •氟能氧化高能燃料:2F2+N2H4=N2+4HF; •CaF2、MgF2难溶于水,AgF可溶于水; •氟能使硫氧化为+6价,其它卤素均不能将硫氧化为+6价。
四、卤素的存在、提取和用途
1.
氟的制备
氟的生产不能使用水溶液电解质,这是由
于产生的氟会立即氧化H2O。
工业上通常是电解熔融HF中的KF(即KHF2 )
第14章氢ppt课件

可
硒镍
见
化 镉
光
半
H2(g)
导
Fe(Ⅱ ),Fe(Ⅲ) 体 箔 电解质溶液
海水
海水制氢的装置示意图
我国已建成大型制氢设备
大容量电解槽体
H2
大型制氢站
氢气纯化装置
氢气储罐群
14.1.3 用途
燃料
氢 气(H2) 戊硼烷(B5H9) 戊 烷(C5H12)
燃烧值/kJ·kg-1 120918 64183 43367
,半径介于 F-与 Cl-间. 因此才显示出 NaCl 型.
(3)H-存在的重要化学证据:电解其与碱金属的熔融物,阳极放H2: 2 H- →H2 + 2e-
(4) 与水反应的实质是
H- +H2O → OH- + H2
(5)
此时 H- 表现出强还原性、不稳定性和强碱性.
(6)
利用这种性质可以 在实验室用来除去有机溶剂或惰性气体(如
CO2溶于水而分离出 H2 .
CO + H2 + H2O(g)
Fe2O3 > 723 K
CO2 + 2 H2
Question
1 用焦炭或天然气与水反应制 H2 ,为什么 都需在高温下进行?
因为这两个反应都是吸热反应:
CH4(g) + H2O(g) C (s) + H2O(g)
3 H2(g) + CO(g),ΔHθm = 206.0 kJ•mol–1 H2(g) + CO(g), ΔHθm = 131.3 kJ•mol–1
氢气的储存
氢气的输送(利用)
14.2 核性质
(1) 同位素 主要同位素有3种,此外还有瞬间即逝的 4H 和 5H. 重氢以重水
无机化学——元素概论:氢
工业上:1. 矿物燃料转化法
(1) 天然气或焦炭与水蒸气作用, 得到水煤气
CH4
+
H2O
700-870℃ Ni、Co催化剂
CO + 3H2
C + H2O 1000℃ CO + H2
(2) 水煤气与水蒸气反应,得到CO2和H2的混合气
CO + H2O Fe、Cr催化剂 CO2 + H2
含量/% 99.98 0.016 0.004
目前世界各地建造的实验性聚变反应堆
用的是一种D和T构成的等离子体燃料
9.2.1 氢原子的性质及其成键特征
氢有三种同位素
符号 含量/%
11H
H
99.98
21H
D
0.016
31H
T
0.004
∵三种同位素质子数相同, 中子数不同 ∴它们的单质和化合物的化学性质基本
9.2.2 氢气的性质和用途
1. 氢气是无色、
熔点/℃ -259.23
无味、无臭 的可燃性气
沸点/℃ -252.77
体,是所有 气体中最轻
气体密氢度气球8.可98携8×带1仪0-5器作高的空探测
也可携带干冰、碘化银等试剂进 (g·行cm人-3)工(降为空雨气的1/14倍)
9.2.2 氢气的性质和用途
元素概论
氢
ⅠA
1 1 ⅡA H
元素周期表
0
ⅢAⅣAⅤAⅥAⅦA 2 He
23 4
5 6 7 8 9 10
Li Be
B C N O F Ne
3 11 12 ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
氢气的化学性质PPT共27页

16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
谢谢!
61、奢侈是舒适的,否则就不是奢侈 。好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
无机化学-氧族元素-氢化物 (3)
H3PO3 H3PO2 H3PO4
Ka1 6.3×10-2 1.0×10-2 6.7×10-3
•缩合度增加,酸性增强
H5P3O10 H4P2O7 H3PO4
Ka1
2.9×10-2 6.7×10-3
Ka2 10-2 5.3×10-3 6.2×10-8
Ka3 10-3 2.2×10-7 4.5×10-13
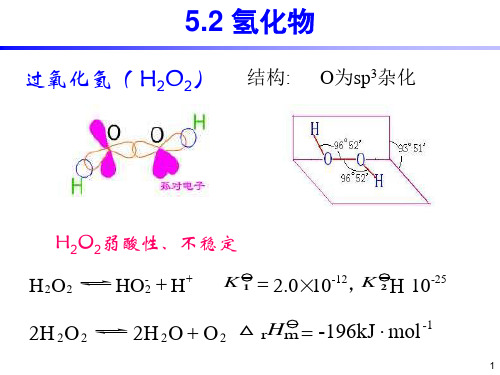
5.2 氢化物
过氧化氢( H2O2) 结构: O为sp3杂化
H2O2弱酸性、不稳定
H2O2
HO-2 + H+ K 1 = 2.0×10-12,K 2 10-25
2H 2O2
2H 2O + O2 △ rHm = -#43;+O2+2e=H2O2 EA=0.68V 2Fe3++2e=2Fe2+ EA=0.77V 2Fe3++H2O2=2Fe2++2H++O2
EA
O2 0.6945V H2O2 1.763V H2O
EB HO-2 + H2O + 2e- 3OH- , EB = 0.867V
3H2O2 + 2MnO4- = 2MnO2↓+3O2↑+2OH- + 2H2O 5H2O2 + 2MnO4-+6H+ = 2Mn2+ + 5O2 ↑ + 8H2O H2O2 + Mn(OH)2 = MnO2 ↓ + 2H2O 3H2O2+2NaCrO2+2NaOH = 2Na2CrO4 + 4H2O H2O2+ 2Fe2++2H+ = 2Fe3++2H2O
无机化学:第5章 氢和稀有气体

如:PdHx(x<1),CrH2 ,VH0.56
2021/3/19
9
物理性质:基本保留着金属的外观特征, 有金属光泽,有导电性。
M(S)+
X 2
H2(g)
吸氢 放氢
MHx(s)
U(s)+
3 2
H2(g)
2021/3/19
18
2.氙的含氧化合物
XeO3白色易潮解、易爆固体,水中以分子形 式存在。强氧化性。
2021/3/19
19
五、稀有气体化合物的结构
1.杂化轨道法 Xe:ns2np6→ ns2np6-xndx XeF2 ,x=1,sp3d杂化(三角双锥),直线型。 XeF4 ,x=2,sp3d2杂化(八面体),四边形。 XeF6 ,x=3,sp3d3杂化,变形八面体。
Xe(g)+nF2(g)→XeF2 、XeF4 、XeF6(镍容器) 性质:强氧化性:XeF2+H2 →Xe+HF
XeF4+Pt→Xe+PtF4 水解:XeF2+H2O →Xe+1/2O2 +2HF
XeF6+3H2O →XeO3+6HF 作氟化剂:XeF4+2SF4 →2SF6+Xe
2XeF6+SiO2 →2XeOF4+SiF4 不能用玻璃容器或石英容器盛氟化氙。
2021/3/19
20
2.价层电子对互斥理论
价层电子对及构型 分子构型
XeF2 XeF4 XeF6
5 三角双锥 直线
6 八面体 平面正方形
7-
重要非金属元素—氢(无机化学课件)

本实验要注意哪些问题?
先通氢气排完空气
反应结束后须继续 通入氢气
试管向下倾斜, 避免水滴回流
酒精灯在验完氢气 浓度后点燃,氧化 铜变红后撤走
04
氢气的用途
四、氢气的用途
密度比空气小
探空气球
四、氢气的用途
高能燃料 氢氧焰
四、氢气的用途
冶炼金属 合成氨 制取盐酸
课程小结
本节重点
① 通常情况下,氢气是无色、无味的气体 ② 难溶于水
无机化学
˝
氢元素及其单质
氢
氢气球爆炸视频 (00'04”-00'16)
为什么气球能飞? 为什么气球易爆炸? 为什么还会引起火灾?
目录
CONTENTS
01 氢 元 素 ( H ) 02 氢 气 物 理 性 质 03 氢 气 化 学 性 质 04 氢 气 的 用 途
01
氢元素(H)
一、氢元素(H)
三、氢气化学性质
1. 可燃性
(1)纯净的氢气在空气里安然燃烧
产生淡蓝色火焰,烧杯壁上会有水珠生成
(2)不纯净的氢气燃烧
可能发生爆炸
反应方程式:2H2+O2=2H2O
三、氢气化学性质
视频 (00'05”-00'15 00'40”-01'30)
氢气燃烧视频
三、氢气化学性质
燃烧 条件
爆炸 条件
(1)可燃物要跟氧气接触 (2)可燃物的温度要达到着火点
一、氢元素(H)
亨利·卡文迪(1731-1810)
拉瓦锡(1743-1794)
H原子只有一个电子(1s1),是所有元素中最简单、最小和最轻的 元素,也是宇宙中含量最多的元素,大约占宇宙质量的75%。
高中化学竞赛-无机化学-第7章氢和氢能源PPT教学课件

合 金
各种储氢材料:
稀土系储氢合金 LaNi5 …. 镁系储氢合金 Mg2Ni Mg2Cu
钛系储氢合金 TiFe TiMnX 锆系储氢合金 ZrV2 ZrCr2
表面结构及储氢机理 靠近表层La扩散到表面与 氧、水结合成La2O3、La(OH)3。 Ni脱溶沉淀,产生表面分凝。 La2O3、La(OH)3保护亚表层Ni 的催化活性。
是同别的原子或分子结合在 一 起 而 存 在 , 如 H3O + 、 H5O2+、NH4+等。
H5O2+
2. 氢原子与活泼金属(如Li、Na、K、Rb、Cs、 Ca、Sr、Ba)能组成离子型氢化物(如LiH、
202N0/1a0/1H6 、CaH2 、LiAlH4、NaBH4、LiGaH4等)。2
3.氢键。 4. 形成单电子(σ)键 H2+。 5. 形成三中心二电子键H3+,为三角形结构。 6. 形成氢桥键 。
U+3
2
H2 ═ UH3
2020/10/16
8
7.4 应用: 储氢合金
一些合金可以在温和条件下可逆地同氢反应形成 金属氢化物,可以吸收和分解出大量氢气,所形成的氢化物
密度大于液态氢——称之为储氢合金
LaNi5+3H2
LaNi5H6
储
TiFe+H2 TiFeH2
氢
液氢:71kg·m-3 3LaNi5:88kg·m-
NaH+CH3OH ═ NaOCH3+H2
(4) 形成配位氢化物
氢化铝锂
4L A iH 3 l( C 无 l 水 L) i4 []乙 A 3醚 L lH iC
Li[AlH4]受潮时强烈水解
Li4 A 42 O H l H Li A OH l3 (4 O 2H H
无机化学第十二章

Si + 2NaOH + H2O Na2SiO3 + 2H↑2
四、氢化物
氢元素与其他元素生成的二元化合物,称为氢 化物。氢化物分为离子型氢化物、金属型氢化物和 分子型氢化物。
(一) 离子型氢化物
氢元素与碱金属元素和碱土金属元素(Be、Mg 元素除外)形成的氢化物称为离子型氢化物。
离子型氢化物都是白色晶体,常因含少量金属 而呈淡灰色至黑色,当温度超过 500℃ 时熔化或分 解。离子型氢化物的密度都比相应金属的密度大。
Ba 6s2 217 1845 727 3.51 0.9 508.9 965 ─ ─ -2.906 +2
碱金属元素的价层电子组态为 n s1,它们的原
子半径在同一周期中都是最大的。碱金属元素的第
一电离能在同一周期中是最小的,很容易失去一个
电子呈 + 1 氧化值,因此碱金属元素是金属性很强
的金属元素。从碱金属元素具有很大的第二电离能
从碱金属元素和碱土金属元素的电负性和单质 所在电对的标准电极电势来看,不论是在固态或在 水溶液中碱金属和碱土金属单质都具有很强的还原 性。虽然金属锂在碱金属单质中是相对稳定的,但 由于 Li+ 的半径相当小,水合时放出的热比金属钠 等其他金属还多,因此 E (Li/Li) 最小,锂在水溶 液中的还原性相当强。
密度/(g·cm-3) 电负性
Ei,1/(kJ·mol-1) Ei,2/(kJ·mol-1) Ei,3/(kJ·mol-1) Eea/(kJ·mol-1) EӨ(M2+/M)/V
氧化值
Be 2s2 111 2467 1287 1.8477 1.5 905.63 1757 14849 -48.2 -1.968 +2
氢化物化学课件

密度比空气略大
②标准状况下硫化氢的密度 = 34g/22.4L = 1.52 g/L
③能溶于水(常温常压下 1 : 2. 6 ) ④剧毒 ,大气污染物。(头痛、头晕、恶心、 昏迷、死亡)
注 意
制取和使用硫化氢时必 须在密闭或通风橱中进行。
2.硫 化 氢 的 化 学 性 质 ①可燃性 (也体现了硫化氢的还原性)
氯化氢
(一)、氯化氢
HCl
1、物理性质
①无色,有刺激性气味的气体 ②密度比空气 大
M(HCl)>29g/moL
③极易溶于水
2、构成微粒
H20
HCl
1V : 500V 空气中形成白雾
HCl分子
(二)、盐酸
氯化氢溶于水形成溶液叫氢氯酸,俗称盐酸
1.构成微粒 2.物理性质
混合物
H+、Cl-、H2O、(OH-)
分子:H2O、NH3.H2O、NH3
NH3· H2O的不稳定性 --受热易分解 △ NH3· H2O == NH3↑+H2O 思考:用右图的装置,加热氨水至 沸腾,在玻璃管的上端,可以收集 到干燥的氨气。请说明在此能够收 集到干燥氨气的原因 。
实验4-5 与酸的反应 一根玻璃棒在浓氨水里蘸一下,另一根玻璃棒在 浓盐酸里蘸一下使这两根玻璃棒接近(不要接触)观 察发生的现象 现象:大量的白烟产生 解释: • 浓氨水、浓盐酸易挥发 • NH3显碱性 • 生成白色固体物质 NH3 + HCl = NH4Cl
• 能形成喷泉实验的气体有哪些? SO2 (H2O) Cl2(NaOH)
HCl(H2O)
CO2(NaOH)
• 烧瓶内的溶液是什么?
二、氨的化学性质
无机化学_第3讲_氢及其化合物

z 更多的结合?氢原子的填隙 ~金属性?
17
¾ 氢的成键性质
复杂性:像碱金属?像卤素?像碳?
z 形成配体
氢负离子H-可以作为阴离子配体同过渡金属离子结合形 成种类众多的络合物,例如HMn(CO)5和H2Fe(CO)4等。在这 种化合物中,M-H键大多是共价型的,但一般计算氧化数时 将H记为-1。 z 形成桥键
O、N原子,使得H原子几乎成为“裸露”的质子,它会吸引邻近的高 电负性原子上的孤电子对,形成分子间或分子内的额外相互吸引,称之 为氢键。
氢键的强度处于共价键和分子间作用力之间,在有机和生 命化学中有非常重要的作用。
25
¾ 氢键特征
(1) 比化学键弱很多,但比范德华引力稍强。 其键能是指由X-H···Y-R分解成X-H和Y-R所需的能量, 约在10 ∼ 40 kJ⋅mol−1范围内。 氢键键长是指X-H ···Y中X原子中心到Y原子中心的距离 ,它比范德华半径之和要小,但比共价键键长(共价半 径之和)要大得多。 C因电负性甚小,一般不形成氢键。所以氢键的强弱与 X,Y的电负性和半径大小有密切关系。
通常情况下氢原子的配位数为1,即只能形成单键。但在 形成某些缺电子化合物如硼烷中,氢会形成多中心的桥键。
18
¾ 氢的简单化合物
*
* Intermediate: 不易归类的化合物
19
不同元素的电负性以及与氢形成的化合物的类型
20
¾ 氢的化合物:Gibbs生成自由能
In the s and p blocks, strengths of E-H bonds decrease down each group. 21In the d block, strengths of E-H bonds increase down each group.
高中化学竞赛 无机化学第7章氢和氢能源(共10页PPT)(共10张PPT)

Li4 A 4l2 H O H Li O AH l( 3 O 42 H H)
4BF3+3NaBH4 ═ 3NaBF4+2B2H6
•9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。2021/8/272021/8/27Friday, August 27, 2021 •10、阅读一切好书如同和过去最杰出的人谈话。2021/8/272021/8/272021/8/278/27/2021 11:33:12 PM •11、只有让学生不把全部时间都用在学习上,而留下许多自由支配的时间,他才能顺利地学习……(这)是教育过程的逻辑。2021/8/272021/8/272021/8/27Aug-2127-Aug-21 •12、要记住,你不仅是教课的教师,也是学生的教育者,生活的导师和道德的引路人。2021/8/272021/8/272021/8/27Friday, August 27, 2021
第7章 氢和氢能源
7.1 氢
氕(符号H)
1 1
H
丰度为99.984%
氘(符号D)
2 1
H
占0.0156%
氚(符号T)31 H 约占10-16%
氘和氚是核聚变反应的原料 :
2 1
H
+
3 1
H
→
4 2
H
e
+
1 0
n
7.2 氢的成键特征
1.形成共价单键: HCl、H2O、NH3。
不存在自由的质子,它总
是同别的原子或分子结合在 一 起 而 存 在 , 如 H3O + 、 H5O2+、NH4+等。
13、He who seize the right moment, is the right man.谁把握机遇,谁就心想事成。2021/8/272021/8/272021/8/272021/8/278/27/2021 •14、谁要是自己还没有发展培养和教育好,他就不能发展培养和教育别人。2021年8月27日星期五2021/8/272021/8/272021/8/27 •15、一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。2021年8月2021/8/272021/8/272021/8/278/27/2021 •16、教学的目的是培养学生自己学习,自己研究,用自己的头脑来想,用自己的眼睛看,用自己的手来做这种精神。2021/8/272021/8/27August 27, 2021 •17、儿童是中心,教育的措施便围绕他们而组织起来。2021/8/272021/8/272021/8/272021/8/27
第五章 氢、稀有气体内容概述:本章综述氢气的性质,氢化

化学性质: (1)强还原性(H-); (2)热稳定性; (3) H- 能在非极性溶剂中同 B3+ 、 Al3+ 、 Ga3+ 等结合成复合 型氢化物。 最有实用价值的离子型氧化物为 CaH2 、 LiH 和 NaH , CaH2反应性能最弱,可作氢气源,制备B、Ti、V等单质, 也可作微量水的干燥剂,Li[AlH4]可用作有机合成中的还 原剂,可将醛、硐、羧酸还原为醇,将硝基还原成氨基等 ,还可作高分子聚合反应的引发剂。
基本要求:了解单质的性质和制备方法;氢化物 的类型、结构和特性;氢的化合物的性质。
(三)金属型氢化物 d区和ds区元素与氢形成金属型氢化物。 过渡金属氢化物中,氢以三种形式存在: (1)以原子状态存在于金属晶格中; ( 2 )以 H+ 形式存在,它的价电子进入氢化物的导带中 ; (3)以H-存在,其电子是从氢化物中得到的。 特征:某些过渡金属具有可逆吸收和释放氢气的特 性。如: 102kPa LaNi5H6 298K,2.5 LaNi5+3H2 因此LaNi5是较为理想的期表中绝大多数 p 区元素与氢形成的氢化物,为共 价型氢化物,它们的固态大多属分子晶体,所以又称分子 型氢化物。 结构特征:共价键 组成:通式RH(8-N),式中R为IVA~VIIA族某元素,N 代表元素所在族数,它们的空间几何构型与中心元素的杂 化轨道方式及具有的孤电子对数有关。 性质:因形成分子晶体,故熔、沸点较低,常温下, 除 H2O , BiH3 为液体外,其余均为气体;大多数无色,物 理性质很多相似。化学性质差异较大。
第五章 氢、稀有气体
内容概述:本章综述氢气的性质,氢化物的类型 及稀有气体及化合物的性质和用途。重点了解 氢化物的结构和特性;氢的化合物的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有的在水中发生酸式解离,如 HCl 完全解离,而 H2S 部分解离。
有的显碱性,如 NH3; 有的与水反应,如 SiH4 , B2H6; 有的与水基本没有作用,如 CH4。
过渡金属与氢形成金属型氢 化物。
它不仅保持金属晶体的形貌, 而且其中金属原子的排列也与金 属单质中一样。
原子之间的空隙被氢原子占 有,很容易形成非整比化合物。
稀有气体主要从液化空气中 获得,其中氦的重要来源是天然 气。
氡是镭等放射性元素蜕变的 产物,在自然界中痕量存在。
温下,氢气无色,无味, 无臭,在水中溶解度很小。
分子间色散力很小, 难于 液化,沸点 -253℃。
H2 和 O2 的混合物在常温下点 燃会发生爆炸反应。
如 LuH2.2,ZrH1.75,VH0.56 均已制得。
倒是整比的过渡金属氢化物,如 MH1,MH2,MH3 等尚未制得。
但是由于金属锌中有时含有砷 化物、磷化物等杂质,致使制得的 H2 不纯。
单质硅和氢氧化钠溶液反应 也可以制得 H2
Si + 2 NaOH + H2O —— Na2SiO3 + 2 H2
由于碱较盐酸便于携带,且 反应温度不高,因此这种方法适 于野外操作的需要。
电解水制取的 H2 较纯。
工业生产中, H2 主要有 三种来源:
此法制得的氢化铍不纯。
MgH2 也曾利用 LiAlH4 还原 镁的化合物制得,现在工业上已开 始用单质直接合成。
具体做法是: 将金属镁置于 380 400℃ 的 高温球磨机中直接氢化,以确保镁 的新鲜表面和反应温度,产品纯度 可达 97%。
离子型氢化物反应活性的差别 很大,例如与水的作用,
(1) 水煤气 (2) 甲烷的转化 (3) 高温下水蒸气与碳 化钙反应
(1) 水煤气 —— 主要是 H2 和 CO 的混合气体。
将水蒸气通入红热炭层 C + H2O —— CO + H2
(2) 甲烷的转化 高温 且有催化剂作用时,甲烷可以转 化为 H2 和 CO CH4 + H2O —— CO + 3 H2 CH4 + CO2 —— 2 CO + 2 H2
4 LiH + AlCl3 —乙— LiAlH4 + 3 LiCl 醚
又如氢化钠与硼酸甲酯反应制 取 NaBH4
(CH3O)3B + 4 NaH —25—0℃
NaBH4 + 3 NaOCH3
这类反应不能在水中进行的。
p 区元素与氢生成分子型氢 化物。
分子型氢化物种类很多,在 水中的性质差别也很大。
高温下 H2 也能还原许多种金属 卤化物
TiCl4 + 2 H2 —— Ti + 4 HCl
不能被氢气还原的卤化物,若其中 的金属可以生成氢化物,那么就可以用 一种不与氢气生成氢化物的还原性金属 做还原剂,来生成前一种金属的氢化物。
2 LiCl + Mg + H2 —— 2 LiH + MgCl2
许多种金属硫化物,高温下可
以被 H2 还原,例如
—— > 900℃
FeS2 + 2 H2
Fe + 2 H2S
在特定的温度、压力下,采用 特定的催化剂,H2 和 CO 反应可 以合成一些有机化合物
CO + 2 H2 —C—u,—Zn—O CH3OH(g)
17. 1. 2 氢气的制备
实验室制 H2 常采用稀盐酸与 金属锌反应的方法。
若某种活泼金属的氧化物与氢气 的混合物共热时不能被还原
向体系中加入一种不与氢气化合 成氢化物的还原性金属,则可以生成 前一种金属的氢化物。
CaO + Mg + H2 —— CaH2 + MgO
常温下 H2 能还原金属 Pd 的氯 化物
PdCl2 + H2 —— Pd + 2 HCl 利用这个反应可以检测 H2 的存在。
H2 和 Cl2 的混合物在光照下爆 炸化合。
H2 和 F2 的混合物在没有光照 时亦将爆炸化合。
高温下,H2 与活泼金属反 应,生成金属氢化物
H2 + 2 Na —— 2 NaH H2 + Ca —— CaH2
高温下 H2 能还原许多种金属 氧化物
CuO + H2 —— Cu + H2O WO3 + 3 H2 —— W + 3 H2O
17. 2 氢化物
碱金属和碱土金属与氢生成离 子型氢化物。
其中 LiH 和 BaH2 较稳定。
BeH2 可以利用 LiAlH4 在乙醚 介质中还原铍的化合物制得
(CH3)2Be + LiAlH4 ——
BeH2 + LiAlH(2 CH3)2
热分解烷基铍也可以制得铍的 氢化物,
加热
(C4H9)2Be ===== BeH2 + 2 C4H8
NaH 与水剧烈反应 NaH(s)+ H2O(l)——
H2(g)+ NaOH(aq)
而 CaH2 与水很温和地反应产 生 H2。
离子型氢化物有还原性,可以 将 CO2 还原成 CO。 2 CO2 + BaH2 —加—热 2 CO + Ba(OH)2
离子型氢化物可以与缺电子型 化合物反应
2 LiH + B2H6 —乙— 2 LiBH4 醚
H2 和 CO 的混合气体与水蒸气 一同通过 500℃ 的 Fe2O3
H2O + CO —— H2 + CO2
H2O 中的 H 元素转化成 H2,同 时 CO 转化成易于分离的 CO2
(3) 高温下水蒸气与碳化钙 反应
CaC2 + 5 H2O —— CaCO3 + CO2 + 5 H2
在较高的压力下,用水吸收掉 CO2, 得到 H2。
第十七章 氢和稀有气体
氢H 大气中少量的氢气 H2O,及其他无机化合物和 有机化合物中化合态的氢
氢在地壳中的质量含量为 0.152 % 第 10 位。
稀有气体: 氦、氖、氩、氪、氙、氡 6 种元素
氩的丰度最高, 在地壳中的质量 分数为1.2 10-4 %,列第 56 位。
其次是氦、氖、氪、氙
