915 物理化学 (2)
大学-物理化学A-2试题及答案

物理化学A-21分,共16分,答案添在题后表格内)1、用Ag 电极电解AgNO 3溶液,在一定温度和外加压力下,用希托夫法测定AgNO 3水溶液通电一定时间后,阴极区Ag +量减少了0.605g ,阴极析出Ag 为1.15g ,则Ag +的迁移数为:a 0.474b 0.526c 0.516d 0.4842、用Pt 电极电解CuSO 4溶液,通过的电流为20A ,经过15min 后,在阴极上析出铜为:a 5.9克b 2.95克c 11.8克d 8.2克3、描述电极上通过的电量与已发生电极反应的物质的量之间关系的是 a 欧姆(Ohm )定律 b 法拉第(Faraday )定律 c 离子独立运动定律 d 能斯特(Nernst )定律4、用同一电导池分别测定浓度为0.01mol.m -3和0.1 mol.m -3的不同电解质溶液,电阻分别为1000Ω及500Ω,则其摩尔电导之比 a 5:1 b 1:5 c 1:20 d 20:15、某反应速率常数k 为0.107min -1,则反应物浓度从1.0mol.L-1变到0.7 mol.L -1和浓度从0.01mol.L -1变到0.007mol.L -1所需时间的比值为 a 10 b 100 c 1 d 0.016、0.1mol/kg 的CaCl 2水溶液其平均活度系数γ±=0.219,则离子平均活度α±为a 410476.3-⨯ b 210964.6-⨯c 210476.3-⨯ d 210386.1-⨯7、某化学反应其反应物消耗43所需的时间是它消耗掉21所需时间的2倍,则反应的级数为a 零级b 三级c 二级d 一级8、已知25℃时NH 4Cl 、NaOH 、NaCl 的无限稀摩尔电导分别为:12122210265.110487.210499.1-----⋅⋅Ω⨯⨯⨯mol m 、、。
则NH 4OH 的无限稀时的摩尔电导:a 277.0121210---⋅Ω⨯mol mb 251.5121210---⋅Ω⨯mol mc 253.2121210---⋅Ω⨯mol md 721.2121210---⋅Ω⨯mol m9、.当表面活性剂加入到溶剂中产生的结果是:a 表面张力降低、产生正吸附;b 表面张力上升、产生负吸附;c 表面张力降低、产生负吸附;d 表面张力上升、产生正吸附;10、在水平放置的玻璃毛细管中注入少许水(水润湿玻璃),在毛细管中水平水柱的两端呈凹液面,当在右端水凹面处加热,毛细管中的水向何端移动?( )a 向右移动;b 向左移动;c 不动;d 难以确定。
2022中南大学考研矿物加工-915真题(太珍贵了)-中南大学矿物加工

2022中南大学考研矿物加工-915真题(太珍贵了)|中南大学矿物加工
2022矿物加工学-915-真题
简答题:〔8分〕
1. 选矿厂常用磨矿机按不同方式如何分类?
2. 当给矿粒度增大或矿石变硬时,磨矿会出现什么情况,如何调整?
3. 影响筛分效率的因素有哪些?
4. 简述机械搅拌式浮选机的优缺点?
名词解释:(3分)
筛分,磨矿效率,粒度组成
填空题:〔1分〕
5. 常用颚式破碎机有两种?/2
6. 机械破碎施力方式有?/5
7. 矿物磁性率的计算公式?/1
8. 浮选过程中,捕收剂、起泡剂、和调整剂的加药顺序?/3
9. 浮选工艺开展到如今经历了三个阶段?/3
10. 浮选过程可分为四个阶段?/4
11. 螺旋分级机作为常用设备,分为三种形式?/3
12. 干预沉降等降比比自由沉降等降比?/1
物理化学局部:
13. 热力学第一第二第三定律的应用?〔15分〕
14. 名词解释:〔3分〕
丁达尔效应、电渗、电泳、临界胶团浓度、AgI、乳化剂及两类。
贵州大学851物理化学二2020年考研专业课初试大纲

贵州大学硕士研究生入学考试大纲
考试科目代码/名称:851物理化学二
一、考试基本要求
本科目考试着重考核考生掌握物理化学的基本概念、基本思想、基本分析方法和基本理论的程度,要求考生对化学热力学、化学动力学、溶液、化学平衡、相图、电化学与表面化学等理论体系的基本框架有一个比较全面的了解,并能综合运用所学知识分析和解决实际问题的能力。
二、适用范围
适用于冶金工程专业。
三、考试形式
闭卷,180分钟。
四、考试内容和考试要求
(一)气体的PVT关系
1、理想气体及其状态方程;
2、理想气体混合物;
3、真实气体状态方程。
(二)热力学第一定律
1、热力学基本概念;
2、热力学第一定律;
3、可逆过程、功的计算;
4、恒容热、恒压热、焓(反应焓、生成焓、燃烧焓);
5、热容、恒容变温过程、恒压变温过程;
6、焦耳实验,理想气体的热力学能、焓;
7、气体可逆膨胀压缩过程;
8、相变化过程;
9、溶解焓及混合焓;
10、化学计量数、反应进度和标准摩尔反应焓;
11、由标准摩尔生成焓和标准摩尔燃烧焓计算标准摩尔反应焓。
傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解(化学动力学基础(二))【圣才出品】

二、过渡态理论 1.过渡态理论基本要点
3 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
(1)反应物到产物必须经过一种过渡状态,即反应物分子活化形成活化络合物的中间 状态,反应物与活化络合物之间能很快速成化学平衡。
(2)活化络合物又可分解为产物,活化络合物分解步骤为慢步骤,化学反应速率由活 化络合物分解步骤决定。
Ep (r) De[exp{2a(r r0)} 2exp{a(r r0)}]
计算双原子分子势能 Ep 最常用的经验公式。式中 r0 是分子中双原子分子间的平衡核间
4 / 52
圣才电子书 十万种考研考证电子书、题库视频学习平台
距,De 是势能曲线的井深,a 为与分子结构有关的常数。
③活化络合物,就向产物转化,这步是反应的速决步。
(2)对于一般基元反应,速率常数的计算式为
k kBT f ' exp( E0 )
h fB
RT
B
4.过渡状态理论的优缺点
(1)优点
①形象地描绘了基元反应进展的过程。
②原则上可以从原子结构的光谱数据和势能面计算宏观反应的速率常数。
(3)反应物分子间相互作用势能是分子间相对位置的函数,反应物转化为产物的过程 是体系势能不断变化的过程。
(4)过渡状态理论提供了由物质基本结构系数[υ(振动频率),m(质量),r(核间距) 等]计算反应速率常数的方法。
过渡态理论:由反应物分子变成生成物分子,中间一定要经过一个过渡态,而形成这个过 渡态必须吸取一定的活化能,即反应物分子活化形成活化络合物的中间状态,所以又称为活 化络合物理论。用该理论,只要知道分子的振动频率、质量、核间距等基本物性,就能计算 反应的速率常数,所以又称为绝对反应速率理论。
西安工程大学2019年全国硕士研究生招生复试科目及参考书目
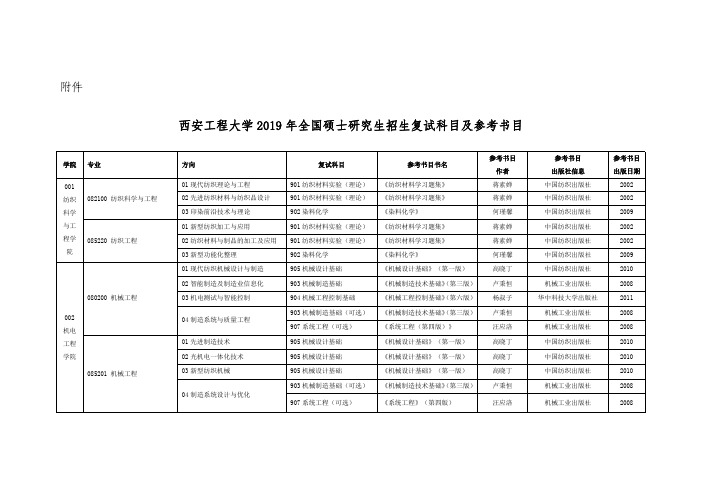
01 先进制造技术 02 光机电一体化技术 03 新型纺织机械
04 制造系统设计与优化
复试科目
901 纺织材料实验(理论) 901 纺织材料实验(理论) 902 染料化学 901 纺织材料实验(理论) 901 纺织材料实验(理论) 902 染料化学 905 机械设计基础 903 机械制造基础 904 机械工程控制基础 903 机械制造基础(可选) 907 系统工程(可选) 905 机械设计基础 905 机械设计基础 905 机械设计基础 903 机械制造基础(可选) 907 系统工程(可选)
《西方经济学》
高鸿业
《环境生态学导论》
盛连喜
《水污染控制工程》(第四版)
高延耀
《水污染控制工程》(第四版)
高延耀
《物理化学》(天津大学物理化 学教研室)(第五版)
刘俊吉(上 册);李松林
(下册)
《有机化学》(第二版)
徐寿昌
参考书目 出版社信息 中国人民大学出版社 机械工业出版社 机械工业出版社 机械工业出版社 中国人民大学出版社 中国人民大学出版社 中国人民大学出版社 中国财政经济出版社
周德庆
《水污染控制工程》(第四版)
高延耀
《大气污染控制工程》
郝吉明
03 固体废弃物处理技术及资源化 943 固体废弃物处理与处置 《固体废弃物处理与处置》
宁平
007 计算 机科 学学
院
081200 计算机科学与技术 085211 计算机技术
01 计算机网络与信息安全 02 计算机视觉与图像处理 03 大数据与人工智能 01 虚拟现实与增强现实 02 云计算技术及应用
924 数据结构 924 数据结构 924 数据结构 924 数据结构 924 数据结构
《物理化学II》

2009 — 2010 学年第二学期《物理化学》期中试卷答案一、判断题(每题1分;正确的打“√”,错误的打“×”)10%1、原电池的正极即为阳极,负极即为阴极。
(×)2、单分子反应肯定是一级反应。
(√)3、电极Pt(s)|H2(pө) | OH-(a=1) 是标准氢电极,其φөH-=0 (×)2O/H2,OH4、在一定的温度和较小的浓度情况下,增大弱电解溶液的浓度,则该弱电解质的电导率增加,摩尔电导率减小。
(√)5、设MgCl2水溶液的质量摩尔浓度为b,离子平均活度因子(系数)为γ±,则其离子平均活度a±=43γ± b /b。
(√)6、对于反应A Y,如果反应物A的浓度减少一半,A的半衰期也缩短一半,则该反应的级数为零级。
(√)7、对反应2NO + Cl2→2NOCl,只有其速率方程为:υ=k{c(NO)}2 c(Cl2),该反应才可能为元反应。
其他的任何形式,都表明该反应不是元反应。
(√)8、用Λm对c作图外推的方法,可求得HAc的无限稀释摩尔电导率。
(×)9、等温等压下进行的一般化学反应,∆G<0,电化学反应的∆G可小于零,也可大于零(√)10、若反应A+B−→−Y+Z 的速率方程为υ=kc A1.5c B0.5,则该反应为二级反应,且肯定不是双分子反应。
(√)二、选择题(每题1分;填上正确答案)10%1、某二级反应,反应物消耗1/3需时10min,若再消耗原1/3还需时(C)(A) 10min (B) 20min (C) 30min (D) 40min2、在等温、等压下电池以可逆方式对外作电功的热效应Q r,则:(B)(A) Q r=0 (B) Q r=T∆S(C) Q r=∆r H(D) Q r=∆r U3、0.001mol·kg-1CuCl2和0.003 mol·kg-1Na2SO4溶液的离子强度是:(D)(A) 0.001mol·kg-1 (B) 0.003mol·kg-1(C) 0.002mol·kg-1 (D) 0.012mol·kg-14、在浓差电池Pt(s)│Cl2(pө)│HCl(a±=0.1)│HCl(a±=0.01)│Cl2(pө) │Pt(s) 中,电池的电动势是E,液接电动势是E J,则:(A)(A) E >0,E J >0 (B)E >0,E J <0 (C)E <0,E J >0 ( D)E <0,E J <05、25℃时,电池反应 Ag(s)+12Hg 2Cl 2==AgCl(s)+Hg(l)的电池电动势E =0.0193V反应时所对应的∆S=32.9 J·K -1·mol -1,则电池电动势的温度系数 为:(D ) (A) 1.70×10-4V ·K -1 (B) 1.10×10-6V ·K-1 (C) 1.01×10-1V ·K -1 (D) 3.41×10-4V ·K -16、有关基元反应的描述在下列诸说法中哪一个是不正确的? (D )(A) 基元反应的级数一定是整数 (B)基元反应的级数一般不大于3(C) 基元反应进行时无中间产物 (D)基元反应不一定符合质量作用定律7、已知下列二个电极反应的标准电极电势为:Cu 2+ + 2e -→Cu(s) φөCu 2+/Cu =0.337VCu + + e -→Cu(s) φөCu +/Cu =0.521V由此算得Cu 2+ + e -→Cu +的φөCu 2+/Cu + =? (D )(A) 0.184V (B) 3.52V (C) -0.184V (D) 0.153V8、在293.15K 及101325Pa 下,反应A(s)+2BD(aq)==AD 2(aq)+B 2(g)在电池中可逆进行,完成单位的反应时间,系统做电功150kJ ,放热80kJ ,该反应的摩尔等压反应热为多少kJ·mol -1? (B )(A) -80 (B) -230 (C) -232.5 (D) -277.59、平行反应中,已知E 1>E 2,下列措施中哪一个不能改变获得B 和C的比例? (B )(A) 提高温度 (B) 延长时间 (C) 降低温度 (D) 使用催化剂10、氢和氧反应发展为爆炸是因为(D )(A) 大量的引发剂引发 (B) 直链传递的速度增加(C) 自由基被消除 (D) 生成双自由基形成支链三、填空题(每题2分;在题中“____”处填上正确答案)20%1、离子导体的电导率随温度升高而增大,电子导体的电导率随温度升高而降低。
中国航天科工集团第三研究院复习参考书目

中国航天科工集团第三研究院复习参考书目901 自动控制原理:控制系统的传递函数,过渡过程,误差分析,根轨迹法和频率特性法,综合与校正,非线性控制系统的分析,线性离散系统的分析,李雅普洛夫稳定性分析,现代控制理论基础。
(占20%,不考最优控制及滤波估计)《自动控制原理》(第五版1-9章),胡寿松主编,国防工业出版社。
903信号与系统:连续时间系统的时域分析;傅氏变换及其应用--滤波、调制与抽样;拉氏变换与S域分析;离散时间系统的时域分析,Z变换及Z域分析。
《信号与系统》(第二版)上、下册,郑君里等编,高等教育出版社。
905理论力学:各种力学平衡,滑动摩擦,重心,点的运动,刚体的运动,质点的运动,微分方程,质点直线振动,碰撞,动力学普遍定理,达朗贝尔原理,虚位移原理,点在非惯性力学中的运动,第二类拉格朗日方程。
《理论力学》,西安交通大学、东南大学合编,人民教育出版社。
或《理论力学》,清华大学编,高等教育出版社。
908电子技术基础:(1)模拟电子技术基础部分(占50%):二极管、三极管基本放大电路和多级放大电路,集成电路运算放大器,反馈放大电路,信号的运算和处理电路。
(场效应管放大电路,功率放大电路,信号产生电路,直流稳压电源等不作要求)。
《电子技术基础》模拟部分(第四版),华中理工大学电子教研室编,康华光等,高等教育出版社。
(2)数字电子技术基础部分(占50%):数字逻辑基础,逻辑门电路,组合逻辑电路分析与设计,常用组合逻辑功能器件,触发器,时序逻辑电路的分析与设计,常用时序逻辑功能器件,(存储器,可编程逻辑器件,脉冲波形数模与模数转换及数字系统设计等不作要求)。
《电子技术基础》数字部分(第四版),华中理工大学电子教研室编,康华光等,高等教育出版社。
909 物理化学:热力学第一定律、热力学第二定律、溶液—多组分体系热力学在溶液中的应用、相平衡、化学平衡、电解质溶液、可逆电池的电动势及其应用、电解及极化作用、化学动力学、界面现象。
物理化学-第二章-热力学第一定律及其应用精选全文

上一内容 下一内容 回主目录
返回
2024/8/13
状态与状态函数
状态函数的特性: 异途同归,值变相等;周而复始,数值还原。
状态函数的性质:
(1) 状态函数的值取决于状态,状态改变则状态函数必定改 变(但不一定每个状态函数都改变);任何一个状态函数 改变,系统的状态就会改变。
上一内容 下一内容 回主目录
即
ΔU=Q+W (封闭系统)
对于无限小过程,则有
dU=δQ+δW (封闭系统)
上一内容 下一内容 回主目录
返回
2024/8/13
3. 焦耳实验 盖.吕萨克—焦尔实验
实验结果:水温未变 dT=0 dV≠0
表明:Q =0
自由膨胀 W=0
上一内容 下一内容 回主目录
返回
2024/8/13
dU= Q+ W =0
1. 热(heat)
a) 定义:体系与环境之间因温差而传递的能量称为热,用 符号Q 表示。单位:KJ 或 J。 b) Q的取号:体系吸热,Q>0;体系放热,Q<0 。
c) 性质:热不是状态函数,是一个过程量;热的大小和具 体的途径有关。
上一内容 下一内容 回主目录
返回
2024/8/13
功和热
不能说在某个状态时系统有多少热量,只能说 在某个具体过程中体系和环境交换的热是多少。
热力学能是状态函数,用符号U表示,单位为J。它 的绝对值无法测定,只能求出它的变化值。
U= U2 –U1
上一内容 下一内容 回主目录
返回
2024/8/13
热力学能
纯物质单相系统
若n确定
U=U ( n,T,V ) U=U (T,V )
819《物理化学II》试题A

3、对于独立离域子物系,由于粒子(),故不存在粒子排列在定点上产生不同微观状态的问题,N!个微观状态实际上为()。
4、吉布斯吸附量的物理意义为(),单位为()。
5、溶胶稳定的三种因素包括()。
三、简答题(10分)
1、理想溶液。
2、热力学电位φ与电动电位ξ的主要区别。
四、计算题(90分,每题15分)
5、某溶液含有NaOH和CH3COOC2H5,浓度均为1.0×10-2mol.dm-3,298K时反应经过10分钟后有39%的CH3COOC2H5分解(可视为二级反应),而在308K时10分钟有55%分解。计算:①反应的活化能;②288 K时,10分钟能分解多少?③293 K时,若有50%的CH3COOC2H5分解,需要多少时间?
一、选择题(30分,每题3分)
1、理想气体的节流过程满足:
A. <0B. =0C. =0 D. >0
2、将H2O(l)变成同温同压的H2O(g),这时体系:
A.内能不变B.内能可能减少,也可能增加
C.内能增大D.内能减少
3、凝固点降低公式适用的最必要条件:
A.稀溶液
B.稀溶液,凝固时析出的固态溶剂中不含溶质。
第3页,共4页
6、水蒸气迅速冷却至25℃时会发生过饱和现象。已知25℃时水的表面张力 ,当过饱和蒸气压为水的平衡蒸气压的4倍时,试求最初形成的水滴半径为多少?此外这种水滴每个含有多少水分子?
第4页,共4页
8、反应 ,已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2,以下措施中拿一种不能改变获得B和D的比例?
A.提高反应温度B.延长反应时间
C.加入适当催化剂D.降低反应温度
9、下列说法中不正确的是:
A.生成的新鲜液面都有表面张力
物理化学公式大全

物理化学公式集热力学第一定律功:δW=δW e+δW f(1)膨胀功δW e=p外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f=xdy非膨胀功为广义力乘以广义位移。
如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。
热Q:体系吸热为正,放热为负。
热力学第一定律:△U=Q—W 焓H=U+pV理想气体的内能和焓只是温度的单值函数。
热容C=δQ/dT(1)等压热容:C p=δQ p/dT=(∂H/∂T)p(2)等容热容:C v=δQ v/dT=(∂U/∂T)v常温下单原子分子:C v,m=C v,m t=3R/2常温下双原子分子:C v,m=C v,m t+C v,m r=5R/2等压热容与等容热容之差:(1)任意体系C p—C v=[p+(∂U/∂V)T](∂V/∂T)p(2)理想气体C p—C v=nR理想气体绝热可逆过程方程:pVγ=常数TVγ-1=常数p1-γTγ=常数γ=C p/ C v理想气体绝热功:W=C v(T1—T2)=(p1V1—p2V2)理想气体多方可逆过程:W=(T1—T2)热机效率:η=冷冻系数:β=-Q1/W可逆制冷机冷冻系数:β=焦汤系数:μJ-T==-实际气体的ΔH和ΔU:ΔU=+ΔH=+化学反应的等压热效应与等容热效应的关系:Q p=Q V+ΔnRT当反应进度ξ=1mol时,Δr H m=Δr U m+RT化学反应热效应与温度的关系:热力学第二定律Clausius不等式:熵函数的定义:dS=δQ R/T Boltzman熵定理:S=klnΩHelmbolz自由能定义:F=U—TS Gibbs自由能定义:G=H-TS热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU=TdS-pdV dH=TdS+VdpdF=-SdT-pdV dG=-SdT+Vdp(2)Maxwell关系:==-(3)热容与T、S、p、V的关系:C V=T C p=TGibbs自由能与温度的关系:Gibbs-Helmholtz公式=-单组分体系的两相平衡:(1)Clapeyron方程式:=式中x代表vap,fus,sub。
西工大版物理化学习题分析与参考答案

Q=W=nRTln(p1/p2)=1386 J 过程 2 为理想气体绝热可逆膨胀:T2=197.3 K W=-ΔU=-nCV,m ΔT=-5/2 …=900 J Q=0 J ΔU=-900 J ΔH=γ ΔU=-1260 J (2) 图略 (3) 过程 3 为恒压过程。
8、分析:可逆过程所做功为最大功,故 W=nRTln(p1/p2)=p1V1 ln(p1/p2)。 解:W=nRTln(p1/p2)=p1V1 ln(p1/p2)=9441 J 9、分析:恒温可逆过程的功根据公式 W=nRTln(p1/p2)计算,气体的恒定外压恒温变体积,注意根据理想气体状 态方程计算始态与终态的体积,用它们计算 ΔV,然后根据 W=p 外 ΔV 计算 W。 解:理想气体恒温可逆过程: 反抗恒外压作恒温膨胀:
-1
37、分析:根据基尔霍夫方程推导即可,关键是要正确计算出 ΔCp,m,注意 Cp,m 中各参数的同源性。
Cp,m(CO2,g)=(28.66+35.702×10 T/K) J·K ·mol -3 5 2 -1 -1 Cp,m(C,石墨)=[17.15+4.27×10 T/K-8.79×10 (K/T) ] J·K ·mol -3 5 2 -1 -1 Cp,m(CO,g)=[26.5366+7.6831×10 T/K-0.46×10 (K/T) ] J·K ·mol -3 5 2 -1 -1 ΔCp,m=2 Cp,m(CO2,g)-Cp,m(C,石墨)-Cp,m(CO,g)=[7.2632-24.6058×10 T/K + 7.87×10 (K/T) ] J·K ·mol
W1= Q1-ΔU1=415.4
Q2 = W2=nRT2ln (p1/p2)=1861 J 整个过程:Q=Q1+Q2=2900 J W=W1+W2=2276 J ΔU=ΔU1=623.6 J ΔH=ΔH1=1039 J (2) 先恒温可逆膨胀 ΔU1=ΔH1=0 J Q1 = W1=nRT1ln (p1/p2)=1573 J 然后恒压加热 Q2=ΔH2=nCp,m ΔT=1039 J ΔU2=ΔH2/γ=1039×3/5 J=623.6 J W2= Q2-ΔU2=415.4
深圳大学915材料科学基础或普通物理或高分子化学2021年考研专业课初试大纲

深圳大学2021年硕士研究生入学考试大纲、参考书目
(初试科目只提供考试大纲,复试科目只提供参考书目)
命题学院/部门(盖章):材料学院
考试科目代码及名称:[915]材料科学基础或普通物理或高分子化学说明:
可使用简易计算器
一、考试基本要求
《材料科学基础或普通物理或高分子化学》考试大纲适用于报
考2021年深圳大学材料科学与工程专业学术型硕士研究生入学考试。
该科目包括三部分内容:(1)材料科学基础;(2)普通物理;(3)高分子化学。
考生根据自己的专业基础,从下列三部分内容中选择其中一个部分(2.1、2.2、2.3中三选一)进行答题。
二、考试大纲
2.1 材料科学基础
(1)考试基本要求
《材料科学基础》是材料学科的专业基础课,着重讲述材料的
成分、组织结构与性能之间的关系。
本课程强调晶体材料中的共性。
华南理工大学考试教材

华工和物化专业课共分为两批,分别是工科物化二和理科物化一,工科物化二最近已经不要求统计热力学内容参考书工科类(非化学类专业)教材:1. 葛华才,袁高清,彭程编. 立体化《物理化学》. 高等教育出版社,2008年下半年将由出版。
配套光盘内容含:教材题解,复习题要,2000-2008年历年研究生题解及本科生典型题解,模拟练习题等。
2. 天津大学物理化学教研室编,王正列,周亚平修订。
物理化学(上下册):第四版。
北京:高等教育出版社。
2001年。
主要教材。
理科类(化学专业)教材:1.南京大学化学化工学院傅献彩等编,物理化学:第五版(上,下册). 北京:高等教育出版社,2005,2006。
主教材实验教材1.华南理工大学物理化学教研室编。
物理化学实验。
广州:华南理工大学出版社,2003年。
主教材2. 复旦大学等编.《物理化学实验》。
北京:高等教育出版社,1993年下载地址:华南理工物化真题PDF及DOC下载好的话,请回个贴,呵呵~~~~/d/e68c5bc59ec0c0bc8ca006154b2bc2fdfac48a1deecb3600华南理工大学物化学习专貼(也有部分化原资料)前言:华工的化工专业这两年很火,难度高于大工,也不低于天大,所以报考时要小心,我认为华东理工的性价比很好,入学难度比较小。
所以我认为如果你想上华工,而且能拿到全免加补助最好奔向最少350分,甚至不少于380分的目标去,低于340分的有可能只是陪太子读书的角色,所以这个分数段的考生复试一定要付出更多努力。
个人意见:清华>中科院(大物所,上有机所)>浙大>天大>华工>大工>华理>北化和中石油>南工正题:华工和物化专业课共分为两批,分别是工科物化二和理科物化一,工科物化二最近已经不要求统计热力学内容。
在2005年以前个人认为无论是工科还是理科物化出题难度较小,而且风格不变,不适合考研这种选拔性的考试,但2006年以后,个人就无法把握规律了。
《物理化学(第五版,傅献彩)》课后习题及答案

压蒸发热为 40.63kJ·mol-1。当 1mol 液态水,在 373K 和外压为 p时完全蒸发成水蒸气时,
试求:
(1)蒸发过程中体系对环境所作的功。
(2)假定液态水的体积略而不计,试求蒸发过程中的功,并计算所得结果的百分误差。
(3)假定把蒸气看作理想气体,且略去液态水的体积,求体系所作的功。
(4)求(1)中变化的△vapHm 和△vapUm。 (5)解释何故蒸发热大于体系所作的功。
T V
0
T
16.证明:
U V
p
C p
T V
p
p
证:
U V
p
H V
P
p
=
H T
T p V
p
p
=
CP
T V
p
p
证明: CP
CV
p T
V
Hp
T
V
证: CP
CV
HT
U = H p T V T
P
HT
V T
dT P
Hp
T dP
H T
V
H T
解:
Zn (s)+2 H+= Zn2++ H2(g)
VH2
RT p
8.314 291 m3 101325
0.024m 3
W pV pVg nRT 8.314 291J 2419.4J
△rUm=(Q+W)/ =(-152-2.42)kJ·mol-1
3 . 在 373.2K 和 p压力下,使 1molH2O(l)汽化。已知水在气化时吸热 40.69kJ·mol-1。
P
Hp
T Tp
V
代入上式
2017上海大学考研初试参考书目(专业学位)

《社会工作实务》朱眉华
334 新闻与传播专业综合能力
《理论新闻传播学导论》童兵 中国人民大学出版社 2011 年
《传播学通论》戴元光 金冠军主编 上海交通大学出版社 2007年
《新闻传媒业的他律与自律》张咏华 黄挽澜 魏永征 上海外语教育出版社 2007年
注:上述论著如果重印,可以用新版。
《分析化学》刘志广主编 高等教育出版社 2008年
926 物理化学(专)
《物理化学》(第5版)天津大学物理化学教研室编 北京:高等教育出版社 2009年
《物理化学解题指南》(第2版)冯霞 高正虹 陈丽编 北京:高等教育出版社 2009年
927 环境化学(专)
《环境化学》(第2版)戴树桂等编 高等教育出版社 2007年
359 日语翻译基础
《日语综合教程》(第7、8册)季林根 皮细庚 上海外语教学出版社 2008年
《日汉翻译教程》高宁 上海外语教育出版社 2010年6月
《新编汉日翻译教程》高宁 上海外语教育出版社 2003年7月
《新编汉日日汉同声传译教程:从即席翻译到同声传译》(第2版) 宋协毅 外语教学与研究出版社 2011年7月
920 模拟与数字电路(专)
《电子技术基础》(模拟部分)(第 5 版)康华光主编 高等教育出版社 2008 年 2 月
《电子技术基础》(数字部分)(第 5 版)康华光主编 高等教育出版社 2006 年 1 月
921 材料科学基础(专)
《材料科学基础》李见 冶金工业出版社 2000年
《材料科学基础》胡赓祥 上海交通大学出版社 2000年
354 汉语基础(文学院)
《现代汉语》黄伯荣,廖序东 高等教育出版社
《古代汉语》王力 中华书局
考研专业解读: 物理化学考研

(3)电化学毕业生这两年还是比较抢手的,由于能源的原因,目前在太阳能电池、燃料电池以及电动汽车用动力电池方面有很大的需求量。
(4)理论与计算化学方面,这两年在这方面市场的需求还是很大的,例如药物设计公司,以及一些世界顶级的化学品公司。
(5)平时可以多关心一些经济、金融方面的信息,可以去基金公司或者证券公司作行业研究员(例如国内的易方达基金管理公司)(化学、药品等行业研究员),同时也可以到政府的宏观经济部门从事化学品相关行业从事调研管理等工作。
北京大学、吉林大学、中国科学技术大学、复旦大学、浙江大学、厦门大学、南开大学、清华大学、南京大学、大连理工大学、武汉大学、北京师范大学、山东大学、辽宁师范大学、北京理工大学、福州大学、华东师范大学、天津大学、中山大学、湖南大学。
五、课程设置(以天津师范大学为例)
主要必修课程:
政治理论课、第一外国语、统计热力学、化学动力学、量子化学、有机化合物结构分析、高等物化实验、有机合成化学
小提示:目前本科生就业市场竞争激烈,就业主体是研究生,在如今考研竞争日渐激烈的情况下,我们想要不在考研大军中变成分母,我们需要:早开始+好计划+正确的复习思路+好的辅导班(如果经济条件允许的情况下)。2017考研开始准备复习啦,早起的鸟儿有虫吃,一分耕耘一分收获。加油!
要求毕业生掌握物理化学学科化学热力学动力学统计热力学量子化学等基础理论具有较好的数学物理基础和相关生物化学分子生物和化学信息学的基础理论熟悉现代物理化学学科的发展和前沿领域熟练掌握物理化学及相关学科的研究方法和实验技术,具有独立进行科学研究的能力。适应我国经济、科技、教育发展需要,成为从事物理化学研究和教学的高层次人才。
安庆师范大学2019年专业学位硕士研究生招生专业目录及参考书目
1、《英美概况》,赵春荣,北京语言大学出版社,2009年版;2、《中国文化读本》,叶朗,外语教学与研究出版社,2008年版;3、《现代汉语语法研究教程》,陆舰明,北京大学出版社,2003年版;4、《汉语写作实用修辞》,李绍林,语文出版社,2006年版。
考试说明:初试各科目考试形式和内容依照全国翻译硕士教指委制定的“全日制翻译硕士专业学位(MTI )研究生入学考试考试总纲”。
20 人)日制3-4年同等学力加试科目:①刑事诉讼法学②民事诉讼法学学与研究出版社,2009年版;3、《西方翻译理论通史》,刘军平著,武汉大学出版社,2009年版;4、《译介学导论》,谢天振,北京大学出版社,2007年版。
础(非法学)④498法硕联考综合(非法学)①刑法学101思想政治理论②201英语一合能力:重点考察考生采访方案制定、消息和深度报道写作、新闻标题制作、新闻稿件分析等应用能力。
440新闻与传播专业基础:重点考察考生对于新闻学和传播学的基本理论、核心概念把握,以及运用相关理论分析新闻传播现象的能力。
法学)人)②色彩①新闻写作同等学力加试科目:①新闻学概论②传播学概论复旦大学出版社,2013年4月2、传播学教程(第二版),郭庆光,中国人民大学出版社,2011年4月3、新闻写作精要,高钢,首都经济贸易大学出版社,2018年1月4、当代新闻评论教程(第五版),丁④922艺术技能测试②204英语二③334新闻与传播专业综合能力(自命题)④440新闻与传播专业基础(自命题)055200新闻与传播日制3年学论②小学数学课程与教学论①舞台设计与创作同等学力加试:①王次炤主编《艺术学基础知识》,中央音乐学院出版社2006年版。
101思想政治理论②204英语二③336艺术基础(自命艺术135103戏曲04戏曲舞美与设计(拟招生人数 20人)①教师学同等学力加试:教育语文课程标准》、《普通高中语文课程标准》)911参考书:阮成武,《小学教育概论》,华东师范大学出版社,2011年版101思想政治理论②204英语二③333教育综合小学教育045115小学学科教学全日制2年①教师学同等学力加试:①中国古代文学②中国现当代文学加试参考书目:胡壮麟,《语言学教程》(第四版),北京大学出版社,2011年903参考书:①王文彦,蔡明主编《语文课程与教学论》,高等教育出版社,2006/6/1②倪文锦,谢锡金主编《新编语文课程与教学论》,华东师范大学出版社,2006年7月101思想政治理论②204英语二③333教育综合④903语文教学论学科教学(语文)01中学语文教学02语文课程与教学论人)①教师学908参考书目:王蔷,《英语教学法教程(第二版)》,高等教育出版社,2006年社,2010.08ISBN 978-7-04-026386-2101思想政治理论②204英语二③333教育综合学科教学(英语)01英语课程与教学①教师学同等学力加试:①创作②素描918参考书:1、《美术概论》第二版,邹跃进,诸迪主编,高等教育出版社,2011.06ISBN978-7-04-033200-1101思想政治理论②204英语二③333教育综合④918 艺术概论学科教学(美术)01美术课程与教学论备注:1、思想政治理论、英语二、数学二三门统考科目考试大纲由教育部考试中心统一编制,自命题考试科目“333-教育综合”考试大纲参照教育部“全日制教育硕士专业学位研究生入学考试大纲”。
物理化学试题-标准答案

物理化学(B卷)学院班级任课教师教研室主任学生人数交题时间:年月日补充:1、作图分析题(20分)A, B两金属的步冷曲线如下图, 被测体系中x B = 0; 0.1; 0.25; 0.4; 0.5; 0.6; 0.75; 0.9 和1.0共9条;已知两金属可形成分子比为1:1的稳定化合物C, 且两者不形成固溶体。
(1) 请绘出A,B两合金的相图; (2) 标明相图中各区域相的组成和自由度; (3) 绘出x B = 0.3的步冷曲线;(4) 相图中有几条三相平衡共存线,并分别指明每条有哪三相平衡共存?1、2 mol单原子分子理想气体由始态(300 K, 10 Pθ), 经历如下一些途径膨胀到2 Pθ:(1) 等温可逆膨胀; (2) 等温恒外压(2 Pθ)膨胀; (3) 绝热可逆膨胀;(4) 绝热恒外压(2 Pθ)膨胀;分别求上述途径的w, Q, ∆U, ∆H, ∆S, ∆G?解: (1) 理想气体等温可逆过程:∵dT=0 ∴∆U=0; ∆H=0Q=-W=nRTln(p1/p2)= 2×8.314×300×ln(10/2)= 8029 J∆S=Qr /T=nRln(p1/p2)= 8029/300= 26.76 J.K-1∆G= nRTln(p2/p1)=-8029 J(4)等温恒外压(2pθ)膨胀:因为途径(2)与途径(1)的始末态相同, 故状态函数的变值相同, 故有: ∆U=0, ∆H=0, ∆S=26.76 J.K-1, ∆G=-8029 J.Q=-W=p2(V2-V1)= p2V2-p2V1=p2V2-0.2p1V1=nRT(1-0.2)=0.8nRT= 3991 J(5)绝热可逆过程:Qr =0 ∆S=∫(δQr/T) =0单原子理气r=C p,m / C V,m = 5/3 而对于理气绝热可逆过程有P11-r T1r = P21-r T2r代入已知条件,可得 T2= 157.6 K∆U = w = CV (T2- T1) = 2×1.5×8.314×(157.6-300)=-3551.7 J∆H = Cp (T2- T1) = 2×2.5×8.314×(157.6-300)= -5919.5 J(4)绝热恒外压(2pθ)膨胀: Q=0 w =∆U = CV (T2- T1) = 2×1.5×8.314×(T2-300)又w =-p2(V2-V1)= p2V1-p2V2=0.2p1V1-p2V2= nR (0.2 T1-T2)= 2×8.314×(60-T2)所以可解出 T2= 204 K∆U = w = CV (T2- T1) = 2×1.5×8.314×(204-300)=-2394.4 J∆H = Cp (T2- T1) = 2×2.5×8.314×(204-300)= -3990.7 J2、1pθ下水的正常沸点为373K,摩尔蒸发焓∆vap Hm=40.70 kJ·mol-1;今将383K,1pθ下1mol液态水等温等压蒸发为同温同压的水蒸汽。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大连海事大学硕士研究生入学考试大纲
考试科目:物理化学
试卷满分及考试时间:试卷满分为150分,考试时间为180分钟。
试卷内容结构:基础知识30%,基础知识运用60%,综合运用10%. 考试内容
一、物质的pVT 关系和热性质:1. pVT 关系和热性质。
2.系统、环境、状态、平衡态、状态函数、强度性质、广延性质等基本概念,以及反映物质pVT 关系的状态方程。
3.功、热、热力学能、焓等的定义和相互关系,Q U V =∆、Q H p =∆的适用条件和应用及热力学标准状态的概念和意义。
4.标准摩尔定容热容、标准摩尔定压热容、标准摩尔相变焓、标准摩尔生成焓、标准摩尔燃烧焓和标准熵等各类热性质的定义和应用。
5.一些热性质数据的实验测定原理和方法。
二、热力学定律和热力学基本方程:1.热力学第二定律的建立过程以及由热力学第二定律演绎得出的三个结论,即热力学温标、存在状态函数熵以及熵增原理。
2.克劳修斯不等式和过程可逆性判据或不可逆程度的度量。
引入亥姆霍兹函数和吉布斯函数的意义。
3.热力学基本方程及由之得出的各偏导数。
4.pVT 变化中热力学函数变化的计算原理和方法。
5.相变化中热力学函数变化的计算原理和方法。
6.热力学第三定律的建立过程和标准熵的含义。
7.化学变化中热力学函数变化的计算原理和方法。
8.可逆性判据与平衡判据的联系和区别。
9.克拉佩龙–克劳修斯方程的推导和应用。
10.能量有效利用的概念。
三、多组分系统的热力学,逸度和活度:1.偏摩尔量的定义与物理意义,集合公式和吉布斯–杜亥姆方程。
2.化学势的定义。
组成可变的均相多组分系统和多相多组分系统的热力学基本方程。
3.用化学势表达的适用于相变化和化学变化的平衡判据。
系统处于平衡时,所应满足的热平衡条件、力平衡条件、相平衡条件和化学平衡条件。
4.相律的推导、内含及其应用。
5.逸度和逸度参考状态的概念,用逸度表示的混合物中组分的化学势。
6. 理想混合物和理想稀溶液的概念。
拉乌尔定律、亨利定律及其应用。
7.活度及选取活度参考状态,以活度
表示液态(固态)混合物中组分以及溶液中溶剂和溶质的化学势,求取组分活度因子的方法。
四、相平衡:1.两组分气液平衡系统恒温相图和恒压相图点、线、面的物理意义。
杠杆规则的运用。
根据相图说明精馏原理。
2.两组分液液气平衡系统相图点、线、面的物理意义,根据相图说明精馏原理。
3.用热分析法和溶解度法制作两组分系统液固平衡相图的方法,各类液固相图的点、线、面的物理意义。
相律和杠杆规则的运用。
液固平衡相图的一些实际应用实例。
4.相平衡计算的基本原理。
各种类型相平衡计算的内容和方法。
5. 稀溶液的依数性及其一些应用。
五、化学平衡:1.标准平衡常数的定义。
以逸度、分压、浓度、活度、摩尔分数表示的平衡常数及其与标准平衡常数的关系。
2.化学反应等温方程。
用等温方程判断化学反应方向与限度的方法。
3.同时平衡。
4.范特荷甫方程的推导,运用范特荷甫方程计算不同温度下标准平衡常数的方法。
5.用热性质数据计算标准平衡常数。
六、化学动力学:1.基元反应、复合反应,以及它们之间的关系。
2.化学反应速率的定义及应用。
3.反应分子数、级数、速率常数和速率系数的概念和含义。
4.零级、一级、二级、n级反应速率方程的基本特征及应用。
5.对峙反应、连串反应和平行反应的基本特点及它们的积分形式。
它们的应用实例。
6.阿仑尼乌斯方程及其应用。
阿仑尼乌斯活化能和指前因子的含义。
7.动力学实验数据处理方法。
8.快速反应的实验方法。
9.由反应机理求速率方程的近似方法——平衡态处理法和恒稳态处理法。
七、界面现象:1.界面张力和单位界面过剩量。
定义界面过剩量的吉布斯方法。
2.有界面相系统的热力学基本方程和平衡条件。
3.拉普拉斯方程、开尔文方程、吉布斯等温方程的推导,各方程的物理含义及一些应用。
4.润湿和铺展。
5.获得各类界面平衡特性的实验方法。
6.气体在固体表面的物理吸附和化学吸附。
兰缪尔模型、BET多层吸附模型的意义和应用。
毛细管凝结现象的原因。
八、电解质溶液:1.电解质活度、离子活度、离子平均活度、溶剂活
度和溶剂渗透因子。
2.离子互吸理论要点。
3.电解质溶液活度的一些应用。
4.电解质溶液的导电机理。
电迁移率、迁移数、电导率、摩尔电导率和离子摩尔电导率的定义和物理意义,以及它们间的相互关系。
5.电导测定对离解平衡的应用。
6.电解质溶液扩散的特点。
扩散系数与电迁移率和摩尔电导率的关系。
7.获得传递性质的半经验方法。
8.电解质溶液中化学反应的特点和影响反应速率的因素。
九、电化学:1.电化学反应与一般化学反应的区别和联系。
2.各类电极和电极反应的书写惯例。
电池和电池反应的书写惯例。
3.电动势、电池电势、电池反应电势、电池反应标准电势和电池反应条件电势的区别。
电极电势、电极反应电势、电极反应标准电势和电极反应条件电势的区别。
3.电化学系统的热力学基本方程、电化学势和电化学平衡判据。
4.电池反应和电极反应的能斯特方程。
以标准氢电极定义电极反应电势和标准电势。
电池反应电势和电极反应电势的计算方法及应用。
5.浓差电池及液接电势的计算。
6.外电势、表面电势和内电势的物理意义及它们与电极电势的关系。
7.电化学反应速率、电流和电势的相互关系。
8.极化现象和超电势、塔费尔方程。
9.电化学过程的应用。
十、胶体:1.胶体系统的分类。
热力学稳定系统与亚稳系统的区别、均相分散系统与多相分散系统的区别。
2.静电稳定胶体系统和高分子稳定胶体系统的稳定机制,DLVO理论和位阻效应。
3. 絮凝和聚结的区别。
影响胶体系统失稳、絮凝或聚结的各种因素。
4.胶体系统的动力性质、动电性质、流变性质和光学性质及变化规律。
5.缔合胶体、乳状液、泡沫和凝胶。
实验部分
①了解与理论部分相关的包括化学热力学、化学动力学、电化学、
界面与胶体化学实验的基本原理。
②明确物理化学中常用物理量测定的相关方法及优缺点。
③明确实验中常用、通用仪器的原理及使用方法。
参考书目:
《多媒体CAI物理化学》,傅玉普等编,第四版,大连理工大学出版社。
