必修二有机化学方程式
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
必修二有机物化学方程式

必修二有机物化学方程式有机物化学方程式1.甲烷燃烧CH+2O→CO+2HO(条件为点燃) 24222.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH→C+2H(条件为高温高压,催化剂)243.甲烷和氯气发生取代反应CH+Cl→CHCl+HCl CHCl+Cl→CHCl+HCl 2324322CHCl+Cl→CHCl+HCl CHCl+Cl→CCl+HCl (条件都为光照。
)42323224.实验室制甲烷CHCOONa+NaOH→NaCO+CH(条件是CaO 加热)42335.乙烯燃烧CH=CH+3O→2CO+2HO(条件为点燃)222226.乙烯和溴水CH=CH+Br→CHBr-CHBr 222227.乙烯和水CH=CH+HO→CH3CH2OH (条件为催化剂)2228.乙烯和氯化氢CH=CH+HCl→CH-CHCl 22329.乙烯和氢气CH=CH+H→CH-CH (条件为催化剂)3223210.乙烯聚合nCH=CH→-[-CH-CH-]n-(条件为催化剂)222211.氯乙烯聚合nCH=CHCl→-[-CH-CHCl-]-(条件为催化剂)n2212.实验室制乙烯CHCHOH→CH=CH↑+HO (条件为加热,浓HSO)422232213.乙炔燃烧CH+3O→2CO+HO (条件为点燃)2222214.乙炔和溴水CH+2Br→CHBr 42222215.乙炔和氯化氢两步反应:CH+HCl→CHCl--------CHCl+HCl→CHCl 2 2232324216.乙炔和氢气两步反应:CH+H→CH →CH+2H→CH (条件为催化6422222222剂)17.实验室制乙炔CaC+2HO→Ca(OH)+CH↑2222218.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO === CaO + CO 2CaO+5C===2CaC+CO 2223CaC+2HO→CH+Ca(OH)C+HO===CO+H-----高温2222222CH+H→CH----乙炔加成生成乙烯CH可聚合42224 2219.苯燃烧2CH+15O→12CO+6HO (条件为点燃)2262620.苯和液溴的取代CH+Br→CHBr+HBr 5666221.苯和浓硫酸浓硝酸CH+HNO→CHNO+HO (条件为浓硫酸)265623622.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H22Ca+H2O )2CH3COOH+CaO→(CH3CH2 乙酸和氧化钙29.30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。
高中化学必修一二化学方程式汇总

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
必修二有机化学方程式
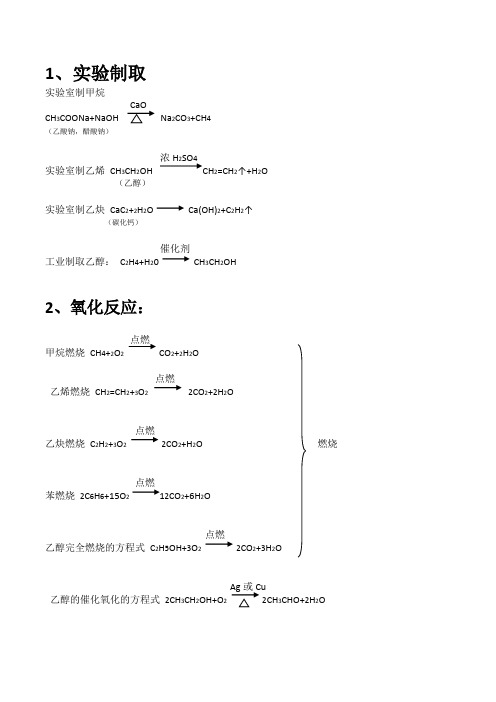
1、实验制取实验室制甲烷CH3COONa+NaOH Na2CO3+CH4(乙酸钠,醋酸钠)浓H2SO4实验室制乙烯CH3CH2OH CH2=CH2↑+H2O(乙醇)实验室制乙炔CaC2+2H2O Ca(OH)2+C2H2↑(碳化钙)催化剂工业制取乙醇:C2H4+H20 CH3CH2OH2、氧化反应:点燃甲烷燃烧CH4+2O2CO2+2H2O点燃乙烯燃烧CH2=CH2+3O22CO2+2H2O点燃乙炔燃烧C2H2+3O22CO2+H2O 燃烧点燃苯燃烧2C6H6+15O212CO2+6H2O点燃乙醇完全燃烧的方程式C2H5OH+3O22CO2+3H2O乙醇的催化氧化的方程式2CH3CH2OH+O22CH3CHO+2H2O甲烷和氯气发生取代反应光照CH4+Cl2CH3Cl+HCl光照CH3Cl+Cl2CH2Cl2+HCl光照CH2Cl2+Cl2CHCl3+HCl光照CHCl3+Cl2CCl4+HCl(注:反应物是卤素单质的蒸汽)苯和浓硫酸浓硝酸C6H6+HNO3C6H5NO2+H2O(硝基苯)FeBr3苯与溴在FeBr3催化作用下反应C6H6+Br2C6H5Br+HBr浓硫酸乙酸乙酯的水解:CH3COOC2H5+H2O CH3COOH+C2H5OH (注:苯的同系物也可以发生取代反应)4、加成反应:乙烯和溴水CH2=CH2+Br2CH2Br-CH2Br催化剂乙烯和水CH2=CH2+H20 加热加压CH3CH2OH催化剂乙烯和氯化氢CH2=H2+HCl CH3-CH2Cl乙烯和氢气CH2=CH2+H2CH3-CH3苯和氢气C6H6+3H2C6H12催化剂乙烯聚合nCH2=CH2-[-CH2-CH2-]n- (条件为催化剂)催化剂氯乙烯聚合nCH2=CHCl -[-CH2-CHCl-]n- (条件为催化剂)6、酯化反应:浓硫酸乙醇乙酸反应的方程式CH3CH2OH+CH3COOH CH3COOC2H5 +H2O (酸脱羟基,醇脱氢)(乙酸乙酯)7、补充:乙醇与钠反应2C2H5OH+2Na 2C2H5ONa+H2↑。
必修二有机物化学方程式

有机物化学方程式1.甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)2.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)3.甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。
)4.实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)5.乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)6.乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br7.乙烯和水CH2=CH2+H2O→CH3CH2OH (条件为催化剂)8.乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl9.乙烯和氢气CH2=CH2+H2→CH3-CH3(条件为催化剂)10.乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)11.氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)12.实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)13.乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)14.乙炔和溴水C2H2+2Br2→C2H2Br415.乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl216.乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6(条件为催化剂)17.实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑18.以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO22CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合19.苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)20.苯和液溴的取代C6H6+Br2→C6H5Br+HBr21.苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)22.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)23.乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)24.乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)25.乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)26.两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2CH3+H2O (条件为催化剂浓硫酸140摄氏度) 27.乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O28.乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H229.乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O30.乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH31.乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑32.甲醛和新制的氢氧化铜HCHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O33.乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O34.乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)一.烯烃是指含有C=C键的碳氢化合物。
必修二有机化学方程式归纳+答案

必修二有机化学方程式归纳一.写出下列反应的方程式(除燃烧外,有机物必须用结构简式表示)1.甲烷与氯气混合光照CH 4+Cl 2 CH 3Cl+HCl CH 3Cl+Cl 2 CH 2Cl 2+HClCH 2Cl 2+Cl 2 CHCl 3+HCl CHCl 3+Cl 2 CCl 4+HCl2.乙烯通入溴水(或通入溴的CCl 4溶液)中CH 2 = CH 2 + Br 2 CH 2BrCH 2Br3.乙烯与水反应 CH 2 = CH 2 + H 2O CH 3CH 2OH4.乙烯与溴化氢反应CH 2 = CH 2 + HBr CH 3CH 2Br5.乙炔与氯化氢反应生成氯乙烯CH ≡CH + HCl H 2C = CHCl6.苯和浓硝酸反应 + HO -NO 2 NO 2 +H 2O7.苯和液溴反应+ Br 2 Br + HBr8.苯和氢气反应+ 3H 2 9.某烃燃烧 CxHy+(x+y/4)O 2 xCO 2+y/2H 2O10.乙醇与钠反应2C 2H 5OH+2Na 2CH 3COONa+H 2↑11.乙醇催化氧化2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 12.乙醛氧化成乙酸2CH 3CHO + O 2 2CH 3COOH13.银镜反应 CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 光照 光照 光照 光照 催化剂 催化剂 催化剂浓H 2SO 450-60℃ Fe 催化剂 加热、加压点燃 Cu △催化剂水浴加热14.乙醛与新制氢氧化铜反应 CH 3CHO+2Cu(OH)2+NaOH CH 3COONa+Cu 2O ↓+2H 2O15.乙酸与钠反应2CH 3COOH+2Na CH 3COONa+H 2↑16.乙酸与碳酸钠反应2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑17.乙酸与氢氧化铜反应2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O18.乙酸与乙醇酯化反应 CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O 19.乙酸乙酯在酸性条件下水解CH 3COOC 2H 5+H 2O ⇋ CH 3COOH+ C 2H 5OH 20.乙酸乙酯在碱性条件下水解 CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 21.硬脂酸甘油酯与烧碱混合加热C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3 C 17H 35COONa+CH-OH C 17H 35COO-CH 2 CH 2-OH水浴加热 催化剂 △稀硫酸 △△△。
高中必修二化学方程式大全汇总(精华版)

高中必修二化学方程式大全汇总(精华版)方程式是化学学科内容的重中之重。
下面是高中必修二化学方程式,希望对大家有所帮助。
高中必修二化学方程式1必修二各章节化学方程式第一章物质结构元素周期律1、li与o2反应(点燃):4li+o22li2ona与o2反应(点燃):2na+o2na2o2na与h2o反应:2na+2h2o===2naoh+h2↑k与h2o反应:2k+2h2o===2koh+h2↑2、卤素单质f2、cl2、br2、i2与氢气反应:f2+h2===2hfcl2+h2===2hclbr2+h2===2bri2+h2===2hi3、卤素单质间的置换反应:(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:①cl2+2nabr===br2+2nacl②cl2+2nai===i2+2nacl(2)溴水与碘化钠溶液反应:br2+2nai===i2+2nabr4、mg与h2o反应:mg+2h2o===mg(oh)2+h2↑al与hcl反应:2al+6hcl===2alcl3+3h2↑mg与hcl反应:mg+2hcl===mgcl2+h2↑点击查看:高一必修二常用化学方程式总结第二章化学反应与能量1、ba(oh)2?8h2o与nh4cl的反应:ba(oh)2·8h2o+2nh4cl==bacl2+2nh3↑+10h2o2、原电池原理典型的原电池(zn-cu原电池)负极(锌):zn-2e-===zn2+(氧化反应)正极(铜):2h++2e-===h2↑(还原反应)、用电子式表示电子流动方向:由锌经过外电路流向铜。
总反应离子方程式:zn+2h+===zn2++h2↑3、h2o2在催化剂作用下受热分解:2h2o22h2o+o2↑4、na2so4与cacl2反应:na2so4+cacl2===caso4↓+na2co35、高炉炼铁:2c+o2===2cofe2o3+3co==2fe+3co2第三章有机化合物1、甲烷的主要化学性质(1)氧化反应(与o2的反应):ch4(g)+2o2(g)co2(g)+2h2o(l)(2)取代反应(与cl2在光照条件下的反应,生成四种不同的取代物):2、乙烯的主要化学性质(1)氧化反应(与o2的反应):c2h4+3o22co2+2h2o(2)加成反应((与br2的反应):(3)乙烯还可以和氢气、氯化氢、水等发生加成反应:ch2=ch2+h2ch3ch3ch2=ch2+hclch3ch2cl(一氯乙烷)ch2=ch2+h2och3ch2oh(乙醇)(4)聚合反应:(乙烯制聚乙烯)(氯乙烯制聚氯乙烯)3、苯的主要化学性质:(1)氧化反应(与o2的反应):2c6h6+15o212co2+6h2o br(2)取代反应:①与br2的反应:+br2+hbr②苯与硝酸(用hono2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
人教版高中化学必修一必修二化学方程式汇总

必修一、必修二化学方程式汇总必修一1、硫酸根离子的检验:BaCl2+Na2SO4====BaSO4↓+2NaCl2、碳酸根离子的检验:CaCl2+Na2CO3=====CaCO3↓+2NaCl3、碳酸钠与盐酸反响:Na2CO3+2HCl=====2NaCl+H2O+CO2↑高温4、木炭复原氧化铜:2CuO+C2Cu+CO2↑5、铁片与硫酸铜溶液反响:Fe+CuSO4=====FeSO4+Cu6、氯化钙与碳酸钠溶液反响:CaCl2+Na2CO3=====CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na+O2Na2O2钠与氧气反响:4Na+O2====2Na2O8、过氧化钠与水反响:2Na2O2+2H2O====4NaOH+O2↑9、过氧化钠与二氧化碳反响:2Na2O2+2CO2====2Na2CO3+O210、钠与水反响:2Na+2H2O====2NaOH+H2↑11、铁与水蒸气反响:3Fe+4H2O(g)====Fe3O4+4H2↑12、铝与氢氧化钠溶液反响:2Al+2NaOH+2H2O====2NaAlO2 +3H2↑13、氧化钙与水反响:CaO+H2O====Ca(OH)214、氧化铁与盐酸反响:Fe2O3+6HCl=====2FeCl3+3H2O第1页共11页15、氧化铝与盐酸反响:Al2O3+6HCl=====2AlCl3+3H2O16、氧化铝与氢氧化钠溶液反响:Al2O3+2NaOH=====2NaAlO2 +H2O17、氯化铁与氢氧化钠溶液反响:FeCl3+3NaOH=====Fe(OH)3 ↓+3NaCl18、硫酸亚铁与氢氧化钠溶液反响:FeSO4+2NaOH====Fe(OH)2 ↓+Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2+2H2O+O2====4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3Fe2O3+3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3+6NH3·H2O====2Al(OH)3↓+3(NH3)2SO422、氢氧化铝与盐酸反响:Al(OH)3+3HCl====AlCl3+3H2O23、氢氧化铝与氢氧化钠溶液反响:Al(OH)3+NaOH====NaAlO2 +2H2O24、氢氧化铝加热分解:2Al(OH)3Al2O3+3H2O25、三氯化铁溶液与铁粉反响:2FeCl3+Fe====3FeCl226、氯化亚铁中通入氯气:2FeCl2+Cl2=====2FeCl327、二氧化硅与氢氟酸反响:SiO2+4HF====SiF4+2H2O硅单质与氢氟酸反响:Si+4HF====SiF4+2H2↑第2页共11页高温28、二氧化硅与氧化钙高温反响:SiO2+CaOCaSiO329、二氧化硅与氢氧化钠溶液反响:SiO2+2NaOH====Na2SiO3+H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓31、硅酸钠与盐酸反响:Na2SiO3+2HCl===2NaCl+H2SiO3↓点燃32、氯气与金属铁反响:2Fe+3Cl22FeCl3点燃33、氯气与金属铜反响:Cu+Cl2CuCl2点燃34、氯气与金属钠反响:2Na+Cl22NaCl35、氯气与水反响:Cl2+H2O====HCl+HClO光照36、次氯酸光照分解:2HClO2HCl+O2↑37、氯气与氢氧化钠溶液反响:Cl2+2NaOH=====NaCl+NaClO+H2O38、氯气与消石灰反响:2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O39、盐酸与硝酸银溶液反响:HCl+AgNO3====AgCl↓+HNO340、漂白粉长期置露在空气中:Ca(ClO)2+H2O+CO2====CaCO3↓+2HClO41、二氧化硫与水反响:SO2+H2O===H2SO3第3页共11页放电42、氮气与氧气在放电下反响:N2+O22NO43、一氧化氮与氧气反响:2NO+O2====2NO244、二氧化氮与水反响:3NO2+H2O====2HNO3+NO催化剂45、二氧化硫与氧气在催化剂的作用下反响:2SO2+O22SO346、三氧化硫与水反响:SO3+H2O====H2SO447、浓硫酸与铜反响:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑48、浓硫酸与木炭反响:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O49、浓硝酸与铜反响:Cu+4HNO3(浓)====Cu(NO3)2+2H2O+2NO2↑50、稀硝酸与铜反响:3Cu+8HNO3(稀)3Cu(NO3)2+4H2O+2NO↑51、氨水受热分解:NH3·H2ONH3↑+H2O52、氨气与氯化氢反响:NH3+HCl====NH4Cl53、氯化铵受热分解:NH4ClNH3↑+HCl↑54、碳酸氢氨受热分解:NH4HCO3NH3↑+H2O↑+CO2↑55、硝酸铵与氢氧化钠反响:NH4NO3+NaOHNH3↑+NaNO3+H2O第4页共11页56、氨气的实验室制取:2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑点燃57、氯气与氢气反响:Cl2+H22HCl58、硫酸铵与氢氧化钠反响:〔NH4〕2SO4+2NaOH2NH3↑+ Na2SO4+2H2O59、SO2+CaO====CaSO360、SO2+2NaOH====Na2SO3+H2O61、SO2+Ca(OH)2====CaSO3↓+H2O62、SO2+Cl2+2H2O====2HCl+H2SO463、SO2+2H2S====3S+2H2O64、NO、NO2的回收:NO2+NO+2NaOH====2NaNO2+H2O65、Si+2F2===SiF466、Si+2NaOH+H2O====Na2SiO3+2H2↑67、硅单质的实验室制法高温电炉粗硅的制取:SiO2+2CSi+2CO〔石英沙〕〔焦碳〕〔粗硅〕粗硅转变为纯硅:Si〔粗〕+2Cl2SiCl4高温SiCl4+2H2Si〔纯〕+4HCl第5页共11页必修二第一章物质构造元素周期律1、Li与O2反响〔点燃〕:4Li+O22Li2ONa与O2反响〔点燃〕:2Na+O2Na2O2Na与H2O反响:2Na+2H2O===2NaOH+H2↑K与H2O反响:2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反响:F2+H2===2HFCl2+H2===2HClBr2+H2===2BrI2+H2===2HI3、卤素单质间的置换反响:〔1〕氯水与饱和溴化钠、氯水与饱和碘化钠溶液反响:①Cl2+2NaBr===Br2+2NaCl②Cl2+2NaI===I2+2NaCl〔2〕溴水与碘化钠溶液反响:Br2+2NaI===I2+2NaBr 4、Mg与H2O反响:Mg+2H2O===Mg(OH)2+H2↑Al与HCl反响:2Al+6HCl===2AlCl3+3H2↑Mg与HCl反响:Mg+2HCl===MgCl2+H2↑5、Na与Cl2反响〔点燃〕:6、用电子式表示氯化氢的形成过程:第二章化学反响与能量第6页共11页1、Ba(OH)2?8H2O与NH4Cl的反响:Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O2、原电池原理典型的原电池〔Zn-Cu原电池〕负极〔锌〕:Zn-2e-===Zn-===Zn2+〔氧化反响〕正极〔铜〕:2H ++2e-===H 2↑〔复原反响〕电子流动方向:由锌经过外电路流向铜。
高中化学苏教版必修二有机化合物化学方程式总结

高中化学苏教版必修二有机化合物化学方程式总结1.甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)2.甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)3.甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HCl CH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。
)4.乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)5.乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br6.乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化)7.乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl8.乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)9.乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)10.乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)11.乙炔和溴水C2H2+2Br2→C2H2Br412.乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl213.乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)14.苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)15.苯和液溴的取代C6H6+Br2→C6H5Br+HBr16.苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)17.苯和氢气C6H6+3H2→C6H12 (条件为催化剂)18.乙烷和氯气反应CH3-CH3+Cl2=CH3-CH2Cl+HC l。
人教版高中化学必修一必修二化学方程式汇总

化学必修一必修二方程式汇总必修一、必修二化学方程式汇总必修一1 、硫酸根离子的检验: B a C l2+ N a2 S O 4 = = = = B a S O 4↓ + 2 N a C l2 、碳酸根离子的检验: C a C l2+ N a 2 C O3 = = = = = C a C O 3↓ + 2 N a C l3 、碳酸钠与盐酸反应:N a 2 C O 3+ 2 H C l= = = = = 2 N a C l+ H 2 O+ C O2↑高温4 、木炭还原氧化铜: 2 C u O +C 2 C u+ C O 2↑5 、铁片与硫酸铜溶液反应: F e+ C u S O 4= = = = = F e S O 4+ C u6 、氯化钙与碳酸钠溶液反应: C a C l2+N a 2 C O 3= = = = = C a C O 3↓ +2 N a C l7 、钠在空气中燃烧: 2 N a+O 2N a 2 O 2钠与氧气反应: 4 N a+O 2= = = = 2 N a 2 O8 、过氧化钠与水反应: 2 N a 2 O 2+ 2 H 2 O = = = = 4 N a O H+O 2↑9 、过氧化钠与二氧化碳反应: 2 N a 2 O 2+ 2 C O 2= = = = 2 N a 2 C O 3+ O 21 0 、钠与水反应:2 N a+ 2 H 2 O = = = = 2 N a O H +H 2↑1 1 、铁与水蒸气反应: 3 F e+ 4 H2 O ( g )= = = = F e3 O 4+4 H 2↑1 2 、铝与氢氧化钠溶液反应: 2 A l + 2 N a O H + 2 H 2 O = = = = 2 N a A l O 2+ 3 H2↑1 3 、氧化钙与水反应: C a O +H2 O= = = = C a ( O H )21 5 、氧化铝与盐酸反应: A l2 O 3+ 6 H C l= = = = = 2 A l C l3+3 H 2 O1 6 、氧化铝与氢氧化钠溶液反应: A l2 O 3+ 2 N a O H = = = = = 2 N a A l O 2+H 2 O1 7 、氯化铁与氢氧化钠溶液反应: F e C l3+ 3 N a O H = = = = = F e ( O H )3↓+ 3 N a C l1 8 、硫酸亚铁与氢氧化钠溶液反应:F e S O 4 +2 N a O H = = = = F e ( O H )2↓+ N a 2 S O 41 9 、氢氧化亚铁被氧化成氢氧化铁: 4 F e ( O H )2+2 H 2 O +O 2= = = =4 F e ( O H )32 0 、氢氧化铁加热分解: 2 F e ( O H )3 F e 2 O 3+ 3 H 2 O ↑2 1 、实验室制取氢氧化铝: A l 2 (S O 4 )3+ 6 N H 3· H 2 O = = = =2 A l ( O H )3 ↓+ 3 ( N H 3 ) 2 S O 42 2 、氢氧化铝与盐酸反应: A l ( O H )3+3 H C l = = = = A l C l3+ 3 H 2 O2 3 、氢氧化铝与氢氧化钠溶液反应:A l ( O H )3+ N a O H = = = = N a A l O 2+ 2 H2O2 4 、氢氧化铝加热分解: 2 A l ( O H )3 A l 2 O 3+ 3 H 2 O2 5 、三氯化铁溶液与铁粉反应: 2 F e C l3+ F e= = = =3 F e C l22 6 、氯化亚铁中通入氯气: 2 F e C l2+ C l2= = = = = 2 F e C l32 7 、二氧化硅与氢氟酸反应:S i O 2+ 4 H F= = = =S i F 4+ 2 H 2 O硅单质与氢氟酸反应:S i+ 4 H F= = = =S i F 4+ 2 H 2↑高温2 8 、二氧化硅与氧化钙高温反应:S i O 2+ C a O C a S i O 32 9 、二氧化硅与氢氧化钠溶液反应:S i O 2+ 2 N a O H = = = = N a 2 S i O 3+H 2 O3 0 、往硅酸钠溶液中通入二氧化碳:N a 2 S i O 3 + C O 2 + H 2 O = = = N a 2 C O 3+H 2 S i O 3↓3 1 、硅酸钠与盐酸反应: N a 2 S i O 3 + 2 H C l = = = 2 N a C l + H 2 S i O 3↓点燃3 2 、氯气与金属铁反应: 2 F e+ 3 C l2 2 F e C l3点燃3 3 、氯气与金属铜反应: C u+ C l2 C u C l2点燃3 4 、氯气与金属钠反应: 2 N a+ C l2 2 N a C l3 5 、氯气与水反应: C l2+H 2 O = = = =H C l+H C l O光照3 6 、次氯酸光照分解: 2 H C l O 2 H C l+O 2↑3 7 、氯气与氢氧化钠溶液反应: C l2+ 2 N a O H = = = = = N a C l + N a C l O+H 2 O3 8 、氯气与消石灰反应: 2 C l2+ 2 C a ( O H ) 2= = = = C a C l2+C a ( C l O )2+ 2 H 2 O3 9 、盐酸与硝酸银溶液反应:H C l+ A g N O 3 = = = = A g C l↓ +H N O 34 0 、漂白粉长期置露在空气中: C a ( C l O )2+ H 2 O + C O 2 = = = = C a C O 3↓+2 H C l O4 1 、二氧化硫与水反应:SO2+H2O == =H2SO3放电4 2 、氮气与氧气在放电下反应:N 2+O 2 2 N O4 3 、一氧化氮与氧气反应: 2 NO +O2==== 2 NO24 4 、二氧化氮与水反应:3NO2+H2O = ===2HNO3+NO4 5 、二氧化硫与氧气在催化剂的作用下反应:2 S O 2 + O 2催化剂2 SO34 6 、三氧化硫与水反应:SO3+H2O == ==H2SO44 7 、浓硫酸与铜反应: C u+ 2 H 2 S O 4 (浓) C u S O 4+ 2 H 2 O +SO2↑4 8 、浓硫酸与木炭反应: C + 2 H2SO4(浓) C O2↑+ 2 SO2↑+ 2 H2O 4 9 、浓硝酸与铜反应: C u + 4 H N O 3 (浓)= = = = C u ( N O 3 ) 2 + 2 H 2 O+ 2 NO2↑5 0 、稀硝酸与铜反应: 3 C u + 8 H N O 3 (稀) 3 C u ( N O 3 )2+ 4 H 2 O+ 2 NO↑5 1 、氨水受热分解:NH3·H2O N H3↑+H2O5 2 、氨气与氯化氢反应:N H 3+H C l= = = =N H 4 C l5 3 、氯化铵受热分解:N H 4 C l N H 3↑ +H C l↑5 4 、碳酸氢氨受热分解:NH4HCO3N H3↑+H2O↑+CO2↑5 5 、硝酸铵与氢氧化钠反应:N H 4 N O 3 + N a O H N H 3↑ + N a N O 3 +H 2 O5 6 、氨气的实验室制取: 2 N H 4 C l+ C a ( O H )2 C a C l2+ 2 H 2 O + 2 NH3↑点燃5 7 、氯气与氢气反应: C l2+H 2 2 H C l5 8 、硫酸铵与氢氧化钠反应:(N H 4)2 S O 4+ 2 N a O H 2 N H 3↑ +N a 2 S O 4+ 2 H 2 O5 9 、 S O 2+ C a O = = = = C a S O 36 0 、 S O 2+ 2 N a O H= = = =N a 2 S O 3+H 2 O6 1 、 S O 2+ C a ( O H )2= = = = C a S O 3↓ +H 2 O6 2 、 S O 2+ C l2+ 2 H 2 O = = = = 2 H C l+H 2 S O 463、SO2+2H2S====3S+2H2O6 4 、 N O 、 N O 2的回收: N O 2+ N O + 2 N a O H = = = = 2 N a N O 2+H 2 O6 5 、 S i+ 2 F 2= = =S i F 46 6 、 S i+ 2 N a O H+H 2 O = = = =N a 2 S i O 3+ 2 H 2↑6 7 、硅单质的实验室制法高温电炉粗硅的制取:S i O 2+ 2 C S i+ 2 C O(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:S i(粗)+ 2 C l2S i C l4高温必修二第一章物质结构元素周期律1 、 L i与O2反应(点燃):4 L i+O2 2 L i2ON a与 O 2反应(点燃) : 2N a + O 2N a 2 O 2N a与 H 2O反应:2N a + 2H 2 O = = = 2 N a O H + H 2↑K 与H2O反应: 2K+2H2O===2KOH+H2↑2 、卤素单质 F 2、C l2、B r2、I2与氢气反应:F 2+ H 2=== 2HF C l 2 + H 2 = = = 2 H C l Br 2 +H 2= = = 2 B rI2+H 2=== 2HI3、卤素单质间的置换反应:( 1 )氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① C l 2 + 2 N a B r = = = B r 2 + 2 N a C l②C l 2 + 2 N a I = = = I 2 + 2 N a C l( 2 )溴水与碘化钠溶液反应: B r 2 + 2 N a I = = = I 2 + 2 N a B r4 、 M g与H2O反应:M g + 2 H2O= = =M g ( O H ) 2 +H 2↑A l与H C l反应: 2 A l + 6 H C l = = = 2 A l C l 3 + 3 H 2↑M g与H C l反应:M g + 2H C l= = =M g C l 2 +H 2↑5 、 N a与C l 2 反应(点燃):6、用电子式表示氯化氢的形成过程:第二章化学反应与能量1 、 B a ( O H )2 ?8 H 2 O 与 N H 4 C l的反应:B a ( O H ) 2 ·8H 2 O + 2 N H 4C l = = B a C l 2 + 2 N H 3↑ + 1 0 H 2 O2 、原电池原理典型的原电池(Z n - C u原电池)负极(锌):Z n - 2 e - = = = Z n 2 +(氧化反应)正极(铜): 2 H + + 2 e - = = = H 2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
高中化学 有机化学部分方程式及基本题型汇总 鲁科版必修2

必修二有机化学部分方程式及基本题型汇总一、认识有机化合物1、甲烷(物理性质必须记住,以下省去)电子式结构简式结构式空间构型相关的反应方程式(有机化学部分方程式均用“→”):(1)、甲烷的取代反应现象取代反应的特点:一定是有机物参与的反应且不能用取代反应的原理制备纯净物,因为反应一旦开始所有的生成物均存在(选择题常考,记住!)四种氯代产物物理性质分别是需要特别注意的是三氯甲烷又叫,曾用作麻醉剂,人扭伤后可用它镇痛(有选择题出现过,若选项中有乙醇,勿错选!)关于取代反应的常见题型:1molCH4与一定量的氯气在光照下发生取代反应,生成的四种氯代甲烷的物质的量相等,则参加反应的氯气的物质的量是多少?思路解析:由于生成的四种氯代甲烷的物质的量相等,可以根据甲烷的四步取代反应写出总的化学方程式,再根据阿伏伽德罗定律求解。
(自己试着做,做在一张纸上,把步骤写清楚)(2)、甲烷的燃烧反应现象总结:(1)、烷烃的结构特点是:它们的分子中碳原子间以单键相连成链状,碳原子的其他价键都被氢原子所饱和(选择题常考,记住!)(2)、同分异构现象和同分异构体(参看自主学习53—54页,试着去理解)写出丁烷的同分异构体的结构式和结构简式:写出戊烷的三种同分异构体的结构式和结构简式:二、石油和煤重要的烃1、关于石油的分馏、裂化和裂解以及煤的干馏(与蒸馏区分开)的问题,阅读你的化学资料和课本,将自主学习丛书上58—59页知识梳理的部分完善,并背诵(选择题会有涉及,也比较重点)记一个化学方程式:十六烷的裂化反应2、乙烯电子式结构简式结构式空间构型相关的反应方程式:(1)、乙烯的燃烧反应现象(2)、乙烯和溴(溴的四氯化碳溶液)的加成反应(注意产物名称)(3)、乙烯和氢气加成(4)、乙烯和氯化氢加成制备一氯乙烷(5)、乙烯和水加成优点:可以制备纯净的一氯乙烷,通常与乙烷的取代反应对比(选择题常考,记住!)注意:烃的密度均比水小3、苯电子式结构简式结构式空间构型苯中的化学键是介于单键与双键之间的特殊化学键,能够证明这一点的判据有:(1)、苯不能使酸性高锰酸钾溶液褪色;(2)、苯中的碳碳键的键长均相等;(3)、苯的邻位取代物只有一种(实际上苯的间位取代物也只有一种,但是不能作为判据);(4)、苯在溴化铁存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色辨析:苯能在加热和催化剂存在的条件下氢化成环己烷能不能作为判据?解析:不能。
高中化学必修二有机化学方程式

高中化学必修二有机化学方程式篇一:必修2有机化学方程式汇总必修2有机化学方程式汇总1. CH4 + 2O CO2 + 2H2O 甲烷的燃烧反应2. CH4 + Cl2 CH3Cl + HCl3. CH3Cl + Cl2 CH2Cl2 + HCl4. CH2Cl + Cl光照CHCl3 + HCl 光照光照点燃甲烷的取代反应5. CHCl3 + Cl CCl4+ HCl6. CH4C +2H2 甲烷受热分解(隔绝空气)7. CH3COONa + NaOH △CH4↑+ Na2CO3甲烷的实验室制备(了解)8. C2H4 + 3O2 2CO2 + 2H2O乙烯的燃烧反应9. CH2 = CH2 + Br CH2Br—CH2Br10. CH2 = CH23CH2OH11. CH2 = CH2CaO 高温光照点燃3—CH2Br 乙烯的加成反应12. CH2 = CH23—CH313. nCH2 = CHCH2乙烯的加聚反应14. 2C6H6 +15O2 12CO2 + 6H2O苯的燃烧反应15. + Br2 苯的卤代反应16. + HO2 +H2O苯的硝化反应17. + HO3H+H2O苯的磺化反应(了解)18. + 3H2 △苯的加成反应Ni -NO2 2O 甲苯硝化反应制TNT(了解)20. C2H6O+ 3O2 2CO2 + 3H2O乙醇的燃烧反应21. 2CH3CH22CH3CH2ONa + H2↑乙醇的置换反应22. 2CH3CH2OH+O2Cu/Ag 2CH3CHO + 2H2O 乙醇的催化氧化△23. CH3CH2OH 浓硫酸 2 = C H2↑+ H2O 乙醇的消去反应(实验室制乙烯的原理)170℃24. C2H5OH+C2H5140℃C2H5OC2H5+H2O 分子间脱水成醚(了解)25. 2CH3COOH+2Na 2CH3COONa+H2↑26.2CH3COOH+Na2CO2CH3COONa+H2O+CO2↑ 27. CH33 CH3COONa+H2O+CO2↑28. CH3COOH + NaOH CH3COONa + H2O 29. 2CH3COOH + Cu(OH)(CHCOO)2Cu + 2H2O 30. CH3COOH+CH3CH23COOCH2CH3 +H2O 酯化反应31. CH3COOCH2CH33COONa+CH3CH2OH 酯的水解32. C6H12O6 (s) + 6O 6CO2 (g) + 6H2O (l) 生理氧化反应(有氧呼吸)33. C6H12O6 2CH3CH2OH + 2CO2发酵生成酒精34. C12H22O11+H2OC6H12O6+ C6H12O6蔗糖葡萄糖果糖 35. C12H22O11 + H2O 催化剂2C6H12O6麦芽唐葡萄糖催化剂催化剂浓硫酸乙酸的酸性(了解)36. (C6H10O5)n + nH2n C6H12O6淀粉葡萄糖37. (C6H10O5)n + nH2催化剂n C6H12O6 △纤维素葡萄糖催化剂双糖和多糖的水解篇二:必修2有机化学方程式汇总必修2有机化学方程式汇总1. CH4 + 2O CO2 + 2H2O 甲烷的燃烧反应2. CH4 + Cl2CH3Cl + HCl3. CH3Cl + Cl2CH2Cl2 + HCl4. CH2Cl + Cl光照CHCl3 + HCl 光照光照点燃甲烷的取代反应5. CHCl3 + Cl CCl4+ HCl6. CHC +2H2 甲烷受热分解(隔绝空气)7. CH3COONa + NaOH △CH4↑+ Na2CO3甲烷的实验室制备(了解)8. C2H4 + 3O2 点燃2CO2 + 2H2O乙烯的燃烧反应9. CH2 = CH2CH2Br—CH2B(来自: 小龙文档网:高中化学必修二有机化学方程式)r10. CH2 = CH23CH2OH11. CH2 = CH2CH3—CH2Br CaO 高温光照乙烯的加成反应12. CH2 = CH23—CH3 13. nCH2 CH 乙烯的加聚反应14. 2C6H6 +15O2 12CO2 + 6H2O苯的燃烧反应15. + Br2 苯的卤代反应16. NO2 +H2O苯的硝化反应17. 3H+H2O苯的磺化反应(了解)18. + 3H2 △苯的加成反应Ni 点燃-NO2 2O 甲苯硝化反应制TNT(了解)20. C2H6O+ 3O2点燃2CO2 + 3H2O乙醇的燃烧反应21. 2CH3CH2 2CH3CH2ONa + H2↑乙醇的置换反应22. 2CH3CH2OH+O2 Cu/Ag 2CH3CHO + 2H2O 乙醇的催化氧化△CH2 = CH2↑+ H2O 乙醇的消去反应23. CH3CH2OH 浓硫酸(实验室制乙烯的原理)170℃浓硫酸24. C2H5OH+C2H5 C2H5OC2H5+H2O 分子间脱水成醚(了解)140℃25. 2CH3 2CH3COO Na+H2↑26.2CH3COOH+Na232CH3COONa+H2O+CO2↑乙酸的酸性27. CH33 CH3COONa+H2O+CO2↑28. CH3 CH3COONa + H2O29. 2CH33COO)2Cu + 2H2O30. CH3COOH+CH3 CH3COOCH2CH3 +H2O 酯化反应31. CH3COOCH2CH33COONa+CH3CH2OH酯的水解32. C6H12O6 (s) + 6O 6CO2 (g) + 6H2O (l) 生理氧化反应(有氧呼吸)33. C6H12O催化剂6 2CH催化剂3CH 2OH + 2CO2发酵生成酒精(无氧呼吸)34. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖35. C催化剂12H22O11 + H22C6H12O6麦芽唐葡萄糖36. (C催化剂双糖和多糖的水解6H10O5)n + nH2 n C6H12O6淀粉葡萄糖37. (C催化剂6H10O5)n + nH2 △n C6H12O6纤维素葡萄糖(了解)篇三:必修二_有机化学_方程式总结必修二有机化学方程式总结甲烷和Cl2:CH4+Cl2光CH3Cl+HClCH3Cl+Cl2 CH2Cl2+HClCH2Cl2+Cl2 CHCl3+HClCHCl3+Cl2 CCl4+HCl 甲烷燃烧:CH4+2O2 2+2H2O 甲烷分解:CH4C+2H2乙烯燃烧:C2H4 +3O2 2CO2+2H2O 乙烯与Br2:C2H4+ BrC2H4Br2 乙烯与H2:C2H4+H2C2H6 乙烯与HX:C2H4+HX 3CH2X 乙烯与H2O:C2H4+H2O 3CH2OH 乙烯的加聚:nC2H4 2-CH 2 点12CO2+6H2O 3 NO2 +H2O +H2SO4(浓3H +H2O 苯与H2+3H2 Ni 乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2 乙醇燃烧:C2H5OH+O2 2CO2+3H2O 乙醇催化氧化:2C2H5OH+O2CH3CHO+2H2O乙醇分子内脱水:C2H5OH浓H2SO4、170℃CH2=CH22O 乙醇分子间脱水:2C2H5OH浓H2SO4 、140℃CH3CH2OC2H5(乙醚)+H2O 注:一般醚以与氧相连的烃基加醚字命名乙醇与HX:C2H5OH+HX C2H5OX+H2O 乙酸与NaOH: CH3COOH+NaOH CH3COONa+H2O 乙酸Na2CO3:CH3COOH+Na2CO3 CH3COONa+H2O+CO2乙醇与乙酸:CH3COOH+ C2H5OH 浓硫酸、△CH3COOC2H5+H2O 乙酸乙酯水解:CH3COOC2H5+H2O CH3COOH+ C2H5OH乙酸乙酯皂化:CH3COOC2H5+NaO △CH3COONa+ C2H5OH 蔗糖水解:C12H22O11蔗+H2O 稀硫酸C6H10O6葡+ C6H10O6果麦芽糖水解:C12H22O11麦+H2O 催 2 C6H10O6葡纤维素水解:(C6H10O5)n纤+H2O 6H10O6葡淀粉水解:(C6H10O5)n淀+H2O nC6H10O6葡C17H35COOCH2 CH2OH (饱和)C17H352O 17H35COOH+CHOH C17H35COOCH2 CH2OH 软质酸甘油酯:C15H35COOCH2(不饱和)C15H35COOCH2C15H35COOCH2油酸甘油酯:C17H33COOCH2C17H33COOCH2相关热词搜索:有机化学方程式必修高中化学高二有机化学方程式必修5有机化学方程式。
高一化学必修二方程式总结人教版

高一化学必修二方程式总结人教版一、氧化还原反应1. 酸-碱反应:H2O + CO2 --> H2CO32. 氧化还原反应:2CO + O2 --> 2CO23. 氰化反应:NaCN + H2O --> NaOH + HCN4. 碳酸根氧化反应:HCO3- + H2O --> CO3²- + H3O+5. 氯气氧化反应:Cl2 + 2H2O --> 4HCl + O26. 独立氧化反应:2K → 2K+ + 2e-7. 氧化还原反应中氧原子的还原:O2 + 4H+ + 4e- → 2H2O8. 氧化性离子的氧化:Fe2+ + 2e- → Fe9. 氧化还原平衡:2 Cr2+ + 2H2O + O2 → 4CrO4²- + 4H+二、酸碱反应1. 水的离解:H2O --> H+ + OH-2. 酸-碱反应:HCl + NaOH → NaCl + H2O3. 氨水的电离:NH3 + H2O → NH4+ + OH-4. 酸碱反应的滴定:HCl + NaOH ↔ NaCl + H2O5. 强碱的溶解:Na2CO3 + H2O → 2Na+ + HCO3- + OH- 6. 有机酸的水解:CH3COOH + H2O → CH3COO- + H3O+ 7. 羧酸的电离:HCOOH → HCOO- + H+8. 盐酸的水解:HCl + H2O → Cl- + H3O+9. 萘醌的水解:C6H5CN + H2O → C6H5COO- + H+ + CN-三、水解反应1. 盐式水解:KHSO4 + H2O --> K+ + HSO4-2. 酯式水解:K2CO3 + H2O --> 2K+ + HCO3-3. 交联式水解:Na2CO3·H2O --> 2Na+ + HCO3-4. 脱水式水解:FeCl3·H2O --> FeCl3 + H2O5. 醇的水解:CH3CH2OH + H2O --> CH3CH2OH2+ + OH- 6. 环糊精的水解:C6H10O5 + H2O --> C6H10O5H2+ + OH- 7. 脱羧酸的水解:HCOOH + H2O --> HCOO- + H3O+8. 毒死芽孢杆菌的水解:C8H11NO2 + H2O --> C8H11NO2H+ + OH-四、分子式的指示性反应1. 过氧化物的缩聚反应:2KClO3 → 2KCl + 3O22. 氧化氢反应:2HCl + O2 → 2H2O + Cl23. 酸整合反应:H3PO4 + 3NaOH → 3H2O + Na3PO44. 共价带来的活化:FeCl3 + NaOH → Fe(OH)3 + NaCl5. 水热反应:CaCO3 + H2O → Ca(OH)2 + H2CO36. 氧化还原反应:S + O2 → SO27. 混合催化反应:2H2 + O2 → 2H2O8. 水杨酸的改性反应:CET + H2O → C6H10O5 + 2H+ + 2OH-。
高一化学必修二第三章--有机化合物知识点总结

高一化学必修二第三章--有机化合物知识点总结第三章:有机化合物知识点总结绝大多数含碳的化合物都被称为有机化合物,简称有机物。
少数化合物,如CO、CO2碳酸、碳酸盐、金属碳化物等,属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:有机物 | 通式 | 代表物 | 结构简式(官能团) | 结构特点 | 空间结构 | 物理性质 | 用途 |烷烃 | CnH2n+2 | 甲烷(CH4) | CH4 | 单键,链状,饱和烃 | 正四面体 | 无色稍有气味的气体,比空气略轻,难溶于水 | 石化工业原料,植物生长调节剂,催熟剂 |烯烃 | CnH2n | 乙烯(C2H4) | CH2=CH2 | 双键,链状,不饱和烃(证明:加成、加聚反应) | 六原子共平面 | 无色有特殊气味的液体,密度比水小,难溶于水 | 优良燃料,化工原料|芳香烃 | C6H6 | 苯(C6H6) | 一种介于单键和双键之间的独特的键(证明:邻二位取代物只有一种),环状平面正六边形| 无色无味的气体,比空气轻,难溶于水 | 有机溶剂,化工原料 |3、烃类有机物化学性质1、甲烷的性质比较稳定,不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应。
2、燃烧反应(氧化反应):CH42O2CO22H2O(淡蓝色火焰)。
3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种):①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代。
②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多。
③取代关系:1H~~Cl2④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。
4、高温分解:CH4XXX2够的Na反应生成2mol氢气,而1mol水只生成1mol氢气。
有机化学方程式总结

有机化学方程式总结有机化学是一门研究有机化合物的组成、结构、性质和变化的科学。
在有机化学的学习中,掌握各种有机化合物的化学反应方程式是非常重要的一部分。
下面是对一些常见有机化学反应方程式的总结:1、烷烃的取代反应CH4 + Cl2 → CH3Cl + HCl2、烯烃的加成反应CH2=CH2 + H2 → CH3CH33、炔烃的加成反应CH≡CH + 2H2 → CH3CH34、醇的氧化反应2CH3CH2OH + O2 → 2CH3CHO + 2H2O5、酮的氧化反应2RCOCH3 + O2 → 2RCOCHO + 2H2O6、羧酸的酯化反应CH3COOH + CH3CH2OH → CH3COOCH2CH3 + H2O7、酯的水解反应CH3COOCH2CH3 + H2O → CH3COOH + CH3CH2OH8、醛的还原反应R-CHO + H2 → R-CH2OH9、酮的还原反应R-CO-R' + H2 → R-CH2-R' + H2O10、酰胺的水解反应NH2CO-R + H2O → NH3 + R-COOH以上仅是一些常见的有机化学反应方程式,但它们是学习有机化学的基础。
通过理解和记忆这些反应方程式,可以更好地理解有机化学的原理和应用。
对于一些复杂的有机化学反应,需要更加深入的学习和理解。
真空泄污系统自控系统是一种高效、环保的自动化设备,专门设计用于处理和减少废物排放。
此系统利用真空技术,自动抽取和处理废气、废液等污染物,达到国家环保排放标准。
真空泵:用于产生负压,从污染源抽取污染物。
传感器:检测污染物的种类和浓度,以便控制系统能够做出相应的调整。
控制系统:根据污染物的种类和浓度,自动调整真空泵的工作状态和净化设备的运行。
净化设备:对抽取的污染物进行过滤、吸附、化学反应等处理,降低或消除污染。
排放系统:经过处理的污染物被安全地排放到大气中。
自动检测:系统自动检测污染物的种类和浓度,实时调整处理策略。
必修二有机化学方程式汇总(精编8K双面)

必修二有机化学反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2) (1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O 现象:产生淡蓝色火焰,放热。
甲烷不能使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HCl CH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷,又叫氯仿)+HCl CHCl 3+Cl 光照4(四氯化碳)+HCl现象:黄绿色逐渐变淡,最后变成无色,瓶壁上产生油状液体,集气瓶内液面上升。
(3)分解反应甲烷分解:CH 高温2 2. 乙烯(烯烃通式:C n H 2n ) (1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O 现象:火焰明亮,伴有黑烟。
乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br 与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O 催化剂CH 3CH 2OH (3)聚合反应加聚生成聚乙烯:n CH 2=CH 2催化剂[CH 2—CH 2 ] n适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯)3. 乙炔(炔烃通式:C n H 2n-2)(1)氧化反应乙炔的燃烧:HC ≡CH +5O 点燃2+2H 2O 现象:火焰明亮,伴有浓黑烟。
高一化学必修二化学方程式总结

高一化学必修二化学方程式总结1、碳酸氢镁溶液中加入过量的澄清石灰水:Mg(HCO3)2+2Ca(OH)2—2CaCO 3 +Mg(OH)2j +2H2O2、氢氧化钡溶液和碳酸氢镁溶液反应:Mg(HCO3)2+Ba(OH)2Mg(OH )2+BaCO 3 +2H2O3、向碳酸氢镁溶液中加人过量氢氧化钠:Mg(HCO3)2+4NaOHMg(OH)22Na2CO3+2H2O4、NH4HCO3液与过量的NaOH§液反应:NH4HCO3+2NaOHJ)——Na2CO3+NH3+2H2O5、向NH4HSO4溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全NH4HSO4+Ba(OH^2- BaSO4 +NH3?H2O+H2O6、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4HCO3+Ba(OH^”BaCO3 +NH3r +2H2O7、在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4HSO3+2NaOHNa2SO3+NH3?H2O+H2O8、硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:2NaHSO4+Ba(OH02^ Na2SO4+BaSO4+2H2O9、硝酸铝溶液中加入过量氨水:Al(NO3)3+3NH3?H2O===Al(OH) 3 +3NH4NO310、明矾溶液中加入过量的氨水:2KAl(SO4)2+6NH3?H202Al(OH) 3 +K2SO4+3(NH4)2SO411、等物质的量浓度、等体积的氢氧化钡溶液与明矾溶液混合:6Ba(OH)2+6KAl(SO4)26BaSO 4 +3K2SO4+4Al(OH)X +Al2(SO4)312、大理石与盐酸反应制CO次体:CaCO3+2HCl^2CaCl2+CO 2 +H2013、碳酸钙中滴入醋酸溶液:w.w.w.k.s.5.u.c.o.mCaCO3+2CH3COOH==(CH3COO)2c a++H2O14、乙酸溶液中加入少量碳酸氢铵溶液:CH3C00H NH4HCO3CH3COONH4+CO2O15、硫化钠溶液中加入盐酸:Na2S+2HCl2NaCl+H2s16、碳酸氢钙溶液和盐酸反应:Ca(HCO3)2+2HClCaCl2+2CO2+2H2O17、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:Na2CO3+HClNaCl+NaHCO318、碳酸钠溶液中逐滴加入等物质的量的乙酸:Na2CO3+CH3COOH==CH3COONa+NaHCO319、适量的稀硫酸滴入四羟基合铝酸钠溶液中:2Na[Al(OH)4]+H2SO42Al(OH)3 ; +Na2SO4+2H2O20、硫酸铜溶液中加入氢硫酸:CuSO4+H2S===CU6H2SO41、Na20般入水中:2Na2O2+2H2O=4Na++4OH2T2、Na投入水中:2Na+2H2O=2Na++20HH2T3、澄清石灰水中通入CO2:①少量:Ca2++2OI+CO2=CaCQ 3+H2O②过量:CO2+OH-=HCO3-4、稀NH4C1溶液中滴入NaOH§液:①混合:NH4++OHNH3?H2O)共热:NH4++OHNH3r +H2O5、NaA1O2溶液中通入CO2:①少量:2A1O2- +CO2+3H2O=2A1(OH)3 +CO32;②过量:A1O2- +CO2+2H2O=A1(OH)3+HCO36、H2s气体通入FeC13 溶液中:2Fe3++H2S=2Fe2++ S+2H+7、FeC13 溶液滴入沸水中:Fe3++3H2OFe(OH)验体)+3H+8、A1C13 溶液中加入(NaA1O2、Na2CO3 NaHCO3)①A13++3A1O2- +6H2O=4A1(OH汹;②2A13++3CO32+3H2O=2A1(OH汹+3CO力③A13++3HCO3=A1(OH)3 ; +3CO力9、乙醛跟银氨溶液反应:CH3CHO+2[Ag(NH3)2]++2OH-CH3c H4++2A g +3NH3+H2O10、FeBr2溶液中通入C12:①少量:2Fe2++C12=2Fe3++2C1-;②过量:2Fe2++4Br-+3C12=2Fe3++2Br2+6C1-11、稀硝酸与Fe反应:①少量:Fe+4H++NO3-Fe3++N0 +2H2O②过量:3Fe+8H++2NO3- =3Fe2++2NO +4H2O12、NaA1O2溶液与NaHCO溶液混合:A1O2-+HCO3- +H2O=A1(OH)3;+CO3213、NaOH§液中滴入A1C13溶液:①少量:4OH-+A13+=A1O2-+2H2O②后续:3A1O2- +A13++6H2O=4A1(OH)3;14、Ca(ClO)2 溶液中通入(CO2 SO2)①少量:Ca2++2ClO+CO2=CaCQ 3+2HC1O 过量:ClO- +CO2+H2O=HC1O+HCO3-② Ca2++C1O +SO2+H2O=CaS O4C1-+2H+15、NaHSO溶液中滴入Ba(OH)2溶液:①至中性:2H++SO42-+Ba2++2OH2H2O+BaSO4②至 SO42垸全沉淀:H++SO42-+Ba2++OH=H2O+BaSO416、NaOK Ca(HCO3)2容液反应:少量:Ca2++2HCO3-+2O=CaCO3 +CO32+2H2O过量:OH-+HCO3Ca2+=CaCO3+H2O17、CO2S入苯酚钠溶液C6H5O+CO2+H2OC6H5OH+HCO318、A1 投入NaOFH§>中2A1+2OH-+2H2O=2A1O33H2T19、饱和Na2CO籀液中通入CO22Na++CO32-+CO2+H2O=2NaHCO320、Mg(HCO3)2容液中滴加Ca(OH)2Mg2++2HCO3-+2Ca2++4OH4g(OH)2J +2CaCO 3 +2H2O1、硫酸工业:4FeS2+11O22Fe2O3+8SO22SO2+O22SO3SO3+H2O=H2SO4(氧化还原反应)设备沸腾炉、接触室、吸收塔2、合成氨工业:N2+3H22NH3K化还原反应)设备合成塔3、硝酸工业:4NH3+5O24NO+6H2O2NO+O2=2NO23NO2+H2O=2HNO3+NO(氧化还原反应)设备氧化炉吸收塔4、氯碱工业2NaCl+2H2O2NaOH+HR阴极)+C12 T (阴极)设备离子交换膜5、侯氏制碱法:NH3+H2O+CO2+NaC1=NH4C1+NaHCO32NaHCO3Na2CO3+H2O+C02氧化还原反应)6、酸性氧化物SO2+2H2s=3S+2H2O7、不成盐氧化物NO+2HNO3()=3NO2+H2O8、酸HC1+HC1O=C12T +H20H2S+3H2SO4)4SO2T +4H2OH2O2+H2SO3=H2SO4+H2O9、非氧化还原反应:①NaHSO4+Ba(OH^2② Mg(HCO3)2+Ca(OH)2(两种沉淀)③ A1C13+NaOH> ④ NaA1O2+HCWD碳酸盐+HC1 等10、氧化还原反应:①单质+H2SO体)一②单质+HNO3③SO2豉H2S)+HNO3④C12(或S)+NaOH>⑤ HC1(浓)+MnO2俄KC1O3 Ca(C1O)2 等)一11、有机反应① CH3CHO+Cu(OH^2)C2H5Br+NaOHCH2=CH2NaBr+H2O12、非氧化还原反应:①A1C13+NaOH>A1(OH)3A1(OH)3+NaOH^NaA1O2(X 为NaOH)或NaA1O2+H8A1(OH)3A1(OH)3+HC1-A1C13(X 为HC1) NaOH+CO2Na2CO3Na2CO3+C aHCO3(肪CO2)(B为其他碳酸盐亦可)或CO2+NaOHNaHCO3NaHCO3+NaOIH2CO3(X^ NaOH)③AgNO3+NH3?H2AgOHAgOH+NH3?H2Oj(NH3)2+(A 为锌铜等盐亦可)(相反过程同①)13、氧化还原反应① Na+O2> Na2ONa2O+e2Na2O2) S(或H2S)+O2> SO2SO2+O2SO3③N2(或NH3)+O"NONO+O2NO④C+O2>COCO+O2CO2(以上X 为O2)④P+C12f PCI3PCI3+CI2-PCl5(X 为Cl2)⑥C+H2O>COCO+H2OCO2(X为H2O)⑦CI2+Fe— FeCI3FeCI3+FnFeCI2(X 为Fe)⑧FeCI3+ZeFeCI2FeCI2+ZeFe(X 为Zn)⑨C2H5OH^ CH2=CH2)+O2CH3CHOCH3CHO+OH3COOH(为O2,B为其他醛亦可)⑩Fe2O3豉Fe3O4)+CO>FeOFeO+COFe(X 为CO俄CuO+H2Cu2OCu2O+IH2Cu14、Na2CO配水Na2CO3+H2ONaHCO3+NaOH15、硫氢化钠的水NaHS+H2OH2S+NaOH16、实验室制备氢氧化铁胶体:FeCI3+3H2OFe(OH)3胶体)+3HCI17、氯化铝溶液中加足量碳酸氢钠溶液:AICI3+3NaHCO3AI(OH)双+3NaCI+3CO 218、硫酸亚铁溶液中加入过氧化氢溶液:2FeSO4+H2O2+H2SO4 Fe2(SO4)3+2H2O19、NaNO密液中力口入酸性KMnO脂液:5NaNO2+2KMnO4+3H2S e42MnSO4+5NaNO3+K2SO4+3H2O20、甲烷和氯气发生取代反应CH4+C1" CH3C1+HC1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
必修二有机化学方程式有机化学是一门研究有机化合物结构和性质的学科。
有机化合物是指含碳元素的化合物,其中也包括含碳氢元素的化合物。
在有机化学的学习中,掌握各种有机化合物的官能团、结构、性质和反应机理是至关重要的。
其中,有机化学方程式是表达有机化合物反应的重要手段。
有机化学方程式可以用来表达有机化合物的合成、分解、氧化、还原等反应过程。
在书写有机化学方程式时,需要注意以下几点:1、遵守原子经济性原则:即反应物中的原子应该尽可能地转化为目标产物,避免浪费和污染。
2、正确表示电子转移和氧化态:在有机化合物中,碳原子的氧化态通常用“-”表示,而氢原子的氧化态则用“+”表示。
3、表明反应条件:反应条件对于反应的进行和产物的生成都至关重要,因此需要在方程式中注明。
4、书写正确的有机化合物结构:在方程式中,需要准确地表示反应物和产物的结构,这有助于理解反应机理和性质。
下面列举一些常见的有机化学方程式:1、烷烃的燃烧反应:CH4 + 2O2 → CO2 + 2H2O2、烷烃的卤化反应:CH4 + Cl2 → CH3Cl + HCl3、烯烃的加成反应:CH2=CH2 + H2 → CH3-CH34、炔烃的加成反应:HC≡CH + 2H2 → CH2=CH-CH35、醇的氧化反应:R-CH2OH + PCC → R-CO-R + HCP6、醛的还原反应:R-CHO + H2 → R-CH2-OH7、羧酸的酯化反应:R-COOH + R′-OH → R-COO-R′ + H2O 8、酰胺的水解反应:R-CONH-R′ + H2O → R-COOH + R′-NH2以上是有机化学方程式的一些例子,掌握这些方程式对于理解有机化合物的结构和性质非常重要。
通过学习有机化学方程式,我们可以更好地了解有机化合物的合成、转化和分解过程,为后续深入学习有机化学奠定基础。
高中化学必修二方程式总结高中化学必修二方程式是化学学习中的重要内容,它们是描述化学反应的语言。
在这篇文章中,我们将总结高中化学必修二中的一些重要方程式,并解释它们的意义和用途。
首先,我们需要了解什么是化学方程式。
化学方程式是用符号表示化学反应的式子,包括反应物和生成物,以及反应的条件和摩尔比例。
在化学方程式中,反应物写在等号的左边,生成物写在等号的右边。
化学反应按反应物和生成物的不同,可以分为化合反应、分解反应、置换反应和复分解反应等。
接下来,我们将逐一总结这些反应的方程式。
1、化合反应化合反应是指两种或多种物质反应生成一种物质的反应。
典型的化合反应包括酸碱中和反应、金属氧化物与酸的反应等。
例如,酸碱中和反应的方程式可以表示为:HCl + NaOH -> NaCl + H2O,其中HCl和NaOH分别表示盐酸和氢氧化钠,NaCl表示氯化钠,H2O表示水。
2、分解反应分解反应是一种物质分解成两种或多种物质的反应。
典型的分解反应包括水的电解、碳酸钙受热分解等。
例如,水的电解方程式可以表示为:2H2O -> 2H2 + O2,其中H2O表示水,H2表示氢气,O2表示氧气。
3、置换反应置换反应是一种单质与一种化合物反应生成另一种单质和化合物的反应。
典型的置换反应包括金属与酸的反应、金属与盐的反应等。
例如,金属与酸的反应方程式可以表示为:Mg +2HCl ->MgCl2+H2,其中Mg表示镁,HCl表示盐酸,MgCl2表示氯化镁,H2表示氢气。
4、复分解反应复分解反应是两种化合物互相交换成分生成另外两种化合物的反应。
典型的复分解反应包括酸碱中和反应、盐与酸的反应等。
例如,酸碱中和反应的方程式可以表示为:NaOH + HCl -> NaCl + H2O,其中NaOH和HCl分别表示氢氧化钠和盐酸,NaCl表示氯化钠,H2O 表示水。
总结起来,化学方程式是化学反应的符号表示,可以描述一种物质如何转化为另一种物质。
在高中化学必修二中,我们学习了多种类型的化学反应,包括化合反应、分解反应、置换反应和复分解反应等。
这些反应的方程式是化学反应的基础,也是我们理解和应用化学的重要工具。
有机化学方程式汇总有机化学方程式汇总:探索化学反应的奥秘有机化学是一门研究碳(C)氢(H)氧(O)氮(N)等有机元素组成化合物的科学。
有机化学方程式是描述这类化合物所发生化学反应的规范工具,对于理解有机化学反应的机制、预测新化合物的性质以及合成目标分子等方面具有重要意义。
本文将汇总一些常见的有机化学方程式,并探讨其应用和反应机理。
首先,我们简要了解一下有机化学反应的类型。
有机化学反应可分为多种类型,如取代反应、加成反应、消除反应、氧化反应和还原反应等。
这些反应在特定条件下发生,每一种反应都涉及到不同的原子或原子团在化学键上的转移。
一、取代反应取代反应是有机化学中一类重要的反应类型,涉及一个原子或原子团从分子中被另一个原子或原子团替换的过程。
以下是一些常见的取代反应方程式:1、烷烃的氯代反应:CH4 + Cl2 → CH3Cl + HCl2、苯环的卤代反应:C6H6 + Br2 → C6H5Br + HBr3、醇与氢碘酸的反应:ROH + HI → R-I + H2O二、加成反应加成反应是通过打破和形成化学键,将两个分子结合成一个分子的过程。
以下是一些常见的加成反应方程式:1、烯烃与氢气的加成反应:CH2=CH2 + H2 → CH3-CH32、炔烃与氢气的加成反应:HC≡CH + H2 → CH2=CHH三、消除反应消除反应是通过打破一个不稳定的化合物,同时形成一个新的双键或三键的过程。
以下是一些常见的消除反应方程式:1、消去反应:CH3CH2OH → CH2=CH2 + H2O2、贝克曼重排反应:四、氧化反应氧化反应是通过增加化合物中氧原子的数量,或者通过提高碳原子的氧化态来改变化合物。
以下是一些常见的氧化反应方程式:1、醇的氧化:C2H5OH + O2 → C2H5-COOH + H2O2、醛的氧化:R-CHO + O2 → R-CO-R五、还原反应还原反应是通过减少化合物中氧原子的数量,或者通过降低碳原子的氧化态来改变化合物。
以下是一些常见的还原反应方程式:1、醛的还原:R-CHO + H2 → R-CH2-R2、酮的还原:RCOR' + H2 → RH + R'HOH以上仅是一些常见的有机化学方程式的示例,实际上有机化学的反应类型和方程式非常丰富。
掌握这些方程式及其反应机理,对于理解有机化学的基本原理、合成新的有机化合物以及解决与有机化学相关的问题都具有重要的意义。
有机化学方程式总结有机化学方程式是描述有机化合物在化学反应中如何相互转化的重要工具。
它们不仅揭示了化学反应的机理,而且还展示了反应中的物质和能量变化。
本文旨在总结有机化学方程式的特点、书写规则以及重要反应类型,以便更好地理解和应用有机化学方程式。
有机化学方程式是描述有机化合物在化学反应中如何相互转化的重要工具。
它们不仅揭示了化学反应的机理,而且还展示了反应中的物质和能量变化。
有机化学方程式具有以下特点:1、使用标准符号和缩写:有机化学方程式使用标准的符号和缩写来代表化学物质和反应过程。
例如,箭头表示反应方向,短线表示键,方括号表示取代基或特定原子团,等等。
2、表明反应条件:有机化学方程式会明确表明反应的条件,例如温度、压力和催化剂等。
这些条件对于预测和控制化学反应的进程至关重要。
3、物质状态的变化:有机化学方程式可以展示反应物和生成物在反应过程中的状态变化,例如气体、液体和固体等。
书写有机化学方程式需要遵循一定的规则。
首先,需要准确地表示反应物和生成物的结构。
其次,要确保方程式中的电子转移和原子守恒。
最后,应该注明反应的条件和物质状态。
重要反应类型包括取代反应、加成反应和消除反应等。
取代反应是指一个原子或原子团被另一个原子或原子团取代的反应。
加成反应是通过加成双键或三键等方式引入新原子的反应。
消除反应则是通过消除不稳定的中间产物而生成双键或三键的反应。
总之,有机化学方程式是描述有机化合物在化学反应中如何相互转化的重要工具。
通过总结有机化学方程式的特点、书写规则以及重要反应类型,我们可以更好地理解和应用它们,进一步深化对有机化学反应的理解。
随着有机化学领域的不断发展,我们有理由相信,有机化学方程式的应用和理解将会不断进步。
化学必修二有机化学基础知识点化学必修二有机化学基础知识点一、有机化学概述有机化学是研究有机化合物的化学,涉及有机物的结构、性质、合成、反应及鉴定等领域。
有机化合物是指含碳元素的化合物,但不包括二氧化碳、一氧化碳、碳酸盐等无机化合物。
二、有机物的分类有机物根据它们的分子组成和结构特点,可以分成以下几类:1、烃类:包括烷烃、烯烃、炔烃、芳香烃等。
2、烃的衍生物:包括醇、酚、醚、醛、酮、羧酸、酯等。
3、生物碱:是一类具有生理活性的有机化合物,如嘌呤、嘧啶等。
4、有机高分子化合物:包括天然橡胶、合成树脂、合成纤维等。
三、有机物的结构特点有机物的结构特点是其分子中存在着化学键,这些化学键包括碳-碳键、碳-氢键、碳-氧键等。
有机分子的三维结构对其性质有很大影响,例如烷烃分子中的碳-碳单键使其具有较大的稳定性,而双键和三键则使其易发生化学反应。
四、有机物的性质有机物的性质主要取决于其分子结构和化学键的性质,以下是有机物的一些重要性质:1、物理性质:有机物的熔点、沸点、密度、溶解度等物理性质与它们的分子结构和分子间作用力有关。
2、化学性质:有机物的化学性质主要包括加成反应、取代反应、消除反应等。
这些反应的机理与有机分子的三维结构有很大关系。
五、有机物的合成和鉴定有机物的合成是通过一系列的化学反应,将简单的有机化合物转化为更复杂的有机化合物的过程。
有机物的鉴定则是通过各种物理和化学方法,对未知有机物进行结构解析和确认的过程。
六、有机化学的应用有机化学在日常生活、工业生产、医疗保健等领域中有着广泛的应用。
例如,有机合成方法可用于生产塑料、合成纤维、药物等;有机化合物的性质研究可以帮助我们更好地理解生物体内的化学过程;有机化合物的合成方法还可以用于研究化学反应机理,提高我们对化学本质的理解。
总之,有机化学是化学学科中的一个重要分支,它涉及到有机化合物的结构、性质、合成、反应及鉴定等领域。
学习和掌握有机化学的基础知识,对于我们理解自然现象、解决实际问题,以及进一步深入研究化学学科都具有重要的意义。
化学选修5有机化学方程式汇总化学选修5有机化学方程式汇总有机化学是化学学科的一个重要分支,涉及到有机化合物的结构、性质、合成、分解等各个方面。
掌握有机化学方程式是学习有机化学的基础,因此,本文将汇总化学选修5中的有机化学方程式,并简要介绍每个方程式的反应类型和特点。
