初中化学化学计算题练习题
化学计算题专题训练

题型一:化学式的计算一、春天是流感的多发季节,民间有很多治疗流感的土方法,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8。
1%,求:(1)大蒜素硫化丙烯属于____________(选填“有机物”或“无机物”)(2)1千克大蒜中含硫元素质量为多少克?(3)硫化丙烯的化学式为____________.二、我国民间有端午节挂艾草的习俗.艾草含有丰富的黄酮素(化学式为:C15H10O2),有很高的药用价值.请回答:(1)黄酮素的相对分子质量为_________.(2)黄酮素中碳、氢元素的质量比为_________(填最简比).(3)11.1g黄酮素中含碳元素的质量为_________g.三.某火力发电厂常用石灰石浆吸收废气中的二氧化硫,以防止空气污染。
(1)补全其反应原理的化学方程式:2CaCO3+O2+2SO2=2CaSO4+2X .其中X的化学式为______.(2)若该发电厂每天要处理含有3.2吨二氧化硫的废气,计算每天至少需含碳酸钙90%的石灰石多少吨才能满足处理废气所需?(写出计算过程,保留1位小数)四。
舟山虾蟹资源丰富,利用虾蟹等甲壳动物的废弃甲壳开发生产的可溶性甲壳素,是研制生物医药、化妆品等新产品的重要原料。
但甲壳素生产过程排放的废液中含有盐酸,对环境会造成严重污染.如图是某工厂所用盐酸容器上标签的部分内容,请仔细阅读后计算:(1)已知甲壳素的化学式为(C8H13NO5)n,它由______种元素组成.(2)甲壳素中碳、氢、氮、氧元素的质量比为_________.(3)取上述20%盐酸10ml,加水稀释至100ml,问稀释后的稀盐酸中含溶质多少克?题型二:质量分数的计算五、某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,在如图甲所示发生装置的锥形瓶内加入二氧化锰0.5g,在分液漏斗内加入该过氧化氢溶液25g.完全反应后,称得发生装置内剩余物质的总质量为24.7g.请回答:(1)若要测量产生的气体体积,则应选_________(选填“乙图”或“丙图”)所示装置收集气体,且要慢慢地上下移动量筒,使量筒内外液面高度相同,读取量筒的气体体积.(2)请列式计算该过氧化氢溶液中溶质的质量分数.六、我校科学兴趣小组考察了钱塘江附近一家企业的污水处理情况,在考察过程中收集到如下数据:①该企业排放的污水主要成分是盐酸,提取未经处理的污水水样,用pH试纸测得pH=3;②处理污水步骤之一是:污水进入中和池进行中和处理,所用的材料是较经济的石灰水;③提取经过处理后可排放的水样,测得pH在7.0左右.根据上述提供的资料,回答下列问题:(1)这种考察属于____________调查(填“直接"或“间接”);(2)要测出污水的酸碱度,可选用____________;(3)经计算得知pH=3的污水中,盐酸的质量分数为0.00365%,现假设中和池中有1。
【化学】 初中化学化学计算题试题(有答案和解析)及解析

(1)根据质量守恒定律可得,产生氢气的质量为:93.7g+20g-113.5g=0.2g;
(2)解:设参加反应的锌的质量为 x,生成氯化锌的质量为 y
Zn+H2SO4=ZnSO4+H2
65
161 2
x
y 0.2g
65 161 2 x y 0.2g
x=6.5g y=16.1g
反应后烧杯里溶液中溶质的质量分数:
(4)设产生硫化氢的质量为 z
z=17kg 故填:17。
6.将 20 g 黄铜(铜和锌的合金)与 93.7 g 稀硫酸放入烧杯中恰好完全反应,反应后烧杯中物
质的质量为 113.5g,求:
(1)产生氢气的质量___。
(2)反应后烧杯里溶液中溶质的质量分数___。
【答案】0.2g 16.1%
【解析】
【详解】
(3)据质量守恒定律可以知道,反应前后减少的质量即为生成的二氧化碳的质量,所以可
以求出图中纵坐标上 a 点数值为:100g+30﹣127.8g=2.2g;
(4)草木灰样品中碳酸钾的质量为 x
K2CO3+H2SO4═ K2SO4+CO2↑+H2O
【答案】40
17
【解析】 【详解】 (1)设需要氢氧化钠的质量为 x
x=40kg 故填:40; (2)设需要用 Ca(OH)2 的质量为 y
y=37kg 氢氧化钠需要的费用为: 6 元/kg×40kg=240 元; 氢氧化钙需要的费用为: 1 元/kg×37kg=37 元 可以节约的费用为:240 元-37 元=203 元; 答:可以节约的费用为 203 元; (3)最开始硫酸的量为 1000kg×4.9%=49kg,消耗氢氧化钙的质量为 37kg,氢氧化钠的质 量为 40kg,故填:
中考化学化工计算题题(含答案)
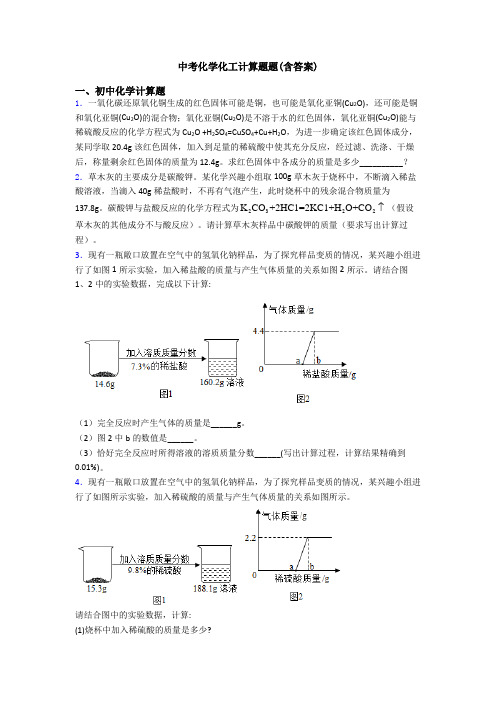
中考化学化工计算题题(含答案)一、初中化学计算题1.一氧化碳还原氧化铜生成的红色固体可能是铜,也可能是氧化亚铜(Cu2O),还可能是铜和氧化亚铜(Cu2O)的混合物;氧化亚铜(Cu2O)是不溶于水的红色固体,氧化亚铜(Cu2O)能与稀硫酸反应的化学方程式为Cu2O +H2SO4=CuSO4+Cu+H2O,为进一步确定该红色固体成分,某同学取20.4g该红色固体,加入到足量的稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体的质量为12.4g。
求红色固体中各成分的质量是多少__________?2.草木灰的主要成分是碳酸钾。
某化学兴趣小组取100g草木灰于烧杯中,不断滴入稀盐酸溶液,当滴入40g稀盐酸时,不再有气泡产生,此时烧杯中的残余混合物质量为K CO+2HC1=2KC1+H O+CO (假设137.8g。
碳酸钾与盐酸反应的化学方程式为2322草木灰的其他成分不与酸反应)。
请计算草木灰样品中碳酸钾的质量(要求写出计算过程)。
3.现有一瓶敞口放置在空气中的氢氧化钠样品,为了探究样品变质的情况,某兴趣小组进行了如图1所示实验,加入稀盐酸的质量与产生气体质量的关系如图2所示。
请结合图1、2中的实验数据,完成以下计算:(1)完全反应时产生气体的质量是______g。
(2)图2中b的数值是______。
(3)恰好完全反应时所得溶液的溶质质量分数______(写出计算过程,计算结果精确到0.01%)。
4.现有一瓶敞口放置在空气中的氢氧化钠样品,为了探究样品变质的情况,某兴趣小组进行了如图所示实验,加入稀硫酸的质量与产生气体质量的关系如图所示。
请结合图中的实验数据,计算:(1)烧杯中加入稀硫酸的质量是多少?(2)变质后的样品中氢氧化钠的质量分数。
(写出计算过程,结果保留1位小数)5.软磁铁氧体是用量很大的一种磁性材料,也是电子信息和家电工业等的重要基础功能性材料。
Mn3O4是生产软磁铁氧体材料的主要原料,实验室以SO2气体制备少量高纯Mn3O4的操作步骤如下:(资料)①亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
(完整版)初中化学计算题大全

初中化学计算专题(一)有关化学式计算题类型: 第一种类型:标签型化学式计算题:1、在现代生活中,人们越来越注重微量元素的摄取。
碘元素对人体健康有至关重要的作用。
下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:(1)由食用方法和贮藏指南可推测碘酸钾(KIO 3)的化学性质之一是 ; (2)计算碘酸钾(KIO 3)中,钾元素、碘元素、氧元素的质量比 ; (3)计算碘酸钾(KIO 3)中,碘元素的质量分数是多少? ;(计算结果精确到0.01,下同)(4)计算1kg 这样的食盐中,应加入 g 碘酸钾(用最高含碘量计算) 第二种类型:叙述型化学式计算题:1、蛋白质是由多种氨基酸[丙氨酸:CH 3CH(NH 2)COOH 等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比 。
(2)丙氨酸的相对分子质量 。
(3)丙氨酸中碳、氢、氧、氮元素的质量比 。
2、抗震救灾,众志成城。
用于汶川震后防疫的众多消毒剂中,有一种高效消毒剂的主要成分为三氯异氰尿酸(C 3O 3N 3Cl 3),又称高氯精。
下列有关高氯精的说法不正确的是( ) A .高氯精由4种元素组成 B .高氰精中C 、O 、N 、Cl 的原子个数比为1∶1∶1∶1 C .高氯精中C 、N 两种元索的质量比为12∶14 D .高氯精中氯元素的质量分数为25% 第三种类型:综合型化学式计算题:1、青少年正处于生长发育时期,每天需要摄取足量的蛋白质,蛋白质的代谢产物主要是尿素[CO(NH 2)2]。
若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g 。
(1)30g 尿素中含氮元素多少克?(2)已知蛋白质中氮元素的平均质量分数为16%,则每人每天至少应从食物里摄取的蛋白质为多少克?(3)请你根据下表中几种常见食物的蛋白质含量,计算出每天至少应摄人多少克下列食物才能满足你对蛋白质的需求(可以只摄取一种食物,也可同时摄取几种食物)。
初中化学计算题大全(含答案及解析)

2024年中考化学《必考经典》计算题大全(含答案及解析)1.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。
分析并计算:(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。
_____(4)计算恰好完全反应时所得溶液的溶质质量分数。
_____【答案】Na+、H+、SO42- 0.8 稀H2SO4的溶质质量分数是9.8%;恰好完全反应时所得溶液的溶质质量分数是5.5%。
【解析】【详解】(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;(3)10g稀硫酸样品含有H2SO4的质量为x,生成的硫酸钠的质量为y2NaOH+H SO=Na SO+2H O2424280981420.8g x y解得:x=0.98g y=1.42g稀H2SO4的溶质质量分数为:×100%=9.8%;(4)恰好完全反应时所得溶液的溶质质量分数:×100%≈5.5%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g。
【化学】初中化学化学计算题练习题

【化学】初中化学化学计算题练习题一、中考化学计算题1.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:第六第一次第二次第三次第四次第五次次加入稀硫酸的日101010101010(g)剩余固体的质量(g)9.358.78.057.4 6.75 6.75(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)(2)所用稀硫酸的质量分数为多少?【答案】(1)32.5%;(2)9.8%【解析】质量分数的一种常用的计算方法是分别计算出目的物质的质量和样品的总质量,然后求比值。
第(2)问中的化学反应方程式以及计算是关键。
(1)10g样品反应完全后,剩下6.75g为铜的质量,所以锌的质量为二亭-6-5_f=三二M 所以样品中锌的质量分数为(2)设在第二次加入稀硫酸后,参加反应硫酸的质量为x,据表中数据知,参加反应的锌的质量为根据反应方程式65980.65gx有,解得所用稀硫酸的质量分数为2.若要生产含杂质4%的生铁100t,需要含氧化铁60%的赤铁矿石的质量是多少(要求写出计算过程,计算结果保留小数点后1位)【答案】228.6t【解析】试题分析:含杂质物质的计算要把混合物的质量转化为纯物质的质量,即纯物质质量=含杂质物质质量X纯度,再把纯物质的质量带入化学方程式计算。
最后再把计算出的纯物质质量转换为含杂质物质的质量。
[解]设:需要向炼铁高炉中投入这种铁矿石的质量为X高总Fe2O3+3CO==2Fe+3CO216011260%x(1-4%)xlOOtx="228.6"t答:需要向炼铁高炉中投入这种铁矿石的质量为228.6t。
考点:含杂质的物质利用化学方程式的计算3.取24g氢氧化钠和碳酸钠的固体混合物,加136g水完全溶解后,再缓慢加入石灰乳(氢氧化钙和水的混合物)至恰好完全反应,过滤得到4g沉淀和10%的氢氧化钠溶液•试计算反应中应加入石灰乳的质量是?【答案】73.6g【解析】【详解】设:24g样品中碳酸钠的质量为x,生成的氢氧化钠的质量为yCa(OH)2+Na2CO3=CaCO3^+2NaOH10610080x4gyx=4.24gy=3.2g.得到的10%NaOH溶液的质量为(24g-4.24g+3.2g)+10%=229.6g加入石灰乳的质量为229.6g+4g-136g-24g=73.6g答:应加入石灰乳的质量是73.6go4.化学兴趣小组的同学取10g铜锌合金样品于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:(1)样品中锌的质量为g 。
初中化学计算题100题含答案

初中化学计算题100题含答案
1、一块铝热量发生变化时所放出的热量为?
答案:Q=m·C·ΔT
2、一次反应所需的能量是多少?
答案:ΔH=Hf-Hi
3、一克硝酸钠可与多少毫升水反应?
答案:1克硝酸钠可与25毫升水反应。
4、一克重氢氧化钠在室温时最多可溶解多少克水?
答案:一克重氢氧化钠在室温时最多可溶解5.6克水。
5、1 mol酸能把多少ml水搞碱?
答案:1 mol酸能把1000ml水搞碱。
6、醋酸的PH值是多少?
答案:醋酸的PH值为2.4
7、H2SO4形成的水溶液中,氢离子的浓度是多少?
答案:H2SO4形成的水溶液中,氢离子的浓度为1 mol/L。
8、浓硫酸中含有多少原子硫?
答案:浓硫酸中含有2个原子硫。
9、一克CuSO4能溶解多少克水?
答案:一克CuSO4能溶解37.2克水。
10、氢化钠可与100g水反应吗?
答案:可以,氢化钠可与100g水反应。
化学计算题试题含答案
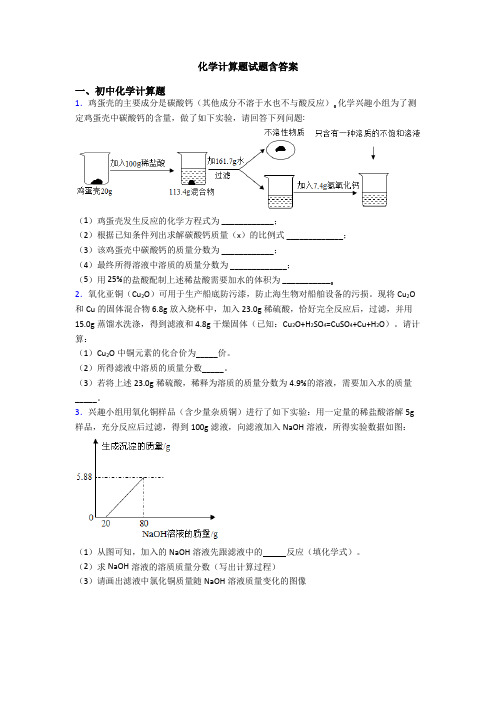
化学计算题试题含答案一、初中化学计算题1.鸡蛋壳的主要成分是碳酸钙(其他成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做了如下实验,请回答下列问题:(1)鸡蛋壳发生反应的化学方程式为 ____________;(2)根据已知条件列出求解碳酸钙质量(x)的比例式 _____________;(3)该鸡蛋壳中碳酸钙的质量分数为 ____________;(4)最终所得溶液中溶质的质量分数为 _____________;(5)用 25%的盐酸配制上述稀盐酸需要加水的体积为 ___________。2.氧化亚铜(Cu2O)可用于生产船底防污漆,防止海生物对船舶设备的污损。
现将Cu2O 和Cu的固体混合物6.8g放入烧杯中,加入23.0g稀硫酸,恰好完全反应后,过滤,并用15.0g蒸馏水洗涤,得到滤液和4.8g干燥固体(已知:Cu2O+H2SO4=CuSO4+Cu+H2O)。
请计算:(1)Cu2O中铜元素的化合价为_____价。
(2)所得滤液中溶质的质量分数_____。
(3)若将上述23.0g稀硫酸,稀释为溶质的质量分数为4.9%的溶液,需要加入水的质量_____。
3.兴趣小组用氧化铜样品(含少量杂质铜)进行了如下实验:用一定量的稀盐酸溶解5g 样品,充分反应后过滤,得到100g滤液,向滤液加入NaOH溶液,所得实验数据如图:(1)从图可知,加入的NaOH溶液先跟滤液中的反应(填化学式)。
(2)求NaOH溶液的溶质质量分数(写出计算过程)(3)请画出滤液中氯化铜质量随NaOH溶液质量变化的图像(4)另取5g该样品,用足量的CO还原成纯铜,理论上可得到纯铜 g。
4.某课外活动小组为测定一包碳酸钠样品的质量分数,取来了一些样品,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应),向其中加入足量的稀盐酸,根据实验测得的数据绘制出所加稀盐酸的质量和放出的CO2的质量关系图。
(1)10g样品可以产生多少克二氧化碳?(2)该样品中碳酸钠的质量分数是多少?(3)加入稀盐酸到恰好完全反应时,所得的溶液中溶质的质量分数是多少?(写出计算过程)5.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:第1次第2次第3次第4次第5次第6次加入稀硫酸的质量(g)101010101010剩余固体的质量(g)9.35m8.057.4 6.75 6.75的值为.(2)黄铜样品中锌的质量分数为.(写出计算步骤,下同)(3)所用稀硫酸的溶质质量分数为多少?6.“学化学,爱化学,用好化学”学习小组为测出鸡蛋壳(主要成分是碳酸钙)中碳酸钙的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10g置于烧杯中,将烧杯放在电子天平上,往烧杯中平均分5次加入50g的稀盐酸,测得实验数据如表:实验次数12345加入稀盐酸质量/g10.020.030.040.050.0剩余物质质量/g19.028.037.046.756.7(1)第_____ 次实验时鸡蛋壳已经完全反应。
初中化学计算题练习题含答案

初中化学计算题练习题含答案一、初中化学计算题1.某化学兴趣小组用化学方法测定铜、锌合金样品中铜的含量,称取了10g样品,投入装有50g稀硫酸(足量)的烧杯(烧杯质量也为10g)中。
在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:反应时间/s T0T1T2T3烧杯和药品质量/g7069.969.869.8(1)共生成氢气 g。
(2)计算铜.锌合金样品中铜的质量分数(写出计算过程)。
2.(1)工业上若要炼出含2%杂质的生铁1600t,则理论上需要氧化铁质量分数为80%的赤铁矿的质量为_________。
(2)取8g含杂质的锌粒于烧杯中,向其中加入稀硫酸至恰好完全反应,共用去稀硫酸100g,实验结束后,称得烧杯中物质的总质量为107.8g。
(杂质不溶于水也不与稀硫酸反应)请计算:①产生氢气的质量为_______g。
②所用锌粒中锌的质量分数。
(写出计算过程)3.在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中滴加入一定溶质量分数的碳酸钠溶液,生成沉淀。
(1)产生沉淀的质量为_____g。
(2)求所加碳酸钠溶液的溶质质量分数是多少?(写出计算过程)(3)若恰好完全反应时所得溶液的溶质质量分数为10%,求原固体混合物的质量?(写出计算过程)4.某化学小组的同学们对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们取了 7.2g 固体样品,用图 1 所示的装置继续实验,测定的部分数据如图 2 所示。
请计算:(1)写出硬质玻璃管内的实验现象_____;(2)该样品中含有氧化铁的质量为_____g;(3)若澄清石灰水足量,反应结束后,装置 B 增重质量为多少?_____(写出具体计算步骤)5.洁厕灵的有效成分为HC1,为测定某品牌洁厕灵中HC1的质量分数(洁厕灵中的其它成分不与碳酸钠反应)。
将100g洁厕灵倒入锥形瓶中,逐次加入等质量、相同溶质质量分数的Na2CO3溶液,测出每次完全反应后溶液的总质量,实验数据记录如下表。
化学计算题的专项培优练习题(含答案)及详细答案

一、中考初中化学计算题1.小新用20g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。
操作过程如下:请计算:(1)20g样品中碳酸钠的质量为__________g;(2)反应后所得滤液中氢氧化钠的质量分数为多少?__________(写出计算过程)(3)将200g滤液浓缩制成“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水__________g.【答案】10.6 4% 120【解析】【分析】【详解】(1)20g样品中碳酸钠的质量为20g×53%=10.6 g(2)解:设反应生成氢氧化钠的质量为x;Na CO+Ca(OH)=CaCO+2NaOH23231068010.6g x106/10.6g=80/x 解得x=8 g氢氧化钠的质量分数=8g/200g×100%=4%答:反应后所得滤液中氢氧化钠的质量分数为4% 。
(3)将200g滤液浓缩制成“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水的质量为X根据溶液稀释前后溶质的质量不变有:200g ×4%=(200g-X) ×10%X=120g2.某氯化钠样品中含有氯化镁。
为测定其中氯化钠的质量分数,称量5.00g样品于烧杯中,加适量水完全溶解,然后逐滴加入氢氧化钠溶液至恰好完全反应,生成0.58g沉淀。
请回答下列问题:(1)氢氧化钠溶液可使紫色石蕊溶液变成_____色。
(2)计算该样品中氯化钠的质量分数为____________。
【答案】蓝 81%【解析】(1)根据氢氧化钠溶液显碱性能使紫色石蕊溶液变蓝解答;(2)根据反应的化学方程式计算出氯化镁的质量,然后再计算氯化钠的质量及质量分数。
(1)氢氧化钠溶液可使紫色石蕊溶液变成蓝色;(2)设样品中氯化镁的质量为x。
MgCl2+2NaOH=Mg(OH)2↓+2NaCl95 58x 0.58gx=0.95g样品中氯化钠的质量为5.00g-0.95g=4.05g样品中氯化钠的质量分数为×100%=81%答:(2)该样品中氧化钠的质量分数为81%。
(化学)50套初中化学化学计算题含解析

增加的质量
【解析】
(1)反应中产生氢气 25.7g-25.5g=0.2g. 这种钢样品中铁的含量是∶
解∶设样品中铁的质量为 xg
Fe+2HCl=FeCl2 +H2 ↑.
56
2
X
0.2g
56 = 2 ,x=5.6g. x 0.2g
5.6 g
这种钢样品中铁的含量是∶
×100%=98.2% . (2)钢的类型分为:假设残留在烧杯中的
提示:若溶液中溶质含有 H2SO4 和 CuSO4,则反应的先后顺序如下: H2SO4+2NaOH=2 H2O+Na2SO4 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
【答案】(1)A;(2)16;(3)24.5%;(4)
【解析】
氧化铜能与硫酸反应生成易溶于水的硫酸铜和水,使固体质量减少,而铜不与硫酸反应,
(化学)50 套初中化学化学计算题含解析
一、中考化学计算题
1.某化学兴趣小组用化学方法测定一种钢样品中铁的含量。同学们称取了 5.7g 钢样品, 投入装有 10.0g 稀盐酸(足量)的烧杯(烧杯质量也为 10.0g)中。在化学反应过程中对烧杯 (包括溶液和残余固体)进行了四次称量,记录如下表:
(1)反应中产生氢气_________克,这种钢样品中铁的含量是多少?(精确到 0.1%) ______ (2)钢的类型分为:含碳质量(C%)0.03%~0.3%为低碳钢;0.3%~0.6%为中碳钢;
【答案】B 93.3% 19.6%
【解析】 【详解】 (1)分析图表可发现向第二次的剩余固体中加硫酸,固体继续减少,说明第二次剩余固体 中铁剩余,当然碳不反应,也剩余.故答案为:B (2)表中第 3、第 4 次剩余固体都是 4g,可知最终剩余固体 4g 为碳,所以生铁中铁的质
初中化学计算题(带答案)

初中化学计算题一、根据化学式的计算1、计算相对分子质量相对分子质量=化学式中各原子的相对原子质量的总和。
点拨:①计算物质的相对分子质量时,同种元素的相对原子质量与其原子个数是相乘的关系,不同种元素相对质量是相加的关系。
②计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
③化学式中原子团(或根)右下角的数字表示的是原子团(或根)的个数。
计算时先求一个原子团或根的总相对原子质量,再乘以原子团(或根)的个数,即得出几个原子团的总相对原子质量。
2、计算物质中各元素的质量比组成化合物的各元素的质量比=化合物中各元素的相对原子质量总和(即相对原子质量与原子个数乘积)之比。
点拨:①计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
②计算时的结果约成最简整数比。
3、计算物质中某元素的质量分数化合物中某元素的质量×100%4、已知某化合物的质量,求某元素的质量化合物里某元素的质量=化合物的质量×化合物中某元素的质量分数化合物的质量=化合物中已知元素的质量÷化合物中已知元素的质量分数5、求化学式点拨:求物质化学式的主要类型:①由元素的相对原子质量和化合物的相对分子质量,确定化学式。
②根据化合物中某元素质量分数确定化合物的化学式。
③已知化合物中元素的质量比和相对原子质量,确定化学式。
原子个数比=元素的质量比:相对原子质量比④根据质量守恒定律确定化学式。
6、计算不纯物中某元素(或某纯净物)的质量分数计算公式:①某纯净物的质量分数= ×100%②不纯物中某元素的质量分数=不纯物中纯净物的质量分数×该纯净物中某元素的质量分数。
③某纯净物的质量分数=实际上某元素的质量分数÷化学式中该元素的质量分数×100%二、根据化学方程式的计算根据化学方程式的计算就是从量的方面来研究物质变化的一种重要的方法,其计算步骤和方法,一般分为以下几步: ①设未知量,未知量不带单位,常用X 表示.②根据题意确定反应物与生成物,写出并配平反应的化学方程式. ③在有关物质化学式下面写出相对分子质量并代入已知量和所设未知量. ④列比例式求解,写出答案.在初中阶段,根据化学方程式的计算,主要有以下几种基本类型.(1)根据化学方程式计算反应物、生成物间的质量比反应物、生成物间的质量比,就是各反应物、生成物相对分子质量×计量数之比. (2)根据化学方程式计算反应物或生成物的质量反应物或生成物质量的计算,一般是根据化学方程式中各反应物、生成物间的质量比来求算的,对某些反应,可直接依据质量守恒定律进行计算.(3)根据化学方程式进行含有一定且杂质的反应物或生成物的计算根据化学方程式的计算,其反应物或生成物的质量必须是纯物质的质量.含有一定量杂质的反应物或生成物的质量,必须换算成纯物质的质量,才能按根据化学方程式的计算步骤和方法进行计算.纯物质质量=含有一定量杂质的物质质量×该物质质量分数三、有要溶液组成的计算1.用溶质所占溶液的质量分数表示溶液的组成,其关系如下:溶质的质量分数= 溶质质量溶质+溶剂 × 100%=溶液质量溶质质量 × 100%在饱和溶液中: 溶质的质量分数=+溶解度溶解度g 100 × 100%2、有关溶液加水稀释的计算在溶液加水稀释过程中,溶质的质量分数将随溶液的稀释而改变,溶质质量分数一定的溶液加水稀释,稀释前后溶质的总质量不会发生改变.溶液加水稀释的计算,根据的就是这个道理.M 浓溶液×浓溶液的溶质质量分数=M 稀溶液×稀溶液的溶质质量分数 =(M 浓溶液+M 水)×稀溶液的溶质质量分数 3、溶质的质量分数在化学方程式的应用反应后溶液的质量=反应物的总质量(包含溶液的质量)-生成气体或沉淀的质量四、综合计算题分类解析从近几年全国各地的中考化学试题来看,化学计算已经走出了“为计算而计算”的考查误区,考题所涉及的内容更加注重与日常生活、工农业生产的联系;更加注重对同学们图表、数据、信息、实验综合分析能力的考查。
中考化学复习《计算题》专项综合练习及详细答案

一、中考初中化学计算题1.某碳酸钠样品中含有少量氯化钠。
现称量11 g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体。
计算:(1)碳酸钠样品中碳酸钠的质量______________(2)反应后所得溶液中溶质的质量分数。
(结果精确到0.1%)_____________【答案】10.6g 21.4%【解析】【分析】【详解】设样品中氯化钠的质量为x,则生成的氯化钠质量为12.1g-x,样品中碳酸钠的质量为11g-x,生成的二氧化碳质量为y,反应中消耗的盐酸质量为z。
2322 Na CO+2HCl=2NaCl+H O+CO106731174411g-x z14.6%12.1g-x y ↑⨯1067311744=== 11g-x z14.6%12.1g-x y⨯解得x=0.4g;y=4.4g;z=50g则样品中碳酸钠的质量为10.6g反应后所得溶液中溶质质量分数为:12.1g100%11g+50g-4.4g⨯≈ 21.4%答:碳酸钠样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质的质量分数为21.4%。
2.在一烧杯中盛有24.3g Na2SO4和NaCl组成的固体混合物,加入100g水使Na2SO4和NaCl全部溶解。
向其中逐渐滴加溶质质分数为20%的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图所示。
(1)请分析当BaCl2溶液滴加到B点时,溶液中的溶质是。
(2)请计算当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数(计算结果保留一位小数)。
【答案】(1)BaCl2NaCl (2)10.6%【解析】试题分析:(1)当沉淀的质量不再增加时,说明反应已经进行完毕,所以当BaCl2溶液滴加到B点时说明氯化钡溶液滴加过量,当BaCl2溶液滴加到B点时,溶液中的溶质有刚生成的氯化钠和原来的氯化钠以及过量的氯化钡。
最新初三化学化学计算题题20套(带答案)

最新初三化学化学计算题题20套(带答案)一、中考化学计算题1.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算物质的质量分数2.将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量Fe x C)与足量稀硫酸反应,得到0.48gH2(Fe x C与稀硫酸反应不产生H2)。
若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO2.试通过计算确定:(1)此粗还原铁粉中单质铁的质量_____(2)此粗还原铁粉中杂质Fe x C的化学式。
_____【答案】13.44g Fe 2C 【解析】 【分析】 【详解】若将14.06g 还原铁粉(含少量Fe x C )在氧气流中加热,得到0.22gCO 2,碳元素的质量=0.22g ×1244=0.06g (1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH 2,设消耗铁的质量为x 。
2442Fe +H SO =FeSO +562x0H .48g562=x 0.48gx=13.44gFe x C 的质量=14.06g ﹣13.44g=0.62g ; Fe x C 的中铁元素的质量=0.62g ﹣0.06g=0.56g则:56x 0.56g=120.06gx=2所以化学式为Fe 2C3.食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含有NaCl 0.9%,一般成年人每日需NaCl 的量为4.5g ~9g .(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,医生通过诊断需为他注射200g 生理盐水,则该病人每天可补充食盐约___g .(2)若用50g 溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9%的生理盐水,需加水___g .(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65g 溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到1.435g 沉淀.请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格____. 【答案】⑴1.8 ⑵950⑶设该生理盐水的溶质质量分数为0.9%,故此生理盐水的氯化钠含量合格。
中考化学化工计算题题(含答案)
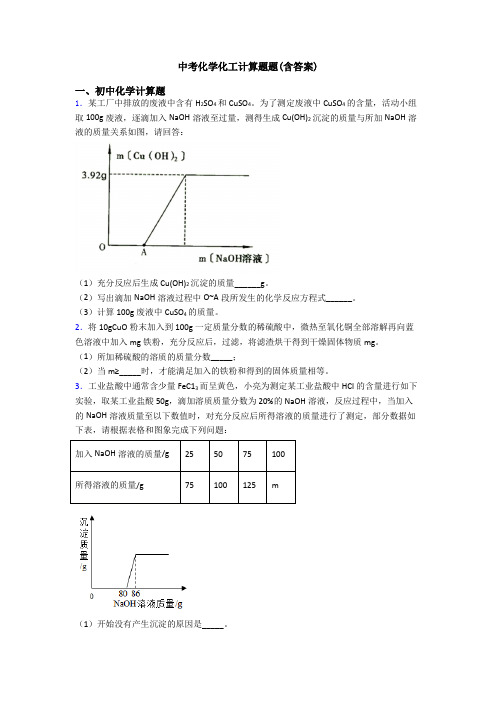
中考化学化工计算题题(含答案)一、初中化学计算题1.某工厂中排放的废液中含有H2SO4和CuSO4。
为了测定废液中CuSO4的含量,活动小组取100g废液,逐滴加入NaOH溶液至过量,测得生成Cu(OH)2沉淀的质量与所加NaOH溶液的质量关系如图,请回答:(1)充分反应后生成Cu(OH)2沉淀的质量______g。
(2)写出滴加NaOH溶液过程中O~A段所发生的化学反应方程式______。
(3)计算100g废液中CuSO4的质量。
2.将10gCuO粉末加入到100g一定质量分数的稀硫酸中,微热至氧化铜全部溶解再向蓝色溶液中加入mg铁粉,充分反应后,过滤,将滤渣烘干得到干燥固体物质mg。
(1)所加稀硫酸的溶质的质量分数_____;(2)当m≥_____时,才能满足加入的铁粉和得到的固体质量相等。
3.工业盐酸中通常含少量FeC13而呈黄色,小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50g,滴加溶质质量分数为20%的NaOH溶液,反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表,请根据表格和图象完成下列问题:加入NaOH溶液的质量/g255075100所得溶液的质量/g7*******m(1)开始没有产生沉淀的原因是_____。
(2)m=______(结果保留两位小数)。
(3)该工业盐酸中HCl的质量分数为_____。
4.小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定。
取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图象。
(1)滴加的溶液中溶质属于____(选填“盐”或“碱”);(2)图象中的a点数值是_____;(3)废液中含有的溶质是_____(写化学式);(4)通过计算说明,图象横坐标中的b点表示的溶液的质量是多少克?5.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:第1次第2次第3次第4次第5次第6次加入稀硫酸的质量(g)101010101010剩余固体的质量(g)9.35m8.057.4 6.75 6.75的值为.(2)黄铜样品中锌的质量分数为.(写出计算步骤,下同)(3)所用稀硫酸的溶质质量分数为多少?6.某兴趣小组同学为了测定大理石中碳酸钙的质量分数,取一定量的大理石样品放入烧杯中,将50g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下,请根据信息回答下列问题:次数12345加入稀盐酸质量/g1010101010剩余固体质量/g9.07.0m 3.0 1.1。
初中化学计算专练50题1

(1)计算Vc中碳、氢元素的质量比_______。
(2)通过计算确定Vc的化学式____________。
(3)新鲜的水果和蔬菜富含Vc,若100g西红柿含Vc30mg,则每天食用多少质量的西红柿也可达到服用上述Vc片的效果(请写出解题过程)。
28.戊二醛(C5H8O2)是防控新冠肺炎疫情的消毒剂请计算:
6.褪黑激素(C13H16O2N2)具有促进睡眠、调节时差、抗衰老、调节免疫,抗肿瘤等多项生理功能。根据上述信息回答下列问题:
(1)褪黑激素中碳元素和氧元素的质量之比是______________;
(2)每个分子中共有___________个原子。
7.已知用作相对原子质量基准的碳原子的质量为1.993×10-26kg,1个铝原子的质量为4.482×10-26kg,请列式求铝原子的相对原子质量。(保留整数)
(1)由题意可知,反应生成氢气的质量共_______g
(2)若欲计算反应后所得溶液的质量,你认为至少还应该补充的一个条件是_______
(3)弹壳中铜的质量______(计算结果精确至0.1,请书写出计算过程)
27.如图是已破损的维生素C(简写为Vc)片剂说明书的部分信息。已知维生素C由碳、氢、氧三种元素组成。
18.黄铜(铜锌合金),为了测定黄铜中锌的含量。取20g黄铜样品加入足量稀硫酸充分反应,生成氢气的质量为0.2g。
(1)该反应属于_______(填基本反应类型)。
(2)求黄铜样品中锌的质量分数。
19.鸡蛋壳的主要成分是CaCO3,现在取15g干燥的鸡蛋壳放入20g的烧杯中,向其中加入40g稀盐酸恰好完全反应(杂质不溶于水,且不与稀盐酸反应),反应后烧杯和物质的总质量为70.6g,计算鸡量中的CaCO3的质量分数是多少?(结果保留到0.1%)
50套初中化学化学计算题及解析

50套初中化学化学计算题及解析题目 1:将 25 克含杂质 20%的石灰石与 100 克稀盐酸恰好完全反应,求生成二氧化碳的质量。
解析:首先算出纯石灰石的质量为 25×(1 20%)= 20 克。
石灰石的主要成分是碳酸钙(CaCO₃),其相对分子质量为 100。
化学方程式为:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑ 。
根据化学方程式可知,100 克的碳酸钙生成 44 克的二氧化碳。
20 克的碳酸钙生成二氧化碳的质量为 20÷100×44 = 88 克。
题目 2:加热 316 克高锰酸钾,一段时间后,停止加热,冷却后称量剩余固体质量为 284 克,求生成氧气的质量。
解析:根据质量守恒定律,反应前后物质的总质量不变。
反应前高锰酸钾的质量为 316 克,反应后剩余固体质量为 284 克,所以生成氧气的质量为 316 284 = 32 克。
题目 3:_____用氢气还原 8 克氧化铜,反应结束后,称得剩余固体质量为 72 克,求参加反应的氢气的质量。
解析:氧化铜(CuO)被氢气(H₂)还原为铜(Cu)。
化学反应方程式为:H₂+ CuO = Cu + H₂O 。
固体质量减少的部分就是氧化铜中氧元素的质量,即 8 72 = 08 克。
氧化铜中氧元素的质量分数为16÷80×100% = 20% ,所以参加反应的氧化铜的质量为 08÷20% = 4 克。
根据化学方程式计算,参加反应的氢气的质量为 02 克。
题目 4:在实验室用一氧化碳还原 56 克氧化铁,反应结束后,剩余固体质量为 48 克,求生成二氧化碳的质量。
解析:氧化铁(Fe₂O₃)被一氧化碳(CO)还原为铁(Fe)。
化学方程式为:3CO + Fe₂O₃= 2Fe + 3CO₂。
固体质量减少的部分就是氧化铁中氧元素的质量,即 56 48 = 08 克。
氧化铁中氧元素的质量分数为 48÷160×100% = 30% ,所以参加反应的氧化铁的质量为08÷30% ≈ 267 克。
化学计算题试卷带答案

化学计算题试卷带答案一、初中化学计算题1.为测定某胃药中碳酸氢钠的含量,向一锥形瓶中加入10g该胃药,再加入100g一定质量分数的稀盐酸,恰好完全反应,气体全部逸出,反应后锥形瓶内物质的总质量为105.6g。
(胃药中的其他成分不参与反应,不考虑稀盐酸挥发)。
回答下列问题:(1)反应结束共产生气体的质量是______g。
(2)若实验室用质量分数为34%的浓盐酸配制该实验所需桥盐酸,主要步骤有:计算、量取、______、装瓶并贴上标签。
在配制过程中,用量筒量取水时俯视读数,但其它操作无误,用配制得到的盐酸按上述方法测定胃药中碳酸钠的含量,其结果会______。
(填“偏大”、“不变”或“偏小”)(3)该胃药中碳酸氢钠的质量分数(写出计算过程)。
2.在电缆生产过程中,不可避免地会产生一定量的含铜废料(废料中电缆皮和其它杂质不参与化学反应也不溶于水)。
某化学兴趣小组的同学得知这一情况后,想回收利用含铜废料,根据工业制备硫酸铜的流程做了如下实验:查阅资料:Cu+H2SO4+H2O250-60℃CuSO4+2H2O(1)将废料粉碎的目的是______;过滤操作中玻璃棒的作用:________。
(2)滤液中硫酸铜的质量分数?_______(写出必要的计算过程)3.某纯碱样品中含有少量氯化钠杂质。
称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。
反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。
试计算所得溶液中溶质的质量分数。
(写出解题过程,计算结果精确到0.1%)4.小明在协助老师清理实验室时,发现有一瓶碳酸钠和氯化钠组成的混合液。
他想测定该溶液中碳酸钠和氯化钠的质量分数,为此设计并进行了如下实验。
(实验1)取该混合液50 g ,向其中逐滴加入稀盐酸,当加入稀盐酸的质量为20 g、40 g、60 g 时,生成气体的质量见下表(气体的溶解度忽略不计)。
(化学) 初中化学化学计算题试题(有答案和解析)及解析

(化学)初中化学化学计算题试题(有答案和解析)及解析一、中考化学计算题1.某粗盐样品仅含NaCl和MgCl2,为探究粗盐中NaCl的质量分数,某研究性小组取了10g样品,加适量水使其完全溶解后,加入20g 5%的氢氧化钠溶液,测得相关数据如图。
(1)请列式计算该粗盐样品中NaCl的质量分数为____________。
(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量是____________?【答案】90.5% 10.22g【解析】(1)根据氯化镁与氢氧化钠反应的化学方程式,由氢氧化镁的质量求出氯化镁的质量即可求出氯化钠的质量,再计算出粗盐样品中NaCl的质量分数;(2)根据图像分析解答。
(1)设样品中氯化镁的质量为x,反应生成氯化钠的质量为y。
MgCl2+ 2NaOH=Mg(OH) 2↓+2NaCl95 58 117x 0.58g y95581170.58x g y==x=0.95gy=1.17g样品中氯化钠的质量为10g-0.95g=9.05g该粗盐样品中NaCl的质量分数为9.0510gg×100%=90.5%(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量为10g-0.95g+1.17g=10.22g 答:(1)该粗盐样品中NaCl的质量分数90.5%;(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量10.22g。
2.食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含有NaCl 0.9%,一般成年人每日需NaCl的量为4.5g~9g.(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,医生通过诊断需为他注射200g生理盐水,则该病人每天可补充食盐约___g.(2)若用50g溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9%的生理盐水,需加水___g.(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65g溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到1.435g沉淀.请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格____.【答案】⑴1.8 ⑵950⑶设该生理盐水的溶质质量分数为0.9%,故此生理盐水的氯化钠含量合格。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学化学计算题练习题一、中考化学计算题1.我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0g,将其放入干净的烧杯中,向烧杯中逐滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数_____(计算结果精确至0.1%)【答案】纯碱或苏打 NH4+ Na2CO3与盐酸或HCl恰好完全反应 NaCl、HCl 96.4%。
【解析】(1)Na2CO3的俗名是纯碱或苏打,氯化铵中的阳离子是铵根离子,符号为NH4+。
(2)①由图像可知,当滴入上述稀盐酸至图中A点时,加入的稀盐酸恰好与碳酸钠反应。
由图像可知,当滴入上述稀盐酸至图中B点时,加入的稀盐酸的量是过量的,烧杯中溶液里的溶质为NaCl、HCl。
(5).设样品中,含Na2CO3的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑106 73x 100 g×7.3%x=10.6 g样品中Na2CO3的质量分数是:≈96.4%答:样品中Na2CO3的质量分数是96.4%2.为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。
反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。
试计算:(1)样品中铜的质量分数;(2)反应所消耗的硫酸溶液质量;(3)反应后所得溶液质量。
【答案】(1)67.5%;(2)50g;(3)53.15g【解析】根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量0.10g,可以计算出:(1)参加反应的锌的质量,进而计算出样品中铜的质量分数;(2)参加反应的硫酸的质量,进而计算出硫酸溶液的质量;(3)生成硫酸锌的质量,进而计算出所得硫酸锌溶液的溶质质量分数。
解:设样品中铜的质量分数为x,消耗硫酸溶液的质量为y 。
Zn + H2SO4 = ZnSO4 + H2↑65 98 210g(1-x) y×9.8% 0.10g(1)652=101-x0.10gg()⨯,x=67.5%(2)982=9.800.10yg⨯,y=50g(3)所得溶液的质量为:50g+10g×(1-67.5%)-0.10g=53.15g答:(1)样品中铜的质量分数为67.5%;(2)消耗硫酸溶液的质量为50g;(3)所得溶液的溶质质量分数为53.15g。
3.为了测定某硫酸铜溶液的质量分数,小杨同学取50.0g样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如下图所示。
请计算:(1)NaOH的化学式量为_________。
(2)硫酸铜刚好完全反应时,所得溶液的质量为_____g(保留一位小数)。
(3)硫酸铜溶液中溶质的质量分数是________?(写出计算过程)【答案】40 65.1 16.0%【解析】【分析】(1)根据化学式量为化学式中的各原子的相对原子质量之和,(2)根据质量守恒定律分析所得溶液的质量;(3)根据氢氧化铜的质量结合化学方程式计算硫酸铜的质量,进一步计算硫酸铜溶液中溶质的质量分数。
【详解】(1)NaOH 的化学式量为23+16+1=40;(2)所得溶液的质量为50.0g +20.0g−4.9g =65.1g ;(3)设样品中硫酸铜的质量为xCuSO 4+2NaOH =Cu (OH )2↓+Na 2SO 4160 98x 4.9g 160984.9x g= x =8 g硫酸铜溶液中溶质的质量分数为8100%16.0%50g g⨯= 答:硫酸铜溶液中溶质的质量分数为16.0%。
4.生铁是铁的合金,化学兴趣小组的同学为测定某生铁样品中铁的质量分数.进行如下实验:称取生铁样品5.8g 放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水).回答下列问题:(1)当滴加稀硫酸质量为______时,反应恰好完全,此时产生气体质量是______. (2)计算恰好反应时所得溶液中溶质的质量._____。
(温馨提示:Fe+H 2SO 4=FeSO 4+H 2↑)【答案】50g 0.2g 15.2g【解析】【分析】生铁是铁的合金,铁和稀硫酸反应生成硫酸亚铁和氢气,加入的稀硫酸溶液的质量为50g 时,生成氢气的质量为0.2g ,恰好完全反应,根据化学方程式计算溶液中溶质的质量。
【详解】(1)生铁样品中的杂质不与稀硫酸反应,也不溶于水,由图可知,铁完全反应用去的硫酸的质量是50g,产生气体质量是0.2g。
(2)设反应生成的硫酸亚铁的质量为xx=15.2g答:恰好反应时所得溶液中溶质的质量为15.2g。
【点睛】计算溶液中溶质的质量时,要计算生成溶液的那部分,其它的杂质不考虑。
5.向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示(1)计算氢氧化钠溶液的溶质质量分数;(要求写出计算过程)(2)与氢氧化钠溶液反应所消耗硫酸溶质的质量为克。
【答案】(1)30%(2)29.4g【解析】试题分析:(1)利用化学方程式根据生成的沉淀氢氧化镁的质量即可计算出氢氧化钠的质量。
由于加入的氢氧化钠溶液先与未反应完的稀硫酸与,再与硫酸镁反应,通过图像可知与硫酸镁反应的氢氧化钠溶液的质量=120g-80g=40g;解:设与硫酸镁反应消耗NaOH的质量为x2NaOH+MgSO4=Mg(OH)2↓+ Na2SO480 58X 8.7gX=12gNaOH%=12g/40g ×100% = 30%(2)利用化学方程式,根据氢氧化钠的质量即可计算出与氢氧化钠反应的硫酸的质量;与硫酸反应的氢氧化钠溶液中溶质的质量=80g×30%=24g设硫酸的质量为y,H2SO4+2NaOH==Na2SO4+2H2O98 80Y 24g98/80 =y /24gY=29.4g答:略考点:有关化学方程式的计算6.老师带领化学小组为了测定并回收硫酸铜溶液中的金属铜,请回答下列问题:(1)反应A 的化学方程式为_____;(2)根据已知条件列出求解实验中反应生成气体的质量(x)的比例式为_____;(3)若将滤液a 和b 倒入同一烧杯并得到溶质质量分数为8%的溶液,应加水的质量是_____;(4)用98%的浓硫酸配制上述稀硫酸,需加水的体积为_____;(5)过滤操作需要的用品除了带铁圈的铁架台和漏斗以外还需要_____。
【答案】Fe+CuSO 4=FeSO 4+Cu 56/2=5.6g/x 57g 88mL 烧杯、玻璃棒、滤纸【解析】【详解】(1)反应A 是铁和硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO 4=FeSO 4+Cu ;(2)有题意可知:与稀盐酸反应的铁的质量=8.8g-3.2g=5.6g ;设与5.6g 铁反应的硫酸的质量为y ,生成氢气的质量为x ,生成硫酸亚铁的质量为z ,则:2442=569815225.6g y Fe +H SO FeSO +H z xx 2=5.6g 56; y 98=5.6g 56y=9.8g , z 152=5.6g 56z=15.2g , (3)设生成3.2g 铜需要铁的质量为m ,生成硫酸亚铁的质量为n ,则:44Fe +CuSO FeSO +C =5615264m un 3.2gm 56=3.2g 64m=2.8g , n 152=3.2g 64n=7.6g , 滤液a 的质量=125g-(3.2g-2.8g)=124.6g ;滤液b 的质量=98g+5.6g-0.2g=103.4g ;若将滤液a 和b 倒入同一烧杯并得到溶质质量分数为8%的溶液,加水的质量=(15.2g+7.6g)÷8%-(124.6g+103.4g)=57g ;(4)参加反应10%稀硫酸的质量=9.8g ÷10%=98g ,用98%的浓硫酸配制98g10%稀硫酸,需加水的质量=98g-9.8g ÷98%=88g ,即88mL ;(5)过滤操作需要用到的基本仪器有:铁架台、烧杯、玻璃棒和漏斗;在漏斗内放滤纸制作过滤器。
【点睛】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
7.为测定21.2g 某变质氢氧化钠固体中碳酸钠的含量,将其配置成500mL 溶液,分别取出50mL 用两种方法进行测定。
已知:Na 2CO 3+BaCl 2=BaCO 3↓+2NaCl请任选1种方法的数据,计算该固体中碳酸钠的质量分数(写出计算过程及结果)。
【答案】50%【解析】试题分析:解:①方法一 设50ml 溶液中含有碳酸钠x 克,由Na 2CO 3+BaCl 2=BaCO 3↓+2NaCl106 197xg 1.97g得到,,解得x=1.06(g),则固体中碳酸钠的质量分数为 1.06g/2.12g×100%=50%。
答:该固体中碳酸钠的质量分数50%②方法二设50ml溶液中含有碳酸钠x克,由Na2CO3+H2SO4=Na2SO4+CO2↑106 44xg 0.44g得到,,解得x=1.06(g),则固体中碳酸钠的质量分数为1.06g/2.12g×100%=50%。
答:该固体中碳酸钠的质量分数50%考点:根据化学方程式的计算8.现有硫酸钠和氢氧化钠的固体混合物(假设它们是混合均匀的),取部分样品进行分析实验:(1)取2.62g固体混合物加水完全溶解后,加入氯化钡溶液至不再产生沉淀为止,过滤干燥后,称得沉淀的质量为2.33g.求2.62g固体混合物中硫酸钠的质量是多少?(2)另取等质量的固体混合物溶于56.38g水后,再加入12g一定质量分数的稀硫酸,恰好完全反应,试计算反应后所得溶液中溶质的质量分数.【答案】(1)1.42g;(2)5%【解析】解(1)设固体混合物中硫酸钠的质量是x,Na2SO4 + BaCl2= BaSO4↓+ 2NaCl142 233x 2.33g142/x=233/2.33g x=1.42g;(2)2.62g固体混合物中氢氧化钠的质量为2.62g-1.42g=1.2g设氢氧化钠与硫酸反应生成硫酸钠的质量为y2NaOH + H2SO4 == Na2SO4 +2H2O80 1421.2g y80/1.2g=142/y y=2.13g反应后所得溶液中溶质的质量分数=(2.13g+1.42g)÷(2.62g+56.38g+12g)×100%=5%答:略点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要仔细检查。
