高考化学易错题精选-铁及其化合物练习题附答案解析
高考化学易错题精选-铁及其化合物练习题附答案解析

高考化学易错题精选-铁及其化合物练习题附答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析

全国高考化学铁及其化合物的综合高考真题分类汇总含答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.图中,固体A是铁锈的主要成分。
请回答:(1)固体C的化学式是___,上述框图中体现了SO2的___(填“氧化性”、“还原性”或“漂白性”)。
(2)写出A→B的化学方程式___。
(3)写出D→E的离子方程式___。
(4)若通入的SO2是足量的,请你设计实验方案检验“溶液D”中的金属阳离子___。
【答案】FeCl3还原性 Fe2O3+3CO高温2Fe+3CO2 Ba2++SO42-=BaSO4↓取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+【解析】【分析】固体A是铁锈的主要成分,则A为Fe2O3,结合图中转化可知,A与CO反应生成B为Fe,B与氯气反应生成C为FeCl3,C与二氧化硫发生氧化还原反应,溶液D中Fe2+、SO42-等,溶液D与氯化钡反应生成白色沉淀E为BaSO4。
【详解】(1)由上述分析可知,固体C的化学式是:FeCl3,上述框图中SO2失去电子转化为硫酸根离子,作还原剂;(2)A→B的化学方程式为:Fe2O3+3CO高温2Fe+3CO2;(3)D→E的离子方程式为:Ba2++SO42−=BaSO4↓;(4)若通入的SO2是足量的,溶液D中金属阳离子为Fe2+,检验该阳离子的方法为:取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+。
2.在一定条件下,A、B、C、D、E物质相互转化关系如图所示(反应条件和部分产物略),其中A、B、C为单质。
(1)若A为金属,B、C常温下均为气体,D为黑色晶体,E为一种生活中必不可少的物质,则这五种物质的化学式为:A 为__,B 为__,C 为__,D 为__,E 为__。
(2)A 和E 在一定条件下反应生成D 的化学方程式为__。
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案
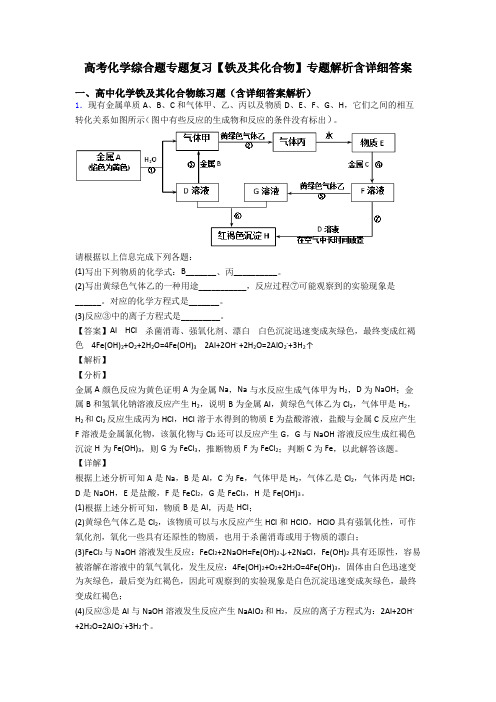
高考化学综合题专题复习【铁及其化合物】专题解析含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
精选高考化学易错题专题复习铁及其化合物推断题附详细答案

精选高考化学易错题专题复习铁及其化合物推断题附详细答案一、铁及其化合物1.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子并得到副产物ZnO。
制备流程如图所示:(已知ZnO能溶于强碱)已知:Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:(1)用NaOH溶液处理废旧镀锌铁皮的目的是________(填字母)。
A 去除油污B 溶解镀锌层C 去除铁锈D 钝化铁皮(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是抽滤______。
(3)加适量H2O2 目的是________ 溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_____。
(4)副产物ZnO常用于制备锌单质。
我国早有炼锌技术的记载,明代宋应星著的《天工开物》中有“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红冷定毁罐取出…即倭铅也。
”该炼锌工艺过程涉及主要反应的化学方程式为_________,(注:炉甘石的主要成分为碳酸锌,“倭铅”是指金属锌)。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
若需配制浓度为0.01 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7[保留4位有效数字,已知M r(K2Cr2O7)=294]。
配制该标准溶液时,下列仪器中用不到的有________(填编号)。
①电子天平②烧杯③量筒④玻璃棒⑤250 mL容量瓶⑥胶头滴管⑦移液管(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
【答案】AB 洗涤、灼烧将部分亚铁离子氧化成铁离子防止Fe2+被氧化 ZnCO3+2C 高温Zn+3CO↑ 0.7350 ③⑦偏大【解析】【分析】【详解】(1)A.氢氧化钠溶液与油污反应生成高级脂肪酸盐,具有去除油污作用,A符合题意;B.根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层,B符合题意;C.氢氧化钠和铁不反应,C不符合题意;D.氢氧化钠不能钝化铁皮,故D不符合题意;答案为:AB;(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO;(3)Fe3O4中有+3价铁,因此加适量H2O2目的是将部分亚铁离子氧化成铁离子,将亚铁离子和铁离子达到Fe3O4中+2价铁与+3价铁的比例关系,持续通入N2,主要防止Fe2+被氧化;故答案为:将部分亚铁离子氧化成铁离子;防止Fe2+被氧化;(4)该炼锌工艺参加反应的物质是煤炭饼和炉甘石(碳酸锌),得到的物质是倭铅(金属锌)和CO,联想初中所学高炉炼铁原理,则炼锌过程涉及主要反应的化学方程式为ZnCO3+2C 高温Zn+3CO↑;(5)m(K2Cr2O7)=0.01 mol·L-1×0.250 L×294 g·mol-1=0.7350 g,电子天平用于准确称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流,容量瓶用于配制溶液,胶头滴管用于加水定容。
高考化学 铁及其化合物 培优 易错 难题练习(含答案)附详细答案

(3)溶液2中含有的溶质有__________(填化学式)。
(4)写出操作④的化学反应方程式____________。
(5)金属铜能与浓硫酸在加热的条件下发生反应,产生的气体为_________(填化学式)。
【答案】铝2Al+3Cu2+=2Al3++3Cu氨水过滤Al2(SO4)3、H2SO4Al2(SO4)3、H2SO4SO2
【解析】
【分析】
D是一种红褐色沉淀,应为Fe(OH)3,由转化关系可知E为Fe2O3,A为Fe,则B为FeCl3,C为FeCl2,结合对应物质的性质以及题目要求解答该题。
【详解】
(1)由以上分析可知A为Fe,E为Fe2O3,
故答案为:Fe;Fe2O3;
(2)C为FeCl2,可与氯气反应生成FeCl3,方程式为2FeCl2+Cl2=2FeCl3,B为FeCl3,可与氢氧化钠溶液反应生成Fe(OH)3,方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,可经一氧化碳高温下还原(或铝热反应)生成Fe,方程式为Fe2O3+3CO 2Fe+3CO2(或Fe2O3+2Al 2Fe+Al2O3),
(2)操作①②③用于分离固体和液体,为过滤操作;
(3)溶液2中含有的溶质有Al2(SO4)3、H2SO4;
(4)操作④是加热Al(OH)3,Al(OH)3不稳定,受热发生分解反应,化学方程式为:2Al(OH)3 2Al2O3+3H2O;
(5)金属Cu与浓硫酸混合加热,发生氧化还原反应,产生CuSO4、SO2、H2O,反应方程式为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,所以反应产生的气体为SO2。
高考化学易错题专题复习-铁及其化合物练习题附答案解析

高考化学易错题专题复习-铁及其化合物练习题附答案解析一、高中化学铁及其化合物1.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义,下列是回收金属铜和刻蚀液再生的流程图,回答下列问题:(1)沉淀A中含有的单质是_________。
(2)通入的气体C的化学式是________。
(3)滤液与气体C反应生成刻蚀液的离子方程式:_________________。
【答案】Fe、Cu Cl2 2Fe2++Cl2=2Fe3++2Cl-【解析】【分析】废液中含有Fe2+、Fe3+、Cu2+,废液中加入过量铁屑后发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu;过滤后得到的沉淀A为Fe、Cu;滤液中含有Fe2+,滤液中通入气体C,得到刻蚀液FeCl3溶液,则气体C为氯气;沉淀A与过量盐酸反应,Fe与盐酸反应生成氯化亚铁,而铜不反应,则沉淀B为Cu,据此进行解答。
【详解】根据上述分析可知沉淀A为Fe、Cu,沉淀B为Cu,滤液含有Fe2+,气体C为Cl2。
(1)废液中含有Fe2+、Fe3+、Cu2+,向废液中加入过量Fe屑,发生反应Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu,所以沉淀A中含有过量的Fe和反应产生的Cu,即沉淀A中含有的金属单质是Fe、Cu;(2)A中含有Fe、Cu,向A中加入盐酸,铁溶解生成FeCl2,而Cu不溶解,过滤得到沉淀B 是Cu,向含有FeCl2的滤液中通入Cl2,发生反应:2FeCl2+Cl2=2FeCl3;(3)Cl2与FeCl2反应产生FeCl3,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
【点睛】本题考查了无机推断,明确常见元素及其化合物性质为解答关键,题目侧重考查学生对基础知识的掌握,有利于提高学生的分析、理解能力及灵活应用能力。
2.D、E为中学化学常见的单质,在一定条件下C、D间能发生反应。
高考化学易错题精选-铁及其化合物练习题附详细答案

高考化学易错题精选-铁及其化合物练习题附详细答案一、高中化学铁及其化合物1.有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验:请回答:(1)X的化学式_________________,挖出后在空气中容易发黄的原因______________。
(2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:___________________,_________________。
【答案】Fe2(OH)2CO3或Fe(OH)2·FeCO3 +2价铁元素被空气氧化为+3价铁元素2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-= Fe(SCN)3【解析】【分析】⑴先计算分解生成的水的物质的量,再计算CO2的物质的量,根据现象得出含有亚铁离子并计算物质的量,根据比例关系得出化学式。
⑵滴加双氧水是Fe2+与H2O2反应生成Fe3+,Fe3+与3SCN-反应生成血红色。
【详解】⑴分解生成的水是1.8g,物质的量是0.1mol;无色无味气体是CO2,物质的量是0.1mol;黑色固体用稀硫酸溶解后分为两等分,滴加KSCN溶液没有实验现象,然后滴加双氧水变为血红色,则含有亚铁离子;另一份加入足量的氢氧化钠溶液得到沉淀,过滤洗涤并充分灼烧后得到8g固体,该固体是氧化铁,物质的量是0.05mol,其中铁元素的物质的量是0.1mol,则黑色固体中亚铁离子的物质的量是0.2mol,所以氧化亚铁是0.2mol,X中相当于含有0.1氢氧化亚铁和0.1mol碳酸亚铁,所以化学式为Fe2(OH)2CO3或Fe(OH)2·FeCO3,挖出后在空气中容易发黄的原因是+2价铁元素被空气氧化为+3价铁元素;故答案为:Fe2(OH)2CO3或Fe(OH)2·FeCO3;挖出后在空气中容易发黄的原因是+2价铁元素被空气氧化为+3价铁元素。
高考化学 铁及其化合物 培优 易错 难题练习(含答案)及答案

高考化学铁及其化合物培优易错难题练习(含答案)及答案一、高中化学铁及其化合物1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
高考化学易错题专题训练-铁及其化合物推断题练习题附详细答案

高考化学易错题专题训练-铁及其化合物推断题练习题附详细答案一、铁及其化合物1.钛(Ti )被称为继铁、铝之后的第三金属,钛白(2TiO )是目前使用最广泛的白色颜料。
制备2TiO 和Ti 的原料是钛铁矿,用含23Fe O 的钛铁矿(主要成分为3FeTiO )制备2TiO 的流程如下:(1)步骤①加Fe 的目的是________________________;步骤②冷却的目的是__________________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入_______处理。
(3)由金红石(2TiO )制取单质钛(Ti )的过程为,其中反应42800C TiCl 2Mg2MgCl Ti ︒++在氩气气氛中进行的理由是______________________________。
【答案】将3+Fe 还原为2+Fe 析出绿矾(42FeSO 7H O ⋅) 生石灰(或碳酸钙、碱) 高温下镁或钛与2O 、2N 等反应【解析】【分析】根据钛铁矿中23Fe O 、3FeTiO 与浓硫酸反应的溶液中加入铁粉、过滤后,滤液冷却得到硫酸亚铁晶体推知,铁粉与铁离子发生反应得到亚铁离子。
水浸后的溶液成酸性。
【详解】(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价Fe 转化为+2价Fe ;降低温度,减小了42FeSO 7H O ⋅的溶解度,有利于绿矶结晶析出。
(2)水浸过程发生的离子反应为2223TiO 2H O H TiO 2H +++=↓+,废液呈酸性,所以处理水浸后的废液应加入CaO 、3CaCO 或碱。
(3)由于Ti 和Mg 易与空气中的2O 、2N 等反应,故该反应应在氩气气氛中进行。
2.某强酸性溶液 X 中可能含有 Fe 2+、Fe 3+、Al 3+、Ba 2+、NH 4+、CO 32-、NO 3-、SO 42-、SiO 32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。
高考化学铁及其化合物综合题含答案解析

高考化学铁及其化合物综合题含答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
高考化学铁及其化合物综合练习题及详细答案

高考化学铁及其化合物综合练习题及详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1 .某固体化合物 A,按图所示发生系列变化, E 溶液中参加氨水后产生的白色沉淀很 快变为灰绿色,最后变为红褐色.(3)反响④是氢氧化亚铁和氧气水发生反响生成氢氧化铁的也复原反响,反响的化学反应方程式为 4Fe(OH%+O 2+2H 2O=4Fe(OH )3.稀盐酸元粉末E 溶液稀氨水■ 在空气中久叠答复以下问题:(1)物质A 是 (2)反响②的离子反响方程式为(3)反响④的化学反响方程式为(填化学式).【答案】Fe(OH\ FaO3 + 6H + =2Fe 3++ 3H 2O 4Fe(OH 2+O 2+2H 2O=4Fe(OH» 【解析】 【分析】E 溶液中参加氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明 化铁,Fe(O H )3, A 加热分解生成B 为Fe 2O 3, C 为H 2O,依据流程分析判断 Fe, E 为FeC 2溶液,据此分析. 【详解】E 溶液中参加氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明 化铁,F e(0H 及A 加热分解生成B 为Fe 2O 3, C 为H 2O,依据流程分析判断 Fe, E 为FeC 2溶液.(1)依据推断可知 A 为Fe(OH ?;(2)反响②是盐酸和氧化铁发生的复分解反响,反响的离子反响方程式为 =2Fe 3++3H 2O ;A 为氢氧D 为 FeC3, X 为 A 为氢氧D 为 FeC3, X 为 F&O3 + 6H+2 .现有金属单质 A 、B 、C 和气体甲、乙、丙以及物质 D 、E 、F 、G 、H,它们之间的相互 请根据以上信息完成以下各题:(1)写出以下物质的化学式: B 、丙.(2)写出黄绿色气体乙的一种用途 ,反响过程⑦可能观察到的实验现象是 .对应的化学方程式是 . (3)反响③中的离子方程式是 .【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)+O 2+2H 2O=4Fe(OH )3 2A1+2OH -+2H 2O=2AlO 2-+3H 2 T 【解析】 【分析】金属A 颜色反响为黄色证实 A 为金属Na, Na 与水反响生成气体甲为 H2, D 为NaOH;金 属B 和氢氧化钠溶液反响产生 H 2,说明B 为金属Al,黄绿色气体乙为 C12,气体甲是H 2, H 2和C12反响生成丙为 HCl, HCl 溶于水得到的物质 E 为盐酸溶液,盐酸与金属 C 反响产生 F 溶液是金属氯化物,该氯化物与C 2还可以反响产生 G, G 与NaOH 溶液反响生成红褐色沉淀H 为Fe(OH )3,那么G 为FeC3,推断物质F 为FeC2;判断C 为Fe,以此解答该题. 【详解】根据上述分析可知 A 是Na, B 是Al, C 为Fe,气体甲是H 2,气体乙是C2,气体丙是HCl; D 是 NaOH, E 是盐酸,F 是 FeC2, G 是 FeC3, H 是 Fe(OH )3. (1)根据上述分析可知,物质B 是Al,丙是HCl;(2)黄绿色气体乙是 Cl 2,该物质可以与水反响产生HCl 和HClO, HClO 具有强氧化性,可作氧化剂,氧化一些具有复原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeC 2 与 NaOH 溶液发生反响:FeC 2+2NaOH=Fe(OH2J +2NaC l Fe(OH)2 具有复原性,容易 被溶解在溶液中的氧气氧化,发生反响:4Fe(OH)2+O 2+2H 2O=4Fe(OH >,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终 变成红褐色; (4)反响③是Al 与NaOH 溶液发生反响产生 NaAlO 2和H 2,反响的离子方程式为: 2Al+2OH -+2H 2O=2AlO 2-+3H 2 T o 【点睛】此题是无机物推断,物质的颜色及转化关系中特殊反响是物质推断的突破口,再结合转化 关系推断,需要学生熟练掌握元素化合物知识,试题培养了学生的分析水平及逻辑推理能 力.转化关系如下图(图中有些反响的生成物和反响的条件没有标出O3 .有以下物质相互转化:沉淀H(1)写出B 的化学式 , D 的化学式为 ; (2)写出由E 转变成F 的化学方程式 . (3)写出D 转化成H 的离子方程式 .(4)除去溶液B 中混有的少量 G 溶液的最适宜方法是 .【答案】FeC 2 KCl 4FeOH )2+O 2+2H 2O=4Fe(OH )3 Ag ++C -=AgCl J 向溶液 B 中参加足量 铁粉,再经过滤操作 【解析】 【分析】D 和硝酸银、稀硝酸的混合溶液反响生成沉淀H 和焰色反响呈紫色的溶液可知,H 为AgCl , D 为KCl,白色沉淀E 在空气中变成红褐色沉淀F 可知E 为Fe(OH 〞 F 为Fe(OH )3,所以 G 为 FeCl3, A 为 Fe, B 为 FeCl2, C 为 NaOH ,据此解答. 【详解】(1)由分析可知,B 为FeCl2, D 为KCl,故答案为:FeC2; KC|(2) E 为 Fe(OH )2, F 为 Fe(OH )3,反响的方程式为:4Fe(OH)2+O 2+2H 2O=4Fe(OH)3,故答 案为:4Fe( OH) 2+O 2+2H 2O=4Fe( OH) 3;(3) D 为KCl , H 为AgCl , D 转化为H 的离子方程式为: Ag ++Cl -=AgCl J,故答案为:Ag ++C -=AgCl J ;(4) FeCl 2中混有的少量FeCl 3,可用过量的铁粉将 FeCl 3转化为FeCl 2,过量的铁粉用过 滤除去,故答案为:向溶液 B 中参加足量铁粉,再经过滤操作.【点睛】白色沉淀迅速变为灰绿色,最后变为红褐色所涉及的反响正是 E 到F :4Fe(OH)2+2H 2O+O 2=4Fe(OH) 3.4 .A 是一种常见金属,F 是一种红褐色沉淀.根据图中转化关系,答复以下问题.(1)写出F 、G 的化学式:F.; G..(2)检3^D 中阳离子的方法为 __________________________________________ (3)保存C 溶液时要加固体 A 的原因是 ________________________________泊色沉浓E 餐、第及号-^4^1师请答复以下问题:(4)写出以下转化的离子方程式:CD BH>C : ________________________________________________________________ ② 8D : ______________________________________________________________________ 【答案】Fe(OH} Fe2O3取D溶液少许于试管中,参加几滴KSCN溶液,溶液变红色,证明含Fe3+ 预防Fe2+被.2 氧化Fe s O4+8H+— Fe2++2Fe3++4H2O 2F(2++C『2Fe2++2C「【解析】【分析】A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3, A为Fe, Fe与氧气反响生成B为Fe s O4,四氧化三铁与盐酸反响得到氯化亚铁与氯化铁,故Fe与盐酸反响得到X为氢气、C为FeC2,可推知E为Fe(OH)2、D为FeC3, G为F及O3.【详解】⑴由上述分析可知,F为Fe(OH)3, G为F及O3;(2)检3FeC3中阳离子的方法为:取D溶液少许于试管中,参加几滴KSCN容液,溶液变红色,证实含Fe3+;⑶保存FeC2溶液时要加固体Fe的原因是:预防Fe2+被.2氧化;(4)①B-C 的离子方程式:Fe3O4+8H+— Fe2++2Fe3++4H2.;②C^D 的离子方程式:2Fe2++C2— 2Fe2++2C「;【点睛】物质的颜色是推断突破口,再结合转化关系推断各物质,需要学生熟练掌握元素化合物的性质5 .物质A〜F有如下图的转化关系,各反响均在高温下进行(必要时需催化剂), A是种常见的金属单质,B常温下是一种液态化合物, E为一种无色气体,且E分子的电子数与(1)写出①的化学方程式.(2)写出③的化学方程式.(3)写出一个B作复原剂的化学方程式.(4)写出一个F作氧化剂的化学方程式.【答案】3Fe+ 4H20(g) - Fe3O4+4H2 CO+h2O(g)= CO2+ H2 2历+2H2O=4HF+Q高温点燃C+CQ= 2C0 (或2Mg+CO2 - 2Mg0+C)【解析】【分析】反响均是在高温下进行的(必要时可使用催化剂), A是一种常见的金属单质,B常温下是一种液态化合物,E为一种无色气体,且E分子的电子数与用的电子数相同,那么E为C0,依据转化关系结合反响条件分析判断, A为Fe, B为H20, C为Fe s O4, D为H2, E为CO, F为C02,据此分析解答.【详解】[Wj温(1)反响①是铁和水蒸气反响生成四氧化三铁和氢气,化学方程式3Fe+ 4H20(g)— Fe304 +4H2;[Wj温(2)反响③是一氧化碳和水蒸气反响生成二氧化碳和氢气,化学方程式CO+H2O(g)— CQ +H2;(3)B为H2O,氟单质与水反响生成氟化氢和氧气,该反响中水作复原剂,化学方程式2F2+2H2O=4HF+O2;(4)F为CQ,二氧化碳在高温下与碳单质反响生成一氧化碳,或二氧化碳与金属镁反响生[Wj温成氧化镁和碳单质,反响中二氧化碳作氧化剂,化学方程式C+CC2= 2CO (或点燃2Mg+CO2 - 2MgO+C);6 .某课外小组对金属钠进行研究. C、D都是单质,F的水溶液是一种常见的强酸.(1)金属Na在空气中放置足够长时间,最终的生成物是:.(2)假设A是一种常见金属单质,且A与B溶液能够反响,写出该反响的化学方程式______________________________ O(3)假设A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出白色絮状沉淀转变成红褐色沉淀过程发生化学反响的方程式:. 【答案】碳酸钠或Na z CQ 2Al+2NaOH+2H2O=2NaAlO2+3H2 f 4Fe(OH?+O2+2H2O=4Fe(OH? 【解析】【分析】Na和O2点燃生成M,那么M为Na2O2;Na和水反响生成B和C,其中C为单质,那么C为H2, B为NaOH; F的水溶液为常见的强酸,那么F为HCl , D为C.题中没有给出A、E、G的信息,故需要结合小题中的信息,去推断各题对应的物质.【详解】(1)金属Na在空气中,外表会被氧化为Na2O, Na和Na2O都会和水蒸气反响生成NaOH, NaOH会再和CC2反响生成Na2CO3;(2)从题中信息可以推出A为Al, A、B反响的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2 T ;(3)从题中信息可以推出A为亚铁盐,白色絮状沉淀为Fe(OH)2, E为Fe(OH)3,白色絮状沉淀转变成红褐色沉淀过程发生化学反响的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH?. 【点睛】金属钠在空气中放置,先变为氧化钠,与水反响生成氢氧化钠,该物质易吸水而潮解,形成氢氧化钠溶液,再与空气中的二氧化碳反响生成碳酸钠晶体,风化后得到碳酸钠粉末.7 .金属A能够被磁铁所吸引.A及其A的化合物之间有如下的转化关系:[―^~万~| NaOH」液(一色』A—[置于空r中〒彘酸^向3帝淞.「E*色)(1)写出A、C的化学式:A; C.(2)检验B中阳离子的试剂是.(3)写出以下反响的化学方程式或离子方程式:A ―D的离子方程式E-C的化学方程式【答案】Fe Fe(OH) KSCNN§^或NaOH 溶液Fe+2H+ —Fe2++H2 T4Fe(OH?+2H2O+O2^ 4Fe(OH)3【解析】【分析】金属A能够被磁铁所吸引,那么A是Fe, Fe在氯气中燃烧生成B为FeC3, Fe和HCl反响生成FeC2和H2, FeC3和Fe反响生成FeC2,那么D为FeC2, B和NaOH反响生成红褐色的C 为Fe(OH)3, D和NaOH溶液反响生成的白色E 为Fe(OH)2, Fe(OH»和氧气、水反响生成Fe(OH)3o【详解】(1)通过以上分析知,A、C分别是Fe、Fe(OH)3,故答案为:Fe; Fe(OH)3;(2)B为氯化铁,铁离子用KSCN或NaOH溶液检验,铁离子和KSCN混合后溶液呈血红色,和NaOH反响生成红褐色沉淀,所以可以用KSCN或NaOH溶液检验,故答案为:KSCN溶液或NaOH溶液;(3)Fe和稀盐酸反响生成氯化亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2 T ,氢氧化亚铁和氧气、水反响生成氢氧化铁,反响方程式为 4 Fe(OH)2+2H2O+O2—4 Fe(OH)3,故答案为:Fe+2H+=Fe2++H2 T ;4 Fe(OH)2+2H2O+O2=4 Fe(OH)3o【点睛】此题以Fe及其化合物之间的转化为载体考查无机物推断,明确物质性质是解此题关键.本题的突破口为C的颜色.此题的易错点为氢氧化亚铁氧化的方程式的书写.8.现有金属单质A、B和气体甲、乙、丙以及物质C、D、E F,它们之间能发生如下反应.(图中有些反响的产物和反响条件没有标出)黄'录色产(*乌罗「物瓦石I_______ 、巴② ------------------ J~~ ~~1金属 A 水③金属(拓色为黄色)「①| H —―--------- 黄绿色II I ■ —-i ■-十点羊,★? (3)物质C t;物, F下物质E~®l" T-■ ■1 . 一一^ 1I驾侬图(1)A的原子结构示意图为 ,丙的化学式为.(2)金属A、B和气体甲、乙、丙以及物质C、D、E、F中不能导电的有、属于电解质的有.(填"A〞“托T ZT丙〞“C〞“D〞“E〞“ F〞)(3)写出转化①发生的化学方程式: ,写出转化④发生的离子方程式:_________________________________________________________________ O(4)将Na2O2投入到E溶液中,可以观察到的现象是:.【答案】a) C HCl 甲、乙、丙丙2Na+2H2O=2NaOH+H2 T C2+2Fe2+=2C「+2Fe3+7// /产生红褐色沉淀,同时生成无色气体【解析】【分析】金属A焰色反响为黄色,那么A为金属Na,由反响①可知,C为NaOH溶液,气体甲为H2;黄绿色气体乙为C12,与氢气反响生成丙HCl , HCl溶于水得物质D为盐酸,盐酸与金属B反响生成物质E,物质E与C12反响生成物质F, F与NaOH反响生成红褐色沉淀为Fe(OH)3,故物质F中含有Fe3+,分析可知金属B为Fe,物质E为FeCL溶液,物质F为FeCl3溶液.【详解】K\\(1)金属A焰色反响为黄色,那么A为金属Na,原子结构示意图为顿力,黄绿色气rrrvq体乙为Cl2,与氢气反响生成丙为HCl;故答案为:磅打、HCl;(2) A: Na、B: Fe、C: NaOH 溶液、D:盐酸、E: FeCL溶液、F: FeCl3溶液、甲:H2、乙:Cl2、丙:HCl,其中不能导电的有:甲、乙、丙、属于电解质:丙,故答案为:甲、乙、丙;丙;(3)转化①为金属Na与水的反响氢氧化钠和氢气,反响的化学方程式为:2Na+2H2O=2NaOH+H2 T ,转化④为FeCl2与Cl2的反响生成氯化铁,反响的离子方程式为:Cl2+2Fe2+=2C「+2Fe3+,故答案为:2Na+2H2O=2NaOH+H2 T ;Cl2+2Fe2+=2C-+2Fe3+;(4) E为FeCl2,将Na2O2投入到FeCl2溶液中,NmO2具有强氧化性,氧化亚铁离子生成铁离子,产生红褐色沉淀,同时生成无色气体氧气,故答案为:产生红褐色沉淀,同时生成无色气体.【点睛】电解质:在水溶液或熔融状态下能导电的化合物,不能是单质.非电解质:在水溶液和熔融状态下都不能导电的化合物,也不能是单质.9. A〜L分别表示中学化学中常见的一种物质,其中A、G为常见的金属单质,K、L为气体,K能使湿润的红色石蕊试纸变蓝, M由两种元素组成,其质量比8: 1.(1) K的电子式为(2)反响②的离子方程式: ,反响③的离子方程式:(3)反响④的化学方程式: ,反响⑥的化学方程式(4)A和K反响为置换反响,那么M的化学式为【答案】FQO4+8H+= 2Fe3++Fe2++H2O F(3++3NH3?H2O= Fe (OH)3j+3NH4+ 4Fe H(OH) 2+O2+2H2O = 4Fe (OH) 3 Al2O3+2NaOH— 2NaAlO2+H2O Fe s N【解析】【分析】K能使湿润的红色石蕊试纸变蓝,应为NH3,由转化关系可知A为变价金属,那么为Fe,可知B 为Fe s O4, C 为FeC2, D 为FeC3, E为Fe (OH) 2、F为Fe (OH) 3, A 和K反响为置换反响,M由两种元素组成,其质量比8: 1 ,那么应为Fe2N, L为H2, G为O2, H为Al、I 为A2O3, J为NaAlO2,以此解答该题.【详解】(1)K为氨气,电子式为H :出H故答案为H:N: H;H H(2)反响②为Fe3O4与盐酸的反响,离子方程式为Fe3O4+8H+=2Fe3++Fe2++H2O,反响③为FeC3与氨水的反响,离子方程式为Fe3++3NH3?H2O= Fe (OH) 3 J +3NH+,故答案为:Fe3O4+8H+=2Fe3++Fe2++H2O; Fe3++3NH3?H2O= Fe (OH) 3j+3NH+;(3)反响④的化学方程式为4Fe(OH) 2+6+2H2O = 4Fe (OH) 3,反响⑥的化学方程式为Al2O3+2NaOH— 2NaAlO2+H2.,故答案为:4Fe(OH) 2+O2+2H2O= 4Fe (OH) 3;Al2O3+2NaOH— 2NaAlO2+H2O;(4)由以上分析可知M为Fe2N,故答案为:Fe2N o【点睛】此题考查无机物推断,为高考常见题型,结合题干信息推断物质名称为解答关键,注意掌握常见元素化合物性质,试题侧重考查学生的分析、理解水平及逻辑推理水平.10. A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,组成单质A的元素有可变化合价.它们之间存在如以下图所示的转化关系.由此推断:(i)甲的化学式为,丙的化学式为(2)写出甲和D反响的化学方程式:_______________________________________________(3)为检验化合物甲中元素的化合价,需要用到的药品有 (填字母).A.稀硫酸B.盐酸C.硫氧化钾溶液D.高镒酸钾溶液高温【答案】Fe3O4 AI2O3 3Fe3O4+ 8Al 9Fe+ 4AI2O3 ACD【解析】【分析】A、B、C D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,乙是H2O,组成单质A 的元素有可变化合价,且高温条件下与H2O反响,那么A是Fe,甲是Fe3O4, C是H2, B是O2, F-O4与D反响生成Fe,此反响为铝热反响,那么D是Al,丙是A12O3.【详解】(1)乙在常温常压下为无色无味的液体,乙是H2O,组成单质A的元素有可变化合价,且高温条件下与H2O反响,那么A是Fe,甲是Fe3O4, Fe3O4与D反响生成Fe,此反响为铝热反响,那么D是Al,丙是A12O3,故甲的化学式为Fe s O4,丙的化学式为AI2O3.高温(2)甲是Fe s O4, D是Al,其化学反响方程式为:3Fe s O4+ 8Al^= 9Fe+ 4AI2O3(3)甲是Fe s O4,要检验其中所含有的阳离子,要先用稀硫酸使其发生反响:Fe3O4+8H+= 2Fe3+ + Fe2++4H2O,然后再用高镒酸钾溶液检验Fe2+,用硫氧化钾溶液检验Fe3+,故使用的物质是A、C、Do11. 有A、R C三种常见的金属单质, A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反响生成氢气和一种黑色固体.根据以上信息答复以下问题:(1)写出化学式:A. ;B. ;C. o(2)写出化学方程式:①C 与水蒸气反响;②A与水反响.【答案】Na Mg Fe 3F计4H2O(g) Fe s O4+4H2 2Na+ 2H2O=2NaOH+ H2 T【解析】【分析】有A、B、C三种常见的金属单质, A在空气中燃烧生成淡黄色固体,那么A为钠;B也能在空气中剧烈燃烧,发出耀眼的白光,那么B为镁;C在一定条件下与水蒸气反响生成H2和一种黑色固体,那么C为铁,据此分析.【详解】有A、B、C三种常见的金属单质, A在空气中燃烧生成淡黄色固体,那么A为钠;B也能在空气中剧烈燃烧,发出耀眼的白光,那么B为镁;C在一定条件下与水蒸气反响生成H2和一种黑色固体,那么C为铁.(1)A、B、C的化学式分别为Na、Mg、Fe.(2)化学方程式为高温①C与水蒸气反响化学方程式为3Fe+4H2O(g) ^=Fe3O4+4H2;②A与水反响化学方程式为2Na +2H2O=2NaOH+ H2 T.12.有关物质的转化关系如下图(局部反响的产物已略去). A只含两种元素,摩尔质量为72gmol-1.B是无色气体,其水溶液是常见的酸, C是常见金属,E的组成元素与水相同,其水溶液常用于实验室制氧气, H的俗名是熟石灰,J为红褐色固体.—^>1 F——^-41I—I a ~~■—③——।LsH(1) A的化学式为―.(2) D的电子式为—.(3)写出反响③的离子方程式:—.(4)写出反响④的化学方程式:—.【答案】CaQ 点/匚/ 同同H2O2+2H+ + 2Fe2+=2Fe3++2H2O 3Ca(OH2 +2FeC3 =2Fe(OH)3 J + 3CaC2【解析】【分析】H的俗名是熟石灰,H是Ca(OH)2; E的组成元素与水相同,其水溶液常用于实验室制氧气,E是H2O2;A只含两种元素,与B反响生成E (H2O2) , A为CaO, CaO2与酸反响生成过氧化氢,B是无色气体,其水溶液是常见的酸,那么B 为HCl; J为红褐色固体,J应该是Fe(OH)3;那么金属C应该是Fe,以此解答对应物质的性质以及题目要求解答该题.【详解】(1)由分析可知,A为Ca.,化学式为:CaQ;(2) A 为CaO2, B 为HCl, CaO2+2HCl=CaC2+H2O2,贝U D 为CaC2,电子式为电『C1 [彳上];(3) E是H2O2, B为HCl, C是Fe,那么Fe我FeC2,反响③的离子方程式为:H2O2+2H + +2Fe2+=2Fe3++2H2O;(4)由三可知I 为FeC3, J 为红褐色固体,J 应该是Fe(OH )3, H 为Ca(OHp,④的化学方 程式为:3Ca(OH} + 2FeC3 = 2Fe(OH )3 J + 3CaC 2.13. A 、B 、C 、D 都是中学化学常见的物质,其中 A 、B 、C 均含同一种元素.在一定条件下相互转化关系如以下图所示(局部产物已略去).请按要求答复以下问题:2日上©(1)假设日C 为氧化物,B 转化为C 时,质量增加25%, C 能够与水反响生成一种强酸, 那么B转化为C 的化学方程式是;(2)假设D 为某金属单质,向 C 的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉 淀,那么B 的化学式是;(3)假设D 为强电解质溶液,A 和C 在溶液中反响生成白色沉淀 B,那么A 和C 反响的离子方 程式是 符合条件的D 物质可能是 (填序号).①硫酸 ②醋酸③氢氧化钠 ④一水合氨 ⑤氯化银催化剂【答案】(1) 2SC 2+O 2 £ --------------- 2SQ; (2) FeC3; (3) 6H 2O+Al 3++3AlO 2-=4Al(OH )3 J .A【解析】 试题分析:(1)假设B 、C 为氧化物,B 转化为C 时,质量增加25%, C 能够与水反响生成 一种强酸,那么B 、C 分别为SQ 、SQ, B 转化为C 的化学方程式是 ,惟‘剂」2SO 3; ( 2)向C 的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,该沉淀为 AgCl,说明B 、C 为氯化物,D 为某金属单质,B 、D 发生化合反响,应为 FeC 3和Fe 反响,A是Cl 2; (3) A 、B C 均含同一种元素,D 为强电解质溶液,A 和C 在溶液中反响生成白色沉淀 B, A 和C 在溶液中反响生成白色沉淀B,沉淀B 应为Al(CH )3, A是AICI 3, C 是NaAlO 2,由Al 3+和3AIC 2发生互促水解反响生成,反响的离子方程式为 6H 2O+Al 3++3AlO 2-=4Al(OH )3 J .考点:考查物质的性质及相互转化关系的知识.14.以下图①到⑩分别代表反响中的一种物质,且它们均为化学中的常见物质.(1)①的化学式为 ,⑤和⑥反响的化学方程式为 . (2)实验室由⑧制取⑨的离子方程式为 ; ⑨转变为⑩的化学方程式为 . 由⑨转变为⑩的反响现象为 .2SC 2+C 2【答案】A12O3 2Al+Fe2O3 向inn =2Fe+A2O3 F/+2OH=Fe(OH? J4Fe(OH肘O2+2H2O=4Fe(OH)3白色沉淀逐渐变为灰绿色最后变为红褐色【解析】【分析】①到⑩分别代表反响中的一种物质,且它们均为中学化学中的常见物质,①能与酸或碱反应,且①电解生成氧气,那么①为AI2O3,②中含A1O2-离子,③中含Al3+离子,④为Al(OH)3,⑤为单质Al,⑤⑥发生铝热反响,⑦为Fe,⑧中含Fe2+离子,⑨为Fe(OH>,⑩为F e(0H耳Fe(OH)3受热分解产生⑥是Fe2O3,然后结合物质的性质及化学用语来解答.【详解】根据上述分析可知:①为AI2O3,②为A102-,③为Al3+,④为Al(0H)3,⑤为Al,⑥为F殳03,⑦为Fe,⑧为Fe2+,⑨ Fe(OH},⑩为Fe(OH[(1)由上述分析可知,①为A12O3,⑤和⑥反响的化学方程式为2Al+Fe2O3sjLAl2O3+2Fe;(2)实验室由Fe2+变为Fe(OH)2的操作方法是向其中参加NaOH溶液,因此由⑧制取⑨发生的离子反响为Fe2++2OH-=Fe(OH)4 ;由于Fe(OH)2不稳定,容易被溶解在其中的氧气氧化变为Fe(OH)3,那么由⑨转变为⑩的离子方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,由⑨转变为⑩的反应现象为白色沉淀会逐渐由白色变为灰绿色,最后变为红褐色.15.以下图中每一方框中表示一种反响物或生成物,其中A、C、D、E在通常情况下均为气体,B为液体,(图中有些反响的产物和反响条件没有标出).试答复:(1) X 是 _ , C 是, F 是.(2)写出AfD反响的化学方程式.(3)写出Gr^E反响的化学方程式 .(4)写出C-E反响的化学方程式.【答案】(1) NH4HCQ 或(NH4)2CQNH3NO2(2) 2CO2+ 2Na2O2= 2Na2CO3+ O2(3) 3Cu+8HNO3(稀) = 3Cu(NO3"+2NOT + 4H2O(4) 4 NH3+5O2="=4NO" + 6H2O 【解析】试题分析:(1)既能够与酸反响,又能够与碱反响,经过加热还可以分解的也只有碳酸氢氨了,或者碳酸氨了, A是碳酸氢氨与盐酸反响得到的物质,且A为气体,那么A为二氧化碳,那么D是二氧化碳与过氧化钠反响得到的物质,且D为气体,那么D是氧气.C到E的化学反响是氨气与氧气在催化剂存在下的反响,生成一氧化氮与水. F是氧气与一氧化氮的反响,那么F为二氧化氮.(2)如前所述,A为二氧化碳,那么反响式为:2CO2+2Na2O2=2Na2CQ + O2" (3) E是一氧化氮,F是二氧化氮,B是水,那么G为硝酸,那么G至U E的方程式是稀硝酸与铜反响的方程式.方程式为:3Cu+ 8HNO3(稀)=3Cu(NO3"+2NOT +4H2..(4) C是氨气,D是氧气,氨气与氧气在催化剂存在下的反响是: 4 NH3+ 5O2="=4NO" + 6H2..考点:着重是对钱盐的考查,考查学生分析推断水平.。
高考化学易错题精选-铁及其化合物练习题含答案解析

高考化学易错题精选-铁及其化合物练习题含答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.已知有以下物质相互转化:请回答下列问题:(1)写出B的化学式___________,D的化学式为____________;(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
(4)除去溶液B中混有的少量G溶液的最适宜方法是________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Ag++Cl-=AgCl↓向溶液B中加入足量铁粉,再经过滤操作【解析】【分析】D和硝酸银、稀硝酸的混合溶液反应生成沉淀H和焰色反应呈紫色的溶液可知,H为AgCl,D为KCl,白色沉淀E在空气中变成红褐色沉淀F可知E为Fe(OH)2,F为Fe(OH)3,所以G为FeCl3,A为Fe,B为FeCl2,C为NaOH,据此解答。
【详解】(1)由分析可知,B为FeCl2,D为KCl,故答案为:FeCl2;KCl;(2)E为Fe(OH)2,F为Fe(OH)3,反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)D为KCl,H为AgCl,D转化为H的离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;(4)FeCl2中混有的少量FeCl3,可用过量的铁粉将FeCl3转化为FeCl2,过量的铁粉用过滤除去,故答案为:向溶液B中加入足量铁粉,再经过滤操作。
【点睛】白色沉淀迅速变为灰绿色,最后变为红褐色所涉及的反应正是E到F:4Fe(OH)2+2H2O+O2=4Fe(OH)3。
2.下列物质之间有如下反应关系:已知由E 转化成C 的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:(1)写出下列物质的化学式:A______,B______,D________,甲_______,乙_______,丙__________。
高考化学复习铁及其化合物专项易错题附答案解析

高考化学复习铁及其化合物专项易错题附答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.物质X是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。
在密闭容器中加热X使之完全分解,发生如下转化:请回答下列问题:(1)X的化学式为__。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__。
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之_。
【答案】AlCl3·2FeSO4 Al3++2H++6OH-=AlO2-+4H2O 将气体通入足量NaOH溶液中,收集余气,把一条带火星的木条伸入其中,若复燃,则说明是O2【解析】【分析】固体氧化物B溶于稀盐酸后得到的溶液C中滴加KSCN溶液,混合液变血红色,说明B中含有Fe3+,则B为Fe2O3,C为FeCl3溶液,无色D气体能使品红褪色,则D为SO2,由元素守恒可知A中含有Fe、S、O元素,A加热分解能生成氧化铁和二氧化硫,则盐A为FeSO4,氧化铁的物质的量为3.2g160g/mol=0.02mol,生成二氧化硫为0.448L22.4L/mol=0.02mol,由Fe、S原子为1:1可知生成SO3为0.02mol,4.27g混合晶体E为AlCl3和SO3,AlCl3的物质的量为4.27g-0.02mol80g/mol133.5g/mol=0.02mol,X的组成为AlCl3∙2FeSO4,以此解答该题。
【详解】(1)根据上述分析,X的化学式为AlCl∙2FeSO4;(2)将E混合晶体溶于水配成溶液,三氧化硫反应生成硫酸,则硫酸与氯化铝的物质的量相等,逐滴加入过量稀NaOH溶液,该过程的总反应的离子方程式为:Al3++2H++6OH-=AlO2-+4H2O;(3)若在高温下长时间煅烧X,生成的三氧化硫再分解生成二氧化硫和氧气,另一种气体分子式是O2,检验氧气的方法为:将气体通入足量NaOH溶液中,收集余气,把一条带火星的本条伸入其中,若复燃,则说明是O2。
精选高考化学易错题专题复习铁及其化合物附详细答案

精选高考化学易错题专题复习铁及其化合物附详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3【解析】【分析】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
【详解】已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;(3)反应④是氢氧化亚铁和氧气水发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
2.某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。
工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
回答下列问题;(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:__________、______。
(3)得到FeSO4•7H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
【答案】Fe H2SO4 Fe + 2Fe3+=3Fe2+ Fe + Cu2+=Fe2++ Cu 过滤洗涤【解析】【分析】工业废水中含大量Fe2+、Fe3+、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,要加入铁粉,可置换出铜,同时生成硫酸亚铁,经过滤,得到的滤液C中主要含硫酸亚铁,滤渣B中含Cu、Fe,向该固体混合物中加入D为H2SO4,得到的溶液F为硫酸亚铁,得到滤渣E为Cu,将溶液C、F合并就是FeSO4溶液,溶液经蒸发、浓缩、冷却结晶、过滤,洗涤、干燥就可得到FeSO4·7H2O晶体,以此来解答。
高考化学易错题精选-铁及其化合物练习题含答案

高考化学易错题精选-铁及其化合物练习题含答案一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
2.A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
高考化学易错题专题复习-铁及其化合物练习题附详细答案

高考化学易错题专题复习-铁及其化合物练习题附详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。
其中A、D为金属单质。
(反应过程中生成的水及其他产物已略去)请回答以下问题:(1)B是__________,H是_______________。
(填化学式)(2)写出J与D反应转化为G的离子方程式_________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式 _______。
【答案】Fe2O3 Fe(OH)2 2Fe3++Fe=3Fe2+ 2Al+2OH-+2H2O=2AlO2-+3H2↑【解析】【分析】A、D为常见金属单质,B、C为金属氧化物,反应条件是高温进行,可以判断为铝热反应,可以推断A为Al,D为Fe,B为铁的氧化物,结合C与氢氧化钠反应证明C为Al2O3,E为AlCl3,F为NaAlO2,通过转化关系判断,G为FeCl2,H为白色沉淀Fe(OH)2,I为红褐色沉淀Fe(OH)3,B为Fe2O3,J为FeCl3,依据判断结果分析解答问题。
【详解】A、D为常见金属单质,B、C为金属氧化物,反应条件是高温进行,可以判断为铝热反应,可以推断A为Al,D为Fe,B为铁的氧化物,结合C与氢氧化钠反应证明C为Al2O3,E为AlCl3,F为NaAlO2,通过转化关系判断,G为FeCl2,H为白色沉淀Fe(OH)2,I为红褐色沉淀Fe(OH)3,B为Fe2O3,J为FeCl3;(1)依据分析判断可知B为:Fe2O3;H的化学式为:Fe(OH)2;故答案为:Fe2O3;Fe(OH)2;(2)反应“J+D→G”的离子方程式为铁和三氯化铁的氧化还原反应,离子方程式为:2Fe3++Fe=3Fe2+;故答案为:2Fe3++Fe=3Fe2+;(3)A为Al在常温下也可与NaOH溶液反应生成F为偏铝酸钠,反应的化学方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑。
高考化学易错题精选-铁及其化合物练习题含答案解析

高考化学易错题精选-铁及其化合物练习题含答案解析一、高中化学铁及其化合物1.下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质。
(1)①的化学式为_______,⑤和⑥反应的化学方程式为_______________。
(2)实验室由⑧制取⑨的离子方程式为____________________;⑨转变为⑩的化学方程式为____________________。
由⑨转变为⑩的反应现象为__________________。
【答案】Al2O3 2Al+Fe2O32Fe+Al2O3 Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3白色沉淀逐渐变为灰绿色最后变为红褐色【解析】【分析】①到⑩分别代表反应中的一种物质,且它们均为中学化学中的常见物质,①能与酸或碱反应,且①电解生成氧气,则①为Al2O3,②中含AlO2-离子,③中含Al3+离子,④为Al(OH)3,⑤为单质Al,⑤⑥发生铝热反应,⑦为Fe,⑧中含Fe2+离子,⑨为Fe(OH)2,⑩为Fe(OH)3,Fe(OH)3受热分解产生⑥是Fe2O3,然后结合物质的性质及化学用语来解答。
【详解】根据上述分析可知:①为Al2O3,②为AlO2-,③为Al3+,④为Al(OH)3,⑤为Al,⑥为Fe2O3,⑦为Fe,⑧为Fe2+,⑨Fe(OH)2,⑩为Fe(OH)3。
(1)由上述分析可知,①为Al2O3,⑤和⑥反应的化学方程式为2Al+Fe2O3Al2O3+2Fe;(2)实验室由Fe2+变为Fe(OH)2的操作方法是向其中加入NaOH溶液,因此由⑧制取⑨发生的离子反应为Fe2++2OH-=Fe(OH)2↓;由于Fe(OH)2不稳定,容易被溶解在其中的氧气氧化变为Fe(OH)3,则由⑨转变为⑩的离子方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,由⑨转变为⑩的反应现象为白色沉淀会逐渐由白色变为灰绿色,最后变为红褐色。
高考化学铁及其化合物(大题培优 易错 难题)含详细答案

高考化学铁及其化合物(大题培优易错难题)含详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3先产生白色沉淀,迅速变为灰绿色,最后变为红褐色 2Fe+3Cl22FeCl3 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ H++2Fe2++HClO=2Fe3++Cl-+H2O【解析】【分析】结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。
由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。
由B→C→D的转化可推知,C为Fe(OH)3。
【详解】(1)由以上分析可知,D为氧化铁,其化学式:Fe2O3。
答案为:Fe2O3;(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。
历年高考化学易错题汇编-铁及其化合物练习题及答案解析

历年高考化学易错题汇编-铁及其化合物练习题及答案解析一、高中化学铁及其化合物练习题(含详细答案解析)1.已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各是什么物质的化学式为:A_______、B_______、C_______、D_______。
(2)现象②中所发生的反应的化学方程式为:__________________________________、______________________________。
(3)现象③中所发生反应的离子方程式为:__________________________________、________________________________。
【答案】BaCl2 FeSO4 AlCl3 NaOH; FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4 4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3 Al3+ + 3OH-=Al(OH)3↓ Al(OH)3 + OH-=AlO2- + 2H2O【解析】【分析】①A+B→白色沉淀,加入稀硝酸,沉淀不溶解应,则生成的白色沉淀为BaSO4,②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色,是Fe(OH)2的转化为Fe(OH)3,故A 为BaCl2,B为FeSO4,D为NaOH,则C为AlCl3,氯化铝溶液与NaOH溶液反应生成白色沉淀Al(OH)3,Al(OH)3能溶解在NaOH溶液中,符合③中现象。
【详解】(1)根据以上分析可知A、B、C、D依次为BaCl2、FeSO4、AlCl3、NaOH;(2)现象②先生成白色沉淀,在空气中放置,沉淀由白色转化为红褐色时所发生的反应的化学方程式为:FeSO4 + 2NaOH=Fe(OH)2↓+ Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)现象③中所发生反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O。
高考化学知识点复习《铁及其化合物》真题练习含答案

高考化学知识点复习《铁及其化合物》真题练习含答案一、单选题1.(2023年7月黑龙江省普通高中学业水平合格性考试)长江以南的低山丘陵区普遍存在着红色土壤,有人说主要因其含铁质(三价铁)相对较多。
某研究小组设计简单实验验证该说法是否正确,应选择的试剂是 A .KClB .KNO 3C .K 2SO 4D .KSCN 【答案】D【解析】验证土壤中是否含有Fe 3+,可以使用KSCN 溶液检验,向蒸馏水中加入少量的土壤后搅拌,土壤中的离子可以进入到蒸馏水中,过滤后得到澄清溶液,向溶液中滴加KSCN 溶液,若溶液变成红色,则说明土壤中含有Fe 3+,故答案选D 。
2.(2023年黑龙江省春季普通高中学业合格考试)向盛有()43Fe SO 溶液的试管中,滴入几滴KSCN 溶液,溶液呈A .无色B .红色C .白色D .蓝色 【答案】B【解析】向盛有()43Fe SO 溶液的试管中,滴入几滴KSCN 溶液,溶液中的反应为:3+-3Fe 3SCN Fe(SCN)+=,生成血红色溶液。
答案选B 。
3.(2023年1月辽宁省普通高中学业水平合格性考试)下列关于铁及其化合物的叙述错误的是 A .铁具有导电、导热、延展性B .氧化铁常用作涂料、油漆的红色颜料C .用铜粉除去2FeCl 溶液中含有的少量3FeCl 杂质D .实验室制备氢氧化亚铁的关键是防止氧气的干扰【答案】C【解析】A .铁是一种金属单质,具有导电、导热、延展性,A 正确;B . 氧化铁是红棕色粉末,常用作涂料、油漆的红色颜料,B 正确;C .氯化铁溶液和铜反应得到氯化亚铁和氯化铜,用铜粉除去2FeCl 溶液中含有的少量3FeCl 杂质时会引入新杂质氯化铜,C 不正确;D .氢氧化亚铁具有还原性,易发生:22234Fe(OH)+O +2H O=4Fe(OH) ,实验室制备氢氧化亚铁的关键是防止氧气的干扰,D 正确;答案选C 。
4.(2023年1月辽宁省普通高中学业水平合格性考试)下列可用于检验3Fe +的试剂是A .稀盐酸B .KCl 溶液C .4CuSO 溶液D .KSCN 溶液 【答案】D【解析】铁离子与稀盐酸、KCl 溶液和4CuSO 溶液均不反应,铁离子能发生特征反应:3-3Fe 3SCN Fe(SCN)++,所得溶液呈血红色,故可以用KSCN 溶液检验3Fe +,故选D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学易错题精选-铁及其化合物练习题附答案解析一、高中化学铁及其化合物1.金属及其化合物在人类生活、生产中发挥着重要作用.印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用FeCl3溶液作为“腐蚀液”,有CuCl2和FeCl2生成.如图是某工程师为了从使用过的腐蚀废液中回收铜、并重新获得FeCl3溶液所采用的工艺流程图:请回答下列问题:(1)实验室中检验溶液中存在Fe3+的试剂是________,证明Fe3+存在的现象是_________;(2)写出FeCl3溶液与金属铜发生反应的离子方程式:__________;(3)写出上述流程图中加入或生成的有关物质的化学式:①_________,②________,④_________;(4)含有②的滤液与⑤反应的化学方程式为__________;(5)如向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是_________。
A.有铜单质剩余但无铁单质剩余B.有铁单质剩余但无铜单质剩余C.铁、铜单质都有剩余D.铁、铜单质都无剩余【答案】KSCN溶液溶液呈红色 2Fe3++Cu═2Fe2++Cu2+ Fe FeCl2 HCl2FeCl2+Cl2═2FeCl3 B【解析】【分析】废液中含有FeCl2、CuCl2、FeCl3,向滤液中加入过量Fe,发生的离子反应方程式为2Fe3++Fe═3Fe2+、Cu2++Fe═2Fe2++Cu,然后过滤,滤液中含有FeCl2,滤渣中含有Cu、Fe,向滤渣中加入过量HCl,Fe溶解,Cu不溶解,然后过滤得到金属单质Cu,滤液中含有FeCl2,向 FeCl2滤液中通入过量Cl2,发生的反应为2Fe2++Cl2═2Fe3++2Cl﹣,从而得到溶液FeCl3溶液,以此解答。
【详解】(1)铁离子和KSCN溶液混合生成络合物硫氰化铁而使溶液呈血红色,可以用KSCN溶液检验铁离子,可观察到的现象是:溶液由黄色转化为血红色;(2)氯化铁具有氧化性,能氧化Cu生成铜离子,自身被还原生成氯化亚铁,离子反应方程式为2Fe3++Cu═2Fe2++Cu2+;(3)通过以上分析知,①②④分别是Fe、FeCl2、HCl;(4)含有②的滤液中含有亚铁离子、⑤为氯气,二者发生氧化还原反应生成铁离子和氯离子,化学方程式为:2FeCl2+Cl2═2FeCl3;(5)A.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,故A 不符合题意;B.加入铁和铜的混合物,铁首先与氯化铁反应,铜后参加反应,不会出现有铁无铜的情形,故B符合题意;C.若氯化铁的量少,加入的铁粉和铜粉可能剩余,故C不符合题意;D.若氯化铁的量多,加入的铁粉和铜粉全部参加反应,不会有剩余,故D不符合题意;故选B。
2.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
【点睛】本题是无机物推断,物质的颜色及转化关系中特殊反应是物质推断的突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,试题培养了学生的分析能力及逻辑推理能力。
3.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
【详解】(1)反应①称为铝热反应(属于置换反应),该反应的化学方程式:2Al+Fe2O3高温2Fe+Al2O3,反应中Al有0价变为+3价,化合价升高,失电子,被氧化,作还原剂;(2)反应④为FeCl2与双氧水反应生成FeCl3,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)C为FeCl2,D为FeCl3,亚铁离子具有还原性,易被氧化,新配制的FeCl2溶液中应加入铁粉(屑),以防止其转化为FeCl3。
检验三价铁离子常用试剂是KSCN(或NH4SCN),三价铁离子遇SCN-变为血红色溶液。
4.在下列物质转化关系中,反应的条件和部分产物已略去。
已知:甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
回答下列问题:(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,写出该物质的电子式:_______,该化合物中存在的化学键有:_________。
与甲在同一周期的金属元素(包括甲),按单质熔点由高到低的顺序排列依次为:_______(元素符号)。
(2)反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置是_______;写出反应Ⅱ的化学方程式_______。
(3)通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性_______(填“强”或“弱”),比较二者金属性强弱的依据还可以是_______(写出一种即可)。
(4)下列关于第三周期金属元素的单质及其化合物的说法正确的是_______(选填答案编号)a.工业上一般用电解法进行冶炼,获取单质b.金属阳离子都具有相同的电子排布式c.氢氧化物都能容易分解得到相应的氧化物d.金属氯化物都是电解质,都属于离子化合物【答案】离子键、共价键 Al、Mg、Na 第四周期Ⅷ族高温Fe3O4+H2强 NaOH是强碱,而Fe(OH)3是弱碱 ab3Fe+4H2O−−−→【解析】【分析】已知反应Ⅲ是工业制盐酸的反应,则丙为H2,丁为HCl;反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则甲为金属钠;反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为铁。
据此解答。
【详解】(1)由以上分析知,甲为金属钠,则焰色反应为黄色的物质为NaOH,电子式为,该化合物中存在的化学键有离子键、共价键。
与甲在同一周期的金属元素有Na、Mg、Al三种,它们的离子带电荷数依次增多,离子半径依次减小,所以按单质熔点由高到低的顺序排列依次为Al、Mg、Na。
答案为:;离子键、共价键;Al、Mg、Na;(2)由以上分析知,乙为铁,与H2O在高温下反应,生成的有磁性的物质为Fe3O4,铁为26号元素,电子排布式为1s22s22p63s23p63d64s2,则铁在周期表中的位置是第四周期Ⅷ族;反应Ⅱ的化学方程式为3Fe +4H 2O −−−→高温Fe 3O 4+H 2。
答案为:第四周期Ⅷ族;3Fe +4H 2O −−−→高温Fe 3O 4+H 2;(3)钠与水在常温下剧烈反应,铁与水在高温下才能反应,由此可得出钠的金属性比铁的金属性强,比较二者金属性强弱的依据还可以是NaOH 是强碱,而Fe (OH )3是弱碱来判断。
答案为:强;NaOH 是强碱,而Fe (OH )3是弱碱;(4)a .工业上一般用电解法冶炼NaCl 、MgCl 2、Al 2O 3,获取单质,a 正确;b .Na +、Mg 2+、Al 3+都具有相同的电子排布式1s 22s 22p 6,b 正确;c .NaOH 热稳定性强,很难分解得到相应的氧化物,c 不正确;d .金属氯化物都是电解质,但AlCl 3属于共价化合物,d 不正确;答案为:ab 。
【点睛】在书写铁与H 2O 在高温下反应,我们易忽视“有磁性的物质”,而把产物写成Fe 2O 3和H 2,从而产生错误。
5.甲、乙、丙三种物质之间有如下转化关系:3224NH H O H SO Δ⋅−−−→−−−−→−−→甲乙丙甲(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。
则甲是________(填化学式)。
写出“32NH H O ⋅−−−−→乙丙”转化的离子方程式______________________。
(2)若乙溶液中加入KSCN 溶液,有血红色出现,则乙溶液中含有的离子是___________,甲的化学式为_____________。
