化工原理精馏
化工原理 ---精馏

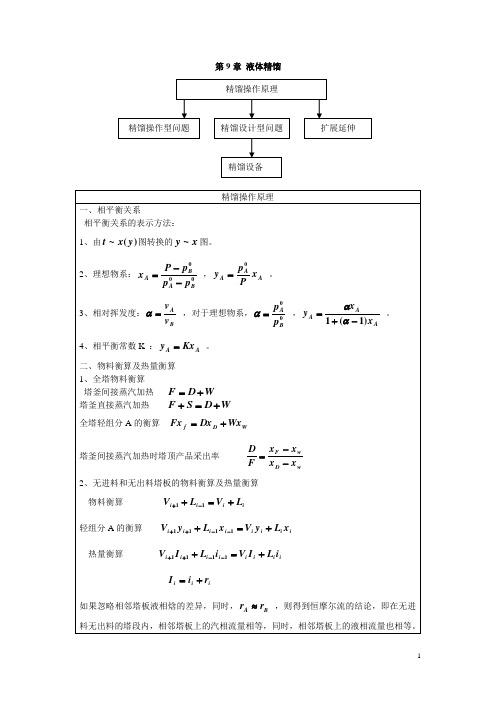
6.3 双组分连续精馏塔的计 算6.3.1 全塔物料衡算
V
总物料:
F=D+W
易挥发组分:
F xF=D xD+W xw
原料液
F , xF , IF
应用见P263例7-1
L’
精品课件
15
馏出液 L D , xD , ID
V’ 釜残液 W , xW , IW
16
6.3 双组分连续精馏塔的计 算
33
6.3 双组分连续精馏塔的计 说算明:
1 ) NT是指精馏塔所需的理论塔板数,其数值 必须指明是否包括塔釜在内(塔釜也相当于一块理论 塔板)。
2)由教材P270 例 7-7可知,进料热状况不同,
所需 NT及进料板位置均不同。
3)随着进料的 q值逐渐减小,精馏塔所需的 NT是逐渐增加的。
4)直接蒸气加热与间接蒸气加热的区别主要体
yn
13
6.2 精馏原理
有回流的多次部分汽化、冷凝
xD xF
✓具有不同挥发度的组分
所组成的混合液,经多次 进行部分气化和部分冷凝, 使其分离成几乎纯态组分 的过程。
✓实现的 条件:
回流; 塔釜产生的蒸汽
xw
精品课件
14
6.3 双组分连续精馏塔的计 算
涉及的主要问题:
全塔物料衡算、恒摩尔流假设、操作线 方程 、q线方程、(最小)回流比 、适宜回流 比 、(最少)理论塔板数、全塔效率、实际塔板 数
凝
t
y1>xF>x1
y1——加热原料液时产 生的第一个 气泡的组
成。
x1——经过一次气化后 原料剩下的液体的组成。
P=定值
D C B
A
化工原理实验—精馏

化工原理实验—精馏1. 概述精馏是一种常用的分离技术,广泛应用于化工工艺中。
它通过将混合液加热至蒸发,然后在冷凝器中冷却并凝结回液体,从而实现混合物中组分的分离。
本实验旨在通过精馏实验,掌握精馏原理、操作步骤和相关设备的使用方法。
2. 实验原理2.1 精馏原理精馏是基于液体混合物中各组分的不同沸点而进行的分离过程。
在加热的作用下,沸点较低的组分会先蒸发,经过冷凝器冷却后变为液体回流,而沸点较高的组分则会滞留在容器中。
通过收集冷凝后的液体,我们可以分离出混合物中的不同组分。
2.2 实验设备在精馏实验中,主要使用以下设备:•加热设备:电热板、油浴等;•冷凝器:通常采用水冷型冷凝器,通过循环冷却水实现液体冷凝;•分馏柱:用于增加接触面积,提高分离效果;•采样装置:用于采集样品,检测组分浓度等。
2.3 操作步骤精馏实验的基本步骤如下:1.准备实验设备:包括加热设备、冷凝器、分馏柱等;2.准备混合液:按照实验要求,将需要分离的混合液制备好;3.装配设备:将冷凝器安装在分馏柱上方,连接好相应的管道和热源;4.开始加热:逐渐加热混合液,将其中的沸点较低组分蒸发出来;5.冷却和回流:通过冷凝器使蒸发的组分冷却并凝结成液体,回流到容器中;6.收集液体:将回流液体收集,并记录途中温度和时间等相关数据;7.结束实验:实验完成后,及时关闭加热设备和冷凝器,整理实验装置。
3. 实验操作及数据记录3.1 实验设备准备首先,确保实验室环境安全,检查仪器设备是否齐全,并找到精馏实验所需的各种设备:•电热板:用来提供加热源;•分馏柱:用来增加接触面积,提高分离效果;•冷凝器:通常为水冷型冷凝器,确保冷却效果良好。
3.2 实验样品准备按照实验要求,取出需要分离的混合液样品。
注意记录样品的成分和浓度等信息。
3.3 装配设备将冷凝器安装在分馏柱上方,并连接好相应的管道和热源。
确保连接紧密,无泄漏。
3.4 开始实验1.打开电热板,设置适当的加热温度;2.将混合液置于分馏烧瓶中,放入加热设备中;3.监测温度变化:通过温度计等工具,记录样品温度的变化。
化工原理课件 9.4 精馏

q [rF cP (tb tF )] rF
b. 饱和液体进料(泡点进料) 饱和液体温度等于泡点
iF i
q 1
V V
0 q 1
L LF
c.汽液混合物进料 汽液混合物的温度介于泡点和露点之间
i iF I
V V
LL
q=x(液相分率) 已知进料中汽相与液相的摩尔数之比为2:1,轻组分的摩尔分 数为0.55,则q=_____. A. 1/3 B. 0.55 C.不能确定
传质单元高度
精 馏
实 际 塔 板 数
理论板数
反映分离任务的难易, 与设备型式无关
反映设备效能的高低
全塔效率
④塔板物料、热量衡算及传递速率的最终简化 引入理论板的概念及恒摩尔流假设使塔板过程的物料衡 算、热量衡算及传递速率最终简化为 物料衡算式
Vy n1 Lxn1 Vy n Lxn
相平衡方程
LL q F 以1kmol/h进料为基准,提馏段中的液体流量较精馏段的液 体流量增大的kmol/h数即为q值
L L qF
V V (1 q)F
I iF q I i
iF i I
q 1
L L qF
V V, L L
V V (1 q)F
a. 过冷液体进料 过冷液体温度低于泡点
I iF q I i
L L qF
V V (1 q)F
d.饱和蒸汽进料(露点进料) 饱和蒸汽的温度等于露点
iF I
q0
V V F
LL
e.过热蒸汽进料(过热蒸汽的温度高于露点)
iF I
q0
V V, L L
q cP (tF td ) rF
化工原理精馏实验

化工原理精馏实验化工原理精馏实验是化工工程中的一项重要实验内容,它主要用于分离和提纯混合物中的组分。
本文将介绍化工原理精馏实验的基本原理、实验步骤以及实验中需要注意的事项。
1. 实验目的化工原理精馏实验的主要目的是通过温度差异,利用液体蒸汽和凝结的原理,将混合物中的组分分离并得到纯净的产品。
通过这个实验,我们可以了解精馏作为一种分离技术的原理和应用。
2. 实验原理化工原理精馏实验的基本原理是利用混合物中各组分的不同沸点,通过升温使其中具有较低沸点的组分先蒸发,然后通过冷凝使其变为液体,从而实现分离。
在实验过程中,我们需要使用精馏塔,该塔内部设置有填料,用于增加混合物和蒸汽之间的交流面积,并实现更充分的分离。
3. 实验步骤(1) 准备实验所需设备和药品,包括精馏装置、混合物、填料等。
(2) 将混合物加入精馏瓶中,并将瓶塞密封。
(3) 将冷凝管和进料管连接到精馏瓶上,确保连接牢固。
(4) 将精馏瓶放入加热设备中,逐渐升温。
(5) 观察精馏瓶内的液体是否开始蒸发,当温度上升到某一点时,开始收集冷凝液。
(6) 根据实验需要,调整加热温度和收集冷凝液的时间,以实现所需组分的分离和提纯。
4. 实验注意事项(1) 在进行化工原理精馏实验前,需先对所需设备进行检查和清洁,确保实验过程的安全性。
(2) 在实验操作中,热量的传递速度会影响分馏过程的效果,因此需要掌握合适的加热速率。
(3) 为了避免精馏烧坏填料或其他设备,需要控制温度,确保温度在安全范围内。
(4) 实验结束后,应将设备进行清洗和消毒,防止残留物对下次实验的影响。
5. 实验结果分析通过化工原理精馏实验,可以得到分离出的纯净组分,并进行定量分析。
根据实验结果,可以进一步探讨精馏的分离效果、提纯效率等指标,并对所得纯净组分进行性质分析。
总结:化工原理精馏实验是一项重要的实验内容,通过实验可以了解精馏作为一种分离技术的原理和应用。
在实验过程中,需要注意设备的清洁和安全操作,合理控制加热温度和加热速率,以达到较好的分馏效果。
(化工原理)精馏原理

精馏的原理和过程
原理
基于物质的沸点不同,通过加热和冷凝的方法,将不同沸点的物 质分离出来。
过程
将液体混合物加热至沸腾,产生的蒸汽在冷凝器中冷凝,再通过 回流装置将冷凝液返回精馏塔中,重复进行加热和冷凝的过程, 直至达到分离目的。
操作温度应根据进料组成 和产品要求进行选择,以
实现最佳分离效果。
操作压力应根据进料组成 和产品要求进行选择,以
实现最佳分离效果。
操作条件的优化
实验法
通过实验方法测定不同操作条件下的分离效果,找 出最优的操作条件。
模拟法
利用计算机模拟软件对精馏过程进行模拟,通过优 化算法找出最优的操作条件。
经济分析法
石油化工原料的制备
通过精馏技术可以制备石油化 工原料,如乙烯、丙烯等,这 些原料是生产塑料、合成橡胶 等材料的重要基础。
精馏在其他领域的应用
01
02
03
食品工业
精馏技术可用于食品工业 中,如分离果汁中的果糖 和乙醇饮料中的酒精等。
制药工业
精馏技术可用于药品的生 产和提纯,如分离抗生素、 维生素等。
精馏的分类
02
01
03
根据操作方式的不同,精馏可以分为连续精馏和间歇 精馏。
根据进料位置的不同,精馏可以分为侧线精馏、塔顶 精馏和塔底精馏。
根据操作压力的不同,精馏可以分为常压精馏、加压 精馏和减压精馏。
02
精馏塔的构造和工作原理
精馏塔的结构
塔体
进料板
塔板
溢流管
冷凝器
精馏塔的主要部分,用于 容纳待分离的液体混合物 和进行传热传质过程。
化工原理精馏PPT课件

D,xD
•
(xD,xD)
3
(二) 提馏段操作线方程
总物料衡算:L=V+W
m Lxm V ym+1
m+1
易挥发组分衡算 :Lxm= Vym+1+ WxW
yN
ym 1LL Wxm LW WxW 或 ym 1V Lxm V WxW
N xN
V
LxN
W,xw
提馏段操作 线方程
•(xW,xW)
4
【例1】在连续精馏塔中分离某理想二元混合物。已知原料液流量 为100kmol/h,组成为0.5(易挥发组分的摩尔分率,下同),提馏 段下降液体量与精馏段相等,馏出液组成为0.98,回流比为2.6。若 要求易挥发组分回收率为96%,试计算: (1) 釜残液的摩尔流量; (2) 提馏段操作线方程。
IV IL
(1)饱和液体进料——泡点进料
LV F
此时,IF=IL
q=1
原料液全部与精馏段下降液体汇合进入 提馏段。
L V
饱和液体
L =L+F
V =V
11
(2)饱和蒸汽进料
IF=IV
q=0
q IV IF IV IL
原料全部与提馏段上升气体汇合进入 精馏段。
L =L V=V +F
(3)冷液进料
内容回顾
一、精馏原理
(1)无中间加热及冷凝器的多次部分气化和多次部分冷凝 (2)顶部回流及底部气化是保证精馏过程稳定操作的必不可 缺少的条件。 (3)精馏操作流程 (4)相邻塔板温度及浓度的关系
tn1tntn1 xn1xnxn1 yn1ynyn1
1
二、理论塔板
三、恒摩尔流假定 四、全塔物料衡算
化工原理-精馏

y x 1 ( 1)x
y
思考: 若=1,则情形如何?
y x ,不能用普通蒸
馏方法分离提纯。
x
5.2.3.非理想溶液的汽液相平衡
正 偏 差 溶 液 负 偏 差 溶 液
与拉乌尔定律有偏差的溶液称为~。
此时, f A A f BB f AB
pA p*A xA
pB
pB* xB
(1)正偏差溶液
第二节 二元物系的汽液相平衡
5.2.1 相律
自由度=组分数-相数+2 即F = C –φ+2
t, P, y
A
B
t, x 溶液(A+B)
加热
故双组分气液平衡物系的自由度为2,在t、p、y、x 4个变量
中,任意确定其中的两个变量,则物系的状态被唯一地确定,余 下的参数已不能任意选择。
一般精馏在恒压(p一定)下操作,物系只剩下1个自由度。 故:
精馏
汽油
煤油
柴油 原 油
润滑油
石蜡
沥青
三. 蒸馏的分类
二元蒸馏 根据被蒸馏的混合物的组分数,可分为:多元蒸馏
连续蒸馏 根据操作过程是否连续,可分为:间歇蒸馏
常压蒸馏 根据操作压力,可分为加压蒸馏
减压蒸馏
简单蒸馏 根据操作方式,可分为:平衡蒸馏
精馏 四、蒸馏操作的费用
主要费用:加热和冷却费用,即能耗大
汽相线
I点:tI=101.5℃;饱和汽体
G
F
J点:tJ=120℃;过热汽体
泡点线 液相线
t-x 或 y 图
杠杆定律: M液CH=M汽HD
注意:
①纯物质在一定压力下饱和温度称为沸 点,是一定值,且无泡点、露点之分;
化工原理 精馏

6.2 平衡蒸馏与简单蒸馏
露点线
t/C
泡点线
0
xA xf
yA 1.0
x(y)
任一时刻,易挥发组分在蒸汽中的含量 y 始终大于剩余在釜内的液
相中的含量 x,釜内易挥发组分含量 x 由原料的初始组成 xF 沿泡点 线不断下降直至终止蒸馏时组成 xE,釜内溶液的沸点温度不断升高 ,蒸汽相组成 y 也随之沿露点线不断降低。
图 3.3 无中间产品的 多次部分 气化的分离示意图
3.精馏原理
混合液体连续或多次部分汽化,液相组成沿 t-x(y) 相图的 泡点线变化,可得难挥发组分含量很高而易挥发组分含量很低的 釜液。
组成也可算出溶液泡点。
纯组分 饱和蒸汽压与温度的关系,用安托因(Antoine)方程表示:
logp0 A B tC
A、B、C 为安托因常数,可由相关的手册查到。
6.1 双组分溶液的气液相平衡关系
当汽相为理想气体时
yA
pA P
pA0xA P
xA
P pB0 pA0 pB0
yA
pA0 P
PpB0 pA0 pB0
减
压
加热器 F, xF, tF
阀
t0 Q
D, yD, te yD
闪 蒸 罐
xW W, xW, te
2 平衡蒸馏与简单蒸馏
2.1 平衡蒸馏
2. 物料衡算 总物料衡算
FD W
减
压
加热器 F, xF, tF
阀
t0 Q
D, yD, te yD
闪 蒸 罐
xW W, xW, te
易挥发组分的物料衡算 FFxDDy WWx
3.1 多次部分气化和部分冷凝 过程分析
t/C
化工原理第九章液体精馏

FiF Li V I Li VI
由恒摩尔假定,不同温度和组成的饱和液体焓i和汽 化潜热均相等。
20
联立上二式,得 定义:
L L I iF F I i
q
I iF分子:1kmol原料变成饱和蒸气所需的热 I i 分母:原料的摩尔汽化热
可得
L L qF
V V (1 q)F
q为加料热状态参数 q=0,饱和气体(露点);q=0,饱和液体(泡点) q<0,过热蒸气;0<q<1,气液两相,q>1,冷液
不管加料板上状态如何,离开加料板的两相温度相
等,组成互为平衡。
V,I,ym
L,i,xm-1
物料衡算式
F,iF,xF
FxF V ym1 Lxm1 Vym Lxm 相平衡方程
ym f (xm )
3)精馏段和提馏段流量的关系
V’,I,ym+1
L’,i,xm
列加料板物料和热量衡算式
F LV LV
临界压强时,气液共存区 缩小,分离只能在一定范 围内进行,不能得到轻组 分的高纯度产品。
8
9.3 平衡蒸馏和简单蒸馏
D
9.3.1 平衡蒸馏
令W q, F
则D 1q F
物料衡算:F xF D y W x
F
F DW
xF
联立得:y q x xF q 1 q 1
热量衡算:忽略组成对比热影响,
2)对理想物系
A / B
pA / xA pB / xB
p
0 A
xA
/
xA
pB0 xB / xB
pA0
pB0
3)对物系相对挥发度 1和相差2 不大
m
1 2
(1
化工原理精馏PPT课件全

用饱和蒸气压表示的气液平衡关系
2)用相对挥发度表示 ☆挥发度定义
某组分在气相中的平衡分压与该组分在液相中
的摩尔分率之比
挥发度意义
vi
pi xi
某组分由液相挥发到气相中的趋势,是该组分 挥发性大小的标志
双组分理想溶液
vA
pA xA
pAo xA xA
pAo
vB
pB xB
pBo xB xB
pBo
☆相对挥发度定义
pA pyA
pB pyB p(1 yA )
p
o A
xA
pyA
yA
p
o A
xA
p
pBo xB pyB
yB
pBo xB p
yA
p
o A
x
A
p
xA
p pBo pAo pBo
yA
pAo p
p pBo pAo pBo
xA
p pBo pAo pBo
,
yA
pAo p
p pBo pAo pBo
解 (1)利用拉乌尔定律计算气液平衡数据
xA
p pBo pAo pBo
yA
p
o A
x
A
p
t/℃ x y
80.1 84 88 92 96 100 104 108 110.8 1.000 0.822 0.639 0.508 0.376 0.256 0.155 0.058 0.000 1.000 0.922 0.819 0.720 0.595 0.453 0.305 0.127 0.000
xF,y,x---原料液、气相、液相产品的组成,摩尔分数
y
1
F D
x
化工原理精馏

化工原理精馏
精馏是化工过程中常用的分离方法,用于将混合物中的组分按照其挥发性分离为不同纯度的产品。
精馏过程中,混合物首先加热至沸腾点,然后将生成的蒸气输送到冷凝器中进行冷凝。
冷凝后,液体收集器中会得到不同纯度的产品。
精馏过程基于混合物中不同组分的挥发性差异。
挥发性大的组分在加热后较早转化为蒸气,而挥发性小的组分则在较高温度下才蒸发。
经过冷凝后,收集器中会得到高挥发性组分的纯产品。
余下的低挥发性组分则在塔底收集。
精馏过程中,塔是一个重要的设备。
塔内通常包括填料或板片,用于增大接触面积,促进挥发和冷凝。
高挥发性组分在塔上部可迅速逸出,而低挥发性组分则被慢慢分离。
精馏还可用于提纯液体产品。
通过多级精馏,可以获得更高纯度的产品。
多级精馏是基于挥发性差异的温度差异实现的,每一级都以前一级的塔顶产品作为进料。
总之,精馏是一种重要的化工分离方法,通过控制温度和塔内工艺参数,可以将混合物分离为不同纯度的产品。
化工精馏原理

化工精馏原理
精馏是一种分离技术,用于将混合物中的组分通过升华和冷凝的方式进行分离。
该过程基于分子之间的不同挥发性和沸点的差异。
精馏的基本原理是利用组分在不同温度下的汽化和冷凝特性。
在精馏塔内,混合物被加热,使得易挥发的组分蒸发成气体,然后通过冷凝器冷却,转变回液体。
随后,这些液体进入分馏塔的不同部位,从而实现对组分的分离。
在精馏塔内,由于塔的高度,温度逐渐降低。
这导致组分的挥发性逐渐降低,使其向下凝结,并最终收集在不同的容器中。
高挥发性的组分在较低温度下首先凝结,低挥发性的组分在较高温度下凝结。
精馏塔内的分馏效果取决于各种因素,包括初始混合物的成分、入口温度、压力、塔的结构和精馏塔体系的设计等。
通过调整这些参数,可以实现较高效率的分离效果。
化工精馏广泛应用于石油、化工、制药等行业。
它可以用于分离原油、制取石油产品,提取溶剂、纯化有机化合物,以及获得高纯度的化学品等。
精馏技术的不断改进和创新也不断提高着分离效率和产品质量。
(化工原理)精馏原理

精馏原理是一种将混合物按照沸点差异进行分离的方法。它在化工工业中有 广泛的应用。
什么是精馏原理
1 背景
精馏原理是一种将混合物中的组分根据其沸点进行分离的技术。
2 原理
利用物质因沸点差异而产生的气液相变,实现混合物的蒸馏分离。
3 应用
精馏原理在石化、化工、制药等行业中广泛用于纯化和分离各种物质。
精馏原理的应用范围
石油精制
用于对原油进行分馏,将原油中的不同级别燃 料分离。
制药工艺
用于制备纯净的药品原料和中间体。
化学制品生产
用于生产பைடு நூலகம்净的化学品,如有机溶剂、醇类、 酸类等。
食品加工
用于提取和分离食品中的成分,如酒精、香料、 酸等。
前置装置的作用
1 过滤器
去除前处理物料中的杂质和固体颗粒。
2 加热器
提供能量,使混合物中的液体达到沸点从而蒸发。
3 冷凝器
降低蒸发气体温度,使其凝结成液体。
精馏塔的种类
板式塔
通过不同的板式结构实现组 分的分离作用。
填料塔
使用填料提供更大的表面积 用于气液接触。
萃取塔
通过液相浸泡实现组分的分 离。
精馏塔的组成结构
下部
包括加热器、冷凝器和分离器 等。
中部
包括塔板或填料层,用于增加 接触面积。
上部
包括塔顶冷凝器和回流器等。
传热方式和传质方式
传热方式
主要通过对流和辐射传热进行。
传质方式
主要通过物质的扩散进行。
精馏过程中的热力学原理
精馏过程中,利用混合物中各组分的沸点差异,实现高沸点组分的分离。
化工原理课程知识模块(6)(精馏)
Rmin =
x D始 − y f yf − xf
R = (1.2 ~ 2) Rmin
操作初态塔内的操作方程
y=
x R x+ D R+1 R+1
逐板计算法或图解法得到所需要的理论塔板数。
x D始 的验算:与简单蒸馏相似, F , x f , W , x w 这 4 个量之间的关系为
F ln = W
xf
xAq 是精馏段操作线方程式、提馏段操作线方程式的交点坐标值。掌握了芬斯克公式,再
3
应用吉利兰关联式,是求理论板数的简捷计算法。 3、单板效率及总板效率 以汽相组成变化来表示的单板效率
E mv ,i =
y i − y i +1 y i∗ − y i +1 x i −1 − x i x i −1 − x i∗
Dx D 。主要求解: (1)操作回流比 R ; (2)所需要的理论塔板数。 Fx f
1、回流比的确定 首先确定操作线与平衡线的夹紧点坐标( x e , y e ) 。若夹紧点出现在精馏段上或进料板 上,则
Rmin =
x D − ye ye − xe
若夹紧点出现在提馏段上,则根据此时精馏段的斜率求出最小回流比 Rmin
以液相组成变化来表示的单板效率
E mL , i =
E0 =
塔的总板效率
NT Np
4、塔径的确定 根据塔内汽相的实际体积流量及流速计算塔径
D=
π
Vs 4 u
汽相流速根据 Smith 曲线确定的汽相负荷因子进行确定。 精馏操作型问题 精馏操作型问题的命题方式:已知塔内所具有的理论板数和进料位置、进料流量、组 成和热状态、操作回流比、产品分配比,求解:塔顶产品组成 x D 、塔底产品组成 xW 以 及各塔板上汽相组成及液相组成。 求解方法: ,根据物料衡算式 Fx f = Dx D + WxW 计算 x D (或者 xW ) ; 1)先设 xW (或者 x D ) 2)从塔顶开始逐板计算,计算所得到的 xW 值与假设值进行比较,若相吻合,则结束计 算;若相差较大,则以所得到的 xW 值作为假设值,重复以上的计算,直至计算所得到的
精馏实验(化工原理实验)

精馏实验一、实验目的1、了解筛板式精馏塔及其附属设备的基本结构,掌握精馏操作的基本方法;2、掌握精馏过程全回流和部分回流的操作方法;3、掌握测定板式塔全塔效率。
二、实验原理1、全塔效率E T全塔效率又称总板效率,是指达到指定分离效果所需理论板数与实际板数的比值,即-1=T T P N E N (1)式中:T N -完成一定分离任务所需的理论塔板数,包括塔釜;P N -完成一定分离任务所需的实际塔板数。
全塔效率简单地反映了整个塔内塔板的平均效率,表明塔板结构、物性系数、操作状况等因素对塔板分离效果的影响。
对于双组分体系,塔内所需理论塔板数N T ,可通过实验测得塔顶组成x D 、塔釜组成x W 、进料组成x F 及进料热状况q 、回流比R等有关参数,利用相平衡关系和操作线用图解法或逐板计算法求得。
图1塔板气液流向示意图2、单板效率ME 单板效率又称莫弗里板效率,如图1所示,是指气相或液相经过一层实际塔板前后的组成变化值与经过一层理论塔板前后的组成变化值之比。
按气相组成变化表示的单板效率为1*1y =n n MV n n y E y y ++--(2)按液相组成变化表示的单板效率为1*1n n ML n n x x E x x ---=-(3)式中:y n 、1n y +-分别为离开第n 、n+1块塔板的气相组成,摩尔分数;1n x -、n x -分别为离开第n-1、n 块塔板的液相组成,摩尔分数;*ny -与x n 成平衡的气相组成,摩尔分数;*nx -与y n 成平衡的液相组成,摩尔分数。
3、图解法求理论塔板数N T图解法又称麦卡勃-蒂列(McCabe-Thiele)法,简称M-T 法,其原理与逐板计算法完全相同,只是将逐板计算过程在y-x 图上直观地表示出来。
对于恒摩尔流体系,精馏段的操作线方程为:111D n n x R y x R R +=+++(4)式中:1n y +-精馏段第n+1块塔板上升的蒸汽组成,摩尔分数;n x -精馏段第n 块塔板下流的液体组成,摩尔分数;D x -塔顶溜出液的液体组成,摩尔分数;R -回流比。
化工原理 第六章 精馏

化工原理第六章精馏第六章精馏一、精馏过程的数学描述在化工生产中,常根据混合液中各组分挥发度的不同,以精馏实现均相混合液的分离,二元连续精馏的基本流程如图6-1所示。
精馏过程的实质是伴有传热的传质过程,传质推动力取决于相互接触汽液两相偏离平衡的程度。
因此精馏过程的严格分析除了要应用相平衡、物料衡算两关系外,还需结合热量衡算及传质速率方程。
为了避开后两关系使分析得以简化,在工程上常引入似下两个概念:(1)理论板,(2)恒摩尔流,前者将影响板上传质速率的全部因素包括在塔板效率中;后者则是对热量衡算的简化。
于是精馏过程的数学描述可归结为全塔物料衡算、逐板组成变化两关系。
以图6-1的流程分离理想溶液;其已知量、未知量之间的关系可用图6-2表示。
图6-2表明,描述二元连续精馏的基本方程为 )(1W F D W D F x x R q N N f x Wx Dx Fx W D F ,,,,,,α=+=+= 由于三式中共涉及11个基本变量)(1R q N N x x x W D F W D F ,,,,,,,,,,α,因此其自由度为8,即须给定其中8个独立变量,才能确定另外3个变量。
二、精馏操作型问题的特点及基本类型精馏操作型问题的特点是:精馏塔已经给定(设塔板效率已知)。
即N 、N 1(或进料位置,通常不一定是最佳进料位置)为巳知量,其主要类型如下。
(1)对现有的精馏塔,在给定精馏条件下,核算其可能达到的分离程度。
如:已知N 、N 1、α、F 、x F 、q 、R 及W ,求D 、x D 、x W 。
(2)对运行中的精馏塔,当某一操作条件改变时,分析分离效果的变化,是否能获得合格的产品及为此需采取的措施;还会产生什么其他的影响。
如:(6-1)①已知N、N1、α、F、x F、q、R不变,若V'减少时,分析D、x D、x W的变化趋势;②已知N、N1、α、F、x F、q、V'不变,若x F下降,能否采取什么措施使x F不降低?通常对类型2,操作条件的变化将引起塔内液,汽流量的改变,并影响塔板效率,若这一影响甚小而能忽略,便可把操作中精馏塔的理论板数视为不变。
化工原理实验—精馏

化工原理实验—精馏化工原理实验—精馏精馏是一种重要的分离技术,主要用于分离、纯化液体混合物中的各种成分。
在实际生产和科研实验中,精馏已经成为不可或缺的重要技术。
本文将就化工原理实验中的精馏实验进行详细介绍。
一、实验原理精馏的基本原理是根据不同成分在液态和气态之间的平衡关系,在加热条件下将混合物中单一成分蒸发和冷凝来实现分离、提纯目标成分。
实验中要分离的混合物首先被加热到沸腾点以上,因为各种成分的沸点不同,有些成分的沸点比另一些成分高得多,因此在离开混合物比较早的时候,一些液体成分便会压缩成气体形式,通过冷凝的方式回到液体形式,从而分离。
二、实验步骤1.实验前准备:确定实验目的,熟悉仪器使用方法和名词术语,检查实验物品是否准备充分。
2.实验流程:(1)调整设备:将水箱放在上部,并根据实验需要将装有混合物的烧瓶安装在下部。
(2)加热混合物:先在小火下加热,让混合物慢慢升温,确定加热速度以防止挥发速度过快。
随着温度的升高,由混合物挥发出来的单一成分便会通过塞子进入冷凝器,冷凝器中的水为其退回到液体形态,收集并量取所需要的物质。
3.实验结束:(1)关闭所有开关:实验完成后,将电源关闭,并将实验设备切断电源和气源。
(2)清洗设备与仪器:清洗所有已使用的材料和设备,以确保下次的实验能保证卫生和安全。
三、实验注意事项1.将水箱放置在塞子上方,仔细检查所有漏洞的位置和具有修复能力的地方,以避免机械故障与事故到来。
2.在进行实验时,必须小心谨慎地装填液体混合物,尤其是对于易燃物质,必须保持警惕,并根据实验条件和混合物来选择实验设备和材料。
3.在加热过程中,如果需要调整加热器的温度,必须慢慢调整,直到较稳定的加热水平达到。
总之,精馏实验是一项非常重要的化工原理实验,同学们在进行实验时一定要小心谨慎,严格遵守实验规范,才能保证实验的顺利进行。
精馏的化工原理和应用

精馏的化工原理和应用1. 引言精馏是一种常见的分离技术,在化工过程中有广泛的应用。
它通过利用液体混合物的不同沸点,将其分离为纯净的组分。
本文将介绍精馏的基本原理和常见的应用领域。
2. 精馏的基本原理精馏的基本原理是通过控制温度和压力,在复杂的液体混合物中分离出不同沸点的组分。
它基于以下两个基本概念:2.1 液体沸点液体沸点是指在一定的压力下,液体开始转化为气体的温度。
不同组分的液体在不同的沸点下发生沸腾,从而可以通过控制温度将液体分离出来。
2.2 蒸馏过程精馏通过蒸馏过程来实现分离。
蒸馏过程包括以下几个步骤:1.将液体混合物加热到使其中最易挥发组分开始汽化的温度。
2.挥发的气体通过蒸馏塔上升,经过冷凝器冷却为液体,称为馏出液。
3.馏出液再次加热,挥发为气体,再次经过冷凝器冷却变为液体,称为返流液。
4.不易挥发组分在蒸馏塔内逐渐富集,最后得到纯净的组分。
3. 精馏的应用精馏作为分离技术,在化工领域有广泛的应用。
下面介绍一些常见的应用领域:3.1 原油精馏原油精馏是利用精馏的原理将原油分解成不同的组分,例如汽油、柴油、润滑油等。
这种分离处理可以使原油中的各种组分得到高效的利用,提高资源利用率。
3.2 酒精提纯酒精的提纯一般使用精馏技术。
通过控制温度,将酒精从其他杂质中分离出来,得到高纯度的酒精。
3.3 盐水淡化盐水淡化是将含盐的海水或咸水中的盐分去除,得到淡水的过程。
精馏技术可以通过控制温度和压力,将水蒸发并冷凝为淡水,实现盐水淡化。
3.4 精炼化学品制备在化学品制备过程中,常常需要对原材料进行精炼,去除其中的杂质。
精馏作为一种常见的精炼方法,在化学品制备过程中有重要应用。
3.5 食品加工在食品加工中,精馏技术可以用于去除食品中的某些成分,提高产品的纯度和质量。
例如,酒精加工、精制油脂等。
4. 总结精馏是一种常见的化工分离技术,利用液体混合物的不同沸点将其分离为纯净的组分。
本文介绍了精馏的基本原理和常见的应用领域,包括原油精馏、酒精提纯、盐水淡化、精炼化学品制备和食品加工等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/8/1
1.2.2汽液平衡相图:x-y 图 ➢x-y 图代表在总压一定下,液相组成和与之成平衡的汽相组成的关系。 ➢x-y 图可通过 T-x(y) 图作出,图中对角线 (y=x) 为一参考线。 ➢大多数溶液,两相平衡时,y 总是大于 x,平衡线位于对角线上方。 ➢平衡线偏离对角线越远,该溶液越易分离。
ViL — 纯液体 i 的摩尔体积。
根据相平衡常数的定义
Ki
yi xi
fiL i Pi
式中 i,i 的计算与气(汽)相组成和液相组成有关,相平衡常数 K 不
仅与系统温度、压强有关,也与组成有关。
当系统压力较低,气相近似为理想气体时,气相逸度系数 i 接近于1,
有
Ki
pi0 P
i
液相为非理想溶液,汽相为理想 气体的相平衡常数计算式
1.3 汽液平衡关系式的表示方法 汽液两相平衡组成常用相平衡常数 K 或相对挥发 的关系式来表达。
1.3.1相平衡常数
Ki 表示 i 组分的相平衡常数,其定义为
Ki
yi xi
=f(物系 , T,P )
式中: yi 和 xi 分别表示 i 组分在互为平衡的汽、液两相中的摩尔分数。 对于易挥发组分,Ki >1,即 yi > xi。
1.1 理想物系的汽液平衡
理想物系:
液相为理想溶液、汽相为理想气体的物系。理想溶液服从拉乌尔 (Raoult)定律,理想气体服从 道尔顿分压定律。 根据拉乌尔定律,两组分物系理想溶液上方的平衡蒸汽压为
pA
p
A
x
A
pB pB xB
式中:poA、poB ——溶液温度下纯组分饱和蒸汽压。
6.1 双组分溶液的气液相平衡关系
p
0 A
pB0
上式为一定总压下汽相组成与温度的关系式。该温度又称为露点 (dew-point),上式又称为露点方程。
严格地说没有完全理想的物系。对那些性质相近、结构相似的组分 所组成的溶液,如苯-甲苯,甲醇-乙醇等,可视为理想溶液;若汽相 压力不太高(<10Mpa),可视为理想气体,则物系可视为理想物系。
Ki 值越大,组分在汽、液两相中的摩尔分数相差越大,分离也越容易。
对多组分物系汽液平衡关系的计算,应用相平衡常数比较方便。
气(汽)液相平衡时,两相的温度和压强相等,每个组分在两相中的逸 度(fugacity)相等,即
fˆiG fˆiL
对非理想物系,气(汽)、液相的逸度服从下列方程:
fˆiG Pyii
fˆiL fiL xi i
式中:i — 气(汽)相 i 组分的逸度系数; i — 液相 i 组分的活度系数;
fiL — 纯液体 i 在系统温度、压力下的逸度,可由下式计算
fiL
pi0i0 expViL
P RT
pi0
式中: pio — 纯组分i 的饱和蒸汽压;
io — 纯组分 i 的逸度系数;
溶液沸腾时,溶液上方的总压应等于各组分分压之和,即
P
pA
pB
p
0 A
xA
pB0 1
xA
xA
P pB0
p
0 A
pB0
泡点方程(bubble-poiB 取决于溶液沸腾温度,上式表达一定总压下液相组成与溶液泡
点温度关系。已知溶液的泡点可由上式计算液相组成;反之,已知溶液
组成也可算出溶液泡点。
纯组分 饱和蒸汽压与温度的关系,用安托因(Antoine)方程表示:
log p0 A B t C
A、B、C 为安托因常数,可由相关的手册查到。
6.1 双组分溶液的气液相平衡关系
当汽相为理想气体时
yA
pA P
p
0 A
x
A
P
xA
P pB0 pA0 pB0
yA
p
0 A
P
P pB0
对非理想物系不能简单地使用上述定律。汽液相平衡数据更多地依靠 实验测定。
1 双组分溶液的气液相平衡关系
1.2.1 汽液平衡相图: T-x(y) 图
T-x(y) 图代表的是在总压 P 一定的条 件下,相平衡时汽(液)相组成与 温度的关系。
在总压一定的条件下,将组成为 xf 的溶液加热至该溶液的泡点 tA,产 生第一个气泡的组成为 yA。
多组分精馏:例如原油的分离。 双组分精馏:如正异构丁醛,苯-甲苯体系等。
简单蒸馏或平衡蒸馏:用在分离要求不高的情况下。 精馏:分离纯度要求很高时采用。 特殊精馏:混合物中各组分挥发性相差很小,难以用普通精馏分离,
借助某些特殊手段进行的精馏。
1 双组分溶液的气液相平衡关系
蒸馏分离的物系由加热至沸腾的液相和产生的蒸汽相构成。相平衡 关系是蒸馏过程分析的重要理论基础。
蒸馏
概述
1.工作原理: 利用液体混合物中各组分挥发性差异,以热能为媒介 使其部分汽化从而在汽相富集轻组分液相富集重组分而使混合液 分离。
原料液 加热器 减压阀 Q
塔顶产品
yA
闪 蒸 罐 xA
yA xA 或
yA xA yB xB
塔底产品
2. 蒸馏操作的用途
许多生产工艺常常涉及到互溶液体混合物的分离问题,如石油炼制 品的切割,有机合成产品的提纯,溶剂回收和废液排放前的达标处 理等等。分离的方法有多种,工业上最常用的是蒸馏或精馏。
A
pA xA
B
pB xB
对纯组分液体,其挥发度就等于该温度下液体的饱和蒸汽压。
继续加热,随温度升高,物系变为 互成平衡的汽液两相,两相温度相 同组成分别为 yA 和 xA 。
t/C
气相区
露点 两相区
露点线
泡点
泡点线
液相区
0
xA
xf
yA 1.0
x(y)
当温度达到该溶液的露点,溶液全部汽化成为组成为 yA= xf 的气相, 最后一滴液相的组成为 xA。
1.2.2汽液平衡相图:x-y 图
蒸馏操作实例:石油炼制中使用的 250 万吨常减压装置
概述
3. 蒸馏的分类
间歇精馏:多用于小批量生产或某些有特殊要求的场合。 连续精馏:多用于大批量工业生产中。
常压蒸馏:蒸馏在常压下进行。 减压蒸馏:常压下物系沸点较高或热敏性物质不能承受高温的情况 加压蒸馏:常压下为气体的物系精馏分离,加压提高混合物的沸点.
若液相也为理想溶液,液相的活度系数就等于1,则
Ki
pi0 P
此式即为拉乌尔定律表达式。
对多组分物系汽液平衡关系的计算,应用相平衡常数比较方便。
1 双组分溶液的气液相平衡关系
1.3.2 相对挥发度 α
溶液中各组分的挥发性由挥发度来量衡,定义为组分在汽相中的 平衡蒸汽压与在液相中的摩尔分数的比值。对双组分物系
