体外消化实验
养殖技术中的饲料消化率评估方法

养殖技术中的饲料消化率评估方法引言:饲料消化率是评估养殖动物对饲料中的养分吸收利用能力的重要指标。
准确评估饲料消化率对于优化养殖管理,提高养殖效益至关重要。
在养殖技术中,饲料消化率的评估方法有多种,下文将介绍其中几种常用方法。
一、代谢试验法代谢试验法是一种直接测定动物对饲料养分消化利用率的方法。
通过收集动物排泄物和尿液,以及测定摄入的饲料量,可以计算出饲料中的各种养分的消化率。
代谢试验法的优点是直接、准确,能够真实反映动物对饲料的利用情况。
但是,该方法需要耗费时间和人力,且具有一定的侵入性,因此在实际应用中受到一定的限制。
二、捕食消化能试验法捕食消化能试验法是通过测定动物排泄物中能量的代谢率来评估饲料消化率的方法。
该方法的特点是相对简便、节省时间,且不需要对动物进行干预。
通过测定饲料中能量含量及动物排泄物中的代谢能量,可以计算出动物对饲料能量的消化率。
然而,捕食消化能试验法对饲料中非能量养分的评估相对较弱,在实际应用中需结合其他方法进行综合评估。
三、营养素标记法营养素标记法是通过标记饲料中的特定营养物质,如氨基酸、脂肪酸等,来评估饲料的消化率。
该方法主要通过测定标记物在动物的排泄物中的浓度变化来估算饲料的消化率。
这种方法具有非侵入性,能够实时监测动物对饲料中各种营养物质的利用情况。
然而,该方法仅适用于特定营养物质的评估,对于其他养分的评估有一定的局限性。
四、体外消化试验法体外消化试验法是通过模拟动物消化系统,测定饲料在体外消化过程中的变化,来评估饲料的消化率。
该方法主要通过采集饲料和消化液,模拟动物的消化过程,评估不同饲料的消化率和营养价值。
体外消化试验法具有简单、快速的优点,能够较准确地评估饲料的消化率。
然而,该方法存在模拟动物消化系统的不精确性,对于饲料中的一些特殊成分评估不准确的问题。
结论:饲料消化率是评估养殖动物对饲料中养分利用的重要指标,准确评估饲料消化率对于改善养殖管理和提高养殖效益具有重要意义。
模拟肠道消化实验报告

一、实验目的为了探究食物在人体肠道中的消化过程,本实验采用模拟肠道消化方法,对某种食物进行体外消化实验,观察食物在模拟肠道环境中的消化情况,并分析消化产物。
二、实验材料1. 实验试剂:模拟消化液、酶制剂、pH缓冲液、指示剂等;2. 实验器材:离心机、恒温箱、分光光度计、消化装置、烧杯、试管等;3. 实验样品:某种食物(如面粉、米饭等)。
三、实验方法1. 模拟消化液的制备:根据模拟肠道消化液成分,配制pH值为6.8的缓冲液,加入适量的消化酶,使酶浓度与人体肠道消化酶浓度相当。
2. 样品处理:将实验样品粉碎,过筛,称取适量样品置于烧杯中,加入适量的模拟消化液,搅拌均匀。
3. 模拟消化过程:将烧杯置于恒温箱中,模拟人体肠道温度(37℃),消化时间为2小时。
4. 消化产物检测:消化结束后,将消化液离心,取上清液进行以下检测:(1)蛋白质含量测定:采用双缩脲法检测消化液中的蛋白质含量;(2)淀粉含量测定:采用碘液法检测消化液中的淀粉含量;(3)脂肪含量测定:采用索氏抽提法检测消化液中的脂肪含量;(4)氨基酸含量测定:采用高效液相色谱法检测消化液中的氨基酸含量。
5. 数据分析:将实验数据与对照样品进行对比分析,评估实验样品在模拟肠道环境中的消化情况。
四、实验结果1. 蛋白质含量:实验样品在模拟肠道环境中的蛋白质含量较对照样品降低,说明蛋白质在模拟消化过程中得到了部分分解。
2. 淀粉含量:实验样品在模拟肠道环境中的淀粉含量较对照样品降低,说明淀粉在模拟消化过程中得到了部分分解。
3. 脂肪含量:实验样品在模拟肠道环境中的脂肪含量较对照样品降低,说明脂肪在模拟消化过程中得到了部分分解。
4. 氨基酸含量:实验样品在模拟肠道环境中的氨基酸含量较对照样品增加,说明蛋白质在模拟消化过程中被分解为氨基酸。
五、实验结论本实验采用模拟肠道消化方法,对某种食物进行了体外消化实验,结果表明:1. 实验样品在模拟肠道环境中的蛋白质、淀粉和脂肪含量均有所降低,说明这些营养成分在模拟消化过程中得到了部分分解;2. 实验样品在模拟肠道环境中的氨基酸含量增加,说明蛋白质在模拟消化过程中被分解为氨基酸。
食品营养成分和功能评价的实验方法

食品营养成分和功能评价的实验方法食品的营养成分和功能评价对于消费者的健康和营养摄入至关重要。
为了准确评估食品的营养价值以及其对人体健康的益处,科学家们开发了多种实验方法。
本文将介绍几种常用的食品营养成分和功能评价的实验方法。
1. 体外消化模拟实验体外消化模拟实验可模拟人体消化过程,评估食物在胃和肠道中的消化。
该方法通过模拟胃酸和酶的作用,在一定的温度、酸度和时间条件下,观察食物在模拟消化过程中的变化,以评估其营养成分的消化率和可利用率。
体外消化模拟实验可以帮助科学家们确定食品中蛋白质、脂肪、碳水化合物等营养成分的消化情况,为食品的配方和工艺改进提供依据。
2. 细胞模型实验细胞模型实验是评估食品功能性成分对细胞生理功能的影响。
科学家们利用细胞培养技术,将特定细胞品系培养在实验室中,并加入不同浓度的食品提取物或功能性成分。
通过观察细胞生长、代谢、氧化应激等指标的变化,确定食品的功能性成分对细胞的影响程度。
这些实验可以评价食品对抗氧化、抗炎、抗肿瘤等功能性特性,有助于开发具有保健功效的食品和药物。
3. 动物实验证明动物实验证明可评估食品对动物生长、免疫功能、内分泌调节等方面的影响。
在实验过程中,科学家们将特定的食品添加到动物的饲料中,观察动物的体重变化、血液生化指标、器官功能等,并与对照组进行比较。
通过这些动物实验证明,科学家们可以评估食品对动物营养需求的满足程度,以及其对动物健康的益处。
这些实验证明为人类食品安全和营养评估提供了参考。
4. 人体实验人体实验是评估食品在人体内的影响和效果的最直接方法。
科学家们通过招募志愿者,设计合理的实验方案,观察特定食品摄入对人体生理指标的影响。
例如,在葡萄糖耐量试验中,科学家们通过测量被试者的血糖水平,评估特定食品对血糖代谢的影响。
人体实验可以更直接、准确地评估食品成分和功能对人体健康的影响,但由于涉及人体,应严格遵循伦理原则和实验安全规范。
综上所述,食品营养成分和功能评价的实验方法包括体外消化模拟实验、细胞模型实验、动物实验证明和人体实验。
体外消化模型的研究进展

内容摘要
为了更深入地探讨7种饲料原料粉碎粒度对蛋白质体外消化率及能耗的影响, 我们设计了一项实验研究。在实验中,我们选取了7种常见的饲料原料,分别为 玉米、豆粕、麦麸、鱼粉、棉粕、菜粕和酵母粉。首先,我们将每种饲料原料分 别粉碎成不同粒度的粉末,然后测定其蛋白质体外消化率和能耗。
内容摘要
实验结果表明,对于不同的饲料原料,粉碎粒度对蛋白质体外消化率及能耗 的影响存在差异。其中,玉米、豆粕和鱼粉的粉碎粒度对蛋白质体外消化率的影 响较为显著,而麦麸、棉粕、菜粕和酵母粉的影响相对较小。此外,粉碎粒度的 变化对蛋白质体外消化率的影响并非单调递增或递减,而是存在一个最优粒度。 对于能耗方Байду номын сангаас,粉碎粒度越小,能耗越高,这与文献综述中的结论一致。
柚子皮多糖的体外消化及其抗氧化活性的变化规律
日常生活中,我们也可以通过食用柚子或柚子制品来摄取柚子皮多糖等有益 健康的成分。除了食用柚子外,我们还可以了解更多有关植物来源的食物和补充 剂的信息,以及它们对我们的健康可能产生的影响。通过合理的饮食和生活方式, 我们可以充分利用这些天然抗氧化物质,提高我们的健康水平并预防疾病。
内容摘要
在讨论中,我们分析了粉碎粒度对蛋白质结构的影响,发现较小的粉碎粒度 有助于改善蛋白质的分散性和溶出性,从而提高其体外消化率。此外,我们还探 讨了粉碎粒度提高蛋白质体外消化率的可能性,认为其可能与提高饲料与消化酶 的接触面积有关。
内容摘要
总之,本项研究证实了7种饲料原料的粉碎粒度对蛋白质体外消化率及能耗具 有显著影响。在实际生产中,应根据不同的饲料原料和养殖需求,选择合适的粉 碎粒度,以充分发挥饲料的营养价值并降低能耗。这一研究结果对于优化畜牧业 生产具有一定的指导意义。
谢谢观看
肉饼体外消化实验报告

肉饼体外消化实验报告
实验目的:
验证肉饼在体外消化过程中的化学反应和分解过程。
实验原理:
体外消化是指将实验样品置于模拟人体胃液和胰液的溶液中,模拟人体消化过程,观察样品在消化液中的反应和分解过程。
胃液中含有胃蛋白酶,可以将蛋白质分解为肽和氨基酸,而胰液中含有胰蛋白酶和胰脂酶,可以进一步将肽和脂肪分解为氨基酸和脂肪酸。
本实验将肉饼置于模拟胃液和胰液中,观察肉饼的消化过程。
实验步骤:
1. 准备实验所需的材料,包括肉饼、模拟胃液、模拟胰液等。
2. 将肉饼置于模拟胃液中,放置一段时间,观察肉饼在胃液中的变化。
3. 将肉饼从胃液中取出,置于模拟胰液中,放置一段时间,观察肉饼在胰液中的变化。
4. 观察实验结果,记录下肉饼在胃液和胰液中的变化情况。
实验结果:
在模拟胃液中,肉饼经过一段时间的浸泡,变得柔软,并有一些褐色液体从肉饼中渗出。
在模拟胰液中,肉饼进一步分解,变得更为柔软,并有更多的褐色液体从肉饼中渗出。
实验讨论:
根据实验结果,可以得出肉饼在体外消化过程中的化学反应和
分解过程。
当肉饼置于胃液中时,胃蛋白酶开始将蛋白质分解为肽和氨基酸,导致肉饼变得柔软并有一些褐色液体渗出。
当肉饼进一步置于胰液中时,胰蛋白酶和胰脂酶进一步将肉饼中的肽和脂肪分解为氨基酸和脂肪酸,导致肉饼变得更为柔软并有更多的褐色液体渗出。
实验结论:
肉饼在体外消化过程中,经过胃液和胰液的作用,逐渐分解为氨基酸和脂肪酸。
体外模拟消化法优化生长猪饲粮非淀粉多糖酶谱

体外模拟消化法优化生长猪饲粮非淀粉多糖酶谱导读非淀粉多糖(NSP)作为一种抗营养因子,常影响畜禽饲粮营养物质的消化。
NSP 酶由于可降低NSP 的抗营养作用,越来越受到关注。
许多研究表明,NSP 酶能够降低NSP 的抗营养作用,提高营养物质利用率,改善肠道健康。
但是也有研究发现,NSP 酶对猪生产性能、营养物质利用率没有影响。
由于不同饲粮中NSP的含量和组成差异较大,而NSP 酶作为生物反应的催化剂,对底物具有专一性,因此,NSP 酶的合理配伍是充分发挥其对饲粮中NSP 降解作用的关键。
但是针对不同的饲粮,通过动物试验方法来筛选与之相适应的NSP 酶的配伍,不但工作量巨大,而且结果变异比较大,不能满足实际需求。
近年来,一些研究者通过体外模拟消化的方法来研究饲粮中添加NSP 酶的效果,为高效、快速的优化NSP 酶的配伍提供了一个可行的途径。
王恩玲等和何科林等使用胃蛋白酶-胰液素的体外2 步模拟消化法对NSP 酶在家禽饲粮中的作用效果进行了体外评定,取得了良好的促生产效果。
Narasimha 等使用体外消化法成功筛选出了纤维素酶、木聚糖酶和β-葡聚糖酶在几种饲料原料中的最佳组合。
但是,使用体外模拟消化法优化生长猪不同饲粮NSP 酶谱的研究目前还没有报道。
此外,胰液素是含有多种消化酶的复合物,不同批次之间组成有所不同,无法实现模拟肠液的重复以及测试重演性的需求。
本实验室前期在研究生长猪小肠液组成的基础上开发了猪模拟小肠液,并在猪饲粮的体外模拟消化上取得了较好的效果。
因此,本试验使用基于生长猪生理消化液组成依据的体外三角瓶2 步消化法,在玉米-豆粕型和玉米-杂粕型2 种不同类型的生长猪饲粮中使用6 种NSP 酶,探讨NSP 酶对不同类型饲粮的作用效果,探索优化猪饲粮中NSP酶配伍的方法,为NSP 酶在猪饲粮中的高效使用提供依据。
1材料与方法1.1 NSP 酶及酶活性测定选用纤维素酶、木聚糖酶、β-葡聚糖酶、β-甘露聚糖酶、α-半乳糖苷酶和果胶酶6 种NSP酶。
体外消化实验
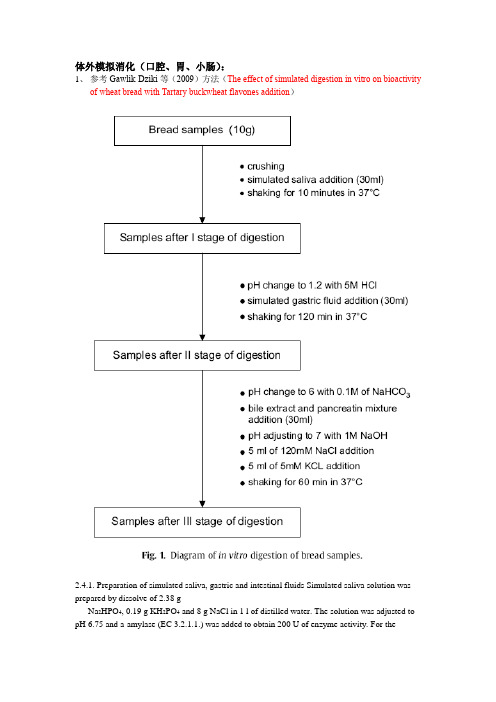
体外模拟消化(口腔、胃、小肠):1、参考Gawlik-Dziki等(2009)方法(The effect of simulated digestion in vitro on bioactivityof wheat bread with Tartary buckwheat flavones addition)2.4.1. Preparation of simulated saliva, gastric and intestinal fluids Simulated saliva solution was prepared by dissolve of 2.38 gNa2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and a-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For thegastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal. juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2.4.1. Preparation of simulated saliva, gastric and intestinal fluidsSimulated saliva solution was prepared by dissolve of 2.38 g Na2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and α-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For the gastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2、参考Versantvoort等(2005)(Applicability of an in vitro digestion model in assessing thebioaccessibility of mycotoxins from food)和Hur等(2009)的方法(Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion)Table 1Constituents and concentrations of the various synthetic juices of the in vitro digestion model representing fed conditionsSaliva 唾液Gastric juice 胃液Duodenal juice十二指肠液Bile juice 胆汁Inorganic solution 10 ml KCl 89.6g/l15.7 ml NaCl 175.3g/l40 ml NaCl175.3g/l30 ml NaCl175.3g/l10 ml KSCN20g/l3.0 ml NaH2PO4 88.8g/l40 ml NaHCO384.7 g/l68.3 ml NaHCO384.7 g/l10 ml NaH2PO488.8 g/l9.2 ml KCl 89.6 g/l10 ml KH2PO48g/l4.2 ml KCl 89.6 g/l 10 ml NaSO457g/l18 ml CaCl2· 2H2O22.2 g/l6.3 ml KCl89.6 g/l150 μl HCl 37%g/g1.7 ml NaCl175.3 g/l10 ml NH4Cl 30.6 g/l10 ml MgCl2 5g/l20 ml NaHCO384.7 g/l6.5 ml HCl 37%g/g180 μl HCl37%g/gOrganic solution 8 ml urea 25 g/l10 ml glucose 65 g/l 4 ml urea 25 g/l10 ml urea 25 g/l10 ml glucuronic acid(葡萄糖醛酸) 2g/l3.4 ml urea 25g/l10 ml glucosaminehydrochloride (盐酸氨基葡萄糖) 33g/lAdd to mixtureorganic+ inorganic solution290 mgα-amylase1g BSA9mlCaCl2· 2H2O22.2 g/l10ml CaCl2· 2H2O22.2 g/l15 mg uric acid 2.5 g pepsin1g BSA 1.8 g BSA25 mg mucin 3 g mucin9 g pancreatin30 g bile1.5 g lipasepH 6.8 ± 0.2 1.30 ± 0.028.1 ± 0.28.2 ± 0.2 The inorganic and organic solutions are augmented to 500ml with distilled water. After mixing of the inorganic and organic solutions, some further constituents are added and dissolved. If necessary, the pH of the juices is adjusted to the appropriate interval.另外,抗性淀粉含量测定:1、参考Li等(2008)方法(Characterization of maize amylose-extender (ae) mutant starches. PartI: Relationship between resistant starch contents and molecular structures)2.3. Resistant starch (RS) contentRS contents of the ae-mutant starch samples were determined using the AOAC Method 991.43 for total dietary fiber (AOAC, 2003) and Englyst’s method (1992) for comparison.For the AOAC 991.43 method, starch (1.0 g, dry-starch basis, dsb) was suspended in a Mes-tris buffer solution (0.05 M, 40 ml) and hydrolyzed with 500 u of a-amylase from Bacilluslicheniformis (Sigma Chemical, Cat. No. A3403) in a boiling water-bath for 30 min with stir. The sample was then digested with protease from Bacillus licheniformis (5 mg, Sigma Chemical, Cat. No. P3910) at 60 ºC in a shaker waterbath for 30 min. The sample dispersion was adjusted to pH 4.4–4.6 by adding HCl and then hydrolyzed with amyloglucosidase (300 U, Sigma chemical, Cat. No. A9913) at 60 ºC in a shaker water-bath for 30 min. The digested sample was filtered through a celite layer in a crucible and washed twice with 15 ml of 78% ethanol, twice with 15 ml of 100% ethanol and rinsed with 15 ml of acetone. The remaining sample was dried in an oven at 100 ºC overnight. The resistant starch content was calculated using the equation:(%)RS content = Remaining sample weight (g, dsb)/initial sample weight (g, dsb) ×100%For RS determined using Englyst’s method (1992), Starch (1.000 g, db) in 20 mL of sodium acetate buffer (0.1 M, pH 5.2) was cooked in a boiling water-bath for 30 min. The starch dispersion was cooled down to 37 ºC, mixed with an enzyme solution (5 mL) consisting of pancreatin extract and amyloglucosidase, and incubated in a water-bath at 37 ºC. The pancreatin extract was prepared as follows; 3.0 g of pancreatin (Sigma, Cat. No. P7545) was suspended in 20 mL deionized water, stirred for 10 min at room temperature, and centrifuged at 1500g for 10 min. The enzyme solution was prepared by mixing 13.5 ml supernatant of pancreatin extract, 210 U amyloglucosidase (Sigma, Cat. No. A7095), and 1.0 mL deionized water. The rapid digestible starch (RDS) was defined as the total starch digested within the first 20 min, and the slowly digestible starch (SDS) was the starch digested between 20 and 120 min (Englyst et al., 1992). The resistant starch content was calculated as follows:(%)RS content = 100%×(total starch – RDS - SDS) (g, dsb)/total starch (g, dsb)。
消化实验方法总结

《豆粕粉碎粒度与蛋白质体外消化率的关系研究》采用胃蛋白酶-胰酶两步法,通过体外模拟鸡体消化道内环境来比较不同粉碎力度豆粕的蛋白消化率,从而确定适合肉仔鸡生长的较适宜豆粕粉碎力度。
白消化率,从而确定适合肉仔鸡生长的较适宜豆粕粉碎力度。
平均粒径采用GB 6971-86 方法,体外试验采用Boisen 和Fernandez 等体外模拟消化方法。
等体外模拟消化方法。
胃蛋白酶最适浓度的选择1g 豆皮→豆皮→100ml 100ml 三角瓶三角瓶+25ml +25ml 磷酸缓冲液(磷酸缓冲液(pH=6.0 0.01M pH=6.0 0.01M )+10ml 盐酸(盐酸(0.2M 0.2M 0.2M)→温和搅拌)→温和搅拌+1ml(15mg/ml,30mg/ml,45mg/ml,60mg/ml,75mg/ml,90mg/ml)的新鲜胃蛋白酶溶液(由0.01M HCl 配制)配制),pH=2.0 +0.5ml 抑菌剂(青霉素抑菌剂(青霉素++链霉素)→链霉素)→393939℃恒温水浴中震荡℃恒温水浴中震荡6h,6h,消消化后化后+20%+20%+20%黄基水杨酸黄基水杨酸5ml 5ml→室温静置→室温静置30min 30min→抽滤→干燥后残渣凯式定氮法测蛋白质含量→→抽滤→干燥后残渣凯式定氮法测蛋白质含量→计算蛋白质和干物质消化率。
确定最适胃蛋白酶浓度为75mg/ml.胰酶最适浓度选择在最适(75mg/m )胃蛋白酶液消化后的产物中加入10ml 磷酸缓冲液(0.2M pH=6.8)+5mlNaoH(0.6M)+1ml(70mg/ml,90mg/ml,110mg/ml,130mg/ml,150mg/ml)的胰酶溶液(由磷酸二氢钾缓冲液配制)pH=6.8→3939℃恒温水浴中震荡℃恒温水浴中震荡18h 18h→消化后→消化后→消化后+20%+20%+20%磺基水杨酸磺基水杨酸5ml 5ml→室温→室温静置30min 30min→抽滤,干燥后残渣按照凯式定氮法测其蛋白质含量,计算粗蛋白和干物质消化→抽滤,干燥后残渣按照凯式定氮法测其蛋白质含量,计算粗蛋白和干物质消化率,确定最适胰酶浓度为110mg/ml 110mg/ml。
几种蛋白质原料体外消化率测定方法的比较

化的真实情况。 oe 和Eg ( 9) 蛋白 Bin g m 1 s u 1 在胃 酶- 9
胰蛋 白酶两步法 中利用标准过滤装置测得饲料蛋 白
质消化率与鼠和猪的真消化率十分接近, 他们认为这
种方法测得的蛋白质体外消化率经内源氮校正与回
用高, 而且对外界环境的要求较高, 季节、 温度、 光照
等都会影响消化率测定值。 体外消化法是利用精制的 消化酶或研究对象的消化道酶提取液在试管内进行
肠末端蛋白质表观消化率高度相关。 我国饲料原料品
种多, 营养成分含量差异大, 加工方式各异, 饲料原料
对不同鱼类的营养价值差异更大。 由于鱼类生活在水
的消化试验,其测定值可近似反映鱼对饲料的消化 率。此法能快速测定原料的相对利用率, 为营养师制
中, 测定鱼类饲料真消化率比 测定畜禽的更加困难。
所以寻找一种准确、 简便、 实用的消化率测定方法对 评价鱼类饲料的消化率有着十分重要的意义。 本试验
1 . 3 离体消化程 序 .2 2.
黄沦海等: 几种蛋白质原料体外消化率测定方法的比较
①胃蛋白酶处理
a 饲料样品2 分别置于20 . 称取0g . 5 份, 5 m 带盖 l 三角瓶中( 每个样品测2 个平行样) 。
b 称取17 蛋白 准确到00 ) .7 胃 酶( . 准确 7g .1 , 0g置
量一 消化后滤渣粗蛋白 含量) / 饲料样品 粗蛋白 含量
d . 将三角瓶置于( 1.℃台式恒温摇床中, 4 0) 0 1 以其 2 结 果 温度达到4℃时开始计时, 0 震荡3, h频率为8 次/i 0 / n 21 饲料的粗蛋白含量 m , .
《 门料工业)20 年第2 直第 2 朋 -05 6 0
j柳 . 9 1 >4率A鲤方法韵毙钗 rIMM磺10*外Nq jMis 4 4 01 JOl , wI g - Iw Ab & 1 j ,
稻米淀粉体外消化试验方法的优化及应用

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2023ꎬ39(2):539 ̄546http://jsnyxb.jaas.ac.cn李颖颖ꎬ蒋彦婕ꎬ李文奇ꎬ等.稻米淀粉体外消化试验方法的优化及应用[J].江苏农业学报ꎬ2023ꎬ39(2):539 ̄546.doi:10.3969/j.issn.1000 ̄4440.2023.02.028稻米淀粉体外消化试验方法的优化及应用李颖颖1ꎬ2ꎬ㊀蒋彦婕1ꎬ㊀李文奇1ꎬ㊀陶亚军1ꎬ㊀王芳权1ꎬ㊀陈智慧1ꎬ㊀许㊀扬1ꎬ3ꎬ㊀王㊀军1ꎬ3ꎬ范方军1ꎬ㊀朱建平1ꎬ㊀夏士健1ꎬ㊀李㊀霞1ꎬ2ꎬ3ꎬ㊀杨㊀杰1ꎬ3(1.江苏省农业科学院粮食作物研究所ꎬ农业农村部淮河下游种质创新重点实验室ꎬ江苏南京210014ꎻ2.南京农业大学生命科学学院ꎬ江苏南京210095ꎻ3.江苏省粮食作物现代产业技术协同创新中心ꎬ江苏扬州225009)收稿日期:2022 ̄04 ̄20基金项目:江苏省农业科技自主创新基金项目[CX(20)3008]ꎻ江苏省重点研发计划(现代农业)项目(BE2020)ꎻ国家自然科学基金项目(31571585)作者简介:李颖颖(1998-)ꎬ女ꎬ安徽宿州人ꎬ硕士研究生ꎬ研究方向为水稻营养ꎮ(E ̄mail)2361350374@qq.com通讯作者:李㊀霞ꎬ(E ̄mail)jspplx@jaas.ac.cnꎻ杨㊀杰ꎬ(E ̄mail)yangjie168@aliyun.com㊀㊀摘要:㊀为实现快捷㊁经济的稻米升糖指数(GI)估测ꎬ首先以不同直链淀粉含量的水稻品种紫金糯2号㊁南粳04062㊁宁西优Y16稻米为研究材料ꎬ分析了样品前处理方式㊁α ̄淀粉酶和淀粉糖苷酶的添加量及方式等对稻米淀粉水解的影响ꎬ明确了稻米淀粉体外消化的适宜前处理方式㊁α ̄淀粉酶和淀粉糖苷酶的适宜添加量和方式ꎬ进而根据淀粉水解指数和水解率进行了稻米升糖指数的估算ꎮ结果表明ꎬ稻米升糖指数估算适宜的淀粉体外消化试验方法是0 75g精米加水煮熟后ꎬ人工研棒挤压30下ꎬ加pH6 8的磷酸盐缓冲液定容至15mlꎬ同时加入300U/ml的α ̄淀粉酶和50U/ml的淀粉糖苷酶各1ml联合水解60minꎬ通过监测水解液葡萄糖含量动态变化ꎬ计算1h内的淀粉水解指数及1h的水解率ꎬ即可实现稻米升糖指数的估算ꎻ9个稻米样本的GI估算结果表明本研究建立的试验方法能实现低GI稻米资源和遗传材料的初步筛选ꎮ关键词:㊀水稻ꎻ淀粉水解率ꎻ升糖指数(GI)ꎻ淀粉体外消化中图分类号:㊀S511ꎻR151.2㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2023)02 ̄0539 ̄08OptimizationandapplicationofinvitrodigestiontestmethodofricestarchLIYing ̄ying1ꎬ2ꎬ㊀JIANGYan ̄jie1ꎬ㊀LIWen ̄qi1ꎬ㊀TAOYa ̄jun1ꎬ㊀WANGFang ̄quan1ꎬ㊀CHENZhi ̄hui1ꎬ㊀XUYang1ꎬ3ꎬ㊀WANGJun1ꎬ3ꎬ㊀FANFang ̄jun1ꎬ㊀ZHUJian ̄ping1ꎬ㊀XIAShi ̄jian1ꎬ㊀LIXia1ꎬ2ꎬ3ꎬ㊀YANGJie1ꎬ3(1.InstituteofFoodCropsꎬJiangsuAcademyofAgriculturalSciencesꎬKeyLaboratoryofGermplasmInnovationinDownstreamofHuaiheRiver(Nanjing)ꎬMinistryofAgricultureandRuralAffairsofthePeople sRepublicofChinaꎬNanjing210014ꎬChinaꎻ2.CollegeofLifeSciencesꎬNanjingAgriculturalUni ̄versityꎬNanjing210095ꎬChinaꎻ3.CollaborativeInnovationCenterforModernProductionTechnologyofGrainCropsofJiangsuProvinceꎬYangzhou225009ꎬChina)㊀㊀Abstract:㊀Inordertoestimatetheglycemicindex(GI)ofricequicklyandeconomicallyꎬthericevarietiesZijinnuo2ꎬNanjing04062andNingxiyouY16withdifferentamylosecontentswereusedastheresearchmaterials.Theeffectsofsamplepretreatmentmethodsꎬtheadditionamountandmethodofα ̄amylaseandamyloglucosidaseonthehydrolysischarac ̄teristicsofricestarchwereanalyzed.Thesuitablepretreatmentmethodofricestarchinvitrodigestionꎬthesuitableadditionamountandmethodofα ̄amylaseandamy ̄loglucosidaseweredetermined.TheGIvalueofricewases ̄timatedaccordingtothestarchhydrolysisindexandhydrol ̄ysisrate.Theresultsshowedthatthesuitablestarchinvitrodigestiontestschemeforestimatingtheglycemicindexofricewasasfollows:0.75gofpolishedricewasboiledwithwaterꎬthenextruded30timesbyartificialstickꎬandthe935volumewasadjustedto15mlwithpH6.8phosphatebuffer.Thenꎬ1ml300U/mlα ̄amylaseand1ml50U/mlamyloglucosi ̄dasewereaddedsynchronouslytohydrolyzefor60min.Bymonitoringthedynamicchangeofglucosecontentinthehydroly ̄sateꎬtheGIvalueofricecouldbeestimatedbythestarchhydrolysisindexwithin1handthehydrolysisrateat1h.TheGIestimationvaluesofninericesamplesindicatedthattheexperimentalmethodestablishedinthisstudycouldrealizethepre ̄liminaryscreeningoflowGIriceresourcesandgeneticmaterials.Keywords:㊀riceꎻstarchhydrolysisrateꎻglycemicindex(GI)ꎻstarchdigestioninvitro㊀㊀肥胖㊁Ⅱ型糖尿病和相关慢性病的发病率在发展中国家和发达国家均不断增加ꎮ据报道ꎬ2022年全世界约1.9ˑ109成年人超重或肥胖ꎬ其中5.37ˑ108人患有Ⅱ型糖尿病[1]ꎮ由于肥胖㊁糖尿病等大多与过量摄食有关ꎬ因此通过膳食干预是解决这些全球健康问题经济有效的手段[2]ꎮ目前医学界普遍认为ꎬ食用低血糖生成指数(或升糖指数ꎬGI)的食品对肥胖㊁糖尿病等疾病的预防和控制具有较好作用[3]ꎮ水稻是全球数十亿人的主食作物ꎮ据国际粮农组织报告ꎬ2022年度全球精米消费量估计超过5ˑ108tꎬ人均消费量超过65kg[4]ꎮ精米是最常见的大米消费形式ꎬ它是稻谷通过物理加工去除谷壳和麸皮ꎬ露出的淀粉状胚乳ꎮ精米的淀粉含量高达90%[5]ꎬ因此淀粉性状是精米升糖指数的决定性因素ꎮ与许多其他淀粉食品相比ꎬ目前人们食用大米的GI相对较高ꎬ属于高GI食品[6]ꎮ目前食品升糖指数的检测标准通常是根据健康人群食用食物及对照品之后2h内的血液中血糖变化来计算ꎮ对于低GI稻米的培育以及低GI产品的加工来说ꎬ需要快速便捷的GI估算方法ꎬ为此ꎬ科学家根据食品在人体中的消化过程ꎬ尝试在体外建立食品GI的估测方法[7]ꎮ食物的血糖反应在很大程度上与其碳水化合物的消化速度相关ꎬ用混合酶类对食物进行水解ꎬ测定水解后的还原糖量以判断消化程度ꎬ就可对食物的升糖指数进行估测[8]ꎮ目前已经建立了不少体外消化方法来评估食物中的淀粉水解率ꎬ进而估计食物的GI[9 ̄10]ꎬ淀粉体外消化的反应时间在1~4h均有报道[11 ̄14]ꎮ已有研究结果表明ꎬ不同淀粉样品在消化60min之后ꎬ葡萄糖的释放量趋于稳定ꎬ没有大幅度的递增[15]ꎻ马铃薯淀粉体外酶解60min时得到的估计升糖指数与人体检测得到的升糖指数一致性最好[16]ꎮ而在稻米淀粉的体外水解方面ꎬ研究人员在水解反应液pH值㊁酶的种类和浓度㊁体外消化时间以及操作步骤等方面还没有一个统一的检测标准[17 ̄18]ꎮ此外ꎬ还需要依赖昂贵的体外消化模拟设备在水解前对稻米样品进行破碎处理[19]ꎬ这就导致目前的稻米淀粉体外水解方法的普适性㊁通用性不强ꎮ碳水化合物的体外模拟消化速度可用水解率㊁水解指数㊁淀粉消化指数等指标来反映ꎬ但不同来源淀粉样品各指标的实验程序和计算方法并不一致[2]ꎮ因此ꎬ有必要建立一种简单省时㊁可靠且成本低廉的稻米淀粉体外消化方法ꎬ来估测稻米的升糖指数ꎬ以实现稻米低升糖指数水稻资源以及初级遗传材料的筛选ꎮ为此ꎬ本研究以粳糯紫金糯2号㊁粳稻南粳04062㊁杂交籼稻宁西优Y16稻米为试验材料ꎬ从样品前处理㊁水解酶种类㊁水解酶含量以及水解时间等对稻米淀粉水解的影响进行分析ꎬ尝试建立一个简单有效且经济的稻米淀粉体外消化方法ꎬ以估测稻米的升糖指数ꎻ并选取了9个稻米样品来验证本方法的有效性ꎬ为低GI稻米快速便捷鉴定提供重要参考ꎮ1㊀材料与方法1.1㊀材料与试剂本研究选取的材料包括本单位保存水稻品种的精米及市场上购买的不同类型精米ꎮ本单位保存的水稻品种包括紫金糯2号㊁南粳04062㊁宁西优Y16㊁JYJ ̄1(籼稻)和JYJ ̄2(籼稻)等ꎮ其中ꎬ粳糯紫金糯2号属于粳亚种ꎬ稻米不透明ꎬ直链淀粉含量ɤ2%ꎻ粳稻南粳04062也属于粳亚种ꎬ但稻米透明ꎬ直链淀粉含量14%~16%ꎻ杂交籼稻宁西优Y16属于籼稻亚种ꎬ米粒狭长ꎬ直链淀粉含量18%~20%ꎮ具体稻米外观见图1ꎮ市场上购买的精米产品包括米抗儿低GI精米(中农海稻深圳生物科技有限公司产品)㊁米无忌高抗性淀粉精米(南京晶健米业有限公司产品)㊁牧谷屋中GI精米(哈尔滨沃禾农业发展有限责任公司产品)ꎬ降特3D特制脱水加工精米(特素生物科技天津有限公司产品)ꎮ白面包(曼可045江苏农业学报㊀2023年第39卷第2期顿食品上海有限公司产品)ꎮ此外ꎬα ̄淀粉酶(4000U/g)购自源叶生物科技有限公司ꎬ淀粉糖苷酶(AMGꎬ103U/mg)购自Sigma公司ꎬ葡萄糖检测试剂盒购自南京建成生物工程研究所ꎬ可溶性淀粉购自成都市科龙化工试剂厂ꎬ其他试剂均为化学分析纯ꎮα ̄淀粉酶母液:分别取原酶(4000U/g)0.0500g㊁0.0625g㊁0.0750g㊁0.0875g㊁0.1000g㊁0.1125g加水定容至1mlꎬ配置成含量分别为200U/ml㊁250U/ml㊁300U/ml㊁350U/ml㊁400U/ml㊁450U/ml的反应酶母液ꎮ淀粉糖苷酶母液:分别取原酶(103U/mg)0 97mg㊁1 94mg㊁2 90mg㊁3 90mg㊁4 90mg㊁5 80mg㊁6 80mg加水定容至1mlꎬ配置成含量分别为100U/ml㊁200U/ml㊁300U/ml㊁400U/ml㊁500U/ml㊁600U/ml㊁700U/ml的酶溶液ꎬ稀释10倍得到含量分别为10U/ml㊁20U/ml㊁30U/ml㊁40U/ml㊁50U/ml㊁60U/ml㊁70U/ml的反应酶母液ꎮA:稻米长度ꎻB:稻米透明度(图中标尺均为1cm)ꎮ图1㊀三种典型稻米表型特征Fig.1㊀Threetypicalriceapparentcharacteristics1.2㊀仪器设备研钵㊁研棒㊁JA203H分析天平购自常州市幸运电子设备有限公司ꎬDK ̄8D三孔电热恒温水槽购自上海一恒科学仪器有限公司ꎬL3 ̄5K台式低速离心机购自湖南可成仪器设备有限公司ꎬUV ̄3200紫外分光光度计购自上海美谱达仪器有限公司ꎮ1.3㊀试验方法1.3.1㊀样品前处理㊀以紫金糯2号精米为试验材料ꎬ分析咀嚼和研磨两种前处理方式对测试结果的影响ꎮ取2份0 75g米样洗净ꎬ按照文献[20]加入适量的水ꎬ常压蒸制30minꎬ以确保米粒完全煮熟ꎬ冷却至室温ꎬ然后采用咀嚼和研磨的方式对煮熟的米饭ꎬ分别经研棒研磨30下和人工咀嚼30下ꎬ然后再分别加pH6.8的磷酸盐缓冲液定容到15mlꎬ37ħ恒温孵育ꎬ分别加入1ml含量为200U/ml㊁250U/ml㊁300U/ml㊁350U/mlα ̄淀粉酶母液反应60minꎬ100ħ热失活10minꎬ静置至室温ꎬ再加1ml含量为70U/ml淀粉糖苷酶母液ꎬ继续反应30minꎬ100ħ热失活10min终止反应ꎬ4000r/min离心5minꎬ测得水解液体积ꎮ取10μl上清液ꎬ用葡萄糖检测试剂盒测定上清液中葡萄糖含量ꎮ每个处理重复3次ꎮ1.3.2㊀淀粉消化酶含量以及加酶方式的确定㊀根据Fitzgerald等[20]ꎬLin等[21]和Goni等[22]方法ꎬ分别在水解酶用量㊁加酶的顺序以及水解反应时间等方面进行优化ꎬ具体如下:1.3.2.1㊀α ̄淀粉酶含量确定㊀以紫金糯2号㊁南粳04062㊁宁西优Y16精米为试验材料ꎬ各取5份0 75g米样ꎬ洗净ꎬ按照文献[23]加入适量的水ꎬ常温蒸至米粒熟透ꎬ以研磨方式进行前处理ꎬ然后加入pH6 8的磷酸盐缓冲液定容到15mlꎬ再分别加入1ml含量为250U/ml㊁300U/ml㊁350U/ml㊁400U/ml㊁450U/ml的α ̄淀粉酶母液ꎬ37ħ保温ꎬ进行体外水解反应ꎬ反应60min后ꎬ100ħ热失活10minꎬ静置至室温ꎬ再加1ml含量为70U/ml淀粉糖苷酶母液ꎬ继续反应30minꎬ100ħ热失活10min终止反应ꎬ4000r/min离心5minꎬ测量各处理水解液体积ꎮ取10μl上清液用葡萄糖检测试剂盒测定其葡萄糖含量ꎮ每个处理重复3次ꎮ1.3.2.2㊀淀粉糖苷酶含量确定㊀以紫金糯2号㊁南粳04062㊁宁西优Y16精米为试验材料ꎬ各取5份0 75g米样ꎬ常温蒸至米粒熟透ꎬ以研磨方式进行前处理ꎬ然后加入pH6 8的磷酸盐缓冲液定容到15mlꎬ统一加入1ml含量为300U/ml的α ̄淀粉145李颖颖等:稻米淀粉体外消化试验方法的优化及应用酶ꎬ37ħ保温ꎬ进行体外水解反应ꎬ反应60min后ꎬ然后在南粳04062和宁西优Y16样品中分别添加1ml含量为10U/ml㊁20U/ml㊁30U/ml㊁40U/ml㊁50U/ml的淀粉糖苷酶母液ꎬ在紫金糯2号样品中分别添加1ml含量为30U/ml㊁40U/ml㊁50U/ml㊁60U/ml㊁70U/ml的淀粉糖苷酶母液ꎬ继续37ħ水解40minꎬ100ħ热失活10min终止反应ꎬ4000r/min离心5minꎬ测量各处理水解液体积ꎮ取10μl上清液ꎬ用葡萄糖检测试剂盒测定上清液中葡萄糖含量ꎮ每个处理重复3次ꎮ1.3.2.3㊀加酶顺序的确定㊀以紫金糯2号精米为试验材料ꎬ取6份0 75g米样ꎬ常温蒸至米粒熟透ꎬ以研磨方式进行前处理ꎬ加入pH6.8的磷酸盐缓冲液定容到15mlꎬ然后以两种方法加入酶反应液ꎮ第一种方法是先加入1ml含量为300U/mlα ̄淀粉酶母液ꎬ37ħ水解反应60minꎬ100ħ热失活10minꎬ冷却至37ħꎬ再加1ml含量为50U/ml淀粉糖苷酶母液ꎬ继续水解反应30minꎬ100ħ热失活10min终止反应(依次加酶法)ꎻ第二种方法是在定容后的样液中ꎬ同时加入1ml含量为300U/mlα ̄淀粉酶母液和1ml含量为50U/ml淀粉糖苷酶母液ꎬ37ħ反应90minꎬ100ħ热失活10min终止反应(合并加酶法)ꎮ两种加酶方法的反应液均通过4000r/min离心5minꎬ测量反应液体积ꎬ各取10μl上清液ꎬ用葡萄糖检测试剂盒测定上清液中的葡萄糖含量ꎮ每个处理重复3次ꎮ1.3.3㊀稻米体外模拟消化时间的确定㊀每个精米样品取15份0 75g米样洗净ꎬ按照文献[23]ꎬ以精米的类型加入适量的水ꎬ常压蒸制30minꎬ以确保米粒完全煮熟ꎬ冷却至室温ꎬ上下挤压研磨30下后加入pH6 8磷酸盐缓冲液定容到15mlꎬ同时加入1ml300U/mlα ̄淀粉酶母液和1ml50U/ml淀粉糖苷酶母液ꎬ37ħ恒温孵育水解ꎬ分别在水解反应20min㊁30min㊁40min㊁50min和60min时各取3份水解反应液ꎬ100ħ热失活10min终止反应ꎮ不同时间点取出的反应液均经4000r/min离心5min后ꎬ测量各处理反应液体积ꎬ取10μl上清液用葡萄糖检测试剂盒测定水解反应液中葡萄糖浓度ꎮ每个处理重复3次ꎮ1.3.4㊀相关指标计算㊀本研究中主要采用碳水化合物的水解率和水解指数(HI)来估计升糖指数ꎬ淀粉水解率按公式1计算[24 ̄27]:SHR=CˑVˑ0.9/(MˑSC)ˑ100%(1)式中ꎬSHR为样品的淀粉水解率ꎬC㊁V分别为取样时间点水解反应液中葡萄糖含量和体积ꎬM为样品总干物质量ꎬSC为样品中淀粉含量ꎮ再根据不同水解时间点的淀粉水解率绘制水解曲线ꎬ水解曲线与时间轴间的积分面积表示样品水解后的葡萄糖变化总量ꎬ并以可溶性淀粉标准品的水解曲线作为对照ꎬ按照公式2计算样品水解指数(HI)[10ꎬ27]ꎮHI=样品水解曲线下积分面积(0~60min)/标准品水解曲线下积分面积(0~60min)ˑ100%(2)再根据Goñi等的方法[23]进行升糖指数(eGI)的估算:eGI=39.71+0.549HI(3)此外ꎬ直接用样品水解60min得到的葡萄糖质量与等质量的葡萄糖来估算升糖指数ꎬ算法如下:eGI=(CˑVˑM/m2)ˑ100%(4)式中ꎬC为50g样品水解60min时葡萄糖浓度(mmol/L)ꎻV为反应液总体积(L)ꎻM表示葡萄糖摩尔质量ꎬ0 18g/mmolꎻm2表示50g葡萄糖ꎮ1.3.5㊀数据处理㊀试验数据采用Excel2019和Ori ̄gin9.1处理和作图ꎮ并对试验结果进行单因素方差(One ̄WayANOVA)分析ꎮ2㊀结果与讨论2.1 稻米淀粉体外水解方法的优化2.1.1㊀样品前处理㊀咀嚼㊁研磨㊁机械损伤以及均质化等前处理方法对样品升糖指数的测定均有较大影响[28 ̄33]ꎮ不同α ̄淀粉酶含量下样品前处理方式对紫金糯2号稻米水解60min时淀粉水解率的影响如图2所示ꎮ从图2可以看出两种前处理方法对稻米的淀粉水解率存在一定的差异ꎬ其中咀嚼的淀粉水解率虽然在200U/ml和250U/mlα ̄淀粉酶含量下ꎬ显著高于人工研磨ꎬ其原因可能是咀嚼处理方法下人体口腔分泌的唾液会促进样品的水解ꎮ但是随着α ̄淀粉酶含量的增加ꎬ增加了酶与底物的充分接触ꎬ两种前处理方法对样品淀粉水解率的差异在缩小ꎮ为了提高检测方法的可比较性ꎬ选用人工研磨(用研棒挤压30下)作为样品前处理方法ꎬ以减少前处理方法造成淀粉水解程度的差异ꎮ2.1.2㊀淀粉体外水解酶含量的确定2.1.2.1㊀α ̄淀粉酶含量的选择㊀不同α ̄淀粉酶含量245江苏农业学报㊀2023年第39卷第2期图2㊀不同前处理方法对紫金糯2号稻米淀粉水解率的影响Fig.2㊀Effectsofdifferentpretreatmentmethodsonstarchhy ̄drolysisrateinZijinnuo2对紫金糯2号㊁南粳04062㊁宁西优Y16稻米样品进行90min水解后淀粉水解率变化如图3所示ꎮ从图3可以看出ꎬ随着反应液中α ̄淀粉酶含量增加ꎬ3种样品的水解率不断上升ꎬ其中糯稻的水解率最高ꎬ籼稻的水解率最低ꎬ该结果与王淑颖等[34]的研究结果一致ꎮ值得关注的是ꎬ当α ̄淀粉酶含量增加到300U/ml时ꎬ3种稻米样品区分比较明显ꎮ进一步增加酶含量ꎬ对样品的水解率增幅有限ꎬ结合图2样品前处理的结果以及节约成本的考虑ꎬ选择300U/mlα ̄淀粉酶含量为稻米样品体外水解的适宜酶含量ꎮ图3㊀不同α ̄淀粉酶含量对样品淀粉水解率的影响Fig.3㊀Theeffectofdifferentα ̄amylasecontentonthehydroly ̄sisrateofricestarch2.1.2.2㊀淀粉糖苷酶含量的选择㊀紫金糯2号㊁南粳04062㊁宁西优Y16稻米样品添加300U/mlα ̄淀粉酶水解60min后ꎬ进一步添加不同含量的淀粉糖苷酶到反应液中ꎬ继续水解40minꎬ3个样品的淀粉水解率如表1所示ꎮ在0~50U/mlꎬ随含量的增加淀粉水解率增加ꎬ而且在50U/ml淀粉糖苷酶含量下ꎬ3个样品水解程度有差异ꎮ当淀粉糖苷酶含量进一步增加时ꎬ紫金糯2号稻米淀粉水解率并没有显著增加ꎬ因此ꎬ淀粉糖苷酶50U/ml作为适宜含量ꎮ2.1.3㊀加酶顺序的确定㊀紫金糯2号稻米经前处理后ꎬα ̄淀粉酶和淀粉糖苷酶合并后添加水解60minꎬ其淀粉水解率为41.67%ʃ0 62%ꎬ显著高于依次加入两种酶的处理(30.13%ʃ0 67%)ꎬ而且两种酶合并后添加水解时间可以节省至少50minꎬ为此ꎬ认为采用α ̄淀粉酶和淀粉糖苷酶合并后添加的方法检测精米GI更高效ꎮ2.2㊀稻米体外淀粉水解优化方法在不同品种稻米水解中的应用㊀㊀本研究选取了9个不同稻米样品ꎬ采用本研究建立的水解方法ꎬ检测样品体外水稻后葡萄糖浓度随水解时间的变化ꎮ结果(图4)显示ꎬ白面包与一些常规稻米样品的淀粉水解率差异不大ꎬ用之来做GI估算的对照样品难以区分稻米样品间差异ꎮ而可溶性淀粉的淀粉水解率显著高于检测样品ꎬ因而更有利于区分升糖指数差异不大的遗传群体ꎮ在0~60min水解时间ꎬ每个样品水解液的葡萄糖浓度和淀粉水解率均随水解时间的增加而增加ꎬ在前20min内水解最快(图4)ꎮ水解60min后ꎬ紫金糯2号稻米的水解率最高ꎬ降特3D特制脱水加工大米最低ꎮ降特3D特制脱水加工大米为即食大米ꎬ也就是通过脱水获得的稻米样品ꎬ其含水量较低ꎬ因此ꎬ具有稍低的淀粉水解率ꎬ这一结果与Ritudom ̄phol等研究结果一致[35]ꎮ已有研究结果表明ꎬ淀粉颗粒粒度㊁膳食纤维含量㊁直链淀粉与支链淀粉的比例㊁结晶度和直链淀粉 ̄脂质复合物也会影响淀粉水解率[36 ̄37]ꎬ深入分析上述样品的淀粉组成将有助于获得更多的低GI稻米的特征ꎬ加速低GI稻米品种的筛选和选育ꎮ2.3㊀稻米淀粉体外消化的升糖指数的估算根据公式3和公式4估算得到的升糖指数(eGI)如表2所示ꎮ从表中可以看出ꎬ两种算法得到的升糖指数表现出一定的同步性ꎬ但用60min水解得到的葡萄糖质量与等质量的葡萄糖估算的升糖指数整体上小于用淀粉水解曲线积分面积估算的升糖指数ꎮ相对而言ꎬ用60min水解得到的葡萄糖质量与等质量的葡萄糖来估算样品的eGI只体现了水解反应60min的葡萄糖含量ꎬ没有全面反映淀粉水解成葡萄糖的过程ꎮ比如JYJ ̄1和JYJ ̄2稻米ꎬ从水解60min后葡萄糖浓度看ꎬ两者差别不大ꎬ但是从两材料的水解345李颖颖等:稻米淀粉体外消化试验方法的优化及应用曲线看ꎬJYJ ̄2稻米在水解时ꎬ前30min葡萄糖的浓度低于JYJ ̄1稻米ꎬ而水解30min后则高于JYJ ̄1稻米ꎬ说明两材料的快消化淀粉(0~20min水解的淀粉)和慢消化淀粉(20min以后水解的淀粉)比例有差异ꎮ其中通过淀粉水解曲线积分面积的估算方法ꎬ可以反映稻米淀粉体外水解过程中的不同稻米组分对GI的影响ꎮ参考体内升糖指数的标准测定方法ꎬ认为通过体外不同水解时间的淀粉水解曲线积分面积获得的eGI可能更接近于体内升糖指数测定的数值ꎮ但由于淀粉在体内消化㊁吸收及代谢过程比体外的水解更为复杂ꎬ稻米产品的GI准确测定还是以人体试验为主ꎬ但用稻米淀粉体外水解建立的稻米GI估算方法对低GI稻米资源以及遗传材料的初级筛选是合适的ꎮ表1㊀不同淀粉糖苷酶含量对稻米样品淀粉水解率的影响Table1㊀Effectsofdifferentamyloglucosidasecontentonstarchhydrolysisrateofricesamples样品㊀㊀㊀水解率(%)淀粉糖苷酶含量10U/ml淀粉糖苷酶含量20U/ml淀粉糖苷酶含量30U/ml淀粉糖苷酶含量40U/ml淀粉糖苷酶含量50U/ml淀粉糖苷酶含量60U/ml淀粉糖苷酶含量70U/ml宁西优Y16稻米12.36ʃ0.70d14.30ʃ0.18c15.04ʃ0.07c17.56ʃ0.44b19.75ʃ0.29a--南粳04062稻米13.42ʃ0.04e16.37ʃ0.07d18.84ʃ0.26c19.61ʃ0.39b21.17ʃ0.42a--紫金糯2号稻米--19.56ʃ0.18c20.22ʃ0.14b23.50ʃ0.51a23.04ʃ0.34a23.46ʃ0.32a同一行不同小写字母表示相同样品不同酶含量下淀粉水解率存在显著性差异(P<005)ꎮ图4㊀不同样品水解液中葡萄糖含量和淀粉水解率随时间变化特征Fig.4㊀Thevariationcharacteristicsofglucosecontentandstarchhydrolysisrateofdifferentsampleswithtime表2㊀不同方法估算的稻米升糖指数比较Table2㊀Comparisonofglycemicindexofricesamplesestimatedbydifferentmethods样品㊀㊀㊀水解60min得到的葡萄糖质量与等质量的葡萄糖估算的升糖指数(%)淀粉水解曲线积分面积估算的升糖指数(%)紫金糯2号稻米74.20ʃ0.77a80.71ʃ0.88a南粳04062稻米70.31ʃ1.04b74.89ʃ0.50b宁西优Y16稻米61.20ʃ1.27d72.78ʃ1.56cJYJ ̄1稻米64.08ʃ0.82c69.71ʃ1.35cJYJ ̄2稻米65.74ʃ0.89c71.44ʃ1.00c米抗儿低GI精米48.78ʃ0.90e64.20ʃ1.46e米无忌高抗性淀粉精米44.60ʃ0.84f62.08ʃ0.81e降特3D特制脱水加工精米37.11ʃ0.50g60.46ʃ1.01f牧谷屋中GI精米48.92ʃ1.40e66.73ʃ1.15d同列不同小写字母表示样品间差异显著(P<0 05)ꎮ3㊀结论人类对米饭的消化和吸收是完全或接近完全的[38]ꎬ然而ꎬ消化速度受到一些内在因素(例如淀粉性质㊁淀粉 ̄蛋白质相互作用和淀粉 ̄脂质相互作用)[39]和外部因素(例如水热处理和家庭烹饪的变化)的影响[40]ꎮ淀粉体外水解方法可以快速经济地检测稻米的升糖特性ꎬ为低GI稻米品种筛选与培育提供有效的技术手段ꎮ本研究利用两种淀粉酶ꎬ在60min内ꎬ通过淀粉体外消化的水解曲线ꎬ估算了稻米样品的升糖指数ꎬ可以有效区分不同升糖特性的稻米样品ꎮ与已报道的淀粉体外消化法相比ꎬ该方法的主要优点是操作简单㊁快速且相对便宜ꎬ为低升糖指数的水稻种质资源大批量筛选提供了一种445江苏农业学报㊀2023年第39卷第2期实用方法ꎮ参考文献:[1]㊀INTERNATIONALDIABETESFEDERATION.IDFdiabetesatlas(EB/OL).[2022/04/20].https://www.diabetesatlas.org/en/. [2]㊀MICHELLERTꎬASGARFꎬABISHEKBSꎬetal.Intrinsicandextrinsicfactorsaffectingricestarchdigestibility[J].TrendsinFoodScience&Technologyꎬ2019ꎬ88:10 ̄22.[3]㊀冯㊀博.低GI与低碳水饮食对超重㊁肥胖症者的减脂效果[J].食品安全导刊ꎬ2022(21):134 ̄136.[4]㊀FOODANDAGRICULTUREORGANIZATIONOFTHEUNITEDNATION.Ricemarketmonitor(EB/OL).[2022/04/20].ht ̄tps://www.fao.org/markets ̄and ̄trade/commodities/rice/fao ̄rice ̄price ̄update/en/[5]㊀BUTARDOVMꎬSREENIVASULUNꎬJULIANOBO.Improvingricegrainquality:state ̄of ̄the ̄artandfutureprospects[J].Meth ̄odsinMolecularBiologyꎬ2019ꎬ1892:19 ̄55.[6]㊀LEEKYꎬLEEHG.Comparativeeffectsofslowlydigestibleandresistantstarchfromriceinhigh ̄fatdiet ̄inducedobesemice[J].FoodScienceandBiotechnologyꎬ2016ꎬ25(5):1443 ̄1448. [7]㊀TRINIDADTPꎬMALLILLINACꎬENCABORRꎬetal.Theeffectofapparentamylosecontentanddietaryfibreontheglycemicre ̄sponseofdifferentvarietiesofcookedmilledandbrownrice[J].InternationalJournalofFoodSciencesandNutritionꎬ2013ꎬ64(1):89 ̄93.[8]㊀PHYLLISAC.Fact:Theglycemicresponsetofoods[J].NutritionTodayꎬ1984ꎬ19(2):6 ̄11.[9]㊀JAMESWWꎬJOHNAMꎬCHARLESSꎬetal.Simulatinghumancarbohydratedigestioninvitro:areviewofmethodsandtheneedforstandardisation[J].InternationalJournalofFoodScience&Technologyꎬ2008ꎬ43(12):2245 ̄2256.[8]㊀杨小雪ꎬ王丽丽ꎬ丁㊀岚ꎬ等.加工方式对红小豆粉理化性质及预估血糖生成指数的影响[J].中国粮油学报ꎬ2021ꎬ36(1):33 ̄38.[9]㊀GRANFELDTYꎬBJÖRCKIꎬDREWSAꎬetal.Aninvitroproce ̄durebasedonchewingtopredictmetabolicresponsetostarchincerealandlegumeproducts[J].AmericanJournalofClinicalNu ̄tritionꎬ1994ꎬ59(3):777S.[10]BUTARDOVMꎬSREENIVASULUN.Tailoringgrainstoragere ̄servesforahealthierricedietanditscomparativestatuswithothercereals[J].InternationalReviewofCellandMolecularBiologyꎬ2016ꎬ23:31 ̄70.[11]姜彩霞ꎬ汪㊀睿ꎬ郑喜群ꎬ等.白芸豆中α ̄淀粉酶抑制剂的制备及性质研究[J].食品科技ꎬ2022ꎬ47(2):251 ̄255.[12]李㊀恒ꎬ刘㊀静ꎬ孙桂菊ꎬ等.抗性淀粉㊁脂肪和蛋白质对淀粉体外消化速度的影响[J].卫生研究ꎬ2007(3):308 ̄310. [13]BUTARDOVMꎬSREENIVASULUNꎬJULIANOBO.Improvingricegrainquality:State ̄of ̄the ̄artandfutureprospects[J].Meth ̄odsinMolecularBiologyꎬ2019ꎬ1892:19 ̄55.[14]张翼麟ꎬ谢㊀勇ꎬ易川虎ꎬ等.青稞结构对淀粉体外消化的影响[J].食品与发酵工业ꎬ2021ꎬ47(15):98 ̄103.[15]曾㊀悦.稻谷类及豆类碳水化合物消化速度与血糖反应的初步研究[D].北京:中国农业大学ꎬ2005.[16]KAILꎬWANGSꎬLECꎬetal.Discoveryofalow ̄glycemicindexpotatoandrelationshipwithstarchdigestioninvitro[J].BritishJournalofNutritionꎬ2013ꎬ111(4):699 ̄705.[17]TOUTOUNJIMRꎬBUTARDOVMꎬZOUWJꎬetal.Ahigh ̄throughputinvitroassayforscreeningricestarchdigestibility[J].Foodsꎬ2019ꎬ8(12):601.[18]FERNANDESJMꎬMADALENADAꎬPINHEIROACꎬetal.Riceinvitrodigestion:applicationofINFOGESTharmonizedpro ̄tocolforglycemicindexdeterminationandstarchmorphologicalstudy[J].JournalofFoodScienceandTechnologyꎬ2020ꎬ57:1393 ̄1404.[19]JENKINSDJꎬWOLEVERTMꎬTAYLORRHꎬetal.Glycemicin ̄dexoffoods:aphysiologicalbasisforcarbohydrateexchange[J].TheAmericanJournalofClinicalNutritionꎬ1981ꎬ34(3):362 ̄366. [20]FITZGERALDMAꎬRAHMANSꎬRESURRECCIONAꎬetal.I ̄dentificationofamajorgeneticdeterminantofglycemicindexinrice[J].Riceꎬ2011ꎬ4(2):66 ̄74.[21]LINLSꎬCAICHꎬGILBERTRGꎬetal.Relationshipsbetweenamylopectinmolecularstructuresandfunctionalpropertiesofdiffer ̄ent ̄sizedfractionsofnormalandhigh ̄amylosemaizestarches[J].FoodHydrocolloidsꎬ2016ꎬ52:359 ̄368.[22]GOÑIIꎬGARCIA ̄ALONSOAꎬSAURA ̄CALIXTOF.Astarchhy ̄drolysisproceduretoestimateglycemicindex[J].NutritionRe ̄searchꎬ1997ꎬ17(3):427 ̄437.[23]中华人民共和国国家质量监督检验检疫总局ꎬ中国国家标准化管理委员会.优质稻谷GB/T㊀17891-2017[S].北京:中国标准出版社ꎬ2017.[24]刘㊀辉ꎬ王成祥ꎬ刘兵军ꎬ等.一种血糖生成指数体外检测方法:CN105911007A[P].2016 ̄08 ̄31.[25]顾㊀娟ꎬ洪㊀雁ꎬ顾正彪.荞麦淀粉理化性质的研究[J].食品与发酵工业ꎬ2008(4):36 ̄39.[26]AHMEDRꎬSEGALIꎬHASSANH.Fermentationofdietarystarchinhumans[J].AmericanJournalofGastroenterologyꎬ2000ꎬ95(4):1017 ̄1020[27]徐㊀箐ꎬ柳㊀嘉ꎬ林㊀静ꎬ等.低GI淀粉原料的筛选及理化特性和体外消化特性的研究[J].食品研究与开发ꎬ2020ꎬ41(20):8 ̄14.[28]LICꎬYUWWꎬWUPꎬetal.Currentinvitrodigestionsystemsforunderstandingfooddigestioninhumanuppergastrointestinaltract[J].TrendsinFoodScience&Technologyꎬ2020ꎬ96:114 ̄126. [29]PANZꎬYEAQꎬLISꎬetal.Dynamicinvitrogastricdigestionofsheepmilk:Influenceofhomogenizationandheattreatment[J].Foodsꎬ2021ꎬ10(8):1938.[30]CAIYDꎬQINWꎬSUNANTHAKꎬetal.Impactofparticlesizeofpulverizedcitruspeeltissueonchangesinantioxidantpropertiesofdigestedfluidsduringsimulatedinvitrodigestion[J].FoodSci ̄545李颖颖等:稻米淀粉体外消化试验方法的优化及应用enceandHumanWellnessꎬ2020ꎬ9(1):58 ̄63.[31]TSUGAMIYꎬSUZUKINꎬKAWAHARAMꎬetal.Establishmentofaninvitroculturemodeltostudymilkproductionandtheblood ̄milkbarrierwithbovinemammaryepithelialcells[J].AnimalSci ̄enceJournalꎬ2020ꎬ91(1):e13355.[32]MUIRJGꎬO DEAK.Measurementofresistantstarch:factorsaf ̄fectingtheamountofstarchescapingdigestioninvitro[J].Ameri ̄canJournalofClinicalNutritionꎬ1992ꎬ56(1):123 ̄127. [33]曾㊀悦ꎬ刘㊀芳ꎬ刘㊀波ꎬ等.一种淀粉类食品消化速度体外测定法的探讨及应用[J].食品与发酵工业ꎬ2005(5):114 ̄118. [34]王淑颖ꎬ范志红ꎬ刘㊀波.不同品种稻米中碳水化合物的消化特性[J].中国农业大学学报ꎬ2012ꎬ17(4):129 ̄134. [35]RITUDOMPHOLOꎬLUANGSAKULN.OptimizationofprocessingconditionofinstantricetolowertheGlycemicIndex[J].JournalofFoodScienceꎬ2019ꎬ84(1):101 ̄110.[36]RANAWANADꎬHENRYCJꎬLIGHTOWLERHJꎬetal.Glycae ̄micindexofsomecommerciallyavailablericeandriceproductsinGreatBritain[J].InternationalJournalofFoodSciencesandNutri ̄tionꎬ2009ꎬ60(4):99 ̄110.[37]ARAYAHꎬCONTRERASPꎬALVIñAMꎬetal.Acomparisonbe ̄tweenaninvitromethodtodeterminecarbohydratedigestionrateandtheglycemicresponseinyoungmen[J].EuropeanJournalofClinicalNutritionꎬ2002ꎬ56(8):735 ̄739.[38]JULIANOBO.Rice:Chemistryandtechnology[M].StPaulꎬMN:AmericanAssociationofCerealChemistsꎬ1985[39]BUTARDOVMꎬSREENIVASULUNꎬJULIANOBO.Ricegrainquality:Stateoftheartandfutureprospects[M]//SREENIVASU ̄LUN.Ricegrainquality:Methodsandprotocols.Clifton:HumanaPressꎬ2019[40]STROCCHIAꎬLEVITTMD.Measurementofstarchabsorptioninhumans[J].CanadianJournalofPhysiologyandPharmacologyꎬ1991ꎬ69:108 ̄110.(责任编辑:石春林)645江苏农业学报㊀2023年第39卷第2期。
体外消化法评定饲料营养价值研究进展

体外消化法评定饲料营养价值研究进展对各种饲料的营养价值进行准确评定是配制日粮的关键。
众所周知,评定饲料的营养价值的方法主要有化学分析法、体内法和体外法。
化学分析法是评定饲料营养价值的一种常用方法,如总能、总磷、粗蛋白、粗纤维和粗脂肪等测定方法。
但利用概略养分分析所测得的饲料养分与动物消化吸收养分间存在很大差异,不足以准确地反映出饲料的实际营养价值。
利用动物试验能够比较准确地对饲料营养价值进行评定,但这些方法往往耗时、费力,很难在短时间内对大量的饲料样品进行评价分析,且生物学影响因素多,结果变异较大,重复性差,限制了其实用性。
因此,人们建立了体外法来研究饲料的营养价值。
随着技术的进步和动物消化生理的研究进展,利用动物体外消化模拟技术来研究饲料的营养价值也成为可能。
体外法具有简单、快捷、重演性好等特点,在饲料营养价值评定等方面占有重要地位。
本文就体外法在不同动物上的应用状况、应用中存在的问题及应用前景作以综述,以提高人们对体外法的认识和重视。
体外消化在猪上的应用由于猪个体较大,体外消化所需要的一些消化酶,如胃蛋白酶和胰酶以及小肠液等比较容易获得。
而且一次性获得数量也比较大。
因此,体外消化法在猪上的研究和应用较多。
猪体外消化法有pH法、单酶(比如胃蛋白酶)法、两步法(胃蛋白酶-胰酶法)、三步法(胃蛋白酶-胰酶-碳水化合物法)等,它们都能很好地预测猪饲料的体内消化情况。
利用NaOH不断中和蛋白质水解过程中所产生的H+,使pH保持恒定不变,并记录所用NaOH数量。
利用该方法所测定的31种植物性蛋白质饲料和11种动物性蛋白质饲料体外消化率与猪体内消化率存在显著相关(r=0.85和0.92)。
在对89个日粮样品进行评定时发现,用胃蛋白酶在 pH=1.5的条件下处理饲料样品,有机物质体外消化率与体内消化率相关系数很高(r=0.92),可以用来预测饲料在猪体内的消化率。
研究员对胃蛋白酶 -胰酶法进行了改进。
在分离已消化养分与残渣时,先利用三氯乙酸将可溶性肽和蛋白质沉淀出来,然后用测定纤维的标准过滤器过滤消化食糜液,分离已消化养分。
验证体外消化的方法与评价_概述及解释说明

验证体外消化的方法与评价概述及解释说明1. 引言1.1 概述本文旨在探讨体外消化的方法与评价,针对这一主题进行综述和解释。
随着生物科技的发展,体外消化作为一种重要的研究手段被广泛应用于生命科学领域,尤其在食品营养学和消化疾病研究中具有重要意义。
1.2 文章结构本文将按以下顺序组织:首先介绍整篇文章的大纲结构,并详述各个部分的内容安排。
然后进入正文部分,逐步展开对方法与评价的概述、验证重要性的解释以及最后得出的结论。
1.3 目的本文旨在向读者介绍体外消化方法与评价方面的知识,并深入探讨其在实验设计和结果可信度方面的重要性。
通过详细描述相关概念、技术和原理,希望能够给读者提供一个全面而清晰的认识,从而增强他们对于该领域的理解和应用能力。
以上是文章“1. 引言”部分所包含内容,请您根据需要进一步完善和调整。
2. 正文体外消化是一种常见的实验方法,用于模拟人体内消化过程,以便研究食物的消化和吸收情况。
该方法广泛应用于食品科学、药物开发和营养学等领域中。
在体外消化实验中,通常需要模拟口腔、胃和小肠三个部位的消化过程。
首先是口腔阶段,通过加入唾液来模拟咀嚼和混合食物的过程;接着是胃阶段,将酸性胃液加入样品中,模拟胃酸对食物的分解作用;最后是小肠阶段,添加碱性液体以调节pH值,并加入胰液来模拟小肠酶对食物的进一步分解。
对于每个阶段的体外消化实验,需要合理选择试剂配比和温度条件,并进行适当的时间控制。
为了评估消化效果,可以测量营养物质(如蛋白质、脂肪等)的降解率或者采用特定指标(如酶活性)来评估关键成分的变化。
此外,在进行实验前还需考虑是否需要添加辅酶、金属离子或其他辅助物质以提高消化效果。
同时,需要注意防止可能的实验干扰因素,如光照、氧化等。
体外消化实验的结果可用于研究食物的生物利用率、营养价值和口感特性。
通过模拟人体内消化过程,我们可以了解不同食物在机体中的代谢情况,并为开发更好的食品添加剂、制药工艺和营养配方提供参考依据。
动物蛋白质的胃蛋白酶消化率(体外消化)

四、计算
甲基红—乙醇指示剂(2g/L)
次甲基蓝指示剂(1g/L)
临时将上述两种指示液等量混合为混合指示剂。
三、仪器:
半微量定氮器
微量滴定管:最小分度0.01ml
四、分析步骤:
试样处理:将试样除去脂肪、骨及腱后,绞碎搅匀,称取约10.0g,置于锥形瓶中,加100ml水,不时振摇,浸渍30min后过滤,滤液帜置冰箱备用。
2、分析:
合格的鱼粉,其粗蛋白质的胃蛋白酶消化率应不小于85%;羽毛粉应在75%以上。
植物油脂检验不皂化物测定法GB5535-85
本标准适用于商品植物油不皂化物的测定。
油脂中不皂化物即油脂皂化时,与碱不起作用的,不溶于水的物质,包括留醇,脂溶性维生素的色素等。
一、仪器和用具:
锥形瓶:250ml
冷凝管
蒸馏滴定:将盛有10ml吸收液及5滴~6滴混合指示液的锥形瓶置于冷凝管的下端,并使其下端插入吸收液的液面下,准确吸取5.0ml上述试样滤液于蒸馏器反应室内,加5ml氧化镁混悬液(10g/L),迅速盖塞,并加水以防漏气,通入蒸汽,进行蒸馏,蒸馏5min即停止,吸收液用盐酸标准滴定溶液(0.010mol/L)或硫酸标准滴定溶液滴定,终点至蓝紫色。同时做试剂空白试验。
附:0.02mol/L硫代硫酸钠标准溶液的标定
1、标定:
精确称取0.15g于120℃烘3小时至恒重的基准重铬酸钾,置于碘量瓶中,溶于25ml水,加2g碘化钾及20ml硫酸溶液(20%),摇匀,于暗处放置10min。加150m水,用配制好的硫代硫酸钠溶液滴定。近终点时加3ml淀粉指示液(5g/L),继续滴定至溶液由蓝色变为亮绿色。同时作空白试验。
体外消化实验
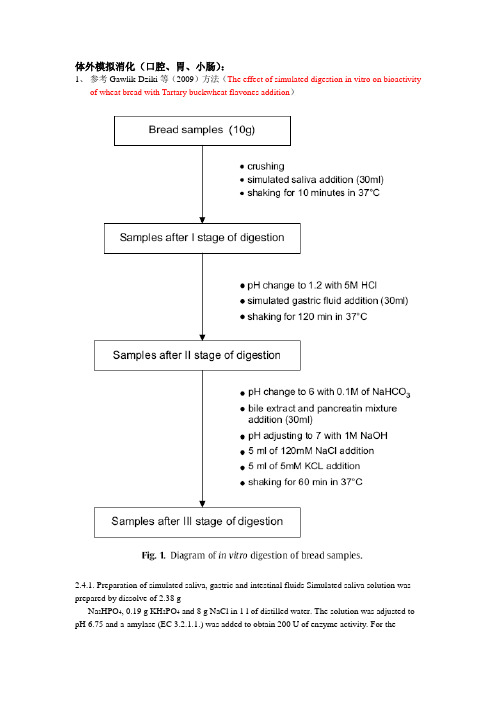
体外模拟消化(口腔、胃、小肠):1、参考Gawlik-Dziki等(2009)方法(The effect of simulated digestion in vitro on bioactivityof wheat bread with Tartary buckwheat flavones addition)2.4.1. Preparation of simulated saliva, gastric and intestinal fluids Simulated saliva solution was prepared by dissolve of 2.38 gNa2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and a-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For thegastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal. juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2.4.1. Preparation of simulated saliva, gastric and intestinal fluidsSimulated saliva solution was prepared by dissolve of 2.38 g Na2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and α-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For the gastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2、参考Versantvoort等(2005)(Applicability of an in vitro digestion model in assessing thebioaccessibility of mycotoxins from food)和Hur等(2009)的方法(Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion)Table 1Constituents and concentrations of the various synthetic juices of the in vitro digestion model representing fed conditionsSaliva 唾液Gastric juice 胃液Duodenal juice十二指肠液Bile juice 胆汁Inorganic solution 10 ml KCl 89.6g/l15.7 ml NaCl 175.3g/l40 ml NaCl175.3g/l30 ml NaCl175.3g/l10 ml KSCN20g/l3.0 ml NaH2PO4 88.8g/l40 ml NaHCO384.7 g/l68.3 ml NaHCO384.7 g/l10 ml NaH2PO488.8 g/l9.2 ml KCl 89.6 g/l10 ml KH2PO48g/l4.2 ml KCl 89.6 g/l 10 ml NaSO457g/l18 ml CaCl2· 2H2O22.2 g/l6.3 ml KCl89.6 g/l150 μl HCl 37%g/g1.7 ml NaCl175.3 g/l10 ml NH4Cl 30.6 g/l10 ml MgCl2 5g/l20 ml NaHCO384.7 g/l6.5 ml HCl 37%g/g180 μl HCl37%g/gOrganic solution 8 ml urea 25 g/l 10 ml glucose 65 g/l 4 ml urea 25 g/l 10 ml urea 25 g/l10 ml glucuronic acid(葡萄糖醛酸) 2g/l3.4 ml urea 25g/l10 ml glucosaminehydrochloride (盐酸氨基葡萄糖) 33g/lAdd to mixtureorganic+ inorganic solution290 mgα-amylase1g BSA9mlCaCl2· 2H2O22.2 g/l10ml CaCl2· 2H2O22.2 g/l15 mg uric acid 2.5 g pepsin 1g BSA 1.8 g BSA25 mg mucin 3 g mucin 9 g pancreatin 30 g bile1.5 g lipasepH 6.8 ± 0.2 1.30 ± 0.02 8.1 ± 0.2 8.2 ± 0.2 The inorganic and organic solutions are augmented to 500ml with distilled water. After mixing of the inorganic and organic solutions, some further constituents are added and dissolved. If necessary, the pH of the juices is adjusted to the appropriate interval.另外,抗性淀粉含量测定:1、参考Li等(2008)方法(Characterization of maize amylose-extender (ae) mutant starches. PartI: Relationship between resistant starch contents and molecular structures)2.3. Resistant starch (RS) contentRS contents of the ae-mutant starch samples were determined using the AOAC Method 991.43 for total dietary fiber (AOAC, 2003) and Englyst’s method (1992) for comparison.For the AOAC 991.43 method, starch (1.0 g, dry-starch basis, dsb) was suspended in a Mes-tris buffer solution (0.05 M, 40 ml) and hydrolyzed with 500 u of a-amylase from Bacilluslicheniformis (Sigma Chemical, Cat. No. A3403) in a boiling water-bath for 30 min with stir. The sample was then digested with protease from Bacillus licheniformis (5 mg, Sigma Chemical, Cat. No. P3910) at 60 ºC in a shaker waterbath for 30 min. The sample dispersion was adjusted to pH 4.4–4.6 by adding HCl and then hydrolyzed with amyloglucosidase (300 U, Sigma chemical, Cat. No. A9913) at 60 ºC in a shaker water-bath for 30 min. The digested sample was filtered through a celite layer in a crucible and washed twice with 15 ml of 78% ethanol, twice with 15 ml of 100% ethanol and rinsed with 15 ml of acetone. The remaining sample was dried in an oven at 100 ºC overnight. The resistant starch content was calculated using the equation:(%)RS content = Remaining sample weight (g, dsb)/initial sample weight (g, dsb) ×100%For RS determined using Englyst’s method (1992), Starch (1.000 g, db) in 20 mL of sodium acetate buffer (0.1 M, pH 5.2) was cooked in a boiling water-bath for 30 min. The starch dispersion was cooled down to 37 ºC, mixed with an enzyme solution (5 mL) consisting of pancreatin extract and amyloglucosidase, and incubated in a water-bath at 37 ºC. The pancreatin extract was prepared as follows; 3.0 g of pancreatin (Sigma, Cat. No. P7545) was suspended in 20 mL deionized water, stirred for 10 min at room temperature, and centrifuged at 1500g for 10 min. The enzyme solution was prepared by mixing 13.5 ml supernatant of pancreatin extract, 210 U amyloglucosidase (Sigma, Cat. No. A7095), and 1.0 mL deionized water. The rapid digestible starch (RDS) was defined as the total starch digested within the first 20 min, and the slowly digestible starch (SDS) was the starch digested between 20 and 120 min (Englyst et al., 1992). The resistant starch content was calculated as follows:(%)RS content = 100%×(total starch – RDS - SDS) (g, dsb)/total starch (g, dsb)澳大利亚NI 消化系统图片GI20。
大班科学实验教案:观察螃蟹的体外消化

大班科学实验教案:观察螃蟹的体外消化观察螃蟹的体外消化引言:螃蟹作为一种普遍存在于海洋和淡水中的生物,对于我们来说还是比较陌生的。
但是,螃蟹却是可以帮助我们了解许多生命科学领域的生物知识的。
在本次实验中,我们将会结合观察和实验的方式,了解螃蟹的体外消化过程。
一、实前准备工作1、实验器材:显微镜、玻璃盒子盛水的器皿、手套、实验夹、塑料袋、搅拌器等。
2、实验材料:螃蟹、人造海水、生物饲料等。
二、实验操作步骤1、螃蟹的喂养:在实验开始前,先给螃蟹喂养一段时间,等到螃蟹的摄食量增加至其体积的1/3以上时,才可使用螃蟹进行实验;2、取出螃蟹的胃肠:取出螃蟹,穿上手套,将其翻转并取出螯足,用手套将其头钳住,然后用实验夹夹住螃蟹身体的一侧,将螃蟹向另一侧腹面翻转。
用剪刀沿着背骨两侧对称地切开,然后将背骨剃开。
在螃蟹腹面,将胃肠取出并洗净;3、准备观察:将胃肠置于玻璃盒子中,加入适量的人造海水,使胃肠能够浸在海水中。
用实验夹夹住玻璃盒子,放入适当的温度下温育30分钟左右,使螃蟹的体温达到与外界相同;4、观察过程:在玻璃盒子上覆盖透明膜,用显微镜观察螃蟹的胃肠内消化液的排出情况;5、消化液的采集:在观察消化液排出的同时,用搅拌器将海水和消化液搅拌均匀,并倒入塑料袋中,将其封紧,标注消化液产生的时间及方法;三、实验结果分析1、观察胃肠内消化液排出情况:在温育30分钟左右,观察到螃蟹的消化液缓缓从胃肠内排出,随着时间的推移,消化液越来越明显地排出,最终几乎全部排出。
2、消化液的采集结果分析:经过观察和测量,我们得到了消化液的产生时间及方式,可知螃蟹在体外消化过程中,主要依赖于胃液的作用,通过酸性环境和酶的作用,在其中分解螃蟹摄食的食物。
四、实验总结及意义通过上述实验,我们从实践和观察的角度深入认识了生命科学领域中螃蟹的体外消化过程,以及消化液在其中的作用。
同时,通过这样的实验教学方式,也为学生提供了一种全新的、直观且有趣的学习方式。
两级离体消化率法测定的原理与主要步骤

两级离体消化率法测定的原理与主要步骤1. 了解两级离体消化率法说到两级离体消化率法,首先得问一句:你知道我们吃的东西是怎么消化的吗?别急,今天咱们就来聊聊这个“消化之旅”。
简单来说,这个方法是用来评估食物在肚子里能被分解成多少营养成分的。
就像是把美味的饭菜送到一个“测试舱”,看它能不能被“消化系统”友好地处理掉。
1.1 原理揭秘这方法的原理其实很简单,基本上就是模仿我们身体里的消化过程。
你想想,咱们吃的东西在肚子里经历了多少“折腾”:先是咀嚼,再是胃酸的“洗礼”,最后肠道里的细菌和酶来帮忙。
两级离体消化率法就是把这些步骤简化到实验室里,让食物在“模拟”的环境中接受测试。
1.2 重要性那么,这个法子到底有什么用呢?说白了,研究人员可以通过这种方法来了解不同食物的营养价值和消化能力。
比如,有些食物虽然看起来很健康,但经过测试后发现其实消化率不高,最后营养吸收的效果可能就大打折扣了。
就像是你买了个苹果,结果咬了一口发现里面全是坏的,真是让人心塞。
2. 主要步骤说到操作流程,那就得细细说道了。
要进行这个测试,步骤虽然多,但不难,跟做一道简单的家常菜差不多。
2.1 准备样品首先,你得准备好样品。
这就像备菜一样,选择你要测试的食物,可能是米饭、面条,甚至是蔬菜。
然后,把这些食物切成小块,越小越好,便于后面的处理。
对了,这里可别马虎,卫生问题可是第一位的!2.2 体外消化过程接下来就是正式的“消化”过程了。
首先把样品放进一个特制的容器,添加一定比例的消化酶和胃液,模拟咱们的胃。
这一步得讲究,温度、时间都要控制得当。
你可以想象一下,就像你把一锅水放在火上,等它煮沸。
然后,经过一段时间的“炖煮”,样品就会被分解得七七八八。
2.3 收集数据最后一步就是收集数据了。
通过过滤、离心等方式,把消化后的样品和未消化的部分分开。
然后,分析这些样品,看看有多少营养成分被释放出来,消化率到底是多少。
简而言之,就是看看你的食物在“胃里”表现得如何。
羊奶婴儿配方奶粉中蛋白质体外模拟消化研究

1.4 指标测定
1.4.1 蛋白质体外消化率的测定 乳样中蛋白质的消化率测定参照于立梅等[9]和任大喜
等[10]的方法。取4mL乳样消化液于10mL离心管中,向其
中加入等体积24%的三氯乙酸溶液沉淀蛋白, 14000r/min 离心20min,收集上清液,用凯氏定氮法测定其中氮的含
量(盐酸标准液用0.01mol/L),样品中蛋白质含量用凯氏
digestibility of proteins was measured. The results showed that the in vitro gastric, intestinal and total digestibility of proteins
in goat milk formula was significantly higher than that in cow milk formula and whole goat milk powder (P < 0.05), and
胃蛋白酶、胰蛋白酶 美国Amresco公司;硫酸 铜、硫酸钾、三氯乙酸、98%浓硫酸、盐酸、硼酸、甲 基红、溴甲酚绿、95%乙醇、氢氧化钠均为分析纯。 1.2 仪器与设备
HH-S4型电热恒温水浴锅 北京科伟永兴仪器公 司;KDY-9810凯氏定氮仪 北京市通润源机电技术有 限责任公司;消化炉 瑞典FOSS公司;智能型全温振 荡器 金坛市金南仪器制造有限公司;低温高速离心机
1.3.3 体外模拟总消化 体外模拟总消化参照Johns[8]的方法并对其加以改
进。将奶粉样品用蒸馏水配制成蛋白质质量分数为1%的 乳液,于37℃水浴中预热10min,用1mol/L的HCl调乳液 pH3。在每100mL乳样中添加3×106U胃蛋白酶(即每克 蛋白质对应的酶用量为3×106U),于37℃恒温摇床上消 化水解1.5h,然后用lmol/L的NaOH调节乳液pH值至7。 再向每100mL乳样中添加1.25×105U胰蛋白酶(即每克蛋 白质对应的酶用量为1.25×105U),于37℃恒温摇床上消 化水解2h,然后沸水浴5min灭活,测定其中蛋白质的总 消化率。
大豆组织蛋白发酵产品的体外消化特性

大豆组织蛋白发酵产品的体外消化特性目录一、内容概述 (2)1. 研究背景与意义 (3)2. 国内外研究现状概述 (3)二、材料与方法 (4)1. 原料选择与处理 (6)2. 发酵剂的选用与培养条件 (7)3. 体外消化模型的建立 (8)4. 口感与营养成分分析检测方法 (8)三、大豆组织蛋白发酵产品的体外消化特性分析 (10)1. 消化物释放规律 (12)2. 主要消化酶活性变化 (13)3. 消化物分子结构变化 (14)4. 活性肽的释放与鉴定 (15)四、影响因素探讨 (16)1. 发酵温度的影响 (17)2. 发酵时间的影响 (18)3. 发酵剂添加量的影响 (19)4. 原料处理方式的影响 (20)5. 营养成分的保护与流失 (21)五、优化策略与建议 (22)1. 发酵工艺的优化 (24)2. 添加剂的合理使用 (25)3. 保护营养成分的措施 (26)4. 持续改进的方向与展望 (27)六、结论 (28)1. 研究成果总结 (29)2. 存在的问题与不足 (30)3. 对未来研究的建议 (31)一、内容概述本文深入探讨了大豆组织蛋白发酵产品的体外消化特性,旨在全面评估其在人体内的消化吸收情况。
通过一系列精心设计的实验,文章详细分析了发酵过程中大豆蛋白的结构变化、微生物菌群的演替以及潜在的营养物质释放。
研究人员首先对大豆组织蛋白进行了详细的预处理,以确保实验结果的准确性和可靠性。
他们利用特定的发酵剂进行发酵,并在设定的时间点收集样品,以分析发酵过程中蛋白质结构的变化和微生物菌群的动态变化。
通过对发酵后的大豆组织蛋白进行一系列的体外消化实验,包括模拟胃液和肠液的消化过程,文章揭示了发酵产品在人体内的消化吸收特性。
这些实验结果表明,经过发酵处理的大豆组织蛋白其结构变得更加松散,易于被人体消化酶分解,从而提高了其营养物质的生物利用率。
文章还对发酵过程中可能产生的有害物质进行了评估,确保了发酵产品的安全性。
5种粉质类豆类的体外消化特性研究

5种粉质类豆类的体外消化特性研究郑欢欢1,2,张晶晶2,3,陈 艳4,汪 敏2,3*(1.西南医科大学 公共卫生学院,四川泸州 646000;2.西南医科大学附属医院 临床营养科,四川泸州 646000;3.血流动力学医工结合泸州重点实验室,四川泸州 646000;4.四川省旌晶食品有限公司,四川德阳 618000)摘 要:目的:探讨5种粉质类豆类的体外消化特性。
方法:通过体外消化方法测定绿豆粉、鹰嘴豆粉、红豆粉、黄豆粉、青豆粉的总淀粉含量、淀粉组分、体外淀粉水解率等指标,并计算预测血糖生成指数(e xpected Glycemic Index,eGI)。
结果:绿豆粉的总淀粉含量最高(45.14 g/100 g),青豆粉最低(0.16 g/100 g);粉质类豆类中以抗性淀粉为主,其抗性淀粉含量顺序为青豆粉(99%)>黄豆粉(97.91%)>红豆粉(72.93%)>鹰嘴豆粉(67.14%)>绿豆粉(66.87%)。
经体外测定,5种粉质类豆类的eGI值为绿豆粉(30.04)、红豆粉(26.96)、鹰嘴豆粉(26.88)、黄豆粉(9.57)、青豆粉(8.81)。
结论:本次实验结果显示5种粉质类豆类的eGI值均小于55,且淀粉组分以抗性淀粉为主。
关键词:粉质类豆类;体外消化;血糖生成指数Study on in Vitro Digestion Characteristics of Five Types ofPowdered LegumeZHENG Huanhuan1,2, ZHANG Jingjing2,3, CHEN Yan4, WANG Min2,3*(1.College of Public Health, Southwest Medical University, Luzhou 646000, China;2.Department of Clinical Nutrition, The Affiliated Hospital of Southwest Medical University, Luzhou 646000, China;3.Hemodynamics and Medical Engineering Combination Key Laboratory of Luzhou, Luzhou 646000, China;4.Sichuan Jingjing Foodstuff Co., Ltd., Deyang 618000, China)Abstract: Objective: To explore the in vitro digestion characteristics of five powdery legumes. Method: The total starch content, starch components, and in vitro starch hydrolysis rate of mung bean powder, chickpea powder, red bean powder, soybean powder, and green bean powder were determined by in vitro digestion method, and the expected Glycemic Index (eGI) was calculated. Result: The total starch content of mung bean powder is the highest (45.14 g/100 g), and the lowest (0.16 g/100 g); among powdery legumes, resistant starch is the main component, with the order of resistant starch content being green bean powder(99%)>yellow bean powder(97.91%)>red bean powder(72.93%)>chickpea powder(67.14%)>mung bean powder(66.87%). According to in vitro measurements, the eGI values of five powdery legumes are mung bean powder (30.04), red bean powder (26.96), chickpea powder (26.88), soybean powder (9.57), and green bean powder (8.81). Conclusion: The results of this experiment show that the eGI values of the five powdery legumes are all less than 55, and the starch component is mainly resistant starch.Keywords: powdered legume; in vitro digestion; glycemic index豆类泛指豆科植物中生产豆荚的植物,被联合国粮食及农业组织定义为“可收获干籽的作物”[1]。
抗性淀粉体外消化模拟的研究_尚晓娅

摘 要: 采用体外消化模拟方法, 研究了抗性淀粉在人工胃肠液 和大肠液中的消化吸收情况, 并用原淀粉作为对照组。结 果表明, 抗性淀粉和原淀粉在生理盐水中均没有被分解, 生理盐水对抗性淀粉的消化毫无影响。与对照组原淀粉 相 比 , 抗 性 淀 粉 在 人 工 胃 液 ( pH3、pH4、pH5) 和 人 工 肠 液 ( pH6.8) 中变化很小, 人工胃液和人工肠液对抗性 淀 粉 不 起消化作用。抗性淀粉在大肠液中有明显的失重, 说明大 肠液对抗性淀粉有影响, 抗性淀粉能够被大肠中的微生 物发酵或部分发酵。从而说明抗性淀粉不能在胃和小肠 中消化吸收。
1 材料与方法
1.1 实验材料
50%高链玉米淀粉 国民淀粉公司; 50% ̄60%抗 性淀粉 实验室自制; 生理盐水 广军区总医院; 人 工胃液、人工肠液 实验室自配; 大肠液 兔中提取。
1.2 人工胃液及人工肠液的配制
1.2.1 人工胃液的配制[5] 9.5% ̄10.5%的盐酸8.2mL, 加 水 稀 释 , 使 pH 分 别 达 到 3、4、5; 灭 菌15min, 冷 至 50℃以下时, 每 100mL 液体中加入 1g 胃蛋白酶, 混 匀后待用。 1.2.2 人工肠液的配制[5] 磷酸二氢钾 6.8g, 加水 500mL 溶 解 , 用 0.4%的 氢 氧 化 钠 溶 液 调 pH 至 6.8, 加 水 稀 释 至 1000mL, 灭 菌 15min, 冷 至 50℃以 下 时 , 每 100mL 液体中加入 1g 胰蛋白酶, 混匀后待用。
2.4 人工肠液( pH6.8) 对抗性淀粉的消化作用
从表 3 可 以 看 出 , 抗 性 淀 粉 在 人 工 肠 液 ( pH6.8) 中失重率为 4.75%, 原淀粉在人工肠液中失重比抗性 淀粉大, 失重率为 9.49%。与对照组相比, 抗性淀粉生 成的葡萄糖浓度比原淀粉低 26.72%。所以人工肠液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
体外模拟消化(口腔、胃、小肠):1、参考Gawlik-Dziki等(2009)方法(The effect of simulated digestion in vitro on bioactivityof wheat bread with Tartary buckwheat flavones addition)2.4.1. Preparation of simulated saliva, gastric and intestinal fluids Simulated saliva solution was prepared by dissolve of 2.38 gNa2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and a-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For thegastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal. juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2.4.1. Preparation of simulated saliva, gastric and intestinal fluidsSimulated saliva solution was prepared by dissolve of 2.38 g Na2HPO4, 0.19 g KH2PO4 and 8 g NaCl in 1 l of distilled water. The solution was adjusted to pH 6.75 and α-amylase (EC 3.2.1.1.) was added to obtain 200 U of enzyme activity. For the gastric digestion, 0.32% pepsin (from porcine stomach mucosa, pepsin A, EC 3.4.23.1) dilution in 0.03 M NaCl, pH 1.2 was prepared. Simulated intestinal juice was prepared by dilution of 0.05 g of pancreatin and 0.3 g of bile extract in 35 ml 0.1 M NaHCO3.2、参考Versantvoort等(2005)(Applicability of an in vitro digestion model in assessing thebioaccessibility of mycotoxins from food)和Hur等(2009)的方法(Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion)Table 1Constituents and concentrations of the various synthetic juices of the in vitro digestion model representing fed conditionsSaliva 唾液Gastric juice 胃液Duodenal juice十二指肠液Bile juice 胆汁Inorganic solution 10 ml KCl 89.6g/l15.7 ml NaCl 175.3g/l40 ml NaCl175.3g/l30 ml NaCl175.3g/l10 ml KSCN20g/l3.0 ml NaH2PO4 88.8g/l40 ml NaHCO384.7 g/l68.3 ml NaHCO384.7 g/l10 ml NaH2PO488.8 g/l9.2 ml KCl 89.6 g/l10 ml KH2PO48g/l4.2 ml KCl 89.6 g/l 10 ml NaSO457g/l18 ml CaCl2· 2H2O22.2 g/l6.3 ml KCl89.6 g/l150 μl HCl 37%g/g1.7 ml NaCl175.3 g/l10 ml NH4Cl 30.6 g/l10 ml MgCl2 5g/l20 ml NaHCO384.7 g/l6.5 ml HCl 37%g/g180 μl HCl37%g/gOrganic solution 8 ml urea 25 g/l 10 ml glucose 65 g/l 4 ml urea 25 g/l 10 ml urea 25 g/l10 ml glucuronic acid(葡萄糖醛酸) 2g/l3.4 ml urea 25g/l10 ml glucosaminehydrochloride (盐酸氨基葡萄糖) 33g/lAdd to mixtureorganic+ inorganic solution290 mgα-amylase1g BSA9mlCaCl2· 2H2O22.2 g/l10ml CaCl2· 2H2O22.2 g/l15 mg uric acid 2.5 g pepsin 1g BSA 1.8 g BSA25 mg mucin 3 g mucin 9 g pancreatin 30 g bile1.5 g lipasepH 6.8 ± 0.2 1.30 ± 0.02 8.1 ± 0.2 8.2 ± 0.2 The inorganic and organic solutions are augmented to 500ml with distilled water. After mixing of the inorganic and organic solutions, some further constituents are added and dissolved. If necessary, the pH of the juices is adjusted to the appropriate interval.另外,抗性淀粉含量测定:1、参考Li等(2008)方法(Characterization of maize amylose-extender (ae) mutant starches. PartI: Relationship between resistant starch contents and molecular structures)2.3. Resistant starch (RS) contentRS contents of the ae-mutant starch samples were determined using the AOAC Method 991.43 for total dietary fiber (AOAC, 2003) and Englyst’s method (1992) for comparison.For the AOAC 991.43 method, starch (1.0 g, dry-starch basis, dsb) was suspended in a Mes-tris buffer solution (0.05 M, 40 ml) and hydrolyzed with 500 u of a-amylase from Bacilluslicheniformis (Sigma Chemical, Cat. No. A3403) in a boiling water-bath for 30 min with stir. The sample was then digested with protease from Bacillus licheniformis (5 mg, Sigma Chemical, Cat. No. P3910) at 60 ºC in a shaker waterbath for 30 min. The sample dispersion was adjusted to pH 4.4–4.6 by adding HCl and then hydrolyzed with amyloglucosidase (300 U, Sigma chemical, Cat. No. A9913) at 60 ºC in a shaker water-bath for 30 min. The digested sample was filtered through a celite layer in a crucible and washed twice with 15 ml of 78% ethanol, twice with 15 ml of 100% ethanol and rinsed with 15 ml of acetone. The remaining sample was dried in an oven at 100 ºC overnight. The resistant starch content was calculated using the equation:(%)RS content = Remaining sample weight (g, dsb)/initial sample weight (g, dsb) ×100%For RS determined using Englyst’s method (1992), Starch (1.000 g, db) in 20 mL of sodium acetate buffer (0.1 M, pH 5.2) was cooked in a boiling water-bath for 30 min. The starch dispersion was cooled down to 37 ºC, mixed with an enzyme solution (5 mL) consisting of pancreatin extract and amyloglucosidase, and incubated in a water-bath at 37 ºC. The pancreatin extract was prepared as follows; 3.0 g of pancreatin (Sigma, Cat. No. P7545) was suspended in 20 mL deionized water, stirred for 10 min at room temperature, and centrifuged at 1500g for 10 min. The enzyme solution was prepared by mixing 13.5 ml supernatant of pancreatin extract, 210 U amyloglucosidase (Sigma, Cat. No. A7095), and 1.0 mL deionized water. The rapid digestible starch (RDS) was defined as the total starch digested within the first 20 min, and the slowly digestible starch (SDS) was the starch digested between 20 and 120 min (Englyst et al., 1992). The resistant starch content was calculated as follows:(%)RS content = 100%×(total starch – RDS - SDS) (g, dsb)/total starch (g, dsb)澳大利亚NI 消化系统图片GI20。
