选修三第一二单元测试题及答案
物理人教选修3-1第一章静电场单元测试(第一章过关检测)含解析

第一章过关检测(时间:90分钟,满分:100分)一、选择题(本题共10小题,每小题4分,共40分。
在每小题给出的四个选项中,有的小题只有一个选项正确,有的小题有多个选项正确。
全部选对的得4分,选不全的得2分,有选错或不答的得0分)1.下列物理量中哪些与检测电荷q无关()A. 电场强度EB。
电势UC。
电势能E pD。
电场力F2。
下列说法正确的是()A. 电场线相互平行的电场不一定是匀强电场B。
在电场中将电荷由a移到b,如果电场力做功为零,a、b两点场强大小必定相等C. 电势降低的方向不一定就是场强方向D。
在电场中,只在静电力作用下,使电荷沿电场线运动,这样的电场只能是匀强电场3。
如图是表示在一个电场中a、b、c、d四点分别引入检验电荷时,测得的检验电荷的电荷量跟它所受电场力的函数关系图象,那么下列叙述正确的是()A. 这个电场是匀强电场B. a、b、c、d四点的场强大小关系是E d>E a>E b>E cC。
a、b、c、d四点的场强大小关系是E a>E b>E d>E cD。
无法确定这四个点的场强大小关系4。
使带电的金属球靠近不带电的验电器,验电器的箔片张开。
下列各图表示验电器上感应电荷的分布情况,正确的是()5.带负电的粒子在某电场中仅受静电力作用,能分别完成以下两种运动:①在电场线上运动,②在等势面上做匀速圆周运动。
该电场可能由()A. 一个带正电的点电荷形成B. 一个带负电的点电荷形成C. 两个分立的带等量负电的点电荷形成D. 一带负电的点电荷与带正电的无限大平板形成6。
下图中的实线表示电场线,虚线表示只受电场力作用的带正电粒子的运动轨迹,粒子先经过M 点,再经过N 点,可以判定( )A 。
M 点的电势大于N 点的电势B 。
M 点的电势小于N 点的电势C. 粒子在M 点受到的电场力大于在N 点受到的静电力 D 。
粒子在M 点受到的电场力小于在N 点受到的静电力7。
静电场中,带电粒子在静电力作用下从电势为φa 的a 点运动至电势为φb 的b 点。
新人教版高中数学选修三第一单元《计数原理》测试题(包含答案解析)(1)

一、选择题1.已知()52x a x x ⎛⎫+- ⎪⎝⎭的展开式中所有项的系数和为2-,则展开式中的常数项为( ) A .80B .80-C .40D .40-2.在第二届乌镇互联网大会中, 为了提高安保的级别同时又为了方便接待,现将其中的五个参会国的人员安排酒店住宿,这五个参会国要在a 、b 、c 三家酒店选择一家,且每家酒店至少有一个参会国入住,则这样的安排方法共有 A .96种 B .124种 C .130种D .150种3.已知8281239(1)x a a x a x a x +=++++,若数列()*123,,,,19,k a a a a k k N ⋅⋅⋅≤≤∈是一个单调递增数列,则k 的最大值是( ) A .6B .5C .4D .34.已知231(1)nx x x ⎛⎫++ ⎪⎝⎭的展开式中没有2x 项,*n N ∈,则n 的值可以是( ) A .5 B .6 C .7 D .85.若()352()x x a -+的展开式的各项系数和为32,则实数a 的值为( )A .-2B .2C .-1D .16.在二项式()12nx -的展开式中,所有项的二项式系数之和为256,则展开式的中间项的系数为( ) A .960-B .960C .1120D .16807.在某次体检中,学号为i (1,2,3,4i =)的四位同学的体重()f i 是集合{45,48,52,57,60}kg kg kg kg kg 中的元素,并满足(1)(2)(3)(4)f f f f ≤≤≤,则这四位同学的体重所有可能的情况有( ) A .55种B .60种C .65种D .70种8.将甲、乙、丙、丁四人分配到A 、B 、C 三所学校任教,每所学校至少安排1人,则甲不去A 学校的不同分配方法有( ) A .18种B .24种C .32种D .36种9.若,m n 均为非负整数,在做m n +的加法时各位均不进位(例如,134********+=),则称(),m n 为“简单的”有序对,而m n +称为有序数对(),m n 的值,那么值为2964的“简单的”有序对的个数是( ) A .525B .1050C .432D .86410.()6232x x ++展开式中x 的系数为( ) A .92B .576C .192D .38411.设(1+x )+(1+x )2+(1+x )3+…+(1+x )n =a 0+a 1x+a 2x 2+…+a n x n ,当a 0+a 1+a 2+…+a n =254时,n 等于( ) A .5B .6C .7D .812.疫情期间,上海某医院安排5名专家到3个不同的区级医院支援,每名专家只去一个区级医院,每个区级医院至少安排一名专家,则不同的安排方法共有( ) A .60种B .90种C .150种D .240种二、填空题13.有2个不同的红球和3个不同的黄球,将这5个球放入4个不同的盒子中,要求每个盒子至少放一个球,且同色球不能放在同一个盒子中,则不同的放置方法有________种.(用数字作答)14.4名志愿者被随机分配到、、A B C 三个不同的岗位服务,每个岗位至少有一名志愿者,则甲、乙两名志愿者没有分配到同一个岗位服务的概率为______.15.在(23)n x y -的二项展开式中,二项式系数的和是512,则各项系数的和是_____ . 16.同宿舍的6个同学站成一排照相,其中甲只能站两端,乙和丙必须相邻,一共有_____种不同排法(用数字作答)17.有3名大学毕业生,到5家招聘员工的公司应聘,若每家公司至多招聘一名新员工,且3名大学毕业生全部被聘用,若不允许兼职,则共有________种不同的招聘方案.(用数字作答)18.设n 为正整数,32nx x ⎛⎫- ⎪⎝⎭展开式中仅有第5项的二项式系数最大,则展开式中的常数项为__________.19.62x ⎛ ⎝的展开式中3x 的系数为__________.(用数字作答)20.从6男2女共8名学生中选出队长1人,副队长1人,普通队员3人,组成5人服务队,要求服务队中至少有1名女生,共有________种不同的选法(用数字作答)三、解答题21.(1)求证:当n *∈N 时,((11nn+为偶数;(2)当n *∈N 时,(3n的整数部分是奇数,还是偶数?请证明你的结论.22.已知2nx⎛⎝展开式前三项的二项式系数和为22.(1)求展开式中的常数项; (2)求展开式中二项式系数最大的项.23.已知在n 的展开式中第5项为常数项.(1)求n 的值;(2)求展开式中含有2x 项的系数; (3)求展开式中所有的有理项.24.已知(n x 的展开式中的第二项和第三项的系数相等.()1求n 的值;()2求展开式中所有二项式系数的和;()3求展开式中所有的有理项.25.在二项式n 的展开式中,前三项系数的绝对值成等差数列.(1)求展开式的第四项; (2)求展开式的常数项; (3)求展开式中各项的系数和.26.已知二项式10x⎛⎝的展开式.(1)求展开式中含4x 项的系数;(2)如果第3r 项和第2r +项的二项式系数相等,求r 的值.【参考答案】***试卷处理标记,请不要删除一、选择题 1.B 解析:B 【分析】令1x =,由展开式中所有项的系数和为2-,列出方程并求出a 的值,得出展开式中常数项为52x x ⎛⎫- ⎪⎝⎭中1x -的系数与52x x ⎛⎫- ⎪⎝⎭的0x 的系数之和,然后利用二项展开式的通项公式求解. 【详解】解:由题可知,()52x a x x ⎛⎫+- ⎪⎝⎭的展开式中所有项的系数和为2-,令1x =,则所有项的系数和为()()5211121a a ⎛⎫+-=-+=- ⎪⎝⎭,解得:1a =,()()555522221x a x x x x x x x x x x ⎛⎫⎛⎫⎛⎫⎛⎫∴+-=+-=-+- ⎪ ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭⎝⎭,则()521x x x ⎛⎫+- ⎪⎝⎭展开式中的常数项为: 52x x ⎛⎫- ⎪⎝⎭中1x -的系数与52x x ⎛⎫- ⎪⎝⎭的0x 的系数之和, 由于52x x ⎛⎫- ⎪⎝⎭展开式的通项公式为:()5515522rr r r r r r T C x C x x --+⎛⎫=⋅-=⋅-⋅ ⎪⎝⎭,当521r -=-时,即3r =时,52x x ⎛⎫- ⎪⎝⎭中1x -的系数为:()335280C ⨯-=-,当520r -=时,无整数解,所以()521x x x ⎛⎫+- ⎪⎝⎭展开式中的常数项为80-.故选:B. 【点睛】本题考查二项式定理的应用,考查利用赋值法求二项展开式所有项的系数和,以及二项展开式的通项公式,属于中档题.2.D解析:D 【分析】根据题意,分2步进行分析:①把5个个参会国的人员分成三组,一种是按照1、1、3;另一种是1、2、2;由组合数公式可得分组的方法数目,②,将分好的三组对应三家酒店;由分步计数原理计算可得答案. 【详解】根据题意,分2步进行分析:①、五个参会国要在a 、b 、c 三家酒店选择一家,且这三家至少有一个参会国入住, ∴可以把5个国家人分成三组,一种是按照1、1、3;另一种是1、2、2 当按照1、1、3来分时共有C 53=10种分组方法;当按照1、2、2来分时共有22532215C C A = 种分组方法;则一共有101525+= 种分组方法;②、将分好的三组对应三家酒店,有336A = 种对应方法;则安排方法共有256150⨯= 种; 故选D .【点睛】本题考查排列组合的应用,涉及分类、分步计数原理的应用,对于复杂一点的计数问题,有时分类以后,每类方法并不都是一步完成的,必须在分类后又分步,综合利用两个原理解决.3.B解析:B 【分析】可得结论.写出各项的系数,由组合数性质知123456789a a a a a a a a a <<<<>>>>,结合数列123,,,,k a a a a ⋅⋅⋅是一个单调递增数列,可得结论. 【详解】由二项式定理,得98ii a C -=()*19,i i N≤≤∈,所以根据组合数性质知123456789a a a a a a a a a <<<<>>>>, 又数列()*123,,,,19,k a a a a k k N ⋅⋅⋅≤≤∈是一个单调递增数列,所以k 的最大值为5. 故选:B 【点睛】本题主要考查二项式定理的运用,考查学生分析解决问题的能力,属于基础题.4.C解析:C 【分析】将条件转化为31nx x ⎛⎫+ ⎪⎝⎭的展开式中不含常数项,不含x 项,不含2x 项,然后写出31nx x ⎛⎫+ ⎪⎝⎭的展开式的通项,即可分析出答案. 【详解】因为231(1)nx x x ⎛⎫++ ⎪⎝⎭的展开式中没有2x 项,所以31nx x ⎛⎫+ ⎪⎝⎭的展开式中不含常数项,不含x 项,不含2x 项31nx x ⎛⎫+ ⎪⎝⎭的展开式的通项为:4131,0,1,2,,rr n r r n r r n n T C x C x r n x --+⎛⎫=== ⎪⎝⎭所以当n 取5,6,7,8时,方程40,41,42n r n r n r -=-=-=无解检验可得7n = 故选:C 【点睛】本题考查的是二项式定理的知识,在解决二项式展开式的指定项有关的问题的时候,一般先写出展开式的通项.5.D解析:D 【分析】根据题意,用赋值法,在()352()x x a -+中,令1x =可得()521(1)32a -+=,解可得a的值,即可得答案. 【详解】 根据题意,()352()xx a -+的展开式的各项系数和为32,令1x =可得:()521(1)32a -+=, 解可得:1a =, 故选:D . 【点睛】本题考查二项式定理的应用,注意特殊值的应用.6.C解析:C 【分析】先根据条件求出8n =,再由二项式定理及展开式通项公式,即可得答案. 【详解】由已知可得:2256n =,所以8n =,则展开式的中间项为44458(2)1120T C x x =-=,即展开式的中间项的系数为1120. 故选:C . 【点睛】本题考查由二项式定理及展开式通项公式,考查函数与方程思想、转化与化归思想,考查逻辑推理能力、运算求解能力.7.D解析:D 【分析】根据(1)(2)(3)(4)f f f f ≤≤≤中等号所取个数分类讨论,利用组合知识求出即可. 【详解】解:当(1)(2)(3)(4)f f f f ≤≤≤中全部取等号时,情况有155C =种;当(1)(2)(3)(4)f f f f ≤≤≤中有两个取等号,一个不取等号时,情况有215330C C =种;当(1)(2)(3)(4)f f f f ≤≤≤中有一个取等号,两个不取等号时,情况有315330C C =种;当(1)(2)(3)(4)f f f f ≤≤≤中都不取等号时,情况有455C =种;共560+60+5=70+种.故选:D.【点睛】本题考查分类讨论研究组合问题,关键是要找准分类标准,是中档题.8.B解析:B【分析】根据题意,分两种情况讨论:①其他三人中有一个人与甲在同一个学校,②没有人与甲在同一个学校,由加法原理计算可得答案.【详解】解:根据题意,分两种情况讨论,①其他三人中有一个人与甲在同一个学校,有11232212C A A=种情况,②没有人与甲在同一个学校,则有12223212C C A=种情况;则若甲要求不到A学校,则不同的分配方案有121224+=种;故选:B.【点睛】本题考查排列、组合的应用,涉及分类加法原理的应用,属于中等题.9.B解析:B【分析】由题意知本题是一个分步计数原理,第一位取法两种为0,1,2,第二位有10种取法,从0,1,2,3,4,5,6,7,8,9 ,第三位有7种取法,从0,1,2,3,4,5,6取一个数字,第四为有5种,从0,1,2,3,4取一个数字,根据分步计数原理得到结果.【详解】由题意知本题是一个分步计数原理,第一位取法3种为0,1, 2,第二位有10种为0,1,2,3,4,5,6,7,8,9 ,第三位有7种为0,1,2,3,4,5,6,第四为有5种为0,1,2, 3,4根据分步计数原理知共有3×10×7×5=1050个故选:B.【点睛】解答排列、组合问题的角度:解答排列、组合应用题要从“分析”、“分辨”、“分类”、“分步”的角度入手.(1)“分析”就是找出题目的条件、结论,哪些是“元素”,哪些是“位置”;(2)“分辨”就是辨别是排列还是组合,对某些元素的位置有、无限制等;(3)“分类”就是将较复杂的应用题中的元素分成互相排斥的几类,然后逐类解决;(4)“分步”就是把问题化成几个互相联系的步骤,而每一步都是简单的排列、组合问题,然后逐步解决.10.B解析:B 【解析】()6232x x ++展开式中含x 的项为15565(3)26332576C x C x x ⋅⋅=⨯⨯=,即x 的系数为576;故选B.点睛:本题考查二项式定理的应用;求三项展开式的某项系数时,往往有两种思路: (1)利用组合数公式和多项式乘法法则,如本题中解法;(2)将三项式转化成二项式,如本题中,可将26(32)x x ++化成66(1)(2)x x ++,再利用两次二项式定理进行求解.11.C解析:C 【解析】试题分析:观察已知条件a 0+a 1+a 2+…+a n =254,可令(1+x )+(1+x )2+(1+x )3+…+(1+x )n=a 0+a 1x+a 2x 2+…+a n x n 中的x=1,可得254=2n+1﹣2,解之即可.解:∵(1+x )+(1+x )2+(1+x )3+…+(1+x )n =a 0+a 1x+a 2x 2+…+a n x n ∴令x=1得2+22+23+…+2n =a 0+a 1+a 2+…+a n , 而a 0+a 1+a 2+…+a n =254==2n+1﹣2,∴n=7 故答案为C考点:数列的求和;二项式定理的应用.12.C解析:C 【分析】先分组1,2,2和1,1,3再安排得解 【详解】5名专家到3个不同的区级医院,分为1,2,2和1,1,3两种情况;分为1,2,2时安排有1223542322C C C A A ;分为1,1,3时安排有1133543322C C C A A 所以一共有12211333542543332222150C C C C C C A A A A += 故选:C 【点睛】本题考查排列组合问题,先分组再安排是解题关键.二、填空题13.【分析】由题意可得一个盒子里有2个球一定为1红1黄其余盒子每个盒子放一个根据分步计数原理可得【详解】解:这5个球放入4个不同的盒子中要求每个盒子至少放一个球且同色球不能放在同一个盒子中则一个盒子里有 解析:144【分析】由题意可得一个盒子里有2个球,一定为1红1黄,其余盒子每个盒子放一个,根据分步计数原理可得. 【详解】解:这5个球放入4个不同的盒子中,要求每个盒子至少放一个球, 且同色球不能放在同一个盒子中,则一个盒子里有2个球,一定为1红1黄,其余盒子每个盒子放一个,故有11134233144C C C A =种,故答案为:144. 【点睛】本题考查了分步计数原理,运用组合数的运算,理解题目意思是关键..14.【分析】要保证每个岗位至少一人人所以首先将四个人分成三组在将三组全排列求出总事件数然后再将甲乙分到不同两组得出甲乙不在同一岗位的基本事件数总而得出概率【详解】因为每个岗位至少有一人所以要将四个人分成解析:56【分析】要保证每个岗位至少一人人,所以首先将四个人分成三组,在将三组全排列求出总事件数,然后再将甲乙分到不同两组,得出甲乙不在同一岗位的基本事件数,总而得出概率. 【详解】因为每个岗位至少有一人,所以要将四个人分成三组,则只能是211、、所以总事件数为: 2113421322=36C C C A A ⋅⋅⋅, 甲乙不在同一岗位的基本事件数:()11232223+=30C C C A ⋅⋅ 所以甲、乙两名志愿者没有分配到同一个岗位服务的概率305=366P =, 故答案为:56. 【点睛】本题考查等可能性事件的概率,利用排列组合公式求出基本事件的总数和满足某个事件的基本事件个数是解答本题的关键.15.【分析】根据二项式系数的和求解出的值求解各项系数的和时可考虑令由此可计算出各项系数的和【详解】因为二项式系数的和是所以所以又因为令可得:所以各项系数的和为:故答案为【点睛】本题考查根据二项式系数求参 解析:1-【分析】根据二项式系数的和求解出n 的值,求解各项系数的和时可考虑令1x y ==,由此可计算出各项系数的和. 【详解】因为二项式系数的和是512,所以01...2512n nn n n C C C +++==,所以9n =,又因为()()()()()()()998109129992323...2323C x y C x y C x y x y =-+-+-+-, 令1x y ==可得:()()()()()()()998191299912323...231C C C -=-+-++-=-,所以各项系数的和为:1-. 故答案为1-. 【点睛】本题考查根据二项式系数求参数以及求解各项系数和,难度一般.(1)求解形如()nax by +的展开式中的各项系数和时,可令1x y ==求得结果; (2)形如()nax by +的展开式中的二项式系数之和为2n .16.【分析】设甲乙丙之外的三人为ABC 将乙和丙看作一个整体与ABC 三人全排列然后排甲甲只能在两端有2种站法利用分步乘法计数原理可求出答案【详解】设甲乙丙之外的三人为ABC 将乙和丙看作一个整体与ABC 三人 解析:96【分析】设甲乙丙之外的三人为A 、B 、C ,将乙和丙看作一个整体,与A 、B 、C 三人全排列,然后排甲,甲只能在两端,有2种站法,利用分步乘法计数原理可求出答案. 【详解】设甲乙丙之外的三人为A 、B 、C ,将乙和丙看作一个整体,与A 、B 、C 三人全排列,有2424A A 48=种,甲只能在两端,甲有2种站法,则共有48296⨯=种排法.【点睛】本题考查了排列组合,考查了相邻问题“捆绑法”的运用,属于基础题.17.【解析】分析:根据排列定义求结果详解:将5家招聘员工的公司看作5个不同的位置从中任选3个位置给3名大学毕业生则本题即为从5个不同元素中任取3个元素的排列问题所以不同的招聘方案共有=5×4×3=60( 解析:60【解析】分析:根据排列定义求结果.详解:将5家招聘员工的公司看作5个不同的位置,从中任选3个位置给3名大学毕业生,则本题即为从5个不同元素中任取3个元素的排列问题.所以不同的招聘方案共有35A=5×4×3=60(种).点睛:本题考查排列定义,考查基本求解能力.18.112【解析】由展开式中仅有第5项的二项式系数最大得则令则展开式中的常数项为解析:112 【解析】由展开式中仅有第5项的二项式系数最大得8n =则()884188322rr r r r r r T C x C x x --+⎛⎫=-=- ⎪⎝⎭,令840r -=,2r =则展开式中的常数项为()2282112C -=19.60【解析】的展开式的通项公式为令得∴的系数为故答案为60解析:60 【解析】62x ⎛ ⎝的展开式的通项公式为()366621661222xrr x r r r r T C x C x ---+⎛⎛⎫==-⋅ ⎪ ⎝⎭⎝ 令3632r -=得2r∴3x 的系数为2622612602C -⎛⎫-⋅⋅= ⎪⎝⎭故答案为6020.1000【分析】根据题意分为1女4男和2女3男再利用排列组合求解每类的种数结合计数原理即可求解【详解】由题意可分为两类:第一类:先选1女4男有种再在这5人中选2人作为队长和副队长有种所以共有;第二类解析:1000 【分析】根据题意,分为1女4男和2女3男,再利用排列、组合求解每类的种数,结合计数原理,即可求解. 【详解】由题意,可分为两类:第一类:先选1女4男,有142630C C =种,再在这5人中选2人作为队长和副队长有2520A =种,所以共有3020600⨯=; 第二类:先选2女3男,有232620C C =种,再在这5人中选2人作为队长和副队长有2520A =种,所以共有2020400⨯=,根据分类计数原理,共有6004001000+=种不同的选法. 故答案为:1000 【点睛】本题主要考查了分类计数原理和分步计数原理,以及排列、组合的综合应用,其中解答中认真审题,合理分类,结合排列、组合的知识求得每类的种数是解答的关键,着重考查了分析问题和解答问题的能力.三、解答题21.(1)证明见详解;(2)奇数,证明见详解. 【分析】(1)根据二项展开式的通项公式,将(1n+和(1n-写出二项展开式的形式,分别讨论n 为正奇数和n 为正偶数两种情况,即可证明结论成立;(2)同(1)利用分类讨论法,先判断((33nn+为偶数,根据(031n<-<,即可得出结果.【详解】(1)因为(120121n nnn nnnC C C C +=+++⋅⋅⋅+,(((((0120121nnn nn nnCC C C -=+++⋅⋅⋅+,当n 为正奇数时,((121210212112233n nnn n n nnnn n n C CCC C C ----⎛⎫⎡⎤+=++⋅⋅⋅+=++⋅⋅⋅+ ⎪⎢⎥⎣⎦⎝⎭,而1021233n n nnnC C C --++⋅⋅⋅+显然为正整数,所以((1021211233n nnn n n n C C C --⎛⎫+=++⋅⋅⋅+ ⎪⎝⎭为偶数; 当n 为正偶数时,((0202022112233nnnnn n nnnn n n C CCC C C ⎛⎫⎡⎤+=++⋅⋅⋅+=++⋅⋅⋅+ ⎪⎢⎥⎣⎦⎝⎭,而02233nn n n n C C C ++⋅⋅⋅+显然为正整数,所以((02211233nnnn n n n C C C ⎛⎫+=++⋅⋅⋅+ ⎪⎝⎭为偶数;综上,当n *∈N 时,((11nn+为偶数;(2)因为(0120112233333nnnn n n nnnnC C C C --=⋅⋅+⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅, (((((0120112233333nnnn n n nnnnCC C C --=⋅⋅+⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅,当n 为正奇数时,((212211332333nnn n n n n n n C C C ---⎡⎤+=⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅⎢⎥⎣⎦,其中0212211333n n n n n n n C C C ---⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅显然为正整数,所以((0212211332333nnn n n n n nnC C C---⎡⎤++-=⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅⎢⎥⎣⎦为偶数,记0212211333n n n n n n n k C C C ---=⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅,则((32113nnk =-+-,因为031<-<,则(031n <-<,因此(0131n<-<,所以(3n的整数部分是21k -,为奇数; 当n 为正偶数时,((2220332333nnnn n nn n n C C C -⎡⎤+=⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅⎢⎥⎣⎦,其中2220333nn n nn n n C C C -⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅显然为正整数,所以((0222332333nnnn n nn nnC C C -⎡⎤++=⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅⎢⎥⎣⎦为偶数,记02220333nn n nn n n m C C C -=⋅⋅+⋅⋅+⋅⋅⋅+⋅⋅,则((32113nnm =-+--,因为(0131n<-<,所以(3n的整数部分是21m -,为奇数;综上,当n *∈N 时,(3n的整数部分是奇数. 【点睛】 关键点点睛:求解本题的关键在于利用二次展开式的通项公式,将二项式展开,再讨论n 为正奇数和n 为正偶数两种情况,即可结合题中条件求解. 22.(1)60(2)32160x 【分析】(1)根据2nx⎛ ⎝展开式前三项的二项式系数和为22,由01222n n n C C C ++=,解得6n =,再得到2nx ⎛+ ⎝展开式的通项1r T +366262rr r C x --=,令3602r -=求解. (2)根据6n =,得到展开式中二项式系数最大的项为第四项,再利用通项公式求解.. 【详解】(1)因为2nx ⎛⎝展开式前三项的二项式系数和为22,所以01222n n n C C C ++=,即(1)1222n n n -++=, 所以2420n n +-=, 解得6n =或7n =-(舍去).所以2nx ⎛+ ⎝展开式的通项为:16216(2)rr r r T C x x --+⎛⎫= ⎪⎝⎭366262r r r C x --=, 令3602r -=,得4r =, 所以展开式中的常数项为41T +=4206260C x =.(2)因为6n =,所以展开式中二项式系数最大的项为第四项,即3133322316(2)160T C x x x -+⎛⎫== ⎪⎝⎭. 【点睛】本题主要考查二项式定理的通项公式,二项式系数,还考查了运算求解的能力,属于中档题.23.(1)8;(2)4-;(3)24x -,358,2116x - 【分析】(1)先写出展开式的通项公式2311()2n rr r r nT C x -+=-,由展开式中第5项为常数项,则当4r =时,有203n r-=,从而求出n 出的值. (2)由(1)中得到8n =,则含有2x 项,即8223r-=,得到1r =,从而求出答案. (3)展开式中所有的有理项,则82308r r r Z -⎧∈Z ⎪⎪≤≤⎨⎪∈⎪⎩,可得r 可取1,4,7,可得到答案.【详解】(1)展开式的通项公式为2311(()2n rr n rrr r r nnT C C x --+==-.因为第5项为常数项. 所以4r =时,有203n r-=,解得8n =. (2)令223n r-=,由(1)8n =,解1r =, 故所求系数为181()42C -=-(3)有题意得,82308r r r Z -⎧∈Z ⎪⎪≤≤⎨⎪∈⎪⎩,令82()3r k k Z -=∈,则833422k r k -==- 所以k 可取2,0,2-,即r 可取1,4,7它们分别为24x -,358,2116x -. 【点睛】本题考查二项式展开式的通项公式应用,求展开式中某项的系数,属于中档题. 24.(1)5;(2)32;(3)见解析 【分析】(1)根据展开式中的第二项和第三项的系数相等,列出方程求出n 的值; (2)利用展开式中所有二项式系数的和为2n ,即可求出结果; (3)根据二项式展开式的通项公式,求出展开式中所有的有理项 【详解】二项式nx ⎛ ⎝展开式的通项公式为32112r rr n r n r r r n n T C x C x --+⎛⎫=⋅⋅=⋅⋅ ⎪⎝⎭ (r=0,1,2,…,n );(1)根据展开式中的第二项和第三项的系数相等,得2121122nn C C ⎛⎫⋅=⋅ ⎪⎝⎭,即()111242n n n -=⋅ 解得n=5; (2)展开式中所有二项式系数的和为0123455555555232C C C C C C +++++==(3)二项式展开式的通项公式为355215512r rr r r r r T C x C x--+⎛⎫=⋅⋅=⋅⋅ ⎪⎝⎭(r=0,1,2,…,5);当r=0,2,4时,对应项是有理项, 所以展开式中所有的有理项为0551512T C x x ⎛⎫=⋅⋅= ⎪⎝⎭22532351522T C x x -⎛⎫=⋅⋅= ⎪⎝⎭44565515216T C x x -⎛⎫=⋅⋅= ⎪⎝⎭. 【点睛】注意区别,展开式的“二项式系数”与“二项展开式的系数”,如本题中二项展开式的系数为:12rr nC ⎛⎫⋅ ⎪⎝⎭,而二项式系数为rn C ;二项展开式(a+b )n 的第(r+1)项,其通项公式为1rn r r r n T C a b -+=⋅⋅( r ∈{0,1,2,3,…,n}).25.(1)237x -;(2)358;(3)1256.【解析】试题分析:(1)根据展开式的通项为23112rn r r r n T C x -+⎛⎫=- ⎪⎝⎭,结合前三项系数的绝对值成等差数列,求得8n =,从而求得展开式的第四项;(2)在展开式中,令x 的幂指数等于零,求得r 的值,代入通项公式可得常数项;(3)在二项式n 的展开式中,令1x =,可得各项系数和. 试题展开式的通项为23112rn r r r n T C x -+⎛⎫=- ⎪⎝⎭,r=0,1,2,…,n由已知:02012111,,222n n nC C C ⎛⎫⎛⎫⎛⎫- ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭成等差数列,∴ 12112124n n C C ⨯=+,∴ n=8 ,8231812rr r r T C x -+⎛⎫=- ⎪⎝⎭. (1)令3r =,32233348172T C x x ⎛⎫=-=- ⎪⎝⎭, (2)令820y -=,得4r = ,5358T ∴=, (3)令x=1,各项系数和为1256.【方法点晴】本题主要考查二项展开式定理的通项与系数,属于简单题. 二项展开式定理的问题也是高考命题热点之一,关于二项式定理的命题方向比较明确,主要从以下几个方面命题:(1)考查二项展开式的通项公式1C r n r rr n T a b -+=;(可以考查某一项,也可考查某一项的系数)(2)考查各项系数和和各项的二项式系数和;(3)二项展开式定理的应用. 26.(1)3360;(2)1 【分析】(1)写出二项展开式的通项公式,当x 的指数是4时,可得到关于k 方程,解方程可得k 的值,从而可得展开式中含4x 项的系数;(2)根据上一问写出的通项公式,利用第3r 项和第2r +项的二项式系数相等,可得到一个关于r 的方程,解方程即可得结果. 【详解】(1)设第k +1项为T k +1=令10-k =4,解得k =4,故展开式中含x 4项的系数为()441023360C =-.(2)∵第3r 项的二项式系数为,第r +2项的二项式系数为,∵=,故3r -1=r +1或3r -1+r +1=10,解得r =1或r =2.5(不合题意,舍去),∴r =1.。
高中物理选修3-1-静电场-测试题-单元测试及答案

静电场单元测试一、选择题1.如图所示,a 、b 、c 为电场中同一条电场线上的三点,c 为ab 的中点,a 、b 点的电势分别为φa =5 V ,φb =3 V ,下列叙述正确的是( ) A .该电场在c 点处的电势一定为4 V B .a 点处的场强一定大于b 处的场强C .一正电荷从c 点运动到b 点电势能一定减少D .一正电荷运动到c 点时受到的静电力由c 指向a 2.如图所示,一个电子以100 eV 的初动能从A 点垂直电场线方向飞入匀强电场,在B 点离开电场时,其速度方向与电场线成150°角,则A 与B 两点间的电势差为( )A .300 VB .-300 VC .-100 VD .-1003V3.如图所示,在电场中,将一个负电荷从C 点分别沿直线移到A 点和B 点,克服静电力做功相同.该电场可能是( ) A .沿y 轴正向的匀强电场 B .沿x 轴正向的匀强电场C .第Ⅰ象限内的正点电荷产生的电场D .第Ⅳ象限内的正点电荷产生的电场4.如图所示,用绝缘细线拴一带负电小球,在竖直平面内做圆周运动, 匀强电场方向竖直向下,则( )A .当小球运动到最高点a 时,线的张力一定最小B .当小球运动到最低点b 时,小球的速度一定最大C .当小球运动到最高点a 时,小球的电势能最小D .小球在运动过程中机械能不守恒5.在静电场中a 、b 、c 、d 四点分别放一检验电荷,其电量可变,但很小,结果测出检验电荷所受电场力与电荷电量的关系如图所示,由图线可知 ( )A .a 、b 、c 、d 四点不可能在同一电场线上B .四点场强关系是E c =E a >E b >E dC .四点场强方向可能不相同D .以上答案都不对6.如图所示,在水平放置的光滑接地金属板中点的正上方,有带正电的点电荷Q , 一表面绝缘带正电的金属球(可视为质点,且不影响原电场)自左以速度v 0开始在 金属板上向右运动,在运动过程中 ( ) A .小球做先减速后加速运动 B .小球做匀速直线运动 C .小球受的电场力不做功D .电场力对小球先做正功后做负功7.如图所示,一个带正电的粒子以一定的初速度垂直进入水平方向的匀强电场.若不计重力,图中的四个图线中能描述粒子在电场中的运动轨迹的是( )8.图中虚线是用实验方法描绘出的某一静电场中的一簇等势线,若不计重力的带电粒子从a点射入电场后恰能沿图中的实线运动,b点是其运动轨迹上的另一点,则下述判断正确的是( )A.b点的电势一定高于a点B.a点的场强一定大于b点C.带电粒子一定带正电D.带电粒子在b点的速率一定小于在a点的速率9.如图所示,在粗糙水平面上固定一点电荷Q,在M点无初速度释放一带有恒定电量的小物块,小物块在Q的电场中运动到N点静止,则从M点运动到N点的过程中() A.小物块所受电场力逐渐减小B.小物块具有的电势能逐渐减小C.M点的电势一定高于N点的电势D.小物块电势能变化量的大小一定等于克服摩擦力做的功10.如图所示,A,B两个带有异种电荷的小球分别被两根绝缘细线系在木盒内,且在同一竖直线上,静止时木盒对地面的压力为F N,细线对B的拉力为F.若将系B的细线断开,下列说法中正确的是( )A.刚断开时木盒对地的压力等于F NB.刚断开时木盒对地的压力等于F N+FC.刚断开时木盒对地的压力等于F N-FD.在B向上运动的过程中,木盒对地的压力逐渐变大11.有一匀强电场,其场强为E,方向水平向右,把一个半径为r的光滑绝缘环,竖直放置于场中,环面平行于电场线,环的顶点A穿有一个质量为m,电量为q(q>0)的空心小球,如图所示,当小球由静止开始从A点下滑1/4圆周到B点时,小球对环的压力大小为:( )A.2mgB.qE.C.2mg+qED.2mg+3qE12.如图所示,一金属球原来不带电.现沿球的直径的延长线放置一均匀带电的细杆MN,金属球感应电荷产生的电场在球内直径上a、b、c三点的场强大小分别为E a、E b、E c,三者相比,则:( )A.E a最大B.E b最大C.E c最大D.E a=E b=E c二、填空题13.带正电1.0×10-3 C 的粒子,不计重力,在电场中先后经过A 、B 两点,飞经A 点时动能为10 J ,飞经B 点时动能为4 J ,则带电粒子从A 点到B 点过程中电势能增加了______,A 、B 两点电势差为____.14.在两块平行竖直放置的带等量异种电荷的金属板M 、N 间的匀强电场中有A 、B 两点,AB 连线与水平方向成30°角,AB 长为0.2cm ,如图所示.现有一带电量为4×10-8C 的负电荷从A 沿直线移到B 点,电场力做正功2.4×10-6J ,则A 、B 两点间的电势差大小为________,________点电势高.若此电荷q 沿任意路径从B 到A 点,电荷电势能变化情况是________,此匀强电场的场强大小为________,若两金属板相距0.3cm ,则两板电势差为________.15.如图,带电量为+q 的点电荷与均匀带电薄板相距为2d ,点电荷到带电薄板的垂线通过板的几何中心.若图中a 点处的电场强度为零,根据对称性,带电薄板在图中b 点处产生的电场强度大小为________,方向________.(静电力恒量为k)16.如图所示,质量相等的三个小球A 、B 、C ,放在光滑的绝缘水平面上,若将A 、B 两球固定,释放C 球,C 球的加速度为1m/s 2,方向水平向左.若将B 、C 球固定,释放A 球,A 球的加速度为2m/s 2,方向水平向左.现将A 、C 两球固定,释放B 球,则B 球加速度大小为________m/s 2,方向为________.三、计算题17.如图所示,用长L 的绝缘细线拴住一个质量为m ,带电荷量为q 的小球,线的另一端拴在水平向右的匀强电场中,开始时把小球、线拉到和O 在同一水平面上的A 点(线拉直),让小球由静止开始释放,当摆线摆到与水平线成60°角到达B 点时,球的速度正好为零.求: (1)B 、A 两点的电势差; (2)匀强电场的场强大小.18.如图所示,竖直放置的半圆形绝缘轨道半径为R ,下端与光滑绝缘水平面平滑连接,整个装置处于方向竖直向上的匀强电场E 中.一质量为m 、带电荷量为+q 的物块(可视为质点),从水平面上的A 点以初速度v 0水平向左运动,沿半圆形轨道恰好通过最高点C ,场强大小为E(E 小于mgq).(1)试计算物块在运动过程中克服摩擦力做的功.(2)证明物块离开轨道落回水平面过程的水平距离与场强大小E 无关,且为一常量.19.一质量为m 、电荷量为+q 的小球,从O 点以和水平方向成α角的初速度v 0抛出,当达到最高点A 时,恰进入一匀强电场中,如图.经过一段时间后,小球从A 点沿水平直线运动到与A 相距为S 的A′点后又折返回到A 点,紧接着沿原来斜上抛运动的轨迹逆方向运动又落回原抛出点.求(1)该匀强电场的场强E 的大小和方向;(即求出图中的θ角,并在图中标明E 的方向) (2)从O 点抛出又落回O 点所需的时间.1.C [该电场不一定是匀强电场,φc 不一定等于φa +φb2=4 V ,故A 、B 错误;由φa >φb知,电场线由a 指向b ,正电荷在c 点的受力也应由c 指向b ,选项D 错误;由E p =qφ知选项C 正确.]2.B [电子做类平抛运动,在B 点,由速度分解可知v B =v Acos 60°=2v A ,所以E k B =4E k A =400 eV ,由动能定理得U AB (-e )=E k B -E k A ,所以U AB =-300 V ,B 对.]3.AD [由题意知φA =φB ,A 、B 应处在同一等势面上,又W CA =qU CA <0,q <0,故U CA >0,即φC >φA ,符合条件的可能是选项A 、D.]4.CD [qE =mg ,小球将做匀速圆周运动,球在各处对细线的拉力一样大;若qE <mg ,球在a 处速度最小,对细线的拉力最小;若qE >mg ,球在a 处速度最大,对细线的拉力最大,故A 、B 错;a 点电势最高,负电荷在电势最高处电势能最小,故C 正确;小球在运动过程中除重力外,还有静电力做功,机械能不守恒,D 正确.]5.B 解析:场强与检验电荷电量的大小无关.6. BC 解析:金属板在点电荷的电场中达到静电平衡状态后,其表面是一个等势面,根据电场线与等势面垂直,则带电小球沿金属板表面移动时所受电场力的方向竖直向下,所以带电小球所受的重力、支持力和电场力均在竖直方向上,合力为零.故带电小球做匀速直线运动,∴B 正确;又由于电场力与表面垂直,对小球不做功,故C 正确,D 错误.7. 答案:C8.答案:BD解析:由等势线的分布画出电场线的分布如图所示,可知a 点的场强大,B 正确,根据轨迹可判断电场力指向左方,电场力做负功,a 点速率大于b 点速率,D 正确.但不知粒子电性,也无法判断场强的具体方向,故无法确定a 、b 两点电势的高低,A 、C 错误.9.答案:ABD解析:电场力做正功,摩擦力做负功,大小相等(始末速度为零). 10.答案:BD解析:刚断开时,A ,B 间的库仑力不变.未断开时,对A ,B 和木盒整体进行受力分析,有: F N =G 木+G A +G B ,对于B ,F 库=GB +F.断开时,对A 与木箱整体进行受力分析,有: F N′=G 木+G A +F 库,因为F 库不变.所以B 正确,在B 向上运动过程中F 库变大,所以D 正确. 11.D 12.C13.6 J -6 000 V14.答案:60V ,B ,增加,23×104V/m ,603V 15.答案:2dkq,水平向左(或垂直薄板向左) 16.解析:把A 、B 、C 球作为一个系统,三个小球之间的相互作用力为系统内力.根据牛顿第三定律,每两个小球之间存在一对作用力和反作用力,其大小相等、方向相反.这样系统的内力之和为零.系统的外力之和也为零设三个小球所受的合外力分别为F 1、F 2、F 3,则 F 1=ma 1 F 2=ma 2 F 3=ma 3F 1+F 2+F 3=m(a 1+a 2+a 3)=0设向右为正 a 2=-a 1-a 3=1+2=3(m/s 2)B 球的加速度大小为3m/s 2,方向向右.17.(1)3mgL 2q (2)3mgq解析 (1)由动能定理得: mgL sin 60°-qU BA =0所以U BA =3mgL2q(2)U BA =EL (1-cos 60°)得:E = 3mgq. 18.答案:(1)Wf =12mv20+52(Eq -mg)R (2)s =2R解析:(1)物块恰能通过圆弧最高点C 时,圆弧轨道与物块间无弹力作用,物块受到的重力和电场力提供向心力mg -Eq =m v2CR ①物块在由A 运动到C 的过程中,设物块克服摩擦力做的功为Wf ,根据动能定理有 Eq·2R -Wf -mg·2R =12mv2C -12mv20② 由①②式解得Wf =12mv20+52(Eq -mg)R ③(2)物块离开半圆形轨道后做类平抛运动,设水平位移为s ,则 水平方向有s =vCt ④ 竖直方向有2R =12(g -Eqm )·t2⑤由①④⑤式联立解得s =2R ⑥因此,物块离开轨道落回水平面的水平距离与场强大小E 无关,大小为2R.19.解析:(1)斜上抛至最高点A 时的速度vA =v0cosα① 水平向右由于AA ′段沿水平方向直线运动,所以带电小球所受的电场力与重力的合力应为一水平向左的恒力:F =mgtanθ=qEcosθ,②带电小球从A 运动到A ′过程中作匀减速运动 有(v0cosα)2=2qEcosθs/m ③ 由以上三式得: E =mv40cos4α+4g2s22qsθ=arctan 2gsv20cos2α 方向斜向上(2)小球沿AA ′做匀减速直线运动,于A ′点折返做匀加速运动 所需时间t =2v0sinαg +4s v0cosα。
教科版高二物理选修3-1第2章 直流电路同步单元测试 含答案

2020—2021教科版物理选修3—1第2章直流电路含答案教科版选修3—1第二章直流电路1、一只标有“4 V 3 W”的小灯泡,两端加上电压U,在U由0逐渐增加到4 V 过程中,电压U和电流I的关系可用图像表示,在如图所示的四个图像中,符合实际的是()A BC D2、两根材料相同的均匀导线x和y串联在电路中,两导线沿长度方向的电势变化情况分别如图中的ab段和bc段图线所示,则导线x和y的横截面积之比为()A.2∶1B.1∶2C.6∶1 D.1∶63、两个定值电阻R1、R2串联后接在输出电压U稳定于12 V的直流电源上,有人把一个内阻不是远大于R1、R2的电压表接在R1两端,如图所示,则电压表的示数为8 V,如果他把此电压表改接在R2的两端,则电压表的示数将()A.小于4 V B.等于4 VC.大于4 V,小于8 V D.大于或等于8 V4、(双选)电源、开关S、定值电阻R1、R2、光敏电阻R3和电容器连接成如图所示电路,电容器的两平行板水平放置.当开关S闭合,并且无光照射光敏电阻R3时,一带电液滴恰好静止在电容器两板间的M点,当用强光照射光敏电阻R3时,光敏电阻的阻值变小,则()A.液滴向下运动B.液滴向上运动C.电容器所带电荷量减少D.电容器两极板间电压变大5、额定电压为4.0 V的直流电动机的线圈电阻为1.0 Ω,正常工作时,电动机线圈每秒产生的热量为4.0 J,下列计算结果正确的是()A.电动机正常工作时的电流强度为4.0 AB.电动机正常工作时的输出功率为8.0 WC.电动机每分钟将电能转化成机械能为240.0 JD.电动机正常工作时的输入功率为4.0 W6、如图为含逻辑电路的一个简单电路图,L为小灯泡.光照射光敏电阻时,其阻值R′将变得远小于R.当光照射光敏电阻时,则()A.R两端的电势差变小B.R′两端的电势差变大C.小灯泡L发光D.小灯泡L不发光7、某个由导电介质制成的电阻截面如图所示.导电介质的电阻率为ρ,制成内、外半径分别为a和b的半球壳层形状(图中阴影部分),半径为a、电阻不计的球形电极被嵌入导电介质的球心为一个引出电极,在导电介质的外层球壳上镀上一层电阻不计的金属膜成为另外一个电极.设该电阻的阻值为R,下面给出R的四个表达式中只有一个是合理的,试判断合理的表达式为()A.R=ρ(b+a)2πab B.R=ρ(b-a)2πabC.R=ρab2π(b-a)D.R=ρab2π(b+a)8、一个电流表由小量程的电流表G与电阻R并联而成.若在使用中发现此电流表读数比准确值稍小些,下列采取的措施正确的是()A.在R上串联一个比R小得多的电阻B.在R上串联一个比R大得多的电阻C.在R上并联一个比R小得多的电阻D.在R上并联一个比R大得多的电阻9、如图所示为测量某电源电动势和内阻时得到的U-I图线.用此电源与三个阻值均为3 Ω的电阻连接成电路,测得路端电压为4.8 V.则该电路可能为()10、如图所示,直线OAC为某一直流电源上总功率随电流I的变化图线,曲线OBC表示同一直流电源内部热功率随电流I变化的图线.若A、B的横坐标为1 A,那么AB段表示的功率为()A.1 W B.6 WC.2 W D.2.5 W11、(双选)某同学设计了一个路灯自动控制门电路,如图所示,天黑了,让路灯自动接通,天亮了,让路灯自动熄灭.图中R G是一个光敏电阻,当有光照射时,光敏电阻的阻值会显著地减小,R是可调电阻,起分压作用.J为路灯总开关——控制继电器(图中未画路灯电路).关于此电路,下列说法正确的是()A.天黑时,R G增大,A为高电位,Z为低电位,J使路灯亮B.天黑时,R G增大,A为低电位,Z为高电位,J使路灯亮C.R调大时,傍晚路灯亮得早一些D.R调大时,傍晚路灯亮得晚一些12、欲用伏安法测定一段阻值约为5 Ω的金属导线的电阻,要求测量结果尽量准确,现备有以下器材:A.电池组(3 V,内阻1 Ω)B.电流表(0~3 A,内阻约0.012 5 Ω)C.电流表(0~0.6 A,内阻约0.125 Ω)D.电压表(0~3 V,内阻约3 kΩ)E.电压表(0~15 V,内阻约15 kΩ)F.滑动变阻器(0~20 Ω,额定电流1 A)G.滑动变阻器(0~2 000 Ω,额定电流0.3 A)H.开关、导线(1)上述器材中应选用的是________.(填写各器材前的字母代号)(2)实验电路应采用电流表________(填“内”或“外”)接法.(3)设实验中,电流表、电压表的某组示数如图所示,图中I=________A,U=________V.(4)为使通过待测金属导线的电流能在0~0.5 A范围内改变,请按要求在虚线框中画出测量待测金属导线的电阻R x的原理电路图,然后根据你设计的原理电路图将图中所给定的器材连成实验电路.13、电动机的自动控制电路如图所示,其中R H为热敏电阻,R L为光敏电阻.当温度升高时,R H的阻值远小于R1;当光照射R L时,其阻值远小于R2,为使电动机在温度升高或受到光照时能自动启动,电路中虚线框内应选________门逻辑电路;若要提高光照时电动机启动的灵敏度,可以________(选填“增大”或“减小”)R2的阻值.2020—2021教科版物理选修3—1第2章直流电路含答案教科版选修3—1第二章直流电路1、一只标有“4 V 3 W”的小灯泡,两端加上电压U,在U由0逐渐增加到4 V 过程中,电压U和电流I的关系可用图像表示,在如图所示的四个图像中,符合实际的是()A BC DB[本题应考虑灯丝的电阻随温度的变化,随着电压升高,电流增大,灯丝的电功率增大,温度升高,电阻率也将随之增大,电阻增大.]2、两根材料相同的均匀导线x和y串联在电路中,两导线沿长度方向的电势变化情况分别如图中的ab段和bc段图线所示,则导线x和y的横截面积之比为()A.2∶1B.1∶2C.6∶1 D.1∶6B[两导线串联,电流相等,I1=I2,从两段图线上截取相同的电压,ΔU1=ΔU2,保证电阻是相等的,此时长度之比为L1∶L2=1∶2,由电阻定律知,横截面积之比等于长度之比,则S1∶S2=1∶2,B正确,A、C、D错误.]3、两个定值电阻R1、R2串联后接在输出电压U稳定于12 V的直流电源上,有人把一个内阻不是远大于R1、R2的电压表接在R1两端,如图所示,则电压表的示数为8 V,如果他把此电压表改接在R2的两端,则电压表的示数将()A.小于4 V B.等于4 VC.大于4 V,小于8 V D.大于或等于8 VA[并联电路的电阻小于任何一个支路的电阻,又因为串联电路的电压与电阻成正比,所以把电阻并联在R2的两端,则电压表的示数小于4 V,故选A.]4、(双选)电源、开关S、定值电阻R1、R2、光敏电阻R3和电容器连接成如图所示电路,电容器的两平行板水平放置.当开关S闭合,并且无光照射光敏电阻R3时,一带电液滴恰好静止在电容器两板间的M点,当用强光照射光敏电阻R3时,光敏电阻的阻值变小,则()A.液滴向下运动B.液滴向上运动C.电容器所带电荷量减少D.电容器两极板间电压变大BD[电路稳定时电容器两端电压等于电阻R1两端电压,当用强光照射光敏电阻R3时,光敏电阻的阻值变小,电路中的电流变大,电阻R1两端电压变大,电容器继续充电,所带电荷量增加,并且带电液滴所受电场力增大,液滴向上运动,A、C项错误,B、D项正确.]5、额定电压为4.0 V的直流电动机的线圈电阻为1.0 Ω,正常工作时,电动机线圈每秒产生的热量为4.0 J,下列计算结果正确的是()A.电动机正常工作时的电流强度为4.0 AB.电动机正常工作时的输出功率为8.0 WC.电动机每分钟将电能转化成机械能为240.0 JD.电动机正常工作时的输入功率为4.0 WC[电动机正常工作时的电流强度为I=Qrt=41×1A=2 A,选项A错误;电动机正常工作时的输出功率为P出=IU-P内=2×4 W-4 W=4 W,选项B错误;电动机每分钟将电能转化成机械能为E机=P出t=4×60 J=240 J,选项C正确;电动机正常工作时的输入功率为P=UI=2×4 W=8 W,选项D错误.] 6、如图为含逻辑电路的一个简单电路图,L为小灯泡.光照射光敏电阻时,其阻值R′将变得远小于R.当光照射光敏电阻时,则()A.R两端的电势差变小B.R′两端的电势差变大C.小灯泡L发光D.小灯泡L不发光C[当电阻R′受到光照时,其阻值将变得远小于R.则R两端的电势差大,R′两端间的电势差小.故A、B错误;该逻辑电路为“非”门电路.“非”门的特点是输出状态和输入状态相反,当电阻R′受到光照时,其阻值将变得远小于R,则输入端为低电势,输出端为高电势,故a点电势为高电势,小灯泡L发光.故C正确,D错误.]7、某个由导电介质制成的电阻截面如图所示.导电介质的电阻率为ρ,制成内、外半径分别为a和b的半球壳层形状(图中阴影部分),半径为a、电阻不计的球形电极被嵌入导电介质的球心为一个引出电极,在导电介质的外层球壳上镀上一层电阻不计的金属膜成为另外一个电极.设该电阻的阻值为R,下面给出R的四个表达式中只有一个是合理的,试判断合理的表达式为()A.R=ρ(b+a)2πab B.R=ρ(b-a)2πabC.R=ρab2π(b-a)D.R=ρab2π(b+a)B[A项等式左边的单位是Ω,右边的单位是Ω,单位是合理的,将b=a代入得到R≠0,因为电阻是很薄的一层,电阻应该很小,这个等式是不合理的,故A 错误;B项等式左边的单位是Ω,右边的单位是Ω,单位是合理的,将b=a代入得到R=0,根据上面分析是合理的,故B正确;C项等式左边的单位是Ω,右边的单位是Ω·m2,左右两边单位不同,则此式不合理,故C错误;D项等式左边的单位是Ω,右边的单位是Ω·m2,左右两边单位不同,则此式不合理,故D错误.]8、一个电流表由小量程的电流表G与电阻R并联而成.若在使用中发现此电流表读数比准确值稍小些,下列采取的措施正确的是()A.在R上串联一个比R小得多的电阻B.在R上串联一个比R大得多的电阻C.在R上并联一个比R小得多的电阻D.在R上并联一个比R大得多的电阻A[电流表读数比准确值稍小些,是由于并联的电阻R的阻值偏小,而使流经小量程的电流表的电流偏小造成的,所以应该给电阻R串联一个阻值比R小得多的电阻,从而使改装后的电流表读数准确些.]9、如图所示为测量某电源电动势和内阻时得到的U-I图线.用此电源与三个阻值均为3 Ω的电阻连接成电路,测得路端电压为4.8 V.则该电路可能为()B[由图可知,E=U m=6 V,U=4 V时,I=4 A,因此有6 V=4 V+4r,解得r=0.5 Ω.当路端电压为4.8 V时,U内=6 V-4.8 V=1.2 V,由于U外U内=Rr,所以R=U外U内r=4.81.2×0.5=2 Ω,由电阻的串、并联知识可知,该电路可能为B.]10、如图所示,直线OAC为某一直流电源上总功率随电流I的变化图线,曲线OBC表示同一直流电源内部热功率随电流I变化的图线.若A、B的横坐标为1 A,那么AB段表示的功率为()A.1 W B.6 WC.2 W D.2.5 WC[在C点,电源的总功率等于电源内耗功率,所以电源电动势的大小为E=3 V,短路电流的大小为I=3 A,所以电源的内阻为r=EI=1 Ω,图像上AB段所代表的功率为P AB=P总-I2r=1×3 W-12×1 W=2 W,故选C.]11、(双选)某同学设计了一个路灯自动控制门电路,如图所示,天黑了,让路灯自动接通,天亮了,让路灯自动熄灭.图中R G是一个光敏电阻,当有光照射时,光敏电阻的阻值会显著地减小,R是可调电阻,起分压作用.J为路灯总开关——控制继电器(图中未画路灯电路).关于此电路,下列说法正确的是()A.天黑时,R G增大,A为高电位,Z为低电位,J使路灯亮B.天黑时,R G增大,A为低电位,Z为高电位,J使路灯亮C.R调大时,傍晚路灯亮得早一些D.R调大时,傍晚路灯亮得晚一些BD[当光照变弱时光敏电阻R G的阻值变大,分担的电压大,则门电路获得的电势低,“非”门电路输入端电压变小,继电器得到的电压变高,路灯被点亮,所以B对,A错;在相同的光照情况下,若电阻R增大,使得R分得的电压变大,使“非”门电路的输入端电压变大,继电器得到的电压偏低,路灯不被点亮.只有更晚一些,天色更暗时,光敏电阻更大一些,门电路获得的电势低,“非”门电路输入端电压变小,继电器得到的电压变高,路灯才能被点亮,故C错,D对.]12、欲用伏安法测定一段阻值约为5 Ω的金属导线的电阻,要求测量结果尽量准确,现备有以下器材:A.电池组(3 V,内阻1 Ω)B.电流表(0~3 A,内阻约0.012 5 Ω)C.电流表(0~0.6 A,内阻约0.125 Ω)D.电压表(0~3 V,内阻约3 kΩ)E.电压表(0~15 V,内阻约15 kΩ)F.滑动变阻器(0~20 Ω,额定电流1 A)G.滑动变阻器(0~2 000 Ω,额定电流0.3 A)H.开关、导线(1)上述器材中应选用的是________.(填写各器材前的字母代号)(2)实验电路应采用电流表________(填“内”或“外”)接法.(3)设实验中,电流表、电压表的某组示数如图所示,图中I=________A,U=________V.(4)为使通过待测金属导线的电流能在0~0.5 A范围内改变,请按要求在虚线框中画出测量待测金属导线的电阻R x的原理电路图,然后根据你设计的原理电路图将图中所给定的器材连成实验电路.解析:电池组电压为3 V,待测电阻约为5 Ω,流过待测电阻的最大电流约为3 V5 Ω=0.6 A,故应选量程为0~0.6 A的电流表、量程为0~3 V的电压表.滑动变阻器应选阻值小、额定电流大的,安全又易于调节.由于待测电阻与电流表、电压表内阻比较有50.125<3×1035,故采用电流表外接法.为使流过金属导线的电流在0~0.5 A范围内改变,则滑动变阻器应采用分压式接法.原理电路图和实物连线图如图(a)、(b)所示.答案:(1)A、C、D、F、H(2)外(3)0.48 2.20(4)见解析13、电动机的自动控制电路如图所示,其中R H为热敏电阻,R L为光敏电阻.当温度升高时,R H的阻值远小于R1;当光照射R L时,其阻值远小于R2,为使电动机在温度升高或受到光照时能自动启动,电路中虚线框内应选________门逻辑电路;若要提高光照时电动机启动的灵敏度,可以________(选填“增大”或“减小”)R2的阻值.解析:电路中的逻辑关系是“或”逻辑关系,故虚线框内应选“或”门电路.增大R2的阻值,可增大电动机两端的电压,此时R L的阻值改变较小时,就可以使电动机启动,故增大R2的阻值可提高光照时电动机启动的灵敏度.答案:或增大。
最新人教版高中物理选修3-1单元测试题全套及答案

高中物理选修3-1单元测试题全套及答案第一章《静电场》章末检测题(考试时间90分钟,总分120分)一.选择题(本题包括12小题,每小题4分,共48分。
每小题给出的四个选项中,只有一题号 1 2 3 4 5 6 7 8 9 10 11 12 总分答案A.电场线是电场中实际存在的线B.电场中的任意两条电场线都不可能相交C.顺着电场线的方向,电场强度一定越来越大D.顺着电场线的方向,电场强度一定越来越小2. 下列说法中不正确...的是A.在静电场中沿电场线方向的各点电势一定不相等,场强大小一定不相等B.在静电场中沿电场线方向的各点电势一定降低,场强大小不一定相等C.在静电场中同一等势面上各点电势一定相等,场强大小不一定相等D.在静电场中,点电荷q沿任意路径从a点移至b点,只要a、b在同一等势面上,则电场力一定不做功3. 下列公式中,既适用于点电荷产生的静电场,也适用于匀强电场的有①场强E=F/q②场强E=U/d③场强E=kQ/r2 ④电场力做功W=UqA.①③B.②③C.②④D.①④4.一带电粒子在如图所示的点电荷的电场中,在电场力作用下沿虚线所示轨迹从A点运动到B点,电荷的加速度、动能、电势能的变化情况是A.加速度的大小增大,动能、电势能都增加B.加速度的大小减小,动能、电势能都减少C.加速度增大,动能增加,电势能减少D.加速度增大,动能减少,电势能增加5. 如图所示,a、b、c是一条电场线上的三个点,电场线的方向由a到c,a、b间距离等于b、c间距离。
用U a、U b、U c和E a、E b、E c分别表示a、b、c三点的电势和电场强度,可以判定A. U a>U b>U cB.U a—U b=U b—U cC.E a>E b>E cD.E a=E b=E c6. AB是某电场中的一条电场线,若将一负电荷从A点处自由释放,负电荷沿电场线从A到B运动过程中的速度图线如图所示,则A、B两点的电势高低和场强大小关系是A. ϕϕA B A BE E>>, B. ϕϕA B A BE E><,C.ϕϕA B A BE E<>, D. ϕϕA B A BE E<<,7. 如图所示,有一带电粒子只在电场力作用下沿曲线AB运动,虚线a、b、c、d为电场中的等势面,且ϕϕϕϕa b c d>>>,粒子在A点时初速度v0的方向与等势面d平行,下面说法正确的是A. 粒子带正电荷B. 粒子在运动过程中电势能逐渐减少C. 粒子在运动过程中动能逐渐减少D. 粒子在运动过程中电势能与动能之和逐渐减少8. 如图所示,在E =500V/m 的匀强电场中,a 、b 两点相距d=2cm ,它们的连线跟场强方向的夹角是600,则U ab 等于A.5VB.10VC.-5VD.-10V9. 如图所示,平行金属板A 、B 组成的电容器,充电后与静电计相连,要使静电计指针张角变大,下列措施中可行的是A.A 向上移动B.B 板向左移动C.A 、B 之间充满电介质D.使A 板放走部分电荷10. 如图所示,在电场强度为E 、方向水平向右的匀强电场中,A 、B为一竖直线上的两点,相距为L ,外力F 将质量为m 、带电荷量为q 的粒 子从A 点匀速移到B 点,重力不能忽略,则下列说法中正确的是 A .外力的方向水平 B .外力的方向竖直向上C .外力的大小等于qE +mgD .外力的大小等于22()()qE mg11. A 、B 两点各放有电量为+Q 和+2Q 的点电荷,A 、B 、C 、D 四点在同一直线上,且AC=CD=DB 。
人教版高中数学选修三第二单元《随机变量及其分布》测试卷(有答案解析)(1)

一、选择题1.在市高二下学期期中考试中,理科学生的数学成绩()2~90,X N σ,已知(7090)0.35P X <=,则从全市理科生中任选一名学生,他的数学成绩小于110分的概率为( ) A .0.15B .0.50C .0.70D .0.852.抛掷两枚均匀骰子,观察向上的点数,记事件A 为“两个点数不同”,事件B 为“两个点数中最大点数为4”,则()P B A =( ) A .112B .16C .15D .563.从一个装有3个白球,3个红球和3个蓝球的袋中随机抓取3个球,记事件A 为“抓取的球中存在两个球同色”,事件B 为“抓取的球中有红色但不全是红色”,则在事件A 发生的条件下,事件B 发生的概率()|P B A =( ) A .37B .1237C .1219D .16214.已知随机变量ξ的取值为()0,1,2i i =.若()105P ξ==,()1E ξ=,则( ) A .()()1P D ξξ=< B .()()1P D ξξ== C .()()1P D ξξ=>D .()()115P D ξξ==5.已知随机变量ξ,η的分布列如下表所示,则( )A .E E ξη<,D D ξη<B .E E ξη<,D D ξη>C .E E ξη<,D D ξη=D .E E ξη=,D D ξη=6.某地区气象台统计,该地区下雨的概率是415,刮风的概率为215,既刮风又下雨的概率为110,则在下雨天里,刮风的概率为( ) A .8225B .12C .38D .347.甲、乙、丙三人每人准备在3个旅游景点中各选一处去游玩,则在“至少有1个景点未被选择”的条件下,恰有2个景点未被选择的概率是( ) A .17B .18C .114D .3148.一个盒子装有4件产品,其中有3件一等品,1件二等品.从中不放回的取两次,每次取出一件.设事件A 为“第一次取到的是一等品”,事件B 为“第二次取到的是一等品”.则()|P B A =( )A .34B .13C .23D .129.某班组织由甲、乙、丙等5名同学参加的演讲比赛,现采用抽签法决定演讲顺序,在“学生甲不是第一个出场,学生乙不是最后一个出场”的前提下,学生丙第一个出场的概率为( ) A .313B .413C .14D .1510.下列四个结论中正确的个数是(1)对于命题0:p x R ∃∈使得2010x -≤,则:p x R ⌝∃∈都有210x ->;(2)已知2(2,)XN σ,则 (2)0.5P X >=(3)已知回归直线的斜率的估计值是2,样本点的中心为(4,5),则回归直线方程为ˆ23yx =-; (4)“1≥x ”是“12x x+≥”的充分不必要条件. A .1B .2C .3D .411.把一枚骰子连续掷两次,已知在第一次抛出的是奇数点的情况下,第二次抛出的也是奇数点的概率为( ) A .14B .13C .12D .112.已知随机变量ξ服从正态分布()21,N σ,若()20.66P ξ≤=,则()0P ξ≤=( )A .0.84B .0.68C .0.34D .0.16二、填空题13.已知随机变量X 的分布列为:则随机变量X 的方差()V X 的值为______.14.由“0,1,2”组成的三位数密码中,若用A 表示“第二位数字是2”的事件,用B 表示“第一位数字是2”的事件,则(|)P A B =__________. 15.随机变量X 的概率分布为2()(1,2,3)aP X n n n n===+,其中a 是常数,则()D aX =__________.16.某工厂在试验阶段大量..生产一种零件,这种零件有A 、B 两项技术指标需要检测,设各项技术指标达标与否互不影响,若有且仅有一项技术指标达标的概率为12,至少一项技术指标达标的概率为34.按质量检验规定:两项技术指标都达标的零件为合格品,任意依次抽取该种零件4个,设ξ表示其中合格品的个数,则E ξ=______.17.从标有1,2,3,4,5的五张卡中,依次抽出2张,则在第一次抽到奇数的情况下,第二次抽到偶数的概率为________;18.抛掷红、黄两颗骰子,设事件A 为“黄色的骰子的点数为3或6”,事件B 为“两颗骰子的点数之和大于7”.当已知黄色的骰子的点数为3或6时,两颗骰子的点数之和大于7的概率为__________.三、解答题19.某班级以“评分的方式”鼓励同学们以骑自行车或步行方式“绿色出行”,培养学生的环保意识.“十一黄金周”期间,组织学生去A 、B 两地游玩,因目的地A 地近,B 地远,特制定方案如下:若甲同学去A 地玩,乙、丙同学去B 地玩,选择出行方式相互独立. (1)求恰有一名同学选择“绿色出行”方式的概率; (2)求三名同学总得分X 的分布列及数学期望EX .20.在某运动会上,有甲队女排与乙队女排以“五局三胜”制进行比赛,其中甲队是“慢热”型队伍,根据以往的经验,首场比赛甲队获胜的概率为P ,决胜局(第五局)甲队获胜的概率为23,其余各局甲队获胜的概率均为12.(1)求甲队以3:2获胜的概率; (2)现已知甲队以3:0获胜的概率是112,若比赛结果为3:0或3:1,则胜利方得3分,对方得0分;若比赛结果为3:2,则胜利方得2分,对方得1分,求甲队得分的分布列及数学期望.21.甲、乙两人进行投篮比赛,要求他们站在球场上的A ,B 两点处投篮,已知甲在A ,B 两点的命中率均为12,乙在A 点的命中率为p ,在B 点的命中率为212p -,且他们每次投篮互不影响.(1)若甲投篮4次,求他至多命中3次的概率;(2)若甲和乙每人在A ,B 两点各投篮一次,且在A 点命中计2分,在B 点命中计1分,未命中则计0分,设甲的得分为X ,乙的得分为Y ,写出X 和Y 的分布列,若EX EY =,求p 的值.22.现有甲、乙两个规模一致的大型养猪场,均养有1万头猪.根据猪的体重,将其分为三个成长阶段,如下表:根据以往经验,两个养猪场内猪的体重X 均近似服从正态分布()250,16N .由于我国有关部门加强对大型养猪场即将投放市场的成年期的猪的监控力度,高度重视其质量保证,为了养出健康的成年期的猪,甲、乙两个养猪场引入两种不同的防控及养殖模式.已知甲,乙两个养猪场内一头成年期的猪能通过质检合格的概率分别为43,54. (1)试估算各养猪场三个阶段的猪的数量;(2)已知甲养猪场出售一头成年期的猪,若为健康合格的猪,则可盈利400元,若为不合格的猪,则亏损200元;乙养猪场出售--头成年期的猪,若为健康合格的猪,则可盈利500元,若为不合格的猪,则亏损100元记Y 为甲,乙养猪场各出售一头成年期的猪所得的总利润,求随机变量Y 的分布列,假设两个养猪场均能把成年期的猪售完,求两个养猪场的总利润的期望值. (参考数据:若()2~,Z Nμσ,则()0.683,(22)0.954,(33)0.997P Z P Z P Z μσμσμσμσμσμσ-+≈-+≈-+≈)23.计划在某水库建一座至多安装3台发电机的水电站.过去50年的水文资料显示,水库年入流量X (年入流量:一年内上游来水与库区降水之和.单位:亿立方米)都在40以上.其中,不足80的年份有10年,不低于80且不超过120的年份有35年,超过120的年份有5年,将年入流量在以上三段的频率作为相应段的概率,并假设各年的入流量相互独立.(1)求未来3年中,至多有1年的年入流量超过120的概率;(2)水电站希望安装的发电机尽可能运行,但每年发电机最多可运行台数受年入流量X 限制,并有如下关系:电机年亏损800万元.欲使水电站年总利润的均值达到最大,应安装发电机多少台?24.近年来,我国肥胖人群的规模不断扩大,肥胖人群有很大的心血管安全隐患,目前,国际上常用身体质量指数(Bodv Mass Index,缩写BMI)来衡量人体胖瘦程度以及是否健康,其计算公式是BMI=体重(单位:千克)÷身高2(单位:2m),中国成人的BMI数值标准为:BMI<18.5为偏瘦;18.5≤BMI<24为正常;24≤BMI<28为偏胖;BMI≥28为肥胖.某单位随机调查了100名员工,测量身高、体重并计算出BMI值.(1)根据调查结果制作了如下2×2列联表,请将2×2列联表补充完整,并判断是否有99%的把握认为肥胖与不经常运动有关;人中“经常运动且不肥胖”的人数为X,求随机变量X的分布列和数学期望.附:22()()()()()n ad bcKa b c d a c b d-=++++,n a b c d=+++.25.山竹,原产于马鲁古,具有清热泻火、生津止渴的功效,其含有丰富的蛋白质与脂类,对体弱、营养不良的人群都有很好的调养作用,因此被誉为夏季的“水果之王”,受到广大市民的喜爱.现将某水果经销商近一周内山竹的销售情况统计如下表所示:采购人数1001005020050(1)根据表格中数据,完善频率分布直方图;(2)求近一周内采购量在286箱以下(含286箱)的人数以及采购数量x的平均值;(3)以频率估计概率,若从所有采购者中随机抽取4人,记采购量不低于260箱的采购人E X.数为X,求X的分布列以及数学期望()26.某学校为了了解学生暑假期间学习数学的情况,抽取了人数相等的甲、乙两班进行调查,甲班同学每天学习数学的平均时间的频率分布直方图(将时间分成[0,1),[1,2),[2,3),[3,4),[4,5),[5,6]共6组)和乙班同学每天学习数学的平均时间的频数分布表如图所示(单位:小时).(1)从甲班每天学习数学的平均时间在[0,2)的人中随机选出3人,求3人中恰有1人学习数学的平均时间在[0,1)范围内的概率;(2)从甲、乙两个班每天学习数学平均时间不小于5个小时的学生中随机抽取4人进一步了解其他情况,设4人中乙班学生的人数为ξ,求ξ的分布列和数学期望.【参考答案】***试卷处理标记,请不要删除一、选择题1.D解析:D【分析】根据正态密度曲线的对称性得出()()()110700.57090P X P X P X ≥=≤=-<≤,于是可计算出()()1101110P X P X <=-≥,于此可得出结果. 【详解】 由于()2~90,X N σ,由正态密度曲线的对称性可得()()()110700.570900.15P X P X P X ≥=≤=-<≤=,因此,()()110111010.150.85P X P X <=-≥=-=,故选D. 【点睛】本题考查正态分布在指定区间上的概率的计算,解题的关键在于利用正态密度曲线的对称性将所求概率转化为已知区间概率进行计算,属于基础题.2.C解析:C 【分析】抛掷两枚均匀骰子,构成的基本事件的总数共有36种,其中记事件A 为“两个点数不同”的基本事件共有30种,再由“两个点数不同且最大点数为4”的基本事件共有6种,利用条件概率的计算公式,即可求解. 【详解】由题意,抛掷两枚均匀骰子,构成的基本事件的总数共有36种, 其中记事件A 为“两个点数不同”的基本事件共有36630-=种,又由事件“两个点数不同且最大点数为4”的基本事件为:(1,4),(2,4),(3,4),(4,1),(4,2),(4,3),共有6种,所以6()136()30()536P A B P B A P A ⋂===,故选C . 【点睛】本题主要考查了条件概率的计算,其中解答中熟记条件概率的计算方法,准确计算是解答的关键,着重考查了运算与求解能力,属于基础题.3.C解析:C 【分析】根据题意,求出()P A 和()P AB ,由公式()()()|P AB P B A P A =即可求出解答.【详解】解:因为事件A 为“抓取的球中存在两个球同色”包括两个同色和三个同色,所以()213363393357198428C C C P A C +=== 事件A 发生且事件B 发生概率为:()12213336392363847C C C C P AB C +=== 故()()()3127|191928P AB P B A P A ===. 故选:C. 【点睛】本题考查条件概率求法,属于中档题.4.C解析:C 【分析】设()1P x ξ==,根据()f x ,()1E ξ=列方程求出x ,进而求出()D ξ,即可比较大小. 【详解】 设()1P x ξ==, 则()425P x ξ==-,则()1480121555x x E x ξ⎛⎫=⨯+⨯+-⨯=-= ⎪⎝⎭,解得()315P ξ==,()125P ξ==, 则()()()()22213120111215555D ξ=⨯-+⨯-+⨯-=, 故()()1P D ξξ=>, 故选:C. 【点睛】本题考查离散型随机变量的分布列、数学期望、方差的性质等基础知识,考查运算求解能力,是中档题.5.C解析:C 【分析】由题意分别求出E ξ,D ξ,E η,D η,由此能得到E ξ<E η,D ξ>D η. 【详解】 由题意得: E ξ111123326=⨯+⨯+⨯=116, D ξ22211111111151(1)(2)(3)636108266=-⨯+-⨯+-⨯=.E η111131236236=⨯+⨯+⨯=, D η=(1316-)216⨯+(2136-)212⨯+(3136-)21513108⨯=, ∴E ξ<E η,D ξ=D η. 故选:C . 【点睛】本题考查离散型随机变量的分布列、数学期望、方差的求法,考查运算求解能力,是中档题.6.C解析:C 【分析】利用条件概率公式,即可求得结论. 【详解】该地区下雨的概率是415,刮风的概率为215,既刮风又下雨的概率为110, ∵设A 事件为下雨,B 事件为刮风,由题意得,P (A )415=,P (AB )110=, 则P (B |A )()()13104815P AB P A ===, 故选C . 【点睛】本题考查概率的计算,考查条件概率,考查学生的计算能力,属于基础题.7.A解析:A 【分析】设事件A 为:至少有1个景点未被选择,事件B 为:恰有2个景点未被选择,计算()P AB 和()P A ,再利用条件概率公式得到答案.【详解】设事件A 为:至少有1个景点未被选择,事件B 为:恰有2个景点未被选择331()39P AB == 3337()139A P A =-=()1()()7P AB P B A P A == 故答案选A 【点睛】本题考查了条件概率,意在考查学生对于条件概率的理解和计算.8.C解析:C 【分析】利用古典概型概率公式计算出()P AB 和()P A ,然后利用条件概率公式可计算出结果. 【详解】事件:AB 前两次取到的都是一等品,由古典概型的概率公式得()232412A P AB A ==,由古典概型的概率公式得()34P A =,由条件概率公式得()()()142233P AB P B A P A ==⨯=, 故选C. 【点睛】本题考查条件概率公式求概率,解题时要弄清楚各事件之间的关系,关键在于灵活利用条件概率公式计算,考查运算求解能力,属于中等题.9.A解析:A 【分析】根据条件概率的计算公式,分别求解公式各个部分的概率,从而求得结果. 【详解】设事件A 为“学生甲不是第一个出场,学生乙不是最后一个出场”;事件B 为“学生丙第一个出场”则()41134333555578A C C A P A A A +==,()1333555518C A P AB A A == 则()()()1837813P AB P B A P A === 本题正确选项:A 【点睛】本题考查条件概率的求解,关键是能够利用排列组合的知识求解出公式各个构成部分的概率.10.C解析:C 【分析】由题意,(1)中,根据全称命题与存在性命题的关系,即可判定是正确的;(2)中,根据正态分布曲线的性质,即可判定是正确的;(3)中,由回归直线方程的性质和直线的点斜式方程,即可判定是正确;(4)中,基本不等式和充要条件的判定方法,即可判定. 【详解】由题意,(1)中,根据全称命题与存在性命题的关系,可知命题0:p x R ∃∈使得2010x -≤,则:p x R ⌝∀∈都有210x ->,是错误的;(2)中,已知()22,X N σ~,正态分布曲线的性质,可知其对称轴的方程为2x =,所以 (2)0.5P X >=是正确的;(3)中,回归直线的斜率的估计值是2,样本点的中心为(4,5),由回归直线方程的性质和直线的点斜式方程,可得回归直线方程为ˆ23yx =-是正确; (4)中,当1x ≥时,可得12x x +≥=成立,当12x x +≥时,只需满足0x >,所以“1x ≥”是“12x x+≥”成立的充分不必要条件. 【点睛】本题主要考查了命题的真假判定及应用,其中解答中熟记含有量词的否定、正态分布曲线的性质、回归直线方程的性质,以及基本不等式的应用等知识点的应用,逐项判定是解答的关键,着重考查了分析问题和解答问题的能力,属于基础题.11.C解析:C 【解析】分析:设A 表示“第一次抛出的是奇数点”,B 表示“第二次抛出的是奇数点”,利用古典概型概率公式求出()(),P A P AB 的值,由条件概率公式可得结果. 详解:设A 表示“第一次抛出的是奇数点”,B 表示“第二次抛出的是奇数点”,()()31111,62224P A P AB ===⨯=, ()()()114|122P AB P B A P A ===,∴在第一次抛出的是奇数点的情况下,第二次抛出的也是奇数点的概率为12,故选C. 点睛:本题考查概率的求法,是基础题,解题时要认真审题,注意条件概率计算公式的合理运用,同时注意区分独立事件同时发生的概率与条件概率的区别与联系.12.C解析:C 【解析】分析:先根据正态分布得(12)0.16,P ξ≤≤=再求(01)0.16,P ξ≤≤=最后求得() 0P ξ≤=0.34.详解:由正态分布曲线得(12)0.660.50.16,P ξ≤≤=-= 所以(01)0.16,P ξ≤≤=所以()0P ξ≤=0.5-0.16=0.34. 故答案为C.点睛:(1)本题主要考查正态分布曲线的性质,意在考查学生对这些知识的掌握水平和数形结合思想和方法.(2)解答本题的关键是数形结合,要结合正态分布曲线的图像和性质解答,不要死记硬背.二、填空题13.【分析】由分布列求出然后由方差公式计算方差【详解】由题意故答案为:【点睛】本题考查随机变量的概率分布列考查随机变量的方差根据分布列计算出期望再由方差公式计算即得考查了学生的运算求解能力解析:65216【分析】由分布列求出q ,然后由方差公式计算方差. 【详解】 由题意1111362q =--=, 111()11263E X =-⨯+⨯=-,222111111165()(1)(0)()2333663216V X =⨯-++⨯++⨯+=.故答案为:65216.【点睛】本题考查随机变量的概率分布列,考查随机变量的方差.根据分布列计算出期望,再由方差公式计算即得.考查了学生的运算求解能力.14.【分析】利用古典摡型的概率计算公式分别求得结合条件概率的计算公式即可求解【详解】由012组成的三位数密码共有个基本事件又由用A 表示第二位数字是2的事件用B 表示第一位数字是2的事件可得所以故答案为:【解析:13【分析】利用古典摡型的概率计算公式,分别求得(),()P B P A B ,结合条件概率的计算公式,即可求解. 【详解】由“0,1,2”组成的三位数密码,共有33327⨯⨯=个基本事件,又由用A 表示“第二位数字是2”的事件,用B 表示“第一位数字是2”的事件, 可得33131(),()273279P B P A B ⨯====, 所以1()19(|)1()33P A B P A B P B ===. 故答案为:13.【点睛】本题主要考查了条件概率的计算与求解,其中解答中熟记条件概率的计算公式,准确运算时解答得关键,属于基础题.15.【分析】根据随机变量分布列概率和为1求出求出再由方差性质即可求解【详解】由题意得则∴则∴故答案为:【点睛】本题考查离散型随机变量分布列性质期望方差以及方差的性质考查计算求解能力属于中档题解析:608729【分析】根据随机变量分布列概率和为1求出a ,求出(),()E X D X ,再由方差性质,即可求解. 【详解】 由题意得11111311122334223344a a a a a ⎛⎫++=-+-+-== ⎪⨯⨯⨯⎝⎭, 则43a =,∴()213P X ==,()229P X ==,()139P X ==,则24113()3939E X =++=,222132********()12393999981D X ⎛⎫⎛⎫⎛⎫=-⨯+-⨯+-⨯=⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭,∴2608()()729D aX a D X ==. 故答案为:608729【点睛】本题考查离散型随机变量分布列性质、期望、方差以及方差的性质,考查计算求解能力,属于中档题.16.1【分析】设两项技术指标达标的概率分别为得到求得的值进而得到可得分布列和的值得到答案【详解】由题意设两项技术指标达标的概率分别为由题意得解得所以即一个零件经过检测为合格品的概率为依题意知所以故答案为解析:1 【分析】设,A B 两项技术指标达标的概率分别为12,P P ,得到()()()()122112111231114P p P P P P ⎧-+-=⎪⎪⎨⎪---=⎪⎩,求得12,P P 的值,进而得到1(4,)4B ξ,可得分布列和E ξ的值,得到答案.【详解】由题意,设,A B 两项技术指标达标的概率分别为12,P P ,由题意,得()()()()122112111231114P p P P P P ⎧-+-=⎪⎪⎨⎪---=⎪⎩,解得1211,22P P ==, 所以1214P PP ==,即一个零件经过检测为合格品的概率为14, 依题意知1(4,)4B ξ,所以1414E ξ=⨯=.故答案为1. 【点睛】本题主要考查了随机变量的分布列及其数学期望的计算,其中解答中根据概率的计算公式,求得12,P P 的值,得到随机变量1(4,)4B ξ是解答的关键,着重考查了分析问题和解答问题的能力,属于中档试题.17.【分析】设事件A 表示第一张抽到奇数事件B 表示第二张抽取偶数则P (A )P (AB )利用条件概率计算公式能求出在第一次抽到奇数的情况下第二次抽到偶数的概率【详解】解:从标有12345的五张卡片中依次抽出2 解析:12【分析】设事件A 表示“第一张抽到奇数”,事件B 表示“第二张抽取偶数”,则P (A )35=,P (AB )3235410=⨯=,利用条件概率计算公式能求出在第一次抽到奇数的情况下,第二次抽到偶数的概率. 【详解】解:从标有1、2、3、4、5的五张卡片中,依次抽出2张,设事件A 表示“第一张抽到奇数”,事件B 表示“第二张抽取偶数”,则P (A )35=,P (AB )3235410=⨯=, 则在第一次抽到奇数的情况下,第二次抽到偶数的概率为:P (A|B )()()3P AB 1103P A 25===. 【点睛】本题考查概率的求法,考查条件概率等基础知识,考查运算求解能力.18.【解析】分析:由题意知这是一个条件概率做这种问题时要从这两步入手一是做出黄色骰子的点数为或的概率二是两颗骰子的点数之和大于的概率再做出两颗骰子的点数之和大于且黄色骰子的点数为或的概率根据条件概率的公 解析:712【解析】分析:由题意知这是一个条件概率,做这种问题时,要从这两步入手,一是做出黄色骰子的点数为3或6的概率,二是两颗骰子的点数之和大于7的概率,再做出两颗骰子的点数之和大于7且黄色骰子的点数为3或6的概率,根据条件概率的公式得到结果.详解:设x 为掷红骰子的点数,y 为黄掷骰子得的点数,(),x y 共有6636⨯=种结果,则黄色的骰子的点数为3或6所有12种结果,两颗骰子的点数之和大于7所有结果有10种,利用古典概型概率公式可得()()()1211077,,363361836P A P B P AB =====,由条件概率公式可得()()()7736|1123P AB P B A P A ===,故答案为712. 点睛:本题主要考查条件概率以及古典概型概率公式的应用,属于难题,利用古典概型概率公式求概率时,找准基本事件个数是解题的关键,基本亊件的探求方法有 (1)枚举法:适合给定的基本事件个数较少且易一一列举出的;(2)树状图法:适合于较为复杂的问题中的基本亊件的探求.在找基本事件个数时,一定要按顺序逐个写出;(3)利用两个原理及排列组合知识.三、解答题19.(1)736;(2)分布列见解析,1225=EX . 【分析】(1)分析恰有一个同学选择“绿色出行”方式的情况,利用相互独立事件的概率计算公式求解;(2)根据题意得,X 的所有可能取值为0,1,2,3,分别计算概率,列出分布列,代入公式求解EX .【详解】(1)恰有一名同学选择绿色出行方式的概率2123111274343336P C ⎛⎫=⋅+⋅⋅⋅= ⎪⎝⎭.(2)根据题意,X 的所有可能取值为0,1,2,3,根据事件的独立性和互斥性得:1111(0)43336P X ==⨯⨯=;1231112173(1)4334363==⨯⨯+⨯⨯⨯=P X C ;21221124(2)4393343⎛⎫==⨯⨯⨯+⨯= ⎪⎝⎭P X C ;3221(3)4333==⨯⨯=P X .故X 的分布列为:所以360123369312=⨯+⨯+⨯+⨯=EX . 【点睛】本题考查了随机变量分布列问题,一般列分布列时先判断变量的可能取值,遇到比较复杂的情况可以采用列表格的方式能更直观的判断出可能取值有哪些,然后计算不同取值下的概率,需要分析清楚不同取值对应的所有情况,注意是二项分布还是超几何分布问题. 20.(1)14;(2)分布列见解析,数学期望为118. 【分析】(1)分析出第五局甲赢,前四局甲队赢两局,利用独立事件的概率乘法公式可求得所求事件的概率;(2)利用独立事件的概率乘法公式计算得出13P =,设甲队得分为X ,则X 的可能取值有0、1、2、3,计算出X 在不同取值下的概率,可得出随机变量X 的分布列,进而可求得()E X 的值. 【详解】(1)记事件A :甲队以3:2获胜,则第五局甲队胜,前面四局甲队赢两局,所以,()()33123312121123234P A P C P C ⎛⎫⎛⎫=⋅⋅⋅+-⋅⋅⋅= ⎪ ⎪⎝⎭⎝⎭;(2)记甲队以3:0获胜为事件B ,则()21112412P B P P ⎛⎫=⨯== ⎪⎝⎭,解得13P =. 记甲队得分为X ,则X 的可能取值有0、1、2、3, 若X 0=,则甲队以0:3或1:3落败,所以,()23312111111301113232328P X C ⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫==-⋅-+⋅+-⋅⋅=⎪ ⎪ ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭;若1X =,则甲队以2:3落败,所以,()331233111211113233238P X C C ⎛⎫⎛⎫==⋅⋅⋅+⋅⋅⋅= ⎪ ⎪⎝⎭⎝⎭;若2X =,则甲队以3:2获胜,所以,()()124P X P A ===; 若3X =,则甲队以3:0或3:1获胜,所以,()2231211111211332322324P X C ⎛⎫⎛⎫⎛⎫==⋅+⋅⋅⋅+⋅= ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭.所以,随机变量X 的分布列如下表所示:因此,()012388448E X =⨯+⨯+⨯+⨯=. 【点睛】思路点睛:求解随机变量分布列的基本步骤如下:(1)明确随机变量的可能取值,并确定随机变量服从何种概率分布; (2)求出每一个随机变量取值的概率;(3)列成表格,对于抽样问题,要特别注意放回与不放回的区别,一般地,不放回抽样由排列、组合数公式求随机变量在不同取值下的概率,放回抽样由分步乘法计数原理求随机变量在不同取值下的概率. 21.(1)1516;(2)分布列答案见解析,12p =. 【分析】(1)根据相互独立事件的概率计算“甲4次全部命中”的概率,用1减去“甲4次全部命中”的概率即可得出答案;(2)由题意得,X Y 的可能取值均为0,1,2,3,依据题意算出其概率,列出其分布列分布列,根据数学期望公式算出,EX EY ,由EX EY =建立方程解出p . 【详解】解:(1)“甲至多命中3次”的对立事件为“甲4次全部命中”,所以甲至多命中3次的概率为41151216⎛⎫-= ⎪⎝⎭.(2)X ,Y 的可能取值均为0,1,2,3. X 的分布列为所以31234442EX =⨯+⨯+⨯=. Y 的分布列为2322(1)124312122EY p p p p p p p =--++-=+-.由231222p p +-=,解得12p =.【点睛】离散型随机变量的均值与方差的常见类型及解题策略:(1)求离散型随机变量的均值与方差.可依题设条件求出离散型随机变量的分布列,然后利用均值、方差公式直接求解;(2)由已知均值或方差求参数值.可依据条件利用均值、方差公式得出含有参数的方程(组),解方程(组)即可求出参数值;(3)由已知条件,作出对两种方案的判断.可依据均值、方差的意义,对实际问题作出判断.22.(1)幼年期的猪215头,成长期的猪9540头,成年期的猪215头;(2)135450元. 【分析】(1)设各阶段猪的数量分别为123,,n n n ,根据猪的体重X 近似服从正态分布2(50,16)N ,分别求得(218)P X <,(1882)P X <,(8298)P X 即可.(2)随机变量Y 的所有可能取值为900,300,300-,分别求得其概率,列出分布列,再根据分布列利用均值公式求解. 【详解】(1)设各阶段猪的数量分别为123,,n n n , ∵猪的体重X 近似服从正态分布2(50,16)N ,0.9970.954(218)(50316502 16) 0.02152P X P X -∴<=-⨯<-⨯≈=,1100000.0215215n ∴=⨯=(头);(1882)(5021650216)0.954P X P X <=-⨯<+⨯≈2100000.9549540n ∴=⨯=(头);0.9970.954(8298)(5021650316) 0.02152P X P X -=+⨯+⨯≈=,3100000.0215215n ∴=⨯=(头)∴甲、乙两个养猪场各有幼年期的猪215头,成长期的猪9540头,成年期的猪215头. (2)随机变量Y 的所有可能取值为900,300,300-.43341137111(900),(300),(300)5455454205420P Y P Y P Y ==⨯===⨯+⨯==-=⨯=,Y ∴的分布列为()90030030063052020E Y ∴=⨯+⨯-⨯=(元),由于两个养猪场均有215头成年期的猪,且两个养猪场各出售一头成年期的猪所得的总利润的期望为630元,则总利润的期望为630215135450⨯=(元). 【点睛】方法点睛: (1)求离散型随机变量的均值与方差关键是确定随机变量的所有可能值,写出随机变量的分布列,正确运用均值、方差公式进行计算.(2)注意性质的应用:若随机变量X 的均值为E (X ),则对应随机变量aX +b 的均值是aE (X )+b ,方差为a 2D (X ). 23.(1)9721000;(2)2台. 【分析】(1)先求出年入流量X 的概率,根据二项分布可得未来3年中,至多有1年的年入流量超过120的概率;(2)分三种情况进行讨论,分别求出安装1台、2台、3台的数学期望,比较即可求解. 【详解】(1)依题意,得110(4080)0.250p P X =<<==, 235(80120)0.750p P X =≤≤==, 35(120)0.150p P X =>==. 由二项分布,记“在未来3年中,至多有1年的年入流量超过120”为事件A ,320133919729243972)101010100010001000P A C C ⎛⎫⎛⎫⎛⎫=+=+= ⎪ ⎪⎪⎝⎭⎝⎭⎝⎭( (2)记水电站年总利润为Y (单位:万元).①安装1台发电机的情形:由于水库年入流量总大于40,故一台发电机运行的概率为1,对应的年利润5000Y =,()500015000E Y =⨯=;②安装2台发电机的情形:依题意,当4080X <<时,一台发电机运行,此时50008004200Y =-=,因此1(4200)(4080)0.2P Y P X p ==<<==;当80X ≥时,两台发电机运行,此时5000210000Y =⨯=,因此23(10000)(80)0.8P Y P X p p ==≥=+=.由此得Y 的概率分布列如下:所以0.88840⨯=. ③安装3台发电机的情形:依题意,当4080X <<时,一台发电机运行,此时500016003400Y =-=, 因此1(3400)(4080)0.2P Y P X p ==<<==;当80120X ≤≤时,两台发电机运行,此时500028009200Y =⨯-=, 因此2(9200)(80120)0.7P Y P X p ==≤≤==;当120X >时,三台发电机运行,此时5000315000Y =⨯=,因此3(15000)(120)0.1P Y P X p ==>==,由此得Y 的概率分布列如下:所以,150000.18620+⨯=. 综上所述,欲使水电站年总利润的均值达到最大,应安装发电机2台. 【点睛】 思路点睛:求离散型随机变量的分布列及期望的一般步骤: (1)根据题中条件确定随机变量的可能取值;(2)求出随机变量所有可能取值对应的概率,即可得出分布列;(3)根据期望的概念,结合分布列,即可得出期望(在计算时,要注意随机变量是否服从特殊的分布,如超几何分布或二项分布等,可结合其对应的概率计算公式及期望计算公式,简化计算).24.(1)列联表见解析,有;(2)分布列见解析,65.。
高中物理选修3-1第二章《恒定电流》单元测试

3-11. 电源电动势反映了电源把其它形式的能量转化为电能的能力,因此( )A. 电动势是一种非静电力B. 电动势越大,表明电源储存的电能越多C. 电动势的大小是非静电力做功能力的反映D. 电动势就是闭合电路中电源两端的电压2.额定电压是220V ,电阻是440Ω的灯泡,在正常工作时,3 分钟内通过灯丝横截面的电量为( )A.30CB.90CC.220CD.360C3.如图所示为两电阻R1 和R2 的伏安特性曲线.关于它们的电阻值及串联或并联后电路中的总电流比较正确的是( )A. 电阻R1 的阻值比电阻R2 的阻值大B. 电阻R2 阻值比电阻R1 的阻值大C.两电阻串联后比并联后接入同一电源,电路中的总电流大D.两电阻并联后比串联后接入同一电源,电路中的总电流小4.如图所示,电流计的内阻R g=100Ω ,满偏电流I g=1mA ,R1=900Ω ,R2=100/999Ω ,则下列说法正确的是:A. 当S1 和S2 均断开时,虚线框中可等效为电流表,最大量程是1AB. 当S1 和S2 均断开时,虚线框中可等效为电压表,最大量程是10VC. 当S1 和S2 均闭合时,虚线框中可等效为电压表,最大量程是0. 1AD. 当S1 和S2 均闭合时,虚线框中可等效为电流表,最大量程是1A5.如图所示的长方体是用电阻率为ρ的均匀金属制成的,长度为2L,其横截面为正方形,边长为L,若将它的a、b端接入电路时的电阻为R,则将它的两个侧面上的c、d端接入电路时的电阻是( )A.RB.R/4C.R/2D.4R6.在如图所示的− 图象中,直线Ⅰ为某一电源的路端电压与电流的关系图象,直线Ⅱ为某一电阻R的伏安特性曲线. 用该电源与电阻R组成闭合电路. 由图象判断错误的是( )A.电源的电动势为3 V,内阻为0.5B.接入电路后电阻R的阻值为 1C.电源的效率为80%D.电源的输出功率为 4 W7.在如图所示电路中,当滑动变阻器滑片P向下移动时,则()A.A 灯变亮、B 灯变亮、C 灯变亮B.A 灯变亮、B 灯变亮、C 灯变暗C.A 灯变亮、B 灯变暗、C 灯变暗D.A 灯变亮、B 灯变暗、C 灯变亮8.如图所示,已知R1=R2=R3= 1Ω ,当开关S闭合后,电压表的读数为1V;当开关S断开后,电压表的读数为0.8V,则电池的电动势等于( )A. 1VB. 1.2VC.2VD.4V9.如图所示的电路中,闭合电键k 后,灯a 和b 都正常发光,后来由于某种故障使灯 b 突然变亮,电压表读数增加,由此推断这故障可能是( )A.a 灯灯丝烧断B.电阻R2 短路C.电阻R2 断路D.电容被击穿短路10.如图所示,电源内阻较大,当开关闭合、滑动变阻器滑片位于某位置时,水平放置的平行板电容器间一带电液滴恰好处于静止状态,灯泡L 也能正常发光,现将滑动变阻器滑片由该位置向a端滑动,则( )A.灯泡将变暗,电源效率将减小B.液滴带正电,将向下做加速运动C. 电源的路端电压增大,输出功率也增大D.滑片滑动瞬间,带电液滴电势能将减小11.某同学将一直流电源的总功率PE 、输出功率PR 和电源内部的发热功率Pr 随电流I 变化的图线画在同一坐标系内,如图所示,根据图线可知( )A.反映Pr变化的图线是 aB. 电源电动势为8 VC. 电源内阻为2 ΩD. 当电流为0.5 A 时,外电路的电阻为6 Ω12.如图所示,是一个小灯泡的电流强度随小灯泡两端电压变化的关系图,则根据小灯泡的伏安特性曲线可判定下列说法中正确的是( )A.小灯泡的电阻随着所加电压的增加而减小B.小灯泡灯丝的电阻率随着灯丝温度的升高而减小C.欧姆定律对小灯泡不适用D.如果把三个这种相同的灯泡串联后,接到电压恒为12V 的电源上,则流过每个小灯泡的电流为0.4A13.如图所示为两个不同闭合电路中两个不同电源的U-I图象,则下列判断正确的是( )A. 电源电动势E1>E2B. 电源电动势E1=E2C. 电源内阻r1 >r2D. 电源内阻r1 <r214.在如图所示的电路中,输入电压U 恒为8 V ,灯泡L 标有“3 V,6 W”字样,电动机线圈的电阻R M=1 Ω .若灯泡恰能正常发光,下列说法正确的是( )A. 电动机的效率是80%B.流过电动机的电流是 2 AC. 电动机的输入电压是5 VD.整个电路消耗的电功率是10 W15.如图所示,电源电动势E= 12V,内阻r=3Ω ,R0=2Ω ,直流电动机内阻R0 ′= 1Ω ,额定输出功率P0=2W.调节滑动变阻器R1 可使甲电路输出功率最大,调节R2 可使乙电路输出功率最大且此时电动机刚好正常工作,则( )A. 甲电路中当R1= 1Ω时,定值电阻R0 功率最大B. 甲电路中当R1= 1Ω时,电源的输出功率最大C. 乙电路中当R2= 1.5Ω时,电源的输出功率最大D. 乙电路中当R2=2Ω时,电源的输出功率最大16.某同学要测量一节干电池的电动势和内电阻.实验室除提供开关S 和导线外,有以下器材可供选择:电压表:V(量程3V ,内阻Rv 约为10kΩ)电流表:G(量程3mA ,内阻Rg= 100Ω)滑动变阻器:R(阻值范围0~10Ω ,额定电流2A)定值电阻:R0=0.5Ω( 1)该同学将电流表G 与定值电阻R0 并联,实际上是进行了电表的改装,则他改装后的电流表对应的量程是____________ A.(2)该同学利用上述实验原理图测得数据,以电流表G 读数为横坐标,以电压表V 读数为纵坐标绘出了如图乙所示的图线,根据图线可求出电源的电动势E= _______ V(结果保留三位有效数字) ,电源的内阻r= ______ Ω(结果保留两位有效数字).(3)由于电压表内阻电阻对电路造成影响,本实验电路测量结果电动势 E ____________ ,内阻r ______ (选填“偏大” 、“不变”或“偏小”)17.如图,灯泡D 与电动机M 中串联在一个稳压电源上,电源的输出电压为U=20V,灯泡D 的电阻为R D=6Ω ,电动机M 线圈的电阻为R M=2Ω ,与电动机并联的理想电压表读数为U M= 14V.电动机的转轴的摩擦可忽略,求:( 1)通过灯泡的电流I=?(2)电动机M 线圈的发热功率P Q=?(3)电动机M 输出的机械功率P 机=?18.如图所示电路中,R1=R2=2Ω ,R3= 1Ω.当K 接通时,电压表的读数为1V;K 断开时,电压表的读数为0.75V.求电源电动势E和内阻r.19.如图所示,电源电动势为E=6V ,内电阻为r= 1Ω ,滑动变阻器电阻的阻值范围0 ﹣10Ω,当滑动变阻器电阻R=2Ω时,当K 闭合后,求:( 1)电路中的电流为多大?(2)电路中路端电压为多少?(3)电源的输出功率为多少?(4)电源的总功率为多少?3-11. 电源电动势反映了电源把其它形式的能量转化为电能的能力,因此( )A. 电动势是一种非静电力B. 电动势越大,表明电源储存的电能越多C. 电动势的大小是非静电力做功能力的反映D. 电动势就是闭合电路中电源两端的电压【答案】C2.额定电压是220V ,电阻是440Ω的灯泡,在正常工作时,3 分钟内通过灯丝横截面的电量为( )A.30CB.90CC.220CD.360C 【答案】B3.如图所示为两电阻R1 和R2 的伏安特性曲线.关于它们的电阻值及串联或并联后电路中的总电流比较正确的是( )A. 电阻R1 的阻值比电阻R2 的阻值大B. 电阻R2 阻值比电阻R1 的阻值大C.两电阻串联后比并联后接入同一电源,电路中的总电流大D.两电阻并联后比串联后接入同一电源,电路中的总电流小【答案】B4.如图所示,电流计的内阻R g= 100Ω ,满偏电流I g= 1mA ,R1=900Ω ,R2= 100/999Ω ,则下列说法正确的是:A. 当S1 和S2 均断开时,虚线框中可等效为电流表,最大量程是1AB. 当S1 和S2 均断开时,虚线框中可等效为电压表,最大量程是10VC. 当S1 和S2 均闭合时,虚线框中可等效为电压表,最大量程是0. 1AD. 当S1 和S2 均闭合时,虚线框中可等效为电流表,最大量程是1A【答案】D5.如图所示的长方体是用电阻率为ρ的均匀金属制成的,长度为2L,其横截面为正方形,边长为L,若将它的a、b端接入电路时的电阻为R,则将它的两个侧面上的c、d端接入电路时的电阻是( )A.RB.R/4C.R/2D.4R【答案】B6.在如图所示的− 图象中,直线Ⅰ为某一电源的路端电压与电流的关系图象,直线Ⅱ为某一电阻R的伏安特性曲线. 用该电源与电阻R组成闭合电路. 由图象判断错误的是( )A. 电源的电动势为3 V,内阻为0.5B.接入电路后电阻R的阻值为 1C. 电源的效率为80%D. 电源的输出功率为 4 W【答案】C7.在如图所示电路中,当滑动变阻器滑片P 向下移动时,则( )A.A 灯变亮、B 灯变亮、C 灯变亮B.A 灯变亮、B 灯变亮、C 灯变暗C.A 灯变亮、B 灯变暗、C 灯变暗D.A 灯变亮、B 灯变暗、C 灯变亮【答案】D8.如图所示,已知R1=R2=R3= 1Ω ,当开关S闭合后,电压表的读数为1V;当开关S断开后,电压表的读数为0.8V,则电池的电动势等于( )A. 1VB. 1.2VC.2VD.4V【答案】C9.如图所示的电路中,闭合电键k 后,灯a 和b 都正常发光,后来由于某种故障使灯 b 突然变亮,电压表读数增加,由此推断这故障可能是( )A a 灯灯丝烧断.B. 电阻R2 短路C. 电阻R2 断路D. 电容被击穿短路【答案】C10.如图所示,电源内阻较大,当开关闭合、滑动变阻器滑片位于某位置时,水平放置的平行板电容器间一带电液滴恰好处于静止状态,灯泡L 也能正常发光,现将滑动变阻器滑片由该位置向a端滑动,则( )A.灯泡将变暗,电源效率将减小B.液滴带正电,将向下做加速运动C. 电源的路端电压增大,输出功率也增大D.滑片滑动瞬间,带电液滴电势能将减小【答案】D11.某同学将一直流电源的总功率PE 、输出功率PR 和电源内部的发热功率Pr 随电流I 变化的图线画在同一坐标系内,如图所示,根据图线可知( )A.反映Pr变化的图线是aB. 电源电动势为8 VC. 电源内阻为2 ΩD. 当电流为0.5 A 时,外电路的电阻为6 Ω【答案】CD12.如图所示,是一个小灯泡的电流强度随小灯泡两端电压变化的关系图,则根据小灯泡的伏安特性曲线可判定下列说法中正确的是( )A.小灯泡的电阻随着所加电压的增加而减小B.小灯泡灯丝的电阻率随着灯丝温度的升高而减小C.欧姆定律对小灯泡不适用D.如果把三个这种相同的灯泡串联后,接到电压恒为12V 的电源上,则流过每个小灯泡的电流为0.4A【答案】D13.如图所示为两个不同闭合电路中两个不同电源的U-I图象,则下列判断正确的是( )A. 电源电动势E1>E2B. 电源电动势E1=E2C. 电源内阻r1 >r2D. 电源内阻r1 <r2【答案】BD14.在如图所示的电路中,输入电压U 恒为8 V ,灯泡L 标有“3 V,6 W”字样,电动机线圈的电阻R M=1 Ω .若灯泡恰能正常发光,下列说法正确的是( )A. 电动机的效率是80%B.流过电动机的电流是 2 AC. 电动机的输入电压是5 VD.整个电路消耗的电功率是10 W【答案】BC15.如图所示,电源电动势E= 12V,内阻r=3Ω ,R0=2Ω ,直流电动机内阻R0 ′= 1Ω ,额定输出功率P0=2W.调节滑动变阻器R1 可使甲电路输出功率最大,调节R2 可使乙电路输出功率最大且此时电动机刚好正常工作,则( )A. 甲电路中当R1= 1Ω时,定值电阻R0 功率最大B. 甲电路中当R1= 1Ω时,电源的输出功率最大C. 乙电路中当R2= 1.5Ω时,电源的输出功率最大D. 乙电路中当R2=2Ω时,电源的输出功率最大【答案】BC16.某同学要测量一节干电池的电动势和内电阻.实验室除提供开关S 和导线外,有以下器材可供选择:电压表:V(量程3V ,内阻Rv 约为10kΩ)电流表:G(量程3mA ,内阻Rg= 100Ω)滑动变阻器:R(阻值范围0~10Ω ,额定电流2A)定值电阻:R0=0.5Ω( 1)该同学将电流表G 与定值电阻R0 并联,实际上是进行了电表的改装,则他改装后的电流表对应的量程是____________ A.(2)该同学利用上述实验原理图测得数据,以电流表G 读数为横坐标,以电压表V 读数为纵坐标绘出了如图乙所示的图线,根据图线可求出电源的电动势E= _______ V(结果保留三位有效数字) ,电源的内阻r= ______ Ω(结果保留两位有效数字).(3)由于电压表内阻电阻对电路造成影响,本实验电路测量结果电动势 E ____________ ,内阻r ______ (选填“偏大” 、“不变”或“偏小”)【答案】( 1) 0.603或0.6 ;(2) 1.48;0.86(0.78 一0.90) ;(3)偏小;偏小;17.如图,灯泡D 与电动机M 中串联在一个稳压电源上,电源的输出电压为U=20V,灯泡D 的电阻为R D=6Ω ,电动机M 线圈的电阻为R M=2Ω ,与电动机并联的理想电压表读数为U M= 14V.电动机的转轴的摩擦可忽略,求:( 1)通过灯泡的电流I=?(2)电动机M 线圈的发热功率P Q=?(3)电动机M 输出的机械功率P 机=?【答案】( 1) 1A ;(2)2W;(3) 12W【解析】( 1)灯两端的电压为U D= U一U M= 20 一14 = 6V所以通过灯泡的电流为I= = A= 1A(2)电动机M 线圈的发热功率P Q= I2R M= 12 2W= 2W(3)电动机M 消耗的电功率为P M= UI= 14 1 = 14W输出的机械功率P机= P M一P Q= 14 一2 = 12W18.如图所示电路中,R1=R2=2Ω ,R3= 1Ω.当K 接通时,电压表的读数为1V;K 断开时,电压表的读数为0.75V.求电源电动势E和内阻r.【答案】E =3V ,r = 1Ω【详解】设电源电动势为 E , 内阻为 r ,则当 K 接通,R 1 、R 2 并联再与 R 3 串联,R 1 、R 2 并 联电阻值是 1Ω ,电压表测 R 3 两端的电压, 所以: U 1 =E1即 : 1 = 当 K 断开,R 2 、R 3 串联,电压表测 R 3 两端的电压,则:E R 3 R + R + r2 + 1 + r联立①②代入数据得:E =3V ,r = 1Ω19.如图所示,电源电动势为 E=6V , 内电阻为 r= 1Ω ,滑动变阻器电阻的阻值范围 0 ﹣ 10Ω,当滑动变阻器电阻 R =2Ω时,当 K 闭合后,求:( 1)电路中的电流为多大? (2)电路中路端电压为多少? (3)电源的输出功率为多少? (4)电源的总功率为多少?【答案】( 1)2A (2)4V (3)8W (4) 12W【解析】根据闭合电路欧姆定律列式求解电流;根据 U =IR 求解路端电压;根据 P = UI 求解电源的输出功率;根据 P =EI 求解求解电源的总功率. ( 1)根据闭合电路欧姆定律,电流: I = =A = 2A(2)电路中路端电压:U =IR =2×2V=4V ; (3)电源的输出功率为:P = UI =4V×2A=8W ; (4)电源的总功率为:P =EI =6V×2A= 12W ;U 2 3E 1即: 0.75 = 1 + 1 + r= 2。
最新人教版高中物理选修3-2测试题及答案全套

最新人教版高中物理选修3-2测试题及答案全套单元测评(一)电磁感应(时间:90分钟满分:100分)第Ⅰ卷(选择题,共48分)一、选择题(本题有12小题,每小题4分,共48分.)1.下列现象中,属于电磁感应现象的是()A.小磁针在通电导线附近发生偏转B.通电线圈在磁场中转动C.因闭合线圈在磁场中运动而产生的电流D.磁铁吸引小磁针解析:电磁感应是指“磁生电”的现象,而小磁针和通电线圈在磁场中转动,反映了磁场力的性质,所以A、B、D项不是电磁感应现象,C项是电磁感应现象.答案:C如图所示,开始时矩形线框与匀强磁场的方向垂直,且一半在磁场内,一半在磁场外,若要使线框中产生感应电流,下列办法中不可行的是() A.将线框向左拉出磁场B.以ab边为轴转动(小于90°)C.以ad边为轴转动(小于60°)D.以bc边为轴转动(小于60°)解析:将线框向左拉出磁场的过程中,线框的bc部分做切割磁感线运动,或者说穿过线框的磁通量减少,所以线框中将产生感应电流.当线框以ab边为轴转动时,线框的cd边的右半段在做切割磁感线运动,或者说穿过线框的磁通量在发生变化,所以线框中将产生感应电流.当线框以ad边为轴转动(小于60°)时,穿过线框的磁通量在减小,所以在这个过程中线框中会产生感应电流.如果转过的角度超过60°(60°~300°),bc 边将进入无磁场区,那么线框中将不产生感应电流.当线框以bc边为轴转动时,如果转动的角度小于60°,则穿过线框的磁通量始终保持不变(其值为磁感应强度与矩形线框面积的一半的乘积).答案:D如图所示,通电螺线管水平固定,OO′为其轴线,a、b、c三点在该轴线上,在这三点处各放一个完全相同的小圆环,且各圆环平面垂直于OO′轴.则关于这三点的磁感应强度B a、B b、B c的大小关系及穿过三个小圆环的磁通量Φa、Φb、Φc的大小关系,下列判断正确的是()A.B a=B b=B c,Φa=Φb=ΦcB.B a>B b>B c,Φa<Φb<ΦcC.B a>B b>B c,Φa>Φb>ΦcD.B a>B b>B c,Φa=Φb=Φc解析:根据通电螺线管产生的磁场特点可知B a>B b>B c,由Φ=BS可得Φa >Φb>Φc,故C项正确.答案:C如图所示,一均匀的扁平条形磁铁的轴线与圆形线圈在同一平面内,磁铁中心与圆心重合,为了在磁铁开始运动时在线圈中得到逆时针方向的感应电流,磁铁的运动方式应是()A.N极向纸内,S极向纸外,使磁铁绕O点转动B.N极向纸外,S极向纸内,使磁铁绕O点转动C.磁铁在线圈平面内顺时针转动D.磁铁在线圈平面内逆时针转动解析:当N极向纸内、S极向纸外转动时,穿过线圈的磁场由无到有并向里,感应电流的磁场应向外,电流方向为逆时针,A选项正确;当N极向纸外、S极向纸内转动时,穿过线圈的磁场向外并增加,电流方向为顺时针,B选项错误;当磁铁在线圈平面内绕O点转动时,穿过线圈的磁通量始终为零,因而不产生感应电流,C、D选项错误.答案:A5.穿过闭合回路的磁通量Φ随时间t变化的图象分别如图所示,下列关于回路中产生的感应电动势的论述,正确的是()①②③④A.图①中回路产生的感应电动势恒定不变B.图②中回路产生的感应电动势一直在变大C.图③中回路在0~t1时间内产生的感应电动势小于在t1~t2时间内产生的感应电动势D.图④中回路产生的感应电动势先变小再变大解析:图④中磁通量的变化率先变小后变大,因此,回路产生的感应电动势先变小再变大.答案:D6.(多选题)变压器的铁芯是利用薄硅钢片叠压而成的,而不是采用一整块硅钢,这是因为()A.增大涡流,提高变压器的效率B.减小涡流,提高变压器的效率C.增大铁芯中的电阻,以产生更多的热量D.增大铁芯中的电阻,以减小发热量解析:不使用整块硅钢而是采用很薄的硅钢片,这样做的目的是增大铁芯中的电阻,阻断涡流回路,来减少电能转化成铁芯的内能,提高效率是防止涡流而采取的措施.本题正确选项是BD.答案:BD7.(多选题如图所示,电阻不计的平行金属导轨固定在一绝缘斜面上,两相同的金属导体棒a、b垂直于导轨静止放置,且与导轨接触良好,匀强磁场垂直穿过导轨平面.现用一平行于导轨的恒力F作用在a的中点,使其向上运动.若b始终保持静止,则它所受摩擦力可能()A.变为0B.先减小后不变C.等于F D.先增大再减小解析:导体棒a在恒力F作用下加速运动,最后匀速运动,闭合回路中产生感应电流,导体棒b受到安培力方向应沿斜面向上,且逐渐增大,最后不变.由力平衡可知,导体棒b受到的摩擦力先沿斜面向上逐渐减小,最后不变,所以选项A、B正确,选项C、D错误.答案:AB8.如图所示,两条平行虚线之间存在匀强磁场,虚线间的距离为l,磁场方向垂直纸面向里,abcd是位于纸面内的梯形线圈,ad与bc间的距离也为l,t=0时刻,bc边与磁场区域左边界重合.现令线圈以向右的恒定速度v沿垂直于磁场区域边界的方向穿过磁场区域,取沿a→b→c→d→a方向的感应电流为正,则在线圈穿越磁场区域的过程中,感应电流I随时间t的变化的图线是图中的()A BC D解析:0~lv段,由右手定则判断感应电流方向为a→d→c→b→a,大小逐渐增大;lv~2lv段,由右手定则判断感应电流方向为a→b→c→d→a,大小逐渐增大,故B选项正确.答案:B9.(多选题)如图所示,水平放置的平行金属导轨左边接有电阻R,轨道所在处有竖直向下的匀强磁场,金属棒ab横跨导轨,它在外力的作用下向右匀速运动,速度为v.若将金属棒的运动速度变为2v,(除R外,其余电阻不计,导轨光滑)则() A.作用在ab上的外力应增大到原来的2倍B.感应电动势将增大为原来的4倍C.感应电流的功率将增大为原来的2倍D.外力的功率将增大为原来的4倍解析:由平衡条件可知,F=B2L2Rv,可见,将金属棒的运动速度变为2v时,作用在ab上的外力应增大到原来的2倍,外力的功率将增大为原来的4倍.答案:AD10.(多选题)如图所示,E为电池,L是电阻可忽略不计、自感系数足够大的线圈,D1、D2是两个规格相同且额定电压足够大的灯泡,S是控制电路的开关.对于这个电路,下列说法正确的是()A.刚闭合开关S的瞬间,通过D1、D2的电流大小相等B.刚闭合开关S的瞬间,通过D1、D2的电流大小不相等C.闭合开关S待电路达到稳定,D2熄灭,D1比原来更亮D.闭合开关S待电路达到稳定,再将S断开的瞬间,D2立即熄灭,D1闪亮一下再熄灭解析:由于线圈的电阻可忽略不计、自感系数足够大,在开关S闭合的瞬间线圈的阻碍作用很大,线圈中的电流为零,所以通过D1、D2的电流大小相等,A项正确、B项错误;闭合开关S待电路达到稳定时线圈短路,D1中电流为零,回路电阻减小,D2比原来更亮,C项错误;闭合开关S待电路达到稳定,再将S断开瞬间,D2立即熄灭,线圈和D1形成回路,D1闪亮一下再熄灭,D项正确.答案:AD如图所示,矩形线圈放置在水平薄木板上,有两块相同的蹄形磁铁,四个磁极之间的距离相等,当两块磁铁匀速向右通过线圈时,线圈仍静止不动,那么线圈受到木板的摩擦力方向是()A.先向左,后向右B.先向左、后向右、再向左C.一直向右D.一直向左解析:当两块磁铁匀速向右通过线圈时,线圈内产生感应电流,线圈受到的安培力阻碍线圈相对磁铁的向左运动,故线圈有相对木板向右运动的趋势,故受到的静摩擦力总是向左.选项D正确,A、B、C项错误.答案:D光滑曲面与竖直平面的交线是抛物线,如图所示,抛物线的方程为y =x 2,其下半部处在一个水平方向的匀强磁场中,磁场的上边界是y =a 的直线(如图中的虚线所示).一个小金属块从抛物线上y =b (b >a )处以速度v 沿抛物线下滑,假设曲面足够长,则金属块在曲面上滑动的过程中产生的焦耳热总量是( )A .mgbB.12m v 2 C .mg (b -a ) D .mg (b -a )+12m v 2 解析:金属块进出磁场时,会产生涡流,部分机械能转化成焦耳热,所能达到的最高位置越来越低,当最高位置y =a 时,由于金属块中的磁通量不再发生变化,金属块中不再产生涡流,机械能也不再损失,金属块会在磁场中往复运动,此时的机械能为mga ,整个过程中减少的机械能为mg (b -a )+12m v 2,全部转化为内能,所以D 项正确.答案:D第Ⅱ卷(非选择题,共52分)二、实验题(本题有2小题,共14分.请按题目要求作答)13.(6分)如图所示,在一根较长的铁钉上,用漆包线绕两个线圈A 和B .将线圈B 的两端与漆包线CD 相连,使CD 平放在静止的小磁针的正上方,与小磁针平行.试判断合上开关的瞬间,小磁针N 极的偏转情况?线圈A 中电流稳定后,小磁针又怎样偏转?解析:在开关合上的瞬间,线圈A内有了由小变大的电流,根据安培定则可判断出此时线圈A在铁钉内产生了一个由小变大的向右的磁场.由楞次定律可知,线圈B内感应电流的磁场应该阻碍铁钉内的磁场在线圈B内的磁通量的增加,即线圈B内感应电流的磁场方向是向左的.由安培定则可判断出线圈B 内感应电流流经CD时的方向是由C到D.再由安培定则可以知道直导线CD内电流所产生的磁场在其正下方垂直于纸面向里,因此,小磁针N极应该向纸内偏转.线圈A内电流稳定后,CD内不再有感应电流,所以,小磁针又回到原来位置.答案:在开关合上的瞬间,小磁针的N极向纸内偏转.(3分)当线圈A内的电流稳定以后,小磁针又回到原来的位置(3分)14.(8分)如图所示为“研究电磁感应现象”的实验装置,部分导线已连接.(1)用笔画线代替导线将图中未完成的电路连接好.(2)如果在闭合电键时发现灵敏电流计的指针向右偏了一下,那么闭合电键后,将原线圈迅速插入副线圈的过程中,电流计指针将向________偏;原线圈插入副线圈后,将滑动变阻器滑片迅速向右移动时,电流计指针将向________偏.答案:(1)如图所示.(4分)(2)右(2分)左(2分)三、计算题(本题有3小题,共38分.解答应写出必要的文字说明、方程式和重要的演算步骤,只写出最后答案的不能得分.有数值计算的题,答案中必须明确写出数值和单位)15.(10分)匀强磁场的磁感应强度B=0.8 T,矩形线圈abcd的面积S=0.5 m2,共10匝,开始B与S垂直且线圈有一半在磁场中,如图所示.(1)当线圈绕ab边转过60°时,线圈的磁通量以及此过程中磁通量的改变量为多少?(2)当线圈绕dc边转过60°时,求线圈中的磁通量以及此过程中磁通量的改变量.解析:(1)当线圈绕ab转过60°时,Φ=BS⊥=BS cos 60°=0.8×0.5×12Wb=0.2 Wb(此时的S⊥正好全部处在磁场中).在此过程中S⊥没变,穿过线圈的磁感线条数没变,故磁通量变化量ΔΦ=0. (5分)(2)当线圈绕dc 边转过60°时,Φ=BS ⊥, 此时没有磁场穿过S ⊥,所以Φ=0; 不转时Φ1=B ·S2=0.2 Wb ,转动后Φ2=0,ΔΦ=Φ2-Φ1=-0.2 Wb , 故磁通量改变了0.2 Wb. (5分) 答案:(1)0 (2)0.2 Wb16.(14分)两根光滑的长直金属导轨MN 、M ′N ′平行置于同一水平面内,导轨间距为l ,电阻不计,M 、M ′处接有如图20所示的电路,电路中各电阻的阻值均为R ,电容器的电容为C .长度也为l 、阻值同为R 的金属棒ab 垂直于导轨放置,导轨处于磁感应强度为B 、方向竖直向下的匀强磁场中.ab 在外力作用下向右匀速运动且与导轨保持良好接触,在ab 运动距离为x 的过程中,整个回路中产生的焦耳热为Q .求:(1)ab 运动速度v 的大小; (2)电容器所带的电荷量q .解析 (1)设ab 上产生的感应电动势为E ,回路中的电流为I ,ab 运动距离为x ,所用时间为t ,则有E =Bl v (2分) I =E4R(2分) t =xv (2分) Q =I 2(4R )t (2分)由上述方程得v =4QRB 2l 2x (2分)(2)设电容器两极板间的电势差为U ,则有U =IR ,电容器所带电荷量q =CU ,(2分) 解得q =CQRBlx (2分) 答案:(1)4QR B 2l 2x(2)CQRBlx17.(14分)如图所示,两足够长的光滑金属导轨竖直放置,相距为L ,一理想电流表与两导轨相连,匀强磁场与导轨平面垂直.一质量为m 、有效电阻为R 的导体棒在距磁场上边界h 处静止释放.导体棒进入磁场后,流经电流表的电流逐渐减小,最终稳定为I .整个运动过程中,导体棒与导轨接触良好,且始终保持水平,不计导轨的电阻.求:(1)磁感应强度的大小B ;(2)电流稳定后,导体棒运动速度的大小v ; (3)流经电流表电流的最大值I m .解析:(1)电流稳定后,导体棒做匀速运动,受力平衡, 有F 安=G ,即BIL =mg ①(2分)解得B =mgIL ②(2分)(2)由法拉第电磁感应定律得导体棒产生的感应电动势 E =BL v ③(1分)闭合电路中产生的感应电流I =ER ④(1分) 由②③④式解得v =I 2Rmg (2分)(3)由题意知,导体棒刚进入磁场时的速度最大,设为v m , 由机械能守恒定律得12m v 2m =mgh (2分)感应电动势的最大值E m =Bl v m (1分) 感应电流的最大值I m =E mR (1分) 解得I m =mg 2ghIR .(2分)答案:(1)mgIL (2)I 2R mg (3)mg 2gh IR单元测评(二) 交变电流(时间:90分钟 满分:100分) 第Ⅰ卷(选择题,共48分)一、选择题(本题有12小题,每小题4分,共48分.) 1.在下图中,不能产生交变电流的是( )ABCD解析:矩形线圈绕着垂直于磁场方向的转轴做匀速圆周运动就产生交流电,而A图中的转轴与磁场方向平行,线圈中无电流产生,所以选A.答案:A2.闭合线圈在匀强磁场中匀速转动时,产生的正弦式交变电流i=I m sin ωt.若保持其他条件不变,使线圈的匝数和转速各增加1倍,则电流的变化规律为()A.i′=I m sin ωt B.i′=I m sin 2ωtC.i′=2I m sin ωt D.i′=2I m sin 2ωt解析:由电动势的最大值知,最大电动势与角速度成正比,与匝数成正比,所以电动势最大值为4E m,匝数加倍后,其电阻也应该加倍,此时线圈的电阻为2R,根据欧姆定律可得电流的最大值为I m′=4E m2R=2I m,因此,电流的变化规律为i′=2I m sin 2ωt.答案:D3.(多选题)如图是某种正弦式交变电压的波形图,由图可确定该电压的()A .周期是0.01 sB .最大值是311 VC .有效值是220 VD .表达式为u =220sin 100πt (V)解析:由波形图可知:周期T =0.02 s ,电压最大值U m =311 V ,所以有效值U =U m 2=220 V ,表达式为u =U m sin 2πT t (V)=311sin100πt (V),故选项B 、C正确,选项A 、D 错误.答案:BC4.(多选题)如图所示,变频交变电源的频率可在20 Hz 到20 kHz 之间调节,在某一频率时,L 1、L 2两只灯泡的炽热程度相同.则下列说法中正确的是 ( )A .如果将频率增大,L 1炽热程度减弱、L 2炽热程度加强B .如果将频率增大,L 1炽热程度加强、L 2炽热程度减弱C .如果将频率减小,L 1炽热程度减弱、L 2炽热程度加强D .如果将频率减小,L 1炽热程度加强、L 2炽热程度减弱解析:某一频率时,两只灯泡炽热程度相同,应有两灯泡消耗的功率相同,频率增大时,感抗增大,而容抗减小,故通过A1的电流增大,通过A2的电流减小,故B项正确;同理可得C项正确,故选B、C.答案:BC5.(多选题)如图所示,在远距离输电过程中,若保持原线圈的输入功率不变,下列说法正确的是()A.升高U1会减小输电电流I2B.升高U1会增大线路的功率损耗C.升高U1会增大线路的电压损耗D.升高U1会提高电能的利用率解析:提高输电电压U1,由于输入功率不变,则I1将减小,又因为I2=n1n2I1,所以I2将减小,故A项对;线路功率损耗P损=I22R,因此功率损耗在减小,电压损失减小,故B项、C项错误;因线路损耗功率减小,因此利用率将升高,D项正确.答案:AD6.如图甲所示,a、b为两个并排放置的共轴线圈,a中通有如图乙所示的交变电流,则下列判断错误的是()甲乙A.在t1到t2时间内,a、b相吸B.在t2到t3时间内,a、b相斥C.t1时刻两线圈间作用力为零D.t2时刻两线圈间吸引力最大解析:t1到t2时间内,a中电流减小,a中的磁场穿过b且减小,因此b中产生与a同向的磁场,故a、b相吸,A选项正确;同理B选项正确;t1时刻a 中电流最大,但变化率为零,b中无感应电流,故两线圈的作用力为零,故C 选项正确;t2时刻a中电流为零,但此时电流的变化率最大,b中的感应电流最大,但相互作用力为零,故D选项错误.因此,错误的应是D.答案:D7.如图所示是四种亮度可调的台灯的电路示意图,它们所用的白炽灯泡相同,且都是“220 V40 W”,当灯泡所消耗的功率都调到20 W时,消耗功率最小的台灯是()ABCD解析:利用变阻器调节到20 W时,除电灯消耗电能外,变阻器由于热效应也要消耗一部分电能,使台灯消耗的功率大于20 W,利用变压器调节时,变压器的输入功率等于输出功率,本身不消耗电能,所以C中台灯消耗的功率最小.答案:C8.一电阻接一直流电源,通过4 A的电流时热功率为P,若换接一正弦交流电源,它的热功率变为P2,则该交流电电流的最大值为()A.4 A B.6 A C.2 A D.4 2 A解析:由P=I2R得R=PI2=P16,接交流电时,P2=I′2P16,2I′2=16,I′=42A,所以I m=2I′=4 A.应选A.答案:A9.(多选题)如图所示为两个互感器,在图中圆圈内a、b表示电表,已知电压比为100∶1,电流比为10∶1,电压表的示数为220 V,电流表的示数为10 A,则()A.a为电流表,b为电压表B.a为电压表,b为电流表C.线路输送电功率是2 200 WD.线路输送电功率是2.2×106 W解析:电压互感器应并联在电路中,并且是降压变压器,即图中a为电压互感器,由其读数知,输电线上的电压为22 000 V,同理可知输电线上的电流为100 A.答案:BD10.水电站向小山村输电,输送电功率为50 kW ,若以1 100 V 送电,则线路损失为10 kW ,若以3 300 V 送电,则线路损失可降为( )A .3.3 kWB .1.1 kWC .30 kWD .11 kW解析:由P =UI ,ΔP =I 2R 可得:ΔP =P2U2R ,所以当输送电压增大为原来3倍时,线路损失变为原来的19,即ΔP =1.1 kW.答案:B11.如图所示,理想变压器的原、副线圈的匝数比n 1∶n 2=2∶1,原线圈接正弦式交流电,副线圈接电动机,电动机线圈电阻为R ,当输入端接通电源后,电流表读数为I ,电动机带动一质量为m 的重物以速度v 匀速上升,若电动机因摩擦造成的能量损失不计,则图中电压表的读数为( )A .4IR +mg vI B.mg v I C .4IRD.14IR +mg v I 解析:根据电流与匝数的关系知变压器的输出电流为2I ,电动机消耗的总功率为P 2=mg v +4IR ,又变压器的输入功率P 1=UI =P 2=mg v +4I 2R ,则U =mg vI +4IR ,故A 项正确.答案:A12.(多选题)如图所示,M是一小型理想变压器,接线柱a、b接在电压u =311sin 314t (V)的正弦交流电源上,变压器右侧部分为一火警报警系统原理图,其中R2是半导体热敏传感器(温度升高时R2的电阻减小),电流表A2安装在值班室,显示通过R1的电流,电压表V2显示加在报警器上的电压(报警器未画出),R3为一定值电阻.当传感器R2所在处出现火警时,以下说法中正确的是()A.A1的示数增大,A2的示数减小B.A1的示数不变,A2的示数增大C.V1的示数不变,V2的示数减小D.V1的示数增大,V2的示数增大解析:传感器R2所在处出现火警,温度升高,则R2电阻减小,副线圈负载电阻减小.因输出电压不变,所以副线圈电流增大,则电阻R3两端电压增大,电压表V2的示数减小,电流表A2的示数减小.副线圈电流增大,则原线圈电流增大,但输入电压不变,即电流表A1的示数增大,电压表V1的示数不变.答案:AC第Ⅱ卷(非选择题,共52分)二、计算题(本题有4小题,共52分.解答应写出必要的文字说明、方程式和重要的演算步骤,只写出最后答案的不能得分.有数值计算的题,答案中必须明确写出数值和单位)13.(12分)一小型发电机内的矩形线圈在匀强磁场中以恒定的角速度ω绕垂直于磁场方向的固定轴转动,线圈匝数n=100匝.穿过每匝线圈的磁通量Φ随时间按正弦规律变化,如图甲所示.发电机内阻r=5.0 Ω,外电路电阻R=95 Ω.已知感应电动势的最大值E m=nωΦm,其中Φm为穿过每匝线圈磁通量的最大值.求串联在外电路中的交流电流表(内阻不计)的读数.甲乙解析:从Φ-t图线看出Φm=1.0×10-2Wb,T=3.14×10-2s.(2分) 已知感应电动势的最大值E m=nωΦm,又ω=2πT.(3分)故电路中电流最大值I m=E mR+r=n·2π·ΦmT(R+r)=100×2×3.14×1.0×10-23.14×(95+5.0)×10-2A=2 A(4分)交流电流表读数是交变电流的有效值,即I=I m2=1.4 A.(3分)答案:1.4 A14.(12分)有一个电子元件,当它两端的电压的瞬时值高于u=110 2 V 时则导电,低于u=110 2 V时不导电,若把这个电子元件接到220 V、50 Hz的正弦式交变电流的两端,则它在1 s 内导电多少次?每个周期内的导电时间为多少?解析:由题意知,加在电子元件两端电压随时间变化的图象如图所示,表达式为u =2202sin ωt V .(2分)其中ω=2πf ,f =50 Hz ,T =1f =0.02 s ,得u =2202sin100πt V .(2分)把u ′=110 2 V 代入上述表达式得到t 1=1600 s ,t 2=5600s(2分) 所以每个周期内的通电时间为Δt =2(t 2-t 1)=4300 s =175s .(3分) 由所画的u -t 图象知,一个周期内导电两次,所以1 s 内导电的次数为n =2t T =100.(3分)答案:100次 175s 15.(14分)如图所示,变压器原线圈输入电压为220 V ,副线圈输出电压为36 V ,两只灯泡的额定电压均为36 V ,L 1额定功率为12 W ,L 2额定功率为6 W .求:(1)该变压器的原、副线圈匝数比.(2)两灯均工作时原线圈的电流以及只有L 1工作时原线圈中的电流.解析:(1)由变压比公式得U 1U 2=n 1n 2(2分) n 1n 2=22036=559.(2分) (2)两灯均工作时,由能量守恒得P 1+P 2=U 1I 1(3分)I 1=P 1+P 2U 1=12+6220A =0.082 A(2分) 只有L 1灯工作时,由能量守恒得P 1=U 1I ′1(3分)解得I ′1=P 1U 1=12220A =0.055 A .(2分) 答案:(1)55∶9 (2)0.082 A 0.055 A16.(14分)某村在较远的地方建立了一座小型水电站,发电机的输出功率为100 kW ,输出电压为500 V ,输电导线的总电阻为10 Ω,导线上损耗的电功率为4 kW ,该村的用电电压是220 V .(1)输电电路如图所示,求升压、降压变压器的原、副线圈的匝数比;(2)如果该村某工厂用电功率为60 kW ,则该村还可以装“220 V ,40 W”的电灯多少盏?解析:(1)因为P损=I22R线(2分)所以I2=P损R线=4×10310A=20 A(1分)I1=PU1=100×103500A=200 A(2分)则n1n2=I2I1=20200=110(1分)U3=U2-I2R线=(500×10-20×10) V=4 800 V(2分)则n3n4=U3U4=4 800220=24011.(1分)(2)设还可装灯n盏,据功率相等有P3=P4(1分)其中P4=(n×40+60×103) W(1分)P3=(100-4) kW=96 kW(1分)所以n=900.(2分)答案:(1)1∶10240∶11(2)900盏单元测评(三)传感器(时间:90分钟满分:100分)第Ⅰ卷(选择题,共48分)一、选择题(本题有12小题,每小题4分,共48分.)1.关于干簧管,下列说法正确的是()A.干簧管接入电路中相当于电阻的作用B.干簧管是根据热胀冷缩的原理制成的C.干簧管接入电路中相当于开关的作用D.干簧管是作为电控元件以实现自动控制的答案:C2.(多选题)为了保护电脑元件不受损害,在电脑内部有很多传感器,其中最重要的就是温度传感器,常用的温度传感器有两种,一种是用金属做的热电阻,另一种是用半导体做的热敏电阻.关于这两种温度传感器的特点说法正确的是()A.金属做的热电阻随着温度的升高电阻变大B.金属做的热电阻随着温度的升高电阻变小C.用半导体做的热敏电阻随着温度的升高电阻变大D.用半导体做的热敏电阻随着温度的升高电阻变小解析:金属的电阻率随着温度的升高而变大,半导体在温度升高时电阻会变小.答案:AD3.街旁的路灯、江海里的航标都要求在夜晚亮、白天熄,利用半导体的电学特性制成了自动点亮、熄灭的装置,实现了自动控制,这是利用半导体的() A.压敏性B.光敏性C.热敏性D.三种特性都利用答案:B4.(多选题)有定值电阻、热敏电阻、光敏电阻三只元件,将这三只元件分别接入如图所示电路中的A、B两点后,用黑纸包住元件或者把元件置入热水中,观察欧姆表的示数,下列说法中正确的是()A.置入热水中与不置入热水中相比,欧姆表示数变化较大,这只元件一定是热敏电阻B.置入热水中与不置入热水中相比,欧姆表示数不变化,这只元件一定是定值电阻C.用黑纸包住元件与不用黑纸包住元件相比,欧姆表示数变化较大,这只元件一定是光敏电阻D.用黑纸包住元件与不用黑纸包住元件相比,欧姆表示数相同,这只元件一定是定值电阻解析:热敏电阻的阻值随温度变化而变化,定值电阻和光敏电阻不随温度变化;光敏电阻的阻值随光照变化而变化,定值电阻和热敏电阻不随之变化.答案:AC5.传感器是一种采集信息的重要器件,如图是由电容器作为传感器来测定压力变化的电路,当待测压力作用于膜片电极上时,下列说法中正确的是()①若F向下压膜片电极,电路中有从a到b的电流②若F向下压膜片电极,电路中有从b到a的电流③若F向下压膜片电极,电路中不会有电流产生④若电流表有示数,说明压力F发生变化⑤若电流表有示数,说明压力F不会发生变化A.②④B.①④C.③⑤D.①⑤解析:当下压时,因为C=εr S4πkd,d减小,C增大,在U不变时,因为C=QU,Q增大,从b向a有电流流过,②正确;当F变化时,电容器两板的间距变化,电容变化,电容器上的带电量发生变化,电路中有电流,④正确,故选A.答案:A6.如图所示,R1为定值电阻,R2为负温度系数的热敏电阻,当温度降低时,电阻变大,L为小灯泡,当温度降低时()。
人教版高中政治选修三测试题及答案全套

人教版高中政治选修三单元测试题及答案全套阶段质量检测(一)各具特色的国家和国际组织(时间:45分钟,满分:100分)一、单项选择题(每小题5分,共60分。
在每小题给出的四个选项中,只有一项是最符合题目要求的)1.“国家是人民通过社会契约而结成的,国家维护一切缔约者的自由、平等、生命、财产,国家对任何人都是平等的。
”这一观点()A.指出了国家是一定历史阶段的产物B.否认了国家的阶级性质C.反映了国家的社会管理职能D.体现了资本主义自由、平等、博爱的原则2014年3月13日,十二届全国人大二次会议在北京闭幕。
据此回答2~3题。
2.本次会议审议通过了“一府两院”的工作报告,表决通过了关于2013年国民经济和社会发展计划执行情况与2014年国民经济和社会发展计划的决议等。
这体现了()A.人民代表大会是我国的最高国家权力机关B.我国人民代表大会制度实行民主集中制C.社会主义民主具有广泛性D.民主与专政是辩证统一的关系3.我国的人民代表大会制度与西方的议会制共和制、总统制共和制同属于民主共和制,但两者有不同之处,这种不同从本质上说在于()A.所体现的阶级属性不同B.所体现的国家结构不同C.所体现的权力授受关系不同D.所体现的国家政权运行方式不同2014年3月12日,正在以色列访问的英国首相卡梅伦发表演讲,呼吁巴以双方实现历史性和解。
他当天在以色列议会演讲时说,他完全支持美国国务卿克里对巴以和平进程起草的框架协议及两国方案。
据此回答4~6题。
4.英、美两国均是世界上的老牌资本主义国家,在国际事务中一直配合默契。
下列表述属于其共同点的是()①从国家本质上看,两国都是资产阶级统治的国家②从政体上看,两国都实行代议制③从国家结构形式上看,两国都实行联邦制④从国家元首的产生方式看,两国元首都由选举产生A.①②B.①②③C.①②④D.①③④5.美、英两国都是发达资本主义国家,但其政权组织形式却迥然不同,这是因为()A.政体是独立于国体之外的B.国体决定政体C.政体受历史条件、传统习惯、国际环境等因素的影响D.政体是指国家政权组织形式6.作为民主共和制的美国和君主立宪制的英国,两国政体的主要区别是()①国家元首是否通过选举产生并有一定的任期②是否都代表资产阶级利益③国家元首是否有实权④国家元首的权力是否受宪法的限制A.①②B.①③C.②③D.②④欧盟是世界一体化程度最高的区域性国际组织,在国际社会中发挥着重要作用。
(必考题)高中数学选修三第一单元《计数原理》测试题(包含答案解析)(4)

一、选择题1.261(12)()x x x+-的展开式中,含2x 的项的系数是( ) A .40-B .25-C .25D .552.在二项式(1)n x +的展开式中,存在系数之比为2:3的相邻两项,则指数*()n n N ∈的最小值为( ) A .6B .5C .4D .33.已知8281239(1)x a a x a x a x +=++++,若数列()*123,,,,19,k a a a a k k N ⋅⋅⋅≤≤∈是一个单调递增数列,则k 的最大值是( ) A .6B .5C .4D .34.在二项式()12nx -的展开式中,所有项的二项式系数之和为256,则展开式的中间项的系数为( ) A .960-B .960C .1120D .16805.将甲、乙、丙、丁四人分配到A 、B 、C 三所学校任教,每所学校至少安排1人,则甲不去A 学校的不同分配方法有( ) A .18种B .24种C .32种D .36种6.汉代数学家赵爽在注解《周髀算经》时给出的“赵爽弦图”是我国古代数学的瑰宝.如图所示的弦图中,由四个全等的直角三角形和一个正方形构成.现有五种不同的颜色可供涂色,要求相邻的区域不能用同一种颜色,则不同的涂色方案有( )A .180B .192C .420D .4807.若0k m n ≤≤≤,且,,m n k N ∈,则0mn m k n k n k CC --==∑( )A .2m n+B .2mn m CC .2n mn C D .2m mn C8.()52112x x ⎛⎫-- ⎪⎝⎭展开式的常数项为() A .112B .48C .-112D .-489.如图,用6种不同的颜色把图中A,B,C,D 四块区域涂色分开,若相邻区域不能涂同一种颜色,则不同涂法的种数为( )A .400B .460C .480D .49610.()61211x x ⎛⎫+- ⎪⎝⎭的展开式中的常数项是( ) A .-5B .7C .-11D .1311.某电视台的一个综艺栏目对六个不同的节目排演出顺序,最前只能排甲或乙,最后不能排甲,则不同的排法共有( ) A .240种B .288种C .192种D .216种12.在622x x ⎛⎫- ⎪⎝⎭的展开式中,常数项为( ) A .15-B .15C .60-D .60二、填空题13.512a x x x x ⎛⎫⎛⎫+- ⎪⎪⎝⎭⎝⎭的展开式中各项系数之和为2,则该展开式中4x 的系数为___________.14.若投掷一枚质地均匀的骰子,第一次投掷的点数为a ,第二次投掷的点数为b ,则b a >的概率为______.15.计算:01220181232019C C C C ++++=______.16.若28C x=3828C x -,则x 的值为_______. 17.二项式61(2x )x-的展开式中常数项为______(用数字表示). 18.现有红、黄、蓝三种颜色,对如图所示的正五角星的内部涂色(分割成六个不同部分),要求每个区域涂一种颜色且相邻部分(有公共边的两个区域)的颜色不同,则不同的涂色方案有________种.(用数字作答).19.已知()1121011012101112x a a x a x a x a x +=+++++ ,则12101121011a a a a -+-+=_____.20.若102100121013x a a x a x a x -+++⋯+=(),则12310a a a a +++⋯+=_____.三、解答题21.已知(x 2x)n 的展开式中的第二项和第三项的系数相等.(1)求n 的值;(2)求展开式中所有的有理项.22.在13nx ⎫⎪⎭(*n N ∈)的展开式中所有二项式系数之和为256.(1)求展开式中的常数项;(2)求展开式中二项式系数最大的项.23.从1到7的7个数字中取两个偶数和三个奇数组成没有重复数字的五位数.试问: (1)五位数中,两个偶数排在一起的有几个?(2)两个偶数不相邻且三个奇数也不相邻的五位数有几个?(所有结果均用数值表示)24.已知()2*12nx n N x ⎛⎫-∈ ⎪⎝⎭的展开式中所有偶数项的二项式系数和为64. (1)求展开式中二项式系数最大的项;(2)求221122nx x x x ⎛⎫⎛⎫+- ⎪⎪⎝⎭⎝⎭展开式中的常数项. 25.请从下面三个条件中任选一个,补充在下面的横线上,并解答.①第5项的系数与第3项的系数之比是14:3;②第2项与倒数第3项的二项式系数之和为55;③22110n n nC C -+-=.已知在n的展开式中,________. (1)求展开式中二项式系数最大的项; (2)求展开式中含5x 的项.26.已知二项式)22nx -.(1)若展开式中第二项系数与第四项系数之比为1:8,求二项展开式的系数之和. (2)若展开式中只有第6项的二项式系数最大,求展开式中的常数项.参考答案【参考答案】***试卷处理标记,请不要删除一、选择题 1.B 解析:B 【分析】写出二项式61()x x-的展开式中的通项,然后观察含2x 项有两种构成,一种是()212x+中的1与61()x x-中的二次项相乘得到,一种是()212x+中的22x与61()x x-中的常数项相乘得到,将系数相加即可得出结果. 【详解】二项式61()x x-的展开式中的通项662166()1C (1)C k kk k k k k T x x x--+=-=-,含2x 的项的系数为223366(1)2(1)25C C -+⨯-=- 故选B. 【点睛】本题主要考查二项式定理的应用,二项展开式的通项公式,二项式系数的性质,属于基础题.2.C解析:C 【分析】利用二项式定理的展开式写出满足题意的表达式,然后即可求出指数*()n n N ∈的最小值.【详解】解:由题意知:123k n k n C C -=或者132k n k n C C -=.即123n k k -+= 或132n k k -+= 解得,533k n -= 或522k n -=.当533k n -=时,当3k =时,min 4n =; 当522k n -=时,当2k =时,min 4n =.综上所述: min 4n =. 故选:C. 【点睛】本题考查了二项式定理的应用.本题的易错点是未进行分类讨论.3.B解析:B 【分析】可得结论.写出各项的系数,由组合数性质知123456789a a a a a a a a a <<<<>>>>,结合数列123,,,,k a a a a ⋅⋅⋅是一个单调递增数列,可得结论. 【详解】由二项式定理,得98ii a C -=()*19,i i N≤≤∈,所以根据组合数性质知123456789a a a a a a a a a <<<<>>>>, 又数列()*123,,,,19,k a a a a k k N ⋅⋅⋅≤≤∈是一个单调递增数列,所以k 的最大值为5. 故选:B【点睛】本题主要考查二项式定理的运用,考查学生分析解决问题的能力,属于基础题.4.C解析:C 【分析】先根据条件求出8n =,再由二项式定理及展开式通项公式,即可得答案. 【详解】由已知可得:2256n =,所以8n =,则展开式的中间项为44458(2)1120T C x x =-=,即展开式的中间项的系数为1120. 故选:C . 【点睛】本题考查由二项式定理及展开式通项公式,考查函数与方程思想、转化与化归思想,考查逻辑推理能力、运算求解能力.5.B解析:B 【分析】根据题意,分两种情况讨论:①其他三人中有一个人与甲在同一个学校,②没有人与甲在同一个学校,由加法原理计算可得答案. 【详解】解:根据题意,分两种情况讨论,①其他三人中有一个人与甲在同一个学校,有11232212C A A =种情况, ②没有人与甲在同一个学校,则有12223212C C A =种情况;则若甲要求不到A 学校,则不同的分配方案有121224+=种; 故选:B . 【点睛】本题考查排列、组合的应用,涉及分类加法原理的应用,属于中等题.6.C解析:C 【分析】就使用颜色的种类分类计数可得不同的涂色方案的总数. 【详解】相邻的区域不能用同一种颜色,则涂5块区域至少需要3种颜色.若5块区域只用3种颜色涂色,则颜色的选法有35C ,相对的两个直角三角形必同色,此时共有不同的涂色方案数为335360C A =(种).若5块区域只用4种颜色涂色,则颜色的选法有45C ,相对的两个直角三角形必同色,余下两个直角三角形不同色,此时共有不同的涂色方案数为414524240C C A =(种).若5块区域只用5种颜色涂色,则每块区域涂色均不同,此时共有不同的涂色方案数为55120A =(种).综上,共有不同的涂色方案数为420(种). 故选:C. 【点睛】本题考查排列组合的应用,注意根据题设要求合理分类分步,此类问题属于中档题.7.D解析:D 【分析】先利用特殊值排除A,B,C ,再根据组合数公式以及二项式定理论证D 成立. 【详解】 令0m =得,CC C C 1mn mk n n k n n n k --===∑,在选择项中,令0m =排除A ,C ;在选择项中,令1m =,101110C C C C C C 2mn m k n n n k n n n n n k n -----==+=∑排除B ,()!!()!()!!()!mmn m k n knk k n k n CC n m m k k n k --==-=⋅---∑∑000!!2()!!!()!mm mm k m k m mn m n m n k k k n m C C C C C n m m k m k ====⋅=⋅==--∑∑∑,故选D【点睛】本题考查组合数公式以及二项式定理应用,考查基本分析化简能力,属中档题.8.D解析:D 【分析】把51(2)x -按照二项式定理展开,可得()52112x x ⎛⎫-- ⎪⎝⎭的展开式的常数项.【详解】 由于()()52205142332455555111111121()2()4()8()1632x x C C C C C x x x x x x ⎛⎫⎛⎫---⋅-⋅+⋅-⋅+⋅- ⎪⎭= ⎪⎝⎝⎭故展开式的常数项为3583248C -+=-,故选D .【点睛】本题考查二项式定理的应用,考查了二项式展开式,属于基础题.9.C解析:C 【解析】分析:本题是一个分类计数问题,只用三种颜色涂色时,有31116321C C C C 种方法,用四种颜色涂色时,有41126322C C C A 种方法,根据分类计数原理得到结果.详解:只用三种颜色涂色时,有31116321120C C C C =种方法, 用四种颜色涂色时,有41126432360C C C A =种方法,根据分类计数原理得不同涂法的种数为120+360=480. 故答案为C.点睛:(1)本题主要考查计数原理,考查排列组合的综合应用,意在考查学生对这些知识的掌握水平和分析推理能力.(2)排列组合常用的方法有一般问题直接法、相邻问题捆绑法、不相邻问题插空法、特殊对象优先法、等概率问题缩倍法、至少问题间接法、复杂问题分类法、小数问题列举法.10.C解析:C 【解析】611x ⎛⎫- ⎪⎝⎭的展开式的通项公式是61,rr C x ⎛⎫- ⎪⎝⎭ 其中含1x 的项是1161,C x ⎛⎫- ⎪⎝⎭ 常数项为0611,C x ⎛⎫-= ⎪⎝⎭ 故()61211x x ⎛⎫+- ⎪⎝⎭的展开式中的常数项是116121112111.x C x ⎡⎤⎛⎫⨯-+⨯=-+=-⎢⎥ ⎪⎝⎭⎢⎥⎣⎦故选C.11.D解析:D 【详解】最前排甲,共有55A 120=种;最前排乙,最后不能排甲,有种,根据加法原理可得,共有种,故选D .考点:排列及计数原理的应用.12.D解析:D 【分析】根据二项展开式的通项公式计算即可求解. 【详解】631216C (1)2rr r r r T x --+=-,令3120r -=,即4r =, ∴常数项为60, 故选:D 【点睛】本题主要考查了二项式定理,二项展开式的通项公式,属于中档题.二、填空题13.-48【分析】令x=1解得a=1再利用的通项公式进而得出【详解】令x=1=2解得a=1又的通项公式令5−2r=35−2r=5解得r=1r=0∴该展开式中的系数为=−80+32=−48故答案为:−48解析:-48 【分析】令x =1,解得a =1,再利用512x x ⎛⎫- ⎪⎝⎭的通项公式,进而得出. 【详解】令x =1,()()5112a +-=2,解得a =1.又512x x ⎛⎫- ⎪⎝⎭的通项公式()5521512r r rr r T C x --+=-⋅,令5−2r =3,5−2r =5. 解得r =1,r =0.∴该展开式中4x 的系数为()()141505512+12C C --=−80+32=−48, 故答案为:−48. 【点睛】本题考查二项式定理的应用,根据通项公式求系数,属于中等题.14.【分析】将两次点数表示成有序数对分别求出基本事件总数和包含的基本事件个数即可求解概率【详解】将两次点数表示成有序数对根据基本计数原理得:基本事件总数为包含的基本事件个数为所以的概率故答案为:【点睛】 解析:512【分析】将两次点数表示成有序数对(),a b ,分别求出基本事件总数和b a >包含的基本事件个数即可求解概率. 【详解】将两次点数表示成有序数对(),a b ,根据基本计数原理得: 基本事件总数为6636⨯=,b a >包含的基本事件个数为5432115++++=,所以b a >的概率1553612P ==. 故答案为:512【点睛】此题考查古典概型,关键在于准确求出基本事件总数和某一事件包含的基本事件个数.15.【分析】将变为然后利用组合数性质即可计算出所求代数式的值【详解】故答案为:【点睛】本题考查组合数的计算利用组合数的性质进行计算是解题的关键考查计算能力属于中等题 解析:2039190【分析】将01C 变为02C ,然后利用组合数性质111k k k n n n C C C ++++=即可计算出所求代数式的值.【详解】()111,,1k k k n n n C C C n N k N k n ++*++=∈∈≤+, 012201801220181220182018123201922320193320192020C C C C C C C C C C C C ∴++++=++++=+++=2039190=.故答案为:2039190. 【点睛】本题考查组合数的计算,利用组合数的性质进行计算是解题的关键,考查计算能力,属于中等题.16.4或9【解析】分析:先根据组合数性质得解方程得结果详解:因为=所以因此点睛:组合数性质:解析:4或9. 【解析】分析:先根据组合数性质得383828x x x x 或=-+-=,解方程得结果 详解:因为28C x=3828C x -,所以383828x x x x 或=-+-= 因此49.x x ==或点睛:组合数性质:11111,,.m n m m m m k k n n n n n n n C C C C C kC nC -++-+-=+==17.-160【解析】二项式的展开式的通项为令可得即展开式中常数项为答案:解析:-160 【解析】二项式612x x ⎛⎫- ⎪⎝⎭的展开式的通项为66621661(2)()(1)2r r r r r r rr T C x C x x ---+=-=-⋅⋅⋅,0,1,2,,6r =.令3r =,可得33346(1)2160T C =-⋅⋅=-,即展开式中常数项为160-. 答案:160-18.【分析】根据题意假设正五角星的区域依此为分析6个区域的涂色方案数再根据分步计数原理计算即可【详解】根据题意假设正五角星的区域依此为如图所示:要将每个区域都涂色才做完这件事由分步计数原理先对区域涂色有解析:96【分析】根据题意,假设正五角星的区域依此为A 、B 、C 、D 、E 、F ,分析6个区域的涂色方案数,再根据分步计数原理计算即可. 【详解】根据题意,假设正五角星的区域依此为A 、B 、C 、D 、E 、F ,如图所示:要将每个区域都涂色才做完这件事,由分步计数原理,先对A 区域涂色有3种方法,B 、C 、D 、E 、F 这5个区域都与A 相邻,每个区域都有2种涂色方法,所以共有32222296⨯⨯⨯⨯⨯=种涂色方案. 故答案为:96 【点睛】方法点睛:涂色问题常用方法:(1)根据分步计数原理,对各个区域分步涂色,这是处理区域染色问题的基本方法; (2)根据共用了多少种颜色讨论,分别计算出各种情形的种数,再用分类计数原理求出不同的涂色方法种数;(3)根据某两个不相邻区域是否同色分类讨论.从某两个不相邻区域同色与不同色入手,分别计算出两种情形的种数,再用分类计数原理求出不同涂色方法总数.19.【分析】对原方程两边求导然后令求得表达式的值【详解】对等式两边求导得令则【点睛】本小题主要考查二项式展开式考查利用导数转化已知条件考查赋值法属于中档题 解析:22【分析】对原方程两边求导,然后令1x =-求得表达式的值. 【详解】对等式112012(12)x a a x a x +=++10111011a x a x +++两边求导,得101222(12)2x a a x +=+91010111011a x a x +++,令1x =-,则1210112101122a a a a -+-+=.【点睛】本小题主要考查二项式展开式,考查利用导数转化已知条件,考查赋值法,属于中档题.20.1023【分析】赋值法令得:;令得:再两式相减可得【详解】解:∵令得:;①令得:;②由①②可得:;故答案为:【点睛】赋值法在求各项系数和中的应用(1)形如()的式子求其展开式的各项系数之和常用赋值法解析:1023 【分析】赋值法 令0x =得:01a =;令1x = 得:10012310131024a a a a a =++⋯+-=++(),再两式相减可得.【详解】解:∵102100121013x a a x a x a x -+++⋯+=(),令0x =得:01a = ;①令1x = 得:10012310131024a a a a a =++⋯+-=++(); ②由①②可得:12310102411023a a a a +++⋯+-==; 故答案为:1023. 【点睛】赋值法在求各项系数和中的应用(1)形如()n ax b +,2()m ax bx c ++ (a b c R ∈,,)的式子求其展开式的各项系数之和,常用赋值法,只需令1x =即可.(2)对形如()()n ax by a b R +∈,的式子求其展开式各项系数之和,只需令1x y ==即可. (3)若()2012nn f x a a x a x a x +++⋯+=,则()f x 展开式中各项系数之和为()1f .三、解答题21.(1)5n =;(2)51T x =,2352T x =,5516T x=. 【分析】(1)写出二项式(n x +展开式的通项公式,得到第二项和第三项的系数,所以得到关于n 的方程,解得答案;(2)由(1)得到n的值,写出二项式(n x 展开式的通项公式,整理后,得到其x 的指数为整数的r 的值,再写出其展开式中的有理项. 【详解】解:二项式(n x +展开式的通项公式为32112rrn rr n r r r n n T C x C x--+⎛⎫=⋅⋅=⋅⋅ ⎪⎝⎭,()0,1,2r n =⋅⋅⋅; (1)根据展开式中的第二项和第三项的系数相等,得2121122nn C C ⎛⎫⋅=⋅ ⎪⎝⎭,即()111242n n n -=⋅, 解得5n =;(2)二项式展开式的通项公式为3521512rrr r T C x -+⎛⎫=⋅⋅ ⎪⎝⎭,()0,1,2r n =⋅⋅⋅;当0,2,4r =时,对应项是有理项, 所以展开式中所有的有理项为0551512T C x x ⎛⎫=⋅⋅= ⎪⎝⎭, 22532351522T C x x -⎛⎫=⋅⋅= ⎪⎝⎭,44565515216T C x x -⎛⎫=⋅= ⎪⎝⎭. 【点睛】本题考查二项展开式的项的系数,求二项展开式中的有理项,属于中档题.22.(1)289;(2)837081x -【分析】(1)由题意利用二项式系数的性质,求得n 的值,再利用二项式展开式的通项公式,求得展开式中的常数项.(2)由题意利用二项式系数的性质,二项式展开式的通项公式,求得二项式系数最大的项. 【详解】解:(1)*31()3nx n N x ⎛⎫+∈ ⎪⎝⎭的展开式中所有二项式系数之和为2256n =,8n ∴=,故展开式的通项公式为8431813rr r r T C x-+⎛⎫= ⎪⎝⎭.令8403r-=,求得2r ,故展开式中的常数项为2812899C =. (2)由于8n =,故当4r =时,二项式系数最大,故二项式系数最大的项为48843358170381T C x x --⎛⎫==⎪⎝⎭. 【点睛】本题主要考查二项式定理的应用,二项式系数的性质,二项式展开式的通项公式,属于中档题.23.(1)576;(2)144 【分析】(1)先从3个偶数抽取2个偶数和从4个奇数中抽取3个奇数,利用捆绑法把两个偶数捆绑在一起,再和另外三个奇数进行全排列;(2)利用插空法,先排两个偶数,再从两个偶数形成的3个间隔中,插入三个奇数,即可得出结果. 【详解】解:可知从1到7的7个数字中,有3个偶数,4个奇数, (1)五位数中,偶数排在一起的有:23413442576C C A A =个,(2)两个偶数不相邻且三个奇数也不相邻的五位数有:23233423144C C A A =个. 【点睛】本题考查数字的排列问题,涉及排列和组合的实际应用以及排列数和组合数的运算公式,考查利用捆绑法解决相邻问题,利用插空法解决不相邻问题,考查运算能力. 24.(1)54500T x =-,25280T x =(2)112 【分析】(1)由偶数项二项式系数可得7n =,可知展开式中间两项二项式系数最大,利用展开式通项公式求解;(2)由(1)利用展开式通项公式求含1x -和2x 项,结合与212x x ⎛⎫+ ⎪⎝⎭相乘即可求解. 【详解】(1)由展开式中所有的偶数项二项式系数和为64,得1264n -=, 所以7n =所以展开式中二项式系数最大的项为第四项和第五项.因为7212x x ⎛⎫- ⎪⎝⎭的展开式的通项公式为()()()72714317712121rrrr r r rr r T C xC x x ---+⎛⎫=-=- ⎪⎝⎭, 所以()f x 的展开式中二项式系数最大的项为54500T x =-,25280T x =(2)由(1)知7n =,且7212x x ⎛⎫- ⎪⎝⎭的展开式中1x -项为684T x =-, 2x 项为25280T x =,所以221122nx x x x ⎛⎫⎛⎫+- ⎪⎪⎝⎭⎝⎭展开式的常数项为()2841280112⨯-+⨯=, 【点睛】本题主要考查二项式定理的应用,二项式系数的性质,二项式展开式的通项公式,属于中档题. 25.(1)56252x -;(2)5x .【分析】(1)先求出二项展开式的通项,根据条件求出n ,即可知道二项式系数最大的项; (2)令x 的指数为5,即可计算出r ,求出含5x 的项. 【详解】可知3561(1)rn rr n r r r r n n T C C x --+⎛==- ⎝, 方案一:选条件①,(1)由题可知4422(1)14(1)3n n C C -=-, !2!(2)!144!(4)!!3n n n n -∴⨯=-,25500n n ∴--=,解得10n =或5n =-(舍去),所以展开式共有11项,其中二项式系数最大的项是第六项,555566610(1)252T C x x =-=-,所以展开式中二项式系数最大的项是第6项,566252T x =-;(2)由(1)知56110510,(1)r r r rn T C x-+==-,令5556r -=,0r ∴=,51T x ∴=, 所以展开式中含5x 的项是第一项,为5x ; 方案二:选条件②, (1)由题可知21212552n nnnnn nC CC C -++=+==,整理得21100n n +-=,解得10n =或11n =-(舍去), 所以展开式共有11项,其中二项式系数最大的项是第六项,555566610(1)252T C x x =-=-,所以展开式中二项式系数最大的项是第6项,566252T x =-;(2)同方案一(2); 方案三:选条件③, (1)222211110n n nn n n C C C C C -++-=-==,10n ∴=,所以展开式共有11项,其中二项式系数最大的项是第六项,555566610(1)252T C x x =-=-,所以展开式中二项式系数最大的项是第6项,566252T x =-;(2)同方案一(2). 【点睛】本题考查二项展开式的相关性质,属于中档题. 26.(1)-1 (2)180 【分析】(1)先求出n 的值,再求二项展开式的系数之和;(2)根据已知求出n 的值,再求出展开式中的常数项. 【详解】 (1)二项式)22nx--的展开式的通项为5221(2)(2)n r r n rr rr r nnTC x C x---+=-=-,所以第二项系数为1(2)n C -,第四项系数为33(2)n C -,所以13(2)188n n C C -=-,所以5n =.所以二项展开式的系数之和)52211-⨯=-.(2)因为展开式中只有第6项的二项式系数最大, 所以展开式有11项,所以10.n = 令1050,22rr -=∴=. 所以常数项为2210(2)180C -=.【点睛】本题主要考查二项式展开式的系数问题,考查指定项的求法,意在考查学生对这些知识的理解掌握水平.。
2023-2024学年高中化学鲁科版选修3第2章 化学键与分子间作用力单元测试(含答案解析)
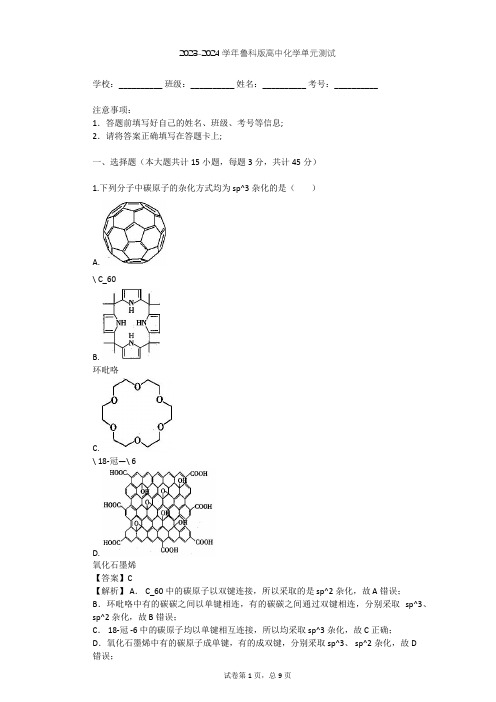
2023-2024学年鲁科版高中化学单元测试学校:__________ 班级:__________ 姓名:__________ 考号:__________注意事项:1.答题前填写好自己的姓名、班级、考号等信息;2.请将答案正确填写在答题卡上;一、选择题(本大题共计15小题,每题3分,共计45分)1.下列分子中碳原子的杂化方式均为 sp^3杂化的是()A.\ C_60B.环吡咯C.\ 18-冠—\ 6D.氧化石墨烯【答案】C【解析】 A. C_60中的碳原子以双键连接,所以采取的是 sp^2杂化,故 A错误;B.环吡咯中有的碳碳之间以单键相连,有的碳碳之间通过双键相连,分别采取sp^3、sp^2杂化,故 B错误;C. 18-冠 -6中的碳原子均以单键相互连接,所以均采取 sp^3杂化,故 C正确;D.氧化石墨烯中有的碳原子成单键,有的成双键,分别采取 sp^3、 sp^2杂化,故 D错误;故选: C。
2.已知 W、 X、 Y、 Z是四种原子序数依次增大的短周期元素。
甲、乙、丙分别是 W与X、 Y、 Z形成的 18电子二元化合物,且都存在极性键和非极性键。
下列说法正确的是()A. 最简单氢化物沸点:\ Xgt YB. 原子半径:\ Xgt Ygt Zgt WC. \ X的最高价氧化物对应水化物是一元强酸D. 常温下,甲、乙、丙都是液体且都具有对称结构【答案】B【解析】根据题干信息可知 W是氢,氢和碳、氮、氧都能形成既有极性键和非极性键的 18电子微粒,甲、乙、丙分别是 CH_3 CH_3、 N_2 H_4、 H_2 O_2,则 X是碳, Y是氮, Z是氧,据此回答:A.因为氨气分子间有氢键,简单氢化物沸点甲烷比氨气的低,故 A错误;B.同周期元素的原子,原子序数越大,半径越小,则原子半径 C \gt N \gt O \gt H,故B正确;C.碳酸是二元弱酸,故 C错误;D.常温下 CH_3 CH_3是气体,故 D错误;故选 B。
新人教版高中数学选修三第一单元《计数原理》测试(有答案解析)

一、选择题1.从5名志愿者中选出4人分别到A 、B 、C 、D 四个部门工作,其中甲、乙两名志愿者不能到A 、B 二个部门工作,其他三人能到四个部门工作,则选派方案共有( ) A .120种B .24种C .18种D .36种2.关于6212x x ⎛⎫- ⎪⎝⎭的展开式,下列说法中正确的是( ) A .展开式中二项式系数之和为32B .展开式中各项系数之和为1C .展开式中二项式系数最大的项为第3项D .展开式中系数最大的项为第4项3.712x x ⎛⎫- ⎪⎝⎭的展开式中5x 的系数为( ) A .448B .448-C .672D .672-4.回文联是我国对联中的一种.用回文形式写成的对联,既可顺读,也可倒读.不仅意思不变,而且颇具趣味.相传,清代北京城里有一家饭馆叫“天然居”,曾有一副有名的回文联:“客上天然居,居然天上客;人过大佛寺,寺佛大过人.”在数学中也有这样一类顺读与倒读都是同一个数的自然数,称之为“回文数”.如44,585,2662等;那么用数字1,2,3,4,5,6可以组成4位“回文数”的个数为( ) A .30B .36C .360D .12965.根据中央对“精准扶贫”的要求,某市决定从3名男性党员、2名女性党员中选派2名去甲村调研,则既有男性又有女性的不同选法共有( ) A .7种B .6种C .5种D .4种6.某煤气站对外输送煤气时,用1至5号五个阀门控制,且必须遵守以下操作规则: ①若开启3号,则必须同时开启4号并且关闭2号; ②若开启2号或4号,则关闭1号; ③禁止同时关闭5号和1号. 则阀门的不同开闭方式种数为( ) A .7B .8C .11D .147.若m 是小于10的正整数,则()()()151620m m m ---等于( )A .515m P -B .1520mm P --C .520m P - D .620m P -8.已知*n N ∈,设215nx x ⎛⎫- ⎪⎝⎭的展开式的各项系数之和为M ,二项式系数之和为N ,若992M N -=,则展开式中x 的系数为( )A .-250B .250C .-500D .5009.若0,0a b >>,二项式6()ax b +的展开式中3x 项的系数为20,则定积分22abxdx xdx +⎰⎰的最小值为( )A .0B .1C .2D .310.从5种主料中选2种,8种辅料中选3种来烹饪一道菜,烹饪方式有5种,那么最多可以烹饪出不同的菜的种数为 A .18B .200C .2800D .3360011.如图,用6种不同的颜色把图中A,B,C,D 四块区域涂色分开,若相邻区域不能涂同一种颜色,则不同涂法的种数为( )A .400B .460C .480D .49612.将编号为1,2,3,4,5,6,7的小球放入编号为1,2,3,4,5,6,7的七个盒子中,每盒放一球,若有且只有三个盒子的编号与放入的小球的编号相同,则不同的放法种数为( ) A .315B .640C .840D .5040二、填空题13.()3621()x x x-+的展开式中的常数项为_____.(用数字作答)14.有2个不同的红球和3个不同的黄球,将这5个球放入4个不同的盒子中,要求每个盒子至少放一个球,且同色球不能放在同一个盒子中,则不同的放置方法有________种.(用数字作答)15.已知33210n n A A =,那么n =__________.16.若251(3)(2)x a x x--的展开式中3x 的系数为80,则a =_______.17.把4件不同的产品摆成一排.若其中的产品A 与产品B 都摆在产品C 的左侧,则不同的摆法有____种.(用数字作答)18.25(32)x x ++的展开式中3x 的项的系数是________.19.如图所示,在杨辉三角中,斜线AB 上方箭头所示的数组成一个锯齿形的数列:1,2,3,3,6,4,10,…,记这个数列的前n 项和为S (n ),则S (16)的值为_____.20.()()611ax x -+的展开式中,3x 项的系数为10-,则实数a =___________.三、解答题21.已知nx x ⎛+ ⎝的展开式中只有第五项的二项式系数最大.(1)求该展开式中有理项的项数; (2)求该展开式中系数最大的项. 22.设()22201221nn n x x a a x a x a x ++=+++⋅⋅⋅.(1)求0a 的值;(2)求1232n a a a a +++⋯+的值; (3)求13521n a a a a -+++⋯+的值.23.从1到7的7个数字中取两个偶数和三个奇数组成没有重复数字的五位数.试问: (1)五位数中,两个偶数排在一起的有几个?(2)两个偶数不相邻且三个奇数也不相邻的五位数有几个?(所有结果均用数值表示) 24.已知i ,m ,n 是正整数,且1i m n <≤<. (1)证明:i i i im n n A m A <;(2)证明:(1)(1)m nn m +<+.25.已知n的二项展开式的各二项式系数的和与各项系数的和均为256. (1)求展开式中有理项的个数; (2)求展开式中系数最大的项.26.为弘扬我国古代的“六艺”文化,某夏令营主办单位计划利用暑期开设“礼”、“乐”、“射”、“御”、“书”、“数”六门体验课程.(1)若体验课连续开设六周,每周一门,求其中“射”不排在第一周,“数”不排在最后一周的所有可能排法种数;(2)甲、乙、丙、丁、戊五名教师在教这六门课程,每名教师至少任教一门课程,求其中甲不任教“数”的课程安排方案种数.【参考答案】***试卷处理标记,请不要删除一、选择题 1.D 解析:D 【分析】根据题意,分两种情况讨论:①、甲、乙中只有1人被选中,②、甲、乙两人都被选中,根据分类计数原理可得 【详解】解:根据题意,分两种情况讨论:①、甲、乙中只有1人被选中,需要从甲、乙中选出1人,到C ,D 中的一个部门,其他三人到剩余的部门,有113223··24C C A =种选派方案. ②、甲、乙两人都被选中,安排到C ,D 部门,从其他三人中选出2人,到剩余的部门,有2223·12A A =种选派方案, 综上可得,共有24+12=36中不同的选派方案, 故选D . 【点睛】本题考查排列、组合的应用,涉及分类加法原理的应用,属于中档题.2.B解析:B 【分析】直接利用二项式展开式的应用求出结果. 【详解】 解:关于621(2)x x-的展开式,根据二项式的展开式的应用:61621(2)()r rr r T C x x -+=-, 对于选项A :展开式中二项式系数之和6264=,故错误.对于选项B :利用赋值法的应用,当1x =时,各项的系数的和为6(21)1-=,故正确.对于选项C :展开式中二项式系数最大的项为第4项3620C =,故错误. 对于选项D :展开式中系数最大的项为第2项,系数为2462240C ⨯=.故错误.故选:B . 【点睛】本题考查的知识要点:二项展开式的应用,主要考查学生的运算能力和转换能力及思维能力,属于中档题.3.B解析:B 【分析】求出展开式的通项公式,利用x 的次数为5进行求解即可. 【详解】展开式的通项公式77727171(2)(1)2rr rr r r r rx T C x C x ---+⎛⎫=-=- ⎪⎝⎭, 由725r -=得1r =,所以展开式中5x 的系数为1717(1)2764448C --⋅=-⨯=-,故选:B . 【点睛】该题考查的是有关二项式定理的问题,涉及到的知识点有求二项展开式指定项的系数,属于简单题目.4.B解析:B【分析】依据回文数对称的特征,可知有两种情况:1、在6个数字中任取1个组成16C 个回文数;2、在6个数字中任取2个26C 种取法,又由两个数可互换位置22A 种,即2262C A 个回文数;结合两种情况即可求出组成4位“回文数”的个数 【详解】由题意知:组成4位“回文数”∴当由一个数组成回文数,在6个数字中任取1个:16C 种 当有两组相同的数,在6个数字中任取2个:26C 种又∵在6个数字中任取2个时,前两位互换位置又可以组成另一个数 ∴2个数组成回文数的个数:22A 种故,在6个数字中任取2个组成回文数的个数:2262C A综上,有数字1,2,3,4,5,6可以组成4位“回文数”的个数为:2262C A +16C =36 故选:B 【点睛】本题考查了排列组合,根据回文数的特征—对称性,先由分类计数得到取数的方法数,再由分步计数得到各类取数中组成回文数的个数,最后加总即为所有组成4位“回文数”的个数5.B解析:B 【分析】根据题意可得选出的2人必为一男—女,分别求出选出1名男性党员和1名女性党员的选法数目,由分步乘法计数原理计算可得答案. 【详解】根据题意,选出的2人中既有男性又有女性,必为一男一女,在3名男性党员中任选1人,有3种选法,在2名女性党员中任选1人,有2种选法,则既有男性又有女性的不同选法有3×2=6种, 故选:B 【点睛】本题主要考查排列组合的应用,涉及分步乘法计数原理的应用,属于基础题.6.A解析:A 【分析】分两类解决,第一类:若开启3号,然后对2号和4号开启其中一个即可判断出1号和5号情况,第二类:若关闭3号,关闭2号关闭4号,对1号进行讨论,即可判断5号,由此可计算出结果. 【详解】解:依题意,第一类:若开启3号,则开启4号并且关闭2号,此时关闭1号,开启5号, 此时有1种方法; 第二类:若关闭3号,①开启2号关闭4号或关闭2号开启4号或开启2号开启4号时,则关闭1号,开启5号,此时有种3方法;②关闭2号关闭4号,则开启1号关闭5号或开启1号开启5号或关闭1号,开启5号, 此时有种3方法;综上所述,共有1337++=种方式. 故选:A. 【点睛】本题考查分类加法计数原理,属于中档题.7.D解析:D 【分析】利用排列数的定义可得出正确选项. 【详解】()()()()()()()()()()1231415162020!1516201231414!m m m m m m m m m m ⋅⋅--------==⋅⋅--()()20!206!m m -=--⎡⎤⎣⎦,由排列数的定义可得()()()620151620m m m m P ----=. 故选D. 【点睛】本题考查排列数的表示,解题的关键就是依据排列数的定义将代数式表示为阶乘的形式,考查分析问题和解决问题的能力,属于中等题.8.A解析:A 【分析】分别计算各项系数之和为M ,二项式系数之和为N ,代入等式得到n ,再计算x 的系数. 【详解】215nx x ⎛⎫- ⎪⎝⎭的展开式取1x =得到4n M = 二项式系数之和为2n N = 429925n n M N n -=-=⇒=5251031551(5)()5(1)r r r r r r r r T C x C x x---+=-=- 取3r = 值为-250故答案选A【点睛】本题考查了二项式定理,计算出n 的值是解题的关键.9.C解析:C 【分析】由二项式定理展开项可得1ab =,再22022abxdx xdx a b +=+⎰⎰利用基本不等式可得结果.【详解】二项式()6ax+b 的展开式的通项为6616r r r rr T C a b x --+= 当63,3r r -==时,二次项系数为3336201C a b ab =∴=而定积分2202222abxdx xdx a b ab +=+≥=⎰⎰当且仅当a b =时取等号 故选C 【点睛】本题考查了二项式定理,定积分和基本不等式综合,熟悉每一个知识点是解题的关键,属于中档题.10.C解析:C 【分析】根据组合定义以及分布计数原理列式求解. 【详解】从5种主料中选2种,有2510C =种方法, 从8种辅料中选3种,有3856C =种方法,根据分布计数原理得烹饪出不同的菜的种数为10565=2800⨯⨯,选C. 【点睛】求解排列、组合问题常用的解题方法:分布计数原理与分类计数原理,具体问题可使用对应方法:如 (1)元素相邻的排列问题——“捆邦法”;(2)元素相间的排列问题——“插空法”;(3)元素有顺序限制的排列问题——“除序法”;(4)带有“含”与“不含”“至多”“至少”的排列组合问题——间接法.11.C解析:C 【解析】分析:本题是一个分类计数问题,只用三种颜色涂色时,有31116321C C C C 种方法,用四种颜色涂色时,有41126322C C C A 种方法,根据分类计数原理得到结果.详解:只用三种颜色涂色时,有31116321120C C C C =种方法, 用四种颜色涂色时,有41126432360C C C A =种方法,根据分类计数原理得不同涂法的种数为120+360=480. 故答案为C.点睛:(1)本题主要考查计数原理,考查排列组合的综合应用,意在考查学生对这些知识的掌握水平和分析推理能力.(2)排列组合常用的方法有一般问题直接法、相邻问题捆绑法、不相邻问题插空法、特殊对象优先法、等概率问题缩倍法、至少问题间接法、复杂问题分类法、小数问题列举法.12.A解析:A 【分析】分两步进行,第一步先选三个盒子的编号与放入的小球的编号相同,第二步再将剩下的4个小球放入与小球编号不同的盒子中,然后利用分布计数原理求解. 【详解】有三个盒子的编号与放入的小球的编号相同有3735C =种放法,剩下的4个小球放入与小球编号不同的盒子有11339C C ⋅=种放法,所以有且只有三个盒子的编号与放入的小球的编号相同,则不同的放法种数为359315⨯=种, 故选:A 【点睛】本题主要考查组合应用题以及分布计数原理,属于中档题.二、填空题13.180【分析】根据二项式定理结合展开式通项即可确定的指数形式将多项式展开即可确定常数项【详解】的展开式中的通项公式而分别令解得或∴的展开式中的常数项故答案为:180【点睛】本题考查了二项式定理通项展解析:180 【分析】根据二项式定理,结合展开式通项即可确定x 的指数形式.将多项式展开,即可确定常数项. 【详解】62x ⎫⎪⎭的展开式中的通项公式 363216622kkkk k k k T C C x x --+⎛⎫==⋅⋅ ⎪⎝⎭,而()666332221)x x x x x =-⎫⎫⎫-⎪⎪⎪⎭⎭⎭ 分别令3332k -=-,3302k -=, 解得4k =,或2k =.∴()6321x x ⎫-⎪⎭的展开式中的常数项44226622180C C -=.故答案为:180. 【点睛】本题考查了二项式定理通项展开式的应用,多项式的乘法展开式,常数项的求法,属于中档题.14.【分析】由题意可得一个盒子里有2个球一定为1红1黄其余盒子每个盒子放一个根据分步计数原理可得【详解】解:这5个球放入4个不同的盒子中要求每个盒子至少放一个球且同色球不能放在同一个盒子中则一个盒子里有 解析:144【分析】由题意可得一个盒子里有2个球,一定为1红1黄,其余盒子每个盒子放一个,根据分步计数原理可得. 【详解】解:这5个球放入4个不同的盒子中,要求每个盒子至少放一个球, 且同色球不能放在同一个盒子中,则一个盒子里有2个球,一定为1红1黄,其余盒子每个盒子放一个,故有11134233144C C C A =种,故答案为:144. 【点睛】本题考查了分步计数原理,运用组合数的运算,理解题目意思是关键..15.8【详解】分析:利用排列数公式展开解方程即可详解:解得即答案为8点睛:本题考查排列数公式的应用属基础题解析:8 【详解】分析:利用排列数公式展开,解方程即可. 详解:33210n n A A = ,()()()()221221012,n n n n n n ∴--=--()()22152,n n -=-解得8n =. 即答案为8.点睛:本题考查排列数公式的应用,属基础题.16.【解析】分析:中的系数与的积加上中的系数与的系数的积就是展开式的系数详解:展开式通项为令则令则∴解得故答案为-2点睛:二项式的展开式的通项为由此通项公式可求展开式中的特定项如果是两个(或多个)式子相 解析:2-【解析】分析:31(2)x x -中3x 的系数与a -的积,加上31(2)x x-中x 的系数与23x 的系数的积就是展开式3x 的系数.详解:51(2)x x-展开式通项为55521551(2)()2r rr r r r r T C x C x x---+=-=, 令523-=r ,则1r =,令521r -=,则2r,∴41325523280a C C -⨯+⨯=,解得2a =-,故答案为-2.点睛:二项式()n a b +的展开式的通项为1C r n r rr n T a b -+=,由此通项公式可求展开式中的特定项.如果是两个(或多个)式子相乘,可在第个式子中取一项相乘,只要未知数的次数满足要求,这时要注意不能遗漏.17.8【解析】当在最右边位置时由种排法符合条件;当在从右数第二个位置时由种排法符合条件把件不同的产品摆成一排若其中的产品与产品都摆在产品的左侧则不同的摆法有种故答案为解析:8 【解析】当C 在最右边位置时,由336A = 种排法符合条件;当C 在从右数第二个位置时,由222A =种排法符合条件,把4件不同的产品摆成一排.若其中的产品A 与产品B 都摆在产品C 的左侧,则不同的摆法有6+2=8种,故答案为8.18.1560【分析】把转化为再利用二项式的展开式的通项公式可求出答案【详解】由题意因为的展开式的通项公式为的展开式的通项公式为所以的展开式中的项的系数是故答案为:1560【点睛】关键点点睛:本题考查二项解析:1560 【分析】把25(32)x x ++转化为()()5512x x ++,再利用二项式的展开式的通项公式,可求出答案.【详解】由题意,()()2555(32)12x x x x =++++,因为()51x +的展开式的通项公式为15r rr T C x +=,()52x +的展开式的通项公式为5152k k k k T C x -+=,所以25(32)x x ++的展开式中3x 的项的系数是305214123032555555552222C C C C C C C C +++320800*********=+++=.故答案为:1560. 【点睛】关键点点睛:本题考查二项式定理的应用,考查三项展开式的系数问题.解决本题的关键是把25(32)x x ++转化为()()5512x x ++,进而分别求出()51x +、()52x +的展开式的通项公式,令3r k +=,可求出25(32)x x ++的展开式中3x 的项的系数.考查学生的逻辑推理能力,计算求解能力,属于中档题.19.164【分析】根据图形可知从第三行起每一行取第二和第三个数字再根据组合数的性质即可计算求出【详解】由图可知这十六个数的和为故答案为:164【点睛】本题主要考查组合数的性质的应用解题关键是凑出的形式反解析:164 【分析】根据图形可知,从第三行起每一行取第二和第三个数字,再根据组合数的性质,即可计算求出. 【详解】由图可知,这十六个数的和为2112121222334499C C C C C C C C ++++++++()()1112223493493C C C C C C =++++++++()()21113222334933491C C C C C C C C =+++++++++-2310101451201164C C =+-=+-=.故答案为:164. 【点睛】本题主要考查组合数的性质的应用,解题关键是凑出1m m n n C C -+的形式,反复利用组合数性质求和,属于基础题.20.【分析】由分别写出和的展开式通项分别令的指数为求出对应的参数值代入通项可得出关于的等式进而可求得实数的值【详解】的展开式通项为所以的展开式通项为令可得由题意可得解得故答案为:【点睛】方法点睛:对于求 解析:2【分析】由()()()()6661111ax x x ax x -+=+-+,分别写出()61x +和()61ax x +的展开式通项,分别令x 的指数为3,求出对应的参数值,代入通项可得出关于a 的等式,进而可求得实数a 的值. 【详解】()()()()6661111ax x x ax x -+=+-+,()61x +的展开式通项为16kkk T C x +=⋅,所以,()61ax x +的展开式通项为1166r r r r r A axC x aC x ++=⋅=⋅,令313k r =⎧⎨+=⎩,可得32k r =⎧⎨=⎩,由题意可得3266201510C aC a -=-=-,解得2a =. 故答案为:2. 【点睛】方法点睛:对于求多个二项式的和或积的展开式中某项的系数问题,要注意排列、组合知识的运用,还要注意有关指数的运算性质.对于三项式问题,一般是通过合并其中的两项或进行因式分解,转化成二项式定理的形式去求解.三、解答题21.(1)5;(2)121792x和11792x - 【分析】(1)先求出8n =,再写出二项式展开式的通项382182k kkk T C x-+=⨯⨯,令382kZ -∈即可求解;(2)设第1k +项系数最大,则118811882222k k k k k k k k C C C C --++⎧⨯≥⨯⎨⨯≥⨯⎩,即可解得k 的值,进而可得展开式中系数最大的项. 【详解】(1)由题意可得:152n+=,得8n =,8x ⎛+ ⎝的展开式通项为138********k k k k k k kk T C x x C x ---+=⨯⨯=⨯⨯,()08k ≤≤,要求展开式中有理项,只需令382kZ -∈, 所以0,2,4,6,8k = 所以有理项有5项,(2)设第1k +项系数最大,则118811882222k k k k kk k k C C C C --++⎧⨯≥⨯⎨⨯≥⨯⎩ , 即()()()()()()118!8!22!8!1!81!8!8!22!8!1!81!k k k k k k k k k k k k -+⎧⨯≥⨯⎪---+⎪⎨⎪⨯≥⨯⎪-+--⎩,即2191281k k k k ⎧≥⎪⎪-⎨⎪≥⎪-+⎩,解得:56k ≤≤,因为k Z ∈, 所以5k =或6k =所以1155226821792T C x x =⨯⨯=,166127821792T C x x -=⨯⨯=所以展开式中系数最大的项为121792x 和11792x -.【点睛】解二项式的题关键是求二项式展开式的通项,求有理项需要让x 的指数位置是整数,求展开式中系数最大的项需要满足第1k +项的系数大于等于第k 项的系数,第1k +项的系数大于等于第2k +项的系数,属于中档题22.(1)1;(2)231n-;(3)2312n -.【分析】(1)赋值0x =即可得解;(2)赋值1x =,结合(1)即可得解; (3)赋值1x =-,结合(2)即可得解. 【详解】(1)0x =代入()22201221nn n x x a a x a x a x ++=+++⋅⋅⋅可得:01a =; (2)1x =代入()22201221nn n x x a a x a x a x ++=+++⋅⋅⋅可得:032122=3n n a a a a a ++++⋯+,所以: 13222=31n n a a a a +++⋯-+;(3)1x =-代入()22201221nn n x x a a x a x a x ++=+++⋅⋅⋅可得:01232=1n a a a a a -+-+⋯+,又032122=3n n a a a a a ++++⋯+,、两式相减可得:5221312()31n na a a a -+++⋯=-+,所以221351312n n a a a a -+=+⋯-++. 【点睛】本题考查了二项展开式中项的系数和项的系数和,主要方法是赋值法,属于基础题. 23.(1)576;(2)144 【分析】(1)先从3个偶数抽取2个偶数和从4个奇数中抽取3个奇数,利用捆绑法把两个偶数捆绑在一起,再和另外三个奇数进行全排列;(2)利用插空法,先排两个偶数,再从两个偶数形成的3个间隔中,插入三个奇数,即可得出结果. 【详解】解:可知从1到7的7个数字中,有3个偶数,4个奇数, (1)五位数中,偶数排在一起的有:23413442576C C A A =个,(2)两个偶数不相邻且三个奇数也不相邻的五位数有:23233423144C C A A =个. 【点睛】本题考查数字的排列问题,涉及排列和组合的实际应用以及排列数和组合数的运算公式,考查利用捆绑法解决相邻问题,利用插空法解决不相邻问题,考查运算能力.24.(1)证明过程见解析;(2)证明过程见解析. 【分析】(1)根据排列数的公式,结合不等式的性质进行证明即可;(2)根据二项式定理,结合(1)中的结论、排列数、组合数的公式进行证明即可. 【详解】(1)由排列数的公式得:(1)(2)(1)121i m i A m m m m i m m m m i m mmm m m m m m---+---+==⋅⋅, (1)(2)(1)121i n i A n n n n i n n n n i n nnn n n n n n---+---+==⋅⋅, 当1i m n <≤<,1,2,31k i =-时,()()()=0m k n k n m k m n k k m n m k n km n mn mn m n ---------=<⇒<, 由不等式的性质可知:121m m m m i m m m m ---+⋅⋅<121n n n n i n n n n---+⋅⋅, 即i m i A m <i i i m ni i n i n A nm A A <⇒; (2)由二项式定理可知:0(1),(1)mnmi i ni imn i i n n Cm m C ==+=⋅+=⋅∑∑,因为,!!i iiim n mn A A C C i i ==,由(1)知:i i i i m n n A m A <, 所以有i i i im n n C m C <,又因为000011111,,0i in m n m n m C n C m C n C nm m C ====>(1)i m n <≤<,所以(1)(1)n mii ii n m nm i i m C n Cm n ==⋅>⋅⇒+>+∑∑.【点睛】本题考查了排列数、组全数公式的应用,考查了二项式定理,考查了不等式的性质,考查推理论证能力和数学运算能力. 25.(1)3;(2)70x 或1220412x - 【分析】(1)根据二项式系数和的性质,以及二项式系数和为256,可得2256n =,解出8n =,再由通项公式163418k kk k Ta C x-+=,0,1,2,,8k =,分析即得;(2)根据各项系数的和均为256,可得()81256a +=,解出3a =-或1a =,再由通项公式分情况进行计算即得. 先通过二项展开式的各二项式系数的和与各项系数的和均为256求出n . 【详解】(1)n的二项展开式的各二项式系数的和为2n,各项系数的和为()1n a +,由已知得2256n =,故8.n =此时n展开式的通项为:163418k k k k T a C x -+=,0,1,2,,8k =,当0,4,8k =时,该项为有理项,故有理项的个数为3. (2)由()81256a +=,得3a =-或 1.a = 当1a =时,展开式通项为163418k kk TC x-+=,0,1,2,,8k =,故二项式系数最大时系数最大,即第5项系数最大,即系数最大的项为45870T C x x ==;当3a =-时,163418(3)k kk k TC x-+=-,0,1,2,,8k =,展开式系数最大的项是奇数项,其中41T x =,523252T x =,55670T x =,12720412T x-=,296561T x -=,故展开式中系数最大的项为第7项,即系数最大的项为12720412T x-=.综上,展开式中系数最大的项为70x 或1220412x -. 【点睛】本题考查二项式系数的性质,以及通项公式的应用,要注意二项式系数与各项的系数的区别,考查分析计算能力,属于中档题. 26.(1)504种;(2)1440种. 【分析】(1)由题意,分“射”排在最后一周,剩下的课程没有限制和“射”不排在最后一周从中间四周选一周,再选一门课程排在最后一周,其他没有限制,然后与加法计数原理求解. (2)由题意,分甲只任教1科和甲任教2科,然后与加法计数原理求解. 【详解】(1)当“射”排在最后一周时,5554321120A =⨯⨯⨯⨯=, 当“射”不排在最后一周时,114444444321384C C A =⨯⨯⨯⨯⨯=,120384504+=,所以“射”不排在第一周,“数”不排在最后一周的排法有504种.(2)当甲只任教1科时,11121454325433554341200C C C C C A A =⨯⨯⨯⨯=, 当甲任教2科时,245454432124021C A ⨯=⨯⨯⨯⨯=⨯, 12002401440+=,所以甲不任教“数”的课程安排方案有1440种. 【点睛】本题主要考查排列组合的应用以及分步,分类计数原理的应用,属于中档题.。
(必考题)高中数学选修三第一单元《计数原理》测试卷(含答案解析)(4)

一、选择题1.若1nx x ⎛⎫- ⎪⎝⎭的展开式中只有第7项的二项式系数最大,则展开式中含2x 项的系数是 A .462- B .462 C .792D .792-2.有5名同学从左到右站成一排照相,其中中间位置只能排甲或乙,最右边不能排甲,则不同的排法共有( ) A .42种B .48种C .60种D .72种3.()7322121x x ⎛⎫+- ⎪⎝⎭展开式中常数项是( ) A .15B .-15C .7D .-74.在某次体检中,学号为i (1,2,3,4i =)的四位同学的体重()f i 是集合{45,48,52,57,60}kg kg kg kg kg 中的元素,并满足(1)(2)(3)(4)f f f f ≤≤≤,则这四位同学的体重所有可能的情况有( ) A .55种B .60种C .65种D .70种5.动点M 位于数轴上的原点处,M 每一次可以沿数轴向左或者向右跳动,每次可跳动1个单位或者2个单位的距离,且每次至少跳动1个单位的距离.经过3次跳动后,M 在数轴上可能位置的个数为( ) A .7B .9C .11D .136.汉代数学家赵爽在注解《周髀算经》时给出的“赵爽弦图”是我国古代数学的瑰宝.如图所示的弦图中,由四个全等的直角三角形和一个正方形构成.现有五种不同的颜色可供涂色,要求相邻的区域不能用同一种颜色,则不同的涂色方案有( )A .180B .192C .420D .4807.()52112x x ⎛⎫-- ⎪⎝⎭展开式的常数项为() A .112B .48C .-112D .-488.已知*n N ∈,设215nx x ⎛⎫- ⎪⎝⎭的展开式的各项系数之和为M ,二项式系数之和为N ,若992M N -=,则展开式中x 的系数为( )A .-250B .250C .-500D .5009.在二项式n 的展开式中,当且仅当第5项的二项式系数最大,则系数最小的项是 A .第6项B .第5项C .第4项D .第3项10.在二项式3nx ⎫⎪⎭的展开式中,各项系数之和为A ,二项式系数之和为B ,若72A B +=,则n =( )A .3B .4C .5D .611.若2132020x x C C -+=,则x 的值为( )A .4B .4或5C .6D .4或612.疫情期间,上海某医院安排5名专家到3个不同的区级医院支援,每名专家只去一个区级医院,每个区级医院至少安排一名专家,则不同的安排方法共有( ) A .60种B .90种C .150种D .240种二、填空题13.同宿舍的6个同学站成一排照相,其中甲只能站两端,乙和丙必须相邻,一共有_____种不同排法(用数字作答)14.在上海高考改革方案中,要求每位高中生必须在物理、化学、生物、政治、历史、地理6门学科(3门理科,3门文科)中选择3门学科参加等级考试,小李同学受理想中的大学专业所限,决定至少选择一门理科学科,那么小李同学的选科方案有________种. 15.用1、2、3、4、5、6六个数字组成的没有重复数字的六位数,要求任何相邻两个数字的奇偶性不同,且1和2相邻,这样的六位数的个数是____________. 16.若()()7280128112x x a a x a x a x +-=++++,则127a a a +++的值为__.17.62x ⎛ ⎝的展开式中3x 的系数为__________.(用数字作答)18.25(32)x x ++的展开式中3x 的项的系数是________.19.用0,1,2,3,4,5这六个数字组成没有重复数字的三位数,且是偶数,则这样的三位数有______个. 20.若()202022020012202032x a a x a x a x +=++++,则1352019a a a a ++++被12整除的余数为______.三、解答题21.三个女生和五个男生排成一排.(1)如果女生必须全排在一起,有多少种不同的排法; (2)如果女生必须全分开,有多少种不同的排法.22.已知2nx⎛⎝展开式前三项的二项式系数和为22.(1)求展开式中的常数项;(2)求展开式中二项式系数最大的项.23.已知在2nx ⎫⎪⎭的展开式中,第6项的系数与第4项的系数之比是6: 1. (1)求展开式中11x 的系数; (2)求展开式中系数绝对值最大的项;(3)求2319819n nn n n n C C C -++++的值.24.已知4530n n A C =,设()nf x x ⎛= ⎝. (Ⅰ)求n 的值;(Ⅱ)求()f x 的展开式中的常数项.25.(1)求(-x +12x)6的展开式的各项系数之和及展开式的常数项. (2)4位男同学与3位女同学任意排成一排照相. ①求3位女同学站在一起的概率; ②求4位男同学互不相邻的概率.26.已知n的展开式中的二项式系数之和比各项系数之和大255(1)求展开式所有的有理项; (2)求展开式中系数最大的项.【参考答案】***试卷处理标记,请不要删除一、选择题 1.D 解析:D 【解析】∵1nx x ⎛⎫- ⎪⎝⎭的展开式中只有第7项的二项式系数最大,∴n 为偶数,展开式共有13项,则12n =.121x x ⎛⎫- ⎪⎝⎭的展开式的通项公式为()1212211C r r r r T x -+=-,令1222r -=,得5r =. ∴展开式中含2x 项的系数是()12551C 792-=-,故选D . 【名师点睛】求二项展开式有关问题的常见类型及解题策略:(1)求展开式中的特定项,可依据条件写出第1r +项,再由特定项的特点求出r 值即可;(2)已知展开式的某项,求特定项的系数,可由某项得出参数项,再由通项写出第1r +项,由特定项得出r 值,最后求出其参数.2.A解析:A 【分析】根据题意,分2种情况讨论:①甲在最中间,将剩余的4人全排列,②乙在中间,分析可得此时的排法数目,由加法原理计算可得答案. 【详解】根据题意,中间只能排甲或乙,分2种情况讨论:①甲在中间将剩余的4人全排列,有4424A =种情况,②乙在中间,甲不能在最右端,有3种情况,将剩余的3人全排列,安排在剩下的三个位置,此时有33318A ⨯=种情况,则一共有241842+=种排法。
人教版化学选修三物质结构与性质测试考题(含答案)

绝密★启用前人教版化学选修三物质结构与性质测试考题本试卷分第Ⅰ 卷和第Ⅱ卷两部分,共100 分。
分卷I一、单选题(共10小题,每小题4.0分,共40 分)1.在硼酸[B(OH) 3]分子中,B 原子与3 个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B 原子杂化轨道的类型及同层分子间的主要作用力分别是( )A .sp,范德华力B.sp2,范德华力C.sp2,氢键D .sp3,氢键2.下列各组物质中,化学键类型都相同的是( )A.CaCl2 和NaOHB.Na2O 和Na2O2C.CO2和CS2D .HCl 和NaOH3.下列有关金属元素特征的叙述正确的是( )A.金属元素的原子只有还原性,离子只有氧化性B.金属元素在一般化合物中只显正价C.金属元素在不同的化合物中的化合价均不同D.金属元素的单质在常温下均为金属晶体4.前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有( )A.3 种B .4 种C.5 种D.6 种5.根据科学人员探测,在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物。
有关其组成的两种分子的下列说法正确的是( )A .它们都是极性键构成的极性分子B.它们之间以氢键结合在一起C.它们的成键电子的原子轨道都是sp3—s D .它们的立体结构都相同6.金属的下列性质中和金属晶体结构无关的是( )A .良好的导电性B.反应中易失去电子C.良好的延展性D .良好的导热性7.下列对各组物质性质的比较中,不正确的是( )A.熔点:Li >Na>KB.导电性:Ag>Cu>Al >FeC.密度:Na﹤Mg ﹤AlD.空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积8.下列各组微粒不是按半径逐渐增大的顺序排列的是( )A.Na、K、RbB.F、Cl、Br2+、Al 3+、Zn2+C.MgD.Cl -、Br-、I-9.下列分子中,属于易溶于水的一组是( )A.CH4、CCl4、CO2B.NH 3、HCl 、HBrC.Cl 2、H2、N2D.H2S、NO、SO210.下列叙述中,正确的是( )A .在一个基态多电子的原子中,可以有两个运动状态完全相同的电子B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子C.如果某一基态原子3p轨道上仅有2 个电子,它们自旋方向必然相反D .在一个基态多电子的原子中,M 层上的电子能量肯定比L 层上的电子能量高二、双选题(共4小题,每小题5.0 分,共20分)11.(多选)下列配合物的配位数不是 6 的是( )A.[Cu(NH 3)4]Cl 2B.Na2[SiF6]C.Na3[AlF 6]D.K 2[Co(SCN) 4]一个则无K+),下列说法正确的是()12.(多选)普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是()A.化学式可以表示为KFe2(CN)6B.一个立方体中含有12个π键C.普鲁士蓝中含有配位键D.Fe3+周围有12 个Fe2+离子13.(多选)高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0 价,部分为﹣2 价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是()A.超氧化钾的化学式为KO 2,每个晶胞含有4个K+和4 个O2-B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+C.晶体中与每个K +距离最近的K+有8 个D.晶体中,0 价氧原子与﹣2 价氧原子的数目比为3:114.(多选)下列有关范德华力的叙述正确的是()A .范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键B.范德华力与化学键的区别是作用力的强弱问题C.稀有气体形成的晶体中原子之间不存在范德华力D .范德华力较弱,故破坏它需要的能量很少分卷II三、综合题(共4小题,每小题10.0分,共40 分)15.A ,B ,C,D 是四种短周期元素,E是过渡元素。
化学选修三物质结构与性质单元测试题试题2

第一章练习题1、下列说法中正确的是()A、处于最低能量的原子叫做基态原子B、3p2表示3p能级有两个轨道C、同一原子中,1s、2s、3s电子的能量逐渐减小D、同一原子中,2p、3p、4p能级的轨道数依次增多2、下列说法中,正确的是()A、在周期表里,主族元素所在的族序数等于原子核外电子数B、在周期表里,元素所在的周期数等于核外电子层数C、最外层电子数为8的都是稀有气体元素的原子D、元素的原子序数越大,其原子半径越大3、13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWüthrich 等人为此获得2002年诺贝尔化学奖。
下面有关13C、15N叙述正确的是A.13C与15N有相同的中子数 B.13C与C60互为同素异形体C.15N与14N互为同位素 D.15N的核外电子数与中子数相同4、下列能级中轨道数为3的是A.S能级 B.P能级C.d能级 D.f能级5、下列各原子或离子的电子排布式错误的是A.Al 1s22s22p63s23p1 B.S2- 1s22s22p63s23p4 C.Na+ 1s22s22p6 D.F 1s22s22p5 6、下列说法正确的是A.原子的种类由原子核内质子数、中子数决定B.分子的种类由分子组成决定C.32He代表原子核内有2个质子和3个中子的氦原子D.178O和188O原子的核外电子数是前者大7、一个电子排布为1s22s22p63s23p1的元素最可能的价态是A.+1 B.+2 C.+3 D.-18、具有下列电子排布式的原子中,半径最大的是A.ls22s22p63s23p? B.1s22s22p3 C.1s22s2sp2 D.1s22s22p63s23p49、有关核外电子运动规律的描述错误的是A.核外电子质量很小,在原子核外作高速运动B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多10、X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6。
物理教科版选修3-1单元测试:第二章直流电路含解析

第二章测评(时间:90分钟满分:100分)一、选择题(本题包括12个小题,共48分)1在下列用电器中,哪些属于纯电阻用电器…()A.电扇和电吹风B.电烙铁和电热毯C.洗衣机和电冰箱D.电动机2黄昏时电灯比深夜暗,是因为黄昏时()A.线路总电阻变大,电流变小B.干线电流过大,线路损失电压增大C.总电流一定,支路增多分去了电流D.总电阻变小,各支路电流变小3实验室用的小灯泡灯丝的IU特性曲线可用以下哪个图象来表示()4当外电路电阻分别为8 Ω和2 Ω时,单位时间外电路放出的热量正好相等,则电源的内阻为()A.1 ΩB.2 ΩC.4 ΩD.8 Ω5在如下图甲所示的电路中,电源电动势为3.0 V,内阻不计,L1、L2、L3为3个相同规格的小灯泡,这种小灯泡的伏安特性曲线如下图乙所示.当开关闭合后,下列关于电路中的灯泡的判断中,正确的是()A.灯泡L1的电阻为12 ΩB.通过灯泡L1的电流为灯泡L2的电流的2倍C.灯泡L1消耗的电功率为0.75 WD.灯泡L2消耗的电功率为0.30 W6一个T型电路如图所示,电路中的电阻R1=10 Ω,R2=120 Ω,R3=40 Ω。
另有一测试电源,电动势为100 V,内阻忽略不计.则()A.当cd端短路时,ab之间的等效电阻是40 ΩB.当ab端短路时,cd之间的等效电阻是40 ΩC.当ab两端接通测试电源时,cd两端的电压为80 VD.当cd两端接通测试电源时,ab两端的电压为80 V7电动势为E、内阻为r的电源与定值电阻R1、R2及滑动变阻器R连接成如图所示的电路,当滑动变阻器的触头由中点滑向b端时,下列说法正确的是()A.电压表和电流表读数都增大B.电压表和电流表读数都减小C.电压表读数增大,电流表读数减小D.电压表读数减小,电流表读数增大8某同学设计了一个转向灯电路(如图所示),其中L为指示灯,L1、L2分别为左、右转向灯,S为单刀双掷开关,E为电源,当S置于位置1时,以下判断正确的是()A.L的功率小于额定功率B.L1亮,其功率等于额定功率C.L2亮,其功率等于额定功率D.含L支路的总功率较另一支路的大9如图,电源内阻不计.为使电容器的带电荷量增大,可采取以下哪些方法()A.增大R1B.增大R2C.增大R3D.减小R110如图所示,R1、R2是定值电阻,R3是滑动变阻器,当变阻器的滑动头P向左移动时()A.R1的功率将增大B.R2的功率将减小C.电源的功率将增大D.电源的效率将减小11如图所示,电源电动势为E,内电阻为r.当滑动变阻器的触片P从右端滑到左端时,发现电压表V1、V2示数变化的绝对值分别为ΔU1和ΔU2,下列说法中正确的是()A.小灯泡L1、L3变暗,L2变亮B.小灯泡L3变暗,L1、L2变亮C.ΔU1<ΔU2D.ΔU1>ΔU212在研究微型电动机的性能时,应用如图所示的实验电路.当调节滑动变阻器R并使电动机停止转动时,电流表和电压表的示数分别为0.5 A和2 V.重新调节R并使电动机恢复正常运转,此时电流表和电压表的示数分别为2 A和24 V,则这台电动机正常运转时的输出功率为()A.32 W B.44 WC.47 W D.48 W二、填空题(13题6分,14题10分,共16分)13如图所示为一正在测量中的多用电表表盘.(1)如果是用×10 Ω挡测量电阻,则读数为______ Ω。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质结构与性质测试卷(一)一、选择题1.下列有关化学键的叙述中,不正确的是().A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数B.水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子C.完全由非金属元素形成的化合物中也可能含有离子键D.配位键也具有方向性、饱和性2.下列说法中不正确的是().A.σ键比π键重叠程度大,形成的共价键强B.两个原子之间形成共价键时,最多有一个σ键C.气体单质中,一定有σ键,可能有π键D.N分子中有一个σ键,两个π键23.老鼠能在多氟碳化物溶液内部潜水游动,科学家预测多氟碳化物可能成为血液的替代品。
全氟丙烷(CF)是一种常见的多氟碳化物,下列对该物质的叙述中正确的是( )83.全氟丙烷的电子式为B.原子半径C比AF的小C.全氟丙烷分子中的化学键只有共价键 D.全氟丙烷分子中既含σ键又含π键4.下列叙述中正确的是()A.NH、CO、CO都是极性分子B.CH、CCl都是含有极性键的非极性分子4243C.HF、HCl、HBr、HI的稳定性依次增强D.CS、HO、CH都是直线形分子22225.下列有关物质性质、结构的表述均正确,且存在因果关系的是()6.下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。
示例:根据各图表示的结构特点,下列有关叙述正确的是( )A.上述结构图中共出现6种元素 B.甲、乙、丙为非极性分子,丁为极性分子C.甲与丁可以发生化合反应生成离子化合物1 / 6D.向CaCl溶液中加入(或通入)丙有白色沉淀产生2 7.根据科学人员探测,在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物。
有关其组成的两种分子的下列说法正确的是( ) A.它们都是极性键构成的极性分子 B.它们之间以氢键结合在一起.它们的成键电子的原子轨道都是sp—S D.它们的立体结构都相同3C8.下列说法正确的是( )A.一个水分子与其他水分子间只能形成2个氢键 B.含氢键的分子熔、沸点一定升高C.分子间作用力包括氢键和范德华力 D.当HO由液体变为气体时只破坏了氢键29.碘单质在水溶液中溶解度很小,但在CCl中溶解度很大,这是因为( ) 4A.CCl 与I相对分子质量相差较小,而HO与I相对分子质量相差较大2242B.CCl与I都是直线形分子,而HO不是直线形分子242C.CCl和I都不含氢元素,而HO中含有氢元素242D.CCl和I 都是非极性分子,而HO是极性分子24210.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。
下列关于“暖冰”的说法正确的是( )A.暖冰中水分子是直线形分子B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化C.暖冰中水分子的各原子均满足8电子稳定结构D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”二、非选择题11.有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。
已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体。
(1)B、C两元素按原子个数1∶1组成的化合物F中的阴阳离子比为________,F中既存在离子键又存在________共价键(填“极性”或“非极性”)。
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式)____>______。
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:__________________________________________________。
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:____________________________________________。
(5)D的氢化物分子中,D原子的杂化方式是________,空间构型是________。
12.(2018·福建高考)氮元素可以形成多种化合物。
回答以下问题:(1)基态氮原子的价电子排布式是。
(2)C、N、O三种元素第一电离能从大到小的顺序是。
(3)肼(NH)分子可视为NH分子中的一个氢原子被——NH(氨基)取代形成的另2423一种氮的氢化物。
①NH分子的空间构型是;NH分子中氮原子轨道的杂化类型是。
432②肼可用作火箭燃料,燃烧时发生的反应是:-1H=-1 038.7 kJ·molO4H(g)△)lNO()+2NH(l===3N(g)+222424若该反应中有4 mol N -H键断裂,则形成的π键有mol。
③肼能与硫酸反应生成NHSONHSO晶体类型与硫酸铵相同,则NHSO的晶体内不464222664,存在(填标号)。
a.离子键b.共价键c.配位键d.范德华力(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
2 / 6下列分子或离子中,能被该有机化合物识别的是(填标号)。
a.CFb.CH 44+c.NHd.HO24物质结构与性质测试卷(二)1.下列各组分子中,都属于含极性键的非极性分子的是( )A.CO HS B.CH CHC.C CH D.NH HCl 32224602442.下列现象与氢键有关的是( )①NH的熔、沸点比ⅤA族其他元素的氢化物高②小分子的醇、羧酸可以和水以任意比3互溶③冰的密度比液态水的密度小④尿素的熔、沸点比醋酸的高⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低⑥水分子高温下也很稳定A.①②③④⑤⑥ B.①②③④⑤C.①②③④ D.①②③3.在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1-1、N,晶体片段结构如右图所示。
又发现利用N可制取出mol(N的键能为942kJ·)522+)极不稳定。
则下列说法错误的是( NN。
含N离子的化合物及、N53560.按键型分类,该晶体中含有非极性共价键A+.含N离子的化合物中既有离子键又有共价键B5+、、NN互为同素异形体、C.高聚氮与NN、N602535D.这种固体的可能潜在应用是烈性炸药或高能材料年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺4.2008)。
下列关于三聚氰胺分子的说法正确的是(sp杂化,所有氮原子采用杂化B.一个分子中共含有15A.所有碳原子采用sp 键 C.属33σ个于极性分子,故极易溶于水 D.分子内既有极性键又有非极性键,它的所有原子的最外层都符合相应稀有气体原子的最外电的化学式为NHA5.固体5)子层结构,则下列有关说法,不正确的是(NHNH B中既有离子键又有共价键.ANH.的熔沸点高于 3553 / 6C.1mol NH中含有5mol N—H键 D.NH固体投入少量水中,可产生两种气体556.0.01mol 氯化铬(CrCl·6HO)在水溶液中用过量的AgNO处理,产生0.02mol AgCl332沉淀,此氯化铬最可能是( )A.[Cr(HO)]Cl B.[Cr(HO)Cl]Cl·HO C.[Cr(HO)Cl]Cl·2HO D.[Cr(HO)Cl]·332242532222263HO 现代无机化学对硫—氮化合物的研究是最为活跃的领域之一。
其中右图是已经合成27.)的最著名的硫—氮化合物的分子结构。
下列说法正确的是(.该物质的分子中既有极性键又有非极性键A.该物质的分子式为SN B 互为同素异形体.该物质与化合物SNC.该物质的分子是非极性分子D22二、非选择题的气态氢化物的沸点最A、D四种元素处于同一短周期,在同族元素中,8.A、B、C之BA、高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于相邻。
与B间,D 的原子的价电子排布式为。
)C(1 键。
键,个σ2)在B的单质分子中存在个π(++间形成的键叫,形成的离子HB原子与B的气态氢化物很容易与H结合,(3)已知原子采取的杂化方式是。
立体构型为,其中B四种元素形成的电子数相同的四种氢化物中沸点最低的是(写分DC、A、B、(4)在。
子式),其沸点显著低于其他三种氢化物的原因是: ___________________________ 1)中国古代四大发明之一——黑火药,它的爆炸反应为:9.(2018·福建高考)(引燃 3CO↑(已配平)A+N↑+2KNO +3C+S=====223 S外,上列元素的电负性从大到小依次为。
①除 A的晶体类型为,含极性共价键的分子的中心原子轨道杂化类型为。
②在生成物中,-π键数目之比为。
分子中σ键与③已知CN与N结构相似,推算HCN2,在周期表中既处于同一周期又位于同一族,且和T36的元素Q(2)原子序数小于+2的未成对电子数QT2。
的基态原子外围电子(价电子)排布式为,原子序数T比Q多是。
x+xn均为(和CrCl(HO)](3)在CrCl的水溶液中,一定条件下存在组成为[nn-236),可发生离子交换反应:R-H正整数)的配离子,将其通过氢离子交换树脂(x+x―→-)]+HR [CrCl(HO nn-62+x HH(O)]+R[CrCl nnx-62+nx H经中和滴定,即可求出,确定配离子的组成。
和交换出来的x+完全交换后,中和生成的R-H]CrCl(HO)的溶液,与[将含0.0015 mol nn-621-+,可知该配离子的化学式为。
溶液25.00 mL·H需浓度为0.1200 molLNaOH·江苏高考)生物质能是一种洁净、可再生能源。
生物质气(主要成分为200910.( H混合,催化合成甲醇是生物质能利用的方法之一。
H、CO、等)与CO222原子的核外电子排布等元素。
写出基态ZnZn、Al1()上述反应的催化剂含有Cu、式。
分子的结构式。
2)根据等电子原理,写出CO(沉CuO)Cu(OH 的碱性溶液反应生成)甲醇催化氧化可得到甲醛,甲醛与新制(322淀。
;①甲醇的沸点比甲醛的高,其主要原因是_____________________________________ 甲醛分子中碳原子轨道的杂化类型为。
σ键的数目为。
1 mol②甲醛分子的空间构型是;甲醛分子中 CuOCu1③在个晶胞中(结构如图所示),所包含的原子数目为。
24 / 6物质结构与性质测试卷(一)答案1-5:ACCBB 6-10:CCCDD11、【答案】 (1)1∶2 非极性(2)HClO HSO 442---+HO +(3)Cl+2OHClO===Cl22(4)NaHSO+NaHSO===NaSO+HO+SO↑2242343V形(5)sp23(2)N>2pO>C 12、答案:(1)2s3②3 ③d (4)c(3)①三角锥形 sp物质结构与性质测试卷(二)答案1-7:BBCBCBB24(2)2 1 ()2s2p3)配位键正四面体形 8、答案:(13杂化(4)CH CH分子间只有范德华力,而NH、HO、spHF分子2344间除范德华力外还存在氢键9、答案:(1)①O>N>C>K ②离子晶体 sp ③1∶1822+](HO3d))4s)[ 4 (3CrCl(252226261021024s]1s10、答案:(1)或[2s2pAr3s3p3d3d4s←O)(2)C≡O(或C===2杂化sp 3()①甲醇分子之间形成氢键②平面三角形3N③4A5 / 66 / 6。
