届高考化学一轮复习讲义课件铝及其重要化合物
高考化学大一轮复习 3.2铝及其重要化合物课件

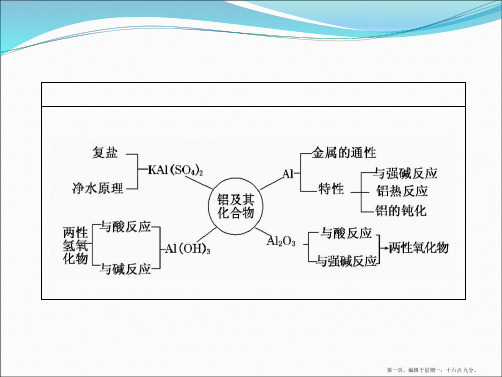
(3)常用铝盐溶液与氨水反应来制备 Al(OH)3,其离子方程式 为:Al3++3NH3·H2O===Al(OH)3↓+3NH4+。
3.明矾
明矾的化学式为: KAl(SO4)2·12H2O ,可溶于水,电离方程
式为:KAl(SO4)2===K++Al3++2SO24-。 明矾可用于净水,其原因是: Al3+水解产生 Al(OH)3 胶体,
第三章 金属及其化合物
第②讲 铝及其重要化合物
பைடு நூலகம்
说考纲—分析考情明考向
说基础
课前预习读教材
SHUO JI CHU 基/础/梳/理
一、铝 1.物理性质及用途 颜色: 银白色 ;硬度、密度: 较小 ;熔点: 较低 ;导电、 导热性: 良好 。 用途:制造 铝合金 、制作 导线 。
2.化学性质
(1)与 O2 反应
特别关注 金属与酸或碱反应的实质是金属与溶液中的 H+或 OH-发生氧 化还原反应。在反应过程中,都是金属失电子,根据得失电子守恒 可知,金属失去的电子数等于生成 H2 中的原子数,如等物质的量 的铝分别与足量的稀盐酸、氢氧化钠溶液反应产生的 H2 的物质的 量相等,常用的方法有守恒法和平均值法(即求混合金属的平均相 对原子质量)。
5.在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在酒精 灯上加热至其熔化,会看到的现象是铝箔熔化,失去光泽,但熔化 的 铝 并 不 滴 落 。 原 因 是 _________________________ _________________________________________________________ ________________________________________________________。
高考化学一轮总复习第四单元第2讲铝及其化合物课件

断,完全正确的是(
)。
选项
陈述Ⅰ
铝制炊具最好不要盛 A 放酸性或碱性较强的
液体食物
氯气不能使干燥的有 B 色布条褪色,能使湿
润的有色布条褪色
C
二氧化硫能使KMnO4 溶液褪色
铁和铝制成的槽车可 D 以密封贮运浓硫酸或
浓硝酸
陈述Ⅱ
因为Al和Al2O3既可以 与酸反应,又可以与 碱反应
判断
Ⅰ对,Ⅱ对, 无
碱反应,Al 与产生 H2 的关系均是:2Al~3H2。
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气
的体积比为VVNHaOClHHH22=1。
第十九页,共49页。
(2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反 应,产生氢气的体积比为VVNHaOClHHH22=13。
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应, 若产生氢气的体积比为13<VVNHaOClHHH22<11,则必定是:铝与盐酸 反应时,铝过量而盐酸不足;铝与氢氧化钠溶液反应时,铝不 足而氢氧化钠过量。
第七页,共49页。
◎ 自主测评 ◎
1.(2014年北京卷)下列(xiàliè)金属中,表面自然形成的氧化层能
保护(bǎohù)内层金属不被空气氧化的是( )。
A.K
B.Na
C.Fe
D.Al
解析:K、Na化学性质非常活泼,在空气中极易被氧气氧
化,A、B错误;Fe在空气中易被氧气氧化生成一层疏松的Fe2O3
第十七页,共49页。
解析:18 mol·L-1 H2SO4为浓H2SO4与Mg、Al反应不产生H2; Mg、Al与稀HNO3反应生成NO而不是H2;Mg与盐酸反应产生H2,而 Mg与NaOH不反应,等质量(zhìliàng)的Al分别与足量的HCl和NaOH溶 液反应,产生H2的量相等。故A项产生H2的量最多。
高三一轮复习铝及其化合物讲课课件

2 考点二:两性金属
考点
[典例 2] 锌和铝都是活泼金属,其氢氧化物既能溶于强酸溶
液,又能溶于强碱溶液,但是 Al(OH)3 不溶于氨水,而 Zn(OH)2 能溶于氨水,生成[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于 NaOH 溶液后,溶液中铝元素的存在形式为 _[_A_l_(O__H_)_4_]-_(_或___A_l_O_- 2_)__(用化学式表示)。
3 考点三:从铝土矿制铝单质
由铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)提取Al2O3的 两大工艺流程:
方案一:碱溶法
3 考点三:从铝土矿制铝单质
由铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)提取Al2O3的 两大工艺流程:
方案二:酸溶法
3 考点三:从铝土矿制铝单质
KAl(SO4)2·12H2O
PART THREE
考点讲解
1 考点一:铝及其化合物的
例题 1.(2017·镇江模拟)下列关于铝单质的叙述正确的是( ) A. 由于铝在空气中不会氧化,所以铝制品的使用寿命都很长 B. 由于铝具有较强的还原性,所以常用铝来冶炼某些高熔点金属 C. 常温下,可用铝制容器盛装浓硫酸,说明铝与浓硫酸不反应 D. Al 有良好的导热性,可制成铝箔包装物品
物的主要性 国卷Ⅱ13;
,4、铝及其化合物以工艺流程的形
质及其应用 2015·全国卷Ⅰ10、27 式出现。
。
,全国卷Ⅱ 13
5、有关铝及其化合物的计算
PART TWO
自主复习
02 自主复习
01
02
03
04
单质——氧化物——对应的水化物——盐(某些重要)
高考理综高三一轮高考化学复习 第3章 第2讲 铝及其重要化合物

第2讲 铝及其重要化合物[考纲要求] 了解铝及其重要化合物的主要性质和应用。
考点一 铝的性质及应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式: ①Al O 2⎪⎪⎪⎪――→ 常温形成致密的氧化膜――→ 点燃4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3③Al 酸⎪⎪⎪⎪――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4.对比记忆镁的化学性质铝镁与非金属反能被Cl 2、O 2氧化2Mg +O 2=====点燃2MgO应3Mg +N 2=====点燃Mg 3N 2 与水反应 反应很困难 能与沸水反应Mg +2H 2O=====△Mg(OH)2+H 2↑与碱反应 能溶于强碱溶液 不反应与某些氧化物反应能与Fe 2O 3、MnO 2、Cr 2O 3等金属氧化物发生铝热反应能在CO 2中燃烧:2Mg +CO 2=====点燃2MgO +C5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
深度思考1.铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能? 答案 铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
2.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H 2SO 4或浓HNO 3?答案 常温下浓H 2SO 4、浓HNO 3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续进行。
高考化学一轮复习 4.2 铝及其重要化合物讲解课件 鲁科版

4mol·L-1 ×500mL
2mol·L
-1
=1 000
重点(zhòngdiǎn)1
例1
铝及其化合物的转化关系及应用
变式训练
(xùnliàn)
1
本题也可按“等价代换”法理解:加入盐酸反应后的溶液中含有 AlCl3、
MgCl2、HCl,加入 NaOH 溶液反应后,相当于用 Na+代换了盐酸中的 H+,用 OH代换了 AlCl3、MgCl2 中的 Cl-。
(Al
)
(OH- )
3+
(Al
当 3<
)
≥4 时,没有沉淀生成;
(OH- )
3+
(Al
)
<4 时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)。
重点(zhòngdiǎn)1
重点(zhòngdiǎn)2
第十页,共31页。
重点1 铝及其化合物的转化(zhuǎnhuà)关系及应用
3+
Al +3OH
-
Mg2++2OHAl(OH)3+OH-
重点(zhòngdiǎn)1
Al(OH)3↓
Mg(OH)2↓
[Al(OH)4]-
重点(zhòngdiǎn)2
第十八页,共31页。
重点2
有关氢氧化铝(qīnɡ yǎnɡ huà huà)沉淀的图像分析
例2
变式训练
(xùnliàn)
2
在 Al2(SO4)3 和 MgSO4 的混合溶液中,滴加 NaOH 溶液,生成沉淀的量与
现较强的金属性。
考点1
考点2
高三化学一轮复习 铝及其重要化合物课件

• ①Al3++3NH3·H2O===Al(OH)3↓+3NH • 或Al3++3OH-===Al(OH)3↓ • ②Al(OH)3+3H+===Al3++3H2O • ③Al(OH)3+OH-===[Al(OH)4]- • ④[Al(OH)4]-+CO2===Al(OH)3↓+HCO3• 或[Al(OH)4]-+H+===Al(OH)3↓+H2O • 或2[Al(OH)4]-+CO2===2Al(OH)3↓+CO
• 1.元素的性质包含金属性和非金属性, 其强弱可以通过该元素对应的某些化学性 质体现出来。某同学认为铝元素是金属元 素,但是有一定的非金属性,下面的化学 反应你认为能支持该同学观点的是
()
• A.铝片与盐酸反应生成氢气
• B.铝热反应
• C.氢氧化铝溶于强碱溶液
• 【解析】 元素的非金属性可以根据其单 质的氧化性、氢化物的稳定性以及最高价 氧化物对应的水化物的酸性来判断。要说 明铝元素具有非金属性只能通过其最高价 氧化物对应的水化物的酸性来判断了,C 选项氢氧化铝能与强碱反应说明氢氧化铝 有一定的酸性,因而可以作为判断铝元素 具有非金属性的依据。
• 2Na[Al(OH)4]+H2SO4===2Al(OH)3↓+ Na2SO4+2H2O。
• (1)上述哪一种方法比较节约试剂?[提示: 试从每生产2 mol Al(OH)3所耗费的试剂用 量予以说明]
• (2)原料相同,请设计一种更为节约试剂的 方法(以方程式表示,并说明其可以最节 约试剂的根据)。
【答案】 AD
• 3.(2008年广东高考)相同质量的下列物质 分别与等浓度的NaOH溶液反应,至体系 中均无固体物质,消耗碱量最多的是
()
• A.Al2O3
高考化学一轮复习课件第讲铝及其化合物

• C.8mol·L-1 NaOH D.18mol·L-1 H2SO4
第二十五页,编辑于星期一:十四点 三十九分。
•
在镁、铝混合物中加入HNO3和浓
H2SO4都不能产生H2,加入NaOH溶液,只有
Al与之反应,加入盐酸,镁和铝都与盐酸反应
生成H2,所以生成的H2的量最多。
方法指导:本题主要考查Mg、Al与硝酸
排在前面的金属能把 排在后面的金属从其 盐溶液中置换出来
溶于王水 不反应
加热分解
常温分解
化合态
游离态
热分解或其他方法
第二十四页,编辑于星期一:十四点 三十九分。
•
(考查单质铝的性质)将等物质的量
的镁和铝相混合,平均分成4份,分别加到足
量的下列溶液中,充分反应后,放出氢气最多
的是( )A
• A.3 mol·L-1 HCl B.4 mol·L-1 HNO3
Al(OH)3+3H+=Al3++3H2O, Al(OH)3+OH-=AlO-2+2H2O 3.明矾的化学式是KAl(SO4)2·12H2O,它
是一种复盐,它能净水的原因是
Al3++3H2O Al(OH)3(胶体)+3H+。
第八页,编辑于星期一:十四点 三十九分。
• 四、从铝土矿中提取铝 • 1.工艺流程
是含量最多的金属,它属于有色金属和轻金 属,自然界中的铝全部以化合态存在;铝土
矿的主要成分是Al2O3。 • 二、铝单质
• 1.物理性质 • 银白色有金属光泽的固体,有良好的延展性、
导电性和导热性等。
第三页,编辑于星期一:十四点 三十九分。
• 2.化学性质
高考化学一轮复习 3.2铝及其重要化合物课时详解课件

3.明矾净水原理
明矾的化学式为 KAl(SO4)2·12_H_2_O__,其净水的原理涉及
到的离子方程式表示为:
__A__l_3+__+__3__H_2O__=_=_=_A_l_(__O_H_)_3_(_胶__体___)_+__3_H__+______。
【思考与探究】 1.下列变化可通过一步化学反应直接完成的是___①_____。 (1)Al(OH)3→Al2O3 (2)Al2O3→Al(OH)3 (3)Al→Al(OH)3 2.既能与盐酸反应,又能与NaOH溶液反应的物质有哪些?
C
解析:Mg、Al失去电子变为离子,离子再结合OH-生成沉 淀,则镁铝合金与盐酸反应转移电子的物质的量等于其生成 沉淀时结合的OH-的物质的量,沉淀量最大时得到Mg(OH)2和 Al(OH)3的混合物,则m(OH-)=(a+1.7)g-a g=1.7 g, n(OH-)=0.1 mol,电子转移总数是0.1NA,A、B正确;沉淀 量最大时,溶液中n(Na+)=n(Cl-),此时HCl和氢氧化钠的
氧
化 物
与NaOH反应 Al2O3+2NaOH==2NaAlO2+H2O
2.氢氧化铝 (1)物理性质 白色胶状不溶于水的固体,有较强的吸附性。
(2)化学性质
写出图中有关反应的化学方程式或离子方程式:
— ——① ② ③— ——AA2— —llA—((l— —OO(—HHO— —))H—33)——+ +3———=3O=—HH=——+-A—l==——2==—O==——3AA+———llO33—+——2H-+2+———O3。2———HH22—O——O;;———
3.用途 纯铝用作导线,铝合金用于制造汽车、飞机、生活 用品等。
【问题与探究】
高考化学一轮专题复习 第三章 第2讲 铝及其重要化合物课件 新人教版

产 生 的 H 2 的 量 相 同 , 各 产 生 1 m ol H 2 时 ,
需
M g 1 m ol, 质 量 为
24 g,需
2 A l3
m ol, 质
量 为 18 g。 故 A 正 确 , B、 C 错 误 。 M g 的
题组二 镁、铝性质的比较
题组设计 思维建模
对比记忆镁、铝的化学性质
铝
镁
与非金属 反应
第三章 金属及其化合物
第2讲 铝及其重要化合物
考点突破 题型透析
学科素养 技能提升
考纲要求
考点一 铝的性质及应用 考点二 铝的重要化合物 考点三 数形结合突破“铝三角”
铝土矿冶炼的两种思维模式 备选素材
返回总目录
考纲要求
1.了解金属铝的主要性质及其应用。 2.了解Al的重要化合物的主要性质及其应用。 3.“铝三角”和铝热反应。
A.物质的量之比为3∶2 B.质量之比为3∶2 C.摩尔质量之比为2∶3 D.反应速率之比为2∶3
镁 与 稀 硫 酸 反 应 : M g+ H 2SO 4===M gSO 4+
H 2↑ , 铝 与 稀 硫 酸 反 应 : 2A l +
3H 2SO 4===A l2(SO 4)3+ 3H 2↑ , 由 图 像 知 ,
考点一 铝的性质及应用
3.写出图中有关反应的化学方程式或离子方程式:
知识梳理 思维深化
考点一 铝的性质及应用
3.制备 2Al2O3(熔融)=冰=通=晶=电石==4Al+3O2↑
知识梳理 思维深化
考点一 铝的性质及应用
1.铝元素在地壳中含量丰富,仅次于硅,是地壳中含量最大的金 属,自然界中的铝全部以化合态存在。 2.常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使 铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。 3.铝与稀硝酸反应时生成的气体是NO而不是H2。 4.用铝箔包裹的钠与水反应时既考虑Na与水的反应,又考虑Al与 NaOH溶液的反应。
高考化学第一轮复习课件铝及其化合物
全局性掌控
本节的重点知识有:铝、氧化铝、氢氧化铝、明矾
的性质及用途.主要考查Al的性质,Al2O3、Al(OH)3的
两性及Al3+、AlO
2
、Al(OH)3之间的转化.预测2012
年高考仍会突出在铝与碱的反应,Al2O3、Al(OH)3的两
性等基础知识上,还可能涉及铝的重要化合物的用途,
第六页,编辑于星期一:十六点 九分。
1.如何除去铁粉中的铝粉? 提示:加入过量NaOH溶液,然后过滤、洗涤、干燥
.
第七页,编辑于星期一:十六点 九分。
二、铝的重要化合物
1.氧化铝 (1)化学性质(用离子方程式表示)
(2)用途 熔点很高,是一种较好的 耐火材料 ,还可制作各种宝石.
第八页,编辑于星期一:十六点 九分。
第五页,编辑于星期一:十六点 九分。
化学性质
与Cl2、S的 反应
化学方程式 2Al+3Cl2= =△= = = 2AlCl3
2Al+3S= =△= = = Al2S3
与盐酸的 反应
与NaOH溶 液的反应
2Al+6HCl === 2AlCl3+3H2↑ 2Al+2NaOH+2H2O === 2NaAlO2+3H2 ↑
金属与酸或碱反应的实质是金属失电子,金属失去的电子
数等于生成H2中的氢原子数,常用的方法有守恒法和平均值 法(即求混合金属的平均相对原子质量).
第二十二页,编辑于星期一:十六点 九分。
1.将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气
C 产生,充分反应后有金属剩余,该溶液可能为 ( )
导电、导热性.
第四页,编辑于星期一:十六点 九分。
高考化学一轮课件第7讲铝及其化合物

教材研读 栏目索引
答案 (1)铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝
不再被氧化,因而铝制品通常具有较强的抗腐蚀性能
(2)不恰当。金属性是指元素的原子失电子的能力,非金属性是指元素
的原子得电子的能力。铝不论是与酸反应还是与碱反应,都会失去电
子,因而铝具有较强的金属性
(3)铝与酸、碱反应的实质都是:
0
Al
Al3+,2H+
碱中的H+来源于水的电离。氧化剂分别为酸和水
H2,只不过
二、铝的重要化合物
1.氧化铝
(1)化学性质(用离子方程式或化学方程式表示)
教材研读 栏目索引
两性氧化物— (2)用途 熔点很高,是一种较好的③ 耐火材料 ,还可制作各种宝石。 2.氢氧化铝
3.常见的铝盐
教材研读 栏目索引
V (H2 )HCl =1∶1。
V (H2 )NaOH
考点一
栏目索引
(2)足量的铝分别与等体积等物质的量浓度的盐酸、NaOH溶液反应,产
生氢气的体积比为 V (H2 )HCl =1∶3。
V (H2 )NaOH
(3)一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,若产生氢气
的体积比为 1 < V (H2 )HCl <1,则必定是:
自测2 依据Al单质的性质,思考并回答下列问题。 (1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有 较强的抗腐蚀性能?
。 (2)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属 性”,你认为这种说法是否恰当?为什么?
。 (3)铝与酸、碱反应的实质是什么?氧化剂是什么?
3 V (H2 )NaOH
