生理学实验:家兔呼吸运动的调节【内容充实】
生理学高分实验报告家兔呼吸运动的调节

肺牵张感受器位于肺泡壁和支气管 平滑肌中,可感受肺部的扩张和缩 小。
呼吸肌感受器位于呼吸肌中,可感 受呼吸肌的收缩和舒张。
中枢和外周感受器的相互作用
中枢和外周感受器之间存在复杂的相 互作用,共同维持呼吸运动的稳定性 和适应性。
02
给实验组家兔分别注射不同浓度的呼吸兴奋剂和呼 吸抑制剂。
03
观察并记录注射药物后家兔呼吸运动的变化情况, 包括呼吸频率、呼吸深度的改变。
实验步骤与操作
• 在药物作用高峰期,再次测定家兔的血气指标,以评估药物对呼吸功能的影响。
实验步骤与操作
4. 数据分析与统计
对实验数据进行整理和分析,比较对照组和实验组家兔在呼吸运动参数和 血气指标上的差异。
体液调节与神经调节的相互作用
协同作用
在某些情况下,体液调节和神经调节可协同作用,共同调节呼吸运动。例如,当机体处 于缺氧状态时,外周化学感受器和中枢化学感受器同时受到刺激,引起呼吸加深加快。
拮抗作用
在某些情况下,体液调节和神经调节可相互拮抗,共同维持呼吸运动的平衡。例如,当 机体处于过度通气状态时,动脉血氧分压升高可抑制外周化学感受器的活动,而中枢化 学感受器则继续受到刺激,引起呼吸减慢变浅。这种拮抗作用有助于防止过度通气对机
证了呼吸运动的调节机制。
04
本实验为深入研究呼吸运动的调节机制提供了有价 值的参考数据,有助于进一步揭示呼吸生理学的奥
秘。
对未来研究的展望和建议
0标1题
进••一文文步研字字究内内不容容同物种 之•间文呼吸字运内动容调节机 制•的文异同字,内以容更全面
地了解呼吸生理学的 普遍规律。
家兔呼吸运动的调节实验报告

一、实验目的1. 观察家兔呼吸运动的生理变化,了解呼吸运动的调节机制。
2. 分析血液中化学因素(PCO2、PO2、[H])对家兔呼吸频率、节律、通气量的影响及调节机制。
3. 探讨迷走神经在家兔呼吸运动调节中的作用。
二、实验原理呼吸运动是呼吸肌在神经系统控制下进行的有节律的收缩和舒张造成的。
呼吸中枢分布于大脑皮层、间脑、桥脑、延髓、脊髓等部位,各级部位相互配合,共同完成呼吸节律性运动。
呼吸运动受体内、外各种因素影响,如血液中CO2分压、PO2、[H]等化学因素,以及迷走神经、肺牵张反射等神经调节机制。
三、实验材料与仪器1. 实验动物:家兔2. 实验仪器:兔体手术台、常用手术器械、张力传感器、引导电极、计算机采集系统、气管插管、注射器、橡皮管、20%氨基甲酸乙酯、生理盐水3. 实验试剂:20%氨基甲酸乙酯、生理盐水四、实验方法与步骤1. 麻醉与固定:将家兔置于兔体手术台上,用20%氨基甲酸乙酯进行麻醉。
待家兔麻醉后,将其背位固定在手术台上。
2. 气管插管:在颈部切开皮肤,分离气管,插入气管插管,连接呼吸传感器。
3. 分离迷走神经:在颈部分离双侧迷走神经,穿线备用。
4. 记录呼吸运动:启动计算机采集系统,记录家兔呼吸频率、节律、通气量。
5. 观察血液中化学因素对呼吸运动的影响:a. 向气管插管内注入一定量的CO2,观察呼吸运动的变化;b. 向气管插管内注入一定量的生理盐水,观察呼吸运动的变化;c. 向气管插管内注入一定量的[H],观察呼吸运动的变化。
6. 观察迷走神经对呼吸运动的影响:a. 切断双侧迷走神经,观察呼吸运动的变化;b. 重新连接双侧迷走神经,观察呼吸运动的变化。
五、实验结果与分析1. 观察到在注入CO2后,家兔呼吸频率、节律、通气量均增加,表明CO2对呼吸运动具有促进作用。
2. 观察到在注入生理盐水后,家兔呼吸运动无明显变化,表明生理盐水对呼吸运动无明显影响。
3. 观察到在注入[H]后,家兔呼吸频率、节律、通气量均降低,表明[H]对呼吸运动具有抑制作用。
最新生理学实验:家兔呼吸运动的调节
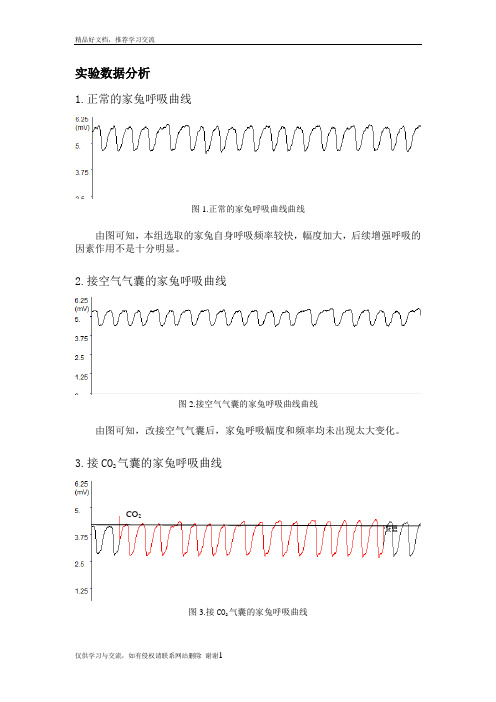
实验数据分析1.正常的家兔呼吸曲线图1.正常的家兔呼吸曲线曲线由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
2.接空气气囊的家兔呼吸曲线图2.接空气气囊的家兔呼吸曲线曲线由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
3.接CO2气囊的家兔呼吸曲线图3.接CO2气囊的家兔呼吸曲线CO2由图可知,接CO2气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO2浓度升高,血液中CO2浓度随之升高,CO2透过血脑屏障使脑脊液的CO2浓度也升高。
CO2与水反应生成H2 CO3,随后水解成HCO3-和H+,由H+刺激延髓化学感受器,间接作用于呼吸中枢,通过一系列调控使得呼吸作用加强。
此外,当CO2浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
4.接N2气囊的家兔呼吸曲线图4.接N2气囊的家兔呼吸曲线由图可知,接N2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N2时,因吸入气体中缺乏O2,肺泡气O2浓度下降,导致动脉血中O2浓度下降;而CO2浓度却基本不变(CO2扩散速度较快)。
随着动脉血中O2浓度下降,通过刺激主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌和肋间外肌活动加强,反射性引起呼吸运动增加。
5.增长解剖无效腔的家兔呼吸曲线图5.增长解剖无效腔的家兔呼吸曲线由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮气量,即每次的有效气体更新变小。
结果促使O2分压下降,CO2分压上升,使其反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。
兔子的呼吸运动的调节实验报告

兔子的呼吸运动的调节实验报告引言呼吸是生物体维持生命活动的基本过程之一。
呼吸运动的调节对于维持正常生理功能非常重要。
兔子作为常见的哺乳动物,其呼吸运动机制一直是研究的热点之一。
本实验旨在研究兔子的呼吸运动的调节过程,并探讨外界环境因素对呼吸运动的影响。
实验方法实验材料和设备•实验兔(6只)•注射器和针头•氧气供应系统•呼吸频率记录仪•麻醉剂实验步骤1.实验前准备:将实验兔置于实验舱中,使其适应环境。
准备好氧气供应系统和呼吸频率记录仪。
2.注射麻醉剂:使用注射器和针头给实验兔注射一定剂量的麻醉剂,使其进入麻醉状态。
3.观察呼吸运动:记录兔子在麻醉状态下的呼吸频率和呼吸深度,并观察呼吸运动的变化情况。
4.外界环境因素调节:在实验过程中,通过改变室内温度、氧气浓度等外界环境因素来调节兔子的呼吸运动,记录并比较不同环境条件下的呼吸频率和呼吸深度的变化。
5.数据记录和分析:将实验过程中观察到的数据记录下来,使用适当的统计方法进行数据分析,并绘制相应的图表。
实验结果与讨论实验数据显示,在麻醉状态下,兔子的呼吸频率较平时明显降低。
此外,呼吸深度也较平时有所减弱。
这可能是由于麻醉剂的作用导致兔子神经系统的抑制,进而影响了呼吸运动。
在外界环境因素调节下,实验结果显示温度的变化对兔子的呼吸运动有一定的影响。
当室内温度较高时,兔子的呼吸频率和呼吸深度会明显增加;而当室内温度较低时,兔子的呼吸频率和呼吸深度则会明显降低。
这说明温度是调节兔子呼吸运动的一个重要因素。
另外,实验结果还显示氧气浓度的变化也会对兔子的呼吸运动产生影响。
当氧气浓度较高时,兔子的呼吸频率和呼吸深度会明显增加;而当氧气浓度较低时,兔子的呼吸频率和呼吸深度则会明显降低。
这表明氧气浓度是调节兔子呼吸运动的另一个重要因素。
结论通过本次实验,我们了解到兔子的呼吸运动受到多种因素的调节。
其中,外界环境因素如温度和氧气浓度对兔子的呼吸频率和呼吸深度有明显的影响。
家兔呼吸运动的调节实验报告

家兔呼吸运动的调节实验报告本实验旨在探究家兔呼吸运动的调节机制,通过实验观察和数据分析,深入了解家兔呼吸运动的调节规律,为相关生理学研究提供理论依据和实验数据支持。
实验材料与方法。
1. 实验材料,健康的家兔若干只,呼吸频率计、呼吸深度计、心率监测仪等实验设备。
2. 实验方法,将家兔置于实验箱内,记录其正常呼吸状态下的呼吸频率和呼吸深度,并监测其心率。
接着通过不同方式的刺激(如运动、音响刺激等)观察家兔呼吸频率、呼吸深度和心率的变化情况。
实验结果。
1. 正常状态下,家兔的呼吸频率约为每分钟40-60次,呼吸深度约为每次10-15毫升,心率约为每分钟120-150次。
2. 运动刺激后,家兔的呼吸频率明显增加,呼吸深度也有所增加,心率也随之加快。
3. 音响刺激后,家兔的呼吸频率和呼吸深度均有所增加,但心率的变化不明显。
实验分析。
1. 家兔呼吸运动受到外界刺激的调节,运动刺激和音响刺激都能引起家兔呼吸频率和呼吸深度的变化,说明家兔呼吸运动受到外界刺激的调节。
2. 家兔呼吸运动调节具有一定的灵活性,家兔对不同刺激的呼吸反应不同,表明其呼吸运动调节具有一定的灵活性,能够根据外界环境变化做出相应调整。
实验结论。
家兔呼吸运动的调节受到外界刺激的影响,具有一定的灵活性,这为家兔在不同环境下适应生存提供了生理基础。
同时,本实验结果也为相关呼吸生理学研究提供了重要的实验数据支持。
结语。
通过本次实验,我们对家兔呼吸运动的调节机制有了更深入的了解,同时也为今后的相关研究提供了重要的实验基础。
希望本实验结果能够为相关领域的科研工作者提供参考,推动相关领域的研究进展。
生理学实验:家兔呼吸运动的调节
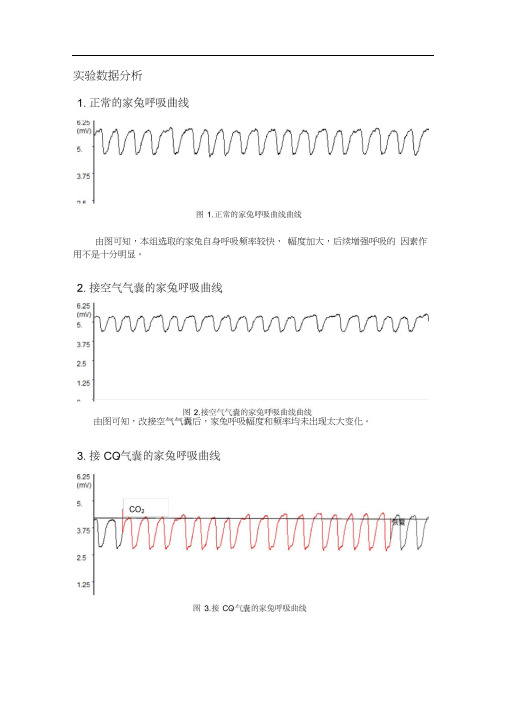
实验数据分析由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
由图可知,接CO气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2 是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO浓度升高,血液中CO 浓度随之升高,CO透过血脑屏障使脑脊液的CO浓度也升高。
CO与水反应生成HCO,随后水解成HCO-;:和H,由H刺激延髓化学感受器,间接作用于呼吸中枢,通过一系列调控使得呼吸作用加强。
此外,当CO浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
时,CO浓度却基本不变(CO T散速度较快)。
随着动脉血中Q浓度下降,通过刺激主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,加强,反射性引起呼吸运动增加。
由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮气量,即每次的有效气体更新变小。
结果促使Q分压下降,CO分压上升,使其反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。
由图可知,接N2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N2 因吸入气体中缺乏O,肺泡气Q浓度下降,导致动脉血中Q浓度下降;而隔肌和肋间外肌活动由图可知,向肺部吹气相当于使肺部发生扩张, 这种扩张刺激了气管平滑肌 的牵张感受器,冲动由迷走神经传入延髓,抑制吸气神经元,切断吸气,引起被 动呼气。
所以如果这次实验注入气体过久,气量过大,可能会使得呼吸停止在呼 气的位置。
实验结果也显示了由于增大肺部的体积引起的膈肌收缩力的减弱和呼 吸频率的减小。
家兔呼吸运动的调节实验报告

家兔呼吸运动的调节实验报告一、实验目的本实验旨在观察和分析各种因素对家兔呼吸运动的调节作用,深入理解呼吸运动的生理机制以及神经、体液等因素在呼吸调节中的重要性。
二、实验原理呼吸运动是呼吸肌节律性收缩和舒张所引起的胸廓有节律的扩大和缩小。
呼吸运动受神经和体液因素的调节。
神经调节主要包括迷走神经和交感神经,体液调节则包括血液中二氧化碳分压、氧分压和氢离子浓度等的变化。
三、实验材料与方法(一)实验材料1、实验动物:健康家兔 1 只,体重 20 25kg。
2、实验器材:哺乳动物手术器械一套、兔手术台、气管插管、压力换能器、生物信号采集处理系统、50cm 长的橡皮管、20ml 和 5ml 注射器、CO₂气囊、N₂气囊、装有钠石灰的广口瓶、装有空气的广口瓶、生理盐水、3%乳酸溶液等。
(二)实验方法1、家兔称重后,用 20%乌拉坦溶液(5ml/kg)于耳缘静脉缓慢注射麻醉。
将家兔仰卧固定于手术台上,剪去颈部手术部位的被毛。
2、颈部正中切开皮肤,分离气管并插入气管插管,通过压力换能器与生物信号采集处理系统相连,记录呼吸运动曲线。
3、分离双侧迷走神经,穿线备用。
4、观察并记录正常呼吸运动曲线。
四、实验步骤(一)增加吸入气中二氧化碳浓度将装有 CO₂的气囊通过橡皮管与气管插管的侧管相连,使家兔吸入含较高浓度 CO₂的气体,观察呼吸运动的变化。
(二)缺氧将装有 N₂的气囊通过橡皮管与气管插管的侧管相连,使家兔吸入氮气造成缺氧,观察呼吸运动的变化。
(三)增大无效腔将一段 50cm 长的橡皮管连接在气管插管的侧管上,增加无效腔,观察呼吸运动的变化。
(四)静脉注射乳酸溶液用 5ml 注射器经耳缘静脉缓慢注入 3%乳酸溶液 2ml,观察呼吸运动的变化。
(五)切断迷走神经分别切断双侧迷走神经,观察呼吸运动的变化。
然后再分别刺激切断后的迷走神经中枢端和外周端,观察呼吸运动的变化。
五、实验结果(一)增加吸入气中二氧化碳浓度当家兔吸入含较高浓度 CO₂的气体后,呼吸运动明显加深加快。
家兔呼吸运动的调节实验报告结果

家兔呼吸运动的调节实验报告结果一、实验目的观察各种因素对家兔呼吸运动的影响,从而了解呼吸运动的调节机制。
二、实验原理呼吸运动是一种节律性运动,其频率和深度受到神经和体液因素的调节。
肺牵张反射、化学感受器反射等在呼吸运动的调节中起着重要作用。
三、实验材料1、实验动物:健康家兔一只,体重 20 25kg。
2、实验器材:哺乳动物手术器械一套、BL-420 生物机能实验系统、压力换能器、呼吸流量换能器、保护电极、20ml 和 5ml 注射器、50cm 长的橡皮管、装有 CO₂和 O₂的气袋、2%乳酸溶液等。
四、实验步骤1、手术准备家兔称重后,用 20%乌拉坦溶液(5ml/kg)耳缘静脉注射麻醉。
将家兔仰卧固定于手术台上,剪去颈部的毛。
沿颈部正中作一长约 5 7cm 的切口,分离皮下组织和肌肉,暴露气管。
在气管下穿两根线,一根在气管下穿一“T”形切口,插入气管插管,并用线结扎固定。
分离一侧颈总动脉,插入动脉插管,通过压力换能器与 BL-420 生物机能实验系统相连,用于记录动脉血压。
分离出颈部两侧迷走神经,穿线备用。
2、实验项目记录正常呼吸运动曲线:将呼吸流量换能器与 BL-420 生物机能实验系统相连,记录家兔的正常呼吸运动曲线。
增加无效腔:将一段 50cm 长的橡皮管连接在气管插管的一侧,增加无效腔,观察呼吸运动的变化。
缺氧:将装有 N₂的气袋通过气管插管与家兔相连,观察呼吸运动的变化。
血中 CO₂增多:通过动脉插管向家兔动脉内注入 2%乳酸溶液 2ml,观察呼吸运动的变化。
切断迷走神经:先切断一侧迷走神经,观察呼吸运动的变化;然后再切断另一侧迷走神经,观察呼吸运动的变化。
五、实验结果1、增加无效腔当家兔的呼吸通道增加了 50cm 长的无效腔后,呼吸运动明显加深加快。
呼吸频率由正常的每分钟约 50 60 次增加到每分钟约 70 80 次,呼吸幅度也显著增大。
这是因为增加无效腔使肺泡通气量减少,导致血液中氧气分压降低和二氧化碳分压升高,刺激了外周化学感受器,反射性地引起呼吸加深加快,以增加肺泡通气量,补偿氧气的不足和排出过多的二氧化碳。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验数据分析
1.
正常的家兔呼吸曲线
由图可知,本组选取的家兔自身呼吸频率较快,幅度加大,后续增强呼吸的因素作用不是十分明显。
2.接空气气囊的家兔呼吸曲线
图2.接空气气囊的家兔呼吸曲线曲线
由图可知,改接空气气囊后,家兔呼吸幅度和频率均未出现太大变化。
3.接CO2气囊的家兔呼吸曲线
CO2
图3.接CO2气囊的家兔呼吸曲线
由图可知,接CO2气囊后,家兔呼吸曲线幅度增大,频率加快。
这是因为CO2是调节呼吸运动最重要的生理性因素,不但对呼吸有很强的刺激作用,而且对维
持延髓呼吸中枢正常兴奋活动是必须的。
当呼入气体中CO
2浓度升高,血液中CO
2
浓度随之升高,CO
2透过血脑屏障使脑脊液的CO
2
浓度也升高。
CO
2
与水反应生成
H 2CO
3
,随后水解成HCO3-和H+,由H+刺激延髓化学感受器,间接作用于呼吸中枢,
通过一系列调控使得呼吸作用加强。
此外,当CO
2
浓度增高时,还刺激主动脉体和颈动脉体的外周化学感受器,反射性地使呼吸加深加快。
4.接N2气囊的家兔呼吸曲线
图4.接N2气囊的家兔呼吸曲线
由图可知,接N
2气囊后,家兔呼吸曲线幅度略有增大。
这是因为吸入纯N
2
时,因吸入气体中缺乏O
2,肺泡气O
2
浓度下降,导致动脉血中O
2
浓度下降;而
CO
2浓度却基本不变(CO
2
扩散速度较快)。
随着动脉血中O
2
浓度下降,通过刺激
主动脉体和颈动脉体外周化学感受器延髓的呼吸中枢兴奋,隔肌和肋间外肌活动加强,反射性引起呼吸运动增加。
5.
增长解剖无效腔的家兔呼吸曲线
图5.增长解剖无效腔的家兔呼吸曲线
由图可知,增长解剖无效腔后,家兔呼吸幅度略有下降,而呼吸频率则稍稍上升,这是因为实验中通过插管的方式增大无效腔,也就是减小了进入肺泡的潮
气量,即每次的有效气体更新变小。
结果促使O
2分压下降,CO
2
分压上升,使其
反射性的调节使呼吸加深加快。
所以膈肌放电的变化幅度加大,频率有微量增大。
N2
反映到膈肌的收缩曲线,由于收缩频率的增大,为了维持正常的肺部通气量,所以收缩强度减弱。
6.家兔肺牵张反射曲线
吸气末抽出20mL空气
呼气末注入20mL空气
图6.家兔肺牵张反射曲线
由图可知,向肺部吹气相当于使肺部发生扩张,这种扩张刺激了气管平滑肌的牵张感受器,冲动由迷走神经传入延髓,抑制吸气神经元,切断吸气,引起被动呼气。
所以如果这次实验注入气体过久,气量过大,可能会使得呼吸停止在呼气的位置。
实验结果也显示了由于增大肺部的体积引起的膈肌收缩力的减弱和呼吸频率的减小。
而从肺部吸气造成了肺部的萎缩,信号通过迷走神经传入呼吸中枢的程度减弱,对于吸气神经元的抑制程度减小,就会引起吸气神经元发生兴奋,增加呼吸的强度。
实验图中显示了从开始抽气到这种变化恢复的过程。
出现了明显的呼吸强度的增大。
7.剪断两侧迷走神经的家兔呼吸曲线
剪断另外一侧迷走神经
剪断一侧迷走神经
图7.剪断两侧迷走神经的家兔呼吸曲线
由图可知,剪断两侧侧迷走神经时,呼吸强度和呼吸频率频率未出现明显变化,这是由于迷走神经为肺牵张反射的传入神经,参与呼气和吸气之间相互转化并维持呼吸的深度和频率。
剪断两侧迷走神经后,中断了肺牵张反射的传入通路,使肺牵张反射的生理作用减弱,出现吸气过深,呼吸频率变慢。
途中由于出现张力曲线的基线下移使得显示出的收缩曲线幅度没有多少变化。
8.刺激迷走神经的家兔呼吸曲线
图8.2V刺激迷走神经的家兔呼吸曲线
图9.1V刺激迷走神经的家兔呼吸曲线
由图可知,1V强度刺激侧迷走神经时,呼吸幅度明显下降,频率略有提高,这是因为刺激迷走神经后,冲动传入延髓抑制了吸气神经元的活动,使得吸气程度部分被抑制,一定程度上引起了被动的呼气,综合起来使得呼吸的速率提高,呼吸的强度减弱。
由于迷走神经的传入神经也是复合神经干,所以在一定范围内这种变化的程度和刺激强度有关。
所以在2V刺激迷走神经的图像中并未观察到规律性的变化。
9.剪断迷走神经后家兔的肺牵张反射曲线
图10.剪断迷走神经后家兔的肺牵张反射曲线
由图可知,剪断迷走神经后,向兔子肺部注射气体或抽取气体均无明显反应,这是因为由于迷走神经已经剪断,信号传不到中枢,也就成了无效信号,所以图中显示刺激前后没有变化。
(注:由于剪断了双侧迷走神经,机体失去了对呼吸的正常调节机制,所以呼吸速率和强度都无法回到正常水平。
)。
