(整理)西安交大 大学化学 第五章 课后答案
其他系统西安交通大学--物理化学所有答案

其他系统西安交通大学--物理化学所有答案只有广度性质才有偏摩尔量。
答案是:正确只受温度影响的平衡系统自由度F=C-ol理想气体从同一始态经过不同的循环途径后回到初始状态,其热力学能不变。
答案是:正确在体系温度恒定的变化中,体系与环境之间 C。
答案是:不一定产生热交换在绝热条件下,用肚于气筒内的压力迅速推动活塞压缩筒内的气体,此过程的熵变 C。
答案是:大于零在100°C和25°C之间工作的热机,其最大效率为D 。
答案是:02用1法拉第的电量可以从CuSO4溶液中沉淀出铜的质量为 C答案是:32g一级反应的半衰期与反应物的初始浓度A 。
答案是:无关液体在毛细管中上升逐是下降,主要 C因素有美。
答案是:液体是否淘湿毛细管下列哪种说法不正确: D答案是:催化剂不参与化学反应下列哪个封闭体系的内能和焓仅是温度的函数D答案是:理想气体下列定义式中,表达正确的是 B。
答案是:G=APV温度对光化反应速度的影响: D答案是:与热反应大不相同,温度的变化对光化反应速度的影响较小为了方便研究,常将统计热力学系统分为独立子系和相倚子系。
下面诸系统中属独立子系的是: C答案是:理想气体凸面液体的垉和蒸汽圧pr平面液体的垉和蒸汽圧p0相比较C答案是:pr> p0水的三相点的温度为B 。
答案是:273 16K若天空云层中小水滴的大小发生变化时,一定是: A答案是:大水滴变大,小水滴变小溶胶有三个最基本的特性,下列哪点不在其中B答案是:热カ学稳定性任何一个化学变化,下列因素中哪个能影响平衡常数的数值 B。
答案是:温度气体反应的碰撞理论的要点是: D答案是:一对反应分子具有足够的能量的迎面碰撞才能弓起反应。
某一电池反应,若算得其电池电动势为负值时,表示此电池反应是: B答案是:逆向进行某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为定值,此反应是: C答案是:零级反应离子独立运动定律适用于: C答案是:无限稀电解质溶液关于物质临界状态的下列描述中,不正确的是D答案是:临界温度越低的物质其气体越易液化关于熵的性质,下面的说法中不正确的是C答案是:熵变等于过程的热温商盖斯定律包含了两个重要问题,即D答案是:热力学第一定律及状态函数的基本特征分配定律不适用于:D答案是:溶质在一相中全部电离的系统对于实际气体,下面的陈述中正确的是C答案是:对于实际气体,范德华方程应用最广,并不是因为它比其它状态方程更精确对弯曲液面所产生的附加压力B答案是:一定不等于零对弯曲液面上的蒸气压的描述正确的是: C答案是:大于或小于平面液体的蒸气压等温等压下,在A和B组成的均相体系中,若A的偏摩尔体积随浓度的改变而增加,则B的偏摩尔体积将: B答案是:减小等概率原理只透用于: B答案是:处在平衡状志的孤立体系;当电池的电压小于它的开路电动势时,则表示电池在: A答案是:放电单一组分的过冷液体的化学势比其固体的化学势: A答案是:高表面张力是物质的表面性质,其值与很多因素有关,但是它与下列因素无关: D答案是:表面积表面活性物质溶于水时,关于溶液的表面张力和溶液表面的描述正确的是D答案是:表面张力显著降低,正吸附表面活性剂在结构上的特征是: D答案是:一定具有亲水基和憎水基101°C时,水在多大外圧下沸腾C答案是:。
分析化学第五章 习题参考答案

第五章 习题参考答案9 解:(1)因H 2C 2O 4·2H 2O 部分风化(失水),H 2C 2O 4有效质量增加,使实际消耗的NaOH 体积增加,故NaOH 浓度偏低。
用此NaOH 溶液测定某有机酸的摩尔质量时,实际消耗的NaOH 体积减小,会使结果偏高。
(2)因Na 2CO 3潮解,Na 2CO 3有效质量减小,使实际消耗的HCl 体积减小,故HCl 浓度偏高。
用此HCl 溶液测定某有机碱 的摩尔质量时,实际消耗的HCl体积增大,会使结果偏低。
14 解:(1)32110100.50.203.17%2989.0-⨯⨯⨯=⨯⨯VV 1=66mL(2) V 2=57mL(3)32310100.50.209.98%9684.1-⨯⨯⨯=⨯⨯VV 3=56mL17 解:CaO + 2HCl = CaCl 2 + H 2O 依CaO HCl A B CaO HCl M C M C b a T ⨯⨯⨯=⨯⨯⨯=--33/102110 所以0.005000=08.5610213⨯⨯⨯-HCl CC HCl =0.1783mol·L -1 1.000×0.2000=0.1783(1.000+V)V=0.1217L=121.7mL18 解:Na 2CO 3 + 2HCl = 2NaCl + H 2O+CO 2↑2:1:32=H Cl CO Na n n故32)(21CO Na HCl M CV m ⋅=V=20mL 时,g m 11.099.105102010.0213=⨯⨯⨯⨯=- 称量误差E r =%2.011.00002.0=±V=25mL 时,g m 13.099.105102510.0213=⨯⨯⨯⨯=- 称量误差E r =%2.013.00002.0=±32210100.50.205.60%10005.1-⨯⨯⨯=⨯⨯V19 解:C=105545.01000.099.105/5877.0/-⋅==L mol VMmNa 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑依H C l n :1:232=CO Na nC HCl ×0.02196:(0.02000×0.05545)=2:1解得:C HCl =0.1010mol•L -121解:MgCO 3 + 2HCl = MgCl 2 + H 2O + CO 2↑ NaOH + HCl = NaCl + H 2O 30.33NaOH C =36.40C HCl NaOH C =1.2C HCl 依H C l n :1:23=MgCO n 所以 (48.48×C HCl -3.83×1.2C HCl )×10-3:32.84850.1=2:1C HCl =1.000 mol•L -1NaOH C =1.2C HCl =1.2×1.000=1.200 mol•L -1 22解:(1)1000.05000.018.294/709.14/===VM m C mol•L -1(2) 6Fe 2+ + Cr 2O 72- + 14H + = 6Fe 3+ + 2Cr 3+ + 7H 2O依 T B/A = a/b 310-⨯A B M CFe O Cr K T/722 = 6722O C K r C ×e F M ×10-3 =6×0.1000×55.845×10-3=0.03351g·mL -1因 Cr 2O 72- ≌ 6Fe 2+ ≌ 3Fe 2O 332722/O Fe O Cr K T= 3722O C K r C ×32O F e M ×10-3 =3×0.1000×159.69×10-3=0.04791g·mL -1或:32722/O Fe O Cr K T =Fe O Cr K T/722·ee F O F M M 232=0.03351×845.55269.159⨯=0.04791g·mL -1 23解:1200.01000.146.36/00.1004374.03=⨯⨯-HClC mol•L -1(1) NaOH + HCl = NaCl + H 2O 依 T B/A = a/b 310-⨯A B M CNaOH HCl NaOH HCl M C T ⨯⨯⨯=-3/101=1×0.1200×10-3×40.00=0.004800 g·mL -1 (2) CaO + 2HCl = CaCl 2 + H 2OCaO HCl CaO HCl M C T ⨯⨯⨯=-3/1021=21×0.1200×10-3×56.08=0.003365 g·mL -1 24解:%47.3%10000.10055.105.6002017.03024.0%10010)(%1003=⨯⨯⨯⨯=⨯⨯⨯=⨯=-SHAcNaOH S HAc HAcm M CV m m ω25解:CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ HCl n :1:23=CaCO n(0.5100×50.00-0.4900×25.00)×10-3:1:209.100=mm=0.6631g ω=m/m s =0.6631/1.000=66.31%27解:依题意 ω=V%2NaOH + H 2C 2O 4 = Na 2C 2O 4 + 2H 2O 解法一:1:2:422=O C Na NaOH n n0.1018×V×10-3:1:204.90102=⨯⨯-V m sm S =0.4583g解法二:ω=%1021/3B sA B B sAB B s A V m M VC m M V bC a m m =⨯==-故g V M V C m B A B B s 4583.001.01004.901018.021%102133=⨯⨯⨯=⨯=-- 解法三:004583.01004.901018.0213422/=⨯⨯⨯=-O C H NaOH T g·mL -1%422422/V m VT m m sO C H NaOH sO C H =⋅==ω=⋅=%422/V VT m O C H NaOH S 100422/⨯O C H NaO H T =0.004583×100=0.4583g解法四:依题意01.0%1%%/422====VV VTO C H NaOH ω01.01004.901018.0213/%/422422=⨯⨯⨯==-SSO C H NaOH O C H NaOH m m T Tm S =0.4583g。
(完整版)分析化学第五版第五章课后习题答案(武大版)

第五章酸碱滴定法习题详解51写出下列溶液的臆子条件式.a.q(mol , L-^NH^c/mol -b.臼《med , L-^NaOH + fiCmol •c.幻(mol , L-^HiPO^c^mol - L-^HCOOHjd.0, 010 mol - L^1 FeCl,.W¥】s [NH:] + CH*] = [C「]一[OH「]或[NHT ] + [H+ ]=q + [OH 'Jb N*] + [H*]=[H£BOr] + [OH-]或E+[H+]=[压BOn+[Q]ire.[H+]=[HwPO「]+2[HFO:-]+3[PO「]+[HCO0—] + [QHrd. [H"] = EFUOH产]+2[FHOH律:]+[。
十]5-2计算下列各溶液的pH缱'岳0. LC mol * b. 0. 10 mol ■ L'^HiSOuc.0, 10 mol,L i三乙薜胺彳d, 5.0X10^mol • L7HC"孔 0. 20 mol - L』1H,FQ‘,【解I a, □由H R。
:.乾凡・ = 5・8X10T,£K.=0. It)X5. 8 X 10-ls^5. 8X 10'll> 1。
章.#=匚二氏项>Jg.所以可用最简式进行计碧, 、内a* o A[FT] =77^ = ( 70, 10X 5. 8X10-lc)niol •[广】=7, GX ICT'mol ・L-1pH= 5* 12上已知H3SO X的K,= 1.QX1G、一级离料完全,涪凌的质子条件式为[H+] = rSOf -J + [OH-]+^[S()i-l+r-f F凫铲f+r整理后得[H+T + KjH+]r[H+] — 2cK.2 =。
解方程得田+ ] = (c- K% ),+ 8瓦=『0. 10—0.01+ /(0. 10—0.0]>2+8><0.10X0.0i]mol ■ L~i L 2J=0.11 mol • L 1pH=0. 96c.已知三乙孵胺的Kb = 5. 8X 10-',cKb = 0. 10 X 5. 8 X 10-T = 5. 8 X 10_,>10K w, 100,所以可用最筒式进行计算.[OH-]= >/cK^=( ✓O. 10X5. 8X10~7)mol ・ L*!-2. 4 X 10-*mol • L~lpH =10. 38d.由于HCl浓度过低,因此不能忽略水解产生的H♦,溶液的质子条件为[H+]=c + [OHr整理后得= O解方程得= [5.0X10-'+ /〈5.0X107)2 士4X10-*=1. 3X 10~f mol • L~lpH = 6. 89e・ H3PO4的K、= 7. 6X1O-',K% = 6. 3X10-',K、= 4. 4Xl<r” ・因为cK.= 0.20X7.6 X10T>10K = 2X6.3X102^<Q05 •</0.20X7.6X10_, K 7.6X10 100,所以可用F式计算.[H・]2+K,[H+]—cK 气=0[H,A奇+序云="藉虹+把毛*+ 0 20X7. 6万3卜。
陕西西安交通大学附属中学高中化学第五章 化工生产中的重要非金属元素 (讲义及答案)及答案

陕西西安交通大学附属中学高中化学第五章化工生产中的重要非金属元素(讲义及答案)及答案一、选择题1.下列有关实验操作和现象及结论均正确的是A.A B.B C.C D.D【答案】D【详解】A.常温下浓硫酸有强氧化性,铝遇浓硫酸钝化,无法比较Al与Zn的活泼性,故A错误;B.比较元素的非金属性要比较最高价氧化物的水化物的酸性强弱,即根据HClO4酸性比H2CO3强,可判断出氯的非金属性大于碳,故B错误;C.向溶液X中先滴加稀硝酸,再滴加BaCl2,出现白色沉淀,该白色沉淀可能为氯化银或SO-,故C错误;硫酸钡,原溶液中可能含有银离子、亚硫酸根离子,不一定含有24NH+,故D正确;D.氨气能使湿润的红色石蕊试纸变蓝,则原溶液中一定含有4答案为D。
2.浓硫酸与下列物质反应(可以加热),既体现酸性、又体现氧化性的是( )A.铜B.炭C.五水硫酸铜D.氧化铜【答案】A【详解】A.铜与浓硫酸在加热条件下反应,生成硫酸铜、二氧化硫和水,浓硫酸表现酸性和强氧化性,A符合题意;B.炭与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水,浓硫酸表现强氧化性,B不符合题意;C.五水硫酸铜中加入浓硫酸,生成无水硫酸铜,浓硫酸表现吸水性,C不符合题意;D.氧化铜与浓硫酸反应,生成硫酸铜和水,浓硫酸表现酸性,D不符合题意;故选A。
3.能正确表示下列反应的离子方程式是( )CO-+2H+=CO2↑+H2OA.在稀盐酸中投入大理石粉末:23B.1mol氯气通入含1molFeBr2的溶液中:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-C.金属钠投入硫酸铜溶液中:2Na+Cu2+=2Na++CuHSO-D.过量SO2通入NaClO溶液中:SO2+ClO-+H2O=HClO+3【答案】B【详解】CO-的形式,A不正确;A.大理石的主要成分为CaCO3,难溶于水,不能改写成23B.0.5molCl2先与1molFe2+反应,另外0.5molCl2再与1molBr-反应,离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,B正确;C.金属钠投入硫酸铜溶液中,钠先与水反应,产物再与硫酸铜反应,而钠不能与Cu2+发生置换反应,C不正确;HSO-还会发生氧化还原反应,二者不能D.过量SO2通入NaClO溶液中,产物中HClO与3共存,D不正确;故选B。
有机化学第五章答案
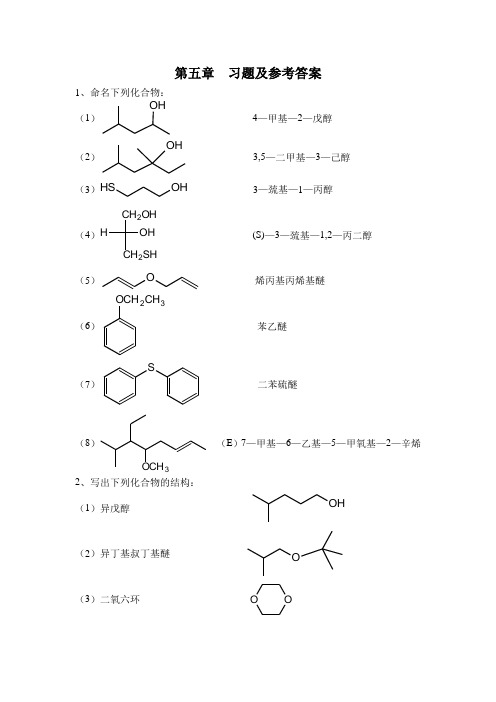
第五章 习题及参考答案1、命名下列化合物:(1)O H4—甲基—2—戊醇(2)O H3,5—二甲基—3—己醇(3)O H SH 3—巯基—1—丙醇(4)H O H CH 2OHCH 2SH(S)—3—巯基—1,2—丙二醇 (5)O烯丙基丙烯基醚(6)OCH 2CH3苯乙醚(7)S二苯硫醚(8)OCH3(E )7—甲基—6—乙基—5—甲氧基—2—辛烯2、写出下列化合物的结构:(1)异戊醇O H(2)异丁基叔丁基醚O(3)二氧六环 O O(4)DMSOC H 3SC H 3O(5)THFO(6)环氧丙烷 O3、按沸点从高到低顺序排列下列化合物:(1)正丁醇(2)正戊醇(3)异丁醇(4)叔丁醇(5)四氢呋喃 (2)﹥(1)﹥(3)﹥(4)﹥(5) 4、用化学方法区别下列各组化合物: (1)正丁醇、仲丁醇、叔丁醇取三支试管分别加入三种化合物少许,分别加入几滴Lucas 试剂,立即变浑浊的是叔丁醇,放置片刻变浑浊的是仲丁醇,室温下无变化,加热后变浑浊的是正丁醇。
(2)1,4—丁二醇、1,2—丁二醇取两支试管分别加入硫酸铜溶液少许,滴加氢氧化钠溶液至有氢氧化铜沉淀生成,一只试管中加1,4—丁二醇,另一只试管中加1,2—丁二醇,能生成将蓝色溶液的是1,2—丁二醇,则另一个是1,4—丁二醇 (3)苄醇和苄基溴高锰酸钾酸性溶液,步骤略 (4)O(CH2CH 2OH)2C H 2C H O HO HC H 3同(2)5(1)CH 2CH 3CH3O H H SOCC HC H 3C H(2)H 3CH2(3)(CH 3)3CCH 2OH+B r H H 3C C H 2C H 3B rC H(4)+OIH O H+CH 3I (Imol)(5)+IH +CH 3I OCH3O H(6)O33(7)O3+OO H(8)O HC C C H 3PhPh O HPh H 2SO4PhC C C H Ph O(9)O HO(CrO 3 /(C 5H 5N)2)或(CrO 3 /H 2SO 4/H 2O)或(MnO2/C 5H 12)6、将下列化合物按水溶解度由大到小排列成序:(1)丙三醇 (2)正丁醇 (3)甲乙醚 (4)甲硫醚 (1)﹥(2)﹥ (3)﹥ (4) 7、解释下列现象: (1)CH 2OHH 2SO4++(2)(CH 3)3C C H O HC H 334(CH 3)3C C HC H 2+(CH 3)2CH CC H 2C H 3+(CH 3)2C=C(CH 3)2(3)CH2OH24175℃(4)O HO HC H3C H3H2SO4OC H3C H3解释:(1)CH2OHH2SO4+C H2O+HH-H2OCH2+重排+++-H++(2)+(CH3)3C C HO HC H385%H3PO4(CH3)2CH C C H2C H3(CH3)2C=C(CH3)2(CH3)3C C HO+C H3H H-H2O(CH3)3C C H+C H3重排C H3C+C HC H3C H3C H3-H+(CH3)3C C H C H2-H+(3)+CH 2OHH 2SO4175℃CH 2O +H 2-H 2OCH2+-H +(4)+O H O HC H 3C H3H 2SO4OC H 3O H OH2+C H 3C H 3-H OO HC H 3C H 3重排3O +C H 3C H H-H +8、写出环氧丙烷与下列试剂反应的主要产物:(1)无水HBr (2)(CH 3CH 2)2NH (3)CH 3CH 2ONa/CH 3CH 2OH (4)CH 3CH 2MgBr (5)CH 3CH 2OH/H + (6)PhOH/OH -O(CH CH )NH3CH 2ONa/CH 3CH 2OHCH 3CH 2MgBrCH 3C H 3C B r C H 3O HC H 3COCH 2CH3C H 3O HC H 3C HC H 2O HC H 3C HC H 2OMgBrC H 2C H 3C H 3C HC H 2O HN(CH2CH 3)2C H 3C HC H 2O HOCH 2CH39、用指定原料合成:(1)由叔丁醇和乙醇合成乙基叔丁基醚C H 3C H 2O H H 3C H 2IC H 3CO HC H 3C H 3NaC H 3CO C H 3C H 3NaC H 3CO C H 3C H 3Na +C H 3C H 2IC H C H O HH 3COC H 3C H 3C 2H 5(2)由正丙醇和异丙醇合成2—甲基—2—戊醇C H 2C H 2O HC H 3C H 3C H O HC H 34C H 3C C H 3O+C H 2C H 2B C H 3Mg无水醚C H 2C H 2MgBrC H 3C H 3C C H 3O C H 2C H 2MgBrC H 3C H 3CC H 2C H 3C H 2C H 3OMgBr2C H 3C C H 2C H 3C H 2C H 3O H(3)由溴苯和异丙醇合成2—苯基—2—丙醇C H 3C H O HC H 34C H 3C C H 3O+Mg C H 3C C H 3O C H 3CC H 3OMgBr 2B rTHFMgBrMgBrC H 3CC H 3O H(4)由环己醇合成二环己醚+O HB rH B rO NaO N aB rO N aHO10、用高碘酸分别氧化四个邻二醇,得到的氧化产物如下: (1)只得到C H 3C C H 2C H 3O(2)得到CH3CHO 和CH3CH2CHO (3)得到HCHO 和C H 3C C H 3O(4)得到一个二羰基化合物C H 3C C H 2OC H 2C H 2CHO请根据氧化产物分别写出四个邻二醇的结构式。
西安交通大学《大学化学》第五章 期末考试拓展学习5

西交《大学化学》第五章原子结构原子结构原子结构:原子是由原子核和电子构成。
原子核由质子和中子构成,而质子和中子由三个夸克构成。
电子的质量为(乘以10的负31 次方)千克,而质子和中子的质量分别是电子的1836倍和1839倍。
原子结构的发现史:从英国化学家和物理学家道尔顿( Dalton ,1766~1844)(右图)创立原子学说以后,很长时间内人们都认为原子就像一个小得不能再小的玻璃实心球,里面再也没有什么花样了。
从1869年德国科学家希托夫发现阴极射线以后,克鲁克斯、赫兹、勒纳、汤姆逊等一大批人科学家研究了阴极射线,历时二十余年。
最终,汤姆逊(Joseph John Thomson)发现了电子的存在(请浏览科技园地“神秘的绿色荧光”)。
通常情况下,原子是不带电的,既然从原子中能跑出比它质量小1700倍的带负电电子来,这说明原子内部还有结构,也说明原子里还存在带正电的东西,它们应和电子所带的负电中和,使原子呈中性。
原子中除电子外还有什么东西? 电子是怎么待在原子里的? 原子中什么东西带正电荷? 正电荷是如何分布的? 带负电的电子和带正电的东西是怎样相互作用的? 一大堆新问题摆在物理学家面前。
根据科学实践和当时的实验观测结果,物理学家发挥了他们丰富的想象力,提出了各种不同的原子模型。
行星结构原子模型1901年法国物理学家佩兰(Jean Baptiste Perrin,1870-1942)(左图)提出的结构模型,认为原子的中心是一些带正电的粒子,外围是一些绕转着的电子,电子绕转的周期对应于原子发射的光谱线频率,最外层的电子抛出就发射阴极射线。
中性原子模型1902年德国物理学家勒纳德(Philipp Edward Anton Lenard,1862—1947)(右图)提出了中性微粒动力子模型。
勒纳德早期的观察表明,阴极射线能通过真空管内铝窗而至管外。
根据这种观察,他在1903年以吸收的实验证明高速的阴极射线能通过数千个原子。
西安交通大学《大学化学》第五章 期末考试拓展学习2

西交《大学化学》第五章原子结构1、光谱光谱是复色光经过色散系统(如棱镜、光栅)分光后,被色散开的单色光按波长(或频率)大小而依次排列的图案。
2、光电效应光电效应是指某些金属受光照射时发射电子的现象。
3、测不准原理不能同时有确定的位置和动量-测不准原理。
4、主量子数(n)含义:(1)描述电子层离核的远近;(2)描述电子层能量的高低。
取值:取零以外的正整数,其中每一个数代表一个电子层(主层)。
5、角量子数(l)含义:(1)在多电子原子中与n一起决定电子亚层的能量,l值越小,亚层能量越低。
(2)每一个l值决定电子层中的一个亚层;(3)每一个l值代表一种电子云或原子轨道的形状。
取值:l从0到(n-1)的正整数6、磁量子数(m)含义:描述原子轨道或电子云在空间取向。
取值:受l限制,可取-l,-2,-1,0,1,2,+l(即0,±1±2…±l)7、自旋量子数(ms)含义:描述核外电子的自旋状态(绕电子自身的轴旋转运动)。
取值:±1/28、电子云电子云是电子出现概率密度的形象化描述。
9、屏蔽效应定义:多电子原子中,内层电子对外层电子的排斥,相当于核电荷对外层电子引力的减弱,这种现象叫做内层电子对外层电子的屏蔽作用。
其它电子对选定电子的屏蔽作用的效果叫屏蔽效应。
10、有效核电荷有效核电荷——被屏蔽效应降低后所剩余的核电荷称为有效核电荷,用Z*=Z-σ表示。
11、钻穿效应定义:由于角量子数l不同,几率的径向分布不同,电子钻到核附近的几率不同,因而能量不同的现象,称为电子的钻穿效应。
12、最低能量原理最低能量原理:电子在核外排列应尽先分布在低能级轨道上, 使整个原子系统能量最低。
13、Pauli不相容原理Pauli不相容原理:每个原子轨道最多容纳两个自旋方式相反的电子。
14、Hund 规则Hund 规则:在n 和l 相同的轨道上分布的电子,将尽可能分占m 值不同的轨道, 且自旋平行。
化学选修5课后习题答案

化学选修5课后习题答案
一、选择题
1. 单选题:根据题目所给的选项,选择最符合题意的答案。
例如,如
果题目是关于化学反应速率的决定因素,正确的答案可能是“温度”
或“催化剂”。
2. 多选题:在多选题中,可能有多个正确选项。
确保仔细阅读题目要求,并选择所有适用的选项。
二、填空题
1. 概念填空:根据化学概念或原理,填写空缺处。
例如,如果空缺处
需要填写一种常见的有机溶剂,可以填写“乙醇”。
2. 数据填空:在需要填写数据或化学式的地方,确保使用正确的化学
符号和数值。
三、简答题
1. 描述化学反应:简述题目中所要求的化学反应过程,包括反应物、
生成物以及反应条件。
2. 解释化学原理:对题目中提到的化学原理进行解释,例如平衡常数、酸碱理论等。
四、计算题
1. 化学计量计算:根据题目所给的化学方程式,计算反应物或生成物
的量。
2. 溶液浓度计算:使用摩尔浓度公式计算溶液的浓度或稀释后的浓度。
五、实验题
1. 实验操作步骤:列出实验的步骤,包括准备、操作和结果分析。
2. 实验结果分析:根据实验数据,分析实验结果,解释可能的误差来源。
六、论述题
1. 论述化学现象:对题目中提到的化学现象进行详细论述,包括原因、过程和影响。
2. 提出化学观点:结合化学知识,提出自己的观点,并给出合理的解
释和论证。
请注意,以上内容仅为模板,具体习题答案需要根据实际习题内容来
编写。
如果需要针对特定习题的答案,请提供具体的习题内容。
有机化学课后习题及答案(第五章)

5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。
大三化学第五章答案

第五章思考题与习题1.写出下列各酸的共轭碱:H2O,H2C2O4,H2PO4-,HCO3-,C6H5OH,C6H5NH3+,HS-,Fe(H2O)63+,R-NH+CH2COOH.答:H2O的共轭碱为OH-;;H2C2O4的共轭碱为HC2O4-;H2PO4-的共轭碱为HPO42-;HCO3-的共轭碱为CO32-;;C6H5OH的共轭碱为C6H5O-;C6H5NH3+的共轭碱为C6H5NH2;HS-的共轭碱为S2-;Fe(H2O)63+的共轭碱为Fe(H2O)5(OH)2+;R-NH2+CH2COOH的共轭碱为R-NHCH2COOH。
2. 写出下列各碱的共轭酸:H2O,NO3-,HSO4-,S2-,C6H5O-,C u(H2O)2(OH)2,(CH2)6N4,R—NHCH2COO-,COO-C O O-。
答:H2O的共轭酸为H+;NO3-的共轭酸为HNO3;HSO4-的共轭酸为H2SO4;S2的共轭酸为HS-;C6H5O-的共轭酸为C6H5OHC u(H2O)2(OH)2的共轭酸为Cu(H2O)3(OH)+;(CH2)6N4的共轭酸为(CH2)4N4H+;R—NHCH2COO-的共轭酸为R—NHCHCOOH,COO-C O O-的共轭酸为COO-C O O-H3.根据物料平衡和电荷平衡写出(1)(NH4)2CO3,(2)NH4HCO3溶液的PBE,浓度为c(mol·L-1)。
答:(1)MBE:[NH4+]+[NH3]=2c; [H2CO3]+[HCO3-]+[CO32-]=cCBE:[NH4+]+[H+]=[OH-]+[HCO3-]+2[CO32-]PBE:[H+]+2[H2CO3] +[HCO3-]=[NH3]+[OH-](2)MBE:[NH4+]+[NH3]=c; [H2CO3]+[HCO3-]+[CO32-]=cCBE:[NH4+]+[H+]=[OH-]+[HCO3-]+2[CO32-]PBE:[H+]+[H2CO3]=[NH3]+[OH-]+[CO32-]4.写出下列酸碱组分的MBE、CEB和PBE(设定质子参考水准直接写出),浓度为c (mol·L-1)。
分析化学(高教第五版)课后习题第五章答案(整理排版4页)

第五章 习题5.1计算pH=5时EDTA 的酸效应系数αY(H)。
若此时EDTA 各种存在形式的总浓度为0.0200mol ·L -1,则[Y 4-]为多少?答案:(1)EDTA 的61~K K :1010.26,106.16,102.67,102.0,101.6,100.961~ββ:1010.26,1016.42,1019.09,1021.09,1022.69,1023.59pH=5.0时:()[][][][][][]66554433221H Y H H H H H H 1ββββββ++++++++++++=α=1+105.26+106.42+104.09+101.09+10-2.31+10-6.41=106.45(2)[Y 4-]=45.610020.0=7.1×10-9mol ·L -15.2 pH=5时,锌和EDTA 配合物的条件稳定常数是多少?假设Zn 2+和EDTA 的浓度皆为10-2 mol ·L -1(不考虑羟基配位等副反应)。
pH=5时,能否用EDTA 标准溶液滴定Zn 2+?答案: 查表5-2: 当pH=5.0时,lg αY(H)=6.45,Zn 2+与EDTA 浓度皆为10-2mol ·L -1, lgK ’=lgK 稳- lg αY(H)=16.50-6.46=10.05﹥8,可以滴定。
5.3假设Mg 2+和EDTA 的浓度皆为10-2 mol ·L -1,在pH=6时,镁与EDTA 配合物的条件稳定常数是多少(不考虑羟基配位等副反应)?并说明在此pH 条件下能否用EDTA 标准溶液滴定Mg 2+。
如不能滴定,求其允许的最小pH 。
答案: (1)查表5-2: 当pH=6.0时,lg αY(H)=4.65,lgK ’=lgK 稳- lg αY(H)=8.69-4.65=4.04, lgK ’﹤8, ∴不能滴定(2)lg αY(H)= lgK 稳-8=0.69,查表5-2得pH ≈9.6。
西安交通大学第二附属中学南校区高中化学选修三第五章《合成高分子》测试题(有答案解析)

一、选择题1.(0分)[ID:141326]化学与生产、生活密切相关,下列说法不正确...的是A.工业上铝、铁、铜等一般通过热还原法冶炼B.FeCl3溶液可用于蚀刻铜制电路板C.地沟油经过加工处理后可用来制生物柴油D.加热能杀死流感病毒是因为蛋白质受热变性2.(0分)[ID:141310]化学与生产、生活、科技、环境等密切相关。
下列说法正确的是A.我国自主研发的“龙芯4000系列”CPU芯片与光导纤维是同种材料B.“复兴号”高铁车厢连接处使用的增强聚四氟乙烯板属于有机高分子材料C.古人煮沸海水制取淡水,现代可通过向海水加入明矾实现海水淡化D.用75%的医用酒精杀死新型冠状病毒,是利用了酒精的强氧化性3.(0分)[ID:141305]2020年5月5日我国成功发射了长征五号B运载火箭。
科学家通过远程操控在火箭运送的新一代载人飞船中完成了我国首次太空3D打印实验。
下列叙述错误的是A.火箭助推剂中的煤油属于混合物B.硅单质可以用于制作飞船上的太阳能电池板C.太空3D打印实验的原材料碳纤维属于有机高分子材料D.火箭采用的高强度新型钛合金构件,属于金属材料4.(0分)[ID:141298]线型PAA()具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。
网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。
其部分结构片段如图所示,下列说法不正确...的是A.线型PAA的单体不存在顺反异构现象B.形成网状结构的过程发生了缩聚反应C.交联剂a的结构简式是D.PAA的高吸水性与-COONa有关5.(0分)[ID:141296]某高聚物的结构片段为-CH2-CH=CH-CH2-CH2-CH2-,该高聚物的单体是A.己烯B.乙烯和乙炔C.乙烯和正丁烯D.乙烯和1,3-丁二6.(0分)[ID:141287]为了减少白色污染,科学家合成了PLA塑料,其结构片段如图所示(图中表示链延长)。
分析化学武大五版第五章答案

1.写出下列溶液的质子条件式。
a.c1 mol·L-l NH3 + c2 mol·L-l NH4Cl;c.c1 mol·L-l)H3PO4 + c2 mol·L-l HCOOH;解:a. 对于共轭体系,由于构成了缓冲溶液,所以可以将其视为由强酸(HCl和弱碱(NH3)反应而来,所以参考水准选为HCl, NH3和H2O 质子条件式为:[ H+ ] + [NH4+] = [Cl-] + [OH-]或[ H+ ] + [NH4+] = c2 + [OH-]c. 直接取参考水平:H3PO4 , HCOOH , H2O质子条件式:[H+] = [H2PO4-] + 2[HPO42-] + 3[PO43-] + [HCOO-]+[OH-]3.计算下列各溶液的pH。
a.0.050 mol·L-l NaAc;c.0.10 mol·L-l NH4CN;e.0.050 mol·L-l氨基乙酸;g.0.010 mol·L-l H2O2液;i.0.060 mol·L-l HCI和0.050 mol·L-l氯乙酸钠(ClCH2COONa)混合溶液。
解:a.对于醋酸而言,Kb = Kw / Ka = 5.6 ⨯ 10-10应为cKb = 5.6 ⨯ 10-10⨯ 5 ⨯10-2 = 2.8 ⨯ 10-11> 10Kwc/Kb> 100 故使用最简式;[OH -] = 105.6100.05-⨯⨯ = 5.29⨯ 10-6pH = 14 – pOH = 8.72 c. NH 4+ K a ’ = 5.6 ⨯ 10-10 HCN K a = 6.2. ⨯ 10-10 cK a ’ > 10K w c > 10 K a 由近似公式可以得到:[H +] = 'a a K K = 206.2 5.610-⨯⨯ = 5.89⨯ 10-10pH = 10 – 0.77 = 9.23e. 氨基乙酸一端羧基显酸性,一端氨基显碱性,K a1 = 4.5⨯ 10-3 , K a2 = 2.5 ⨯ 10-10c/K a2> 100 且c > 10 K a1 所以[H +] =12a a K K =134.2 2.510-⨯⨯ = 1.06 ⨯ 10-6pH = 6-0.03 = 5.97g. 对于双氧水而言,K a = 1.8 ⨯ 10-12 cK a < 10K w c/K a > 100 所以可以计算氢离子浓度[H +] = a w cK K + = 14141.810110--⨯+⨯ = 1.67 ⨯ 10-7pH = 7 – 0.22 = 6.78i. 由于ClCH 2COONa + HCl = ClCH 2COOH + NaCl所以原溶液可以看成0.050mol/L 的ClCH 2COOH 和0.010mo/LHCl 的混合溶液设有x mol/L 的ClCH 2COOH 发生离解,则 ClCH 2COOH ClCH 2COO - + H +0.05-xx 0.01+x所以有(0.01)0.05x xx +- = K a = 1.4 ⨯ 10-3解得x = 4.4 ⨯ 10-3mol/L那么[H +] = 0.0144mol/L pH = -log [H +] = 1.845.某混合溶液含有0.10 mol ·L -l HCl 、2.0×10-4 mol ·L -l NaHSO 4和2.0×10-6 mol ·L -l HAc 。
基础化学智慧树知到课后章节答案2023年下西安交通大学

基础化学智慧树知到课后章节答案2023年下西安交通大学西安交通大学第一章测试1.在使用物质的量单位(mol)时,要注意基本单元的表示。
若n(H2O)=1.0mol,则n(1/2H2O) 的数值为()A: 3.0 mol B: 1.0 mol C: 2.0 mol D: 0.5 mol答案: 2.0 mol第二章测试1.对于非电解质稀溶液,其渗透浓度在数值上等于其质量摩尔浓度。
A:错 B:对答案:对2.临床上将葡萄糖溶液与溶液作为等渗溶液使用。
如将此两溶液以任意比例混合,则所得混合液也必然是等渗溶液。
A:对 B:错答案:对3.渗透浓度为的NaCl溶液和的葡萄糖溶液,它们的渗透压相等,则它们的物质的量浓度也相等。
A:错 B:对答案:错4.由于0 ℃的冰与0 ℃的NaCl溶液温度相同,所以该两相可以共存。
A:对 B:错答案:错5.难挥发非电解质稀溶液的沸点升高、凝固点降低均由溶液的蒸气压下降引起。
A:错 B:对答案:对6.无论溶质是电解质还是非电解质,凝固点降低值较小的溶液的渗透压一定低于凝固点降低值较大的溶液。
A:对 B:错答案:对7.由于苯比水易挥发,故在相同温度下,苯的蒸气压比水大。
A:错 B:对答案:对8.将相同质量的葡萄糖和甘油分别溶于1 L水中,则两溶液的△p1=△p2,△T b1=△T b2,p1=p2(T一定)。
A:对 B:错答案:错9.纯溶剂通过半透膜向溶液渗透的压力称为渗透压。
A:对 B:错答案:错10.渗透浓度均为的NaCl溶液和葡萄糖溶液,NaCl溶液的渗透压大。
A:对 B:错答案:错11.渗透压较高的溶液其物质的量浓度一定较大。
A:对 B:错答案:错12.下列方法最适用于测定蛋白质相对分子质量的是()A:沸点升高法 B:渗透压法 C:蒸气压下降法 D:凝固点降低法答案:渗透压法13.已知水的,测得某人血清的凝固点为-0.56 ℃,则该血清的渗透浓度为()A:506 mmol·L-1 B:301 mmol·L-1 C:560 mmol·L-1 D:408 mmol·L-1答案:301 mmol·L-114.已知苯的凝固点为5.35 ℃,。
西安交通大学《物理化学》第五章 期末考试拓展学习1

西交《物理化学》第五章 电化学一、有关电导、电导率、摩尔电导率的计算根据各个概念的定义进行计算,相对比较简单。
例如:时,·dm -3 KCl 水溶液的电导率为 ·m -1, 将此溶液充满电导池,测得其电阻为Ω。
若将该电导池改充以同浓度的某待测溶液,测得其电阻为2184Ω,试计算:(1)该电导池的电导池常数(2)待测液的电导率(3)待测液的摩尔电导率解:(1)该电导池的电导池常数Al k A l R 1==ρ )m (85.153.11214114.0/-1=⨯==R A l κ(2))m (S 10257.72184/85.15/)/(-13⋅⨯===-R A l κ(3二、电导率和摩尔电导率与浓度的关系?离子数 C ↑,离子数↑, κ↑κ离子运动速率 C ↑,离子运动速率↓, κ↓离子数 C ↑,离子数不变或↓Λm离子运动速率 C ↑,离子运动速率↓, Λm ↓摩尔电导率总是随着浓度的增大而减小。
浓度很稀时,强电解质的Λm 与C 接近线性。
)1(C m m β-Λ=Λ∞浓度很稀时,弱电解质的Λm 增大非常快。
无限稀释时,电解质完全电离,无强弱之分;摩尔电导率最大;电解质的摩尔电导率是正、负离子的简单加和(离子独立运动定律)。
∞-∞+∞+=Λ,,m m m λλ例如:NaCl, HAc, CaSO 4, Na 2SO 4, CaCl 2三、弱电解质的电离度和电离常数的计算-++→B A AB起始时 c 0 0平衡时 c(1-α) c α c αθθc c c c K /)1()/(2αα-= 例如:已知时,H +和Ac -的无限稀释摩尔电导率分别为×10-4S·m2·mol -1和 ×10-4 S·m2·mol -1 ,测得·dm -3 醋酸溶液在电导池常数为36.7m -1的电导池中的电阻为2220Ω,求该条件下醋酸溶液的电离度和电离常数52210868.10423.010423.001.01-⨯=-⨯=-=ααc K四、第一类电极 第二类电极 第三类电极第一类电极 由金属浸在含有该金属离子的溶液中所构成,并包括氢、氧气体电极、卤素电极和汞齐电极。
有机化学课后习题答案第五章

有机化学课后习题答案第五章5章思考题5.1 不饱和卤代烃根据卤原子与不饱和键的相对位置可以分为三类:丙烯基卤代烃,如CH3CH=CHX;烯丙基卤代烃,如CH2=CH-CH2X;孤立式卤代烃,如CH2=CHCH2CH2X。
5.2 S N 2和S N 1历程的区别是:S N 2反应是一步反应,攻击剂和离去基同时发生,而S N 1反应是两步反应,先发生离去基的离去,然后攻击剂才进攻。
5.3 溶剂化效应是指在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用的现象。
5.4 温度对消除反应的影响是:增加温度可以提高消除反应的比例。
5.5 卤代芳烃在结构上的特点是:卤素连在sp2杂化的碳原子上,卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系,使得卤代芳烃的碳卤键与卤代脂环烃比较明显缩短。
5.6 对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度的原因是:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 芳卤中最能使苯环电子离域的卤原子是氟原子,因为氟原子电负性最高,能够更强烈地吸引苯环上的电子。
题5.1 化合物命名:1)3-溴-1-丙烯(2)苄基氯(3)4-甲基-5-溴-2-戊炔(4)2,2-二氟-1-丙醇(5)CF2Cl2(6)三碘甲烷(7)溴代环戊烷(8)2-氯-1-苯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)1,3-二溴苯甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.2 化合物构造式:1)CH2=CHCH2Br(2)C6H5CH2Cl(3)CH3C≡XXX(CH3)2Br(4)CH3CHBrCF2(5)CHCl2F(6)CHI3(7)C5H9Br(8)C6H5CH2CH2Cl(9)Cl2BrC10H18(10)C6H4BrCH2Br(11)CHClFCH2CHClCH3(12)CH3CHBrCH2CH2Cl5.3 反应式补全:1)XXX(水)→ XXX2)CH3CH2Br + KOH(醇)→ CH3CH2OH + KBr3)CH3CH2Br + Mg(乙醚)→ CH3CH2MgBr;CH3CH2MgBr + HC≡CH → CH3CH2CH2C≡CH4)CH3CH2Br + NaI/丙酮→ CH3CH2I + NaBr5)CH3CH2Br + NH3 → CH3CH2NH2 + HBr6)CH3CH2Br + NaCN → XXX NaBr7)CH3CH2Br + CH3C≡CNa → CH3CH2C≡CCH3 + NaBr 8)CH3CH2Br + AgNO3(醇)→ CH3CH2NO2 + AgBr9)CH3CH2Br + Na → CH3CH2Na + Br10)CH3CH2Br + HN(CH3)2 → CH3CH2NH(CH3)2 + HBr5.4 CH3CH2CH2Br与下列化合物反应的主要产物:1)KOH(水)→ CH3CH2OH2)KOH(醇)→ CH3CH2OH3)(A)Mg,乙醚;(B) (A)的产物+HC≡CH →CH3CH2CH2C≡CH4)NaI/丙酮→ CH3CH2I5)NH3 → CH3CH2NH26)NaCN → CH3CH2CN7)CH3C≡CNa → CH3CH2C≡CCH38)AgNO3(醇) → CH3CH2NO29)Na → CH3CH2Na10)HN(CH3)2 → CH3CH2NH(CH3)25.5 化学方法区别各组化合物:1)苯酚和苯甲醛:用FeCl3试剂检验,苯酚会出现紫色沉淀,而苯甲醛不会;2)苯胺和苯甲酰胺:用FeCl3试剂检验,苯胺会出现绿色沉淀,而苯甲酰胺不会;3)苯甲酸和苯甲酐:用NaHCO3试剂检验,苯甲酸会产生CO2气体,而苯甲酐不会产生;4)苯乙酮和苯乙烯:用Baeyer试剂检验,苯乙酮会产生深蓝色沉淀,而苯乙烯不会;5)苯酚和苯醇:用FeCl3试剂检验,苯酚会出现紫色沉淀,而苯醇不会。
西交《《大学化学》考查课试题()

西安交通大学15 年 7 月《《大学化学》考察课试题西安交通大学15 年 7 月《《大学化学》考察课试题西交《大学化学》在线作业单项选择题多项选择题判断题一、单项选择题(共18 道试题,共36 分。
)1.某氧化复原反响的标准吉布斯自由能变成,标准均衡常数为,标准电动势为,则以下对,,的值判断合理的一组是()A. >0,<0, >1B. >0,<0, <1C. <0,<0, >1D. <0,>0, <1----------------- 选择: B2.以下分子或离子中,键角最小的是( )A.HgCl2B.H2OC. NH3D. PH3----------------- 选择: C3.以下分子中心原子是 sp2 杂化的是 ( )A.PBr3B.CH4C.BF3D.H2O----------------- 选择: C4.以下溶液中沸点最高的是()A. 0.1 甘油B. 0.1 NaClC. 0.1 AlCl3D. 0.1 蔗糖----------------- 选择: C5.以下属于溶胶的特征的有()A.电泳现象B.粒径 >100nmC.布朗运动D.丁铎尔效应----------------- 选择: B6.在以下氧化复原电对中,值最大的是()(已知:(AgCl)×10-10(AgBr)×10-13(A gI ) =1.5 × 10-16 )A. Ag+ / AgB.AgCl /AgC.AgBr / AgD.AgI /Ag-----------------选择:7.以下函数均为状态函数的是()A.H, G,UB.U, S,QC.G, W,UD.G,S,W----------------- 选择:8.以下粒子的空间构型正确的有()A. SF4 (平面四边形)B. [Fe(CN)6]3-(正八面体形)C. Ag(NH3)2+(角形)D. ClO4-(正四周体)-----------------选择:9.以下分子中偶极矩不为零的是()l4B.NH3C.SF6D.BeCl2----------------- 选择:10.关于银锌电池: (-)Zn │ Zn2+(1mol L·-1) ‖Ag+(1mol·L-1)│ Ag(+),已知,=0.799V ,该电池的标准电动势为()A.B.C.D.----------------- 选择:11.有以下水溶液:(1) 0.01 mol ·L-1CH3COOH(2)0.01 mol ·L-1CH3COOH 溶液和等体积0.01 mol L-·1HCl 溶液混淆 (3) 0.01 mol L-1CH3COOH·溶液和等体积 0.01 mol L-·1NaOH 溶液混淆 (4) 0.01 mol L·-1CH3COOH 溶液和等体积0.01 mol ·L-1NaAc 溶液混淆则它们的pH 值由大到小的正确序次是( )A.(1)>(2)>(3)>(4)B.(1)>(3)>(2)>(4)C.(4)>(3)>(2)>(1)D.(3)>(4)>(1)>(2)----------------- 选择:12.同一温度下,反响的标准电极电势为,反响的标准电极电势为,则的标准电极电势为为()A.+B.×C.( 2+) /3D.(+) /3----------------- 选择:13. 298K 时,向 1L 0.1 的 HAc 溶液中,加入少许NaAc 晶体,则()A. HAc 的值减小B.溶液的值增添C.溶液的值减少D. HAc 的解离度不变-----------------选择:14.对钠,铝,磷,氯四种元素,随原子序数增添元生性质变化表达正确的有()A.第一电离能挨次增添B.最高氧化值挨次增大;C.原子半径挨次增大;D.电负性挨次增大;-----------------选择:15.以下结论正确的选项是 ( )A.当△ H>0 ,△ S<0 时,反响自觉进行B.当△ H<0 ,△ S>0 时,反响自觉进行C.当△ H<0 ,△ S<0 时,任何温度下均不自觉进行D.当△ H>0 ,△ S>0 时,任何温度下均不自觉进行-----------------选择:16.SO42- 离子的空间构型是 ( )A. 平面正方形B.三角锥形C.四周体D. 八面体-----------------选择:()17. 以下四个量子数正确的组合正确的选项是 A. n=3, l=-3, m=0, ms=0; B. n=4,l=3, m=-1, ms=+1/2; C. n=2, l=0, m=-1,ms=-1/2; D. n=3, l=2, m=2, ms=+1/2;-----------------选择:18.已知某反响 2A(g) == B(s) +C(g) 的 =100 ,当反响达到均衡时,以下举措能够使反响向正向挪动的是()A. 增添系统的温度B. 增添 A 物质的分压C. 增添 C 物质的分压D. 降低 A 物质的分压-----------------选择:西交《大学化学》在线作业单项选择题多项选择题判断题二、多项选择题(共8 道试题,共16 分。
分析化学课后习题答案(第五章)

2第五章酸碱滴定法【习题解答】1写出下列溶液的质子条件:1 1a. G(mol L )NH 3 C 2(mol L )NH 4CI直接参考水准:HCI,NH3和H2OPBE:[H ] [NH 4] [OH ] C 21 1b. C i (mol L )NaOH C 2(mol L )H 3BO 3直接取参考水准: NaOH , H 3BO 3, H 2OPBE :[ H ] c [OH ] [H 2BO 3]C i (mol L 屮3卩。
4 C 2(mol L 1)HCOOHc •直接取参考水准:H 3PO 4 , HCOOH , H 2O23PBE :[H ] [OH ] [H 2PO 4] 2[HPO 4 ] 3[PO 4 ] [HCOO ] d. O.imol L i FeCl 3直接取参考水准:Fe 3+,H 2OPBE:[H ] [OH ] [Fe(OH)2 ] 2[Fe(OH)2 ] 3[Fe(OH)3]2•计算下列各溶液的pH 。
a. 0.10 mol L -!H 3BO 3; c • 0.10mol L -l三乙醇胺e . 0.20 mol L -J H 3PO 4。
10-10, cK a =0.10 5.8 10 10 5.8 10 1110K wE 100所以可以用最简式进行计算。
[H +]= ci<0.10 5.8 10 10 7.6 10 6mol LpH=5.121.0 10 2, 一级离解完全。
溶液的质子条件式为整理后得:[H +]2 K a2[H ] c[H ] 2cK a2 0(C K a2) .(C K a2)2 8cK a22(0.10 0.01) (0.10 0.01)2 8 0.10 0.01 pH 0.96b. 0.10 mol L -1 H 2SO 4; d. 5.0 W -8 mol l_T HCl+ 2- ・[H ]=[SC 4 ]+[OH ]+c2-[SQ ]+c=cK a2 K a2 [H ]解:a.已知H 3BC 3的K a =5.8 b.已知H 2SQ 的K a2[H ]0.11mol Lc. 已知三乙醇胺的K a =5.8 10-7, cK b =0.10 5.8 10 7 5.8 10 8 10K w[H +]= .cKf0.050 5.5 10 10 5.24 10 6mol LpH=5.28c. NH 4+ Ka' = 5.6 10-10, HCN Ka = 6.2 M 0-10cK a ' > 10K w , c > 10 K a 由近似公式可以得到: 「K a K a62 5.6 1020 5.89 10 10mol Lc 0.10K b 5.8 10 100,所以可以用最简式进行计算[OH -]=「cK b0.10 5.8 10 7 2.4 10 4mol L pH=10.38d. 由于HCI 浓度过低,因此不能忽略水离解产生的H整理后得:[H + ]2 c[H ] K 0+,溶液的质子条件式为:[H + ]=[OH -]+c25.0 10 8.(5.0 10 8)2 4 10 141.3 10 7mol L 1pH6.89e 已知H 3PQ 的K a1=7.6 10-3, K a2=6.3 cK a1=0.207.6 10 10K w,K a210-13 -80.20 7.6 10 3,K ; pH=1.463•计算下列各溶液的 pH 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第5章电化学基础……问题1. 什么是氧化还原的半反应式?原电池的电极反应与氧化还原反应式有何关系?答:任何一个氧化还原反应都可以分写成两个半反应:一个是还原反应,表示氧化剂被还原;一个是氧化反应,表示还原剂被氧化。
即:还原反应:氧化态+n e-→ 还原态;氧化反应:还原态-n e-→氧化态这两个式子称为氧化还原的半反应式。
原电池的总反应是一个氧化还原反应,原电池的两个电极反应各乘以一个适当的系数后再加和起来,即得原电池总反应式……氧化还原反应式。
2. 原电池由那些部分组成?试分别叙述每一部分的作用。
答:原电池主要由以下几个部分组成:E正极得到电子,发生还原反应; 负极提供电子,发生氧化反应;●在双液电池中盐桥也必不可少,其作用是通过离子扩散来保持溶液的电中性,消除电极反应产生的过剩电荷的阻力,导通电流;❍导线是导通电流,确保反应持续进行。
3. 如何将一个在溶液中进行的氧化还原反应设计成原电池?答:E先将氧化还原反应分写成两个半反应:一个是还原反应,表示氧化剂被还原;一个是氧化反应,表示还原剂被氧化; 根据两个半反应的电对特点将其设计成电极,并用符号表示电极的组成;●确定正负极:氧化反应对应于阳极,即负极;而还原反应对应于阴极,即正极;❍不同的电解质间要用盐桥连接以减小液接电势。
例如:将反应2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+K2SO4+3H2O设计成原电池。
E氧化反应;SO32--ne-→ SO42- ●电极组成:(-) Pt| Na2SO4,Na2SO3还原反应:MnO4-+ne-→ Mn2+(+) Pt| KMnO4,MnSO4,H2SO4❍电池符号:(-)Pt| Na2SO4,Na2SO3‖KMnO4,MnSO4,H2SO4| Pt(+)4. 如何用符号表示一个原电池?写出原电池:Pt|H2|H+||Cl-|AgCl|Ag的电极反应及电池反应式。
答:用符号表示一个原电池的一般规则为:E负极在左,正极在右; 用“|”表示两相之间的相界面,用“||”表示盐桥;●溶液应注明浓度(mol∙L-1),气体应注明分压(kPa);❍从负极开始沿着电池内部依次书写到正极。
原电池:Pt|H2|H+||Cl-|AgCl|Ag的电极反应及电池反应如下:负极反应:H2-2e-→ 2H+阳极反应:AgCl +e-→ Ag +Cl-电池反应:H2 + 2AgCl = 2Ag + 2Cl-5. 何谓电极电势?怎样用这一概念解释原电池产生电流的原因?答:电极与溶液形成双电层达到动态平衡时,金属的电势E(金属)与溶液的电势E(溶液)之差称为电极电势,以符号E(M n+/M)表示。
即:E(M n+/M)= E(金属)-E(溶液)。
M n+/M表示组成该电极的氧化还原电对,如E(Zn 2+/Zn), E(Cu 2+/Cu)和E(Cl 2/C1-)等。
将两个电极电势不同的电极组成原电池时,原电池的电动势E≠0,电就会从电极电势高的电极(正极)自动地流向电极电势低的电极(负极),从而产生电流。
6. 什么叫标准氢电极?是否在所有温度下,其电极电势都为零?答:在298.15K时,把镀有铂黑的铂片插入含有1 mol∙L-1H +的溶液中,并不断用压力为100kPa纯H2气流通过Pt片,使之吸附H2达到饱和并发生电极反应。
如此构成的氢电极叫标准氢电电极。
标准氢电极的符号记为:H +(1 mol∙L-1)| H2(100kPa)|Pt。
目前国际上将标准氢电极作为标准参比电极,将其电极电势值规定为零,即:EӨ (H+/H 2) = 0.000V。
此值是在298.15K的条件下的规定值,当温度发生变化时其电极电势就不等于零。
具体数值可由能斯特公式求得,。
7. 怎样测定电极的标准电极电势?其符号和大小有何物理意义?答:标准电极电势EӨ (氧化态/还原态)数值的大小表示了反应:氧化态+ n e-还原态,在标准状态下进行的趋势,反映了电极的氧化态及还原态的氧化还原能力或倾向,即标准电极电势数值越大,氧化态得电子能力越强,是强的氧化剂;标准电极电势数值越小,还原态失电子能力越强,是强的还原剂;反之亦然。
标准电极电势的测定方法主要有两种:E氢标法:将待测标准电极与标准氢电极组成原电池,测定该原电池的电动势即标准电动势EӨ,由EӨ = EӨ(正)—EӨ(负)和EӨ (H+/H 2) = 0.000V可求得待测电极的标准电极电势EӨ (氧化态/还原态)的值。
例如,实验测EӨ(Zn2+/Zn)所用的标准原电池如下:(-)Zn|ZnSO4(1 mol∙L-1)|| H+(1 m ol∙L-1)|H2(100kPa)| Pt (+) 测得的标准电动势为EӨ = 0.7628V,由EӨ=EӨ(正)—EӨ(负)=EӨ(H+/H2)-EӨ(Zn2+/Zn)得:0.7628 =0.000 -EӨ(Zn2+/Zn)则得:EӨ(Zn2+/Zn)=-0.7628(V)参比电极法:标准电极电势也可用饱和甘汞电极作为参比电极来测量。
测量时将待测标准电极与饱和甘汞电极组成原电池,测定该原电池的电动势E,由E= E(正)—E(负)和E(Hg2Cl2/H g,饱和) = 0.2415V可求得待测电极的标准电极电势EӨ (氧化态/还原态)值。
8. 怎样利用电极电势来决定原电池的正、负极?计算原电池的电动势?判断氧化还原反应的方向?答: 比较两电对电极电势的代数值,电极电势代数值大的为正极,小者为负极。
原电池的电动势由E=E(正)—E(负)求得。
●按照反应方程式书写方式,在反应物一侧找出氧化剂和还原剂,令氧化剂对应的电对作原电池的正极,还原剂对应的电对作原电池的负极,若:E(氧化剂)>E(还原剂),则氧化还原反应从左→右自发进行;E(氧化剂)<E(还原剂),则氧化还原反应从右→左自发进行;E(氧化剂)=E(还原剂),则氧化还原反应达到了平衡态。
9. 在电化学中EӨ有那些应用?试分别说明之。
答:E判断在标准状态下氧化还原反应进行的方向; 判断氧化还原反应进行的程度。
10. Nernst方程式中有哪些影响因素?它与氧化态及还原态中的离子浓度、气体分压和介质的关系如何?答:浓度对电极电势的影响可由Nernst方程式表示:式中,n为电极反应中得失的电子数(摩尔);R = 8.314J∙mol-1∙K-1;F=96500 C∙mol-1(Faraday常数),[氧化态]、[还原态]表示电极反应中氧化态及还原态物质的相对浓度(c/cӨ)或相对分压(P/pӨ),并以电极反应中对应物质的系数为指数。
从该式可以看出,影响电极电势的主要因素有氧化态、还原态物质的浓度及反应系统的温度等。
[氧化态]越大,电极电势越高;[还原态]越大,电极电势越低;当电极反应中有氢离子H+或氢氧根离子OH-出现时,则介质的pH值对电极电势亦有影响,pH值越大,电极电势越低。
11. 查阅标准电极电势时,为什么既要注意物质的价态,又要注意物质的聚集状态和介质条件(酸碱性)。
答:因为物质的价态、聚集状态和介质条件(酸碱性)对电极电势都有影响,当其不同时,电极电势的值亦不同的。
12. 实验室中,为了保证FeSO4溶液不变质常给溶液中加入无锈铁钉。
试从有关电对的电极电势说明理由。
答:EӨ(Fe3+/ Fe2+)= 0.771,EӨ(O2/ H2O)= 1.229,EӨ(Fe3+/ Fe)= -0.037。
∵EӨ(O2/ H2O)>EӨ(Fe3+/ Fe2+),∴水溶液中的溶解氧能将Fe2+氧化成Fe3+而使FeSO4溶液变质。
又∵EӨ(Fe3+/ Fe2+)>EӨ(Fe3+/ Fe)∴当给溶液中加入无锈铁钉时,Fe能将Fe3+还原成Fe2+,从而保证了FeSO4溶液不变质。
13. 由标准锌半电池和标准铜半电池组成原电池:(-)Zn|ZnSO4(1mol∙L-1)||CuSO4(1mol∙L-1)|Cu(+)(1)改变下列条件对原电池电动势有何影响?(a)增加ZnSO4溶液的浓度;(b)在ZnSO4溶液中加入过量的NaOH;(c)增加铜片的电极表面积;(d)在CuSO4溶液中加入Na2S溶液。
(2)当铜锌原电池工作半小时以后,原电池的电动势是否会发生变化?为什么?答:(1)由Nernst方程式知:(a)增加ZnSO4溶液的浓度, E(Zn2+/Zn)增大,即E(负)增大。
又由E= E(正)—E(负),其他条件不变时,E(负)增大,使E减小。
(b)在ZnSO4溶液中加入过量的NaOH,则发生如下反应:Zn2++4OH-=ZnO22-+2H2O,使溶液中c(Zn2+)减小,E(负)减小,使E增大。
(c)增加铜片的电极表面积,对E(Zn2+)无影响,故E保持不变。
(d)在CuSO4溶液中加入Na2S溶液,则发生如下反应:Cu2++S2-=CuS(↓),使溶液中c(Cu2+)减小,E(正)减小,使E减小。
(2)当铜锌原电池工作半小时以后,原电池的电动势会降低。
因为随着电池反应的进行,正极电解质溶液中的c(Cu2+)减小,使E(正)减小;同时负极电解质溶液中的c(Zn2+)增大,使使E(负)增大,这两个方面产生的结果都使原电池的电动势E减小。
14. 什么叫浓差电池?它与一般化学电池有何不同?答:由不同浓度的同类电极组成的原电池称为浓差电池。
电池(—)Ag|AgNO3(0.01 mol∙L-1)||AgNO3(1 mol∙L-1)|Ag(+)就是一个例子。
该电池的正、负极均由Ag+/Ag电对组成,两电极的化学本性相同,只是c(Ag+)不同。
浓差电池与一般的化学电池相比有如下几点不同:浓差电池的正、负极均由同一电对组成,两电极的化学本性相同,只是某一物质的浓度或分压不同;而一般的化学电池,两极由不同电对组成,两电极的化学本性就不相同;浓差电池的电池反应即电池过程是浓度扩散过程,而一般的化学电池的电池反应是一个氧化还原反应;●浓差电池的标准电动势等于零,而一般的化学电池的标准电动势则等于零;❍浓差电池的电动势只与两极有关物质的浓度或分压有关;而一般化学电池的电动势则不但与两极有关物质的浓度或分压有关,而且还与两极的标准电极电势有关;15. 原电池和电解池在结构和原理上各有何特点?试举例说明(从电极名称、电极反应、电子流方向等方面进行比较)。
答:原电池是以氧化还原反应为基础将化学能转变为电能的装置,即借助原电池可将化学能转变为电能,利用化学反应产生电流;电解池则是借助于电流通过电解质溶液产生化学反应的的装置,即借助电解池由外界对系统作电功,在电流作用下发生化学反应,将电能转变成化学能。
二者的差异如下表所示:16.实际分解电压为什么高于理论分解电压?简单说明超电压(或超电势)的概念。
