物质对光的选择性吸收 - 江南大学教务处
分光光度法

分光光度法
分光光度法
分光光度法是根据物质对不同波长 的单色光的吸收程度不同而对物质 进行定性和定量的分析方法。
1.1 光的性质
光是一种电磁波: 1)波动性 波长λ、频率v、光速c、波数(cm-1)等参数。
c
v
2)粒子性(光量子) E = hv
1.2 物质对光的选择性吸收
A. 透过溶液后的光强度 B. 透过溶液后的吸收光强度
C. 入射光强度
D. 一定厚度溶液的颜色深浅
1.10 紫外-可见光谱法应用
1. 酸碱指示剂离解常数的测定 2. 配合物组成及稳定常数的测定 3. 化合物相对分子质量的测定
c样
A样 A标
c标
1.8 定性及定量分析方法
3)差示分光光度法 采用已知浓度的成分与待测溶液相同的溶 液作参比溶液。 高吸光度差示法 低吸光度差示法 极限精密差示法
1.8 定性及定量分析方法
(× )1. 在多组分的体系中,在某一波长下,如果各种
对光有吸收的物质之间没有相互作用,则体系在该 波长的总吸光度等于单个组分吸光度的和。
1.9 显色反应条件和测量条件的选择
1. 影响显色反应的因素及反应条件的选择 (1)显色剂的选择
1)选择性好 2)灵敏度高 3)有色化合物稳定、组成恒定 4)有色化合物与显色剂的颜色差别大
1.9 显色反应条件和测量条件的选择
(2)影响反应的因素及反应条件
1)显色剂的用量 2)溶液的酸度 3)显色时间 4)显色温度 5)溶剂 6)溶液中共存离子的干扰
维生素B12的水溶液在361nm处的E1%1cm值是207,盛 于1cm吸收池中,测得溶液的吸光度为0.456,计算
吸光光度法知识点

第九章吸光光度法知识点吸光光度法是基于分子对光的选择性吸收而建立的一种分析方法,包括比色法、紫外一可见吸光光度法、红外光谱法等。
1.吸光光度法的基本原理①物质对光的选择性吸收:当光照射到物质上时,会产生反射、散射、吸收或透射。
若被照射的物质为溶液,光的散射可以忽略。
当一束白光照射某一有色溶液时,一些波长的光被溶液吸收,另一些波长的光则透过,溶液的颜色由透射光的波长所决定。
吸收光与透射光互为补色光(它们混合在一起可组成白光)。
分子与原子、离子一样,都具有不连续的量子化能级,在一般情况下分子处于最低能态(基态)。
当入射光照射物质时,分子会选择性地吸收某些频率的光子的能量,由基态跃迁到激发态(较高能级),其能级差E激发态一E基态与选择性吸收的光子能量hv的关系为Hv=E激发态一E基态分子运动包括分子的转动、分子的振动和电子的运动。
分子转动、振动能级间隔一般小于1 eV,其光谱处于红外和远红外区。
电子能级间的能量差一般为1~20 eV,由电子能级跃迁而产生的吸收光谱位于紫外及可见光区,其实验方法为比色法和可见-紫外吸光光度法。
②吸收曲线:以波长为横坐标,以吸收光的强度为纵坐标绘制的曲线,称为吸收光谱图,也称吸收曲线。
它能清楚地描述物质对不同波长的光的吸收情况。
③光的吸收定律——朗伯一比尔定律:当一束平行单色光垂直通过一厚度为b、非散射的均匀吸光物质溶液时,吸光物质吸收光能,致使透射光强度减弱。
若用I。
表示入射光强度,I t表示透射光强度,I。
与I t之比称为透光率或透光度T,T=I。
/I t,吸光物质对光的吸收程度,还常用吸光度A表示,A=lgT=log I。
/I t。
实验证明,当一束平行单色光垂直照射某一均匀的非散射吸光物质溶液时,溶液的吸光度A与溶液浓度c和液层厚度b的乘积成正比,此即朗伯一比尔定律,其数学表达式为A=lgT=log I。
/I t =abc式中,a为吸收系数。
溶液浓度以g·L-1为单位、液层厚度以cm 为单位时,a的单位为L·g-1·cm-1。
第十三章 可见分光光度法和紫外分光光度法

标准曲线的偏离
引起偏离 Lambert-Beer 定律的原因有物理 因素和化学因素两大类。 (一)物理因素引起的偏离
1. 非单色光引起的偏离 假设入射光仅由波长为 λ 1 和
λ2 的两种单色
光组成, 其强度分别为 I01 和 I02 ,当通过浓度 为cB,厚度为d 的吸光物质溶液后,透射光的强 度分别为 I1 和 I2。
二、物质的吸收光谱
吸光度(A):测量溶液对不同波长的 单色光的吸收程度。 吸收曲线(或吸收光谱):以波长 λ 为横坐标,吸光度A为纵坐标作图,可 得一曲线,此曲线就是吸收曲线(或吸 收光谱)
以三(邻二氮菲)合铁(II)离 子的吸收光谱图为例,看看它的吸收光 谱: (1)、(2)(3)、 (4)的浓度逐渐增大
I0 = I a + It + I r
在分光光度法中,通常将被测溶 液和参比溶液分别置于两个材料和厚度 的吸收池中,因此上式可简化为:
I 0 = I a + It
透射光的强度It与入射光强度 I0之比称为透光率,用T表示:
It T= I0
透光率越大,溶液对光的吸收越少; 反之,透光率越小,溶液对光的吸收越 多。
讯号处理及显示器
1、光源
可见分光光度法是以钨灯作 光源。钨灯可发出320至3 200nm的 连续光谱,波长最适宜的波长范围 为360至1 000nm。
2、单色光器
单色光器由棱镜或光栅、狭缝和准直镜 等部分组成。 通过转动棱镜便可在出光 狭缝得到所需波长的单色 光。 所以混合光从空气进入棱镜后,便 按波长由长到短的顺序依次分散成为一个连 续光源。单色光器的作用就是将混合光分散 成一系列的单色光。
hν ≥ ∆E
不同物质的基态和激发态的能量差 不同,选择吸收光子的能量也不同,即 吸收的波长不同。光的能量与波长成反 比,波长越短,能量越高。
分光光度技术

3.吸收池
用于盛装试液的装置。吸收材料必须能够透过所测 光谱范围的光。一般可见光区使用玻璃吸收池,紫外光 区使用石英吸收池。 规格有0.5、1.0、2.0、5.0cm 等。
在高精度的分析测定中(紫外区尤其重要)吸收池 要挑选配对,因为吸收池材料的本身吸光特性以及吸收 池的光程长度的精度等对分析结果都有影响。
第六节 常见分光光度计
四、日本日立U2000紫外/可见分光光度计
吸收曲线图
0.300 0.200 0.100
400
500
600
第二节 光吸收的基本定律 Ir
Ia Io
It
设入射光,吸收光,透射光和反射光的强度依次为I o,I a,
I t,I r,则他们之间的关系为:
Io = Ia + It + Ir
T It Io
或 T % It 100% Io
T为透光度(transmittance)或透光率
一般情况,单独依靠紫外光吸收光谱不能决定一个未知
物质的结构,往往需要与红外、质谱等其它方法相配合。
第四节 分光光度计的基本构造
基本构造主要由光源、单色器、吸收池、检测器和显 示器五大部分组成。
光源 单色器 样品池 检测器
显示器
1.光源
在整个紫外光区或可见光区可以发射连 续光谱,具有足够的辐射强度、较好的稳定 性、较长的使用寿命。
生物技术实验常用研究技术
——分光光度技术
➢比色分析法:利用比较溶液颜色深浅的 方法来确定溶液中有色物质的含量。
➢用分光光度计进行比色分析的方法称为分 光光度法。
物质对光的选择性吸收
溶液为什么有颜色,其实质是什么?
实验证明,溶液的颜色是由于均匀分布在溶液中 的有色化合物的质点选择性的吸收了某种颜色的光所 造成的。
物质对光的吸收

物质颜色与吸收光颜色关系
/nm 400-450 450-480 480-490 490-500 500-560 560-580 580-610 610-650 650-780
吸收光颜色 紫
蓝 绿蓝 蓝绿
绿 黄绿
黄 橙 红
物质颜色 黄绿
黄 橙 红 红紫 紫 蓝 绿蓝 蓝绿
物质旳颜色与光旳关系
★ ① 溶液对可见光几乎全部吸收,则溶液不透光, 呈现黑色。
光谱示意
表观现象示意
完全吸收
黑色
物质旳颜色与光旳关系
★ ② 溶液对多种颜色旳光透过程度相同,则溶液 呈现无色透明。
光谱示意
表观现象示意
完全透过
无色透明
物质旳颜色与光旳关系
★ ③溶液只选择性旳吸收可见光中旳某一单色 光, 则溶液呈现它吸收光旳互补光。
增 大 C
课堂小结:
1、光旳分类 2、物质颜色旳形成 3、吸收曲线
课堂练习:
1、下列哪一种光旳波长可能为780nm( B )。 A. 黑色光 B.红外光 C.紫外光 D.红色光
2、硫酸镍溶液呈现绿色是因为吸收了哪一种光(C )。 A. 蓝色光 B. 黄色光 C. 紫红色光 D. 红色光
3、波长旳单位是 ( D ) A. m B. cm C. mm D. nm
蓝绿
绿 黄绿 黄
绿蓝
橙
蓝 紫 紫红 红
二、 物质颜色旳形成
物质旳颜色与光旳关系
物质旳颜色正是因为物质对不同波长旳光 具有选择性吸收作用而产生旳。当一束白光经 过某一溶液时,若溶液不吸收可见光,则白光 全部经过,溶液为无色透明;若溶液选择性地 吸收了某种颜色旳单色光,则它就呈现出被吸 收光旳互补光。例如,当白光经过KMnO4溶液 时,MnO4-选择地吸收了绿色光,所以KMnO4 溶液呈紫红色。
第章 紫外可见分光光度法

第11页,共36页。
二、Lambert-Beer定律 Lambert-Beer定律: A=kbc
K--吸光系数 b--吸光液层的厚度(光程), cm c--吸光物质的浓度, g L-1, molL-1
第12页,共36页。
吸光系数
吸光系数(K)
物质的性质 入射光波长 温度
与浓度无关,只是符号、取值与浓度 的单位相关
如:硒光电池:
金属膜
硒片
-
e-
+
铁片
第24页,共36页。
稳压电源
72型分光光度计结构图
钨灯
狭缝 反射镜
透镜
棱镜
G
检流计 硒光电池
狭缝
比色室
波长读数盘
反射镜 透镜
第25页,共36页。
二、定量分析方法
1、标准曲线法
取系列浓度标准溶液,测 定吸光度A,作吸光度A
对溶液浓度c的图,得过 坐标原点的直线。
¨ 光学因素 复色光引起
对Beer定律的偏离。
¨ 主观误差
两种不同吸光系数的混合 光对Beer定律的偏离
第31页,共36页。
二、提高测量灵敏度和准确度的方法
1、选择适当的显色剂 灵敏度高
选择性好 显色剂在测定波长处无明显吸收
反应生成的有色化合物组成恒定。
2. 选择合适的测定条件
(1)入射光波长的选择 一般选择λmax作为入射光的波长,但有干扰存在
第22页,共36页。
3、吸收池——比色皿
玻璃比色皿 用于可见光
石英比色皿 用于λ<400nm的紫外光
比色皿的质量要求:无色、透明、耐腐蚀、同一厚度的
透光率误差<5%。
0.5cm
1cm
仪器分析 第三章 紫外可见吸收光谱法

第三章紫外可见吸收光谱法1.定义2.紫外吸收光谱的产生3.物质对光的选择性吸收4.电子跃迁与分子吸收光谱第一节概述11. 定义根据溶液中物质的分子或离子对紫外、可见光谱区辐射能的吸收来研究物质的组成和结构的方法,包括比色分析法与分光光度法。
◆比色分析法:比较有色溶液颜色深浅来确定物质含量的方法。
◆分光光度法:使用分光光度计进行吸收光谱分析测量的方法。
2/紫外-可见波长范围:(真空紫外区)◆远紫外光区:10-200 nm;◆近紫外光区:200-400 nm;◆可见光区:400-780 nm。
◆O2、N2、CO2、H2O等可吸收远紫外区(60-200 nm)电磁辐射。
◆测定远紫外区光谱时,须将光学系统抽真空,并充入惰性气体。
◆准确:近紫外-可见分光光度法(200-780 nm)。
3/方法特点:◆仪器较简单,价格较便宜;◆分析操作简单;◆分析速度较快。
4/紫外可见吸收光谱:分子中价电子能级跃迁(伴随着振动能级和转动能级跃迁)。
2. 紫外可见吸收光谱的产生价电子的定义?AB 电磁辐射5/◆分子内部三种运动形式:电子相对于原子核的运动;原子核在其平衡位置附近的相对振动;分子本身绕其重心的转动。
◆分子具有三种不同能级:电子能级、振动能级和转动能级(量子化,具有确定能量值)。
◆分子内能:包括电子能量E e、振动能量E v、转动能量Er 。
2.1 电子跃迁与分子吸收光谱6/分子的各能级:◆转动能级能量差:0.005~0.05 eV,跃迁产生吸收光谱位于远红外区(远红外光谱或分子转动光谱)。
◆振动能级能量差:0.05~1 eV,跃迁产生吸收光谱位于红外区(红外光谱或分子振动光谱)。
◆电子能级能量差:1~20 eV。
电子跃迁产生的吸收光谱在紫外-可见光区(紫外-可见光谱或分子的电子光谱)。
7/8/◆电子能级间跃迁的同时,总伴随有振动和转动能级间的跃迁。
◆电子光谱中总包含有振动/转动能级间跃迁产生的若干谱线而呈现宽谱带(带状光谱)。
13 第十三章(分光光度法)

有一浓度为1.0 µg · mL - 1 Fe2+的溶液,以邻二氮菲 的溶液, 例 有一浓度为 显色后, 显色后,在比色皿厚度为 2 cm、波长 、波长510nm处测得吸光度为 处测得吸光度为 0.380,计算 透光率 ;(2) 吸光系数 ;(3) 摩尔吸光系数ε 。 透光率T; 吸光系数a; ,计算(1)透光率
动性、粒子性。 动性、粒子性。
E = h ⋅ν = h
c
λ
常数: (Planck常数:h=6.63× 10 -34 J · S ) 常数 ×
上式表明光的波长越短, 上式表明光的波长越短,或者说频率越 大,光的能量越高。 光的能量越高。
具有同一波长的光称为单色光 单色光。 ● 具有同一波长的光称为单色光。 (由具有相同能量的光子组成 由具有相同能量的光子组成) 由具有相同能量的光子组成 ● 不同波长组成的光称为复合光。 不同波长组成的光称为复合光。 复合光 ● 日常生活中肉眼所见到的 白光 , 如 日 日常生活中肉眼所见到的白光 白光, 等是由红、 光 等是由红 、 橙 、 黄 、 绿 、 青 、 蓝 、 紫等光按 适当的强度比例混合而成的, 是在400~750nm 适当的强度比例混合而成的 , 是在 范围的一种复合光。 范围的一种复合光。
I0 1 A = lg = lg = − lg T It T
若光全部透过溶液, 若光全部透过溶液,Io= It , A = 0 若全部被吸收, It = 0 , A = ∞ 若全部被吸收, 吸光度A是用来衡量溶液中 吸光度 是用来衡量溶液中 吸光物质对单色光 λ 的吸收程度 值越大, ,A值越大,其吸收程度越大; 值越大 其吸收程度越大; 反之亦然。 反之亦然。
UV-Vis主要用于分子的定量分析,但紫外光谱(UV) UV- 主要用于分子的定量分析, 和红外光谱( 为四大波谱之一, 和红外光谱(IR)为四大波谱之一,是鉴定许多化合
第八章 吸光光度法

对浓度作图时,应得到一条通过坐标原点的直线,该直线称 为标准曲线或工作曲线。在相同条件下测得试液的吸光度, 从工作曲线上就可以查得试液的浓度。但在实际工作中,常 常遇到偏离线性关系的现象,特别是在溶液浓度较高时,常 会出现标准曲线向上或向下弯曲产生负偏离或正偏离(p244, 图9-4)。
例如:CuSO4溶液由于吸收了580-600 nm的黄色光,呈 现的是与黄色呈互补色的蓝色。不同波长的光具有不同的颜 色,见P294,表9-1。
物质吸收了光子的能量由基态跃迁到较高能态(激发 态),这个过程叫做物质对光的吸收。
M(基态)+hυ → M*(激发态)
当照射光光子的能量hυ与物质的基态与激发态能量之差相等 时,即ΔE= hυ,才能发生吸收。
(2) 平衡效应、酸效ห้องสมุดไป่ตู้、溶剂效应 溶液中有色化合物的平衡移动会使最大吸收波长发生变化,
使工作曲线产生弯曲。溶液的酸度、溶剂会对有色化合物的 形成、分解等产生影响,而使吸收光谱的形状和最大吸收波 长发生变化,从而导致偏离。
§ 8-2 目视比色法及光度计的基本部件
一、目视比色法
用眼睛比较溶液颜色的深浅以测定物质含量的方法称为 目视比色法。常用的目视比色法是标准系列法。这种方法就 是使用一套由同种材料制成的、大小形状相同的平底玻璃管 (称为比色管),于管中分别加入一系列不同量的标准溶液 和待测液,在实验条件相同的情况下,再加入等量的显色 剂,稀释至一定刻度,然后从管口垂直向下观察,比较待测 液与标准溶液颜色深浅。若待测液与某一标准溶液颜色深度 一致,则说明两者浓度相等,若待测液介于两标准溶液之 间,则取两标准液平均值为待测液浓度。
光的吸收定律

• 解:依据朗伯-比尔定律
ቤተ መጻሕፍቲ ባይዱ
A
1.12
-1
-1
16.4L mol cm
bc
0.50 0.792 1000
1
100
58
• 【例题2-2】0.500g钢样溶解后, 以 Ag+作催化剂, 用过硫酸铵将试样中 的Mn氧化成高锰酸根, 然后将试样 稀释至250.00mL, 于540nm处, 用 1.00cm吸收池测得吸光度为0.393。 若高锰酸根在540nm处的摩尔吸收 系数为2025, 计算钢样中Mn的质量 分数。( Ar(Mn)=54.94 )
• 解:依据朗c伯-比尔A定律
b
• 因为Mn的浓度相当于MnO4-的浓度,所
以:
m(Mn)
M
(Mn)
c
250
M
(Mn)
A
1000
4b
(Mn) m(Mn) 100
0.500
54.94 0.393 100% 0.533% 0.500 4 20251.0
吸光度等于各组分吸光度的加和。
• 即: A总=A1+A2+A3+…+An
• τ%称为百分透射比或百分透光度 • τ%= τ×100
• A 、τ、τ%之间的关系
lg lg 1 lg 100 2 lg %
•
A= tr = 100
• 【例题2-1】将纯丙酮用环已烷 配成浓度为0.50%的溶液,在波 长279nm处,液层厚度为1cm时 ,测得吸光度为1.12,求在该波 长下的ε值。(丙酮密度为0.792 ,分子量Ar(酮)=58)。
• 2.吸光系数:K 为一常数,它与物质性 质、入射光波长、温度及溶剂性质有关, 而与溶液浓度、液层厚度无关。
吸光光度法 原理:基于物质对光的选择性吸收而建立起来的一种分析方法

2019年6月9
感谢你的观看
9
3.介质不均匀性引起的偏离 (二)化学因素 1.溶液浓度过高引起的偏离
当溶液浓度较高时,吸光物质的分子或离子间 的平均距离减小,从而改变物质对光的吸收能力。 浓度增加,相互作用增强,导致在高浓度范围内 摩尔吸收系数不恒定而使吸光度与浓度之间的线 性关系被破坏。 2. 化学变化所引起的偏离
溶液中吸光物质常因解离、缔合、形成新的化 合物或在光照射下发生互变异构等,从而破坏了 平衡浓度与分析浓度之间的正比关系。
2019年6月9
感谢你的观看
10
第三节 吸光光度法的仪器
一、基本部件 光源 单色器(分光系统) 吸收池 检测系统和 信号显示系统
(一)光源 常用的光源为6-12伏低压钨丝灯,光源具有足够 的强度和稳定性。
I0:入射光的强度;Ia:吸收光的强度; It:透过光的强度;Ir:反射光的强度
I0=Ir+Ia+It
logI0/I=Kbc 令:A=logI0/I A=KbC
2019年6月9
感谢你的观看
6
A:吸光度, K:比例常数 I/I0:为透光率,用T表示。
A=lg1/T (二)吸收系数和桑德尔灵敏度
1.吸收系数 (1) 吸收系数a c的单位为g/L,b的单位为cm时,K用a表示,称 为吸收系数,其单位为L/g·cm,这时朗伯-比耳定 律变为: A=abc (2) 摩尔吸收系数κ c的单位为mol/L,b的单位为cm,κ表示,称 为摩尔吸收系数,其单位为L/mol·cm。
8
3.标准曲线
绘制:配制一系列已知浓度的标准溶液,在一定 条件下进行测定。然后以吸光度为纵坐标,以浓度 为横坐标作图。
第九章 吸光光度法

2
§8-1 吸光光度法基本原理
比色法介绍
3
一、物质对光的选择性吸收
1.光的基本性质 光是一种电磁波,具有波粒二象性。光的波动性可用波 长、频率、光速c、波数(cm-1)等参数来描述: = c ; 波数 = 1/ = /c 光是由光子流组成,光子的能量: E=h=hc/ (Planck常数:h=6.626 × 10 -34 J .S ) 光的波长越短(频率越高),其能量越大。 白光(太阳光):由各种单色光组成的复合光,是连续光谱。 单色光:单波长的光(由具有相同能量的光子组成) 可见光区:400-750 nm 紫外光区:近紫外区200 - 400 nm 远紫外区10 - 200 nm (真空紫外区)
将Mn2+ 氧化成紫红色的MnO4- 后,在525 nm处进行测 定。
23
4.显色剂 无机显色剂:硫氰酸盐、钼酸铵、过氧化氢等几种。 有机显色剂:种类繁多 偶氮类显色剂:本身是有色物质,生成配合物后,颜色发 生明显变化;具有性质稳定、显色反应灵敏度高、选择性好、 对比度大等优点,应用最广泛。偶氮胂Ⅲ、PAR等。 三苯甲烷类:铬天青S、二甲酚橙等
21
§ 8-3 显色反应及显色条件的选择
一、显色反应的选择 1.选择显色反应时,应考虑的因素 灵敏度高(ε值104~105)、选择性好、生成物稳定、显色 剂在测定波长处无明显吸收,两种有色物最大吸收波长之 差:“对比度”,要求△ > 60nm。 2.配位显色反应 当金属离子与有机显色剂形成配合物时,通常会发生 电荷转移跃迁,产生很强的紫外—可见吸收光谱。 例如:Cu2+与双硫腙配位形成的双硫腙铜在 λ=533nm 处的ε=5×104
27
2. 选择合适的参比溶液
为什么需要使用参比溶液? 调节参比的A=0,使测得的的吸光度真正反映待测物的吸光强 度。扣除待测物的吸收之外的其他所有吸收。 参比溶液的选择一般遵循以下原则: ⑴ 若仅待测组分与显色剂反应产物在测定波长处有吸收,其 它所加试剂均无吸收,用纯溶剂(水) 作参比溶液; ⑵ 若显色剂或其它所加试剂在测定波长处略有吸收,而试液 其它组分无吸收,用“试剂空白”(不加试样溶液)作参比溶液;
(一)物质对光的选择性吸收

第三节 吸光光度法一、测定原理基于物质对光的选择性吸收而建立的分析方法称为吸光光度法,包括比色法、可见分光光度法及紫外分光光度法等。
本章重点讨论可见光区的吸光光度法。
有些物质的溶液是有色的,例如4KMnO 溶液呈紫红色,227K Cr O 水溶液呈橙色。
许多物质的溶液本身是无色或浅色的,但它们与某些试剂发生反应后生成有色物质,例如3Fe +与3Fe +生成血红色配合物; 2Fe +与邻二氮菲生成红色配合物。
有色物质溶液颜色的深浅与其浓度有关,浓度愈大,颜色愈深。
如果是通过与标准色阶比较颜色深浅的方法确定溶液中有色物质的含量,则称为目视比色法,如果是使用分光光度计,利用溶液对单色光的吸收程度确定物质含量,则称为分光光度法。
吸光光度法主要用于测定试样中的微量组分,具有以下特点:(1)灵敏度高。
常可不经富集用于测定质量分数为210-~510-。
的微量组分,甚至可测定低至质量分数为610-~810-的痕量组分。
通常所测试的浓度下限达510-~610-1mol L -⋅。
(2)准确度高。
一般目视比色法的相对误差为5%~l0%,分光光度法为2%~5%。
(3)应用广泛。
几乎所有的无机离子和许多有机化合物都可以直接或间接地用分光光度法进行测定。
不仅用于测定微量组分,也能用于高含量组分的测定及配合物组成、化学平衡等的研究。
如农业部门常用于品质分析、动植物生理生化及土壤、植株等的测定。
(4)仪器简单,操作方便,快速。
近年来,由于新的、灵敏度高、选择性好的显色剂和掩蔽剂的不断出现,以及化学计量学方法的应用,常常可以不经分离就能直接进行比色或分光光度测定。
(一)物质对光的选择性吸收1.光的基本性质光是一种电磁波,同时具有波动性和微粒性。
光的传播,如光的折射、衍射、偏振和干涉等现象可用光的波动性来解释。
描述波动性的重要参数是波长()m λ、频率()Z H υ,它们与光速c 的关系是:341310cc J sm s E h h λυυλ--=⨯==c λυ= (10.1)在真空介质中光速为2.9979810⨯1m s - ,约等于81310m s -⨯ 还有一些现象,如光电效应、光的吸收和发射等,只能用光的微粒性才能说明,即把光看作是带有能量的微粒流。
物质对光的选择性吸收
b:液层厚度(光程长度),通常以cm为单位;
c:溶液的摩尔浓度,单位mol· L-1;
ε :摩尔吸光系数,单位L· mol-1· cm-1; 与所用入射光的波长及物质的本性有关。 或: A=a b c
c:溶液的浓度,单位g· L-1
a:吸光系数,单位L· g-1· cm-1 a与ε 的关系为:
A
增 C大
结论:溶液的透光度越大,表示它对光的吸收越小; 相反,透光度越小,表示它对光的吸收越大。
二、吸光度 A
入射光 I0 吸光度定义: 透射光 It
I0 A lg It
吸光度与透光度的关系
I0 1 A lg lg lg T It T
T 10
A
实践证明,溶液吸光度,与溶液浓度、液层厚度及入 射光波长等因素有关。
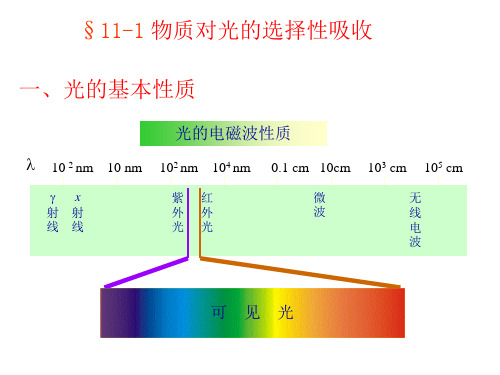
§11-1 物质对光的选择性吸收
一、光的基本性质
光的电磁波性质 10-2 nm 10 nm
射 线 x 射 线
102 nm 104 nm
紫 外 光 红 外 光
0.1 cm 10cm
微 波
103 cm
无 线 电 波
105 cm
可 见
光
光的波粒二象性
光的折射
波动性
λν
光的衍射
光的偏振 光的干涉
粒子性
三、吸收曲线 吸收曲线与最大吸收波长 max
用不同波长的单色光照射,测吸光度A值。
吸收曲线的讨论:
①同一种物质对不同波长光的吸光度
不同。吸光度最大处对应的波长称为最
大吸收波长λ max ②不同浓度的同一种物质,其吸收曲 线形状相似λ max不变。而对于不同物质, 它们的吸收曲线形状和λ max则不同。
请注意与定义比较 未考虑吸收池和溶剂对光的作用
紫外-可见吸收光谱法精选全文完整版

溶剂极性增大
吸收峰呈规律性蓝移
3、溶剂效应
O
异丙叉丙酮(CH3-C-CH=C
CH3
CH3 )的溶剂效应
吸收带
p → p*
正己烷
230nm
CH3Cl
238nm
CH3OH
237nm
H2 O
243nm
波长
红移
n→ p*
329nm
315nm
309nm
电子跃迁类型主要有四种:σ→σ*、n→σ*、π→π*和
n→π*,各种跃迁所需的能量大小不同,次序为:
σ→σ*> n→σ*≥ π→π* > n →π*,
因此,形成的吸收光谱谱带的位置也不相同。
σ→σ*跃迁:
需要能量最大, λ<200nm ,真空紫外区,εmax > 104
饱和烃(远紫外区);
C-H共价键,如CH4( λmax 125nm)
(I) 顺式二苯乙烯 (II)反式二苯乙烯
2、跨环效应的影响
助色基团虽不共轭,但由于空间排列使电子
云相互影响,使 n→π*吸收峰长移。
O
CH3-C - CH3
O
C
S
lmax156,279 nm
lmax238nm
3、溶剂效应影响
溶剂的极性增大时,n p* 跃迁吸收带蓝移
p p* 跃迁吸收带红移
少,分析速度快。
2 灵敏度高。如在紫外区直接检测抗坏血酸时,其最低检出浓度可
达到10-6g/mL。
3 选择性好。通过适当的选择测量条件,一般可在多种组分共存的
体系中,对某一物质进行测定。
4 精密度和准确度较高。在仪器设备和其他测量条件较好的情况下,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5
界面反射(reflection ) reflection) 入 射 光 束
) (transmission transmission) 透 射 光 束
散射c
Io
) (scattering scattering)
It b Io= Ir+ Ic+ Ia+ It Ia+ It
6
吸收a
7
1
12.1.1物质对光的选择性吸收
3
12.1.3偏离朗伯比耳定律的主要因素
12.1.3偏离朗伯比耳定律的主要因素
只适用于 偏离随c增大而加剧 ,故朗伯-比耳定律 比耳定律只适用于 稀溶液. solution : 2.chemical factors of solution: 缔合、解离、及其它相互作用 . 吸光组分间因缔合、解离、及其它相互作用 吸光组分间因 如CrO42-在水溶液中的缩聚平衡 : 2CrO42- + 2H+ 2HCrO4- Cr2O72- + H2O
谱带L 谱带L 谱带N
It1 + It2 101bc[It1 + It210(2 - 1 )bc] = lg It1 + It2
休息 休息
A总= lg
It1101bc
A总 = lg(Io1 + Io2)/(It1 + It2) 据:Io = It10bc + It2102bc
谱带M
17
18
或D:光密度)
与吸光物质性质、 、溶剂以及温度等有关的常数 .
休息
2.质量吸光系数与摩尔吸光系数 : 质量吸光系数 ·L-1,b:cm时,K以a表示,称为 c:g 称为质量吸光系数 :g· ),单位:L ·g-1·cm-1; (mass absorptivity absorptivity), :L· 摩尔吸光系数 , ·L-1,b:cm时,K以表示,称为 称为摩尔吸光系数 c:mol :mol· 单位:L·mol-1·cm-1. a = /M(摩尔质量) ·L-1的吸光组分在光 在数值上等于浓度为 1mol 1mol· 程为1cm时的吸光度 . 表观摩尔吸光系数 : 实验测定,以吸光物质总浓度为基础求得的 .
休息
①定性与结构分析的参数 ; 同一吸光组分 ,不同或不同溶剂 ,不同; 不同吸光组分 ,一定和确定的溶剂 ,也不相同. ②估量定量方法的灵敏度 . max.
max 105:超高灵敏度; max = (6 10)×104:高灵敏度; max = 104 5×104:中等灵敏度; max 2×104:低灵敏度.
12.1.1物质对光的选择性吸收
黄 橙 红
绿
青 青蓝
吸收:
白光
蓝 紫 3. selective absorption and its essence: 选择性吸收: 同一物质对不同波长光表现出不同吸收 能力的性质.
5 休息
7
M+热 +h M* M M+荧光或磷光 E1基态 E2激发态 吸收的实质: 价电子的能级跃迁 . 产生吸收的条件 : E = E2 - E1 = h. 选择性吸收的本质 : 不同的物质微粒因结构不同而 具不同的量子化能级 ,能量差也不同 . 4.token of selective absorption: ),即吸收曲线 A~曲线,(A为吸光度,absorbency absorbency), (或吸收光谱).
黄色 橙色
·L-1时,吸光质 一般来说 ,当溶液浓度 c 10-2 mol mol· 点间就可能发生缔合 、解离 等相互作用 点间就可能发生缔合、解离 、解离等相互作用 . Lambert-Beer Law 只适用于稀溶液 .
休息 下节 目录
19
20
4
12.1概述
12.1概述
INTRODUCTION
12.1.1 物质对光的选择性吸收 12.1.2 光吸收的基本定律 因素 偏离朗伯比耳定律的主要因素 12.1.3偏离朗伯比耳定律的主要
上选择性吸收
12.1.1物质对光的选择性吸收 电磁波谱:
1.photic character: light ). 可见光(visible light). 在电磁波谱 中大约处于400 ~ 750nm. 750nm . 电磁波谱中大约处于 单色光(homogeneous light ): light): 单波长的光 (具相同能量的光子组成 ). light ): 复合光(polychrome light): 由各种单色光组成的光 . 如白光(太阳光). 2.物质的颜色与颜色的互补关系 :
休息
13
14
12.1.2光吸收的基本定律
12.1.2光吸收的基本定律
4.meaning of Lambert-Beer Law: A = bc 当一束平行的单色光通过均匀的、非散射的吸 光溶液时,溶液对光的吸收程度与吸光组分的浓度以 及液程厚度的乘积成正比 . 几种表示形式 : A = bc; A = abc; A = lg(1/T); -lgT; A = -lg Io=It10bc; I o=It10abc; It=Io10-bc; I t=Io10-abc.
休息
8
12.1.1物质对光的选择性吸收
吸收曲线
12.1.1物质对光的选择性吸收
分子光谱: 电子光谱: 最大吸收波长 max: 吸光度 吸收光谱中吸光度 吸收光谱中 最大处对应的波长 ). (wavelength wavelength)
5.action of absorption curve : ①定量分析的依据 ; ②选择测量波长的依据 ; ③定性和结构分析的 依据.
休息
目录
15
16
12.1.3偏离朗伯比耳定律的主要因素
12.1.3偏离朗伯比耳定律的主要因素
偏离朗伯-比耳定律: light : 1.non-homogeneous 1.nonhomogeneous light: 实际所用单色光不纯 .
= 1bc + lg[It1 + It210(2 - 1 )bc] - lg[ It1 + It2] = A1 + lg[It1 + It210(2 - 1 )bc] - lg[ It1 + It2]
吸收曲线
curve )描述 absorption spectrum (or absorption curve) 物质对不同波长光的吸收能力 . 分子光谱的特征 : 带状 .
休息 休息 目录
9
10
12.1.2光吸收的基本定律
12.1.2光吸收的基本定律
Law : mbert-Beer Law: mbert-Beer Io Ia + I t It / Io = T 透射比(transmittance ) transmittance) 透光度 溶液对某一波长单色光的光吸收程度 : A = lg(Io/It) = K b c ↓ 即吸光度 液层厚度 (以前称E:消光度, (cm)
休息
11
12
2
12.1.2光吸收的基本定律
12.1.2光吸收的基本定律
例:每升含铁3.00mg的标准溶液,处理后以邻菲罗啉 吸光度 显色,以2.0cm的比色皿在510 nm波长下测得 波长下测得吸光度 为1.20.求其摩尔吸光系数 . 解: 已知:MFe = 55.85; c(Fe3+) = 3.00 10-3/55.85 ·L-1 = 5.37 10-5 mol mol· = A/bc = 1.20/(2.0 5.37 10-5) = 1.1 104 L·mol-1·cm-1. 3.meaning of molar absorption coefficient:
休息
Lambert-Beer Law 不仅适用于溶液 ,也适用于 其它均匀的、非散射性的吸光物质 (固、液、气 ). 对多组分系统 ,若组分间无相互作用 ,则: A总 = A1 + A2 + …… = 1bc1 + 2bc2 + …… 加和性. 吸光度具加和性 吸光度具 据: A = lg(1/T) = bc,若b固定, A = K’c 标准曲线 或工作 曲线称为标准曲线 标准曲线或 A ~ c曲线称为 curve). 曲线(standard curve).
休息
电磁波谱
5
3 4
12.1.1物质对光的选择性吸收
12.1.1物质对光的选择性吸收 光与物质的作用:
界面 反射
(1)color of substance: 相互作用. 光与物质的相互作用 光与物质的 溶液的颜色是溶液中物质 对光选择性吸收引起的 ,由透过 光波长所决定 . 如,Cu2+溶液以及Fe3+溶液. (2)tinctorial complementary relation: 互补色光: 按一定的强度比例能组成白光的两种色光 .
