2018-2019学年度北京市丰台区高三一模化学试卷及答案
北京丰台区2018-2019年高三一模化学试题及答案

丰台区2019年高三年级第二学期综合练习(一)理科综合化学2019- 03本试卷满分共300分考试时间150分钟可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5第一部分(选择题共120分)6.改革开放四十年来,我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如下表所示,其中属于有机高分子的是A .氨气与氯化氢气体相遇产生白烟 B.铜遇浓硝酸产生红棕色气7.下列实验现象与氧化还原反应无关的是C.过氧化钠放置于空气中逐渐变白D. 一氧化氮遇空气变为红棕色8.天然橡胶在硫化过程中高分子结构片段发生如下变化,下列说法不正确...的是野一曾HC=CH—C 比、HjC ' s 甲」。
*%0一HC—CH 硫化. HC—CH nc^c|.| HC=CH _CHa、H2C C田HiC _crt HzC—CH?田田一HbCH HC=CH天然橡胶A 施化橡胶BA.橡胶A由1,3-丁二烯加聚而成B.橡胶A为反式、线型结构,易老化C.橡胶B为网状结构,强度比A大,耐磨D.硫化过程发生在碳碳双键上9.部分元素在周期表中的分布如右图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是A.虚线左侧是金属元素B . As处于第五周期第VA族C. Si、Ge可作半导体材料D . Sb既有金属性又有非金属性化能),10.CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示( E a表示活A.已知Cl是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:兀♦2( Iz «-»匕■■■CH.CI^0.1mo1/LFe2(SO4)3 溶液加热前溶液为浅黄色,加热后颜色变深厂少量NaCl固体酸化的0.1mo1/LFe2(SO4)3 溶液加热前溶液接近无色,加热后溶液颜色无明显变化酸化的0.1mo1/LFe2(SO4)3 溶液加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深0.1mo1/LFeC13溶液加热前溶液为黄色,加热后溶液颜色变深B .相同条件下,E a越大反应速率越慢C.图中AH V 0,其大小与E a i、E a2无关D.CH4转化为CH3CI的过程中,所有C-H发生了断裂11 .依据下列实验现象,所得结论不正确..的是实验实验现象1—①品红溶液红色褪去,经检验溶液中含有SO42-②加热褪色后的溶液至沸腾,未见颜色恢复,有气_Ln(C12):n(SO2)=1:1体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试□Zk品红溶液纸,无明显变化。
北京丰台区第八中学2018-2019学年高三化学测试题含解析

北京丰台区第八中学2018-2019学年高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 有4种有机物:④CH3-CH=CH-CN,其中可用于合成结构简式为的高分子材料的正确组合为()A.①③④B.①②③C.①②④D.②③④参考答案:D略2. 下列说法不正确的是A.多孔碳可用氢氧燃料电池的电极材料B.pH计不能用于酸碱中和滴定终点的判断C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素D.和CO2反应生成可降解聚合物n,该反应符合绿色化学的原则参考答案:B试题分析:A、氢氧燃料电池要求电极能导电且必须多孔具有很强的吸附能力,并具一定的催化作用,同时增大气固的接触面积,提高反应速率,多孔碳可用氢氧燃料电池的电极材料,正确;B、pH计可用于酸碱中和滴定终点的判断,错误;C、As和P同主族,DNA 链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素,正确;D、甲基环氧乙烷与二氧化碳在一定条件下反应生成聚碳酸酯,原子利用率达到100%,生成的聚碳酸酯易降解生成无毒无害物质,此反应符合绿色化学原则,正确。
3. 25℃时,将浓度和体积分别为c1、V1的一元强碱ROH溶液和c2、V2的一元弱酸HA溶液相混合,下列关于该混合溶液的叙述正确的是()A.若pH>7时,则一定是c1V1 = c2V2B.只有当pH<7时,才能满足c(R+) + c(H+)= c(A—) + c(OH—)C.当pH=7时,若V1= V2,则一定是c1< c2D.若V1= V2、c1= c2,则c(A—)+c(HA) = c(R+)参考答案:CD略4. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是()A.④、③、②、①B.①、②、③、④C.③、④、②、①D.①、②、④、③参考答案:A略5. a、b、c、d为短周期元素,a的原子中只有1个电子,b与a可形成多种有机化合物,c 的单质是构成空气的主要成分,d元素的焰色反应呈黄色。
丰台区2018-2019高三化学期末试题

丰台区2018~2019学年度高三第一学期期末练习2019.01满分:100分 考试时间:100分钟可能用到的相对原子质量:H -1 C -12 O -16 N -14第一部分(选择题 共42分)选择题(每题只有一个符合题意的选项,每题3分,共42分) 1.下列试剂所贴的危险化学品标志不正确...的是 AB CD氢氧化钠 甲烷 汽油 浓硫酸2. 下列化学用语表述不正确...的是 A. Cl 2电子式:B. Na 原子结构示意图:C. NaCl 在水中电离:NaCl ==== Na + + Cl -D. 由Na 和Cl 形成离子键的过程:3. 以下是镍催化乙烯与氢气的反应机理示意图,下列说法不正确...的是A. 乙烯与氢气发生加成反应B. 过程②吸收能量,过程③、④释放能量C. 催化剂可改变反应的焓变D. 反应中有非极性键断裂、极性键形成 4. 下列解释事实的化学方程式不正确...的是 A. 钠放入水中产生大量气体:2Na + 2H 2O == 2NaOH + O 2↑B. 红热的木炭放入浓硝酸中产生红棕色气体:C + 4HNO 3 === CO 2↑ + 4NO 2↑ + 2H 2OC. 氢氧化亚铁在空气中最终变为红褐色:4Fe(OH)2 + O 2 + 2H 2O === 4 Fe(OH)3D. 氨气通入含酚酞的水中,溶液变红:NH 3 + H 2ONH 3·H 2ONH 4+ + OH-通电△反应物被吸引到催化剂表面,键被削弱5. 氮循环是全球生物地球化学循环的重要组成部分,大气与土壤中氮元素转化如右图所示,下列说法不正确...的是A. 将N 2转化为化合物的过程称为固氮B. 无机物与有机物中的氮元素可相互转化C. 硝化细菌将NH 4+转化为NO 3-可能需要O 2参与 D. 在硝化细菌、反硝化细菌作用下氮元素均发生氧化反应6. 铝热反应常用于冶炼高熔点金属,某小组探究Al 粉与Fe 3O 4发生反应所得黑色固体的成分,实验过程及现象如下:下列说法不正确...的是 A. 反应①产生的气体是H 2B. 反应②为:Al 2O 3 + 2OH - == 2AlO 2-+ H 2O C. 反应③的白色沉淀是Al(OH)3D. 黑色固体中不含Al 和Fe 3O 47. “84”消毒液(有效成分为NaClO )可用于消毒和漂白,下列实验现象的分析,不正确...的是 A .对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO − + H + === HClO B .实验③中产生的气体是Cl 2,由HClO 分解得到:2HClO === Cl 2↑ + H 2O C .对比实验②和③,溶液的pH 可能会影响ClO − 的氧化性或Cl − 的还原性 D .加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH 才能安全使用实 验现 象混合后溶液的pH= 9.9,短时间内未褪色,一段时间后蓝色褪去。
北京市丰台区2018届高三一模化学试题

北京市丰台区2018届高三一模化学试题201803第一卷6.化学与人类社会的生产、生活有着密切联系。
下列叙述中不正确的是7.已知34Se、35Br位于同一周期,根据元素在周期表中的位置,下列说法正确的是A.还原性:Cl->Br-B.酸性:H2SeO4>HBrO4>HClO4C.原子半径:Cl>Br>Se D.气态氢化物的稳定性:H2S>H2Se8.下列说法中正确的是A.乙烯和氯乙烯都可以通过聚合反应得到高分子材料B.苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强C.顺-2-丁烯和反-2-丁烯的加氢产物不同D.CH3CH2OH与CH3CO18OH发生酯化反应所得混合液中,18O原子只存在于水分子中9.已知分解1mol H2O2放出热量98kJ。
在含有少量I-的溶液中,H2O2分解机理为:H2O2 + I-H2O + IO-慢H2O2 + IO-H2O + O2 + I-快下列说法正确的是A.IO-是该反应的催化剂B.反应的速率与I-浓度有关C.ν(H2O2) =ν(H2O) =ν(O2) D.反应活化能等于98kJ/mol11.下面是电解饱和食盐水的装置,通电一段时间后下列说法不正确...的是A.阴极附近溶液的pH增大B.阳极产生的气体可用湿润的淀粉碘化钾试纸检验C.若阳极最终收集到气体4.48L,则反应中转移电子的物质的量为0.4 mol D.完全电解后充分混合U型管中物质,所得溶液会含有NaClO12.对FeCl3溶液与KI溶液的反应进行探究。
关于实验的分析和结论不正确...的是A.FeCl3与KI发生了氧化还原反应,有I2生成B.试管1中溶液显红色,证明FeCl3与KI的反应具有可逆性C.试管3中红色比试管1中浅是平衡移动的结果D.试管2中上层溶液变为浅棕黄色是平衡移动的结果第二卷25.(16分)抗高血压药物洛沙坦是一种结构复杂的有机物,H 是合成洛沙坦的一种中间体,其合成路线如下:已知:I.II. 酯和醇可发生如下交换反应: (1)有机物H 中含氧官能团的名称是 。
2018年丰台区高三化学测试(一)-精选教学文档

2019年丰台区高三化学(一)6.化学与生产、生活息息相关,下列说法正确的是( )A. 大量燃烧化石燃料是造成雾霾天气的一种重要因素B.铁粉具有还原性,可用作食品袋内的脱氧剂C.高纯度的晶体硅可以制作晶体管等半导体、电脑芯片和光导纤维D.酒精、溶液、溶液、浓都可使蛋白质发生变性7.下列叙述正确的是( )A. 铁表面镀铜,铁作阴极B. 钢管与电源正极连接,钢管可被保护C. 原电池中电解质溶液中的阳离子向负极移动D. 在入海口的钢铁闸门上装铜块可防止闸门被腐蚀8.下列说法中正确的是()A.用水不能区分乙酸乙酯和乙醛B.麦芽糖及其水解产物均能发生银镜反应C.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色D.聚1,3-丁二烯的结构简式为9. 下列实验设计及其对应的离子方程式均正确的是( )A. 用溶液腐蚀铜线路板:═B. 与反应制备═C. 将氯气溶于水制备次氯酸:═D. 用食醋除去水瓶中的水垢:═11.汽车尾气中NO产生的反应为:⇌,一定条件下,等物质的量的和在恒容密闭容器中反应,如图曲线a表示该反应在温度T下的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时的浓度随时间的变化.下列叙述正确的是( )A. 温度T下,该反应的平衡常数B. 温度T下,随着反应的进行,混合气体的密度减小C. 曲线b对应的条件改变可能是加入了催化剂D. 若曲线b对应的条件改变是温度,可判断该反应的12.实验:(1)将溶液和溶液等体积混合得到浊液;(2)取少量(1)中浊液,滴加溶液,出现红褐色沉淀;(3)将(1)中浊液过滤,取少量白色沉淀,滴加溶液,白色沉淀变为红褐色;(4)另取少量白色沉淀,滴加饱和溶液,沉淀溶解.下列说法中,不正确的是( )A. 将(1)中所得浊液过滤,所得滤液中含少量B. 浊液中存在溶解平衡:⇌C. 实验(2)和(3)均能说明比难溶D. 溶液中的可能是(4)中沉淀溶解的原因25. 0.2 mol有机物A在氧气中完全燃烧后,生成 79.2 g CO2和18 g H2O,同时消耗O2 47.04 L(标准状况下),A在光照条件下生成的一溴取代物B,可发生如下转化关系(无机产物略),其中I与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。
高三一模化学试题试卷含答案解析

北京丰台区一模理综试卷化学部分试卷及答案6.下列用品的主要成分及用途对应不正确...的是A B C D用品主要成分Na2SiO3NaClO NaHCO3Al(OH)3用途木材防腐剂消毒、漂白食品加工抗酸药7...A.向NaHCO3溶液中加入NaOH溶液:HCO3-+ OH-CO2↑ + H2OB.盛放烧碱的试剂瓶不能用玻璃塞:SiO2 + 2NaOH Na2SiO3 + H2OC.为减少煤燃烧产生SO2,用CaCO3脱硫:2CaCO3 + O2 + 2SO2△2CaSO4 + 2CO2 D.向AgCl悬浊液中加入Na2S溶液:2AgCl + S2-Ag2S + 2Cl-8.下列说法正确的是A.乙二醇和丙三醇互为同系物B.室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯X k B 1 . c o mC.分子式为C7H8O且属于酚类物质的同分异构体有4种D.甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼9.X、Y、Z为短周期非金属元素,其相关性质如下,下列叙述正确的是元素X Y Z单质与H2反应条件暗处爆炸光照高温、高压、催化剂常温下氢化物水溶液的pH小于7小于7大于7 A.Z的氢化物分子间存在氢键B.最外层电子数Z>YC.气态氢化物的稳定性Y>X D.Y的含氧酸均为强酸10.利用如图所示装置进行下列实验,不能..得出相应实验结论的是选项①②③实验结论A稀硫酸Na2CO3Na2SiO3溶液非金属性:S>C>SiB浓硫酸蔗糖溴水浓硫酸具有脱水性、氧化n (Mn 2+)时间11.NO 2、O 2和熔融KNO 3可制作燃料电池,其原理如图,该电池在使用过程中石墨I 电极上生成氧化物Y ,Y 可循环使用。
下列说法正确的是 A .O 2在石墨Ⅱ附近发生氧化反应 B .该电池放电时NO 3-向石墨Ⅱ电极迁移 C .石墨Ⅰ附近发生的反应:3NO 2 +2e-NO+ 2NO 3-D .相同条件下,放电过程中消耗的NO 2和O 2的体积比为4∶1 12.下列说法正确的是A .①表示化学反应2NO 2(g) + O 3(g)N 2O 5(g) + O 2(g)△H > 0B .②表示25℃时,用0.1 mol/LCH 3COOH 溶液滴定20 mL 0.1 mol/LNaOH 溶液,溶液的pH 随加入酸体积的变化C .③表示10 mL 0.01 mol/L KMnO 4酸性溶液与过量的0.1 mol/LH 2C 2O 4溶液混合时,n(Mn 2+)随时间的变化D .④表示体积和pH 均相同的HCl 和CH 3COOH 两种溶液中,分别加入足量的锌,产生H 2的体积随时间的变化,则a 表示CH 3COOH 溶液性C 浓硝酸 Fe NaOH 溶液 说明铁和浓硝酸反应可生成NO 2D浓氨水生石灰酚酞氨气的水溶液呈碱性① ② ③ ④ ba V (H 2)tpH 7 13 20 V (酸)/mL能量2NO 2(g)+O 3(g)N 2O 5(g)+O 2(g)25.(16分)A 物质异戊二烯(2-甲基-1,3-丁二烯)用途广泛,除用于合成IR 橡胶外,还可用于生产芳樟醇N 等多种精细化工产品,合成路线如下:已知:i.CH 3C OR + R'Cl一定条件R'CH 2C OR + HClii. C R C H + R'C OR''KOHC R C C R'R''OH(1)A 的结构简式是 ,C 生成N 的反应类型为 (2)实验室常用电石和水制备试剂Y ,试剂Y 的名称是 (3)反式聚异戊二烯的结构简式是 (选填字母)。
北京市2018届高三各城区一模化学试题分类汇编——有机化学word版含答案
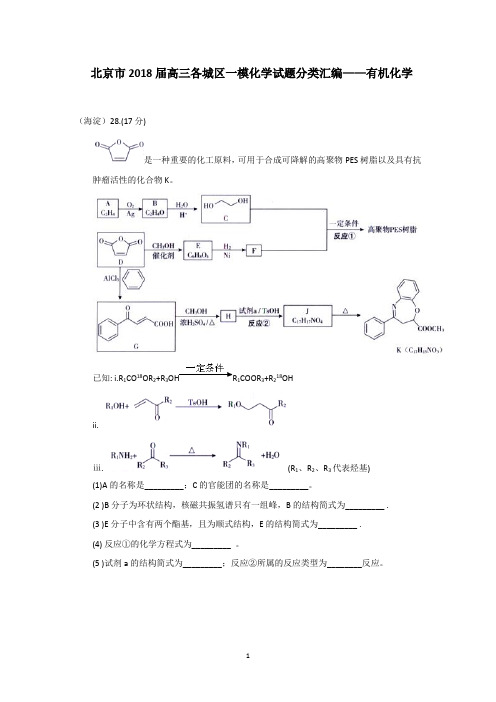
北京市2018届高三各城区一模化学试题分类汇编——有机化学(海淀)28.(17 分)是一种重要的化工原料,可用于合成可降解的高聚物PES 树脂以及具有抗肿瘤活性的化合物K。
已知: i.R1CO18OR2+R3OH R1COOR3+R218OHii.ⅲ. (R1、R2、R3代表烃基)(1)A的名称是_________;C 的官能团的名称是_________。
(2 )B 分子为环状结构,核磁共振氢谱只有一组峰,B 的结构简式为_________ .(3 )E 分子中含有两个酯基,且为顺式结构,E 的结构简式为_________ .(4) 反应①的化学方程式为_________ 。
(5 )试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6) 已知: 。
以1,3- 丁二烯为起始原料,结合已知信息选用必要的无机试剂合成。
将以下合成路线补充完整:(7)已知氨基(-NH 2) 与羟基类似,也能发生反应i 。
在由J 制备K 的过程中,常会产生副产物L 。
L 分子式为C 16H 13NO 3,含三个六元环,则L 的结构简式为________。
(朝阳)25.(17分)有机物P 是某抗病毒药物的中间体,它的一种合成路线如下。
XN(C 4H 8O 2)Br 2ⅰ.NaOH ⅱ.H+Y浓HNO 3M (C 4H 10O)A(C 7H 8)O 2催化剂浓H 2SO 4,△B 氧化还原NCH 3COOH一定条件有机物PF (C 4H 6O 3)E (C 7H 7NO)DPBr3连续氧化MnO 2已知:+CO一定条件RN C +H 2OCO H +CH 2CO 一定条件CH CCO+H 2ORNH 2(1)A 为芳香化合物,其结构简式是 。
(2)A →B 的化学方程式是 ,反应类型是 。
(3)M 无支链,N 中含有的官能团是 。
(4)M 连续氧化的步骤如下:M 转化为Q 的化学方程式是________。
北京市丰台区2018年高三一模化学试题

北京市丰台区2018年高三模拟一试题练习(一)化学试题可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Na-23 Cl—35.5选择题1. 120℃时,将2LH2O、1LCO、1LO2和2LCO2组成的混合气体依次缓慢通过分别装有过量炽热铜粉、过量过氧化钠的两个反应管并充分反应,恢复到原来的温度和压强后得到的气体是____。
(A)O2(B)O2和CO (C)H2、O2和CO (D)H2和O22.常温下某H2CO3溶液的pH约为5.5,c(CO32-)约为5×10-11mol/L,该溶液中浓度最低的离子是____。
(A)HCO3-(B)CO32-(C)H+(D)OH-3.工业上由重晶石制取可溶性钡盐,对已经粉碎后的矿石首先进行的处理方法应是____。
(A)水溶法(B)酸溶法(C)碱溶法(D)还原法4.丙酸和甲酸乙酯是一对同分异构体,对这两种液体进行鉴别有多种方法。
下列方法中操作最不简便的一种是____。
(A)使用蒸馏水(B)使用NaHCO3溶液(C)使用新制Cu(OH)2(D)使用pH试纸5.下列变化过程中未必吸热的是____。
(A)电解质在熔融状态下电离(B)共价键断裂(C)原子失电子(D)溶解6.化学与生活密切相关,下列说法正确的是A.食盐可作调味剂B.CO2属于大气污染物C.柠檬很酸,属于酸性食物D.用聚氯乙烯塑料袋包装食品7.下列解释事实的方程式表达不.正.确.的是A.碳酸氢钠可作食品膨松剂:2NaHCO3 Na2CO3+ CO2↑+H2OB.铝制容器不能盛装碱液:2Al +2OH-+2H2O 2AlO2-+ 3H2↑C.氯气可用于消毒:Cl2+H2O 2H++ Cl-+ClO-D.过氧化钠可用于呼吸面具:2Na2O2 + 2CO2 2 Na2CO3 + O2↑8.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。
下列说法不正确...的是图Ⅰ 图ⅡA .图Ⅰ中a 为纯铜B .图Ⅰ中SO 42—向b 极移动C .图Ⅱ中如果a 、b 间连接电源,则a 连接负极D .图Ⅱ中如果a 、b 间用导线连接,则X 可以是铜 9.下列说法正确的是A .植物油的主要成分是高级脂肪酸B .银氨溶液可用于检验淀粉是否完全水解C .溴乙烷与氢氧化钠水溶液反应可制取乙烯D .丙氨酸(CH 3CHCOOH )缩聚产物的结构简式为10.实验:① 向盛有1 mL 0.1 mol/L MgCl 2溶液试管中加1 mL 0.2 mol/L NaOH 溶液,得到浊液a ,过滤得到滤液b 和白色沉淀c 。
2019年丰台区高三化学一模含答案
7.下列实验现象与氧化还原反应无关的是 A.氨气与氯化氢气体相遇产生白烟 C.过氧化钠放置于空气中逐渐变白 B.铜遇浓硝酸产生红棕色气体 D.一氧化氮遇空气变为红棕色
8.天然橡胶在硫化过程中高分子结构片段发生如下变化,下列说法不正确 的是 ...
硫化
A.橡胶 A 由 1,3-丁二烯加聚而成 C.橡胶 B 为网状结构,强度比 A 大,耐磨
I2(aq) + 2H2O(l) ΔH1 = -247.5 kJ/mol
2I-(aq) + S4O62-(aq) ΔH2 = -1021.6 kJ/mol 。
(1)H2O2 与 S2O32-反应的热化学方程式为
(2)下列实验方案可证实上述反应过程。将实验方案补充完整(所用试剂浓度均为 0.01 mol/L) 。 a.向酸化的 H2O2 溶液中加入 b. ,溶液立即褪色。 溶液,溶液几秒后变为蓝色。
10.CH4 与 Cl2 生成 CH3Cl 的反应过程中,中间态物质的能量关系如下图所示(Ea 表示活 化能) ,下列说法不正确 的是 ... A.已知 Cl· 是由 Cl2 在光照条件下化学键断裂 生成的,该过程可表示为: 光 2
B.相同条件下,Ea 越大反应速率越慢 C.图中 ΔH<0,其大小与 Ea1、Ea2 无关 D.CH4 转化为 CH3Cl 的过程中,所有 C-H 发生了断裂 11.依据下列实验现象,所得结论不正确 的是 ... 实验 实验现象 ①品红溶液红色褪去,经检验溶液中含有 SO42n(Cl2):n(SO2)=1:1 品红溶液 A.品红溶液褪色是氯水漂白所致 B.集气瓶中发生了反应:Cl2 + SO2 + 2H2O C.依据现象②可确定产生的气体为 SO2 D.检验 SO42-的试剂为:盐酸、BaCl2 溶液 12.已知:[FeCl4(H2O)2] 为黄色,下列实验所得结论不正确 的是 ... ① ② ③
北京市丰台区2018-2019高三上学期期末化学试题及答案

丰台区 2018~2019 学年度第一学期期末练习高三化学 考 生 须 知 1. 考生要认真填写考场号和座位序号。
2. 本试卷共 10页,分为两个部分。
第一部分为选择题, 14个小题(共 42分);第二部分为非选择题, 4个大题(共 58分)。
3. 试题所有答案必须填涂或书写在答题卡上,在试卷上作答无效。
第一部分必须 用2B铅笔作答;第二部分必须用黑色字迹的签字笔作答。
4. 考试结束后,考生应将试卷和答题卡放在桌面上,待监考员收回。
2019.01满分: 100 分 考试时间: 100 分钟 可能用到的相对原子质量: H - 1 C - 12 O -16 N -14 第一部分(选择题 共 42 分)选择题(每题只有一个符合题意的选项,每题 3分,共 42 分) A B C D氢氧化钠 甲烷 汽油 浓硫酸1.下列试剂所贴的危险化学品标志不正确...的是 2. 下列化学用语表述不正.确..的是 A. Cl 2 电子式: B. Na 原子结构示意图: 通电+ -C. NaCl 在水中电离: NaCl ==== Na ++ Cl - D. 由Na 和 Cl 形成离子键的过程: 的是3. 以下是镍催化乙烯与氢气的反应机理示意图,下列说法不正确 A. 乙烯与氢气发生加成反应 B. 过程②吸收能量,过程③、④释放能量C. 催化剂可改变反应的焓变D. 反应中有非极性键断裂、极性键形成4. 下列解释事实的化学方程式不正.确..的是A. 钠放入水中产生大量气体: 2Na + 2H 2O == 2NaOH + O 2↑B. 红热的木炭放入浓硝酸中产生红棕色气体: C + 4HNO 3 ==△= CO 2↑ + 4NO 2↑ + 2H 2OC. 氢氧化亚铁在空气中最终变为红褐色: 4Fe(OH) 2 + O 2 + 2H 2O === 4 Fe(OH)3D. 氨气通入含酚酞的水中,溶液变红: NH 3 + H 2ONH 3·H 2ONH 4++ OH -5. 氮循环是全球生物地球化学循环的重要组成部分,大气与土 壤中氮元素转化如右图所示,下列说法不正确...的是A. 将 N 2 转化为化合物的过程称为固氮B. 无机物与有机物中的氮元素可相互转化C. 硝化细菌将 NH 4+转化为 NO 3-可能需要 O 2参与 D. 在硝化细菌、反硝化细菌作用下氮元素均发生氧化反应6. 铝热反应常用于冶炼高熔点金属,某小组探究 Al 粉与 Fe 3O 4 发生反应所得黑色固体的成分,实验过程及现象如下:A .对比实验①和②,②中蓝色迅速褪去的原因是发生了反应B .实验③中产生的气体是 Cl 2,由 HClO 分解得到: 2HClO === Cl 2↑+ H 2OC .对比实验②和③,溶液的 pH 可能会影响 ClO - 的氧化性或 Cl -的还原性产生稀 NaOH黑色 稀 H 2SO 4白色沉淀 CO 2溶液 a ②固体①气体 A. 反应①产生的气体是 H 2 C. 反应③的白色沉淀是 Al(OH) 3B. 反应②为: Al 2O 3 + 2OH - == 2AlO 2-+ H 2O D. 黑色固体中不含 Al 和 Fe 3O 47. “ 84消”毒液(有效成分为 NaClO )可用于消毒和漂白,下列实验现象的分析,不.正.确.的是1mL 蒸馏水①1mL 0.0002mol/LH 2SO 41mL 2mol/LH 2SO 484消”毒液 +石蕊84消”毒液 +石蕊84消”毒液 +石蕊混合后溶液的 pH= 9.9, 短时间内未褪色, 一段 时间后蓝色褪去。
北京市丰台区2018届高三一模(理综化学部分) 精品

北京市丰台区2018年高三统一练习(一)理科综合能力测试本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分300分。
考试时间150分钟。
以下数据可供解题时参考:可能用到的相对原子质量:H – 1 N – 14 O – 16 Fe – 56 Cu – 64 Br – 80第Ⅰ卷(选择题,共120分)本卷共20小题,每小题6分,共120分,在每小题列出的四个选项中,选出符合题目要求的一项。
5.化学与生活是紧密相联的,下列说法正确的是()A.为防止中秋月饼等富脂仪器氧化变质,常在包装袋中放入生石灰B.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化C.现用清洁燃料主要有压缩天然气和液化石油气两类,它们均属于碳氢化合物D.生铁在潮湿的空气中易生锈,其负极反应式为2H2O + O2 + 4e– = 4OH–6.用下列实验装置完成对应实验(部分仪器已省略),操作正确并能达到实验目的的是()7.关于镁和铝的叙述正确的是()A.镁、铝在常温下均能被氧气氧化B.镁、铝均需密封保存C.MgO和Al2O3都是碱性氧化物D.镁铝合金的硬度比镁小8.S2Cl2是橙色液体,少量泄漏会产生窒息气味,喷不雾可减慢挥发,并产生酸性悬浊液。
其分子结构如图所示。
下列关于S2Cl2说法错误的是()A.为非极性分子B.分子中既含有极性键又含有非极性键C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2D.与水反应的化学议程式可能为2S2Cl2 + Cl2 + 2H2O = SO2↑+ 3S↓+4HCl9.下列叙述正确的是()A.Fe ( OH )3不溶于水不能通过化合反应直接得到B.H2O、H2S随着相对分子质量的增大,沸点逐渐升高C.只含一种元素的物质可能为混合物D.物质B的饱和溶液降低温度时一定有B物质析出10.X、Y为短周期元素,X的原子半径小于Y。
下列叙述正确的是()A.原子序数Y大于XB.X原素的最高正价一定大于Y元素的最高正价C.若X元素形成的单质是X2,Y元素的单质一定是Y2D.若X、Y原子电子层数相同,Y的失电子能力一定强于X11.常温下,关于下列溶液的叙述错误..是()A.CH3COOH分子可以存在于pH = 8的碱性溶液中B.l mol/L 氨水与0.5mol/L氨水中c ( OH )–之比是2∶C.甲酸溶液和一定量NaOH溶液恰好完全反应,溶液中c ( HCOO– )<c ( Na+ )D.等体积等pH 的醋酸和盐酸分别加水稀释至a mL和b mL,稀释后溶液pH均为5,则a>b12.64g铜与一定浓度的硝酸反应,铜完全溶解生成NO和NO2(不考虑生成N2O4)混合气体33.6L(所有气体体积均匀标准状况下测得)。
2018-2019高三化学4月月考仿真试卷 丰台区2018-2019高三化学

2018-2019高三化学4月月考仿真试卷丰台区2018-2019高三化学2018-2019高三化学4月月考仿真试卷化学注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Fe 56 Ba 137 7.以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是A.四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应B.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品C.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作8.设NA为阿伏加德罗常数的值,下列说法正确的是A.60g SiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键B.足量的Mg与稀H2SO4完全反应,生成2.24L H2时,转移的电子数为0.2NA C.1L 0.2mo1/L NaHCO3溶液中含HCO?3和CO2?3的离子数之和为0.2NA D.H2O(g)通过足量Na2O2(s)充分反应,固体增重b g时,反应中转移的电子数为bNA/2 9.下列关于有机物的叙述不正确的是A.分子式为C4H8O2的酯有4种结构B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有3种C.丙烯分子中最多有7个原子共平面D.乙烯和溴的四氯化碳溶液反应生成1,2?二溴乙烷10.由下列实验及现象推出的相应结论正确的是实验现象结论A.某溶液中滴加K3[Fe(CN)6]溶液产生蓝色沉淀原溶液中有Fe2+,无Fe3+ B.向C6H5ONa溶液中通入CO2 溶液变浑浊酸性:H2CO3>C6H5OH C.向含有ZnS 和Na2S的悬浊液中滴加CuSO4溶液生成黑色沉淀 Ksp(CuS)r(Y)>r(Z)>r(W)>r(X) B.W和M形成的化合物不能与强碱反应C.Ⅹ、Z、W三元素所形成的化合物一定为共价化合物D.Y、Z的最高价含氧酸的酸性:Y>Z 12.25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。
北京市丰台区2018~2019学年度(1月)高三第一学期化学期末练习含答案

二氧化锰与浓盐酸 KBr 和 KI 无色逐渐变为 氧化性:
D
共热产生的气体
的混合溶液
棕黄色
Cl2 > Br2 > I2
第二部分 (非选择题 共 58 分)
15.(13 分)随着人类社会的发展,氮氧化物的排放导致一系列环境问题。
(1)NO 形成硝酸型酸雨的化学方程式为
。
(2)NO 加速臭氧层被破坏,其反应过程如右图所示:
假设 2:空气中的 O2 也可能氧化-2 价硫元素
步骤 1
取 Na2S2O3 晶体,溶解,配成 0.2mol/L 溶液。
6
步骤 2 步骤 3
取 4mL 溶液,向其中加入 1mL 饱和氯水(pH = 2.4),溶液立即出 现浑浊,经检验浑浊物为 S。 继续滴加氯水,浑浊度增大,最后消失,溶液变澄清。
C. 氢氧化亚铁在空气中最终变为红褐色:4Fe(OH)2 + O2 + 2H2O === 4Fe(OH)3 D. 氨气通入含酚酞的水中,溶液变红:NH3 + H2O NH3·H2O NH4+ + OH-
5. 氮循环是全球生物地球化学循环的重要组成部分,大气与土壤中氮元素
转化如右图所示,下列说法不正确的是
1
A. 将 N2 转化为化合物的过程称为固氮 B. 无机物与有机物中的氮元素可相互转化 C. 硝化细菌将 NH4+转化为 NO3-可能需要 O2 参与 D. 在硝化细菌、反硝化细菌作用下氮元素均发生氧化反应
6. 铝热反应常用于冶炼高熔点金属,某小组探究 Al 粉与 Fe3O4 发生反应所得黑色固体的成分,实验过程及 现象如下:
溶液
实验现象
实验结论
乙醇与浓硫酸共热 A
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
丰台区2019年高三年级第二学期综合练习(一)
化学2019. 03
第一部分(选择题共42分)
本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.改革开放四十年来,我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如下表所示,其中属于有机高分子的是
7.下列实验现象与氧化还原反应无关的是
A.氨气与氯化氢气体相遇产生白烟B.铜遇浓硝酸产生红棕色气体
C.过氧化钠放置于空气中逐渐变白D.一氧化氮遇空气变为红棕色
8.天然橡胶在硫化过程中高分子结构片段发生如下变化,下列说法不正确
...的是
A.橡胶A由1,3-丁二烯加聚而成B.橡胶A为反式、线型结构,易老化
C.橡胶B为网状结构,强度比A大,耐磨D.硫化过程发生在碳碳双键上
9.部分元素在周期表中的分布如右图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确
...的是
A.虚线左侧是金属元素
B.As处于第五周期第V A族
C.Si、Ge可作半导体材料
D.Sb既有金属性又有非金属性
10.CH 4与Cl 2生成CH 3Cl 的反应过程中,中间态物质的能量关系如下图所示(E a 表示活
化能),下列说法不正确...
的是 A .已知Cl ·是由Cl 2在光照条件下化学键断裂
生成的,该过程可表示为:
B .相同条件下,E a 越大反应速率越慢
C .图中ΔH <0,其大小与E a 1、E a 2无关
D .CH 4转化为CH 3Cl 的过程中,所有C-H 发生了断裂 11.依据下列实验现象,所得结论不正确...
的是
A .品红溶液褪色是氯水漂白所致
B .集气瓶中发生了反应:Cl 2 + SO 2 + 2H 2O H 2SO 4 + 2HCl
C .依据现象②可确定产生的气体为SO 2
D .检验SO 42-的试剂为:盐酸、BaCl 2溶液
12.已知:[FeCl 4(H 2O)2]-
为黄色,下列实验所得结论不正确...
的是
酸化的Fe 2(SO NaCl 注:加热为微热,忽略体积变化。
A .实验①中,Fe 2(SO 4)3溶液显浅黄色原因是Fe 3+水解产生了少量Fe(OH)3
B .实验②中,酸化对Fe 3+水解的影响程度大于温度的影响
C .实验③中,存在可逆反应: Fe 3+ + 4Cl -+ 2H 2O
[FeCl 4(H 2O)2]-
D .实验④,可证明升高温度,Fe 3+水解平衡正向移动 25.(16分)某药物中间体K 及高分子化合物G 的合成路线如下。
光
2
少量NaCl
固体
已知:I .R 1NHR 2易被氧化
II
(1)A 中含氧官能团的名称是______。
(2)反应②的反应条件为_______________。
反应①、③的目的是__________________。
(3)E 的结构简式为____________。
(4)反应④的化学反应方程式是__________________。
(5)反应⑤的反应类型为 ________________。
(6)由A 合成H 分为三步反应,选用必要的无机、有机试剂完成合成路线(用箭头表示转化关系,
箭头上注明试剂和反应条件)。
26.(12分)PbCl 2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。
工业生产中利用方铅矿精矿
(主要成分为PbS ,含有FeS 2等杂质)和软锰矿(主要成分为MnO 2)制备PbCl 2的工艺流程如下图所示。
已知:i. PbCl 2微溶于水
23
酸性废液
Mn 2+、SO 42-、Cl -
等)
ii. PbCl 2 (s) + 2Cl -
(aq)
PbCl 42-(aq) ΔH > 0
(1)浸取过程中MnO 2与PbS 发生如下反应,请将离子反应配平:
□____+ □____+□PbS + □MnO 2
□PbCl 2 + □____+ □____+ □____
(2)由于PbCl 2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加
入饱和NaCl 溶液可有效避免这一现象,原因是________。
(3)调pH 的目的是________。
(4)沉降池中获得PbCl 2采取的措施有________。
(5)通过电解酸性废液可重新获得MnO 2,装置示意图如下:
①在_______极(填“a ”或“b ”)获得MnO 2,电极反应为________。
②电解过程中发现有Cl 2产生,原因可能是_________、__________。
27.(13分)某小组进行实验:向硫酸酸化的过氧化氢溶液中加入碘化钾、淀粉和硫代硫酸钠的混合溶液,
一段时间后溶液变蓝。
查阅资料知体系中存在两个主要反应:
(2)下列实验方案可证实上述反应过程。
将实验方案补充完整(所用试剂浓度均为0.01 mol/L )。
a .向酸化的H 2O 2溶液中加入________溶液,溶液几秒后变为蓝色。
b ._____________________________________________,溶液立即褪色。
(3)探究c (H +)对反应速率的影响,实验方案如下表所示。
(所用试剂除H O 以外,浓度均为0.01 mol/L )
① 将实验b 补充完整。
② 对比实验a 和实验b ,t 1_____t 2(填“>”或“<”)。
③ 结合(2)中现象解释溶液混合后一段时间才变蓝的原因__________________________。
④ 利用实验a 的数据,计算t 1时间内H 2O 2与S 2O 32-反应的平均反应速率(用H 2O 2浓度的变化表
示)________mol/(L ·s)。
28.(17分)某小组研究FeCl 3与Na 2S 的反应,设计了如下实验:
b
I. 探究黑色沉淀的成分
查阅资料:Fe 2S 3(黑色)在空气中能够稳定存在,FeS (黑色)在空气中易变质为Fe(OH)3 设计实验:分别取实验a 、b 、c 中沉淀放置于空气中12小时,a 中沉淀无明显变化。
b 、
c 中黑色沉淀部分变为红褐色。
(1)① 同学甲认为实验a 中黑色沉淀为Fe 2S 3,实验b 、c 的黑色沉淀物中既有Fe 2S 3又有FeS ,依据
的实验现象是________。
② 同学乙认为实验b 的黑色沉淀物中有FeS 则一定混有S ,理由是_________。
③ 设计实验检验b 的黑色沉淀物中混有硫。
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。
实验证明了b 中黑色沉淀混有S ,试剂a 是_____,观察到的现象为_____。
II. 探究实验a 中Fe 3+与S 2-没有发生氧化还原反应的原因
经查阅资料,可能的原因有两种:
原因1:pH 影响了Fe 3+与S 2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨
(2)①试剂X 和Y 分别是______________________、________________。
②甲认为若右侧溶液变浑浊,说明Fe 3+与S 2-发生了氧化还原反应。
是否合理?说明理由_______。
③乙进一步实验证明该装置中Fe 3+与S 2-没有发生氧化还原反应,实验操作及现象是____________。
④由此得出的实验结论是______________________________________________。
III.探究实验c 随着FeCl 3溶液的增加,黑色沉淀溶解的原因
(3)①用离子方程式解释实验1中的现象_______________、_______________(写离子方程式)。
②结合化学平衡等反应原理及规律解释实验
2中现象相同与不同的原因__________________。
加入95%酒精 振荡、静置取上层清液
加入试剂a
观察现象。
